cd203a作为三阴乳腺癌干细胞膜治疗靶点的应用
技术领域
1.本发明属于医药领域,具体涉及cd203a作为三阴乳腺癌干细胞膜治疗靶点的应用。
背景技术:
2.在全球妇女中,乳腺癌是导致肿瘤相关发病和死亡的主要疾病。它是一种异质性疾病,根据雌激素受体(estrogen receptor, er)、孕激素受体(progesterone receptor, pr)、人表皮生长因子受体2 (human epidermal growth factor receptor 2, her2)等标记物的表达将其分为不同的亚型。其中,三阴性乳腺癌(triple-negative breast cancer, tnbc)占所有乳腺癌的10-20%
1.,它不表达er、pr和her2蛋白,并仅有少量靶向药物用于临床治疗
2.。与激素受体阳性或her2扩增的乳腺癌相比,tnbc患者更容易向乳腺以外扩散,治疗后也更容易复发。tnbc复发的分子机制尚未完全阐明,而目前仅有少数靶向药物(parp抑制剂(奥拉帕尼)、pd1/pd-l1阻断抗体)在临床治疗中改善了tnbc预后
[3,4]
。研究报道了部分的tnbc亚群(携带种系brca1/2突变)受益于奥拉帕尼治疗
[5,6]
。免疫检查点抑制的单一疗法也仅对一小部分患者有益
[7]
。因此,发明人迫切需要寻找新的治疗靶点来干预tnbc。
[0003]
越来越多的证据表明,乳腺癌中包含异质性的乳腺肿瘤干细胞(breast cancer stem cell, bcsc)群体,它能产生非干细胞肿瘤细胞的后代,并且只有bcsc能够肿瘤再生。频繁的肿瘤复发和不良的预后被认为是bcscs对目前可用的靶向治疗产生耐药性的结果
[8]
。目前,超过60%的获批药物主要针对在生理和病理过程中发挥关键作用的膜蛋白,如转运蛋白和受体
[9]
。尽管经过几十年的研究,bcscs的关键细胞表面蛋白仍未完全了解。同时,许多靶向bcscs的药物对tnbc均有显著作用
2.。虽然膜蛋白仅占人类蛋白质编码基因的三分之一,但它们却占已知药物靶点的三分之二
[10]
。因此,剖析bcsc细胞表面蛋白质组将是识别新的bcsc标志物和治疗靶点的理想方法。分离和鉴定肿瘤细胞(cancer cell, cc)与肿瘤干细胞(cancer stem cell, csc)最有效的方法是分析cscs和ccs中细胞表面蛋白的差异表达
[11]
。tnbc有效治疗方法的开发依赖于鉴定出在正常组织中低表达的bcscs细胞表面标记物。这些差异表达的膜蛋白不仅可以作为csc富集的分子标记物,而且也是治疗靶点的理想候选蛋白
[12]
。基于免疫的抗体偶联药物(antibody-drug conjugate, adc)结合了单克隆抗体的靶向能力和细胞毒性药物的抗癌能力,为tnbc提供了一种新的治疗策略。2020年,美国食品和药物管理局(food and drug administration, fda)批准了首个用于转移性tnbc的adc靶向trop-2 (sacituzumab govitcan),并证明了其具有临床意义的疗效
[13]
。
[0004]
cd203a是一种ii型跨膜糖蛋白,催化atp/gtp水解为amp/gmp和无机焦磷酸盐(inorganic pyrophosphates, ppi),被认为是哺乳动物骨骼和软骨发育的中央调节因子。其编码基因为ectonucleotide pyrophosphatase/phosphodiesterase family member 1, enpp1。未有研究表明其在三阴乳腺癌中有何作用。
技术实现要素:
[0005]
本发明的目的在于克服现有技术的至少一个不足,提供cd203a作为三阴乳腺癌干细胞膜治疗靶点的应用。
[0006]
本发明所采取的技术方案是:本发明的第一个方面,提供:cd203a作为三阴乳腺癌干细胞膜治疗靶点的应用。
[0007]
本发明的第二个方面,提供:化合物在制备靶向杀伤乳腺肿瘤干细胞药物中的应用,所述化合物可以靶向cd203a并具有细胞杀伤作用。
[0008]
在一些应用的实例中,所述化合物为抗体偶联药物。
[0009]
在一些应用的实例中,所述抗体偶联药物的抗体为抗cd203a抗体。
[0010]
在一些应用的实例中,所述抗体偶联药物对细胞具有杀伤作用的小分子选自美登素、单甲基奥瑞他汀e、sn-38、dm4或艾日布林。
[0011]
在一些应用的实例中,所述小分子通过linker与抗体偶联。
[0012]
在一些应用的实例中,所述抗体偶联药物选自抗cd203a抗体
‑ꢀ
smcc-dm1、抗cd203a抗体-德鲁替康或抗cd203a抗体
‑ꢀ
smcc-dm4。
[0013]
本发明的第三个方面,提供:抗体偶联药物在制备三阴乳腺癌治疗药物中的应用,所述抗体偶联药物具有抗cd203a抗体和对细胞具有杀伤作用的小分子。
[0014]
在一些应用的实例中,所述对细胞具有杀伤作用的小分子选自美登素、单甲基奥瑞他汀e、sn-38、dm4或艾日布林。
[0015]
在一些应用的实例中,所述小分子通过linker与抗体偶联。
[0016]
在一些应用的实例中,所述抗体偶联药物选自抗cd203a抗体
‑ꢀ
smcc-dm1、抗cd203a抗体-德鲁替康或抗cd203a抗体
‑ꢀ
smcc-dm4。
[0017]
本发明的第四个方面,提供:一种治疗三阴乳腺癌的抗体偶联药物,包括对细胞具有杀伤作用的小分子,所述小分子偶联在抗cd203a抗体上。
[0018]
在一些抗体偶联药物的实例中,所述对细胞具有杀伤作用的小分子选自美登素、单甲基奥瑞他汀e、sn-38、dm4或艾日布林。
[0019]
在一些抗体偶联药物的实例中,所述抗体偶联药物选自抗cd203a抗体
‑ꢀ
smcc-dm1、抗cd203a抗体-德鲁替康或抗cd203a抗体
‑ꢀ
smcc-dm4。
[0020]
本发明的有益效果是:发明人通过一系列功能实验分别在体内和体外验证了cd203a在tnbc中富集了bcsc。同时,临床标本分析显示出cd203a的表达与三阴性乳腺癌有较高相关性,并对乳腺癌病人的生存预后有较大影响。开发出靶向cd203a的药物,如靶向cd203a的adc药物,可以显著抑制bcscs的生存能力,实现了对tnbc的杀伤作用,达到有效治疗三阴乳腺癌的作用。
附图说明
[0021]
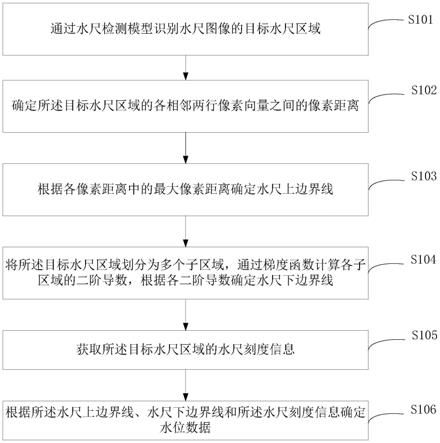
图1是一种发现三阴乳腺癌干细胞膜靶点的多组体筛选方法;
dm1、抗cd203a抗体-德鲁替康或抗cd203a抗体
‑ꢀ
smcc-dm4。
[0036]
下面结合实验,进一步说明本发明的技术方案。
[0037]
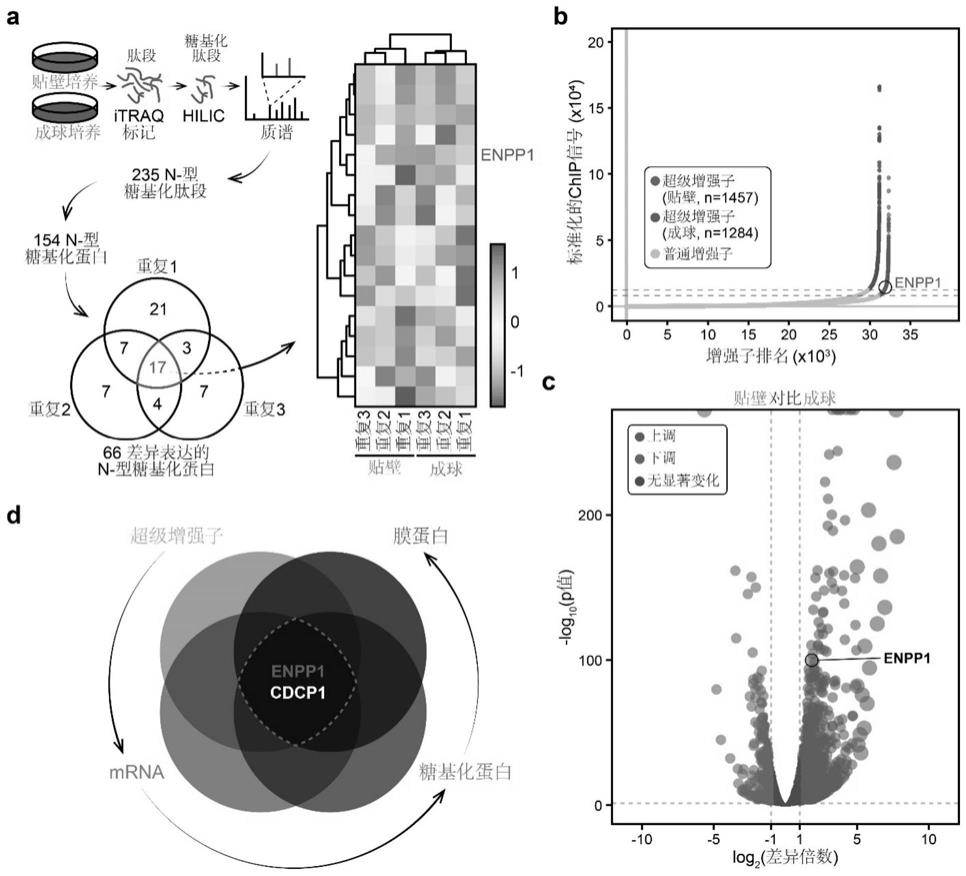
一、多组学筛选发现cd203a为三阴性乳腺癌中肿瘤干细胞的潜在治疗靶点为了确定在三阴性乳腺癌(triple-negative breast cancer, tnbc)中对乳腺肿瘤干细胞(breast cancer stem cell, bcsc)有潜在治疗靶点的细胞膜蛋白,发明人利用多组学方法筛选成球培养和贴壁培养的tnbc细胞(mda-mb-231)之间差异表达的细胞表面蛋白。发明人首先进行了糖基化肽段富集和基于相对和绝对定量同位素标记(isobaric tags for relative and absolute quantitation, itraq)的定量质谱(ms),以3个技术重复量化分析糖基化蛋白质组(图1a)。发明人定量了235个n-型糖肽段(对应154个n-型糖蛋白),并在成球细胞中鉴定出12个上调(》2倍)的糖蛋白(图1a)。为了缩小12个蛋白质的范围,发明人还关注了它们的转录水平。超级增强子(super
ꢀ‑
enhancer, ses)被认为是控制和维持癌细胞特性的基因转录的关键驱动因子
[14]
,因此发明人试图确定tnbc中bcscs的特异性ses。由于缺乏bcsc增强子数据库,发明人对组蛋白h3在lys 27位点乙酰化修饰(h3k27ac)进行染色质免疫沉淀测序(chromatin immunoprecipitation sequencing, chip-seq),并分析了成球和贴壁tnbc细胞基因组中的ses。发明人在成球细胞和贴壁细胞中分别鉴定出1284和1457个ses(图1b)。为了在成球细胞中识别se驱动的特异性基因,发明人进一步进行了rna测序(rna-seq)分析以全面探索差异表达(》2倍,p值《0.05)的基因(图1c)。发明人接下来在成球细胞中表达升高的基因与一系列预测编码膜蛋白的基因(n=5520)进行交集,这些膜蛋白至少包含一个预测的跨膜(transmembrane, tm)片段(www.proteinatlas.org/humanproteome/tissue/secretome)。综合起来,发明人最终将目标基因列表缩小到只有两个候选基因(enpp1和cdcp1)(图1d)。
[0038]
研究表明cdcp1是一种新的肿瘤干细胞标记物
[15]
,并通过同型二聚化和代谢重编程促进tnbc的转移
[16,17]
。靶向cdcp1的抗体偶联药物(antibody-drug conjugate, adc)已经应用于卵巢癌
[18]
。据报道,enpp1可激活bcsc特性
[19]
,并通过细胞外cgamp水解促进乳腺癌转移和免疫逃避
[20]
。然而,enpp1维持乳腺肿瘤干细胞的因果关系尚不清晰,且迄今尚未被探索为乳腺癌肿瘤干细胞(cancer stem cell, csc)的治疗靶点。因此,发明人接下来将以cd203a(enpp1编码的蛋白)作为潜在的治疗靶点,研究其可成药性。
[0039]
在以往的报道中,cd203a是一种单通道跨膜蛋白,具有非常大的细胞胞外结构域(100-925氨基酸)
[21]
,为靶向治疗提供了潜在的表位。为了探究cd203a在tnbc中的亚细胞定位情况,发明人通过细胞成分分离-免疫印迹(western blotting, wb)和流式细胞术分析显示cd203a定位于细胞膜上(图2a, b)。因此,cd203a是在tnbc中进一步研究bcsc可成药物作用靶点的优先选择。
[0040]
二、cd203a维持了三阴性乳腺癌的细胞干性发明人首先通过wb分析验证了发明人的筛选。与贴壁细胞相比,成球细胞显著高表达cd203a(图3a)。另外,不仅是tnbc(mda-mb-231和bt549)还有luminal型的乳腺癌(mcf7)在成球细胞高表达cd203a,这提示cd203a作为bcsc治疗目标有广泛的应用范围(图3a)。因为发明人主要专注于改善tnbc的预后,发明人分别使用三个sgrnas(sg1,sg2 sg3;以下统称sgenpp1)和cas9在tnbc细胞中瞬时敲除enpp1基因。为了确定cd203a对bcsc自我更新功能的作用,发明人比较了wt和enpp1缺失的细胞在乳腺成球中的作用,这是一种广泛
用于确定自我更新能力的试验
[22]
。结果显示sgenpp1显著降低了tnbc细胞的成球数目(图3b),表明cd203a参与维持三阴性乳腺癌细胞的csc表型。
[0041]
三、cd203a高表达与临床不良预后相关发明人使用gepia2(http://gepia2.cancer-pku.cn/)进行了tcga数据分析,发现乳腺癌在所有癌症中enpp1水平表达最高(图4a)。为了研究enpp1/cd203a在乳腺癌中的表达是否与临床相关,发明人在tcga和gtex数据中发现enpp1 mrna在乳腺癌中的表达高于正常乳腺组织(图4b),这符合发明人制备以cd203a为治疗靶点的药物。生存分析显示enpp1高表达和低表达乳腺癌之间存在显著差异(图4c)。简而言之,cd203a是一种对比正常组织具有差异表达的细胞表面分子,包含对tnbc基于免疫偶联药物治疗的潜在表位,并且可以预测更差的临床结果。
[0042]
四、抗cd203a偶联药物的制备及其对三阴性乳腺癌的杀伤效果由于靶向肿瘤细胞表面蛋白的抗体偶联药物(adc)在成神经细胞瘤患者中显示出显著改善的效果
[23
–
25]
,发明人也想要确定以cd203a为靶点的adc是否可以达到这一目的。发明人使用商业化的cd203a抗体(fab6136g, r&d systems)与一种称之为smcc-dm1的药物偶联,其中smcc是蛋白质交联剂,而dm1是一种高效的微管干扰药物(图5a)。发明人利用基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry, maldi-tof ms)评估了药物抗体比(drug to antibody ratio, dar),发现在发明人命名为“抗cd203a-dm1”的adc中,约5%的抗cd203a抗体与smcc-dm1偶联(图5b)。发明人通过共聚焦显微镜评估了该adc对表达gfp融合微管蛋白的癌细胞的微管破坏作用。发明人发现,抗cd203a-dm1处理的细胞中,55% (n=100)的微管网络出现破坏,而同型抗体-dm1组的微管网络出现破坏的细胞为0% (n=250;图5c)。最后,发明人检测了该adc对tnbc细胞和bcsc的杀伤作用。在mtt细胞毒性试验中,抗cd203a-dm1对tnbc细胞具有剂量依赖性的细胞毒性;相比之下,未偶联的亲本抗cd203a抗体和同型抗体-dm1 adc均未显示出明显的细胞毒性(图6a)。发明人用0.5 μg/ml adc或其他对照组处理tnbc细胞30 min,然后进行克隆形成试验并在新鲜培养基中培养一周,观察抗cd203a-dm1对tnbc细胞生长的抑制作用。抗cd203a-dm1治疗组与抗cd203a抗体和同型抗体-dm1 adc组相比,克隆细胞生长减弱(图6b)。由于cd203a在bcscs中高表达,发明人接下来评估adc在成球试验中的作用。令发明人惊喜的是,抗cd203a-dm1处理特异且显著地导致了成球数目的减少(图6c)。
[0043]
总结以上内容,可以预见特异靶向bcscs的adc(如抗cd203a-dm1),并在体外以抗原特异性和浓度依赖性的方式介导乳腺癌细胞毒性,有望针对性地治疗三阴乳腺癌。
[0044]
以上是对本发明所作的进一步详细说明,不可视为对本发明的具体实施的局限。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的简单推演或替换,都在本发明的保护范围之内。
[0045]
参考文献:[1]kumar p, aggarwal r. an overview of triple-negative breast cancer[j]. archives of gynecology and obstetrics, 2016, 293(2): 247
–
269.[2]park, choi, nam. targeting cancer stem cells in triple-negative breast cancer[j]. cancers, 2019, 11(7): 965.
ofsciences,2017,114(32):e6556
–
e6565.[17]wrighthj,arulmolij,motazedim,etal.cdcp1cleavageisnecessaryforhomodimerization-inducedmigrationoftriple-negativebreastcancer[j].oncogene,2016,35(36):4762
–
4772.[18]harringtonbs,hey,khant,etal.anti-cdcp1immuno-conjugatesfordetectionandinhibitionofovariancancer[j].theranostics,2020,10(5):2095
–
2114.[19]takahashir,miyazakih,takeshitaf,etal.lossofmicrorna-27bcontributestobreastcancerstemcellgenerationbyactivatingenpp1[j].naturecommunications,2015,6(1):7318.[20]lij,duranma,dhanotan,etal.metastasisandimmuneevasionfromextracellularcgamphydrolysis[j].cancerdiscovery,2021,11(5):1212
–
1227.[21]katok,nishimasuh,okudairas,etal.crystalstructureofenpp1,anextracellularglycoproteininvolvedinbonemineralizationandinsulinsignaling[j].proceedingsofthenationalacademyofsciences,2012,109(42):16876
–
16881.[22]pastranae,silva-vargasv,doetschf.eyeswideopen:acriticalreviewofsphere-formationasanassayforstemcells[j].cellstemcell,2011,8(5):486
–
498.[23]banerjiu,vanherpencml,saurac,etal.trastuzumabduocarmazineinlocallyadvancedandmetastaticsolidtumoursandher2-expressingbreastcancer:aphase1dose-escalationanddose-expansionstudy[j].thelancetoncology,2019,20(8):1124
–
1135.[24]massardc,soriaj-c,kraussj,etal.first-in-humanstudytoassesssafety,tolerability,pharmacokinetics,andpharmacodynamicsoftheanti-cd27lantibody-drugconjugateamg172inpatientswithrelapsed/refractoryrenalcellcarcinoma[j].cancerchemotherapyandpharmacology,2019,83(6):1057
–
1063.[25]sanor,krytskak,larmource,etal.anantibody-drugconjugatedirectedtothealkreceptordemonstratesefficacyinpreclinicalmodelsofneuroblastoma[j].sciencetranslationalmedicine,2019,11(483):eaau9732.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。