1.本发明涉及细胞显微技术领域,具体是一种用于检测细胞焦亡的荧光探针组合以及一种利用双荧光标记实现细胞焦亡检测的方法。
背景技术:
2.2001年,brennan和cookson首次用pyroptosis来描述这种独特的程序性炎性细胞死亡方式,pyro是指促炎介质的释放,ptosis表示下降, pyroptosis称为细胞焦亡。细胞焦亡是一种依赖于gasdermin家族蛋白形成质膜膜孔的可调控的细胞死亡,与细胞凋亡不同的是细胞焦亡以细胞膜破裂为特征。细胞焦亡时,质膜出现破裂形成直径1-2nm的小孔,细胞外的水分进入细胞,细胞渗透性肿胀,胞内物质流出,通过细胞膜出现典型的“大气球”特征可作为焦亡发生的检测指标之一。
3.焦亡被认为是激活局部免疫反应和提高化疗药物抗癌效果的有效手段,在治疗癌症方面具有巨大的潜力。以诱发焦亡为靶标已经成为癌症患者的治疗选择。所以,焦亡的研究成为了众多学者的研究方向。焦亡研究中,常涉及到细胞学实验,检测药物处理或物理处理导致细胞焦亡形态的改变是研究中常用的实验技术。现文献报道常用的检测方法是普通显微镜或透射电镜扫描检测。普通显微镜常因细胞膜细胞核的对比不强,导致不易观察到焦亡的特征表型,也导致拍照出来的焦亡特征图片效果不佳。而透射电镜需要固定细胞,无法对活细胞进行动态观察,且样本制备过程繁琐、用时长、所需检测设备价格昂贵。
4.因此,寻找一种能够更有效、直观、简单易操作且成本低廉的观察到细胞焦亡的典型形态改变的检测方法,对于焦亡方面的实验研究具有重要意义。
技术实现要素:
5.为了解决现有技术中存在的上述技术问题,本发明提供一种用于检测细胞焦亡的荧光探针组合以及一种利用双荧光标记实现细胞焦亡检测的方法。
6.一种用于检测细胞焦亡的荧光探针组合,包括dio细胞探针和 hoechst 33342染料。
7.进一步的,所述dio细胞探针,是dio细胞探针染液。进一步的,所述dio细胞探针染液是通过如下步骤制备得到:
8.(1)dio细胞探针储存液制备:将dio细胞探针用dmso (dimethyl sulfoxide)或ethyl alcohol(etoh)配置成浓度0.4-40mm的 dio细胞探针储存液(未使用的储存液保存在-20℃,分装保存,避免反复冻融);
9.(2)工作液制备:用无血清培养基稀释dio细胞探针储存液,配制浓度为0.2-20μm的dio细胞探针染液工作液,即得。
10.进一步的,所述hoechst 33342染料,是hoechst 33342细胞染液。进一步的,所述hoechst 33342细胞染液是通过如下步骤制备得到:
11.(1)hoechst 33342储存液制备:将hoechst 33342用pbs配置成浓度0.1-10mg/ml的hoechst 33342储存液(未使用的储存液保存在
ꢀ‑
20℃,分装保存,避免反复冻融);
12.(2)工作液制备:用无血清培养基稀释hoechst 33342储存液,配制浓度为0.1-10μg/ml的hoechst 33342细胞染液工作液,即得。
13.工作液最终浓度是根据不同细胞和实验的经验来配制,并不一定严格限定。可从推荐浓度的十倍以上找最佳条件。
14.一种利用双荧光标记实现细胞焦亡检测的方法,采用dio细胞探针和hoechst 33342染料对细胞进行染色,然后进行观察。
15.进一步的,所述dio细胞探针,是dio浓度为0.2-20μm的dio细胞探针染液。
16.进一步的,所述hoechst 33342,是hoechst 33342浓度为0.1-10 μg/ml的hoechst 33342细胞染液。
17.进一步的,所述的利用双荧光标记实现细胞焦亡检测的方法,具体包括以下步骤:
18.(1)dio细胞探针染液制备:
19.a:dio细胞探针储存液制备:将dio细胞探针用dmso或etoh 配置成浓度0.4-40mm的dio细胞探针储存液;
20.b:工作液制备:用无血清培养基稀释dio细胞探针储存液,配制浓度为0.2-20μm的dio细胞探针染液工作液,即得;
21.(2)hoechst 33342细胞染液制备:
22.a:hoechst 33342储存液制备:将hoechst 33342用pbs配置成浓度0.1-10mg/ml的hoechst 33342储存液;
23.b:工作液制备:用无血清培养基稀释hoechst 33342储存液,配制浓度为0.1-10μg/ml的hoechst 33342细胞染液工作液,即得;
24.(3)细胞染色处理:向需要染色的细胞中加入dio细胞探针染液,使dio的工作液浓度为0.2-20μm,在5%co2,37℃的温箱中孵育1-60min,然后加入hoechst 33342细胞染液,使hoechst 33342的工作液浓度为0.1-10μg/ml,在5%co2,37℃的温箱中孵育1-60min;
25.(4)荧光检测:细胞膜和核均匀染色后,将激光共聚焦皿放置到倒置荧光显微镜或激光共聚焦显微镜下,打开550nm/460nm的滤光器进行hoechst 33342(蓝色荧光)染色完细胞核后的观察及定位,确定合适观察位置后打开484/501nm进行dio(绿色荧光)染色完细胞膜的观察。还可以选取合适位置扫描拍照,将扫描得到的所有图像进行保存。
26.荧光检测技术具有背景干扰低,灵敏度高,精准,成本相对低廉等特点。dio,也称dioc18(3)或dio高氯酸盐,全称是3, 3
′‑
dioctadecyloxacarbocyanine perchlorate,分子式为c53h85cln2o6,分子量为881.72。dio是一种亲脂性的荧光染料,可以用来染细胞膜和其它脂溶性生物结构。进入细胞膜后,dio在整个细胞膜上扩散,最佳浓度时可以使整个细胞膜染色。dio通常不会明显影响细胞的生存力,可用于细胞膜荧光标记并进行动态观察。hoechst 33342,也称 bisbenzimide h 33342或hoe 33342。分子式为 c27h28n6o
·
3hcl
·
3h2o,分子量为615.99。hoechst 33342是一种可以穿透细胞膜的蓝色荧光染料,对细胞的毒性较低。hoechst 33342 在活细胞中dna聚at序列富集区域的小沟处与dna结合。活细胞或固定细胞均可从低浓度溶液中摄取该染料。从而使细胞核着色。故又把此类染料称为dna探针。
27.焦亡发生导致细胞膜通透性增高,出现典型的“大气球”特征。用dio染色可以很直观且清晰的动态观察到细胞膜的改变。发生焦亡的细胞同样会出现细胞核浓缩、染色质dna断裂。荧光染料hoechst 33342能少许进入正常细胞膜,使其染上低蓝色,而焦亡细胞的膜通透性增强,因此进入焦亡细胞中的hoechst 33342比正常细胞的多,荧光强度要比正常细胞中要高,此外,焦亡细胞的染色体dna的结构发生了改变从而使该染料能更有效地与dna结合。
28.最近大量的研究发现,针对焦亡已经成为癌症患者的一种治疗选择。除此外,细胞焦亡广泛参与感染性疾病、神经系统相关疾病和肿瘤等的发生发展,并发挥重要作用,对细胞焦亡的深入研究有助于认识其在相关疾病发生发展和治疗中的作用,为临床防治提供新思路。所以,开发检测焦亡的检测方法具有重要意义。
29.本发明的原理在于:细胞焦亡时,质膜出现破裂形成直径1-2nm 的小孔,细胞外的水分进入细胞,细胞渗透性肿胀,细胞膜出现典型的“大气球”特征。dio是一种亲脂性的绿色荧光染料,可以将细胞膜染成绿色。hoechst 33342是一种可以穿透细胞膜的蓝色荧光染料,可将细胞核染成蓝色。通过荧光显微镜上或共聚焦显微镜可清晰、有效且直观在观察到细胞焦亡在形态学改变。
30.本发明不断摸索实验条件,优化实验参数,成功建立一种细胞焦亡形态学改变的检测方法,能够更有效、直观、简单易操作且成本低廉的观察到细胞焦亡的典型形态。
31.与现有技术相比,本发明创造的技术效果体现在:
32.(1)本发明所用的dio是一种亲脂性的绿色荧光染料,可以将细胞膜染成绿色。hoechst 33342是一种可以穿透细胞膜的蓝色荧光染料,可将细胞核染成蓝色。本发明的检测方法在染色后通过荧光显微镜上或共聚焦显微镜可清晰、有效且直观的观察到细胞焦亡在形态学的改变。
33.(2)本发明的检测方法所选用的试剂及仪器设备,都是成熟的商品化试剂及常用设配,容易购买,价格低廉。
34.(3)本发明的检测方法细胞染色部分,是分别加入两种探针染液,无需换液,操作简单方便。
35.(4)本发明的检测方法细胞所用的都是活细胞染液,对细胞毒性低,不会影响细胞的生长,可以动态观察细胞。
附图说明
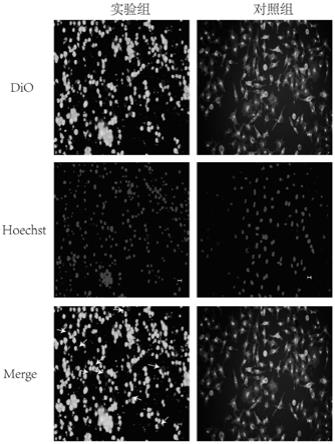
36.图1是dio和hoechst33342荧光双染检测辛伐他汀诱导胃癌 细胞mgc803发生焦亡的形态学改变,其中a:dio染细胞膜(荧光 显微镜下荧光显示为绿色);b:hoechst33342染细胞核(荧光显 微镜下荧光显示为蓝色);c:merge为两者双染。图2是用相差显微镜观察制备好的辛伐他汀处理后的胃癌细胞 mgc803及对照组细胞图。图3是用透射电极观察制备好的辛伐他汀处理后的胃癌细胞 mgc803及对照组细胞结果图。
具体实施方式
37.下面结合具体的实施方式来对本发明的技术方案做进一步的限定,但要求保护的范围不仅局限于所作的描述。
38.1、培养胃癌细胞mgc803。
39.用含10%的胎牛血清的dmem培养基,在5%co2,37℃的温箱中培养胃癌细胞mgc803,根据细胞状态及生长速度进行换液和细胞传代。倒置显微镜下观察,当细胞贴壁生长融合度达80%~90%时进行传代,用灭菌吸管吸去瓶内旧培养液,3~4ml 37℃预温的pbs 轻轻洗涤2~3遍,弃尽瓶内残留液体,向瓶内加入胰酶(用量一般为1 ml/25cm2,2ml/75cm2),以能覆盖培养瓶底为宜,晃动瓶身,胰酶与细胞充分接触,立刻将培养瓶放入37℃温箱中,计时3min,当发现细胞间隙增大、细胞变圆、细胞胞质回缩时,尽快加入与胰酶等体积含10%胎牛血清的完全培养基终止反应。用一次性灭菌吸管反复吹打几次使细胞完全脱落并相互分离,收集细胞悬液,800rpm/min 离心5min后弃上清,加5ml完全培养液用灭菌吸管轻轻吹细胞沉淀,使细胞重悬成单细胞悬液,按1
×
103个细胞/小室,分装在激光共聚焦的四室小皿中,培养液补足0.5ml/小室,置37℃,5%co2的培养箱中培养。
40.2、辛伐他汀诱导胃癌细胞mgc803焦亡。
41.当四室小皿中的细胞融合度生长到约80%左右,去掉旧培养基, pbs轻轻洗一次,更换为含有5μm辛伐他汀的无血清培养基作为实验组。dmso无血清培养基作为对照组。然后将小室置37℃,5%co2的培养箱中培养48h。
42.实施例1
43.(1)dio细胞探针染液制备:
44.a:dio细胞探针储存液制备:将dio细胞探针用dmso配置成浓度4mm的dio细胞探针储存液;
45.b:工作液制备:用无血清培养基dmem作为缓冲液稀释dio细胞探针储存液,配制浓度为2μm的dio细胞探针染液工作液,即得;
46.(2)hoechst 33342细胞染液制备:
47.a:hoechst 33342储存液制备:将hoechst 33342用pbs配置成浓度1mg/ml的hoechst 33342的储存液;
48.b:工作液制备:用无血清培养基dmem作为缓冲液稀释hoechst 33342储存液,配制浓度为1μg/ml的hoechst 33342细胞染液工作液,即得;
49.(3)细胞染色处理:向制备好的辛伐他汀处理后的胃癌细胞mgc803中加入dio细胞探针染液,调整使dio的工作液浓度为2μ m,在5%co2,37℃的温箱中孵育30min,然后加入hoechst 33342 细胞染液,调整使hoechst 33342的工作液浓度为1μg/ml,在5% co2,37℃的温箱中孵育5min;
50.(4)荧光检测:细胞膜和核均匀染色后,将激光共聚焦皿放置到倒置荧光显微镜或激光共聚焦显微镜下,打开550nm/460nm的滤光器进行hoechst 33342(蓝色荧光)染色完细胞核后的观察及定位,确定合适观察位置后打开484/501nm进行dio(绿色荧光)染色完细胞膜的观察。选取合适位置扫描拍照,将扫描得到的所有图像进行保存。
51.实施例2
52.(1)dio细胞探针染液制备:
53.a:dio细胞探针储存液制备:将dio细胞探针用dmso配置成浓度4mm的dio细胞探针储存液;
54.b:工作液制备:用无血清培养基dmem作为缓冲液稀释dio细胞探针储存液,配制浓度为2μm的dio细胞探针染液工作液,即得;
55.(2)hoechst 33342细胞染液制备:
56.a:hoechst 33342水储存液制备:将hoechst 33342用水配置成浓度1mg/ml的hoechst 33342水储存液;
57.b:工作液制备:用无血清培养基dmem作为缓冲液稀释hoechst 33342水储存液,配制浓度为1μg/ml的hoechst 33342细胞染液工作液,即得;
58.(3)细胞染色处理:向制备好的dmso无血清培养基对照组胃癌细胞mgc803中加入dio细胞探针染液,调整使dio的工作液浓度为2μm,在5%co2,37℃的温箱中孵育30min,然后加入hoechst 33342细胞染液,调整使hoechst 33342的工作液浓度为1μg/ml,在 5%co2,37℃的温箱中孵育5min;
59.(4)荧光检测:细胞膜和核均匀染色后,将激光共聚焦皿放置到倒置荧光显微镜或激光共聚焦显微镜下,打开550nm/460nm的滤光器进行hoechst 33342(蓝色荧光)染色完细胞核后的观察及定位,确定合适观察位置后打开484/501nm进行dio(绿色荧光)染色完细胞膜的观察。选取合适位置扫描拍照,将扫描得到的所有图像进行保存。
60.各实施例所用无血清培养基dmem购买自gibco公司。
61.各实施例结果见图1。
62.由图1实验中可以看到,dio和hoechst 33342荧光双染检测辛伐他汀诱导胃癌细胞mgc803焦亡的形态改变。a:dio染细胞膜(荧光显微镜下荧光显示为绿色);b:hoechst 33342染细胞核(荧光显微镜下荧光显示为蓝色);c:merge为两者双染,箭头所指为焦亡细胞,观察到细胞膜典型的泡状突起(白色箭头所指之处)。而图1对照组细胞中无明显的焦亡形态改变。
63.对比例1,用相差显微镜观察制备好的辛伐他汀处理后的胃癌细胞mgc803及对照组细胞,具体结果见图2。其中箭头所指为焦亡细胞,观察到细胞膜典型的泡状突起(箭头所指之处)。
64.对比例2用透射电极观察制备好的辛伐他汀处理后的胃癌细胞mgc803及对照组细胞,具体结果见图3。其中箭头所指为焦亡细胞,观察到细胞膜典型的泡状突起(箭头所指之处)。
65.由上可知,焦亡发生导致细胞膜通透性增高,出现典型的“大气球”特征。用dio染色可以很直观且清晰的动态观察到细胞膜的改变。发生焦亡的细胞同样会出现细胞核浓缩、染色质dna断裂。荧光染料 hoechst 33342能少许进入正常细胞膜,使其染上淡蓝色,而焦亡细胞的膜通透性增强,因此进入焦亡细胞中的hoechst 33342比正常细胞的多,荧光强度要比正常细胞中要高,此外,焦亡细胞的染色体dna 的结构发生了改变从而使该染料能更有效地与dna结合。
66.本发明所用的dio是一种亲脂性的绿色荧光染料,可以将细胞膜染成绿色。hoechst 33342是一种可以穿透细胞膜的蓝色荧光染料,可将细胞核染成蓝色。本发明的检测方法在染色后通过荧光显微镜上或共聚焦显微镜可清晰、有效且直观的观察到细胞焦亡
在形态学的改变。并且观察效果相比相差显微镜的效果更加优秀,相比透射电镜价格低廉且实验操作简便用时短。
67.最后,应当指出,以上实施例仅是本发明较有代表性的例子。显 然,本发明的技术方案并不限于上述实施例,还可以有许多变形。本 领域的普通技术人员能从本发明公开的内容直接导出或联想到的所 有变形,均应认为是本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。