1.本发明涉及微生物领域,具体地,涉及一株金黄杆菌、含有该菌的菌剂及它们的应用以及降解塑料的方法。
背景技术:
2.随着经济高速发展,塑料以其防水、廉价、便捷等特点,广泛应用于建筑、机械、农业、食品包装等领域,涉及人类生活的方方面面。全球每年塑料的消耗量超过3亿吨,并逐年速度增长。塑料制品不仅难以降解,且回收利用率低,其在环境中的持续积累对生态构成严重威胁,塑料垃圾污染已成为目前全球最受关注的环境问题之一,而在塑料垃圾中约60%都为聚对苯二甲酸乙二醇酯(polyethylene terephthalate,pet)塑料制品。pet是由对苯二甲酸和乙二醇线性聚合而成,其在较宽的温度范围内具有优良的物理机械性能,长期使用温度可达120℃,电绝缘性优良,甚至在高温高频下,其电性能仍较好。此外,pet塑料的抗蠕变性,耐疲劳性,耐摩擦性、尺寸稳定性都很好,因此广泛应用于包装业、电子电器、医疗卫生、建筑、汽车等领域。
3.目前,世界各国均积极探索塑料降解技术,传统的物理化学降解法,例如酸解、碱解、醇解、热解等,往往存在着降解条件严苛、成本高等问题,因此,新型的生物降解塑料的技术成为当前研究的热点,被列入多项重点支持计划。但是,现有关于塑料制品生物降解的报道较少。
4.因此,寻找一种绿色高效的塑料降解方法迫在眉睫。
技术实现要素:
5.本发明的目的是为了克服现有的塑料降解过程中存在的上述缺陷,提供一株金黄杆菌、含有该菌的菌剂及它们的应用以及降解塑料的方法。
6.为了实现上述目的,本发明第一方面提供一种金黄杆菌(chryseobacterium sp.),其菌株名为金黄杆菌pet-29(chryseobacterium sp. pet-29),该金黄杆菌的保藏编号为cctcc no: m 2022311。
7.本发明第二方面提供一种菌剂,该菌剂含有上述的金黄杆菌。
8.优选地,所述菌剂含有所述金黄杆菌的活菌体、死菌体和发酵产物中的至少一种,优选为活菌体。
9.优选地,所述菌剂为液态菌剂和/或固态菌剂,优选为液态菌剂。
10.本发明第三方面提供上述的金黄杆菌、上述的菌剂在降解塑料中的应用。
11.优选地,所述塑料为聚对苯二甲酸乙二醇酯塑料。
12.优选地,所述塑料为薄膜或者颗粒。
13.本发明第四方面提供一种降解塑料的方法,该方法包括:将上述的金黄杆菌和/或上述的菌剂与塑料接触。
14.优选地,所述塑料为聚对苯二甲酸乙二醇酯塑料。
15.优选地,所述塑料为薄膜或者颗粒。
16.优选地,所述接触的过程包括:将所述金黄杆菌接种至含有所述塑料的发酵培养基中进行发酵培养。
17.优选地,所述发酵培养的条件包括:温度为20-40℃,转速不低于100rpm,时间不少于12h。
18.优选地,所述发酵培养的条件包括:温度为25-35℃,转速为100-200rpm,时间为1-10天。
19.优选地,相对于1000ml的所述发酵培养基,所述金黄杆菌的种子液接种量不少于5ml,优选为40-60ml;所述塑料的含量为0.2-2.5g。
20.通过上述技术方案,本发明的有益效果为:本发明提供的金黄杆菌菌株或者含有该菌株的菌剂能够用于生物降解聚对苯二甲酸乙二醇酯塑料,尤其是降解环境中废弃片状、颗粒状聚对苯二甲酸乙二醇酯塑料,适合治理自然环境中很难被降解的聚对苯二甲酸乙二醇酯废弃物;因此,该菌株在新型塑料降解酶发掘与改造、废弃塑料回收利用、环境塑料污染生物修复等领域具备进一步研发和工程应用的前景。
21.本发明提供的金黄杆菌菌株用于降解塑料废弃物时,条件温和、低碳环保、成本低、操作方便,且能够采用通用的发酵设备进行生产,生产成本低,对于保护生态系统和人类健康具有重要的意义。
22.本发明的其它特征和优点将在随后的具体实施方式部分予以详细说明。
23.生物保藏本发明提供的菌株为金黄杆菌pet-29(chryseobacterium sp.pet-29),并于2022年03月25日被保藏在中国典型培养物保藏中心(地址:湖北省武汉市武昌区武汉大学校内(武汉大学第一附属小学对面),中国典型培养物保藏中心211室,邮政编码:430072,保藏单位的缩写为cctcc),保藏编号为cctcc no: m 2022311。
附图说明
24.图1是实施例1中金黄杆菌pet-29在以聚对苯二甲酸乙二醇酯颗粒(浓度为2g/l)为唯一碳源的无机盐固体培养基上的生长图;图2是实施例1中金黄杆菌pet-29在营养琼脂培养基上的菌落图;图3是实施例1中金黄杆菌pet-29的系统发育树;图4是实施例2中金黄杆菌pet-29在不同ph条件下的生长曲线;图5是实施例3中金黄杆菌pet-29在不同温度条件下的生长曲线;图6是实施例4中在金黄杆菌pet-29处理下聚对苯二甲酸乙二醇酯薄膜表面的形貌变化图,a为对照组,b为金黄杆菌pet-29处理组;图7是实施例4中在金黄杆菌pet-29处理下和对照组的聚对苯二甲酸乙二醇酯薄膜表面的疏水性检测图,a为对照组,b为菌株pet-29处理组;图8是实施例4中在金黄杆菌pet-29处理下和对照组的聚对苯二甲酸乙二醇酯薄膜表面的官能团检测图。
具体实施方式
25.以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
26.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
27.第一方面,本发明提供了一株金黄杆菌(chryseobacterium sp.),其菌株名为金黄杆菌pet-29(chryseobacterium sp. pet-29),该金黄杆菌的保藏编号为cctcc no: m 2022311。
28.本发明提供的金黄杆菌分离自垃圾填埋场废弃物(采集地为南京)。所述金黄杆菌的分离可以采用本领域常规的用于新菌株分离的方法,例如,采用“分级筛选”策略——液相富集法。
29.液相富集法具体可以包括:称取适量填埋场废弃物样品,放置于以对苯二甲酸二乙酯(聚对苯二甲酸乙二醇酯的结构类似物)为唯一碳源的无机盐液体培养基中,于恒温振荡培养箱中在25-35℃、120-180rpm下振荡培养4-6天为一轮,震荡培养4-6轮后,取最后一轮的培养液制备成菌悬液,将菌悬液按体积比梯度稀释成10-6
、10-7
、10-8
倍的稀释菌悬液;吸取0.05-0.15ml梯度的稀释菌悬液分别涂布于含有高温灭菌的聚对苯二甲酸乙二醇酯颗粒(1-3g/l)的无机盐固体培养基中,于恒温培养箱中25-40℃培养4-6天,设置3组平行;挑取无机盐固体培养基上的单菌落于营养琼脂上,并多次划线纯化分离得到单菌落菌株。
30.本发明中,无机盐液体培养基的组分含有钾盐、镁盐、铵盐、钠盐、铁盐、锌盐和锰盐,具体可以为k2hpo
4 0.5-1g/l、kh2po
4 0.5-1g/l、mgso4·
7h2o 0.5-1g/l、nh4no
3 0.5-1.5g/l、nacl 0.002-0.008g/l、feso4·
7h2o 0.001-0.003g/l、znso4·
7h2o 0.001-0.003g/l、mnso4·
h2o 0.001-0.002g/l,ph调至6.5-7.5。无机盐液体培养基中添加对苯二甲酸二乙酯(聚对苯二甲酸乙二醇酯的结构类似物)为唯一碳源,作为分离筛选的富集培养基;无机盐固体培养基为在无机盐液体培养基的基础上将对苯二甲酸二乙酯替换成聚对苯二甲酸乙二醇酯颗粒,并添加有适量的琼脂。
31.本发明的发明人从筛选出的菌株中选取了一株能够利用聚对苯二甲酸乙二醇酯为碳源和能源生长的菌株,进行了dna提取与鉴定,鉴定结果显示,该菌株的16srdna序列与金黄杆菌(chryseobacterium sp.)高度相似,且在进化距离上相对较近,可以确定其为金黄杆菌,命名为金黄杆菌pet-29(chryseobacterium sp.pet-29),并于2022年03月25日被保藏在中国典型培养物保藏中心,保藏编号为cctcc no: m 2022311。
32.本发明提供的金黄杆菌经过培养能够产生大量的金黄杆菌的活菌体和/或发酵产物。本发明对培养方法没有特别的限制,只要通过该培养方法可以使所述金黄杆菌大量增殖即可,例如,可以按照不低于0.5体积%的接种量将金黄杆菌的活菌体接种于培养基中,并且在20-40℃的温度下培养不少于12h后,得到培养液。其中,所述培养基可以为本领域常规使用的培养基,例如,可以为lb液体培养基(0.8-1重量%蛋白胨,0.5-0.8重量%酵母粉,1-1.5重量%氯化钠;培养温度为20-40℃)。
33.本发明可以进一步分离上述培养液中的金黄杆菌的菌体,对所述分离的方法没有
特别的限制,只要能够从培养液中富集菌体即可,例如可以通过离心和/或过滤的方法实现,所述离心和所述过滤的条件可以为本领域的常规条件,此为本领域技术人员所熟知,在此不再赘述。
34.第二方面,本发明提供了一种菌剂,其中,该菌剂含有上述的金黄杆菌。
35.在本发明中,对所述菌剂中金黄杆菌的浓度没有特别的限制,可以根据具体的情况进行具体的选择。
36.根据本发明,所述菌剂优选含有所述金黄杆菌的活菌体、死菌体和发酵产物中的至少一种,更优选为活菌体。在本发明中,术语“发酵产物”指的是金黄杆菌在发酵或培养过程中产生的代谢产物(包括胞内代谢产物和/或胞外代谢产物)。
37.根据本发明,对所述菌剂的剂型没有特别的限制,可以根据预定用途的不同,将其制备成不同的剂型,并添加相应的赋形剂等成分,例如所述菌剂可以为液态菌剂(例如可以为金黄杆菌的菌液)和/或固态菌剂(例如可以为金黄杆菌干燥制成的粉剂或经分离纯化等步骤制备成高纯度制剂)。其中,在何种剂型的菌剂中添加何种赋形剂为本领域技术人员所熟知,在此不再详细赘述。
38.采用本发明提供的金黄杆菌进行聚对苯二甲酸乙二醇酯塑料的降解处理后,聚对苯二甲酸乙二醇酯塑料的表面能够出现明显的生物侵蚀孔洞、裂痕,塑料薄膜的疏水性显著降低,表面破损严重。基于此,第三方面,本发明提供了上述金黄杆菌、上述菌剂在降解塑料中的应用。
39.根据本发明,优选地,所述塑料为聚对苯二甲酸乙二醇酯塑料;更优选的情况下,所述塑料为薄膜或者颗粒。具体地,所述塑料为聚对苯二甲酸乙二醇酯制成的塑料薄膜或者塑料颗粒。
40.根据本发明,金黄杆菌能够以聚对苯二甲酸乙二醇酯作为唯一的碳源和能源进行生长,利用金黄杆菌对含有聚对苯二甲酸乙二醇酯的塑料进行降解的过程,主要是利用金黄杆菌的生长,对塑料中的聚对苯二甲酸乙二醇酯进行利用和消耗,从而实现对其降解的作用。优选地,所述接触的过程包括:将所述金黄杆菌接种至含有所述塑料的发酵培养基中进行发酵培养。
41.根据本发明,金黄杆菌以种子液的形式接种至所述发酵培养基中进行发酵培养;具体地,金黄杆菌的种子液可以通过将金黄杆菌接种至lb液体培养基中,进行至少一次培养后获得。
42.根据本发明,所述发酵培养基可以是本领域中常见的培养基,优选情况下,采用上述的无机盐液体培养基。无机盐液体培养基的组分含有钾盐、镁盐、铵盐、钠盐、铁盐、锌盐和锰盐,具体可以为k2hpo
4 0.5-1g/l、kh2po
4 0.5-1g/l、mgso4·
7h2o 0.5-1g/l、nh4no
3 0.5-1.5g/l、nacl 0.002-0.008g/l、feso4·
7h2o 0.001-0.003g/l、znso4·
7h2o 0.001-0.003g/l、mnso4·
h2o 0.001-0.002g/l,ph调至6.5-7.5。发明人发现,在该优选的具体实施方式下,能够促进金黄杆菌的生长,提高对聚对苯二甲酸乙二醇酯塑料的降解速率。
43.根据本发明,优选地,所述发酵培养的条件包括:温度为20-40℃,转速不低于100rpm,时间不少于12h;更优选地,所述发酵培养的条件包括:温度为25-35℃,转速为100-200rpm,时间为1-10天。发明人发现,在该优选的具体实施方式下,能够提高金黄杆菌的生长速率,进而提高对聚对苯二甲酸乙二醇酯塑料的降解效率。
44.根据本发明,优选地,相对于1000ml的所述发酵培养基,所述金黄杆菌的种子液接种量不少于5ml,优选为40-60ml;所述塑料的含量为0.2-2.5g。发明人发现,在该优选的具体实施方式下,能够提高对聚对苯二甲酸乙二醇酯塑料的降解效率。
45.以下将通过实施例对本发明进行详细描述。
46.以下实施例中,如无特殊说明,所用的实验材料均为常规生化试剂商店购买得到。
47.lb液体培养基:10g蛋白胨、5g酵母粉、10g氯化钠,去离子水定容至1l,调节ph至6.0
±
0.5。
48.无机盐液体培养基:k2hpo
4 0.7g、kh2po
4 0.7g、mgso4·
7h2o 0.7g、nh4no
3 1.0g、nacl 0.005g、feso4·
7h2o 0.002g、znso4·
7h2o 0.002g、mnso4·
h2o 0.001g,蒸馏水定容至1l、ph调至7.0。
49.无机盐固体培养基:k2hpo
4 0.7g、kh2po
4 0.7g、mgso4·
7h2o 0.7g、nh4no
3 1.0g、nacl 0.005g、feso4·
7h2o 0.002g、znso4·
7h2o 0.002g、mnso4·
h2o 0.001g、琼脂16g,蒸馏水定容至1l、ph调至7.0。
50.营养琼脂培养基:蛋白胨10g、牛肉膏3g、氯化钠5g、琼脂16g,蒸馏水定容至1l。
51.以下实施例中,塑料制品(薄膜或颗粒)表面的微观形貌的测定方法:用无菌水冲洗表面多余的培养基,用质量分数为2%的sds溶液浸泡4h,超声30min,再依次用体积分数25%、50%、75%的乙醇梯度脱水,每次15min;将处理好的膜片样品干燥,固定喷金后在扫描电子显微镜(sem)下观察其微观形貌特征。
52.塑料制品(薄膜或颗粒)表面的疏水性采用接触角测量仪测定。
53.塑料制品(薄膜或颗粒)表面的官能团的测定方法:将塑料制品清洗干净、自然干燥后,采用傅里叶红外光谱仪测定,扫描波长范围600-4000cm-1
,分辨率4cm-1
,扫描次数32次。
54.实施例1(1)菌株的分离以从南京某垃圾填埋场废弃物作为待分离样品进行分离筛选:称取1g采集到的填埋场废弃物样品,放置于100ml含有对苯二甲酸二乙酯(聚对苯二甲酸乙二醇酯的结构类似物,浓度为2g/l)的无机盐液体培养基(对苯二甲酸二乙酯为唯一碳源)中,于恒温振荡培养箱中在温度为30℃、转速为150rpm条件下振荡培养4-6天为一轮,震荡培养五轮后,取第五轮的培养液制备成菌悬液,将菌悬液按体积比梯度稀释成10-6
、10-7
、10-8
倍的稀释菌悬液;吸取0.1ml梯度的稀释菌悬液分别涂布于含有高温灭菌的聚对苯二甲酸乙二醇酯颗粒(浓度为2g/l)的无机盐固体培养基中,于恒温培养箱中30℃培养5天,设置3组平行;挑取无机盐固体培养基上的单菌落于营养琼脂培养基上,并多次划线纯化分离得到单菌落菌株。
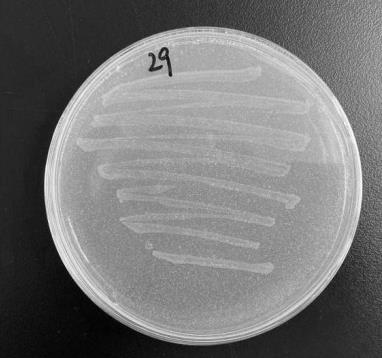
55.通过上述的分离与筛选过程进行多次分离纯化和验证后,获得一株能够利用聚对苯二甲酸乙二醇酯为碳源和能源生长的菌株,将其命名为pet-29;该菌株在以聚对苯二甲酸乙二醇酯颗粒(浓度为2g/l)为唯一碳源的无机盐固体培养基上的生长状态如图1所示,该菌株在营养琼脂培养基上的菌落如图2所示,呈金黄色,表面光滑湿润,边缘整齐,轮廓清晰。
56.(2)菌株的生理特征及分子生物学鉴定将菌株pet-29接种至lb培养基,以30℃、150rpm的条件培养至对数期,对培养至对
数期的菌株pet-29进行革兰氏染色,光学显微镜下,菌株pet-29经革兰氏染色显红色,呈阴性。
57.利用试剂盒(takara minibest bacteria genomic dna extraction kit ver.3.0)提取菌株pet-29的dna,采用细菌通用引物27f、1492r作为扩增引物进行pcr扩增,对pcr扩增的产物进行电泳检测,委托擎科(南京)生物公司进行测序,16s rdna序列如seq id no .1所示。将所得的16s rdna序列与ncbi数据库中已有的序列进行blast分析,并选取同源性相近的菌株,采用mega 7.0软件构建系统发育树。
58.16s rdna序列引物27f的核苷酸序列为:5
’‑
agagtttgatcctggctcag-3’(seq id no .2);16s rdna序列引物1492r的核苷酸序列为:5
’‑
ggttaccttgttacgactt-3’(seq id no .3)。
59.在ncbi数据库上进行16s rdna序列比对结果显示,菌株pet-29与chryseobacterium sp. bacter-20的16s rdna序列高度相似,且在进化距离上相对较近,菌株pet-29的系统发育树如图3所示,结合菌株的生理生化特征,初步将其鉴定为金黄杆菌(chryseobacterium sp.),命名为金黄杆菌pet-29(chryseobacterium sp.pet-29),并于2022年03月25日被保藏在中国典型培养物保藏中心(地址:湖北省武汉市武昌区武汉大学校内(武汉大学第一附属小学对面),中国典型培养物保藏中心211室,邮政编码:430072,保藏单位的缩写为cctcc),保藏编号为cctcc no: m 2022311。
60.实施例2(1)将实施例1得到的金黄杆菌pet-29在lb液体培养基中,在温度为30℃、转速150rpm条件下培养至对数期作为一级种子液,将一级种子液按体积比1.5%的接种量接种于lb液体培养基中,在温度为30℃、转速150rpm条件下振荡培养至对数期,得到二级种子液;(2)将二级种子液按体积比1%的接种量接种于50ml的lb液体培养基中,在温度为30℃,转速150rpm,ph分别为5.5、6.0、6.5、7.0、7.5、8.0的条件下培养60h,在培养6h、12h、24h、36h、48h、60h进行取样;将发酵培养液的样品稀释10倍,检测od
600
,测得金黄杆菌pet-29的生长曲线,结果如图4所示。
61.从图4可以看出,金黄杆菌pet-29在ph为8.0时的生长效果最佳,因此,将金黄杆菌pet-9的发酵ph条件确定为8.0。
62.实施例3(1)将实施例1得到的金黄杆菌pet-29在lb液体培养基中,在温度为30℃、转速150rpm条件下培养至对数期作为一级种子液,将一级种子液按体积比1.5%的接种量接种于lb液体培养基中,在温度为30℃、转速150rpm条件下振荡培养至对数期,得到二级种子液;(2)将二级种子液按体积比1%的接种量接种于50ml的lb液体培养基中,在温度为20℃、30℃、37℃、45℃,转速150rpm,ph为6的条件下培养60h,在培养6h、12h、24h、36h、48h、60h进行取样;将发酵培养液的样品稀释10倍,检测od
600
,测得金黄杆菌pet-29的生长曲线,结果如图5所示。
63.从图5可以看出,金黄杆菌pet-29在温度为30℃时的生长效果最佳,因此,将金黄杆菌pet-29的发酵温度条件确定为30℃。
64.实施例4
(1)将实施例1得到的金黄杆菌pet-29接种至lb液体培养基中,在温度为30℃、转速150rpm条件下培养至对数生长期作为种子液;(2)将聚对苯二甲酸乙二醇酯薄膜裁剪成2*3cm大小,在250ml锥形瓶中加入100ml无机盐液体培养液和1片聚对苯二甲酸乙二醇酯薄膜(约0.02g),灭菌,将步骤(1)中的种子液以5体积%的接种量接种至锥形瓶内,以不接菌处理为对照组,每种处理设置3个平行样;将锥形瓶放置于恒温振荡培养箱中在温度为30℃、转速为150rpm条件下培养5天后,取样分析聚对苯二甲酸乙二醇酯薄膜表面的形貌变化、疏水性变化、官能团变化,结果如图6-图8所示。
65.通过图6可以看出,经过5天的培养,在扫描电镜下观察到接种金黄杆菌pet-29处理的薄膜与对照组相比,表面粗糙,出现明显的微生物侵蚀孔洞、裂痕,表明存在微生物活动的迹象,证明金黄杆菌pet-29对聚对苯二甲酸乙二醇酯塑料具有一定的腐蚀效应。
66.由图7可见,接触角测量仪结果显示,接种金黄杆菌pet-29处理的聚对苯二甲酸乙二醇酯薄膜的水接触角分别为67.0
°
和58.9
°
,远低于对照组的100.1
°
和102.7
°
,表明接种金黄杆菌pet-29处理显著降低了聚对苯二甲酸乙二醇酯塑料的疏水性,更容易被微生物附着侵蚀。
67.图8的结果显示,pet是聚酯类化合物,酯键是最为关键的官能团,其在1000-1300cm
−1之间有两个特征峰,在1700-1750cm
−1之间有一个特征峰,与金黄杆菌pet-29处理和对照组刚好吻合。经分析,经金黄杆菌pet-29处理后的薄膜的酯键官能团透射率增加,即对应的酯键官能团性质减弱,表明金黄杆菌pet-29可通过断裂pet的酯键,将大分子不容物质变成小分子可溶物质,从而达到降解pet的目的。
68.实施例5(1)将实施例1得到的金黄杆菌pet-29接种至lb液体培养基中,在温度为30℃、转速150rpm条件下培养至对数生长期作为种子液;(2)在250ml锥形瓶中加入100ml无机盐液体培养液和0.2g聚对苯二甲酸乙二醇酯颗粒,灭菌,将步骤(1)中的种子液以6体积%的接种量接种至锥形瓶内,以不接菌处理为对照组,每种处理设置3个平行样;将锥形瓶放置于恒温振荡培养箱中在温度为25℃、转速为200rpm条件下培养20天后,取样分析聚对苯二甲酸乙二醇酯颗粒表面的形貌变化和官能团变化。
69.实施例5中金黄杆菌pet-29对聚对苯二甲酸乙二醇酯(pet)塑料颗粒进行降解后,形貌变化和官能团变化与实施例4的结果类似,这表明金黄杆菌pet-29也可以有效降解聚对苯二甲酸乙二醇酯颗粒。
70.实施例6(1)将实施例1得到的金黄杆菌pet-29在lb液体培养基中,在温度为30℃、转速150rpm条件下培养至对数期作为一级种子液,将一级种子液按体积比1.5%的接种量接种于lb液体培养基中,在温度为30℃、转速150rpm条件下振荡培养至对数期,得到二级种子液;(2)将二级种子液按体积比5%的接种量接种于生产罐的lb液体培养基中,在温度为30℃、搅拌速度100rpm的条件下进行培养发酵12h,得到发酵液,将发酵液出罐直接分装成液体菌剂;将该菌剂直接与聚对苯二甲酸乙二醇酯薄膜、颗粒分别进行混合反应,能够有效降解聚对苯二甲酸乙二醇酯塑料,达到实施例4-实施例5中的降解效果。
71.以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。