1.本发明属于生物医药技术领域,具体涉及一种聚羟基脂肪酸酯载药放疗微球及其制备方法和应用。
背景技术:
2.原发性和继发性肝癌发病率高,治疗难度大,仍然是威胁人类健康的一大疾病。目前,以肝部分切除和肝移植为主的外科手术治疗仍然是治愈肝癌最有效,最彻底的治疗手段。但是肝癌起病隐匿,大部分患者发现时已经不符合手术治疗条件。并且,肝癌切除术后复发率仍然较高,超过50%的肝癌患者术后出现复发。肝移植术可以进一步提高患者的治愈率,但是由于肝源缺乏,治疗成本高等问题限制了肝移植的发展。
3.利用肝脏的双重血供,以及肝脏大部分血液供应来自于肝动脉这一特点,经肝动脉介入治疗肝癌具有得天独厚的优势。微球制剂用于肿瘤的栓塞治疗主要有两优点:一是微球对肿瘤毛细管网的栓塞较为完全;二是可以提高药物的治疗指数,因为微球的药物控释作用,可以使肿瘤区的药物长时间维持在较高浓度水平。目前,对于不可用手术治疗的肝肿瘤,这种方法已成为首选方法。肝动脉介入放射粒子治疗是将载体粒子或者微球标记放射性物质(常用的放射性核素有
90
y,
32
p,
125
i,
131
i,
188
re等),然后用介入的方式将放射性粒子注射入肿瘤供血动脉从而利用放射线杀伤肿瘤组织进行放射治疗的方式,是一种新兴的肝癌介入治疗方式。随着
90
y等放射性微球的研究和临床应用,该领域正在迅速发展,并受到越来越多的关注和研究。一般来说,对于不能手术切除的原发性或者转移性肝癌患者,以及肝细胞肝癌,肝胆管癌和结直肠癌肝转移患者都具有放射栓塞适应症。目前用于临床放射治疗的的药物主要是
90
y放射性玻璃微球或树脂微球。此类微球在人体内不能降解,有可能沉积于肺部,长期安全性有待进一步观察,生物相容性较差,因此需要开发更安全的介入放射性栓塞微球,生物可降解的高分子材料是更优的选择。
4.聚羟基脂肪酸酯(polyhydroxyalkanoates,简称pha)是由微生物合成的一类由3-羟基脂肪酸组成的天然高分子生物材料。pha具有材料多变性,非线性光学性能,生物可降解性和良好的生物相容性等特点。pha的分子量分布于50000-20000000da不等。不同的pha主要区别于c-3位上的侧链基团不同,其中侧链为甲基的聚3-羟基丁酸(phb)最为常见。因此,pha已被认为是巨大潜力的生物材料,而基于pha的生物材料在支架,组织工程,骨移植替代品,伤口敷料,药物输送载体,抗菌膜,医用植入物和止血剂等生物医学医学应用领域有着广泛的应用。目前已开发出用于无须拆除的pha外科缝合线商品。pha聚合物微球作为放射性粒子具有显著的优势,将pha制成的微球通过皮下包埋进行动物体内降解实验,8周时仍可保持膜状结构,10周完全降解。生物可降解的载药微球比非生物降解的微球更适于临床应用,因为它们可以在体内降解而不需要在给药后移除。
5.目前,国内外研究的微球药物缓释剂使用的可降解高分子材料多为聚乳酸-羟基乙酸聚合物和聚乙烯醇等,用于介入栓塞的微球还未见pha材料的报道。与之对比,pha的安全性和生物降解性能均较优秀。
技术实现要素:
6.针对现有技术中存在的不足,本发明的首要目的在于提供一种聚羟基脂肪酸酯载药放疗微球,所述微球由聚羟基脂肪酸酯微球和放射性核素组成,所述放射性核素为放射性
125
i或
131
i,优选地,所述聚羟基脂肪酸酯的分子量为10000-2000000。
7.本发明是应用生物可降解材料pha制备不同粒径的介入栓塞微球,同时搭载标记放射性同位素的药物,实现靶向治疗和放射治疗协同效果,是一种新型的体内放疗载药微球。该微球具有良好的生物相容性和安全性,并且可以在体内生物降解,进一步减少对人体正常组织的损伤。
8.本发明还提供了一种聚羟基脂肪酸酯载药放疗微球的制备方法。
9.为实现上述目的,本发明提供如下技术方案:
10.一种聚羟基脂肪酸酯载药放疗微球的制备方法,包括如下步骤:
11.(1)将含有放射性同位素碘的碘化钠配制成内相溶液;
12.(2)将pha配制成外相溶液;
13.(3)采用双腔电喷雾装置制备微球,分别将步骤(1)和步骤(2)配制的内相和外相溶液装载于内相和外相腔体中,双腔毛细管喷嘴与微球收集器之间相距3-16cm,喷嘴处正极,微球收集器接地,加热后的压缩干燥气体过滤后被送入喷雾装置,促进有机溶剂挥发后形成放射性pha微球;
14.(4)收集步骤(3)制备的微球,离心洗涤,真空冷冻干燥,得到固体微球粉末,-20℃保存。
15.优选地,步骤(1)中所述的内相溶液中溶剂为水,碘化钠溶液浓度(w/v)为5-35%。
16.优选地,步骤(2)中所述的外相溶液中溶剂为乙腈,二氯甲烷,三氯甲烷中的一种或两种混合,pha的质量浓度(w/v)为1%-5%。
17.优选地,步骤(3)中所述的电喷雾装置中,内相毛细管的内径为750微米,外径为1250微米;外相毛细管的内径为1500微米,外径为1970微米。
18.优选地,步骤(3)所述的双腔电喷雾装置制备微球中使用的电压为3-18kv。
19.优选地,步骤(3)中所述的干燥气体为氮气。
20.优选地,步骤(3)所述双腔电喷雾装置制备微球的最佳工艺条件为:pha的质量浓度(w/v)为1.2%,电压为18kv,接收距离为8cm,推进速度为85μl/min。
21.静电喷雾法是一种新型的制备纳米微球的方法,具有工艺简单,成本低廉,粒径可控,单分散性好,易于纯化等优点,已经成为有效制备微球材料的主要途径之一。同轴静电喷雾法将药物和载体材料分布装载于内外两大腔体中,采用双通道微量注射泵来控制芯层和表层的流量,通过内层和外层施加相同的电压,形成具有核壳结构的载药微球。
22.本发明结果表明,此制备方式的药物包封率可以接近100%。随着调节载体材料的浓度和注射速度,可以调节微球的粒径,并且载药微球的粒径越小,其中的药物释放速度越快。除此之外,具有核壳结构的pha微球可以大大降低药物的突释,因为大部分药物被包裹在微球核心,几乎没有药物分布于微球表面。药物分子主要分布于微球内部,扩散到微球表面需要较长的时间,这样就有效地延缓了药物地释放,当表面微球的外壳降解后,内部搭载的药物可以完全释放,通过控制外壳的厚度,即微球的粒径,即可达到药物控释的效果。
23.本发明还提供了上述制备的聚羟基脂肪酸酯载药放疗微球在肿瘤介入栓塞治疗
中的应用。此类放疗微球具有以下优势:1)能够以可控的方式在生理条件下逐渐降解,最终降解产物为co2和h2o。无需手术取出载体材料,也没有栓塞风险。2)介入精准栓塞可以靶向肿瘤局部,使放射性同位素局部放射剂量最大化,优化肿瘤放疗效果。3)可以将微球直接置入作用部位,通过材料的降解可调控药物释放速度。4)微球中的药物释放后直接作用于肿瘤局部,对其它组织损伤较小。
24.与现有技术相比,本发明的有益效果是:
25.(1)本发明采用双腔电喷雾法制备聚羟基脂肪酸酯载药放疗微球,由于药物被封装在微球的核心,阻止了表面和表面附近的药物浓度,使药物初始释放速度缓慢,不会产生突释和初始爆发释放。这一点对于内放射治疗尤其重要,因为放射性核素的脱靶将导致放射性肺炎和放射性骨髓抑制等异位放射性损伤,大大制约了内放射疗法的应用效果与安全性。
26.(2)本发明聚羟基脂肪酸酯载药放疗微球药物包封率和释放率高,药物利用率高,通过控制外壳的厚度便可达到药物控释的效果;且不需要额外添加表面活性剂,更加提高生物安全性。
27.(3)本发明使用pha栓塞微球作为放射性同位素载体用于肿瘤介入栓塞治疗,解决了外放射治疗对正常组织损伤大的缺点。并且栓塞后缓慢释放靶向药物,迅速杀伤残余肿瘤,同时增加肿瘤细胞对放射线的敏感性,可以抑制肿瘤血管生成,减少肿瘤转移与复发,达到协同治疗目的。
28.附图
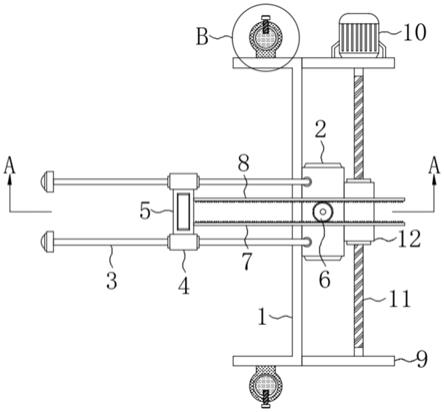
29.图1为本发明制备微球的双腔电喷雾装置图。
30.图2为本发明实施例1和对比例5不同方法制备的微球药物释放曲线。
31.图3为本发明实施例2-4制备的不同粒径微球的药物释放曲线。
32.图4为本发明实施例1制备微球药物释放后的残余材料表面电镜图片。
33.图5为实施例2制备的50微米粒径微球表面电镜图片。
34.图6为实施例3制备的100微米粒径微球表面电镜图片。
35.图7为实施例4制备的400微米粒径微球表面电镜图片。
具体实施方式
36.下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均为可从商业途径得到的试剂和材料。
37.实施例1
38.一种聚羟基脂肪酸酯载药放疗微球的制备方法,包括如下步骤:
39.(1)制备内向水溶液na
131
i,浓度为5%(w/v)。
40.(2)将聚羟基丁酸酯phb(分子量为1.3
×
106))溶解于乙腈溶液,配制成浓度为1%的外相溶液。
41.(3)采用双腔电喷雾装置制备微球,內相毛细管的内径为750微米,外径1250微米;
外相毛细管的内径选择1500微米,外径1970微米,分别将步骤(1)和步骤(2)配制的内相和外相溶液(比例为1:1)装载于内相和外相腔体中,双腔毛细管喷嘴与微球收集器之间相距8cm,建立由直流高压电源形成的高压电场,电压为10kv,喷嘴处正极,微球收集器接地,推进速度为85μl/min,加热后的压缩干燥氮气过滤后被送入喷雾装置,促进溶剂挥发,有机溶剂挥发后形成放射性phb微球,用蒸馏水置于接地铝板上收集制备的微球。
42.(4)离心收集微球,所得微球使用蒸馏水反复洗涤3遍,后真空冷冻干燥,得到固体微球粉末,-20℃保存。
43.使用放射剂量仪测定微球的包封率和载药率,按以下公式计算载药量与包封率:
[0044][0045][0046]
所得放射性phb微球载药率为12.7(w/w),包封率89%(w/w)。
[0047]
实施例2
[0048]
(1)制备内向水溶液na
131
i,浓度为15%(w/v)。
[0049]
(2)将聚羟基丁酸酯phb(分子量为1.3
×
106)溶解于乙腈溶液,配制成浓度为2%的外相溶液。
[0050]
(3)采用双腔电喷雾装置制备微球,內相毛细管的内径为750微米,外径1250微米;外相毛细管的内径选择1500微米,外径1970微米,分别将步骤(1)和步骤(2)配制的内相和外相溶液(比例为1:1)装载于内相和外相腔体中,双腔毛细管喷嘴与微球收集器之间相距10cm,建立由直流高压电源形成的高压电场,电压为15kv,喷嘴处正极,微球收集器接地,推进速度为85μl/min,加热后的压缩干燥氮气过滤后被送入喷雾装置,促进溶剂挥发,有机溶剂挥发后形成放射性phb微球,用蒸馏水置于接地铝板上收集制备的微球。
[0051]
(4)离心收集微球,所得微球使用蒸馏水反复洗涤3遍,后真空冷冻干燥,得到固体微球粉末,-20℃保存。
[0052]
使用放射剂量仪测定微球的包封率和载药率,按以下公式计算载药量与包封率:
[0053][0054][0055]
所得放射性phb微球载药率为15.5(w/w),包封率93%(w/w)。
[0056]
实施例3
[0057]
(1)制备内向水溶液na
131
i,浓度为25%(w/v)。
[0058]
(2)将聚羟基丁酸酯phb(分子量为1.3
×
106)溶解于乙腈溶液,配制成浓度为3%的外相溶液。
[0059]
(3)采用双腔电喷雾装置制备微球,內相毛细管的内径为750微米,外径1250微米;外相毛细管的内径选择1500微米,外径1970微米,分别将步骤(1)和步骤(2)配制的内相和外相溶液(比例为1:1)装载于内相和外相腔体中,双腔毛细管喷嘴与微球收集器之间相距15cm,建立由直流高压电源形成的高压电场,电压为18kv,喷嘴处正极,微球收集器接地,推
进速度为65μl/min,加热后的压缩干燥氮气过滤后被送入喷雾装置,促进溶剂挥发,有机溶剂挥发后形成放射性phb微球,用蒸馏水置于接地铝板上收集制备的微球。
[0060]
(4)离心收集微球,所得微球使用蒸馏水反复洗涤3遍,后真空冷冻干燥,得到固体微球粉末,-20℃保存。
[0061]
使用放射剂量仪测定微球的包封率和载药率,按以下公式计算载药量与包封率:
[0062][0063][0064]
所得放射性phb微球载药率为17.7(w/w),包封率97%(w/w)。
[0065]
实施例4
[0066]
(1)制备内向水溶液na
131
i,浓度为35%(w/v)。
[0067]
(2)将聚羟基丁酸酯phb(分子量为1.3
×
106)溶解于乙腈溶液,配制成浓度为5%的外相溶液。
[0068]
(3)采用双腔电喷雾装置制备微球,內相毛细管的内径为750微米,外径1250微米;外相毛细管的内径选择1500微米,外径1970微米,分别将步骤(1)和步骤(2)配制的内相和外相溶液(比例为1:1)装载于内相和外相腔体中,双腔毛细管喷嘴与微球收集器之间相距18cm,建立由直流高压电源形成的高压电场,电压为18kv,喷嘴处正极,微球收集器接地,推进速度为50μl/min,加热后的压缩干燥氮气过滤后被送入喷雾装置,促进溶剂挥发,有机溶剂挥发后形成放射性phb微球,用蒸馏水置于接地铝板上收集制备的微球。
[0069]
(4)离心收集微球,所得微球使用蒸馏水反复洗涤3遍,后真空冷冻干燥,得到固体微球粉末,-20℃保存。
[0070]
使用放射剂量仪测定微球的包封率和载药率,按以下公式计算载药量与包封率:
[0071][0072][0073]
所得放射性phb微球载药率为23(w/w),包封率97%(w/w)。
[0074]
对比例1
[0075]
对比例1与实施例1不同之处在于,对比例1在采用双腔电喷雾法制备聚羟基脂肪酸酯载药放疗微球的过程中,所用phb的浓度为0.5%,其他制备步骤及条件参数均与实施例1相同,此处不再重述。
[0076]
对比例2
[0077]
对比例2与实施例1不同之处在于,对比例2在采用双腔电喷雾法制备聚羟基脂肪酸酯载药放疗微球的过程中,所用phb的浓度为7%,其他制备步骤及条件参数均与实施例1相同,此处不再重述。
[0078]
对比例3
[0079]
对比例3与实施例1不同之处在于,对比例3在采用双腔电喷雾法制备聚羟基脂肪酸酯载药放疗微球的过程中,所用电喷电压分别为2kv,其他制备步骤及条件参数均与实施
例1相同,此处不再重述。
[0080]
对比例4
[0081]
对比例4与实施例1不同之处在于,对比例4在采用双腔电喷雾法制备聚羟基脂肪酸酯载药放疗微球的过程中,所用电喷电压为20kv,其他制备步骤及条件参数均与实施例1相同,此处不再重述。
[0082]
对比例5
[0083]
微乳液溶剂挥发法制备聚羟基脂肪酸酯载药放疗微球:
[0084]
(1)制备1%的phb/ch2cl2溶液,加入5%的na
131
i水溶液,pha:碘化钠为1:1,于冰浴中混匀制备混合溶液(i)。
[0085]
(2)将上述混合溶液(i)滴加入100ml10%的pva水溶液,震荡半分钟,然后冰浴超声(70khz,300w)中处理30s,再震荡1分钟,往复3~5次,形成微乳溶液。
[0086]
(3)将上述体系转移至磁力搅拌器上,在化学通风橱中,400rpm~1000rpm下搅拌8小时,让有机溶剂挥发。
[0087]
(4)在转速1000rpm离心15min收集微球,用1%pva水溶液洗涤三次,后真空冷冻干燥,得到固体微球粉末,-20℃保存。
[0088]
使用放射剂量仪测定微球的包封率和载药率,按以下公式计算载药量与包封率:
[0089][0090][0091]
所得放射性phb微球载药率为3.0%(w/w),包封率37.4%(w/w)。
[0092]
为了进一步说明本发明的技术效果,对实施例及对比例制备的微球性能进行测试。
[0093]
本发明通过对比例1-2试验发现,当pha的浓度低于0.5%时,电喷后得到的微球形貌不规则,当pha的浓度逐步提高到1%,3%,5%时,成球情况较好,当pha的浓度超过7%时,由于粘度太大,不能形成规则的球形微球。因此,本发明中当pha的浓度介于1%-5%之间时,成球效果较好。
[0094]
本技术在进行对比例3和4制备方法操作时,当电压低于3kv时,不能形成稳定的泰勒锥,使得溶液喷溅产生困难;当电压为20kv时,射流呈现多股状态,喷出的微球粒径分布很宽,大小相差很大。因此,本技术电喷射法制备pha微球的电压范围为3~18kv。
[0095]
药物释放率:称取实施例1和对比例5制备的微球0.1g置于透析袋中,分别浸入200mlpbs缓冲液中,置恒温磁力搅拌仪上37℃持续搅拌,分别于不同时间点时吸取20ml透析液样品,并立即补足相同体积的pbs缓冲液补足容量。用活度仪分别测定样品的放射性活度,并计算累积药物释放率,绘制累积释放曲线,释放曲线如图2所示,按higuchi方程以累积释放率q对t1/2作直线回归分析。
[0096]
通过图2可知,通过对比例5微乳液法制备的颗粒药物分布是随机的,因此,药物的释放方式也是随机的连续的,而且,我们的对照实验证明,超过50%的药物分布于微球的表面或者外层球体中,这些药物会在给药3天之内完全释放,导致局部药物浓度急剧降低。并且,由于微球致密的核心,嵌入微球致密核心的药物难以完全释放,在介入栓塞术后,微球
降解到一定粒径以内时,将脱离栓塞位置,进入血液循环,随之也将带走其中的药物。微乳液溶剂挥发法制备的微球药物释放率难以超过70%。与预混类型的微乳液制备方法相比,本发明制备的微球药物包封率和释放率高,技术效果更好。
[0097]
本发明对实施例2-4制备的不同粒径的微球及微球药物释放率进行测试,实施例2、实施例3和实施例4制备的微球表面电镜图片分别如图5、图6、图7所示,微球药物释放率测试结果如图3所示。由电镜图5-7可知,实施例2制备的微球粒径平均约50μm,实施例3制备的微球粒径平均约100μm,实施例4制备的微球粒径约为400μm,结果表明随着调节载体材料的浓度和注射速度,可以调节微球的粒径,并且,载药微球的粒径越小,其中的药物释放速度越快,因为微球的粒径越小,外壳的厚度越低,水渗透的速度越快,导致微球很快溶胀破裂。因此,可以通过控制外壳的厚度,即微球的粒径,即可达到药物控释的效果。
[0098]
本发明的上述实施例仅仅是为了清楚地说明本发明技术方案的所作的举例,而并非是对本发明的具体实施方式的限定。凡在本发明权利要求书的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。