1.本发明涉及有机化合物合成技术领域,具体涉及一种5-醛基胞嘧啶亚磷酰胺单体(包括用于合成寡聚脱氧核糖核苷酸或寡聚核糖核苷酸的单体)的合成方法。
背景技术:
2.5-醛基胞嘧啶(5-formylcytosine)是生物体内重要的一种表观遗传修饰碱基,不仅存在于脱氧核糖核酸(dna)中,也存在于核糖核酸(rna)中。目前的研究发现5-醛基胞嘧啶与基因的调节、dna结构的变化、细胞的分化以及疾病的发生等有着密切的联系。目前检测5-醛基胞嘧啶的方法是利用化学小分子与5-醛基胞嘧啶发生化学反应,通过荧光检测、定量pcr、测序等方法对5-醛基胞嘧啶进行定性和定量的检测。而化学小分子与5-醛基胞嘧啶的反应则需要在核酸层面进行验证,体外通过固相合成的方法合成的含5-醛基胞嘧啶的寡聚核苷酸(包括寡聚脱氧核糖核苷酸和寡聚核糖核苷酸)成为验证5-醛基胞嘧啶和化学小分子反应必不可少的材料。5-醛基胞嘧啶亚磷酰胺(5-formylcytosine phosphoramidite)单体(包括用于合成寡聚脱氧核糖核苷酸或寡聚核糖核苷酸的单体)则是固相合成含5-醛基胞嘧啶的寡聚核苷酸的原料。
3.目前已有的5-醛基胞嘧啶亚磷酰胺单体合成方法(angew.chem.int.ed.2014,53,315
–
318、chem.eur.j.2017,23,15894
–
15898和专利cn103201281a)采用由钯催化的一氧化碳插羰反应来引入醛基,反应需要价格昂贵的5-碘-2'-脱氧胞苷、5-碘胞苷以及贵金属钯催化剂,需要使用有毒的一氧化碳气体和有机锡试剂三正丁基氢锡,还需要使用高压反应釜,原料成本高、设备复杂,反应也不够安全。
技术实现要素:
4.有鉴于此,为了克服现有技术的不足,本发明的目的在于提供一种5-醛基胞嘧啶亚磷酰胺单体(包括用于合成寡聚脱氧核糖核苷酸或寡聚核糖核苷酸的单体)的合成方法。
5.为达到此目的,本发明所提供的技术方案具体如下:
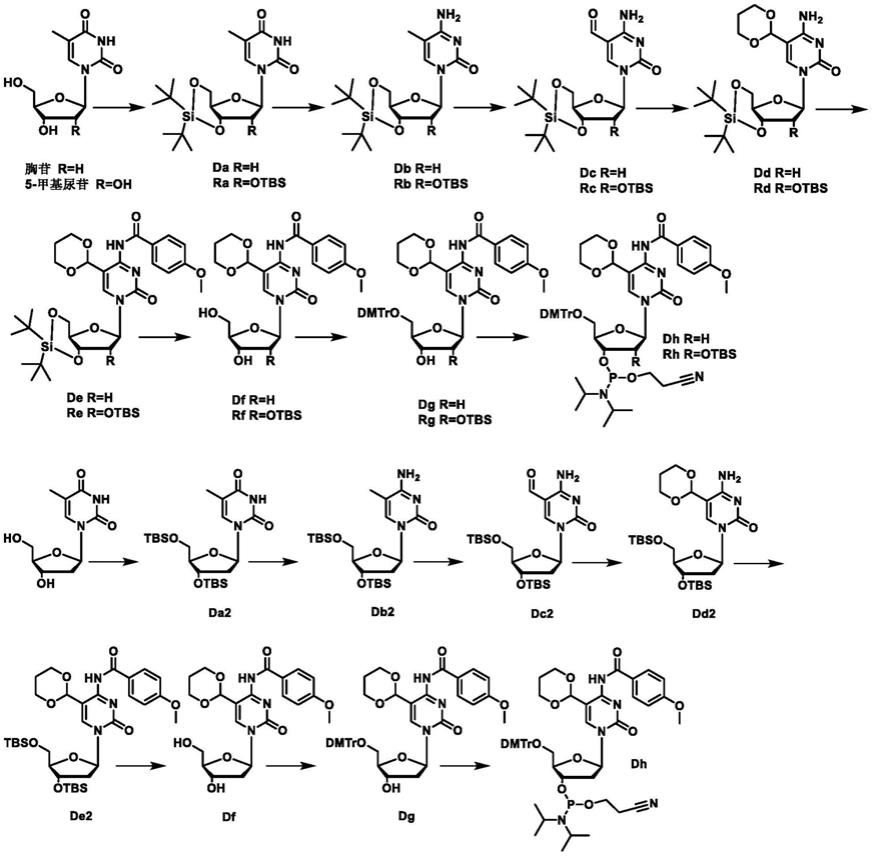
6.一种5-醛基胞嘧啶亚磷酰胺单体的合成方法,总的合成路线如下式所示,包括以下步骤:
[0007][0008]
(1)胸苷与二叔丁基硅基双(三氟甲烷磺酸)酯在n,n-二甲基甲酰胺中进行反应,用饱和碳酸氢钠猝灭后加入乙酸乙酯,将有机相洗涤、干燥、过滤、柱层析,得到化合物da;
[0009]
或胸苷与叔丁基二甲基氯硅烷、咪唑在n,n-二甲基甲酰胺中进行反应,用饱和碳酸氢钠猝灭后加入乙酸乙酯,将有机相洗涤、干燥、过滤、柱层析,得到化合物da2;
[0010]
或5-甲基尿苷与二叔丁基硅基双(三氟甲烷磺酸)酯在n,n-二甲基甲酰胺中先进行反应,再加入叔丁基二甲基氯硅烷、咪唑,继续反应,用饱和碳酸氢钠猝灭后加入乙酸乙酯,将有机相洗涤、干燥、过滤、柱层析,得到化合物ra。
[0011]
(2)化合物da、da2或ra与2,4,6-三异丙基苯磺酰氯、4-二甲氨基吡啶、三乙胺在乙腈中先进行反应,再加入氨水,继续反应,真空下除去溶剂,用盐酸猝灭后加入乙酸乙酯,将有机相洗涤、干燥、过滤、柱层析,得到化合物db、db2或rb。
[0012]
(3)化合物db、db2或rb与过硫酸盐溶液在乙腈中进行反应,加入乙酸乙酯,将有机相洗涤、干燥、过滤、柱层析,得到化合物dc、dc2或rc。所述的过硫酸盐包括过硫酸钠、过硫酸钾,所述的过硫酸盐溶液优选以磷酸盐缓冲液为溶剂。
[0013]
(4)化合物dc、dc2或rc与1,3-丙二醇、原甲酸三乙酯、四氯化钛在二氯甲烷中进行反应,用饱和碳酸氢钠猝灭后加入乙酸乙酯,将有机相洗涤、干燥、过滤、柱层析,得到化合物dd、dd2或rd。
[0014]
(5)化合物dd、dd2或rd与对甲氧基苯甲酰氯在吡啶中进行反应,用甲醇猝灭反应,真空下除去溶剂后柱层析,得到化合物de、de2或re。
[0015]
(6)化合物de、de2或re与吡啶氢氟酸盐在二氯甲烷中进行反应,用硅胶猝灭反应,真空下除去溶剂后柱层析,得到化合物df或rf。
[0016]
(7)化合物df或rf与4,4'-双甲氧基三苯甲基氯在吡啶中进行反应,用甲醇猝灭反应,真空下除去溶剂后柱层析,得到化合物dg或rg。
[0017]
(8)化合物dg或rg与2-氰乙基-n,n,n',n'-四异丙基亚磷酰二胺、四氮唑在二氯甲烷中进行反应,真空下除去溶剂,得到5-醛基胞嘧啶亚磷酰胺单体dh或rh。dh是固相合成含5-醛基胞嘧啶寡聚脱氧核糖核苷酸的原料,rh是固相合成含5-醛基胞嘧啶寡聚核糖核苷酸的原料。
[0018]
进一步地,所述步骤(1)中,胸苷与二叔丁基硅基双(三氟甲烷磺酸)酯的摩尔量之比为1:1.1-1.2。
[0019]
进一步地,所述步骤(1)中,胸苷与二叔丁基硅基双(三氟甲烷磺酸)酯在n,n-二甲基甲酰胺中进行反应的反应温度为0-4℃,反应时间为1-2小时。
[0020]
进一步地,所述步骤(1)中,胸苷与叔丁基二甲基氯硅烷、咪唑的摩尔量之比为1:2.5-3.5:3-6。
[0021]
进一步地,所述步骤(1)中,胸苷与叔丁基二甲基氯硅烷、咪唑在n,n-二甲基甲酰胺中进行反应的反应温度为40-60℃,反应时间为2-4小时。
[0022]
进一步地,所述步骤(1)中,5-甲基尿苷与二叔丁基硅基双(三氟甲烷磺酸)酯的摩尔量之比为1:1.1-1.2。5-甲基尿苷与叔丁基二甲基氯硅烷、咪唑的摩尔量之比为1:1.1-1.2:3-6。
[0023]
进一步地,所述步骤(1)中,5-甲基尿苷与二叔丁基硅基双(三氟甲烷磺酸)酯在n,n-二甲基甲酰胺中进行反应的反应温度为0-4℃,反应时间为1-2小时;加入叔丁基二甲基氯硅烷、咪唑继续反应的反应温度为40-60℃,反应时间为2-4小时。
[0024]
进一步地,所述步骤(2)中,化合物da、da2或ra与2,4,6-三异丙基苯磺酰氯、4-二甲氨基吡啶、三乙胺的摩尔量之比为1:2.5-3.5:2.5-3.5:2.5-3.5;,化合物da、da2或ra与氨水的摩尔量之比为1:5-10。
[0025]
进一步地,所述步骤(2)中,化合物da、da2或ra与2,4,6-三异丙基苯磺酰氯、4-二甲氨基吡啶、三乙胺在乙腈中进行反应的反应温度为20-40℃,反应时间为6-12小时;加入氨水继续反应的反应温度为20-40℃,反应时间为2-4小时。
[0026]
进一步地,所述步骤(3)中,化合物db、db2或rb与过硫酸盐的摩尔量之比为1:1.5-2.5。
[0027]
进一步地,所述步骤(3)中,化合物db、db2或rb与过硫酸盐溶液在乙腈中进行反应的反应温度为60-80℃,反应时间为3-6小时。
[0028]
进一步地,所述步骤(4)中,化合物dc、dc2或rc与1,3-丙二醇、原甲酸三乙酯、四氯化钛的摩尔量之比为1:3-5:1.1-1.2:0.4-0.6。
[0029]
进一步地,所述步骤(4)中,化合物dc、dc2或rc与1,3-丙二醇、原甲酸三乙酯、四氯化钛在二氯甲烷中进行反应的反应温度为0-4℃,反应时间为2-4小时。
[0030]
进一步地,所述步骤(5)中,化合物dd、dd2或rd与对甲氧基苯甲酰氯的摩尔量之比
为1:1.1-1.2。
[0031]
进一步地,所述步骤(5)中,化合物dd、dd2或rd与对甲氧基苯甲酰氯在吡啶中进行反应的反应温度为90-100℃,反应时间为2-4小时。
[0032]
进一步地,所述步骤(6)中,化合物de、de2或re与吡啶氢氟酸盐的摩尔量之比为1:4-10。
[0033]
进一步地,所述步骤(6)中,化合物de或re与吡啶氢氟酸盐在二氯甲烷中进行反应的反应温度为0-4℃,反应时间为2-4小时;化合物de2与吡啶氢氟酸盐在二氯甲烷中进行反应的反应温度为20-40℃,反应时间为2-4小时。
[0034]
进一步地,所述步骤(7)中,化合物df或rf与4,4'-双甲氧基三苯甲基氯的摩尔量之比为1:1.2-1.4。
[0035]
进一步地,所述步骤(7)中,化合物df或rf与4,4'-双甲氧基三苯甲基氯在吡啶中进行反应的反应温度为20-40℃,反应时间为6-12小时。
[0036]
进一步地,所述步骤(8)中,化合物dg或rg与2-氰乙基-n,n,n',n'-四异丙基亚磷酰二胺、四氮唑的摩尔量之比为1:0.9-1:0.4-0.6。
[0037]
进一步地,所述步骤(8)中,化合物dg或rg与2-氰乙基-n,n,n',n'-四异丙基亚磷酰二胺、四氮唑在二氯甲烷中进行反应的反应温度为20-40℃,反应时间为6-12小时。
[0038]
本发明具有如下优点和有益效果:本发明使用价格便宜的胸苷和5-甲基尿苷作为原料,使用过硫酸盐直接氧化甲基一步法生成醛基,避免了使用价格昂贵的5-碘-2'-脱氧胞苷、5-碘胞苷和贵金属钯催化剂,也避免了使用有毒的一氧化碳和有机锡试剂以及高压反应釜,降低反应成本的同时也使操作更加简单和安全。
附图说明
[0039]
图1为化合物dh的核磁共振磷谱图。
[0040]
图2为化合物dh的高分辨质谱图。
[0041]
图3为化合物rh的核磁共振磷谱图。
[0042]
图4为化合物rh的高分辨质谱图。
具体实施方式
[0043]
为了使本发明的目的、技术方案和优点更加清楚,下面将对本发明的优选实例进行详细的描述。
[0044]
以胸苷为起始原料和以5-甲基尿苷为起始原料合成5-醛基胞嘧啶亚磷酰胺单体(包括用于合成寡聚脱氧核糖核苷酸或寡聚核糖核苷酸的单体)的合成方法是一样的,仅在第一步有所区别。
[0045]
实施例1
[0046]
在圆底烧瓶中将4.84g(20mmol)胸苷溶于20ml n,n-二甲基甲酰胺,冰浴下逐滴加入7.8ml(24mmol)二叔丁基硅基双(三氟甲烷磺酸)酯,冰浴下反应45分钟。加入200ml饱和碳酸氢钠猝灭反应,用200ml乙酸乙酯萃取,有机相用200ml饱和碳酸氢钠洗涤,无水硫酸钠干燥后在真空下除去溶剂,用硅胶柱色谱纯化得到化合物da。1h nmr(400mhz,chloroform-d)δ9.46(s,1h),7.03(d,j=1.3hz,1h),6.21(dd,j=7.0,4.1hz,1h),4.43(dd,j=9.4,
5.1hz,1h),4.20(q,j=9.0hz,1h),4.00(dd,j=10.5,9.4hz,1h),3.67(ddd,j=10.5,8.9,5.0hz,1h),2.39
–
2.32(m,2h),1.94(d,j=1.3hz,3h),1.07(s,9h),1.00(s,9h).
13
c nmr(101mhz,chloroform-)δ163.9,150.4,135.2,111.7,83.9,78.0,75.0,67.4,38.6,27.5,27.2,22.8,20.2,12.9.hrms(esi )c
18h31
n2o5si
[m h]
calculated 383.1997,found 383.1998。
[0047]
在圆底烧瓶中将5.36g(14mmol)化合物da溶于200ml乙腈,加入6ml(42mmol)三乙胺、5.14g(42mmol)4-二甲氨基吡啶和12.72g(42mmol)2,4,6-三异丙基苯磺酰氯,室温下反应12小时。加入32ml(105mmol)氨水(25%),室温下反应2小时。真空下除去溶剂,加入200ml的稀盐酸(0.5mol/l)和200ml乙酸乙酯,有机相用200ml的稀盐酸(0.5mol/l)和200ml饱和碳酸氢钠洗涤,无水硫酸钠干燥后在真空下除去溶剂,用硅胶柱色谱纯化得到化合物db。1h nmr(400mhz,chloroform-d)δ8.45(br,1h),7.13(d,j=1.2hz,1h),6.20(dd,j=6.8,3.6hz,1h),5.32(br,1h),4.45(dd,j=9.3,5.0hz,1h),4.12(q,j=9.0hz,1h),4.01(dd,j=10.5,9.4hz,1h),3.75
–
3.68(m,1h),2.39
–
2.28(m,2h),1.93(d,j=1.1hz,3h),1.05(s,9h),1.00(s,9h).
13
c nmr(101mhz,chloroform-d)δ165.8,155.8,137.5,102.0,84.9,78.1,74.9,67.6,39.4,27.6,27.3,22.8,20.2,13.6.hrms(esi )c
18h32
n3o4si
[m h]
calculated 382.2157,found 382.2156。
[0048]
圆底烧瓶中将3.82g(10mmol)化合物db溶于150ml乙腈,将4.76g(20mmol)过硫酸钠溶于100ml磷酸钠缓冲液(0.2mol/l,ph=7.0)并加入圆底烧瓶中,70℃下反应,监测至原料消耗完。加入200ml乙酸乙酯,有机相用200ml饱和碳酸氢钠洗涤,无水硫酸钠干燥后在真空下除去溶剂,用硅胶柱色谱纯化得到化合物dc。1h nmr(400mhz,chloroform-d)δ9.51(s,1h),8.21(s,1h),8.09(s,1h),7.16(s,1h),6.11(dd,j=6.2,3.3hz,1h),4.54(dd,j=9.4,5.0hz,1h),4.11
–
4.00(m,2h),3.83(ddd,j=10.6,9.1,5.0hz,1h),2.54
–
2.45(m,2h),1.05(s,9h),1.02(s,9h).
13
c nmr(101mhz,chloroform-d)δ187.2,162.7,152.9,151.9,105.2,86.2,78.5,74.1,67.4,39.5,27.4,27.1,22.7,20.1.hrms(esi )c
18h30
n3o5si
[m h]
calculated 396.1949,found 396.1952。
[0049]
圆底烧瓶中将0.40g(1mmol)化合物dc溶于15ml二氯甲烷中,冰浴下逐滴加入0.3ml(4mmol)1,3-丙二醇、0.2ml(1.2mmol)原甲酸三乙酯和0.5ml(0.5mmol)四氯化钛(1mol/l,溶于二氯甲烷),冰浴下反应3小时。加入50ml饱和碳酸氢钠猝灭反应,用50ml乙酸乙酯萃取,有机相用50ml饱和碳酸氢钠洗涤,无水硫酸钠干燥后在真空下除去溶剂,用硅胶柱色谱纯化得到化合物dd。1h nmr(400mhz,chloroform-d)δ7.50(s br,2h),6.17(dd br,j=5.8,4.2hz,2h),5.27(s,1h),4.45(dd,j=9.3,5.0hz,1h),4.22(ddt,j=11.1,4.0,1.7hz,2h),4.11(q,j=9.0hz,1h),4.01(dd,j=10.6,9.3hz,1h),3.92(tt,j=12.0,2.3hz,2h),3.71(ddd,j=10.5,9.0,5.0hz,1h),2.39
–
2.32(m,2h),2.17(dtt,j=13.6,12.4,5.0hz,1h),1.46(ddt,j=13.8,2.7,1.3hz,1h),1.05(s,9h),1.00(s,9h).
13
c nmr(101mhz,chloroform-d)δ163.7,155.1,139.5,103.9,98.7,85.2,78.2,74.5,67.6,67.4,39.5,27.6,27.2,25.6,22.8,20.2.hrms(esi )c
21h36
n3o6si
[m h]
calculated 454.2368,found 454.2371。
[0050]
圆底烧瓶中将320mg(0.7mmol)化合物dd溶于10ml无水吡啶,加入130mg(0.77mmol)对甲氧基苯甲酰氯,100℃下反应2小时。加入1ml甲醇猝灭反应,在真空下除去
d)δ8.97(s,1h),7.46(d,j=1.3hz,1h),6.33(dd,j=7.9,5.8hz,1h),4.40(dt,j=5.6,2.6hz,1h),3.92(q,j=2.5hz,1h),3.86(dd,j=11.4,2.6hz,1h),3.75(dd,j=11.4,2.4hz,1h),2.24(ddd,j=13.1,5.9,2.7hz,1h),1.99(ddd,j=13.1,8.0,6.0hz,1h),1.91(d,j=1.3hz,3h),0.92(s,9h),0.89(s,9h),0.11(s,3h),0.10(s,3h),0.07(s,3h),0.07(s,3h).
13
c nmr(101mhz,chloroform-d)δ164.0,150.5,135.6,111.0,87.9,84.9,72.4,63.1,41.5,26.1,25.9,18.5,18.1,12.7,-4.5,-4.7,-5.2,-5.3.hrms(esi )c
22h43
n2o5si
2
[m h]
calculated 471.2705,found 471.2705。
[0056]
实施例3
[0057]
在圆底烧瓶中将5.16g(20mmol)5-甲基尿苷溶于20ml n,n-二甲基甲酰胺,冰浴下逐滴加入7.8ml(24mmol)二叔丁基硅基双(三氟甲烷磺酸)酯,反应45分钟后,加入6.8g(100mmol)咪唑和3.6g(24mmol)叔丁基二甲基氯硅烷,60℃下反应2小时。加入200ml饱和碳酸氢钠猝灭反应,用200ml乙酸乙酯萃取,有机相用200ml饱和碳酸氢钠洗涤,无水硫酸钠干燥后在真空下除去溶剂,用硅胶柱色谱纯化得到化合物ra。1h nmr(400mhz,chloroform-d)δ9.02(s,1h),7.01(d,j=1.3hz,1h),5.65(d,j=0.7hz,1h),4.49(dd,j=9.2,5.0hz,1h),4.29(d,j=4.8hz,1h),4.13
–
4.08(m,1h),3.98(dd,j=10.5,9.2hz,1h),3.92(dd,j=9.6,4.9hz,1h),1.93(s,3h),1.06(s,9h),1.02(s,9h),0.92(s,9h),0.16(s,3h),0.13(s,3h).
13
c nmr(101mhz,chloroform-d)δ163.8,149.9,135.6,111.1,94.3,76.3,75.3,74.5,67.7,27.6,27.1,26.0,22.9,20.5,18.4,12.8,-4.2,-4.9.hrms(esi )c
24h45
n2o6si
2
[m h]
calculated 513.2811,found 513.2809。
[0058]
在圆底烧瓶中将7.18g(14mmol)化合物ra溶于200ml乙腈,加入6ml(42mmol)三乙胺、5.14g(42mmol)4-二甲氨基吡啶和12.72g(42mmol)2,4,6-三异丙基苯磺酰氯,室温下反应12小时。加入32ml(105mmol)氨水(25%),室温下反应2小时。真空下除去溶剂,加入200ml的稀盐酸(0.5mol/l)和200ml乙酸乙酯,有机相用200ml的稀盐酸(0.5mol/l)和200ml饱和碳酸氢钠洗涤,无水硫酸钠干燥后在真空下除去溶剂,用硅胶柱色谱纯化得到化合物rb。1h nmr(400mhz,chloroform-d)δ8.65(br,1h),7.07(d,j=1.2hz,1h),5.64(s,1h),5.29(br,1h),4.49(dd,j=9.1,5.1hz,1h),4.34(d,j=4.7hz,1h),4.21
–
4.08(m,1h),3.99(dd,j=10.6,9.2hz,1h),3.93(dd,j=9.6,4.6hz,1h),1.91(s,3h),1.04(s,9h),1.02(s,9h),0.92(s,9h),0.19(s,3h),0.13(s,3h).
13
c nmr(101mhz,chloroform-d)δ165.9,155.5,138.3,101.8,95.2,76.1,75.2,74.4,67.9,27.6,27.1,26.1,22.9,20.5,18.4,13.5,-4.2,-4.7.hrms(esi )c
24h46
n3o5si
2
[m h]
calculated 512.2971,found 512.2969。
[0059]
圆底烧瓶中将5.12g(10mmol)化合物rb溶于150ml乙腈,将4.76g(20mmol)过硫酸钠溶于100ml磷酸钠缓冲液(0.2mol/l,ph=7.0)并加入圆底烧瓶中,70℃下反应,监测至原料消耗完。加入200ml乙酸乙酯,有机相用200ml饱和碳酸氢钠洗涤,无水硫酸钠干燥后在真空下除去溶剂,用硅胶柱色谱纯化得到化合物rc。1h nmr(400mhz,chloroform-d)δ9.47(s,1h),8.17(br,1h),8.02(s,1h),6.90(br,1h),5.71(s,1h),4.59(dd,j=9.2,5.2hz,1h),4.37(d,j=4.3hz,1h),4.30(dd,j=10.1,5.2hz,1h),4.00(dd,j=10.6,9.2hz,1h),3.75(dd,j=9.7,4.3hz,1h),1.03(s,9h),1.03(s,9h),0.95(s,9h),0.25(s,3h),0.17(s,3h).
13
c nmr(101mhz,chloroform-d)δ187.1,162.7,153.0,152.1,105.5,94.6,75.9,75.3,74.9,68.0,27.6,27.1,26.0,23.0,20.5,18.3,-4.1,-4.7.hrms(esi )c
24h44
n3o6si
2
[m h]
calculated 526.2763,found 526.2765。
[0060]
圆底烧瓶中将0.53g(1mmol)化合物rc溶于15ml二氯甲烷中,冰浴下逐滴加入0.3ml(4mmol)1,3-丙二醇、0.2ml(1.2mmol)原甲酸三乙酯和0.5ml(0.5mmol)四氯化钛(1mol/l,溶于二氯甲烷),冰浴下反应3小时。加入50ml饱和碳酸氢钠猝灭反应,用50ml乙酸乙酯萃取,有机相用50ml饱和碳酸氢钠洗涤,无水硫酸钠干燥后在真空下除去溶剂,用硅胶柱色谱纯化得到化合物rd。1h nmr(400mhz,chloroform-d)δ7.46(s,1h),7.34(br,1h),6.11(br,1h),5.74(s,1h),5.26(s,1h),4.50(dd,j=9.2,5.1hz,1h),4.26(d,j=4.4hz,1h),4.24
–
4.14(m,3h),4.00(dd,j=10.7,9.2hz,1h),3.96
–
3.86(m,3h),2.16(dtt,j=13.6,12.3,4.9hz,1h),1.46(ddt,j=13.7,2.6,1.2hz,1h),1.04(s,9h),1.01(s,9h),0.93(s,9h),0.20(s,3h),0.13(s,3h).
13
c nmr(101mhz,chloroform-d)δ163.6,154.9,139.8,103.8,98.3,94.3,75.8,75.4,74.5,67.9,67.4,27.6,27.1,26.0,25.6,22.9,20.4,18.3,-4.3,-4.7.hrms(esi )c
27h50
n3o7si
2
[m h]
calculated 584.3182,found 584.3187。
[0061]
圆底烧瓶中将400mg(0.7mmol)化合物rd溶于10ml无水吡啶,加入130mg(0.77mmol)对甲氧基苯甲酰氯,100℃下反应2小时。加入1ml甲醇猝灭反应,在真空下除去溶剂,用硅胶柱色谱纯化得到化合物re。1h nmr(400mhz,chloroform-d)δ13.34(br,1h),8.23(s,1h),8.21(s,1h),7.77(s,1h),6.95
–
6.92(m,1h),6.92
–
6.90(m,1h),5.80(s,1h),5.77(s,1h),4.55(dd,j=9.2,5.1hz,1h),4.28
–
4.19(m,4h),4.11
–
3.98(m,3h),3.93(dd,j=9.7,4.3hz,1h),3.87(s,3h),2.24
–
2.09(m,1h),1.47(ddt,j=13.6,2.6,1.3hz,1h),1.06(s,9h),1.03(s,9h),0.94(s,9h),0.20(s,3h),0.15(s,3h).
13
c nmr(101mhz,chloroform-d)δ179.1,163.4,157.1,147.4,139.0,132.2,129.9,113.5,95.6,93.6,75.6,75.6,74.8,67.8,67.7,55.5,27.6,27.1,25.9,25.9,23.0,20.4,18.4,-4.2,-4.9.hrms(esi )c
35h56
n3o9si
2
[m h]
calculated 718.3550,found 718.3549。
[0062]
圆底烧瓶中将360mg(0.5mmol)化合物re溶于10ml二氯甲烷,冰浴下加入0.1ml(4mmol)吡啶氢氟酸盐(70%),冰浴下反应2小时。加入硅胶猝灭反应,在真空下除去溶剂,用硅胶柱色谱纯化得到化合物rf。1h nmr(400mhz,chloroform-d)δ13.37(s,1h),8.22(s,2h),7.96(s,1h),6.95
–
6.92(m,1h),6.92
–
6.90(m,1h),5.79(s,1h),5.57(d,j=4.6hz,1h),4.63(t,j=4.9hz,1h),4.26
–
4.17(m,3h),4.14
–
4.11(m,1h),4.05
–
3.93(m,3h),3.86(s,3h),3.83
–
3.74(m,1h),3.22(s,1h),2.65(d,j=4.9hz,1h),2.22
–
2.08(m,1h),1.44(dt,j=13.6,1.4hz,1h),0.90(s,9h),0.09(s,3h),0.09(s,3h).
13
c nmr(101mhz,chloroform-d)δ179.2,163.4,157.0,147.9,142.0,132.2,129.8,113.5,95.6,94.4,85.8,74.2,70.7,67.7,67.7,62.2,55.5,25.8,25.8,18.1,-4.6,-5.0.hrms(esi )c
27h40
n3o9si
[m h]
calculated 578.2528,found 578.2531。
[0063]
圆底烧瓶中将230mg(0.4mmol)化合物rf和190mg(0.56mmol)4,4'-双甲氧基三苯甲基氯溶于10ml无水吡啶,室温下反应12小时。加入1ml甲醇猝灭反应,在真空下除去溶剂,用硅胶柱色谱纯化得到化合物rg。1h nmr(400mhz,chloroform-d)δ13.41(s,1h),8.36
–
8.19(m,3h),7.53
–
7.47(m,2h),7.38(t,j=8.5hz,4h),7.31(dd,j=8.4,6.9hz,2h),7.25
–
7.20(m,1h),6.96
–
6.94(m,1h),6.93
–
6.91(m,1h),6.89
–
6.82(m,4h),6.14(d,j=6.4hz,1h),5.77(s,1h),4.46(t,j=5.6hz,1h),4.16
–
4.13(m,1h),4.02(s,1h),3.87(s,3h),3.80(s,3h),3.79(s,3h),3.78
–
3.72(m,3h),3.69(d,j=2.0hz,1h),3.66(d,j=1.9hz,1h),
3.16(d,j=11.0hz,1h),2.68(s,1h),1.40
–
1.21(m,2h),0.89(s,9h),0.09(s,3h),0.07(s,3h).
13
c nmr(101mhz,chloroform-d)δ179.3,163.4,158.7,157.2,147.9,144.8,139.3,136.0,135.5,132.2,130.4,130.3,130.0,128.3,128.1,126.9,114.2,113.5,113.4,113.3,95.5,87.4,87.0,84.1,76.0,71.5,67.4,67.3,63.4,55.5,55.4,25.8,25.0,18.1,-4.6,-5.1.hrms(esi )c
48h58
n3o
11
si
[m h]
calculated 880.3835,found 880.3837。
[0064]
圆底烧瓶中将260mg(0.3mmol)化合物rg和11mg(0.15mmol)四氮唑溶于10ml无水二氯甲烷,冰浴及氮气保护下加入0.086ml(0.27mmol)2-氰乙基-n,n,n',n'-四异丙基亚磷酰二胺。室温下反应监测至原料消耗完,在真空下除去溶剂,所得产物rh可直接用于固相合成含5-醛基胞嘧啶寡聚核糖核苷酸。
31
p nmr(162mhz,chloroform-d)δ151.3,148.6.hrms(esi )c
57h75
n5o
12
psi
[m h]
calculated 1080.4914,found 1080.4912。
[0065]
上述实施方式仅为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
