1.本发明属于新黄酮类化合物技术领域,具体涉及一种罗汉果新黄酮类化合物、其制备方法及在蜜蜂引诱剂中的应用。
背景技术:
2.黄酮类化合物是指两个苯环(a环和b环)通过中央三个碳原子相互连接、具有c
6-c
3-c6骨架的一系列化合物,分布广泛,在植物体中主要以糖苷形式存在,对植物的生长、发育、开发、结果以及抵御病原体和动物的侵入起着重要作用。同时,黄酮类化合物也是一类重要的生物活性成分,具有调节免疫力、改善血液循环、抗病毒、抗炎、抗肿瘤、抗衰老、保护肝肾、降血糖、降血脂等多种生理功能及药理作用。新的黄酮类化合物,不仅丰富了天然化合物的种类与来源,也对开发新的健康产品、天然药物以及化工产品具有重要意义。
3.植物自然授粉的方式包含风媒、虫媒、水媒、鸟媒等,其中多数有花植物是靠昆虫为媒介进行传粉。但有些植物因自身特殊的生理结构导致自然授粉的效率十分低下,如罗汉果(siraitia grosvenorii(swingle)c.jeffrey),不仅雄花寿命短且花粉粒牢牢粘附在花药的下弯钩,很难通过风媒进行传粉;且雌花因缺少花香、蜜源等组分,也很难吸引昆虫为其传粉,导致严重的自然传粉受限,坐果结实率极低。农业生产上为提高自然传粉受限这类植物的产量,传统是采用人工辅助授粉的方式来解决这一难题,但该生产环节极为费工费时且并发问题多,尤其近年来不断上涨的劳动力成本导致种植业投入大、产出低的现象经常发生。因此,急需寻找一种能够低成本解决这类植物授粉问题的方法。
4.蜜蜂是优秀的授粉昆虫,且为世界范围内广泛饲养的蜂种,利用蜜蜂引诱剂吸引蜜蜂为自然授粉受限的植物进行授粉,不仅增产增收,同时有利于果实成长的均匀度,减少因人工授粉造成的畸形果。但现有技术中,引诱剂配方多为芳香性的挥发性成分或者植物源的花汁或者糖浆,这些物质喷洒在待授粉的植物花苞上,其挥发性成分很容易扩散导致诱蜂传粉的效果不稳定,然而将含有大量糖分的引诱剂喷洒在植物上面,很容易造成植物发生各种病害,同时也会吸引其他害虫危害。因此有必要从天然产物中发现其它对蜜蜂具有引诱作用的活性成分。
5.罗汉果是葫芦科罗汉果属植物,雌雄异株,其果实药食两用并作为一种天然甜味剂在世界范围内得到广泛应用,其需求量与日剧增,种植面积也逐年增加。而在罗汉果种植过程中同时产生大量的罗汉果茎、叶、藤条等副产物资源却未得到有效利用,叶虽在民间当作茶类使用,但一般也作为废弃物丢弃,既浪费资源又污染环境。因此,若能从罗汉果这些副产物资源中寻找更多的天然活性成分,变废为宝,对于环境保护并促进当地罗汉果产业发展具有重要的现实意义。
技术实现要素:
6.本发明针对现有技术存在的上述不足,提出一种罗汉果新黄酮类化合物、其制备
方法及在蜜蜂引诱剂中的应用。
7.为实现上述目的,本发明提供了如下技术方案:
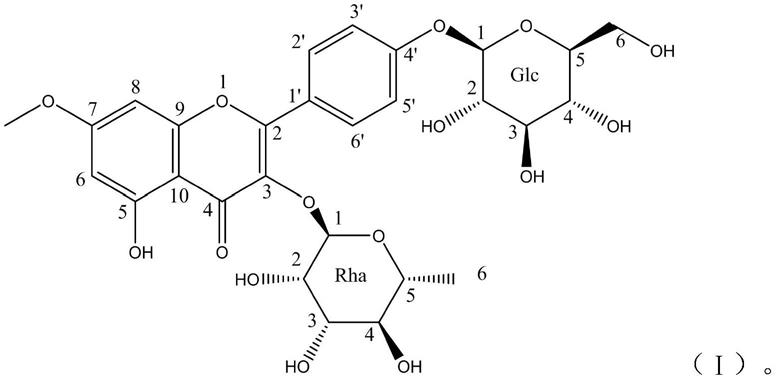
8.本发明提供了一种新黄酮类化合物,其特征在于,所述化合物为具有下述式(ⅰ)所示结构的化合物或其药学上可接受的盐:
[0009][0010]
上述式(ⅰ)所示结构的化合物的化学名称为:鼠李柠檬素-3-o-α-l-鼠李糖-4
′‑
o-β-d-葡萄糖苷;
[0011]
英文名称为:rhamnocitrin-3-o-α-l-rhamnosyl-4
′‑
β-d-glucoside;
[0012]
分子式为:c
28h32o15
,[m hcoo]-653.1739,平均分子量608.55;
[0013]
理化性质如下:黄色无定型粉末,易溶于水、甲醇,难溶于石油醚、氯仿、乙酸乙酯、正丁醇、乙醇。在本发明中将其命名为xy8。
[0014]
本发明还提供了上述新黄酮类化合物的制备方法,包括以下步骤:对罗汉果雄株叶片进行提取,得到提取物,之后对所述提取物进行高速逆流色谱分离,分段收集流分,以uplc-ms或tlc检识并合并流分,回收溶剂,分别得到ⅰ~ⅵ共6个部分,其中第ⅳ部分的黄色粉末状逆流色谱纯化物即为式(ⅰ)所示结构的新黄酮类化合物。
[0015]
进一步地,所述提取以水和/或低碳醇为溶剂;所述高速逆流色谱分离的固定相和流动相由水与酯类溶剂、醇类溶剂、酮类溶剂、醚类溶剂、卤代烃类溶剂、烷烃类溶剂、腈类溶剂或酸类溶剂中的一种或两种以上组成、对所述新黄酮类化合物的分配系数在0.2~5.0之间的两相溶剂体系。
[0016]
对罗汉果雄株叶片进行提取时,罗汉果的雄株叶片可以是新鲜的或干燥的;在提取时的操作(如提取的方式、提取的时间)等均与现有技术相同,优选采用加热提取(40-80℃)或回流提取。
[0017]
进一步地,所述低碳醇包括体积浓度为10~100%甲醇或体积浓度为10~100%乙醇,优选为体积浓度为30~80%甲醇或体积浓度为30~80%乙醇;所述酯类溶剂选自乙酸乙酯、乙酸丁酯和乙酸戊酯中的一种或多种;所述醇类溶剂选自甲醇、乙醇、丙醇、异丙醇、正丁醇、异丁醇、正戊醇和2-戊醇中的一种或多种;所述酮类溶剂选自丙酮、丁酮、环戊酮、甲基异丁酮和环己酮中的一种或多种;所述醚类溶剂选自乙醚、甲基叔丁基醚、二氧六环和四氢呋喃中的一种或多种;所述卤代烃类溶剂选自二氯甲烷、二氯乙烷、三氯甲烷和四氯化碳中的一种或多种;所述烷烃类溶剂选自正己烷、正庚烷、异辛烷、石油醚和汽油中的一种
或多种;所述腈类溶剂为乙腈;所述酸类溶剂为甲酸和/或乙酸。
[0018]
更进一步地,所述石油醚包括沸程30-60℃的石油醚和沸程为60-90℃的石油醚。
[0019]
由于高速逆流色谱两相溶剂体系的配比与两相比例相关,因此两相溶剂的总组成比例可根据上下两相的比例做出改变,而不影响上相的组成或者下相的组成,不影响两相溶剂的分配系数。
[0020]
进一步地,进行高速逆流色谱分离时的固定相和流动相优选为:
[0021]
以体积比为3.5:1:3.5:0.05的乙酸乙酯、甲醇、水和乙酸配制得到的混合溶液。
[0022]
进行高速逆流色谱分离的溶剂体系,可以上相为固定相,下相为流动相;也可以下相为固定相,上相为流动相。
[0023]
进一步地,所述高速逆流色谱分离的温度为10~35℃,主机为正转或反转,转速为750~900rpm,流动相流速为0.5~15.0ml/min。
[0024]
高速逆流色谱取待分离样品的准备、上样、分段收集流分等操作均与现有技术相同。优选如下:
[0025]
高速逆流色谱待分离样品的准备:取提取物干品,称重,取上相溶液或下相溶液,或上下相均有的溶液,体积相当于干品质量数的100~1000倍量,溶解干品,离心取上清液,即得。
[0026]
取不超过高速逆流色谱仪进样环体积的待分离样品,进样注入高速逆流色谱仪,每5~15ml收集1个流分;uplc-ms检测或tlc检测并合并流分,回收溶剂,分别得到ⅰ~ⅵ6个部分,其中第ⅳ部分的黄色粉末状逆流色谱纯化物即为化合物xy8。
[0027]
为了减轻高速逆流色谱仪的负担,优选对所述提取物进行初步纯化后再上高速逆流色谱仪进行分离。所述的初步纯化操作具体可以是将提取物进行大孔树脂柱层析和/或萃取操作,具体的:
[0028]
当采用大孔树脂柱层析进行纯化时,所述的大孔树脂为能吸附分离化合物xy8的药用级大孔吸附树脂,优选的型号为amberlite xad16、x-5、ab-8或d101等。在对大孔树脂柱进行洗脱时,通常采用醇/水按0:100~95:5的混合溶剂进行梯度洗脱,收集含有化合物xy8的部分,优选是收集醇/水按30:70的体积比组成的混合溶剂进行洗脱的部分。其中的醇为甲醇或乙醇。
[0029]
当采用萃取操作进行纯化时,包括除杂质萃取和/或化合物xy8萃取。对于杂质萃取,优选采用石油醚或正己烷萃取去除叶绿素、甾醇等杂质。对于化合物xy8萃取,优选采用正丁醇或者是含正丁醇的混合溶剂将化合物xy8转移到有机溶剂中。
[0030]
采用上述制备方法所得的新黄酮类化合物的纯度达95.0%以上(hplc检测),如需要进一步提高其纯度,则可将其上反相色谱柱层析,以乙腈和水组成的混合溶剂作为流动相进行分离,以得到纯化后的式(ⅰ)所示结构的化合物。其中,在流动相组成中乙腈和水的体积比优选为20:80~40:60。具体的操作为:以体积比为20:80~40:60的乙腈-水作为流动相,进样,分离精制,313波长检测,总运行时间8~18min,收集单峰洗脱液。在进样时,是将样品用甲醇溶解配成质量浓度为0.1~20mg/ml的溶液。
[0031]
优选条件:zorbax sb-c18色谱柱(9.4mm
×
250mm,5μm),流动相系统为乙腈(a)-0.1%甲酸水(b),梯度洗脱程序(0~15min,23%~40%a;15~15.01min,40%~70%a;15.01~23min,70%a,23~23.01min,70~23%a,23.01~30min,23%a);柱温30℃;流速
3.0ml
·
min-1
;进样量80μl,检测波长313nm。
[0032]
本发明还提供了上述新黄酮类化合物在制备蜜蜂引诱剂中的应用。
[0033]
本发明同时提供了一种蜜蜂引诱剂,包括上述所述的新黄酮类化合物。
[0034]
本发明在对罗汉果的研究中发现:罗汉果雄株叶片提取物对蜜蜂有较强的吸引作用,而雌株叶片提取物对蜜蜂无吸引作用,进一步的试验证实,虽然罗汉果雌雄株叶片中均含有较高含量的黄酮类化合物,但罗汉果雄株叶片和雌株叶片黄酮类化合物的具体组成和含量均存在显著差异,表明罗汉果雄株叶片中可能存在含量相对较高的对蜜蜂具有吸引作用的化合物,经过进一步提取分离,得到所述对蜜蜂具有良好的引诱作用的新黄酮类化合物。
[0035]
与现有技术相比,本发明具有以下有益效果:
[0036]
本发明采用高速逆流色谱首次从葫芦科罗汉果属罗汉果(siraitia grosvenorii(swingle)c.jeffrey)的雄株叶片中分离得到一种新的黄酮类化合物,这种黄酮类化合物对蜜蜂具有引诱活性,可用于蜜蜂引诱剂的制备。
[0037]
本发明的新的黄酮类化合物,来源于罗汉果,是一种新的天然化合物,其结构与活性均尚未被报道,对蜜蜂具有较好的引诱活性,为开发新型的蜜蜂引诱剂提供了理想的候选化合物,既开辟了新的蜜蜂引诱剂,又开辟了罗汉果新的应用领域,为罗汉果叶进一步开发利用奠定了基础。
[0038]
本发明的新黄酮类化合物的制备方法简单,产品纯度高,操作容易,市场前景广阔,适合规模化推广应用。
附图说明
[0039]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0040]
图1为实施例1中罗汉果雄株叶片提取物高速逆流色谱分离图谱。
具体实施方式
[0041]
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。
[0042]
另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
[0043]
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的
文献冲突时,以本说明书的内容为准。
[0044]
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本发明说明书和实施例仅是示例性的。
[0045]
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
[0046]
本发明所说的“份”,如无特别说明,均指重量份。
[0047]
实施例1
[0048]
新黄酮类化合物xy8的制备:
[0049]
1)获取罗汉果雄株叶片提取物
[0050]
称取罗汉果(siraitia grosvenorii(swingle)c.jeffrey)雄株叶片干叶1kg,粉碎,加入8倍重量的70%(体积)甲醇,60℃加热回流提取60min,过滤,收集滤液。滤渣再次加入8倍重量的70%(体积)甲醇,60℃加热回流60min提取,过滤。合并滤液,滤液在60℃下用旋蒸仪减压蒸发浓缩至2l。浓缩液加甲醇2l,用石油醚萃取2次,每次用量2l,收集下相,石油醚相回收溶剂后弃去,下相于60℃下旋蒸至2l,得提取液lhgxy01。
[0051]
2)提取物的初步纯化
[0052]
取提取液lhgxy01,上d101大孔吸附树脂柱上毕,依次用水、10%(体积)甲醇-水、50%(体积)甲醇-水、95%(体积)甲醇梯度洗脱。lc-ms分析表明50%(体积)甲醇洗脱部分含有新化合物xy8。将50%(体积)甲醇洗脱液合并,浓缩,减压蒸干得浸膏lhgxy02。
[0053]
3)高速逆流色谱分离
[0054]
3.1)量取乙酸乙酯700ml、甲醇200ml、纯水700ml、乙酸0.1ml,配制体积比为3.5:1:3.5:0.05的混合溶液,该混合液对xy8的分配系数为1.0,充分振摇后静置0.5h,上下两层完全分层澄清,分离上下层,得到上相溶液与下相溶液,分别超声脱气10min,备用;
[0055]
3.2)取浸膏lhgxy021.0g,取步骤3.1)的下相溶液15ml,溶解lhgxy02,溶液离心,取上清液备用;
[0056]
3.3)取步骤3.1)的上相溶液作固定相,泵入高速逆流色谱仪分离管,待固定相充满整个分离管后,调节主机为正转,至最大转速(900r/min),同时将步骤3.1)的下相溶液作流动相泵入,待流动相从柱口流出且固定相不流出,两相溶剂在分离管中达到动态平衡后,取步骤3.2)的上清液15ml,注入进样阀,流速2ml/min的条件下分离样品,313nm波长下检测,每7ml收集1个流分。所得高速逆流色谱分离图谱如图1所示,将所有流分分段为6个部分ⅰ~ⅵ。用真空离心浓缩仪将第iv部分19-24流分旋干,以色谱醇甲醇溶解,uplc-ms检测。其中流分20~23呈黄色粉末状(lhgxy03,153.5mg),为分子量[m hcoo]-653.1739的化合物(即化合物xy8),经hplc检测,纯度为95.8%。
[0057]
对上述所得黄色粉末lhgxy03进行表征:
[0058]
xy8:黄色无定型粉末;uv(meoh)λmax 264,313nm;1h(500mhz)和
13
c(125mhz)nmr数据见表1;电喷雾高分辨质谱(负离子模式)hresims m/z 653.1739[m hcoo]-,分子式c
28h32o15
,计算值653.1723,分子量608.55,不饱和度13。
[0059]
表1:黄色粉末lhgxy03的1hnmr和
13
c nmr数据
[0060][0061][0062]
注:溶剂为氘代甲醇,氢谱500mhz,碳谱125mhz。
[0063]
从表1中可以看出,1hnmrδ7.905(2h,d,j=8.9hz)、7.273(2h,d,j=8.9hz)为黄酮c环4
′
被取代的特征;δ6.614(1h,d,j=2.1hz)、7.273(1h,d,j=2.1hz)为黄酮a环间位被二取代的特征;b环没有氢信号表明黄酮b环3
′
位被取代;δ3.90(1h,s)为甲氧基的特征;δ5.431(1h,d,j=1.8hz)、δ5.431(3h,s)为α-l-鼠李糖的特征;δ5.10(1h,d,j=7.5hz)为β-d-葡萄糖的特征;
13
cnmr碳谱化学位移与4
′
,3,5,7-四羟基黄酮接近,根据文献与hsqc关联信号,确证化合物为4
′
,3,5,7-四羟基黄酮的取代产物。根据hmbc关联信号,甲氧基与6位、8位芳氢有关联信号,表明甲氧基位于7-位;鼠李糖端基氢与3-碳有关联信号,表明鼠李糖位
于3-位;葡萄糖端基氢与4
′‑
碳有关联信号,表明葡萄糖位于4
′‑
位。
[0064]
因此,可确定实验例1所得黄色无定形粉末为化合物xy8,鼠李柠檬素-3-o-α-l-鼠李糖-4
′‑
o-β-d-葡萄糖苷,其结构如下述式(ⅰ)所示,该结构得到核磁共振谱hsqc、hmbc的确证。
[0065][0066]
实施例2
[0067]
新黄酮类化合物xy8的制备:
[0068]
1)获取罗汉果雄株叶片提取物
[0069]
称取罗汉果(siraitia grosvenorii(swingle)c.jeffrey)雄株叶片干叶1kg,粉碎,加入8倍重量的水,50℃加热回流提取60min,过滤,收集滤液。滤渣再次加入8倍重量的水,50℃加热回流60min提取,过滤。合并滤液,滤液在60℃下用旋蒸仪减压蒸发浓缩至2l。浓缩液加甲醇2l,用石油醚萃取2次,每次用量2l,收集下相,石油醚相回收溶剂后弃去,下相于60℃下旋蒸至2l,得提取液lhgxy01。
[0070]
步骤2)~3)同实施例1。
[0071]
本实施例步骤3)经高速逆流色谱分离,所得流分经uplc-ms检测、合并后,也分段为与实施例1相同的6个部分ⅰ~ⅵ,区别在于各部分的含量与实施例1不同。用真空离心浓缩仪将第iv部分19-24流分旋干,以色谱醇甲醇溶解,uplc-ms检测。其中流分20~23呈黄色粉末状(lhgxy03,115.6mg),为分子量[m hcoo]-653.1739的化合物(即化合物xy8),经hplc检测,纯度为95.8%。
[0072]
实施例3
[0073]
新黄酮类化合物xy8的制备:
[0074]
1)获取罗汉果雄株叶片提取物
[0075]
称取罗汉果(siraitia grosvenorii(swingle)c.jeffrey)雄株叶片干叶1kg,粉碎,加入8倍重量的100%(体积)乙醇,40℃加热回流提取60min,过滤,收集滤液。滤渣再次加入8倍重量的100%(体积)乙醇,40℃加热回流60min提取,过滤。合并滤液,滤液在60℃下用旋蒸仪减压蒸发浓缩至2l。浓缩液加甲醇2l,用石油醚萃取2次,每次用量2l,收集下相,石油醚相回收溶剂后弃去,下相于60℃下旋蒸至2l,得提取液lhgxy01。
[0076]
2)高速逆流色谱分离
[0077]
2.1)量取乙酸丁酯600ml、丙酮200ml、纯水600ml、四氢呋喃0.1ml,配制得到混合
溶液,该混合溶液对xy8的分配系数为0.5,充分振摇后静置0.5h,上下两层完全分层澄清,分离上下层,得到上相溶液与下相溶液,分别超声脱气10min,备用;
[0078]
2.2)取浸膏lhgxy021.0g,取步骤2.1)的下相溶液15ml,溶解lhgxy02,溶液离心,取上清液备用;
[0079]
2.3)取步骤2.1)的上相溶液作固定相,泵入高速逆流色谱仪分离管,待固定相充满整个分离管后,调节主机为正转,至最大转速(900r/min),同时将步骤2.1)的下相溶液作流动相泵入,待流动相从柱口流出且固定相不流出,两相溶剂在分离管中达到动态平衡后,取步骤2.2)的上清液15ml,注入进样阀,流速2ml/min的条件下分离样品,313nm波长下检测,每15ml收集1个流分。所得流分经uplc-ms检测、合并后,也分段为与实施例1相同的6个部分ⅰ~ⅵ,区别在于各部分的含量与实施例1不同。用真空离心浓缩仪将第iv部分23-26流分旋干,以色谱醇甲醇溶解,uplc-ms检测。其中流分24~26呈黄色粉末状(lhgxy03,146.5mg),为分子量[m hcoo]-653.1739的化合物(即化合物xy8),经hplc检测,纯度为96.2%。
[0080]
实施例4
[0081]
新黄酮类化合物xy8的制备:
[0082]
1)获取罗汉果雄株叶片提取物
[0083]
称取罗汉果(siraitia grosvenorii(swingle)c.jeffrey)雄株叶片干叶1kg,粉碎,加入8倍重量的10%(体积)甲醇,常温回流提取60min,过滤,收集滤液。滤渣再次加入8倍重量的10%(体积)甲醇,常温回流60min提取,过滤。合并滤液,滤液在60℃下用旋蒸仪减压蒸发浓缩至2l。浓缩液加甲醇2l,用石油醚萃取2次,每次用量2l,收集下相,石油醚相回收溶剂后弃去,下相于60℃下旋蒸至2l,得提取液lhgxy01。
[0084]
2)提取物的初步纯化
[0085]
取提取液lhgxy01,上d101大孔吸附树脂柱上毕,依次用水、10%(体积)甲醇-水、50%(体积)甲醇-水、95%(体积)甲醇梯度洗脱。lc-ms分析表明50%(体积)甲醇洗脱部分含有新化合物xy8。将50%(体积)甲醇洗脱液合并,浓缩,减压蒸干得浸膏lhgxy02。
[0086]
3)高速逆流色谱分离
[0087]
3.1)量取异丁醇600ml、正己烷150ml、纯水600ml、三氯甲烷50ml及乙腈50ml,配制得到混合溶液,该混合溶液对xy8的分配系数为2.5,充分振摇后静置0.5h,上下两层完全分层澄清,分离上下层,得到上相溶液与下相溶液,分别超声脱气10min,备用;
[0088]
3.2)取浸膏lhgxy021.0g,取步骤3.1)的下相溶液15ml,溶解lhgxy02,溶液离心,取上清液备用;
[0089]
3.3)取步骤3.1)的上相溶液作固定相,泵入高速逆流色谱仪分离管,待固定相充满整个分离管后,调节主机为正转,至最大转速(900r/min),同时将步骤3.1)的下相溶液作流动相泵入,待流动相从柱口流出且固定相不流出,两相溶剂在分离管中达到动态平衡后,取步骤3.2)的上清液15ml,注入进样阀,流速2ml/min的条件下分离样品,313nm波长下检测,每7ml收集1个流分。所得流分经uplc-ms检测、合并后,也分段为与实施例1相同的6个部分ⅰ~ⅵ,区别在于各部分的含量与实施例1不同。用真空离心浓缩仪将第iv部分22-27流分旋干,以色谱醇甲醇溶解,uplc-ms检测。其中流分23~27呈黄色粉末状(lhgxy03,
120.7mg),为分子量[m hcoo]-653.1739的化合物(即化合物xy8),经hplc检测,纯度为95.2%。
[0090]
4)采用反相色谱柱层析对步骤3.3)得到的化合物xy8进一步提纯:将xy8化合物用甲醇溶解配制成浓度为10mg/ml的样品溶液,洗脱条件:zorbax sb-c18色谱柱(9.4mm
×
250mm,5μm),流动相系统为乙腈(a)-0.1%甲酸水(b),梯度洗脱程序(0~15min,23%~40%a;15~15.01min,40%~70%a;15.01~23min,70%a,23~23.01min,70~23%a,23.01~30min,23%a);柱温30℃;流速3.0ml
·
min-1
;进样量80μl,检测波长313nm。收集单峰洗脱液,检测所得纯化后的xy8化合物的纯度高达98.5%。
[0091]
实施例5
[0092]
以实施例4步骤4)纯化得到的新化合物xy8及罗汉果叶中分离的其他黄酮类化合物对蜜蜂引诱活性的测定。
[0093]
1.1实验材料
[0094]
供试昆虫:实验用中华蜜蜂(apis cerana cerana)取自广西桂林市资源县梅溪蜂场,实验前禁食0.5h。室内生物测定时随机选用工蜂。
[0095]
供试待测单体化合物:化合物1,xy8;化合物2,山奈酚-3,7-o-α-l-二鼠李糖苷;化合物3,山奈酚-3-o-α-l-鼠李糖苷;化合物4,山奈酚-3-o-α-l-鼠李糖-7-o-[β-d-葡萄糖基-(1-2)-α-l-鼠李糖苷];化合物5,槲皮素-3-o-β-d-葡萄糖-7-o-α-l-鼠李糖苷。化合物2-5为罗汉果叶中分离出的其他已知黄酮类化合物,所有化合物纯度均≥98.0%。以超纯水为溶剂,将每种化合物分别配成10-2
g/ml、10-4
g/ml、10-6
g/ml、10-8
g/ml 4个剂量。每次行为测定时,分别吸取供试化合物每个剂量的1ml溶液作为味源,以1ml超纯水作为ck。
[0096]
1.2y形嗅觉仪及测定程序
[0097]
y形管由无色透明玻璃制成,两臂与基部长度皆为15cm,内径为1.5cm,两臂夹角为120
°
。两臂分别连接味源瓶(或对照瓶)、加湿瓶、空气过滤瓶(内装满已活化的活性炭)和流量计,各部件之间以无味的teflon管连接。测定前分别吸取1ml味源于开口的安碚瓶,开口安碚瓶置于味源瓶中;再吸取1ml超纯水于开口安碚瓶中,置开口安碚瓶于对照瓶中。用气泵从y形管基部管口抽气,测定时调节每臂流量为120ml/min。测定前先抽气10min,使y形管味源臂中充满待测信息物质。测试时用试管将1头中华蜜蜂从y形管基部管口引入。蜜蜂进入之后,则逆风行进,或直线爬行,或螺旋式行进,在y形管交叉处做一个选择,进入y形管的一臂,爬行5cm记为选择该臂,超过5min无反应则不计数。
[0098]
5种味源的每个处理剂量分别测定20头中华蜜蜂,每头只用1次;每测试10头,用无水乙醇擦洗y形管内外壁,烘干,调换y形管两臂与味源瓶和对照瓶的连接位置,用于消除y形管可能的不对称而造成的影响。每个剂量的味源测定结束后,将y形管、味源瓶等玻璃部件用重铬酸钾洗液清洗,于100℃烘箱内烘干。活性炭在100℃烘4h以解除其吸附的异味分子。
[0099]
生物测定在暗室内执行,y形管上方1.5cm处有1盏15w白炽灯提供照明。每天生物测定时间从8:00至16:00,这期间该蜂比较活跃。室温25℃,相对湿度(70
±
3)%。
[0100]
1.3数据分析方法
[0101]
使用spss 22.0软件完成数据分析。对中华蜜蜂进行室内y形管嗅觉行为测定时,假设供试味源对于中华蜜蜂行为没有影响,则中华蜜蜂趋向味源和ck的概率均为50%,则
有假设测验h0=50:50,对于该蜂趋向味源和ck的数量差异作χ2测验,当p《0.05时,则差异达显著水平,当p《0.01时,则差异达极显著水平。
[0102]
实验结果如表2所示。
[0103]
表2 5种单体化合物与超纯水引诱中华蜜蜂数量的差异性
[0104][0105][0106]
注:n.s.不显著;*显著;**极显著
[0107]
由表2可知,5个单体化合物中,化合物1(xy8)在10-2
g/ml浓度下对中华蜜蜂引诱效应与ck(超纯水)之间差异达极显著水平(p《0.01),在10-4
g/ml、10-6
g/ml浓度下对中华蜜蜂引诱效应与ck(超纯水)之间差异达显著水平(p《0.05);而化合物2-5在本试验设定的浓度下对中华蜜蜂引诱效应与ck(超纯水)之间均无显著性差异。表明本发明的新化合物xy8对中华蜜蜂有较好的引诱活性。
[0108]
以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。