用于基因编辑的cas变体
相关申请
1.本技术是申请日为2014年12月12月,申请号:201480072550.2,发明名称为“用于基因编辑的cas变体”的中国发明专利申请的分案申请。本技术要求在35 u.s.c.
§
119(e)下于2013年12月12日提交的美国临时专利申请u.s.s.n.61/915,386和于2014年4月16日提交的美国临时专利申请u.s.s.n.61/980,333的优先权;并且也要求在35 u.s.c.
§
120下全部于2014年7月8日提交的美国专利申请u.s.s.n.14/325,815、14/326,109、14/326,140、14/326,269、14/326,290、14/326,318和14/326,303的优先权;将其每一个通过引用结合在此。政府支持
2.本发明是使用由国防高级研究计划局(darpa)授予的拨款hr0011-11-2-0003、由美国国立卫生研究院(nih)授予的拨款gm095501、以及由空间和海战系统中心(spawar)授予的拨款n66001-12-c-4207下的美国政府资助进行的。政府具有本发明中的某些权利。发明背景
3.核酸序列的靶向编辑,例如,引入特定的修饰到基因组dna,是基因功能研究的非常有前途的方法,并且还具有对人类遗传性疾病提供新疗法的潜力。1理想的核酸编辑技术拥有三大特点:(1)高效插入所需的修饰;(2)最小的脱靶活性;和(3)被编程为在给定的核酸的任何位点(例如人类基因组内的任何位点)精确编辑的能力。2当前基因组工程工具包括设计的锌指核酸酶(zfn),3转录激活因子如效应核酸酶(talen),4以及最近的rna指导的dna核酸内切酶cas9,5在基因组中的效应序列特异性dna切割。此可编程的切割可在切割位点通过非同源末端连接(nhej)导致dna突变或在切割位点周围通过同源定向修复(hdr)导致dna置换。
6,7
4.当前技术的一个缺点是nhej和hdr都是典型地导致适度的基因编辑效率以及可以与期望的改变竞争的不需要的基因改变的随机过程。8因为原则上许多遗传性疾病可以通过在基因组中的特定位置产生特定核苷酸变化来进行处理(例如,疾病相关基因的特定密码子中从c到t的改变),9开发可设计的方式以达到这样的精确基因编辑将代表为基于基因编辑的人类治疗提供了强大的新研究工具以及潜在的新方法。发明概述
5.成簇的规律间隔短回文重复序列(crispr)系统是最近发现的原核适应性免疫系统,
10
该原核适应性免疫系统已被修改以使强大和通用的基因组工程在各种生物体和细胞系中成为可能。
11
crispr-cas(crispr相关)系统是蛋白rna复合体,该复合体使用rna分子(sgrna)为指导将该复合体通过碱基配对定位于靶dna序列。
12
在自然系统中,cas蛋白然后充当核酸内切酶切割靶dna序列。
13
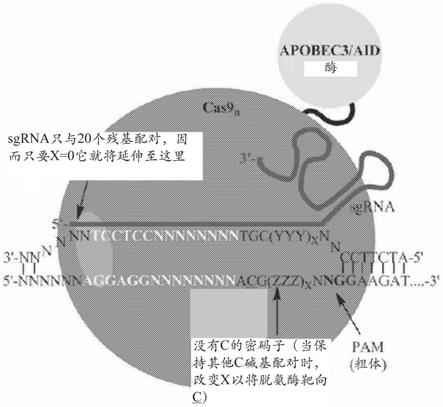
靶dna序列必须与sgrna互补,并且还包含“前间区序列邻近基序(protospacer-adjacent motif,pam)”二核苷酸在互补区的3'端以使系统起作用(图1)。
14
在已知的cas蛋白中,酿脓链球菌(s.pyogenes))cas9已被最广泛地用作基因组工程的工具。
15
此cas9蛋白是含有两个不同核酸结构域的大的多结构域蛋白。可以在cas9中引入点突变以废止核酸酶活性,产生仍然保留其以sgrna编程的方式结合dna的能力的死亡cas9(dcas9)。
16
原则上,当与另一个蛋白或结构域融合,dcas9可以简单地通过与合适的
sgrna共表达将该蛋白靶向几乎任何dna序列。
6.dcas9复合体用于基因组工程的目的的潜力是巨大的。理论上将蛋白引入被sgrna编程的基因组的特异位点的独特的能力被发展成超越核酸酶的各种位点特异的基因组工程工具,包括转录激活因子、转录抑制因子、组蛋白修饰蛋白、整合酶和重组酶。
11
最近已经通过dcas9与转录激活因子融合来实施这些潜在应用的一些以提供rna指导的转录激活因子、
17,18
转录抑制因子、
16,19,20
以及染色质修饰酶。
21
这些与各种sgrna融合的简单的共表达导致靶向基因的特异表达。这些开创性的研究为用于基因组的精准操控的可易编程序列特异性效应子的设计和建造铺平了道路。
7.很大意义上,对人类疾病负责的80%-90%的蛋白突变起源于仅仅单个核苷酸的置换、缺失或插入。6然而,还没有开发出使以整体和直接的方式进行单核苷酸操控成为可能的基因组工程工具。目前针对单碱基基因修正的策略包括工程化的核酸酶(其依赖于创建双链断裂(dsb),接着是随机低效的同源性定向修复(hdr))、以及dna-rna嵌合寡核苷酸。
22
较晚的策略涉及设计rna/dna序列从而与除了待编辑核苷酸外的基因组dna碱基配对。通过细胞的内源修复系统识别和修理产生的错配,导致嵌合或基因组的序列的改变。这些策略都遭受了低基因编辑效率和不需要的基因改变的问题,因为它们受hdr随机性和hdr与非同源末端连接(nhej)之间竞争的支配。
23-25
hdr效率根据靶基因在基因组中的位置、
26
细胞周期的状态、
27
和细胞/组织的类型不同。
28
因此,开发直接的可编程的方式以类酶的效率和非随机的方式安置碱基修饰特异的类型在基因组dna的精确位置将代表为基于基因编辑的研究工具和人类治疗提供功能强大的新方法。
8.本披露的一些方面提供对核酸的靶向编辑有用的策略、系统、试剂、方法和试剂盒,该靶向编辑包括在受试者的基因组(例如人类基因组)中编辑单个位点。在一些实施例中,提供了cas9和核酸编辑酶或酶结构域(例如脱氨酶结构域)的融合蛋白。在一些实施例中,提供了用于靶向核酸编辑的方法。在一些实施例中,提供了产生靶向核酸编辑蛋白(例如cas9和核酸编辑酶或结构域的融合蛋白)的试剂和试剂盒。
9.本披露的一些方面提供包括以下项的融合蛋白:(i)核酸酶非活性的cas9结构域;和(ii)核酸编辑结构域。在一些实施例中,核酸编辑结构域是dna编辑结构域。在一些实施例中,核酸编辑结构域是脱氨酶结构域。在一些实施例中,脱氨酶是胞苷脱氨酶。在一些实施例中,脱氨酶是载脂蛋白b mrna编辑复合体(apobec)家族脱氨酶。在一些实施例中,脱氨酶是apobec1家族脱氨酶。在一些实施例中,脱氨酶是激活诱导的胞苷脱氨酶(aid)。在一些实施例中,脱氨酶是acf1/ase脱氨酶。在一些实施例中,脱氨酶是腺苷脱氨酶。在一些实施例中,脱氨酶是adat家族脱氨酶。在一些实施例中,核酸编辑结构域被融合至cas9结构域的n末端。在一些实施例中,核酸编辑结构域被融合至cas9结构域的c末端。在一些实施例中,cas9结构域与核酸编辑结构域是通过连接体融合的。在一些实施例中,该连接体包含(ggggs)n(seq id no:91)、(g)n、(eaaak)n(seq id no:5)、(ggs)n、sgsetpgtsesatpes(seq id no:93)基序(参见,例如,古灵儿jp(guilinger jp)、汤普森
·
db(thompson db)、刘
·
dr(liu dr)。融合无催化活性的cas9至foki核酸酶改善基因组修饰的特异性(fusion of catalytically inactive cas9 to foki nuclease improves the specificity of genome modification),自然生物技术(nat.biotechnol.)2014;32(6):577-82;将其全部内容通过引用结合在此),或(xp)n基序,或任意这些的组合,其中n独立地是1至30之间的整
数。
10.本披露的一些方面提供用于dna编辑的方法。在一些实施例中,该方法包括使dna分子与以下项接触:(a)包含核酸酶非活性的cas9结构域和脱氨酶结构域的融合蛋白;以及(b)将(a)的融合蛋白靶向dna链的靶核苷酸序列的sgrna;其中所述dna分子与处于有效量的和在适合于核苷酸碱基的脱氨基作用的条件下的所述融合蛋白和所述sgrna接触。在一些实施例中,靶dna序列包括与疾病或失调相关的序列,并且其中核苷酸碱基的脱氨基作用产生与疾病或失调无关的序列。在一些实施例中,该dna序列包括与疾病或失调相关的t》c或a》g点突变,并且其中该突变的c或g碱基的脱氨基作用产生与疾病或失调无关的序列。在一些实施例中,脱氨基作用改正了与疾病或失调相关的序列中的点突变。在一些实施例中,所述与疾病或失调相关的序列编码蛋白,并且其中脱氨基作用在与疾病或失调相关的序列中引入终止密码子,导致编码蛋白的截短。在一些实施例中,脱氨基作用改正了pi3kca基因的点突变,从而修正了h1047r和/或a3140g突变。在一些实施例中,该接触是在倾向于具有、具有或被诊断出具有疾病或失调的受试者的体内进行。在一些实施例中,该疾病或失调是基因组中与点突变或单个碱基突变相关的疾病。在一些实施例中,该疾病是遗传性疾病、癌症、代谢性疾病或溶酶体贮积病。
11.本披露的一些方面提供用于检测cas9:dna编辑结构域融合蛋白的核酸编辑活性的报告构建体。在一些实施例中,该构建体包括(a)包含用于cas9 dna编辑蛋白的靶位点的报告基因,其中靶向的dna编辑导致报告基因表达的增加;以及(b)控制报告基因表达的启动子序列。在一些实施例中,该构建体进一步包括(c)编码将cas9 dna编辑蛋白靶向报告基因的靶位点的sgrna的序列,其中sgrna表达与报告基因的表达是独立的。在一些实施例中,报告基因的靶位点包括未成熟的终止密码子,并且其中通过cas9 dna编辑蛋白对靶向的dna的模板链的编辑导致未成熟的终止密码子转变为编码氨基酸残基的密码子。在一些实施例中,该报告基因编码荧光素酶、荧光蛋白或抗生素抗性标记。
12.本披露的一些方面提供试剂盒,该试剂盒包括:核酸构建体,该构建体包含编码核酸酶非活性的cas9序列的序列,包括克隆位点的序列,该克隆位点被定位于允许编码与cas9编码序列同框的核酸编辑酶或酶结构域的序列的克隆,以及任选地编码连接体的序列,该连接体被定位于cas9编码序列和克隆位点之间的。另外,在一些实施例中,试剂盒包含合适的试剂、缓冲液、和/或说明书用于将编码核酸编辑酶或酶结构域框架克隆进入核酸构建体以产生cas9核酸编码融合蛋白。在一些实施例中,所述包括克隆位点的序列是cas9序列的n末端。在一些实施例中,所述包括克隆位点的序列是cas9序列的c末端。在一些实施例中,所述编码的连接体包含(ggggs)n(seq id no:91)、(g)n、(eaaak)n(seq id no:5)、(ggs)n、sgsetpgtsesatpes(seq id no:93)基序(参见,例如,古灵儿jp(guilinger jp)、汤普森
·
db(thompson db)、刘
·
dr(liu dr),融合无催化活性的cas9至foki核酸酶改善基因组修饰的特异性(fusion of catalytically inactive cas9 to foki nuclease improves the specificity of genome modification),自然生物技术(nat.biotechnol.)2014;32(6):577-82;将其全部内容通过引用结合在此),或(xp)n基序,或任意这些的组合,其中n独立地是1至30之间的整数。
13.本披露的一些方面提供包括以下项的试剂盒,包含核酸酶非活性的cas9结构域和核酸编辑酶或酶结构域的融合蛋白以及任选地,定位于cas9结构域和核酸编辑酶或酶结构
域之间的连接体。另外,在一些实施例中,该试剂盒包括合适的试剂、缓冲液和/或说明书,用于使用融合蛋白(例如,用于体外或体内dna或rna编辑)。在一些实施例中,该试剂盒包括关于用于核酸序列的靶向编辑的合适的sgrna的设计和使用的说明书。
14.以上概述以非限制性的方式意欲说明本文披露的技术的一些实施例、优势、特征、和用途。本文披露的技术的其他实施例、优势、特征、和用途将由于详细说明、附图、实例和权利要求书而是显而易见的。附图简要说明
15.图1.cas9/sgrna-dna复合体。sgrna的3’端与cas9核酸酶形成核糖核蛋白,而sgrna的20nt 5’端识别其互补的dna片段。dna结合要求3-nt的pam序列5'与靶dna结合。在wtcas9的情况下,双链dna切割发生在距pam 3nt处以产生平端(由箭头示出)。应当注意的是,泡的大小是未知的。
16.图2.apobec3g(pdb id 3e1u)的催化结构域的晶体结构。被认为在整个家族中是保守的核心二级结构由两侧为六个α螺旋的五链β片层(箭头)组成。活性中心环(活性位点环)被认为是负责确定脱氨基特异性。负责催化活性的zn
2
被显示为球体。这些序列从上到下对应于seq id no:97-98。
17.图3.基于荧光素酶报告分析的设计。sgrna将发生改变以靶向众多序列从而靶向突变的起始密码子(以下划线标出的c残基),这些序列对应于荧光素酶基因之前和包括荧光素酶基因的区域。将在起始密码子和荧光素酶基因之间加入“缓冲”区域以包括只有a和t(显示为(zzz)
x
)的密码子。指示了夏因-达尔加诺(shine-dalgarno)序列。在一些实施例中,优选是保留所有c的配对碱基对以防止脱靶效应。
18.图4.脱氨酶试验。这些序列从上到下对应于seq id no:99-105。
19.图5.通过cas9-apobec1融合蛋白编辑的ssdna的sds page凝胶。定义
20.如在本文和权利要求中使用的单数形式“一个/种(a、an)”和“所述/该(the)”包括单数和复数指代物,除非上下文明确地指示其他的情况。因此,例如“药剂”的提及包括单一的药剂和多种这样的药剂。
21.术语“cas9”或“cas9核酸酶”是指包括cas9蛋白或其片段(例如包含cas9的活性或非活性dna切割结构域和/或cas9的grna结合结构域的蛋白)的rna指导的核酸酶。cas9核酸酶有时也指casn1核酸酶或crispr(成簇的规律间隔短回文重复序列)相关核酸酶。crispr是对可移动遗传元素(病毒、转位因子和接合质粒)提供保护的适应性免疫系统。crispr簇包含间隔物、与先行可移动元素互补的序列和靶标侵入核酸。crispr簇转录并被加工成crispr rna(crrna)。在ii型crispr系统中正确加工前crrna要求反式编码的小rna(tracrrna)、内源核糖核酸酶3(rnc)和cas9蛋白。tracrrna用作前crrna的核糖核酸酶3辅助加工的指导。随后,cas9/crrna/tracrrna核酸内切地切割与间隔物互补的线状或环状双链dna靶标。与crrna不互补的靶链首先被核酸内切地切割,然后进行3
’‑5’
核酸外切地修剪。在自然界,dna结合与切割典型地需要蛋白和两种rna。然而,可以设计单指导的rna(“sgrna”或简单地称为“gnra”)以便于将crrna和tracrrna两者的方面并入单rna种类。参见,例如,季聂克
·
m.(jinek m.)、吉林斯基
·
k.(chylinski k.)、方法拉
·
i.(fonfara i.)、豪尔
·
m.(hauer m.)、杜德纳
·
j.a.(doudna j.a.)、卡彭特
·
e.(charpentier e.),
科学(science)337:816-821(2012),将其全部内容通过引用结合在此。cas9识别crispr重复序列的短基序(pam或前间区序列邻近基序)以帮助区分自我与非自我。cas9核酸酶序列和结构是本领域技术人员已熟知的(参见,例如,“酿脓链球菌的m1株全基因组序列(complete genome sequence of an m1 strain of streptococcus pyogenes)”,法拉帝
·
j.j.(ferretti j.j.)、马克山w.m.(mcshan w.m.)、阿杰迪克d.j.(ajdic d.j.)、萨维奇
·
d.j.(savic d.j.)、萨维奇
·
g.(savic g.)、里昂
·
k.(lyon k.)、普里莫斯c(primeaux c)、索扎特s(sezate s.)、苏沃洛夫
·
a.n.(suvorov a.n.)、肯顿
·
s.(kenton s.)、赖
·
h.s.(lai h.s.)、林
·
s.p.(lin s.p.)、钱
·
y.(qian y.)、贾
·
h.g.(jia h.g.)、纳加尔
·
f.z.(najar f.z.)、任
·
q.(ren q.)、朱
·
h.(zhu h.)、宋
·
l.(song l.)、怀特
·
j.(white j.)、袁
·
x.(yuan x.)、克利夫顿
·
s.w.(clifton s.w.)、罗伊
·
b.a.(roe b.a.)、麦克劳克林
·
r.e.(mclaughlin r.e.),美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)98:4658-4663(2001);“通过反式编码的小rna和宿主因子rna酶iii进行的crispr rna成熟(crispr rna maturation by trans-encoded small rna and host factor rnase iii)”,德特车维e.(deltcheva e.)、吉林斯基
·
k.(chylinski k.)、夏尔马
·
c.m.(sharma c.m.)、冈萨雷斯
·
k.(gonzales k.)、超
·
y.(chao y.)、皮尔扎达
·
z.a.(pirzada z.a.)、埃克特
·
m.r.(eckert m.r.)、沃格尔
·
j.(vogel j.)、卡彭特
·
e.(charpentier e.),自然(nature)471:602-607(2011);以及“适应性细菌免疫中可编程的双rna指导的dna内源核酸酶(a programmable dual-rna-guided dna endonuclease in adaptive bacterial immunity)”,季聂克
·
m.(jinek m.)、吉林斯基
·
k.(chylinski k.)、方法拉
·
i.(fonfara i.)、豪尔
·
m.(hauer m.)、杜德纳
·
j.a.(doudna j.a.)、卡彭特
·
e.(charpentier e.),科学(science)337:816-821(2012),将其每一个的全部内容通过引用结合在此。cas9直系同源已在各种物种中描述,包括但不限于酿脓链球菌(s.pyogenes)和嗜热链球菌(s.thermophilus)。基于本披露另外的合适的cas9核酸酶和序列对本领域的普通技术人员而言将是显而易见的,并且这样的cas9核酸酶和序列包括来自生物有机体的cas9序列和披露在以下文献中的位点:吉林斯基(chylinski)、卢恩(rhun)和卡彭特(charpentier),“ii型crispr-cas免疫系统的tracrrna和cas9家族(the tracrrna and cas9 families of type ii crispr-cas immunity systems)”(2013)rna生物学(rna biology)10:5,726-737;将其全部内容通过引用结合在此。在一些实施例中,cas9核酸酶具有非活性的(例如非激活的)dna切割结构域。
22.核酸酶非激活的cas9蛋白能够可互换地被称为“dcas9”蛋白(针对核酸酶“死亡”cas9)。产生具有非活性dna切割结构域的cas9蛋白(或其片段)的方法是已知的(参见,例如,季聂克(jinek)等人,科学(science),337:816-821(2012);齐(qi)等人,“将crispr再利用为rna指导的平台以用于基因表达的序列特异性控制(repurposing crispr as an rna-guided platform for sequence-specific control of gene expression)”(2013),细胞(cell),28;152(5):1173-83,将其每一个的全部内容通过引用结合在此)。例如,cas9的dna切割结构域已知包括两个亚结构域:hnh核酸酶亚结构域和ruvc1亚结构域。hnh亚结构域切割与grna互补的链,而ruvc1亚结构域切割非互补的链。在这些亚结构域中的突变可以使cas9的核酸酶活性沉默。例如突变d10a和h841a完全使酿脓链球菌cas9的核酸酶失去活性(季聂克(jinek)等人,科学(science),337:816-821(2012);齐(qi)等人,细胞(cell),28;
152(5):1173-83(2013)。在一些实施例中,提供了包含cas9片段的蛋白。例如,在一些实施例中,蛋白包含如下两个cas9结构域中的一个:(1)cas9的grna结合结构域;或(2)cas9的dna切割结构域。在一些实施例中,包含cas9或其片段的蛋白被称为“cas9变体”。cas9变体与cas9或其片段享有同源性。例如,cas9变体与野生型cas9有至少约70%一致性,至少约80%一致性,至少约90%一致性,至少约95%一致性,至少约96%一致性,至少约97%一致性,至少约98%一致性,至少约99%一致性,至少约99.5%一致性,或至少约99.9%一致性。在一些实施例中,cas9变体包含cas9的片段(例如grna结合结构域或dna切割结构域),以至于该片段与野生型cas9的相应片段有至少约70%一致性,至少约80%一致性,至少约90%一致性,至少约95%一致性,至少约96%一致性,至少约97%一致性,至少约98%一致性,至少约99%一致性,至少约99.5%一致性,或至少约99.9%一致性。在一些实施例中,野生型cas9对应于来自酿脓链球菌的cas9(ncbi参考序列:nc_017053.1,seq id no:1(核苷酸);seq id no:2(氨基酸))。
(单下划线:hnh结构域;双下划线:ruvc结构域)
23.在一些实施例中,野生型cas9对应于或包含seq id no:3(核苷酸)和/或seq id no:4(氨基酸):
(单下划线:hnh结构域;双下划线:ruvc结构域)
24.在一些实施例中,dcas9对应于或包含部分或全部cas9氨基酸序列,该氨基酸序列具有使cas9核酸酶失去活性的一个或多个突变。例如,在一些实施例中,dcas9结构域包含d10a和/或h820a突变。dcas9(d10a和h840a):
(单下划线:hnh结构域;双下划线:ruvc结构域)
25.在其他实施例中,提供了具有除d10a和h820a外的突变的dcas9变体,其(例如)产生核酸酶非激活的cas9(dcas9)。通过实例的方式,这样的突变包括其他在d10和h820处的氨基酸置换或其他在cas9核酸酶结构域内的置换(例如,在hnh核酸酶亚结构域和/或ruvc1亚结构域中的置换)。在一些实施例中,提供了dcas9的变体或同系物(例如,seq id no:34的变体),这些变体或同系物与seq id no:34有至少约70%一致性,至少约80%一致性,至少约90%一致性,至少约95%一致性,至少约98%一致性,至少约99%一致性,至少约99.5%一致性,或至少约99.9%一致性。在一些实施例中,提供了dcas9的变体(例如,seq id no:34的变体),这些变体具有的氨基酸序列短于或长于seq id no:34大约5个氨基酸,大约10个氨基酸,大约15个氨基酸,大约20个氨基酸,大约25个氨基酸,大约30个氨基酸,大约40个氨基酸,大约50个氨基酸,大约75个氨基酸,大约100个氨基酸或更多。
26.在一些实施例中,如本文提供的cas9融合蛋白包括cas9蛋白的全长氨基酸,例如以上提供的序列中的一个。然而,在其他实施例中,如本文提供的融合蛋白不包括全长cas9序列,而仅仅是其片段。例如,在一些实施例中,本文提供的cas9融合蛋白包括cas9片段,其中该片段结合crrna和tracrrna或sgrna,但是不包括功能性核酸酶结构域,例如,因为它仅仅包括核酸酶结构域的截短版本或根本没有核酸酶结构域。文本提供了适合的cas9结构域和cas9片段的示例性氨基酸序列,并且另外的适合的cas9结构域和片段序列对本领域的普通技术人员而言将是显而易见的。
27.在一些实施例中,cas9是指来自以下物种的cas9:溃疡棒状杆菌(corynebacterium ulcerans)(ncbi参考序列:nc_015683.1、nc_017317.1);白喉棒状杆菌(corynebacterium diphtheria)(ncbi参考序列:nc_016782.1、nc_016786.1);spiroplasma syrphidicola(ncbi参考序列:nc_021284.1);中间普氏菌(prevotella intermedia)(ncbi参考序列:nc_017861.1);台湾螺原体(spiroplasma taiwanense)(ncbi参考序列:nc_021846.1);海豚链球菌(streptococcus iniae)(ncbi参考序列:nc_021314.1);belliella baltica(ncbi参考序列:nc_018010.1);psychroflexus torquisi(ncbi参考序列:nc_018721.1);嗜热链球菌(streptococcus thermophilus)(ncbi参考序列:yp_820832.1);无害利斯特菌(listeria innocua)(ncbi参考序列:np_472073.1);空肠弯曲杆菌(campylobacter jejuni)(ncbi参考序列:yp_002344900.1);或脑膜炎奈瑟氏菌(neisseria meningitidis)(ncbi参考序列:yp_002342100.1)。
28.术语“脱氨酶”是指催化脱氨基反应的酶。在一些实施例中,该脱氨酶是胞苷脱氨酶,催化胞苷或脱氧胞苷分别水解脱氨基为尿嘧啶或脱氧尿嘧啶。
29.如本文使用的术语“有效量”是指足够引起期望的生物反应的生物活性剂的量。例
如,在一些实施例中,核酸酶的有效量可以是指足够引起被核酸酶特异性地结合和切割的靶位点的切割的核酸酶的量。在一些实施例中,本文提供的融合蛋白的有效量,例如包含核酸酶非活性cas9结构域和核酸编辑结构域(如脱氨酶结构域)的融合蛋白的有效量,可以是指足够引起被融合蛋白特异性地结合和编辑的靶位点的编辑的融合蛋白的量。如将被熟练的技术人员理解的,有效量的药剂,例如,融合蛋白、核酸酶、脱氨酶、重组酶、杂合蛋白、蛋白二聚体、蛋白(或蛋白二聚体)和多核苷酸的复合体、或多核苷酸,可根据各种因素不同,例如这些因素是,例如,对特定的待编辑的等位基因、基因组或靶位点,对靶向的细胞或组织,以及对所使用的试剂所期望的生物反应。
30.如本文使用的术语“连接体”是指化学基团或分子,连接两个分子或部分,例如融合蛋白的两个结构域,如核酸酶非活性cas9结构域和核酸编辑结构域(如脱氨酶结构域)。在一些实施例中,连接体连接rna可编程的核酸酶的grna结合结构域,包括cas9核酸酶结构域和核酸编辑蛋白催化结构域。在一些实施例中,连接体连接dcas9和核酸编辑蛋白。典型地,连接体位于两个基团、分子或其他部分之间或两侧是两个基团、分子或其他部分,并且通过共价键连接每一个,从而连接两者。在一些实施例中,连接体是一个氨基酸或多个氨基酸(如肽或蛋白)。在一些实施例中,连接体是有机分子、基团、聚合物或化学部分。在一些实施例中,连接体是5-100个长度的氨基酸,例如5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、30-35个、35-40个、40-45个、45-50个、50-60个、60-70个、70-80个、80-90个、90-100个、100-150个、或150-200个长度的氨基酸。还考虑了较长或较短的连接体。
31.如本文使用的术语“突变”是指序列内残基的置换,例如核酸或氨基酸序列与其他的残基,或序列内一个或多个残基的缺失或插入。典型地本文通过识别原始残基随后是该残基在序列内的位置并且随后是新替换的残基的身份来描述突变。本文提供的进行氨基酸置换(突变)的多种方法是本领域熟知的,并且通过,例如,如下文献提供:格林(green)和萨姆布鲁克(sambrook),分子克隆实验指南(molecular cloning:a laboratory manual)(第四版,纽约冷泉港冷泉港实验室出版社(cold spring harbor laboratory press,cold spring harbor,n.y.)(2012))中。
32.如本文使用的术语“核酸”和“核酸分子”是指包括核碱基和酸性部分(例如核苷、核苷酸、或核苷酸的聚合物)的化合物。典型地,聚合核酸(例如包括三个或更多个核苷酸的核酸分子)是线性分子,其中相邻的核苷酸是通过磷酸二酯键彼此连接。在一些实施例中,“核酸”是指单个核酸残基(例如核苷酸和/或核苷)。在一些实施例中,“核酸”是指包含三个或更多个单独的核苷酸残基的寡核苷酸链。如本文使用的术语“寡核苷酸”和“多核苷酸”可以互换使用,指核苷酸的聚合物(例如,一串至少三个核苷酸)。在一些实施例中,“核酸”包含rna以及单和/或双链dna。核酸可以是天然地发生的,例如,在基因组、转录物、mrna、trna、rrna、sirna、snrna、质粒、粘粒、染色体、染色单体、或其他天然存在的核酸分子的背景下。另一方面,核酸分子可以是非天然存在的分子,例如,重组dna或rna、人工染色体、工程化的基因组或其片段、或合成的dna、rna、dna/rna杂合体、或包括非天然存在的核苷酸或核苷。此外,术语“核酸”、“dna”、“rna”和/或类似术语包括核酸类似物,例如,具有除磷酸二酯骨架外的类似物。核酸可以从天然来源中纯化,使用重组表达系统产生并任选地纯化,化学合成等。在适当的地方,例如,在化学合成分子的情况下,核酸可包含核苷类似物,例如具
有经化学修饰的碱基或糖和主链修饰的类似物。除非另行说明,核酸序列是以5’至3’方向存在的。在一些实施例中,核酸是或包括天然的核苷(例如腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷);核苷类似物(例如,2-氨基腺苷、2-硫代胸苷、肌苷、吡咯并嘧啶、3-甲基腺苷、5-甲基胞苷、2-氨基腺苷、c5-溴尿苷、c5-氟尿苷、c5-碘尿苷、c5-丙炔基-尿苷、c5-丙炔基-胞苷,c5-甲基胞苷、2-氨基腺苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、o(6)-甲基鸟嘌呤和2-硫代胞苷);化学修饰的碱基;生物修饰的碱基(例如,甲基化的碱基);嵌入碱基;改性糖(例如,2'-氟代核糖、核糖、2'-脱氧核糖、阿拉伯糖、和己糖);和/或经修饰的磷酸基团(例如,硫代磷酸酯和5'-n-二亚磷酰胺键)。
33.如本文使用的术语“增殖性疾病”是指其中由于细胞或细胞群表现出异常升高的增殖率使细胞或组织的平衡受到干扰的任何疾病。增殖性疾病包括过度增生性疾病,如肿瘤前期增生病状和肿瘤性疾病。肿瘤性疾病的特征在于细胞的异常增殖并包括良性和恶性肿瘤。恶性肿瘤也被称为癌症。
34.术语“蛋白”、“肽”以及“多肽”在此可互换地使用,并且是指被肽(酰胺)键连接在一起的氨基酸残基的聚合物。该术语是指具有任何大小、结构或功能的蛋白、肽或多肽。典型地,蛋白、肽或多肽应是至少三个氨基酸长。蛋白、肽或多肽可以是指单个蛋白或蛋白的聚集体。蛋白、肽或多肽中的一个或多个氨基酸可以被修饰,例如,通过化学实体(如碳水化合物基团、羟基、磷酸盐基团、法呢基、异法呢基、脂肪酸基团、用于共轭、功能化或其他修饰的连接物,等等)的加成。蛋白、肽或多肽也可以是单个分子或可以是多分子复合体。蛋白、肽或多肽可以是天然存在的蛋白或肽的片段。蛋白、肽或多肽可以是天然存在的、重组的、或合成的或这些的任意组合。本文使用的术语“融合蛋白”是指包括来自至少两个不同蛋白的蛋白结构域的杂合多肽。一个蛋白可以位于融合蛋白的氨基末端(n末端)部分或位于羧基末端(c末端)部分,从而分别形成“氨基末端融合蛋白”或“羧基末端融合蛋白”。蛋白可以包括不同的结构域,例如,核酸结合结构域(如指导蛋白连接到靶位点的cas9的grna结合结构域)和核酸切割结构域或核酸编辑蛋白的催化结构域。在一些实施例中,蛋白包括蛋白的部分(例如氨基酸序列构成核酸结合结构域)和有机的化合物(例如可以用作核酸切割剂的化合物)。在一些实施例中,蛋白与核酸如rna处于复合体形式,或与核酸如rna相联合。本文提供的任何蛋白可以通过本领域已知的任何方法产生。例如,本文提供的蛋白可以通过重组蛋白表达和纯化产生,其尤其适合包含肽连接体的融合蛋白。重组蛋白表达和纯化的方法是熟知的,并且包括被描述在如下文献中的那些:格林(green)和萨姆布鲁克(sambrook),分子克隆实验指南(molecular cloning:a laboratory manual)(第四版,纽约冷泉港冷泉港实验室出版社(cold spring harbor laboratory press,cold spring harbor,n.y.)(2012),将该文献的全部内容通过引用方式结合在此。
35.术语“rna可编程的核酸酶”和“rna指导的核酸酶”在此可互换地使用,并且是指与不是切割靶标的一种或多种rna形成(例如结合或联合)复合体的核酸酶。在一些实施例中,rna可编程的核酸酶当与rna形成复合体时,可以被称为核酸酶:rna复合体。典型地,一个或多个结合的rna被称为指导rna(grna)。grna可以作为两个或更多rna的复合体或作为单个rna分子存在。作为单个rna分子存在的grna可以被称为单指导rna(sgrna),但是“grna”是可互换地使用的,是指指导作为单个分子或作为两个或更多分子的复合体存在的rna。典型地,作为单rna种类存在的grna包括两个结构域:(1)与靶核酸享有同源性的结构域(例如以
cas9),科学(science)339,823-826(2013);黄
·
w.y.(hwang,w.y.)等人,在斑马鱼中使用crispr-cas系统进行的有效基因组编辑(efficient genome editing in zebrafish using a crispr-cas system),自然生物技术(nature biotech)31,227-229(2013);季聂克
·
m.(jinek m.)等人,人类细胞中的rna编程的基因组编辑(rna-programmed genome editing in human cells),elife 2,e00471(2013);迪卡洛
·
j.e.(dicarlo,j.e.)等人,利用crispr-cas系统在酿酒酵母中进行基因组编辑(genome engineering in saccharomyces cerevisiae using crispr-cas systems),核酸研究(nucleic acids research)(2013);蒋
·
w.(jiang,w.)等人,利用crispr-cas系统进行的细菌基因组的rna指导的编辑(rna-guided editing of bacterial genomes using crispr-cas systems),自然生物技术(nature biotechnology)31:233-239(2013),将这些文献每一个的全部内容通过引用结合在此)。
37.如本文使用的术语“受试者”是指单个生物有机体,例如,单个哺乳动物。在一些实施例中,该受试者是人类。在一些实施例中,该受试者是非人类哺乳动物。在一些实施例中,该受试者是非人类灵长类动物。在一些实施例中,该受试者是啮齿类动物。在一些实施例中,该受试者是绵羊、山羊、牛、猫、或狗。在一些实施例中,该受试者是脊椎动物、两栖动物、爬行动物、鱼类、昆虫、苍蝇或线虫。在一些实施例中,该受试者是研究动物。在一些实施例中,该受试者是基因工程化的,例如,基因工程化的非人类受试者。该受试者可以是雄性的或雌性的并且可以处于任何发育阶段。
38.术语“靶位点”是指核酸分子内的序列,该序列被脱氨酶或包含脱氨酶的融合蛋白(例如,本文提供的dcas9脱氨酶融合蛋白)脱去氨基。
39.如本文所述,术语“治疗(treatment、treat和treating)”是指旨在逆转、缓解、延迟疾病或失调或其一种或多种症状的发作,或抑制疾病或失调或其一种或多种症状的进展的临床干预。如本文所述,本文使用的术语“治疗(treatment、treat和treating)”是指旨在逆转、缓解、延迟疾病或失调或其一种或多种症状的发作,或抑制疾病或失调或其一种或多种症状的进展的临床干预。在一些实施例中,治疗可以在已经发展出一种或多种症状和/或已经诊断出疾病后给予。在其他实施例中,可以在没有症状时给予治疗,例如,以防止或延迟症状的发作或抑制疾病的发作或进展。例如,先于症状的发作(例如,根据症状历史和/或根据遗传或其他易感因素)向易感个体给予治疗。症状已经解决后也可以继续治疗,例如,以防止或延迟它们复发。本发明的某些实施例的详细说明
40.本披露的一些方面提供包含结合至指导rna(也被称为grna或sgrna)的cas9结构域的融合蛋白,该指导rna反过来通过链杂合结合靶核酸序列;以及可以使核碱基(例如胞苷)脱去氨基的dna编辑结构域(例如脱氨酶结构域)。通过脱氨酶使核碱基脱去氨基可以在各自的残基上导致点突变,其在此被称为核酸编辑。因此包含cas9变体或结构域和dna编辑结构域的融合蛋白可以被用于核酸序列的靶向编辑。这样的融合蛋白对于例如,用于突变的细胞或动物的产生的dna的体外靶向编辑;对于例如,细胞(如随后被重新引入相同或另一个受试者的、从受试者获得的细胞)中体外修正遗传缺陷的靶向突变的引入;以及对于例如,在受试者疾病相关基因中修正遗传缺陷或引入失活突变的靶向突变的引入是有用的。典型地,本文描述的融合蛋白的cas9结构域不具有任何核酸酶活性但是它是cas9片段或
dcas9蛋白或结构域。还提供了如本文描述的cas9融合蛋白的使用的方法。
41.在此提供了非限制性的、示例性的核酸酶非活性cas9结构域。一个示例性的、适合的核酸酶非活性cas9结构域是d10a/h840a cas9结构域突变体:cas9结构域突变体:(seq id no:37;参见,例如,齐(qi)等人,将crispr再利用为rna指导的平台以用于基因表达的序列特异性控制(repurposing crispr as an rna-guided platform for sequence-specific control of gene expression)细胞(cell),2013;152(5):1173-83,将其全部内容通过引用结合在此)。
42.基于本披露,另外的适合的核酸酶非活性cas9结构域对本领域的普通技术人员而言将是显而易见的。此类另外示例的适合的核酸酶非活性cas9结构域包括但不限于d10a、d10a/d839a/h840a、和d10a/d839a/h840a/n863a突变的结构域(参见,例如,普拉桑特(prashant)等人,用于靶标特异性筛选的cas9转录激活因子与用于合作基因组工程化的配对切口酶(cas9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering),自然生物技术(nature biotechnology),2013;31(9):833-838,将其全部内容通过引用结合在此)。cas9和核酸编辑酶或结构域之间的融合蛋白
43.本披露的一些方面提供包括以下项的融合蛋白:(i)核酸酶非活性的cas9酶或结构域;和(ii)核酸编辑酶或结构域。在一些实施例中,核酸编辑酶或结构域是dna编辑酶或结构域。在一些实施例中,核酸编辑酶拥有脱氨酶活性。在一些实施例中,核酸编辑酶或结构域包含或是脱氨酶结构域。在一些实施例中,脱氨酶是胞苷脱氨酶。在一些实施例中,脱氨酶是载脂蛋白b mrna编辑复合体(apobec)家族脱氨酶。在一些实施例中,脱氨酶是apobec1家族脱氨酶。在一些实施例中,脱氨酶是激活诱导的胞苷脱氨酶(aid)。在一些实施例中,脱氨酶是acf1/ase脱氨酶。在一些实施例中,脱氨酶是腺苷脱氨酶。在一些实施例中,脱氨酶是adat家族脱氨酶。本文详细描述了一些核酸编辑酶和结构域以及包括这样的酶或结构域的cas9融合蛋白。基于本披露,另外的适合的核酸编辑酶或结构域对本领域的普通技术人员而言将是显而易见的。
44.本披露提供不同构造的cas9:核酸编辑酶/结构域融合蛋白在一些实施例中,核酸编辑酶或结构域被融合至cas9结构域的n末端。在一些实施例中,核酸编辑酶或结构域被融
合至cas9结构域的c末端。在一些实施例中,cas9结构域与核酸编辑酶或结构域是通过连接体融合的。在一些实施例中,该连接体包含(ggggs)n(seq id no:91)、(g)n、(eaaak)n(seq id no:5)、(ggs)n、sgsetpgtsesatpes(seq id no:93)基序(参见,例如,古灵儿jp(guilinger jp)、汤普森
·
db(thompson db)、刘
·
dr(liu dr),融合无催化活性的cas9至foki核酸酶改善基因组修饰的特异性(fusion of catalytically inactive cas9 to foki nuclease improves the specificity of genome modification),自然生物技术(nat.biotechnol.)2014;32(6):577-82;将其全部内容通过引用结合在此),或(xp)n基序,或这些的任意组合,其中n独立地是1至30之间的整数。在一些实施例中,n独立地是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、或30,或如果存在多于一个连接体或多于一个连接体基序,n是其任意组合。另外的适合的连接体基序和连接体构造对本领域的普通技术人员而言将是显而易见的。在一些实施例中,适合的连接体基序和构造包括描述在以下文献中的那些,陈(chen)等人,融合蛋白连接体:特性、设计和功能(fusion protein linkers:property,design and functionality),先进药物输送评论(adv drug deliv rev)2013;65(10):1357-69,将其全部内容通过引用结合在此)。基于本披露,另外的适合的连接体序列对本领域的普通技术人员而言将是显而易见的。
45.在一些实施例中,本文提供的示例性的cas9融合蛋白的总体架构包括以下结构:[nh2]-[核酸编辑酶或结构域]-[cas9]-[cooh]或[nh2]-[cas9]-[核酸编辑酶或结构域]-[cooh],其中nh2是融合蛋白的n末端,并且cooh是融合蛋白的c末端。
[0046]
可能存在另外的特征,例如,nls与融合蛋白的剩下部分之间和/或核酸编辑酶或结构域与cas9之间的一个或多个连接体序列。可能存在的其他的示例性的特征是定位序列,例如细胞核定位序列、细胞质定位序列、输出序列(例如细胞核输出序列)、或其他定位序列、以及对于融合蛋白的溶解、纯化或检测有用的序列标签。本文提供了适合的定位信号序列和蛋白标签序列,这些序列包括但不限于生物素羧化酶载体蛋白(bccp)标签、myc标签、钙调素标签、flag标签、血凝素(ha)标签、多组氨酸标签(也被称为组氨酸标签或his标签)、麦芽糖结合蛋白(mbp)标签、nus标签、谷胱甘肽-s-转移酶(gst)标签、绿色荧光蛋白(gfp)标签、硫氧还蛋白标签、s-标签、softag(例如,softag 1、softag 3)、strep-标签、生物素连接酶标签、flash标签、v5标签、和sbp标签。另外的适合的序列对本领域的普通技术人员而言将是显而易见的。
[0047]
在一些实施例中,核酸编辑酶或结构域是脱氨酶。例如,在一些实施例中,具有脱氨酶的酶或结构域的示例性的cas9融合蛋白的总体架构包括以下结构:[nh2]-[nls]-[cas9]-[脱氨酶]-[cooh]、[nh2]-[nls]-[脱氨酶]-[cas9]-[cooh]、[nh2]-[cas9]-[脱氨酶]-[cooh]、或[nh2]-[脱氨酶]-[cas9]-[cooh]其中nls是细胞核定位信号,nh2是融合蛋白的n末端,并且cooh是融合蛋白的c末端。在一些实施例中,连接体被插在cas9和脱氨酶之间。在一些实施例中,nls位于脱氨酶和/或cas9结构域的c末端。在一些实施例中,nls位于脱氨酶和cas9结构域之间。也可能存
在另外的特征,例如序列标签。
[0048]
核酸编辑酶和结构域的一个示例性的适合的类型是胞苷脱氨酶,例如apobec家族的。胞苷脱氨酶的载脂蛋白b mrna编辑复合体(apobec)家族包含用于以受控和有益的方式启动突变形成的11个蛋白。
29
一个家族成员(激活诱导的胞苷脱氨酶(aid))负责以转录依赖的链偏好的方式通过将ssdna中的胞嘧啶转换成尿嘧啶使得抗体成熟。
30
载脂蛋白b编辑复合体3(apobec3)酶通过对在反转录病毒ssdna中的胞嘧啶的脱氨基作用为人类细胞提供针对某些hiv-1菌株的保护。
31
这些蛋白都要求zn
2
调节基序(his-x-glu-x
23-26-pro-cys-x
2-4-cys)和用于催化活性的结合水分子。在脱氨基反应中,glu残基用作激活水分子成氢氧化锌用于亲核进攻。每一个家庭成员优选在自己特定的“热点”脱去氨基,该热点的范围从haid的wrc(w是a或t,r是a或g)至hapobec3f的ttc。
32
最近,apobec3g的催化结构域的晶体结构(图2)显示,二级结构由两侧为六个α螺旋的五链β片层构成,这被认为在整个家族中是保守的。
33
已经显示活性中心环负责ssdna结合和确定“热点”身份两者。
34
这些酶的过量表达与基因组的不稳定和癌症相关,从而突出序列特异性靶向的重要性。
35
[0049]
核酸编辑酶和结构域的另一个示例性的适合的类型是腺苷脱氨酶。例如,adat家族腺苷脱氨酶可以融合至cas9结构域,例如核酸酶非活性的cas9结构域,从而产生cas9-adat融合蛋白。
[0050]
本披露的一些方面提供在cas9和脱氨酶之间的融合的系统系列,脱氨酶例如是胞嘧啶脱氨酶(如apobec酶)或腺苷脱氨酶(如adat酶),该系统系列已经被产生,从而将这些脱氨酶的酶活性引导至基因组dna的特定位点。使用cas9作为识别剂的优点有两重:(1)cas9的序列特异性可以轻易地通过简单地改变sgrna序列来改变;以及(2)cas9通过退火dsdna结合至它的靶序列,产生一系列单链的dna和因而用于脱氨酶的可行的底物。已经产生出具有人类和小鼠脱氨酶结构域如aid结构域的成功的融合蛋白。还考虑了人类和小鼠aid的催化结构域和cas9之间的各种其他融合蛋白。应当了解,其他催化结构域或来自其他脱氨酶的催化结构域也可以用于产生具有cas9的融合蛋白,并且本披露不限于这个方面。
[0051]
在一些实施例中,提供了cas9和aid的融合蛋白。在设计cas9融合蛋白以增加ssdna中突变率的尝试中,小鼠和人类aid都被拴在丝状噬菌体基因v(非特异性ssdna结合蛋白)上。在基于细胞的试验中,相比野生型酶,产生的融合蛋白显示出增强的诱变活性。这个工作证明,使用融合蛋白,这些蛋白的酶活性被保持在遗传序列中并可以成功地靶向遗传序列。
36
[0052]
然而,已经报道了cas9(和甚至与它的sgrna和靶dna一起在复合体中的cas9)的若干晶体结构,(参见,例如,季聂克
·
m(jinek m)、蒋
·
f(jiang f)、泰勒
·
dw(taylor dw)、斯腾伯格
·
sh(sternberg sh)、卡亚
·
e(kaya e)、马
·
e(ma e)、安德斯
·
c(anders c)、豪尔
·
m(hauer m)、周
·
k(zhou k)、林
·
s(lin s)、卡普兰
·
m(kaplan m)、亚瓦罗内
·
at(iavarone at)、卡彭特
·
e(charpentier e)、诺加利斯
·
e(nogales e)、杜德纳
·
ja(doudna ja),cas9内切核酸酶的结构揭示rna介导的构象活性(structures of cas9 endonucleases reveal rna-mediated conformational activation),科学(science),2014;343(6176):1247997,pmid:24505130;以及并h(nishimasu h)、冉
·
fa(ran fa)、许
·
fd(hsu pd)、科纳曼s(konermann s)、施哈塔
·
si(shehata si)、道来n(dohmae)n、石谷信一
·
r(ishitani r)、张
·
f(zhang f)、濡木o(nureki o),与引导rna和靶dna一起在复合体
中的cas9的晶体结构(crystal structure of cas9 in c omplex with guide rna and target dna),细胞(cell).2014;156(5):935-49,pmid:24529477,将其每一个的全部内容通过引用结合在此),在cas9-dna复合体中的是单链的dna的部分是未知的(cas9-dna泡的大小)。然而,已经显示在具有为复合体特异地设计来干扰转录的sgrna的dcas9系统中,转录干扰仅仅发生在sgrna结合至非模板链时。这个结果表明在dna-cas9复合体中的dna的特定部分没有被cas9防备,并且可以潜在地被融合蛋白中的脱氨酶靶向(参见齐
·
ls(qi ls)、拉尔森
·
mh(larson mh)、吉尔伯特
·
la(gilbert la)、杜德纳
·
ja(doudna ja)、韦斯曼
·
js(weissman js)、阿尔金
·
ap(arkin ap)、林
·
wa(lim wa),将crispr再利用为rna指导的平台以用于基因表达的序列特异性控制(repurposing crispr as an rna-guided platform for sequence-specific control of gene expression)细胞(cell).2013;152(5):1173-83,pmid:23452860,将其全部内容以引用方式结合在此。进一步支持这个概念,使用外切核酸酶iii和核酸酶p1(其仅仅在ssdna作为底物时起作用)的足迹法试验揭示在非模板链上至少26个碱基易被这些酶消化(参见季聂克
·
m(jinek m)、蒋
·
f(jiang f)、泰勒
·
dw(taylor dw)、斯腾伯格
·
sh(sternberg sh)、卡亚
·
e(kaya e)、马
·
e(ma e)、安德斯
·
c(anders c)、豪尔
·
m(hauer m)、周
·
k(zhou k)、林
·
s(lin s)、卡普兰
·
m(kaplan m)、亚瓦罗内
·
at(iavarone at)、卡彭特
·
e(charpentier e)、诺加利斯
·
e(nogales e)、杜德纳
·
ja(doudna ja),cas9内切核酸酶的结构揭示rna介导的构象活性(structures of cas9 endonucleases reveal rna-mediated conformational activation),科学(science),2014;343(6176):1247997,pmid:24505130)。还已经报道,在某些情况下,cas9在这个易受影响的dna段上以高达15%的频率诱导单碱基置换突变(参见蔡
·
sq(tsai sq)、wyvekens n、khayter c、福登布
·
ja(foden ja)、塔帕尔
·
v(thapar v)、拉永
·
d(reyon d)、古德温
·
mj(goodwin mj)、阿里耶
·
mj(aryee mj)、姜戈jk(joung jk),二聚crispr rna指导的foki核酸酶,用于高度特异性的基因组编辑(dimeric crispr rna-guided foki nucleases for highly specific genome editing),自然生物技术(nat.biotechnol.).2014;32(6):569-76,pmid:24770325,将其全部内容以引用方式结合在此。虽然引入这些突变的机制是未知的,在所有的情况下,突变的碱基是胞嘧啶,这可能指示胞嘧啶脱氨酶的参与。总之,这些数据显然与单链的且易受其他酶影响的靶dna的一部分一致。已经显示在具有为复合体特异地设计来干扰转录的sgrna的dcas9系统中,转录干扰仅仅发生在sgrna结合至非模板链时。这个结果表明在dna-cas9复合体中的dna的特定部分没有被cas9防备,并且可以潜在地被融合蛋白中的aid靶向。
16
相应地,根据本披露的多个方面,cas9的n末端和c末端与脱氨酶结构域的融合是有用的。
[0053]
在一些实施例中,脱氨酶结构域和cas9结构域是通过连接体彼此融合的。可以应用脱氨酶结构域(如aid)和cas9结构域之间的各种连接体长度和灵活性(例如,范围从非常灵活的连接体形式(ggggs)n(seq id no:91)、(ggs)n、和(g)n至更严格的连接体形式(eaaak)n(seq id no:5)、sgsetpgtsesatpes(seq id no:93)(参见,例如,古灵儿jp(guilinger jp)、汤普森
·
db(thompson db)、刘
·
dr(liu dr),融合无催化活性的cas9至foki核酸酶改善基因组修饰的特异性(fusion of catalytically inactive cas9 to foki nuclease improves the specificity of genome modification),自然生物技术(nat.biotechnol.).2014;32(6):577-82;将其全部内容通过引用结合在此)和(xp)n)
37
,以
便于达到用于特定应用的脱氨酶活性的最佳长度。
[0054]
根据本披露的方面,可以融合至cas9结构域的一些示例性的适合的核酸编辑酶和结构域(例如脱氨酶和脱氨酶结构域)提供在下文。应当了解,在一些实施例中,可以利用各自序列的活性结构域,例如,没有定位信号的结构域(细胞核定位信号、没有细胞核的输出信号、细胞质定位信号)。
[0055]
人类aid:(下划线:细胞核定位信号;双下划线:细胞核输出信号)
[0056]
小鼠aid:小鼠aid:(下划线:细胞核定位信号;双下划线:细胞核输出信号)
[0057]
狗aid:(下划线:细胞核定位信号;双下划线:细胞核输出信号)
[0058]
牛aid:(下划线:细胞核定位信号;双下划线:细胞核输出信号)
[0059]
小鼠apobec-3:
(斜体:核酸编辑结构域)
[0060]
大鼠apobec-3:(斜体:核酸编辑结构域)
[0061]
恒河猴apobec-3g:3g:(斜体:核酸编辑结构域;下划线:细胞质定位信号)
[0062]
黑猩猩apobec-3g:(斜体:核酸编辑结构域;下划线:细胞质定位信号)
[0063]
绿猴apobec-3g:
(斜体:核酸编辑结构域;下划线:细胞质定位信号)
[0064]
人类apobec-3g:(斜体:核酸编辑结构域;下划线:细胞质定位信号)
[0065]
人类apobec-3f:3f:(斜体:核酸编辑结构域)
[0066]
人类apobec-3b:(斜体:核酸编辑结构域)
[0067]
人类apobec-3c:
(斜体:核酸编辑结构域)
[0068]
人类apobec-3a:(斜体:核酸编辑结构域)
[0069]
人类apobec-3h:(斜体:核酸编辑结构域)
[0070]
人类apobec-3d:3d:(斜体:核酸编辑结构域)
[0071]
人类apobec-1:mtsekgpstgdptlrrriepwefdvfydprelrkeacllyeikwgmsrkiwrssgknttnhvevnfikkftserdfhpsmscsitwflswspcwecsqaireflsrhpgvtlviyvarlfwhmdqqnrqglrdlvnsgvtiqimraseyyhcwrnfvnyppgdeahwpqypplwmmlyalelhciilslppclkisrrwqnhltffrlhlqnchyqtipphillatglihpsvawr(seq id no:22)
[0072]
小鼠apobec-1:mssetgpvavdptlrrriephefevffdprelrketcllyeinwggrhsvwrhtsqntsnhvevnflekftteryfrpntrcsitwflswspcgecsraiteflsrhpyvtlfiyiarlyhhtdqrnrqglrdlissgvtiqimteqeycycwrnfvnyppsneaywpryphlwvklyvlelyciilglppclkilrrkqpqltfftitlqtchyqripphllwatglk(seq id no:23)
[0073]
大鼠apobec-1:
mssetgpvavdptlrrriephefevffdprelrketcllyeinwggrhsiwrhtsqntnkhvevnfiekftteryfcpntrcsitwflswspcgecsraiteflsryphvtlfiyiarlyhhadprnrqglrdlissgvtiqimteqesgycwrnfvnyspsneahwpryphlwvrlyvlelyciilglppclnilrrkqpqltfftialqschyqrlpphilwatglk(seq id no:24)
[0074]
人类adat-2:meakaapkpaasgacsvsaeetekwmeeamhmakealentevpvgclmvynnevvgkgrnevnqtknatrhaemvaidqvldwcrqsgkspsevfehtvlyvtvepcimcaaalrlmkiplvvygcqnerfggcgsvlniasadlpntgrpfqcipgyraeeavemlktfykqenpnapkskvrkkecqks(seq id no:25)
[0075]
小鼠adat-2:meekvestttpdgpcvvsvqetekwmeeamrmakealenievpvgclmvynnevvgkgrnevnqtknatrhaemvaidqvldwchqhgqspstvfehtvlyvtvepcimcaaalrlmkiplvvygcqnerfggcgsvlniasadlpntgrpfqcipgyraeeavellktfykqenpnapkskvrkkdcqks(seq id no:26)
[0076]
小鼠adat-1:1:1:(斜体:核酸编辑结构域)
[0077]
人类adat-1:1:(斜体:核酸编辑结构域)
[0078]
在一些实施例中,如本文提供的融合蛋白包括核酸编辑酶的全长氨基酸,例如以上提供的序列中的一个。然而,在其他实施例中,如本文提供的融合蛋白不包括核酸编辑酶的全长序列,仅仅是其片段。例如,在一些实施例中,如本文提供的融合蛋白包括cas9结构域和核酸编辑酶的片段,例如,其中片段包括核酸编辑结构域。核酸编辑结构域的示例性的氨基酸序列在以上序列中示为斜体字母,并且此类结构域的另外的适合的序列对本领域的普通技术人员而言将是显而易见的。
[0079]
基于本披露,另外的适合的核酸编辑酶序列,例如,可以根据本发明的诸多方面来
使用的脱氨酶和结构域序列(例如可以融合至核酸酶非活性cas9结构域)对本领域的普通技术人员而言将是显而易见的。在一些实施例中,这样的另外的酶序列包括脱氨酶或脱氨酶结构域序列,这些序列与本文提供的序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列相似性。另外的适合的cas9结构域、变体、和序列对本领域的普通技术人员而言将是显而易见的。此类另外的适合的cas9结构域的实例包括但不限于d10a、d10a/d839a/h840a、和d10a/d839a/h840a/n863a突变的结构域(参见,例如,普拉桑特(prashant)等人,用于靶标特异性筛选的cas9转录激活因子与用于合作基因组工程化的配对切口酶(cas9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering),自然生物技术(nature biotechnology),2013;31(9):833-838,将其全部内容通过引用结合在此。
[0080]
基于本披露,结合本领域的一般知识,产生包括cas9结构域和脱氨酶结构域的融合蛋白的另外的适合的策略对本领域的普通技术人员而言将是显而易见的。基于本披露和本领域的知识,使用连接体和不使用连接体根据本披露的诸多方面产生融合蛋白的适合的策略对本领域的普通技术人员而言将是显而易见的。例如,吉尔伯特(gilbert)等人,真核生物中crispr介导的模块化的rna指导的转录调节(crispr-mediated modular rna-guided regulation of transcription in eukaryotes),细胞(cell).2013;154(2):442-51,显示使用2nls’s作为连接体(spkkkrkveas,seq id no:29)的cas9与vp64的c末端融合,可以应用于转录激活。玛丽(mali)等人,用于靶标特异性筛选的cas9转录激活因子与用于合作基因组工程化的配对切口酶(cas9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering),自然生物技术(nat.biotechnol.).2013;31(9):833-8,报道不使用连接体的与vp64的c末端融合可以应用于转录激活。并且梅德(maeder)等人,crispr rna指导的内源人类基因的激活(crispr rna-guided activation of endogenous human genes),自然方法(nat.methods),2013;10:977-979,报道使用gly4ser(seq id no:91)连接体的与vp64的c末端融合可以用作转录激活因子。最近,dcas9-foki核酸酶融合已经成功地产生出并且相比亲本cas9酶展现了改进的酶特异性(参见古灵儿jp(guilinger jp)、汤普森
·
db(thompson db)、刘
·
dr(liu dr),融合无催化活性的cas9至foki核酸酶改善基因组修饰的特异性(fusion of catalytically inactive cas9 to foki nuclease improves the specificity of genome modification),自然生物技术(nat.biotechnol.).2014;32(6):577-82,以及参见蔡
·
sq(tsai sq)、wyvekens n、khayter c、福登布
·
ja(foden ja)、塔帕尔
·
v(thapar v)、拉永
·
d(reyon d)、古德温
·
mj(goodwin mj)、阿里耶
·
mj(aryee mj)、姜戈jk(joung jk),二聚crispr rna指导的foki核酸酶,用于高度特异性的基因组编辑(dimeric crispr rna-guided foki nucleases for highly specific genome editing),自然生物技术(nat.biotechnol.).2014;32(6):569-76,pmid:24770325,sgsetpgtsesatpes(seq id no:93)或ggggs(seq id no:91)连接体分别被用于foki-dcas9融合蛋白)。使用cas9 dna编辑融合蛋白来修正疾病相关突变
[0081]
一些实施例提供了用于使用本文提供的cas9 dna编辑融合蛋白的方法。在一些实
施例中,通过脱去靶核碱基(例如c残基)的氨基使用融合蛋白来在核酸中引入点突变。在一些实施例中,靶核碱基的脱氨基作用导致遗传缺陷的修正,例如导致在基因产物中引起功能丧失的点突变的修正。在一些实施例中,该遗传缺陷与疾病或失调关联,疾病或失调例如是溶酶体贮失调或代谢性疾病,如i型糖尿病。在一些实施例中,使用本文提供的方法来在编码与疾病或失调相关的基因产物的基因或等位基因中引入失活的点突变。例如,在一些实施例中,本文提供的方法应用cas9 dna编辑融合蛋白在致癌基因中引入失活的点突变(例如在增殖性疾病的治疗中)。在一些实施例中,失活的突变可以在编码序列中产生未成熟的终止密码子,其导致截短的基因产物的表达,例如,缺乏全长蛋白的功能的截短的蛋白。
[0082]
在一些实施例中,本文提供的方法的目的是通过基因组编辑恢复机能失调基因的功能。本文提供的cas9脱氨酶融合蛋白可以在基于基因编辑的人类体外治疗中生效,例如,通过在人类细胞培养物中修正疾病相关突变。本领域的技术人员应当了解,本文提供的融合蛋白,例如包含cas9结构域和核酸脱氨酶结构域的融合蛋白,可以用于修正任何单点(t-》c或a-》g)突变。在第一种情况中,突变的c经脱氨基作用回到u修正了突变,并且在第二种情况中,与突变的g碱基配对的c经脱氨基作用,紧接着经一轮复制,修正了突变。
[0083]
可以通过提供的融合蛋白在体外或体内修正的示例性的疾病相关的突变是在pi3kca蛋白中的h1047r(a3140g)多态性。磷酸肌醇-3-激酶(催化的α亚基(pi3kca)蛋白)的作用是磷酸化磷脂酰肌醇的肌醇环的3-oh基团。已经发现pi3kca基因在许多不同的癌中突变,并且因此它被认为是强有力的致癌基因。
50
实际上,a3140g突变存在于若干nci-60癌症细胞系,例如hct116、skov3、和t47d细胞系,这些细胞系可以容易地从美国典型培养物保藏中心(atcc)获得。
51
[0084]
在一些实施例中,携带待修正的突变的细胞,例如,携带点突变(例如,导致在pi3kca蛋白中的h1047r置换的在pi3kca基因外显子20中的a3140g点突变)的细胞,与编码cas9脱氨酶融合蛋白的表达构建体和将融合蛋白靶向在编码pi3kca基因中的各个突变位点的适当设计的sgrna接触。在设计sgrna来将融合酶靶向在pi3kca基因中的非c残基的情况下可以进行控制实验。在人类细胞培养物中可以提取所处理的细胞的基因组dna,并且对pi3kca基因的相关序列进行pcr扩增和测序来评估融合蛋白的活性。
[0085]
应当了解,提供的修正pi3kca中的点突变的实例是出于说明的目的,并不意味着限制本披露。本领域的技术人员将了解本披露的dna编辑融合蛋白可以用来修正其他的点突变以及与其他癌症和与除癌症以外的疾病(包括其他增殖性疾病)相关的突变。
[0086]
成功的修正疾病相关基因和等位基因中的点突变开启了治疗学和基础研究中使用应用进行基因修正的新策略。位点特异性的单碱基修饰系统,如披露的cas9和脱氨酶或脱氨酶结构域的融合在“逆转”基因治疗中也具有用途,其中某些基因功能故意被抑制或废止。在这些情况下,可以在体外、离体、或体内使用从trp(tgg)、gln(caa和cag)、或arg(cga)残基位点特异性突变为未成熟的终止密码子(taa、tag、tga)来废止蛋白功能。
[0087]
本披露提供用于治疗被诊断出具有与点突变相关或由点突变引起的疾病的受试者的方法,所述点突变可以通过本文提供的cas9 dna编辑融合蛋白来修正。例如,在一些实施例中,提供的方法包括对具有,例如,如以上所述的与pi3kca点突变相关的癌症的疾病的受试者给予有效量的cas9脱氨酶融合蛋白,该融合蛋白修正点突变或在疾病相关基因中引
入失活的突变。在一些实施例中,该疾病是增殖性疾病。在一些实施例中,该疾病是遗传性疾病。在一些实施例中,该疾病是肿瘤性疾病。在一些实施例中,该疾病是代谢性疾病。在一些实施例中,该疾病是溶酶体贮积病。其他可以通过修正点突变或在疾病相关基因中引入失活的突变进行治疗的疾病对本领域的普通技术人员而言将是已知的,并且本披露不限于这一方面。
[0088]
本披露提供用于治疗另外的疾病或失调的方法,例如与点突变相关或由点突变导致的疾病或失调,所述点突变可以通过脱氨酶介导的基因编辑修正。本文描述了一些这样的疾病,并且基于本披露可以使用本文提供的策略和融合蛋白进行治疗的另外的适合的疾病对本领域的普通技术人员而言将是显而易见的。以下列出了示例性的适合的疾病和失调。应当了解在各自序列中的特异性的位置或残基的编号依赖于特定蛋白和使用的编号方案。例如,成熟蛋白的前体和成熟蛋白本身的编号可能不同,并且不同物种的序列的不同可能影响编号。本领域的技术人员能够通过本领域熟知的方法(例如通过序列比对和同源残基的脱氨基作用)识别任何同源蛋白中和各自的编码核酸中的各自的残基。示例性的适合的疾病和失调包括但不限于囊胞性纤维症(参见,例如,施万克(schwank)等人,通过crispr/cas9在囊胞性纤维化患者的肠道干细胞组织体中进行cftr的功能修复(functional repair of cftr by crispr/cas9 in intestinal stem cell organoids of cystic fibrosis patients),细胞干细胞(cell stem cell),2013;13:653-658;以及吴(wu)等人,通过使用crispr-cas9修正小鼠中的遗传性疾病(correction of a genetic disease in mouse via use of crispr-cas9),细胞干细胞(cell stem cell),2013;13:659-662,这两个文献皆没有使用脱氨酶融合蛋白来修正遗传缺陷);苯丙酮尿症-例如,在苯丙氨酸羟化酶基因的位置835(小鼠)或240(人)或同源残基处发生苯丙氨酸至丝氨酸的突变(t》c突变)
–
参见,例如,麦克唐纳(mcdonald)等人,基因组学(genomics),1997;39:402-405;巨大血小板综合征(bss)-例如,在血小板膜糖蛋白ix中的位置55或同源残基处发生苯丙氨酸至丝氨酸的突变,或在位置24或同源残基处发生半胱氨酸至精氨酸的突变(t》c突变)-参见,例如,诺里斯(noris)等人,英国血液学杂志(british journal of haematology),1997;97:312-320;以及阿里(ali)等人,血液学(hematol.),2014;93:381-384;表皮松解性角化过度(ehk)-例如,在角蛋白1的位置160或161(如果计数起始子甲硫氨酸)或同源残基处发生亮氨酸至脯氨酸的突变(t》c突变)-参见,例如,chipev等人,细胞(cell),1992;70:821-828;也参见在www[dot]uniprot[dot]org网站的uniprot数据库中的登录号p04264;慢性阻塞性肺病(copd)-例如,在α
1-抗胰蛋白酶的加工形式的位置54或55(如果计数起始子甲硫氨酸)或同源残基或未加工形式的残基78或同源残基处发生亮氨酸至脯氨酸的突变(t》c突变)-参见,例如,波勒(poller)等人,基因组学(genomics),1993;17:740-743,也参见uniprot数据库中的登录号p01011;进行性神经性腓骨肌萎缩症(charcot-marie-tooth disease)4j型-例如,图4中在位置41或同源残基处发生异亮氨酸至苏氨酸的突变(t》c突变)
–
参见,例如,伦克(lenk)等人,plos遗传学(plos genetics),2011;7:e1002104;神经母细胞瘤(nb)-例如,在半胱天冬酶-9的位置197或同源残基处发生亮氨酸至脯氨酸的突变(t》c突变)-参见,例如,昆都(kundu)等人,3生物技术(3biotech.),2013;3:225-234;血管性血友病(vwd)-例如,在血管性血友病因子的加工形式的位置509或同源残基或在血管性血友病因子的未加工形式的位置1272或同源残基处发生半胱氨酸至
精氨酸的突变(t》c突变)-参见,例如,拉韦涅(lavergne)等人,英国血液学杂志(br.j.haematol.),1992,也参见uniprot数据库中的登录号p04275;82:66-72;先天性肌强直-例如,在肌肉氯离子通道基因clcn1的位置277或同源残基处发生半胱氨酸至精氨酸的突变(t》c突变)-参见,例如,温伯格(weinberger)等人,生理学杂志(the journel of physiology),2012;590:3449-3464;遗传性肾淀粉样变性-例如,在载脂蛋白aii加工形式的78位或同源残基或在未加工形式的位置101或同源残基处发生终止密码子至精氨酸突变(t》c突变)-参见,例如,矢崎(yazaki)等人,国际肾脏(kidney int.),2003;64:11-16;扩张型心肌病(dcm)
–
例如,在foxd4基因的位置148或同源残基处发生色氨酸至精氨酸的突变(t》c突变)-参见,例如,米诺雷迪(minoretti)等人,国际分子医学杂志(int.j.of mol.med.),2007;19:369-372;遗传性淋巴水肿
–
例如,在vegfr3酪氨酸激酶的位置1035或同源残基处发生组氨酸至精氨酸的突变(a》g突变)-参见,例如,irrthum等人,美国人类遗传学(am.j.hum.genet.),2000;67:295-301;家族性阿尔茨海默病
–
例如,在早老蛋白1(presenilin1)的位置143或同源残基处发生异亮氨酸至缬氨酸的突变(a》g突变)-参见,例如,加洛(gallo)等人,阿尔茨海默病杂志(j.alzheimer’s disease),2011;25:425-431;朊病毒病
–
例如,在朊蛋白的位置129或同源残基处发生甲硫氨酸至缬氨酸的突变(a》g突变)-参见,例如,路易斯(lewis)等人,普通病毒学杂志(j.of general virology),2006;87:2443-2449;慢性小儿神经皮肤关节综合征(cinca)
–
例如,在cryopyrin蛋白的位置570或同源残基处发生酪氨酸至半胱氨酸的突变(a》g突变)-参见,例如,藤泽(fujisawa)等人,血液(blood),2007;109:2903-2911;以及结蛋白相关肌病(drm)
–
例如,在b晶状体蛋白的位置120或同源残基处发生精氨酸至甘氨酸的突变(a》g突变)-参见,例如,库马尔(kumar)等人,生物化学杂志(j.biol.chem.)1999;274:24137-24141。所有参考文献和数据库条目的全部内容通过引用结合在此。
[0089]
为了将如本文披露的cas9:核酸编辑酶/结构域融合蛋白靶向靶位点,例如包含待编辑的点突变的位点,典型地有必要与指导rna(如sgrna)一起共表达cas9:核酸编辑酶/结构域融合蛋白,这对本领域的普通技术人员而言将是显而易见的。如本文其他地方更详细的解释,指导rna典型地包括允许cas9结合的tracrrna框架和赋予cas9:核酸编辑酶/结构域融合蛋白序列特异性的指导序列。在一些实施例中,指导rna包含结构5
’‑
[指导序列]-guuuuagagcuagaaauagcaaguuaaaauaaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu-3’(seq id no:38),其中指导序列包括与靶序列互补的序列。典型地,指导序列为20个核苷酸长。基于本披露,用于将cas9:核酸编辑酶/结构域融合蛋白靶向特异性基因组靶位点的适合的指导rna的序列对本领域的普通技术人员而言将是显而易见的。典型地,此类适合的指导rna序列包括与待编辑的靶核苷酸上或下游50个核苷酸内的核酸序列互补的指导序列。以下提供了适合用于将cas9:核酸编辑酶/结构域融合蛋白靶向特异性靶序列的一些示例性的指导rna序列。
[0090]
在磷脂酰肌醇-3-激酶催化α亚基(pi3kca或pik3ca)中的h1047r(a3140g)多态性(下划线是突变的核苷酸和各自的密码子的位置):
(核苷酸序列-seq id no:39;蛋白序列-seq id no:40)。
[0091]
用于将cas9:核酸编辑酶/结构域融合蛋白靶向突变的a3140g残基的示例性的适合的指导序列包括但不限于:5
’‑
aucggaauctauuuugacuc-3’(seq id no:41);5
’‑
ucggaaucuauuuugacucg-3’(seq id no:42);5
’‑
cuuagauaaaacugagcaag-3’(seq id no:43);5
’‑
aucuauuuugacucguucuc-3’(seq id no:44);5
’‑
uaaaacugagcaagaggcuu-3’(seq id no:45);5
’‑
ugguggcuggacaacaaaaa-3’(seq id no:46);5
’‑
gcuggacaacaaaaauggau-3’(seq id no:47);5
’‑
guguuaauuugucguacgua-3’(seq id no:48)。基于本披露,用于将cas9:核酸编辑酶/结构域融合蛋白靶向突变的pi3kca序列、靶向下文提供的任何另外的序列、或靶向与疾病相关的另外的突变的序列的另外适合的指导序列对本领域的普通技术人员而言将是显而易见的。
[0092]
苯丙酮尿症在苯丙氨酸羟化酶基因的残基240处发生苯丙氨酸至丝氨酸的突变(t》c突变)(下划线是突变的核苷酸和各自的密码子的位置):(核苷酸序列-seq id no:49;蛋白序列
–
seq id no:50)。
[0093]
巨大血小板综合征(bss)-在血小板膜糖蛋白ix的残基24处发生半胱氨酸至精氨酸的突变(t》c突变):(核苷酸序列-seq id no:51;蛋白序列-seq id no:52)。
[0094]
表皮松解性角化过度(ehk)-在角蛋白1的残基161处发生亮氨酸至脯氨酸的突变(t》c突变):(核苷酸序列-seq id no:53;蛋白序列-seq id no:54)。
[0095]
慢性阻塞性肺病(copd)-在α
1-抗胰蛋白酶的残基54处发生亮氨酸至脯氨酸的突
变(t》c突变):(核苷酸序列-seq id no:55;蛋白序列-seq id no:56)。
[0096]
慢性阻塞性肺病(copd)-在α1-抗胰凝乳蛋白酶的残基78处发生亮氨酸至脯氨酸的突变(t》c突变):(核苷酸序列-seq id no:89;蛋白序列-seq id no:90)。
[0097]
神经母细胞瘤(nb)-在半胱天冬酶-9的残基197处发生亮氨酸至脯氨酸的突变(t》c突变):(核苷酸序列-seq id no:57;蛋白序列-seq id no:58)。
[0098]
进行性神经性腓骨肌萎缩症4j型-在图4中的残基41处发生异亮氨酸至苏氨酸的突变(t》c突变):(核苷酸序列-seq id no:59;蛋白序列-seq id no:60)。
[0099]
血管性血友病(vwd)
–
在血管性假血友病因子的残基1272处发生半胱氨酸至精氨酸的突变(t》c突变):
(核苷酸序列-seq id no:61;蛋白序列-seq id no:62)。
[0100]
先天性肌强直-在肌肉氯离子通道基因clcn1的位置277处发生半胱氨酸至精氨酸的突变(t》c突变):(核苷酸序列-seq id no:63;蛋白序列-seq id no:64)。
[0101]
遗传性肾淀粉样变性
–
在载脂蛋白aii的残基111处发生终止密码子至精氨酸的突变(t》c突变):(核苷酸序列-seq id no:65;蛋白序列-seq id no:66)。
[0102]
扩张型心肌病(dcm)-在foxd4基因的位置148处发生色氨酸至精氨酸的突变(t》c突变):(核苷酸序列-seq id no:67;蛋白序列-seq id no:68)。
[0103]
遗传性淋巴水肿-在vegfr3酪氨酸激酶的残基1035处发生组氨酸至精氨酸的突变(a》g突变):(核苷酸序列-seq id no:69;蛋白序列-seq id no:70)。
[0104]
家族性阿尔茨海默病-在早老蛋白1的残基143处发生异亮氨酸至缬氨酸的突变(a》g突变):
(核苷酸序列-seq id no:71;蛋白序列-seq id no:72)。
[0105]
朊病毒病-在朊蛋白的残基129处发生甲硫氨酸至缬氨酸的突变(a》g突变):(核苷酸序列-seq id no:73;蛋白序列-seq id no:74)。
[0106]
慢性小儿神经皮肤关节综合征(cinca)
–
在cryopyrin蛋白的残基570处发生酪氨酸至半胱氨酸的突变(a》g突变):(核苷酸序列-seq id no:75;蛋白序列-seq id no:76)。
[0107]
结蛋白相关性肌病(drm)-在αb晶状体蛋白的残基120处发生精氨酸至甘氨酸的突变(a》g突变):(核苷酸序列-seq id no:77;蛋白序列-seq id no:78)。
[0108]
β-地中海贫血-在血红蛋白b的残基115处发生亮氨酸至脯氨酸的突变的一个实例。
[0109]
(核苷酸序列-seq id no:79;蛋白序列-seq id no:80)。应当了解,以上提供的序列是示例性的,并不意味着限制本披露的范围。基于本披露,疾病相关且服从cas9:核酸编辑酶/结构域融合蛋白以及适合的指导rna序列修正的另外的适合的点突变的序列对本领域的普通技术人员而言将是显而易见的。
报告系统
[0110]
本披露的一些方面提供用于检测本文描述的融合蛋白的脱氨酶活性的报告系统。在一些实施例中,该报告系统是基于荧光素酶的试验,其中脱氨酶活性导致荧光素酶的表达。为了最小化脱氨酶结构域(例如,aid结构域)潜在的底物混乱的影响,可能会无意地被靶向以用于脱氨基作用的残基数目(例如,可能潜在地驻留在报告系统内的ssdna上的脱靶c残基)被最小化。在一些实施例中,目的靶残基是位于不能启动翻译的荧光素酶基因的acg突变的起始密码子中。理想的脱氨酶活性导致acg》aug的改变,因而使荧光素酶的翻译和脱氨酶活性的检测和定量成为可能。
[0111]
在一些实施例中,为了最小化单链c残基,前导序列被插在突变的起始密码子和荧光素酶基因的起点之间,该前导序列由一串lys(aaa)、asn(aat)、leu(tta)、ile(att、ata)、tyr(tat)、或phe(ttt)残基组成。可以检测产生的突变体以确保前导序列不会负面地影响荧光素酶的表达或活性。还可以使用突变的起始密码子确定背景荧光素酶活性。
[0112]
可以使用报告系统来检测许多不同的sgrna,例如,以确定关于靶dna序列,各自的脱氨酶(如aid酶)将靶向哪一个或哪几个残基(图3)。因为cas9-dna泡的大小是未知的,也可以检测靶向非模板链的sgrna以便于评估特异性的cas9脱氨酶融合蛋白的脱靶效应。在一些实施例中,设计这样的sgrna以使得突变的起始密码子不会与sgrna碱基配对。
[0113]
一旦已经识别了可以可编程的将位点特异性c改变为u的融合蛋白,可以进一步描述它们活性的特征。来自荧光素酶试验的数据可以,例如,被整合进热地图,该热地图描述了关于sgrna靶dna,哪些核苷酸会被特异性融合蛋白靶向以用于脱氨基作用。在一些实施例中,对于每一个融合,在荧光素酶试验中导致最高活性的位置被考虑为“靶”位置,而所有其他位置被考虑为脱靶位置。
[0114]
在一些实施例中,提供了具有各种apobec3酶的cas9融合物或其脱氨酶结构域。在一些实施例中,提供了具有其他核酸编辑酶或催化结构域的cas9融合蛋白,包括,例如,ssrna编辑酶,如胞苷脱氨酶apobec1和acf1/asf,以及腺苷脱氨酶的adat家族,
38
这些核酸编辑酶或催化结构域当融合至cas9时可以被用于ssdna编辑活性。可以使用与以上描述的相同的报告系统和试验来检测此类融合蛋白的活性。
[0115]
在一些实施例中,本文提供了报告系统,该报告系统包括包含失活的起始密码子(例如,在模板链上从3
’‑
tac-5’至3
’‑
cac-5’的突变)的报告基因。一旦靶标c成功脱去氨基,相应的mrna将被转录为5
’‑
aug-3’而不是5
’‑
gug-3’,使得报告基因的翻译成为可能。适合的报告基因对本领域的普通技术人员而言将是显而易见的。
[0116]
以上提供的对报告系统的示例性实施例的描述仅仅是出于说明性目的,并不意味着限制。本披露也包括另外的报告系统,例如,以上详细描述的各种示例性系统的变体。实例实例1:融合蛋白
[0117]
以下提供了示例性cas9:脱氨酶融合蛋白:
[0118]
cas9:人类aid融合物(c末端)
(下划线:细胞核定位信号;双下划线:细胞核输出信号;粗体:连接体序列)
[0119]
cas9:人类aid融合物(n末端)
(下划线:细胞核定位信号;粗体:连接体序列)
[0120]
cas9:小鼠aid融合物(c末端)
(下划线:细胞核定位信号;粗体:连接体序列;双下划线:细胞核输出信号)
[0121]
cas9:人类apobec-3g融合物(n末端)(下划线:细胞核定位信号;粗体:连接体(1nls)),
[0122]
cas9:人类apobec-1融合物(n末端)
(下划线:细胞核定位信号;粗体:连接体(1nls),(seq id no:92)
[0123]
cas9:人类adat1融合物(n末端)
(下划线:细胞核定位信号;粗体:连接体序列)
[0124]
cas9:人类adat1融合物(c末端)cas9:人类adat1融合物(c末端)
(下划线:细胞核定位信号;粗体:连接体序列)实例2:通过cas9融合蛋白修正pi3k点突变
[0125]
导致pi3k蛋白的h1047r氨基酸置换的在pi3kca基因的外显子20内的a3140g点突变通过接触编码具有cas9:aid(seq id no:30)或cas9:apobec1(seq id no:92)融合蛋白的突变蛋白的核酸和在编码pi3kca基因中将融合蛋白靶向突变位点的恰当地设计的sgrna来修正。通过各自的外显子20序列的基因组pcr来确定a3140g点突变,例如,产生核苷酸3000-3250的pcr扩增子并且随后对pcr扩增子测序。
[0126]
使表达在外显子20中包括a3140g点突变的突变的pi3k蛋白的细胞接触编码cas9:aid(seq id no:30)或cas9:apobec1(seq id no:92)融合蛋白的表达构建体和在编码pi3kca基因的反义链中将融合蛋白靶向突变位点的恰当地设计的sgrna。sgrna的序列是5
’‑
aucggaauctauuuugacucguuuuagagcuagaaauagcaaguuaaaauaaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu 3’(seq id no:81);5
’‑
ucggaaucuauuuugacucgguuuuagagcuagaaauagcaaguuaaaauaaaggcuaguccguuaucaacuugaaaaa guggcaccgagucggugcuuuuu-3’(seq id no:82);5
’‑
cuuagauaaaacugagcaagguuuuagagcuagaaauagcaaguuaaaauaaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu-3’(seq id no:83);5
’‑
aucuauuuugacucguucucguuuuagagcuagaaauagcaaguuaaaauaaaggcuaguccguuaucaacuug aaaaaguggcaccgagucggugcuuuuu-3’(seq id no:84);5
’‑
uaaaacugagcaagaggcuuguuuuagagcuagaaauagcaaguuaaaauaaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu-3’(seq id no:85);5
’‑
ugguggcuggacaacaaaaaguuuuagagcuagaaauagcaaguuaaaauaaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu-3’(seq id no:86);5
’‑
gcuggacaacaaaaauggauguuuuagagcuagaaauagcaaguuaaaauaaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu-3’(seq id no:87);或5
’‑
guguuaauuugucguacguaguuuuagagcuagaaauagcaaguuaaaauaaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu(seq id no:88)。
[0127]
cas9:aid或cas9:apobec1融合蛋白的胞嘧啶脱氨酶活性导致与突变的g3140碱基配对的胞嘧啶脱去氨基成为尿嘧啶。一轮复制以后,恢复了野生型a3140。提取所处理的细胞的基因组dna并且使用适合的pcr引物扩增核苷酸3000-3250的pcr扩增子。通过对pcr扩增子测序来确定使用融合蛋白处理细胞后的a3140g点突变的修正。实例3:通过cas9融合蛋白修正早老蛋白1点突变
[0128]
导致早老蛋白1(psen1)内i143v氨基酸置换的psen1基因的密码子143内的a-》g点突变通过接触编码突变的psen1蛋白(具有cas9:aid(seq id no:30)或cas9:apobec1(seq id no:92)融合蛋白)的核酸和在编码psen1基因中将融合蛋白靶向突变位点的恰当地设计的sgrna来修正。参见,例如,加洛(gallo)等人,阿尔茨海默病杂志(j.alzheimer’s disease),2011;25:425-431,对于与家族性阿尔茨海默病相关的示例性psen1 i143v突变的描述。通过各自的psen1序列的基因组pcr来确定a-》g点突变,例如,产生外显子143周围的约100-250个核苷酸的pcr扩增子并且随后对pcr扩增子测序。
[0129]
使表达突变的psen1蛋白的细胞接触编码cas9:aid(seq id no:30)或cas9:apobec1(seq id no:92)融合蛋白的表达构建体和在编码psen1基因的反义链中将融合蛋白靶向突变位点的恰当地设计的sgrna。cas9:aid或cas9:apobec1融合蛋白的胞嘧啶脱氨
酶活性导致与密码子143中的突变的g碱基配对的胞嘧啶脱去氨基成为尿嘧啶。一轮复制以后,恢复了野生型a。提取所处理的细胞的基因组dna并且使用适合的pcr引物扩增100-250个核苷酸的pcr扩增子。通过对pcr扩增子测序来确定使用融合蛋白处理细胞后的a-》g点突变的修正。实例4:通过cas9融合蛋白修正α
1-抗胰蛋白酶点突变
[0130]
导致α
1-抗胰蛋白酶蛋白内l55p氨基酸置换的α
1-抗胰蛋白酶基因的密码子55内的t-》c点突变通过接触编码突变的α
1-抗胰蛋白酶蛋白(具有cas9:adat1融合蛋白(seq id no:35或36))的核酸和在编码α
1-抗胰蛋白酶基因中将融合蛋白靶向突变位点的恰当地设计的sgrna来修正。参见,例如,波勒(poller)等人,基因组学(genomics),1993;17:740-743,对于与慢性阻塞性肺病相关的示例性密码子55t-》c突变的更详细的描述。通过编码密码子55的各自的α
1-抗胰蛋白酶序列的基因组pcr来确定t-》c点突变,例如,产生约100-250个核苷酸的pcr扩增子并且随后对pcr扩增子测序。
[0131]
使表达突变的α
1-抗胰蛋白酶蛋白的细胞接触编码cas9:aid(seq id no:30)或cas9:apobec1(seq id no:92)融合蛋白的表达构建体和在编码α
1-抗胰蛋白酶基因的有义链中将融合蛋白靶向密码子55内突变的核苷酸的恰当地设计的sgrna。cas9:adat1融合蛋白的胞嘧啶脱氨酶活性导致突变的胞嘧啶脱去氨基成为尿嘧啶从而修正该突变。提取所处理的细胞的基因组dna并且使用适合的pcr引物扩增100-250个核苷酸的pcr扩增子。通过对pcr扩增子测序来确定使用融合蛋白处理细胞后的α
1-抗胰蛋白酶基因的密码子55内t-》c点突变的修正实例5:通过cas9融合蛋白修正血管性血友病因子点突变
[0132]
导致血管性血友病因子蛋白的c509r氨基酸置换的血管性血友病因子基因的密码子509内的t-》c点突变通过接触编码突变的血管性血友病因子蛋白(具有cas9:adat1融合蛋白(seq id no:35或36))的核酸和在编码血管性血友病因子基因的反义链中将融合蛋白靶向突变位点的恰当地设计的sgrna来修正。参见,例如,拉韦涅(lavergne)等人,英国血液学杂志(br.j.haematol.),1992;82:66-7,对于与血管性血友病(vwd)相关的示例性血管性血友病因子c509r突变的描述。通过各自的血管性血友病因子基因组序列的基因组pcr来确定t-》c点突变,例如,产生外显子509周围的约100-250个核苷酸的pcr扩增子并且随后对pcr扩增子测序。
[0133]
使表达突变的血管性血友病因子蛋白的细胞接触编码cas9:adat1融合蛋白(seq id no:35或36)的表达构建体和在编码血管性血友病因子基因的有义链中将融合蛋白靶向突变位点的恰当地设计的sgrna。cas9:adat1融合蛋白的胞嘧啶脱氨酶活性导致密码子509内突变的胞嘧啶脱去氨基成为尿嘧啶从而修正突变。提取所处理的细胞的基因组dna并且使用适合的pcr引物扩增100-250个核苷酸的pcr扩增子。通过对pcr扩增子测序来确定使用融合蛋白处理细胞后血管性血友病因子基因的密码子509内t-》c点突变的修正。实例6:通过cas9融合蛋白修正半胱天冬酶9点突变-神经母细胞瘤
[0134]
导致半胱天冬酶-9蛋白内l197p氨基酸置换的半胱天冬酶-9基因的密码子197内的t-》c点突变通过接触编码突变的半胱天冬酶-9蛋白(具有cas9:adat1融合蛋白(seq id no:35或36))的核酸和在编码半胱天冬酶-9基因的有义链中将融合蛋白靶向突变位点的恰当地设计的sgrna来修正。参见,例如,伦克(lenk)等人,plos遗传学(plos genetics),
2011;7:e1002104,对于与神经母细胞瘤(nb)相关的示例性半胱天冬酶-9l197p突变的描述。通过各自的半胱天冬酶-9基因组序列的基因组pcr来确定t-》c点突变,例如,产生外显子197周围的约100-250个核苷酸的pcr扩增子并且随后对pcr扩增子测序。
[0135]
使表达突变的半胱天冬酶-9蛋白的细胞接触编码cas9:adat1融合蛋白(seq id no:35或36)的表达构建体和在编码半胱天冬酶-9基因的有义链中将融合蛋白靶向突变位点的恰当地设计的sgrna。cas9:adat1融合蛋白的胞嘧啶脱氨酶活性导致密码子197内突变的胞嘧啶脱去氨基成为尿嘧啶从而修正突变。提取所处理的细胞的基因组dna并且使用适合的pcr引物扩增100-250个核苷酸的pcr扩增子。通过对pcr扩增子测序来确定使用融合蛋白处理细胞后的半胱天冬酶-9基因的密码子197内t-》c点突变的修正。实例7:两种dcas9-apobec1融合蛋白的脱氨酶活性
[0136]
产生了具有不同连接体的两种dcas9-apobec1融合蛋白:
[0137]
rapobec1_ggs_dcas9:94);下划线=rapobec1;双下划线=dcas9。
[0138]
rapobec1_(ggs)3_dcas9:
(seq id no:95);下划线=rapobec1;双下划线=dcas9。
[0139]
检査了两种融合蛋白的脱氨酶活性。脱氨酶试验改编自核酸研究(nuc.acids res.)2014,42,p.1095;生物化学杂志(j.biol.chem.)2004,279,p.53379;病毒学杂志(j.virology)2014,88,p.3850;以及病毒学杂志(j.virology)2006,80,p.5992,将其每一个的全部内容通过引用结合在此)。
[0140]
编码融合蛋白的表达构建体被插入cmv骨架质粒中(载体质粒52970;参见古灵儿jp(guilinger jp)、汤普森
·
db(thompson db)、刘
·
dr(liu dr),融合无催化活性的cas9至foki核酸酶改善基因组修饰的特异性(fusion of catalytically inactive cas9 to foki nuclease improves the specificity of genome modification),自然生物技术(nat.biotechnol.)2014;32(6):577-82)。使用tnt快速耦合转录/翻译系统(tnt quick coupled transcription/translation system)(普洛麦格公司(promega))来表达融合蛋白。90分钟后,将5μl溶解产物与5
’‑
标记的ssdna底物(cy3-attattattattccgcggatttatt tatttatttatttattt,seq id no:96)和udg(尿嘧啶dna糖基化酶)在37℃孵育持续3小时。然后添加1m naoh(10μl)溶液以在脱碱基位点切割dna。见图4。将dna在10%的tbe page凝胶上分辨(图5)。还包括阴性对照(其中puc19孵育在tnt系统中),以及阳性对照(其中合成了用“u”代替靶标c的dna)。图5说明两种融合蛋白都展现出脱氨酶活性。参考文献
1.亨伯特
·
o(humbert o)、戴维斯
·
l(davis l)、梅泽尔斯
·
n(maizels n),靶向基因治疗:工具,应用、优化(targeted gene therapies:tools,applications,optimization),生物化学与分子生物学重要评论(crit rev biochem mol biol),2012;47(3):264-81,pmid:22530743。2.佩雷斯-皮涅拉
·
p(perez-pinera p)、奥斯特罗特dg(ousterout dg)、乔斯巴奇ca(gersbach ca),靶向基因组编辑的进展(advances in targeted genome editing),化学生物学新见(curr opin chem biol),2012;16(3-4):268-77。pmid:22819644。3.乌尔诺夫
·
fd(urnov fd),雷巴尔
·
ej(rebar ej)、福尔摩斯
·
mc(holmes mc)、张
·
hs(zhang hs)、格雷戈瑞
·
pd(gregory pd),使用工程化的锌指核酸酶进行基因组编辑(genome editing with engineered zinc finger nucleases),遗传学自然评论(nat rev genet),2010;11(9):636-46,pmid:20717154。4.姜戈jk(joung jk)、桑德
·
jd(sander jd),talens:广泛应用于靶向基因组编辑的技术(talens:a widely applicable technology for targeted genome editing),分子细胞生物学自然评论(nat rev mol cell biol),2013;14(1):49-55,pmid:23169466。5.卡彭特
·
e(charpentier e)、杜德纳
·
ja(doudna ja),生物技术:重写基因组(biotechnology:rewriting a genome),自然(nature),2013;495,(7439):50-1,pmid:23467164。6.潘
·
y(pan y)、夏
·
l(xia l)、李
·
as(li as)、张
·
x(zhang x)、索罗斯p(sirois p)、张
·
j(zhang j)、李
·
k(li k),工程化核酸酶的生物学和生物医学领域的应用(biological and biomedical applications of engineered nucleases),分子生物技术(mol biotechnol),2013;55(1):54-62,pmid:23089945。7.德索萨
·
n.(de souza n.),引物:使用工程化核酸酶进行基因组编辑(primer:genome editing with engineered nucleases),自然方法(nat methods),2012;9(1):27,pmid:22312638。8.圣地亚哥
·
y(santiago y)、陈
·
e(chan e)、刘
·
pq(liu pq)、奥兰多
·
s(orlando s)、张
·
l(zhang l)、乌尔诺夫
·
fd(urnov fd)、福尔摩斯
·
mc(holmes mc)、古斯彻d(guschin d)、韦德
·
a(waite a)、米勒
·
jc(miller jc)、雷巴尔
·
ej(rebar ej)、格雷戈里
·
pd(gregory pd)、克卢格
·
a(klug a)、科林伍德
·
tn(collingwood tn),通过使用工程化锌指核酸酶在哺乳动物细胞中进行靶向基因敲除(targeted gene knockout in mammalian cells by using engineered zinc-finger nucleases),美国国家科学院院刊(proc natl acad sci u s a)2008;105(15):5809-14,pmid:18359850。9.嘉吉
·
m(cargill m)、阿特舒勒
·
d(altshuler d)、爱尔兰
·
j(ireland j)、斯克拉
·
p(sklar p)、爱得利k(ardlie k)、帕蒂尔
·
n(patil n)、莱恩
·
cr(lane cr)、林
·
ep(lim ep)、卡莱阿拉纳曼n(kalyanaraman n)、奈曼什j(nemesh j)、扎瓦格拉l(ziaugra l)、弗里德兰
·
l(friedland l)、罗尔夫
·
a(rolfe a)、沃灵顿
·
j(warrington j)、利浦沙特兹r(lipshutz r)、戴利
·
gq(daley gq)、兰德
·
es(lander es),人类基因编码区域单核苷酸多态性的特性(characterization of single-nucleotide polymorphisms in coding regions of human genes),自然遗传学(nat genet),1999;22(3):231-8,pmid:10391209。
10.詹森r(jansen r)、范埃姆登jd(van embden jd)、嘉仕堡w(gaastra w)、索鸥德斯lm(schouls lm),原核生物中与dna重复序列相关的基因鉴定(identification of genes that are associated with dna repeats in prokaryotes),分子微生物学(mol microbiol),2002;43(6):1565-75,pmid:11952905。11.马里
·
p(mali p)、艾斯维特km(esvelt km)、丘奇
·
gm(church gm),cas9作为多功能工具用于工程生物学(cas9 as a versatile tool for engineering biology),自然方法(nat methods),2013;10(10):957-63,pmid:24076990。12.捷雷
·
mm(jore mm)、伦德格伦
·
m(lundgren m)、范杜津e(van duijin e)、巴特玛jb(bultema jb)、韦斯特拉
·
er(westra er)、沃格梅尔sp(waghmare sp)、怀德亨福特b(wiedenheft b)、普勒
·
u(pul u)、武尔姆
·
r(wurm r)、瓦格纳
·
r(wagner r)、贝耶尔
·
mr(beijer mr)、芭瑞恩德瑞格特
·
a(barendregt a)、守k(shou k)、释倪德思ap(snijders ap)、迪克曼
·
mj(dickman mj)、杜德纳
·
ja(doudna ja)、博科玛ej(boekema ej)、黑克
·
aj(heck aj)、范德奥斯特
·
j(van der oost j)、布龙斯
·
sj(brouns sj),用于crispr rna指导的dna级联识别的结构基础(structural basis for crispr rna-guided dna recognition by cascade),自然结构分子生物学(nat struct mol biol),2011;18(5):529-36,pmid:21460843。13.霍瓦特
·
p(horvath p)、巴然勾r(barrangou r),细菌和古细菌的免疫系统crispr/cas,科学(science),2010;327(5962):167-70,pmid:20056882。14.怀德亨福特b(wiedenheft b)、斯腾伯格
·
sh(sternberg sh)、杜德纳
·
ja(doudna ja),细菌和古细菌中rna指导的基因沉默系统(rna-guided genetic silencing systems in bacteria and archaea),自然(nature),2012;482(7385):331-8,pmid:22337052。15.盖斯尤纳斯g(gasiunas g)、思科纳斯v(siksnys v),crispr系统的rna依赖性dna核酸内切酶cas9:基因组编辑的圣杯?(rna-dependent dna endonuclease cas9 of the crispr system:holy grail of genome editing?)趋势微生物学(trends microbiol),2013;21(11):562-7,pmid:24095303。16.齐
·
ls(qi ls)、拉尔森
·
mh(larson mh)、吉尔伯特
·
la(gilbert la)、杜德纳
·
ja(doudna ja)、韦斯曼
·
js(weissman js)、阿金
·
ap(arkin ap)、林
·
wa(lim wa),将crispr再利用为rna指导的平台以用于基因表达的序列特异性控制(repurposing crispr as an rna-guided platform for sequence-specific control of gene expression)细胞(cell),2013;152(5):1173-83,pmid:23452860。17.佩雷斯-皮涅拉
·
p(perez-pinera p)、高卡克
·
dd(kocak dd)、沃克雷cm(vockley cm)、阿德勒
·
af(adler af)、卡巴迪am(kabadi am)、皮拉斯特lr(polstein lr)、塔克雷pi(thakore pi)、格拉斯
·
ka(glass ka)、奥斯特罗特dg(ousterout dg)、梁
·
kw(leong kw)、归拉科f(guilak f)、克劳福德
·
ge(crawford ge)、雷迪
·
te(reddy te)、乔斯巴奇ca(gersbach ca),基于crispr-cas9的转录因子的rna指导的基因激活(rna-guided gene activation by crispr-cas9-based transcription factors),自然方法(nat methods),2013;10(10):973-6,pmid:23892895。18.马里
·
p(mali p)、阿赫
·
j(aach j)、斯特兰杰斯pb(stranges pb)、艾斯维特
km(esvelt km)、摩斯博纳m(moosburner m)、科索瑞s(kosuri s)、杨
·
l(yang l)、丘奇
·
gm(church gm),用于靶标特异性筛选的cas9转录激活因子与用于合作基因组工程化的配对切口酶(cas9transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering),自然生物技术(nat.biotechnol.)2013;31(9):833-8,pmid:23907171。19.吉尔伯特
·
la、拉尔森
·
mh、莫所特(morsut l)、刘
·
z、布拉尔
·
ga、托雷斯
·
se、施特恩-基纳萨n(stern-ginossar n)、布拉德曼o(brandman o)、怀特海德
·
eh、杜德纳
·
ja(doudna ja)、林
·
wa(lim wa)、韦斯曼
·
js(weissman js)、齐
·
ls(qi ls),真核生物中crispr介导的模块化的rna指导的转录调节(crispr-mediated modular rna-guided regulation of transcription in eukaryotes)细胞(cell),2013;154(2):442-51,pmid:23849981。20.拉尔森
·
mh、吉尔伯特
·
la、王
·
x(wang x)、林
·
wa(lim wa)、韦斯曼
·
js(weissman js)、齐
·
ls(qi ls),用于基因表达的序列特异性控制的crispr干扰(crispri)(crispr interference(crispri)for sequence-specific control of gene expression)自然实验手册(nat protoc),2013;8(11):2180-96,pmid:24136345。21.马里
·
p(mali p)、杨
·
l(yang l)、艾斯维特km(esvelt km)、阿赫
·
j(aach j)、古埃尔
·
m(guell m)、迪卡洛
·
je(dicarlo je)、诺维尔
·
je(norville je)、丘奇
·
gm(church gm),通过cas9进行rna指导的人类基因组工程(rna-guided human genome engineering via cas9),科学(science),2013;339(6121):823-6,pmid:23287722。22.科尔-斯特劳斯
·
a(cole-strauss a)、尹
·
k(yoon k)、向
·
y(xiang y)、伯恩
·
bc(byrne bc)、赖斯
·
mc(rice mc)、戈恩j(gryn j)、霍洛曼
·
wk(holloman wk)、柯麦科eb(kmiec eb),通过rna-dna寡核苷酸修正负责镰状细胞性贫血的突变(correction of the mutation responsible for sickle cell anemia by an rna-dna oligonucleotide),科学(science),1996;273(5280):1386-9,pmid:8703073。23.泰格拉克斯ad(tagalakis ad)、欧文js(owen js)、西蒙斯jp(simons jp),小鼠胚胎中rna-dna寡核苷酸(嵌合修复术)诱变活性的缺乏(lack of rna-dna oligonucleotide(chimeraplast)mutagenic activity in mouse embryos),分子繁殖与发育(mol reprod dev),2005;71(2):140-4,pmid:15791601。24.雷
·
a(ray a)、兰格
·
m(langer m),同源重组:最终作为手段(homologous recombination:ends as the means),趋势植物科学(trends plant sci),2002;7(10):435-40,pmid 12399177。25.布里特
·
ab(britt ab)、梅
·
gd(may gd),重新工程化的植物基因靶向(re-engineering plant gene targeting),趋势植物科学(trends plant sci),2003;8(2):90-5,pmid:12597876。26.瓦格纳
·
v(vagner v)、埃利希
·
md(ehrlich sd),同源dna重组的效率随着枯草杆菌染色体而变化(efficiency of homologous dna recombination varies along the bacillus subtilis chromosome),细菌学杂志(j bacteriol),1988;170(9):3978-82,pmid:3137211。27.萨利赫-戈哈里
·
n(saleh-gohari n)、赫拉德t(helleday t),保守同源重组
优选地修复人类细胞中的细胞周期s期的dna双链断裂(conservative homologous recombination preferentially repairs dna double-strand breaks in the s phase of the cell cycle in human cells),核酸研究(nucleic acids res),2004;32(12):3683-8,pmid:15252152。28.隆巴多
·
a(lombardo a)、吉诺维斯
·
p(genovese p)、博塞茹尔
·
cm(beausejour cm)、科莱奥尼
·
s(colleoni s)、李
·
yl(lee yl)、金
·
ka(kim ka)、安藤
·
d(ando d)、马尔诺夫
·
fd(urnov fd)、加利
·
c(galli c)、格雷戈里
·
pd(gregory pd)、福尔摩斯
·
mc(holmes mc)、纳蒂尼l(naldini l),在人类干细胞中使用锌指核酸酶和整合酶缺陷的慢病毒载体递送进行基因编辑(gene editing in human stem cells using zince finger nucleases and integrase-defective lentiviral vector delivery),自然生物技术(nat.biotechnol.)2007;25(11):1298-306,pmid:17965707。29.科迪赛罗sg(conticello sg),aid/apobec家族核酸增变基因(the aid/apobec family of nucleic acid mutators),基因组生物学(genome biol),2008;9(6):229,pmid:18598372。30.雷诺
·
ca(reynaud ca)、阿欧法齐s(aoufouchi s)、法伊利
·
a(faili a)、威尔
·
jc(weill jc),aid的角色是什么:增变基因或免疫球蛋白变位体的装配工?(what role for aid:mutator,or assembler of the immunoglobulin mutasome?)自然实免疫学(nat immunol),2003;4(7):631-8。31.巴格瓦特
·
as(bhagwat as),dna胞嘧啶脱氨酶:从抗体成熟至抗病毒防御(dna-cytosine deaminases:from antibody maturation to antiviral defense),dna修复(dna repair)(amst),2004;3(1):85-9,pmid:14697763。32.纳瓦拉特曼n(navaratnam n)、萨瓦尔
·
r(sarwar r),胞苷脱氨酶概述(an overview of cytidine deaminases),国际血液学杂志(int j hematol),2006;83(3):195-200,pmid:16720547。33.霍顿
·
lg(holden lg)、普罗赫诺
·
c(prochnow c)、常
·
yp(chang yp)、碧然斯德特r(bransteitter r)、切利科l(chelico l)、森
·
u(sen u)、史蒂文斯
·
rc(stevens rc)、古德曼
·
mf(goodman mf)、陈
·
xs(chen xs),抗病毒apobec3g催化结构域和功能意义的晶体结构(crystal structure of the anti-viral apobec3g catalytic domain and functional implications),自然(nature),2008;456(7218):121-4,pmid:18849968。34.切利科l、范
·
p(pham p)、皮特斯卡j(petruska j)、古德曼
·
mf(goodman mf),通过激活诱导胞苷脱氨酶和apobec3g对dna靶向的胞嘧啶脱氨作用发生应答的免疫学的和逆转录病毒的生化基础(biochemical basis of immunological and retroviral responses to dna-targeted cytosine deamination by activation-induced cytidine deaminase and apobec3g),生物化学杂志(j biol chem),2009;284(41):27761-5,pmid:19684020。35.范
·
p(pham p)、碧然斯德特r(bransteitter r)、古德曼
·
mf(goodman mf),奖励与风险:dna胞嘧啶脱氨酶引发免疫力和疾病(reward versus risk:dna cytidine deaminases triggering immunity and disease),生物化学(biochemistry),2005;44(8):2703-15,pmid15723516。
36.巴尔巴斯
·
cf(barbas cf)、金
·
dh(kim dh),胞苷脱氨酶融合物和相关方法(cytidine deaminase fusions and related methods),pct国际申请(pct int appl),2010;wo 2010132092 a2 20101118。37.陈
·
x(chen x)、扎罗
·
jl(zaro jl)、沈
·
wc(shen wc),融合蛋白连接体:性质、设计和功能(fusion protein linkers:property,design and functionality),先进药物输送评论(adv drug deliv rev),2013;65(10):1357-69,pmid:23026637。38.格柏
·
ap(gerber ap)、凯勒
·
w(keller w),通过碱基脱氨作用进行rna编辑:更多的酶,更多的靶标,新的奥秘(rna editing by base deamination:more enzymes,more targets,new mysteries),趋势生物化学科学(trends biochem sci),2001;26(6):376-84,pmid:11406411。39.袁
·
l(yuan l)、库莱克
·
i(kurek i)、英格里斯j(english j)、基南
·
r(keenan r),实验室定向蛋白进化(laboratory-directed protein evolution),微生物分子生物学评论(microbiol mol biol rev),2005;69(3):373-92,pmid:16148303。40.科布
·
re(cobb re)、孙
·
n(sun n)、赵
·
h(zhao h),定向进化——强大的合成生物学工具(directed evolution as a powerful synthetic biology tool),方法(methods),2013;60(1):81-90,pmid:22465795。41.博思坦s(bershtein s)、陶菲克
·
ds(tawfik ds),酶的实验室进化的进展(advances in laboratory evolution of enzymes),化学生物学新见(curr opin chem biol),2008;12(2):151-8,pmid:18284924。42.希达
·
k(hida k)、哈内斯
·
j(hanes j)、奥斯特梅尔m(ostermeier m),药物和核酸递送的定向进化(directed evolution for drug and nucleic acid delivery),先进药物输送评论(adv drug deliv rev),2007;59(15):1562-78,pmid:17933418。43.艾斯维特km(esvelt km)、卡尔森
·
jc(carlson jc)、刘
·
dr(liu dr),生物分子持续定向进化系统(a system for the continuous directed evolution of biomolecules),自然(nature),2011;472(7344):499-503,pmid:21478873。44.胡斯米y(husimi y),cellstat中噬菌体的选择与进化(selection and evolution of bacteriophages in cellstat),生物物理学进展(adv biophys),1989;25:1-43,pmid:2696338。45.瑞彻曼l(riechmann l)、霍利格
·
p(holliger p),tolac-末端结构域为大肠杆菌丝状噬菌体感染的辅助受体(the c-terminal domain of tola is the coreceptor for filamentous phage infection of e.coli),细胞(cell),1997;90(2):351-60,pmid:9244308。46.尼尔森fk(nelson fk)、弗里德曼sm(friedman sm)、史密斯gp(smith gp),丝状噬菌体dna克隆载体:基因iii中具有非极性删除的非感染性突变体(filamentous phage dna cloning vectors:a noninfective mutant with a nonpolar deletion in gene iii),病毒学(virology),1981;108(2):338-50,pmid:6258292。47.拉克杰克j(rakonjac j)、莫德尔p(model p),piii在丝状噬菌体组装中的作用(roles of piii in filamentous phage assembly),分子生物学杂志(j mol biol),1998;282(1):25-41。
48.史密斯gp(smith gp),丝状噬菌体融合:在病毒表面上显示克隆抗原的新颖表达载体(filamentous fusion phage:novel expression vectors that display cloned antigens on the virion surface),科学(science),1985;228(4705):1315-7,pmid:4001944。49.谢里登
·
c(sheridan c),基因治疗找到其合适的位置(gene therapy finds its niche),自然生物技术(nat.biotechnol.)2011;29(2):121-8,pmid:21301435。50.李jw(lee jw)、宋yh(soung yh)、金sy(kim sy)、李hw(lee hw)、帕克ws(park ws)、纳姆sw(nam sw)、金sh(kim sh)、李jy(lee jy)、柳nj(yoo nj)、李sh(lee sh),pik3ca基因通常在乳腺癌和肝癌中突变(pik3ca gene is frequently mutated in breast carcinomas and hepatocellular carcinomas),致癌基因(oncogene),2005;24(8):1477-80,pmid:15608678。51.伊科得彼on(ikediobi on)、戴维斯
·
h(davies h)、比格内尔
·
g(bignell g)、艾约瑟
·
s(edkins s)、史蒂文斯
·
c(stevens c)、欧米拉
·
s(o’meara s)、斯坦里乌斯t(santarius t)、阿维斯
·
t(avis t)、巴瑟彼s(barthorpe s)、布拉肯伯里l(brackenbury l)、巴克
·
g(buck g)、巴特勒
·
a(butler a)、克莱门茨
·
j(clements j)、科尔
·
j(cole j)、迪克斯
·
e(dicks e)、福布斯
·
s(forbes s)、格雷
·
k(gray k)、哈利迪
·
k(halliday k)、哈里森
·
r(harrison r)、希尔斯
·
k(hills k)、欣顿
·
j(hinton j)、亨特
·
c(hunter c)、詹金森
·
a(jenkinson a)、琼斯
·
d(jones d)、克斯弥渡v(kosmidou v)、勒格
·
r(lugg r)、孟席斯
·
a(menzies a)、米罗纳克t(mironenko t)、帕克
·
a(parker a)、佩里
·
j(perry j)、雷恩
·
k(raine k)、理查森
·
d(richardson d)、谢泼德
·
r(shepherd r)、斯莫尔
·
a(small a)、史密斯
·
r(smith r)、所罗门
·
h(solomon h)、斯蒂芬斯
·
p(stephens p)、缇阙j(teaque j)、托夫茨
·
c(tofts c)、范里安
·
j(varian j)、韦伯
·
t(webb t)、韦斯特
·
s(west s)、威达s(widaa s)、耶茨
·
a(yates a)、莱因霍尔德
·
w(reinhold w)、温斯坦
·
jn(weinstein jn)、斯特拉顿
·
mr(stratton mr)、福特瑞尔pa(futreal pa)、伍斯特
·
r(wooster r),在nci-60细胞系组的24个已知癌症基因的突变分析(mutation analysis of 24known cancer genes in the nci-60cell line set),分子癌症治疗学(mol cancer ther),2006;5(11):2606-12,pmid:17088437。
[0141]
本文,例如,在背景、概述、详细说明、实例、和/或参考文献部分提及的所有出版物、专利、专利申请、公布物、和数据库条目(例如,序列数据库条目)以其整体通过引用结合在此,如同每个单独的出版物、专利、专利申请、公布物和数据库条目被具体和单独地通过引用结合在此。在冲突存在的情况下,将以本技术(包括本文的任何定义)为准。等效物和范围
[0142]
本领域的技术人员仅仅使用常规实验就将认识到或能够确认本文描述的实施例的许多等效物。本披露的范围不旨在限制以上说明书,而是如在所附的权利要求书中所陈述的。
[0143]
冠词如“一个/种(a/an)”和“该/所述(the)”可以意为一个/种或多于一个/种,除非有相反的指明或另外从上下文明显可见。如果一组中一个、多于一个或全部成员存在,则在该组的两个或多个成员之间包括“或”的权利要求书或说明被认为是得到满足,除非有相反的指明或另外从上下文明显可见。在两个或多个组成员之间包括“或”的组的披露提供如
下实施例:其中恰好存在一个组成员的实施例,其中存在多于一个组成员的实施例,和其中存在所有组成员的实施例。出于简洁的目的,那些实施例在本文没有单独地讲出来,但是应当了解本文提供了这些实施例的每一个并且可以具体地要求或拒绝这些实施例中的每一个。
[0144]
应当理解的是,本发明涵盖将一个或多个权利要求项或说明书的一个或多个相关部分中的一个或多个限定、要素、条款、或说明性术语等引入另一权利要求项中的所有变化、组合和排列。例如,可以对从属于另一个权利要求的一个权利要求进行修改以便包括从属于同一基础权利要求的任何一个其他的权利要求中所发现的一个或多个限制。此外,在权利要求叙述组合物的情况下,但应当理解的是,根据本文披露的任何制造或使用的方法或根据本领域中已知的(如果存在)方法的制造或使用组合物的方法都包括在内,除非另有说明或者除非对于本领域的普通技术人员而言显然会产生矛盾或不一致性。
[0145]
在将要素呈现为列表的情况下,例如以马库什组形式,应当理解的是,这些要素的每个可能的亚组也被披露,并且任何要素或要素的亚组都可以从该组中去除。也应指出,名词“包含”旨在是开放的并且允许囊括另外的要素或步骤。应当理解的是,通常,在一个/种实施例、产物或方法被指包括特定元素、特征或步骤的情况下,也提供了由或基本上由这些元素、特征或步骤组成的实施例、产物或方法。出于简洁的目的,那些实施例在本文没有单独地讲出来,但是应当了解本文提供了这些实施例的每一个并且可以具体地要求或拒绝这些实施例中的每一个。
[0146]
在给出范围的情况下,包括端点。此外,应当理解的是,除非另作说明或另外从上下文和/或本领域的普通技术人员所理解的明显可见,在一些实施例中,表达为范围的值可以呈现为所陈述的范围内的任何具体值,至该范围的下限的单位十分之一,除非上下文另作清楚规定。出于简洁的目的,每个范围内的值在本文没有单独地讲出来,但是应当了解本文提供这些值的每一个并且可以具体地要求或拒绝这些值中的每一个。还应当理解的是,除非另作说明或另外从上下文和/或本领域的普通技术人员所理解的明显可见,表达为范围的值可以呈现为给定的范围内的任何亚范围,其中亚范围的端点以相同精确度被表达为该范围的下限单位的十分之一。
[0147]
另外,应当理解的是本发明的任何具体的实施例可以从任何一个或多个权利要求中明确排除。在范围被给定的情况下,范围内的任何值可以从任何一个或多个权利要求中明确排除。本发明的组合物和/或方法的任何实施例、元素、特征、应用或方面可以从任何一个或多个权利要求中排除。出于简洁的目的,本文没有明确陈述其中一个或多个元素、特征、目的或方面被排除的所有实施例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。