1.本发明属于生物医学技术领域,具体是一种预防与治疗肝细胞癌的基因调控方法。
背景技术:
2.肝癌是临床常见的恶性肿瘤之一,其死亡率在恶性肿瘤中排名第二。85%以上的肝癌为肝细胞癌,其病因涉及生活环境、饮食和遗传等多方面因素,尚无有效生物制剂可以预防。临床治疗手段包括手术、放疗、化疗、靶向药物、免疫治疗等。早期发现、早期诊断和早期治疗是临床治疗的关键因素。
技术实现要素:
3.为了更好的预防与治疗肝细胞癌,本发明提供了一种基于基因表达调控的技术,通过改变使用者体内cyp39a1基因的表达量,抑制肝细胞癌的发生和发展。cyp39a1基因编码一种代谢酶蛋白,属于细胞色素p450家族,是细胞色素p450的39家族的a亚家族成员1,参与药物和脂质代谢,未有报道其可预防和治疗肝细胞癌。
4.本发明提供了一种cyp39a1的基因表达调控方案,用于肝细胞癌的高危人群预防和患者的临床治疗。
5.所述基因表达调控是指通过基因表达载体运送基因表达相关元件进入目的器官和细胞,改变基因表达活动从而造成目的器官和细胞内相关蛋白质的数量改变。
6.所述基因表达载体可以是腺相关病毒和蛋白表达质粒载体。
7.所述基因表达相关元件可以是目的基因,通过表达载体而提高其表达。
8.所述目的基因可以是cyp39a1基因,通过提高其表达量而影响肿瘤发生发展。
9.所述基因表达相关元件也可以是基因表达的调控元件例如增强子或小rna等可以改变基因表达的调控分子。
10.本发明进一步提供了一种cyp39a1的基因表达调控技术,用于调控使用者体内cyp39a1的基因表达。
11.为实现以上目的,本发明提供了如下技术方案,可以抑制肝细胞癌的肿瘤细胞的活性,实现了调控使用者肝脏组织细胞内cyp39a1基因表达,并且产生对肝细胞癌的抑制作用,达到预防和治疗肝细胞癌的目的。
12.1.cyp39a1基因表达增高可以抑制肝细胞癌细胞系的活力
13.构建cyp39a1基因表达质粒,例如可以从invitrogen-cdna文库中挑取人源cyp39a1,通过pcr酶切连接构建p3xflag-cmv-14-cyp39a1表达质粒,转染入肝细胞癌细胞系增加其cyp39a1的基因表达。其过程如下。
14.(1)从invitrogen-cdna文库挑取克隆,摇菌过夜,提取质粒。
15.(2)设计带有酶切位点的引物,正向引物带有clai酶切位点,序列为5'-ccatcgatgccaccatggaactaatttccccaac-3',反向引物带有bamhi酶切位点,序列为5'-cgggatcctat
tctttgtttatattcaattcggca-3'。
16.(3)以(2)中的引物对(1)中得到的质粒进行pcr扩增反应,对反应产物进行琼脂糖凝胶电泳后,切胶回收pcr产物。
17.(4)以clai和bamhi内切酶对pcr产物和p3xflag-cmv-14载体进行酶切,酶切产物进行琼脂糖凝胶电泳后,切胶回收酶切产物,对其中的pcr产物和线性载体进行连接反应。
18.(5)将连接反应的产物转入dh5α工程细菌,挑选单克隆、提取质粒,进行pcr、酶切和测序验证。
19.(6)接种18万细胞至六孔板中,当密度大约在70%时,移除旧培养基,加入2毫升不含双抗的培养基,放回细胞培养箱。向两个1.5毫升离心管中各加入100微升opti-mem,然后分别加入1微克的p3xflag-cmv-14-cyp39a1和1微克的p3xflag-cmv-14(阴性对照),再各自加入2微升脂质体3000。轻柔混匀。
20.(7)另准备一个1.5毫升离心管,先后加入100微升opti-mem和3微升脂质体3000,轻柔混匀,室温静置5分钟。将其加入(6)中所得混合液,轻柔混匀,室温静置20分钟。
21.(8)从培养箱取出6孔板,将(7)中最终得到的混合液加入对应孔中,转染6小时更换为完全培养基,转染24小时。
22.(9)在肝细胞癌肿瘤细胞系中增加cyp39a1的表达后,可以明显抑制肿瘤细胞活力。
23.2.cyp39a1基因表达的转移系统与其对肝细胞癌的抑制
24.将cyp39a1的基因序列整合入“睡美人”转座系统(sleeping-beauty-transposon-system,简称sb),得到一个基因转移系统,可以将cyp39a1基因转移至宿主目标组织细胞内的基因组。该基因转移系统包括pt3-ef1α-cyp39a1和pcmv/sb两个质粒组成,其构建和使用如下。
25.(1)如附图6,目标载体(pt3-ef1α-致死基因)与入门载体(attr-目标基因-attr)通过lr重组反应获得表达载体pt3-ef1α-目标基因。使用cyp39a1作为目标基因,即获得cyp39a1的表达载体pt3-ef1α-cyp39a1。
26.(2)pcmv/sb质粒通过cmv启动子驱动sb转座酶的表达,对小鼠高压尾静脉共注射pcmv/sb和pt3-ef1α-cyp39a1,可将pt3载体上ef1α驱动的目标基因cyp39a1整合到肝细胞基因组染色体上,从而增加肝细胞cyp39a1的表达。
27.(3)整合了c-myc基因的“睡美人”转座系统可以在小鼠体内诱发肝细胞癌,其表达载体为pt3-ef1α-c-myc。pt3-ef1α-ct为对照表达载体,在实验中可以作为空白对照。pt3-ef1α-mcl1表达载体中包含了抗凋亡基因mcl1,可以与pt3-ef1α-c-myc共同使用,增强其诱发肝细胞癌的效率。
28.(4)采用不同的表达载体混合,具体混合分组和其中表达载体的剂量如下:
29.a.pt3-ef1α-c-myc(4微克) pt3-ef1α-ct(12微克) pcmv/sb(0.64微克)
30.b.pt3-ef1α-c-myc(4微克) pt3-ef1α-cyp39a1(12微克) pcmv/sb(0.64微克)
31.c.pt3-ef1α-c-myc(4微克) pt3-ef1α-mcl1(4微克) pt3-ef1α-ct(12微克) pcmv/sb(0.8微克)
32.d.pt3-ef1α-c-myc(4微克) pt3-ef1α-mcl1(4微克) pt3-ef1α-cyp39a1(12微克) pcmv/sb(0.8微克)
33.(5)通过小鼠尾静脉高压注射将表达载体注入小鼠体内。提前无菌环境下配置质粒混合液,经物品传递窗进行照射后带入动物房。对6周龄fvb小鼠进行异氟烷吸入麻醉,用55℃左右的热水对小鼠尾巴进行预热处理,使小鼠尾静脉扩张,5毫升针筒配0.45毫米针头,按照10%的小鼠体重计算混合液体积,5-7秒内将质粒混合液完全注射进去。
34.(6)(4)中不同的表达载体混合注射后在小鼠体内呈现不同的生物效应,包括不同程度的诱发肝细胞癌和抑制肝细胞癌。分组a可以在小鼠体内诱发肝细胞癌,分组c加入了抗凋亡因子mcl1基因,其诱发肝细胞癌的能力比分组a更强。分组b将分组a中的对照质粒pt3-ef1α-ct更换为pt3-ef1α-cyp39a1,对肝细胞癌的发生和发展产生了抑制作用。分组d将分组c中的对照质粒pt3-ef1α-ct更换为pt3-ef1α-cyp39a1,对肝细胞癌的发生和发展产生抑制作用。
35.3.cyp39a1基因表达的腺相关病毒系统与其对肝细胞癌的抑制
36.aav8腺相关病毒可以特异地使基因在肝脏高效表达,制备携带cyp39a1基因的腺相关病毒可以特异性的增加cyp39a1基因在肝细胞中的表达。其制备过程如下。
37.(1)构建aav-tbg-cyp39a1表达载体,将cyp39a1基因连接在aav-tbg质粒中,并准备aav-tbg-gfp表达载体作为实验的阴性对照。
38.(2)使用aav8血清型包被质粒(repcap)和腺相关辅助质粒(delta f6 helper)及(1)中表达载体包被病毒。接种1200万细胞至15厘米细胞培养皿,当细胞汇合度约80%时,准备转染实验,移除旧培养基,加入15毫升dmem(无血清)培养基,按照既定用量准备cyp39a1转染混合液,包括70微克repcap、200微克delta f6 helper、70微克aav-tbg-cyp39a1、1300微升pei max40000、1000微升无血清dmem细胞培养基;按照既定用量准备阴性对照转染混合液,包括70微克repcap、200微克delta f6 helper、70微克aav-tbg-gfp、1300微升pei max40000、1000微升无血清dmem细胞培养基。将转染混合液轻柔混匀后,室温静置20分钟。然后将转染混合液加入15厘米细胞培养皿中,轻柔晃动细胞培养皿以混匀。转染24小时后,补加15毫升含0.5%fbs的无抗dmem培养基,48小时后收集病毒:上清和沉淀收集至数个50毫升离心管,1000转4℃离心10分钟沉淀细胞,然后使用20毫升pbs重悬沉淀,移液枪轻柔重悬合并在两个15毫升离心管中,1000转4℃离心10分钟,去除上清,使用5毫升细胞裂解液重悬沉淀合并至一个15毫升离心管,储存在-80℃。处理沉淀:将沉淀从-80℃取出,液氮和37℃水浴锅反复冻融至少三次(确保每次冷冻及溶解完全),加入1摩尔/升mgcl2,使终浓度为1毫摩尔/升,加入25ku/毫升核酸酶,使终浓度为250u/毫升,上下颠倒轻柔混匀。37℃水浴15分钟,每5分钟混匀一次,4000转4℃离心30分钟,将上清转移至新的15毫升离心管中,置于冰上。
39.(3)纯化病毒。用10毫升针筒,外接输液管,从optiseal管底部依次缓慢加入6毫升17%碘克沙醇密度梯度溶液,6毫升25%碘克沙醇密度梯度溶液,5毫升40%碘克沙醇密度梯度溶液,4毫升60%碘克沙醇密度梯度溶液,将病毒上清液轻轻加在顶部,其余用细胞裂解液补充(保证已达到密闭效果),50000转14℃离心3小时,收集病毒:在40%碘克沙醇密度梯度下界面和60%碘克沙醇密度梯度溶液上界面表面,18g针头连接10毫升针筒斜面朝上,刺穿插入,打开optiseal管的瓶盖,收集约3毫升40%碘克沙醇密度梯度溶液。激活100k超滤管:添加5毫升包含10-4
f188的1xpbs,3500转4℃离心5分钟,将所收集病毒加入激活后的100k超滤管中,用包含10-4
f188的1xpbs填满,轻柔混匀,3500转4℃离心20分钟。丢弃滤出
液,重新填充10-4
f188的1xpbs,离心并丢弃掉。再用1xpbs重复三次,浓缩病毒至2-3毫升。添加80%甘油至最终浓度为5%,分装储存在-80℃冰箱,留5微升病毒通过定量pcr(qpcr)方法滴定病毒。
40.(4)滴定病毒。基于构建的aav载体信息设计一对特异引物,制作标准样品。制备5个梯度稀释的标准样品(1:10),计算dna拷贝数的公式如附图17所示。制备病毒样品:5微升病毒 5微升10xdna酶缓冲液 2微升dna酶 38微升双蒸水,混匀后37℃孵育15分钟,接着转移至95℃处理10分钟。添加2微升蛋白酶k(10毫克/毫升) 5微升10xdna酶缓冲液 43微升双蒸水,混匀后,37℃孵育15分钟,接着转移至95℃处理10分钟,接着用sybr green定量pcr方法定量,最终实际的滴度是计算出来的20倍(因为病毒样品制作过程进行了5:100的稀释)。
41.(5)c-myc和mcl1基因表达载体诱发小鼠肝细胞癌。对6周龄fvb小鼠进行异氟烷吸入麻醉,55℃左右热水对小鼠尾巴进行预热处理,使小鼠尾静脉扩张,5毫升针筒配0.45毫米针头,按照小鼠体重10%计量,5-7秒将质粒混合液完全注射进去。具体质粒使用剂量为:pt3-ef1α-c-myc(4微克) pt3-ef1α-mcl1(4微克) pcmv/sb(0.32微克)。一般38天可以在小鼠肝脏形成肉眼明显可见的肿瘤结节。
42.(6)aav8-tbg-cyp39a1病毒抑制c-myc和mcl1基因表达诱发小鼠肝细胞癌。以c-myc和mcl1基因表达载体诱发肝细胞癌,于高压尾静脉注射表达载体的第30天,提前无菌环境下准备好aav8-tbg-gfp和aav8-tbg-cyp39a1病毒,经物品传递窗进行照射后带入动物房。对小鼠进行异氟烷吸入麻醉,55℃左右热水对小鼠尾巴进行预热处理,使小鼠尾静脉扩张,1毫升针吸取100-200微升包含1x10
11
病毒颗粒,匀速从尾静脉推入病毒,整理好所有物品,小鼠放归原处。与aav8-tbg-gfp病毒阴性对照相比,aav8-tbg-cyp39a1能够明显延长小鼠的存活时间。
43.(7)二甲基亚硝胺(den)和四氯化碳(ccl4)组合诱发小鼠肝细胞癌。使用c57bl雄鼠,在小鼠出生第12天,腹腔注射20毫克den每千克体重。从第35天开始腹腔注射1毫升ccl4每千克体重,每周一次,共计注射17次ccl4。
44.(8)aav8-tbg-cyp39a1病毒抑制二甲基亚硝胺(den)和四氯化碳(ccl4)诱发小鼠肝细胞癌。于肝细胞癌模型建立的第45天时,即尚未观察到肿瘤结节时,尾静脉注射1x10
11
病毒颗粒的aav8-tbg-gfp或者aav8-tbg-cyp39a1病毒。与aav8-tbg-gfp病毒阴性对照相比,aav8-tbg-cyp39a1病毒能够明显抑制肿瘤结节的数目和大小。
45.与现有技术对比,本发明具备以下有益效果:
46.1.提供一种可以抑制肝细胞癌发生的基因调控方法,用于预防使用者发生肝细胞癌。
47.2.提供一种可以抑制肝细胞癌进展的基因调控方法,用于控制使用者体内的肝细胞癌的进展,延长患癌个体的生存期、延缓肿瘤的进展与恶化。
48.3.提供一种特异性针对肝脏组织的腺相关病毒调控cyp39a1的方法,避免潜在的对其他组织器官的伤害。
49.4.本发明基于调控正常存在的生理基因表达而预防治疗肝细胞癌,不改变生理基因的序列,不产生遗传性的基因改变。
附图说明
50.图1为实施例1中huh7细胞中增加cyp39a1基因表达后huh7细胞活力的结果。
51.图2为实施例1中hlf细胞中增加cyp39a1基因表达后hlf细胞活力的结果。
52.图3为实施例2中对比cyp39a1敲减组和阴性对照组的裸鼠皮下注射huh7细胞的成瘤能力。
53.图4为实施例2中对比cyp39a1敲减组和阴性对照组的裸鼠皮下注射huh7细胞的成瘤的肿瘤大小。
54.图5为实施例2中对比cyp39a1敲减组和阴性对照组的裸鼠皮下注射huh7细胞的成瘤的肿瘤发生率。
55.图6为显示实施例3中目标载体(pt3-ef1α-致死基因)和入门载体(attr-目标基因-attr)通过lr重组反应获得表达载体pt3-ef1α-目标基因。
56.图7为实施例3中高压尾静脉注射介导“睡美人”系统在小鼠肝脏表达c-myc癌基因诱导肝细胞癌的示意图。
57.图8为实施例3中分组a(对照)与分组b(表达cyp39a1)诱发肝细胞癌实验结果的解剖对比图片。
58.图9为实施例3中分组a(对照)与分组b(表达cyp39a1)诱发肝细胞癌实验中肿瘤发生率的对比。
59.图10为实施例3中分组a(对照)与分组b(表达cyp39a1)诱发肝细胞癌实验中肝体比的对比。
60.图11为实施例3中分组a(对照)与分组b(表达cyp39a1)诱发肝细胞癌实验中肿瘤数目的对比。
61.图12为实施例3中分组a(对照)与分组b(表达cyp39a1)诱发肝细胞癌实验中肿瘤直径的对比。
62.图13为实施例3中分组c(对照)与分组d(表达cyp39a1)诱发肝细胞癌实验结果的解剖对比图片。
63.图14为实施例3中分组c(对照)与分组d(表达cyp39a1)诱发肝细胞癌实验中肝体比的对比。
64.图15为实施例3中分组c(对照)与分组d(表达cyp39a1)诱发肝细胞癌实验中肿瘤数目的对比。
65.图16为实施例3中分组c(对照)与分组d(表达cyp39a1)诱发肝细胞癌实验中肿瘤直径的对比。
66.图17为实施例4中aav8病毒滴定时dna拷贝数的计算公式。
67.图18为实施例4中c-myc小鼠肝细胞癌模型中aav8-tbg-gfp和aav8-tbg-cyp39a1处理的肿瘤负荷对比。
68.图19为实施例4中c-myc小鼠肝细胞癌模型中aav8-tbg-gfp和aav8-tbg-cyp39a1处理的总存活率差异。
69.图20为实施例4中观测二甲基亚硝胺(den)和四氯化碳(ccl4)小鼠肝细胞癌模型中aav8-tbg-gfp和aav8-tbg-cyp39a1处理的解剖差异。
70.图21为实施例4中二甲基亚硝胺(den)和四氯化碳(ccl4)小鼠肝细胞癌模型中
aav8-tbg-gfp和aav8-tbg-cyp39a1处理的肿瘤数目的差异。
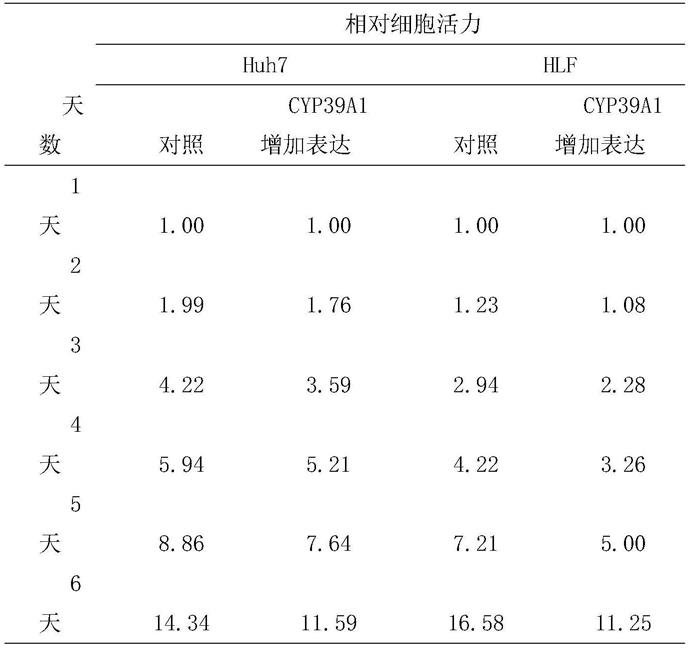
71.图22为实施例4中二甲基亚硝胺(den)和四氯化碳(ccl4)小鼠肝细胞癌模型中aav8-tbg-gfp和aav8-tbg-cyp39a1处理的肿瘤直径的差异。
具体实施方式
72.基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。此处提供以下具体实施例。
73.实施例1.cyp39a1基因表达增高对肝细胞癌细胞系的肿瘤细胞活力的影响
74.从invitrogen-cdna文库中挑取人源cyp39a1,通过pcr酶切连接构建p3xflag-cmv-14-cyp39a1,分别转染入肝细胞癌细胞系huh7和hlf,增加其cyp39a1的基因表达。其过程如下。
75.(1)从invitrogen-cdna文库挑取克隆,摇菌过夜,提取质粒。
76.(2)设计带有酶切位点的引物,正向引物带有clai酶切位点,序列为5'-ccatcgatgccaccatggaactaatttccccaac-3',反向引物带有bamhi酶切位点,序列为5'-cgggatcctattctttgtttatattcaattcggca-3'。
77.(3)以(2)中的引物对(1)中得到的质粒进行pcr扩增反应,对反应产物进行琼脂糖凝胶电泳后,切胶回收pcr产物。
78.(4)以clai和bamhi内切酶对pcr产物和p3xflag-cmv-14载体进行酶切,酶切产物进行琼脂糖凝胶电泳后,切胶回收酶切产物,对其中的pcr产物和线性载体进行连接反应。
79.(5)将连接反应的产物转入dh5α工程细菌,挑选单克隆、提取质粒,进行pcr、酶切和测序验证。
80.(6)接种18万细胞至六孔板中,当密度大约在70%时,移除旧培养基,加入2毫升不含双抗的培养基,放回细胞培养箱。向两个1.5毫升离心管中各加入100微升opti-mem,然后分别加入1微克的p3xflag-cmv-14-cyp39a1和1微克的p3xflag-cmv-14(对照质粒),再各自加入2微升脂质体3000。轻柔混匀。
81.(7)另准备一个1.5毫升离心管,先后加入100微升opti-mem和3微升脂质体3000,轻柔混匀,室温静置5分钟。将其加入(6)中所得混合液,轻柔混匀,室温静置20分钟。
82.(8)从培养箱取出6孔板,将(7)中最终得到的混合液加入对应孔中,转染6小时更换为完全培养基,转染24小时。
83.(9)在两个细胞系质粒过表达cyp39a1,明显抑制细胞增殖能力。如附图1所示,在huh7细胞系过表达带有标签的cyp39a1基因,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(mtt)实验检测1至6天的吸光值,对比第1天读数反映当天总细胞活力值。采用双因素方差分析,对照组(实线)的细胞活力显著高于cyp39a过表达组(虚线)细胞活力,p值小于0.001,具有显著统计学差异,原始数据见表1。
84.(10)如附图2所示,在hlf细胞系过表达带有标签的cyp39a1基因,mtt实验检测1至6天的吸光值,对比第1天读数反映当天总细胞活力值。采用双因素方差分析,对照组(实线)的细胞活力显著高于cyp39a过表达组(虚线)细胞活力,p值小于0.001,具有显著统计学差异,原始数据见表1。
85.实施例2.cyp39a1基因表达降低对裸鼠皮下种植肝细胞癌肿瘤细胞的影响
86.利用针对cyp39a1基因的sirna,转染肝细胞癌细胞系huh7细胞,随后在裸鼠进行皮下种植肿瘤细胞,发现敲减cyp39a1能够明显缩短肿瘤出现时间、提高肿瘤发生率及加快肿瘤生长。其过程如下。
87.(1)接种80万细胞至10厘米培养皿中。
88.(2)细胞密度大约在70%时,移除旧培养基,加入9毫升不含双抗的培养基,放回细胞培养箱。
89.(3)向三个1.5毫升离心管中各加入500微升opti-mem,然后分别加入两种不同的针对cyp39a1基因的sirna1号、sirna2号和阴性对照,使其终浓度为10纳摩尔每升,轻柔混匀。sirna1号的序列为gaaaccgaatgacctttgt,sirna2号的序列为cagtcacagtgaatatgct。
90.(4)另准备一个1.5毫升离心管,先后加入500微升opti-mem和20微升脂质体3000,轻柔混匀,室温静置5分钟。
91.(5)将脂质体3000混合液加至sirna混合液中,轻柔混匀,室温静置20分钟后将液体加入10厘米培养皿中,培养24小时。
92.(6)使用胰酶消化转染后的细胞,以培养基中和并pbs清洗两次后,使用pbs悬浮细胞,细胞浓度为1000万/毫升,和matrigel一起放置冰上,经物品传递窗照射后带入动物房。按照1:1体积将细胞液和matrigel混匀,每只balb/c裸鼠左右后肢皮下各注射200微升混合液。一星期后每隔三天记录小鼠肿瘤发生情况、肿瘤最大直径和最小直径,当肿瘤大小影响小鼠行动时,结束实验。
93.(7)如附图3所示,阴性对照组和cyp39a1敲减组的细胞种植在balb/c裸鼠的皮下组织,自左向右分别为对照组、cyp39a1敲减组1(sirna1号)和组2(sirna2号)的动物图片,敲减组的小鼠皮下明显形成了更多的肿瘤。
94.(8)如附图4所示,分别比较阴性对照组(黑色实线 黑点)与cyp39a1敲减组1(黑色虚线 黑点)和敲减组2(灰色实线 白点)肿瘤形成大小的差异,采用双因素方差分析,p值均小于0.001,具有显著统计学差异,原始数据见表2。说明敲减cyp39a1造成了显著增大的肿瘤结节。
95.(9)如附图5所示,分别比较阴性对照组(黑色实线)与cyp39a1敲减组1(黑色虚线)和敲减组2(灰色实线)肿瘤发生率的差异,采用对数秩和检验,p值分别小于0.05和0.01,具有显著统计学差异,原始数据见表3。说明敲减cyp39a1显著提高了实验动物的肿瘤发生率。
96.实施例3.cyp39a1基因表达的转移系统与其对肝细胞癌的抑制
97.将cyp39a1的基因序列整合入“睡美人”转座系统(sleeping beauty transposon system,简称sb),得到一个基因转移系统,可以将cyp39a1基因转移至宿主目标组织细胞内的基因组。该基因转移系统包括pt3-ef1α-cyp39a1和pcmv/sb两个质粒组成,其构建和使用如下。
98.(1)如附图6,通过目标载体(pt3-ef1α-致死基因)与入门载体(attr-目标基因-attr)通过lr重组反应获得表达载体pt3-ef1α-目标基因。使用cyp39a1作为目标基因,即获得cyp39a1的表达载体pt3-ef1α-cyp39a1。
99.(2)pcmv/sb质粒通过cmv启动子驱动sb转座酶的表达,对小鼠高压尾静脉共注射pcmv/sb和pt3-ef1α-cyp39a1,可将pt3载体上ef1α驱动的目标基因cyp39a1整合到肝细胞基因组染色体上,从而增加肝细胞cyp39a1的表达。
100.(3)整合了c-myc基因的“睡美人”转座系统可以在小鼠体内诱发肝细胞癌,如附图7所示高压尾静脉介导“睡美人”系统在肝脏过表达癌基因诱导肝细胞癌,此为本实施例的c-myc小鼠肝细胞癌模型。其表达载体为pt3-ef1α-c-myc。pt3-ef1α-ct为对照表达载体,在实验中可以作为阴性对照。pt3-ef1α-mcl1表达载体中包含了抗凋亡基因mcl1,可以与pt3-ef1α-c-myc共同使用,增强其诱发肝细胞癌的效率。
101.(4)采用不同的表达载体混合,具体混合分组和其中表达载体的剂量如下。
102.a.pt3-ef1α-c-myc(4微克) pt3-ef1α-ct(12微克) pcmv/sb(0.64微克)
103.b.pt3-ef1α-c-myc(4微克) pt3-ef1α-cyp39a1(12微克) pcmv/sb(0.64微克)
104.c.pt3-ef1α-c-myc(4微克) pt3-ef1α-mcl1(4微克) pt3-ef1α-ct(12微克) pcmv/sb(0.8微克)
105.d.pt3-ef1α-c-myc(4微克) pt3-ef1α-mcl1(4微克) pt3-ef1α-cyp39a1(12微克) pcmv/sb(0.8微克)
106.(5)小鼠尾静脉高压注射表达载体的方法是:提前无菌环境下配置好质粒混合液,经物品传递窗进行照射后带入动物房。对6周龄fvb小鼠进行异氟烷吸入麻醉,55℃左右的热水对小鼠尾进行预热处理,使小鼠尾静脉扩张,5毫升针筒配0.45毫米针头,按照10%的小鼠体重计算混合液体积,5-7秒将质粒混合液完全注射进去。
107.(6)(4)中不同的表达载体混合注射后在小鼠体内呈现不同的生物效应,包括不同程度的诱发肝细胞癌和抑制肝细胞癌。分组a可以在小鼠体内诱发肝细胞癌,分组c加入了抗凋亡因子mcl1基因,其诱发肝细胞癌的能力比分组a更强。分组b将分组a中的对照质粒pt3-ef1α-ct更换为pt3-ef1α-cyp39a1,对肝细胞癌的发生和发展产生了抑制作用。分组d将分组c中的对照质粒pt3-ef1α-ct更换为pt3-ef1α-cyp39a1,对肝细胞癌的发生和发展产生抑制作用。
108.(7)在高压尾静脉注射60天后,分组a中小鼠有63.6%的小鼠形成了肿瘤,分组b中小鼠仅有40%小鼠形成了肿瘤。如附图8所示,通过解剖图片直接观测两组肿瘤形成的不同,分组b(表达cyp39a1)中的小鼠肝脏明显形成更少的肿瘤结节。如附图9所示,分组a和分组b中的肿瘤发生率明显不同,分组a中11只小鼠中有7只小鼠出现肿瘤,分组b中10只小鼠仅有4只小鼠出现肿瘤。如附图10所示,分组b(表达cyp39a1)中肝体比显著小于分组a(对照组),采用非配对t-test检验,p值小于0.05,具有显著统计学差异,原始数据见表4。如附图11所示,分组b(表达cyp39a1)中肝脏肿瘤数目显著少于分组a(对照组),采用非配对t-test检验,p值小于0.05,具有显著统计学差异,原始数据见表4。如附图12所示,分组b(表达cyp39a1)中肝脏肿瘤直径显著小于分组a(对照组),采用非配对t-test检验,p值小于0.05,具有显著统计学差异,原始数据见表4。结果说明cyp39a1的表达明显抑制c-myc诱导肝细胞癌的发生和发展。
109.(8)分组c中在c-myc的基础上添加了抗凋亡基因mcl1,共注射38天后,所有小鼠均出现明显的腹部肿大,而作为对比,分组d中8只鼠仅有1只出现明显的腹部肿大。因此,在38天时,对照组(分组c)所有小鼠进行安乐死后获取组织样本,cyp39a1组(分组d)则是从38天开始每周取出两只疑似存在肿瘤的小鼠,进行安乐死后获取组织。如附图13所示,通过解剖图片直接观测两组肿瘤形成的不同,cyp39a1组的小鼠肝脏明显形成更少的肿瘤结节。如附图14所示,cyp39a1组的肝体比明显小于对照组。如附图15所示,cyp39a1组的肝脏肿瘤数目
明显少于对照组。如附图16所示,cyp39a1组的肝脏肿瘤直径明显小于对照组。结果说明cyp39a1明显延迟或者阻断了c-myc和mcl1诱导肝细胞癌的产生。
110.(9)综上可得,cyp39a1的基因表达在c-myc诱导的肝细胞癌模型中,具有非常强的肿瘤抑制功能。
111.实施例4.cyp39a1基因表达的腺相关病毒系统与其对肝细胞癌的抑制
112.aav8腺相关病毒可以特异地使基因在肝脏高效表达,制备携带cyp39a1基因的腺相关病毒可以特异性的增加cyp39a1基因在使用者肝细胞中的表达。其制备过程如下。
113.(1)构建aav-tbg-cyp39a1表达载体,将cyp39a1基因连接在aav-tbg质粒中,并准备aav-tbg-gfp表达载体作为实验对照。相关技术细节公开于文献和商业产品说明中,本领域技术人员可以轻易获取相关技术细节。
114.(2)使用aav8血清型包被质粒(repcap)和腺相关辅助质粒(delta f6 helper)及(1)中表达载体包被病毒。接种1200万细胞至15厘米细胞培养皿,当细胞汇合度约80%时,准备转染实验,移除旧培养基,加入15毫升dmem(无血清)培养基,按照既定用量准备cyp39a1转染混合液,包括70微克repcap、200微克delta f6 helper、70微克aav-tbg-cyp39a1、1300微升pei max40000、1000微升无血清dmem细胞培养基;按照既定用量准备gfp对照转染混合液,包括70微克repcap、200微克delta f6 helper、70微克aav-tbg-gfp、1300微升pei max40000、1000微升无血清dmem细胞培养基。将转染混合液轻柔混匀后,室温静置20分钟。然后将转染混合液加入15厘米细胞培养皿中,轻柔晃动细胞培养皿以混匀。转染24小时后,补加15毫升含0.5%fbs的无抗生素dmem培养基,48小时后收集病毒:上清和沉淀收集至数个50毫升离心管,1000转4℃离心10分钟沉淀细胞,然后使用20毫升pbs重悬沉淀,移液枪轻柔重悬合并在两个15毫升离心管中,1000转4℃离心10分钟,去除上清,使用5毫升细胞裂解液重悬沉淀合并至一个15毫升离心管,储存在-80℃。处理沉淀:将沉淀从-80℃取出,液氮和37℃水浴锅反复冻融至少三次(确保每次冷冻及溶解完全),加入1摩尔每升mgcl2,使终浓度为1毫摩尔每升,加入25ku/毫升核酸酶,使终浓度为250u/毫升,上下颠倒轻柔混匀。37℃水浴15分钟,每5分钟混匀一次,4000转4℃离心30分钟,将上清转移至新的15毫升离心管中,置于冰上。
115.(3)纯化病毒。用10毫升针筒,外接输液管,从optiseal管底部依次缓慢加入6毫升17%碘克沙醇密度梯度溶液,6毫升25%碘克沙醇密度梯度溶液,5毫升40%碘克沙醇密度梯度溶液,4毫升60%碘克沙醇密度梯度溶液,将病毒上清液轻轻加在顶部,其余用细胞裂解液补充(保证已达到密闭效果),50000转14℃离心3小时,收集病毒:在40%碘克沙醇密度梯度下界面和60%碘克沙醇密度梯度溶液上界面表面,18g针头连接10毫升针筒斜面朝上,刺穿插入,打开optiseal管的瓶盖,收集约3毫升40%碘克沙醇密度梯度溶液。激活100k超滤管:添加5毫升包含10-4
f188的1xpbs,3500转4℃离心5分钟,将所收集病毒加入激活后的100k超滤管中,用包含10-4
f188的1xpbs填满,轻柔混匀,3500转4℃离心20分钟。丢弃滤出液,重新填充10-4
f188的1xpbs,离心并丢弃掉。再用1xpbs重复三次,浓缩病毒至2-3毫升。添加80%甘油至最终浓度为5%,分装储存在-80℃冰箱,留5微升病毒通过定量pcr(qpcr)方法滴定病毒。
116.(4)滴定病毒。基于构建的aav载体信息设计一对特异引物,制作标准样品。制备5个梯度稀释的标准样品(1:10),计算dna拷贝数的公式如附图17所示。制备病毒样品:5微升
病毒 5微升10xdna酶缓冲液 2微升dna酶 38微升双蒸水,混匀后37℃孵育15分钟,接着转移至95℃处理10分钟。添加2微升蛋白酶k(10毫克/毫升) 5微升10xdna酶缓冲液 43微升双蒸水,混匀后,37℃孵育15分钟,接着转移至95℃处理10分钟,接着用sybr green定量pcr方法定量,最终实际的滴度是计算出来的20倍(因为病毒样品制作过程进行了5:100的稀释)。
117.(5)c-myc和mcl1基因表达载体诱发小鼠肝细胞癌,此为本实施例的c-myc小鼠肝细胞癌模型。对6周龄fvb小鼠进行异氟烷吸入麻醉,55℃左右热水对小鼠尾巴进行预热处理,使小鼠尾静脉扩张,5毫升针筒配0.45毫米针头,按照小鼠体重10%计量,5-7秒将质粒混合液完全注射进去。具体质粒使用剂量为:pt3-ef1α-c-myc(4微克) pt3-ef1α-mcl1(4微克) pcmv/sb(0.32微克)。注射38天后,所有的小鼠肝脏均形成了多个肉眼可见的结节。
118.(6)本实施例的病毒注射方法如下。以c-myc和mcl1基因表达载体诱发肝细胞癌,于高压尾静脉注射表达载体的第30天,提前无菌环境下准备好aav8-tbg-gfp和aav8-tbg-cyp39a1病毒,经物品传递窗进行照射后带入动物房。对小鼠进行异氟烷吸入麻醉,55℃左右热水对小鼠尾巴进行预热处理,使小鼠尾静脉扩张,1毫升针吸取100-200微升包含1x10
11
病毒颗粒,匀速从尾静脉推入病毒,整理好所有物品,小鼠放归原处。
119.(7)在c-myc/mcl1高压尾静脉注射30天后,尾静脉注射aav8-tbg-gfp作为对照组(5只小鼠),aav8-tbg-cyp39a1作为实验组(6只小鼠)。结果表明,与aav8-tbg-gfp病毒对照相比,aav8-tbg-cyp39a1能够明显延长小鼠的存活时间。如附图18所示,对照组所有小鼠因为肿瘤的负担陆续死亡,在61天时aav8-tbg-gfp组仅剩余一只小鼠,且腹部明显肿大,其于第62天死亡,70天时aav8-tbg-cyp39a1组小鼠尚有3只小鼠,其中一只腹部稍微鼓起,另外两只腹部无明显隆起。如附图19所示,aav8-tbg-cyp39a1组小鼠总存活率显著高于aav8-tbg-gfp组,采用对数秩和检验,p值小于0.05,具有显著统计学差异,原始数据见表5。
120.(8)二甲基亚硝胺(den)和四氯化碳(ccl4)组合诱发小鼠肝细胞癌,此为本实施例的den-ccl4小鼠肝细胞癌模型。使用c57bl雄鼠,在小鼠出生第12天,腹腔注射20毫克den每千克体重。从第35天开始腹腔注射1毫升ccl4每千克体重,每周一次,共计注射17次ccl4。第22周对小鼠进行安乐死,收取肝脏组织,记录小鼠体重与肝重及肿瘤发生和恶性情况,拍照保存数据。
121.(9)于二甲基亚硝胺(den)和四氯化碳(ccl4)诱发的小鼠肝细胞癌模型建立的第45天时,尾静脉注射1x10
11
病毒颗粒的aav8-tbg-gfp或者aav8-tbg-cyp39a1病毒。如附图20的解剖图片所示,与aav8-tbg-gfp病毒对照相比,aav8-tbg-cyp39a1病毒能够明显抑制肿瘤结节的数目和大小。如附图21所示,aav8-tbg-cyp39a1组小鼠的肝脏肿瘤数目显著小于aav8-tbg-gfp组,采用非配对t-test检验,p值小于0.01,具有显著统计学差异,原始数据见表6。如附图22所示,aav8-tbg-cyp39a1组小鼠的肿瘤直径显著小于aav8-tbg-gfp组,采用非配对t-test检验,p值小于0.001,具有显著统计学差异,原始数据见表6。
122.基因表达调控是指通过基因表达载体运送基因表达相关元件进入目的器官和细胞,改变基因表达量从而造成目的器官和细胞内相关蛋白质的数量改变,基因表达载体可以是腺相关病毒,基因表达相关元件可以是目的基因,通过表达载体而提高其表达。
123.需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖
非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
124.尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
125.表1实施例1中在huh7和hlf细胞中过表达cyp39a1后的肿瘤细胞活力
[0126][0127]
表2实施例2中不同组中肿瘤大小的差异
[0128]
[0129][0130]
表3实施例2中不同组中肿瘤数目的差异
[0131][0132]
表4实施例3中各个分组中小鼠肿瘤的发生情况
[0133]
[0134][0135]
表5实施例4中aav8-tbg-gfp和aav8-tbg-cyp39a1分组中小鼠存活情况
[0136][0137]
表6实施例4中aav8-tbg-gfp和aav8-tbg-cyp39a1分组中小鼠肝组织的肿瘤数目和肿瘤直径
[0138]
[0139]
[0140]
[0141]
[0142]
[0143]
[0144]
[0145]
[0146]
[0147]
[0148]
[0149]
[0150]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。