1.本发明属于生物技术领域,具体涉及以基因工程水稻为生物反应器,表达人糜蛋白酶原和制备重组人糜蛋白酶的方法。
背景技术:
2.糜蛋白酶(chymotrypsin)也叫胰凝乳蛋白酶,属于丝氨酸蛋白酶家族,能专一性水解芳香族氨基酸羧基形成的肽键。糜蛋白酶原由胰腺分泌,随胰液进入小肠后,在arg15和ile16之间(按bovine chymotrypsin a序列编号)被胰蛋白酶切为通过二硫键连接的两部分,随后糜蛋白酶在leu13酶切去短肽ser14-arg15,在tyr146和asn148酶切去短肽tyr147-asn148,形成由二硫键相连的三条多肽链并具有生物活性。
3.糜蛋白酶在临床上具有广泛的用途,药理作用是分解蛋白质,促进血凝块、脓性分泌物和坏死组织等清除,主要用于眼科手术以松弛睫状韧带,减轻创伤性虹膜睫状体炎;也可用于创口或局部炎症,以减少局部分泌和水肿。
4.由于糜乳蛋白酶能消化各种蛋白质,因而在其他表达体系表达时,会导致宿主细胞的维系生命的蛋白质降解,导致现有表达体系表达量不高。因此,现有糜蛋白酶制备依然从牛或者猪的胰脏中提取,经分级盐析后先制成糜蛋白酶原,经胰蛋白酶激活后,再用硫酸铵、乙醇重结晶精制而得。该工艺提取特异性差,操作时间长,收率低。从牛或者猪的胰脏中提取的糜蛋白酶,其氨基酸序列与人糜蛋白酶和牛源糜蛋白酶的氨基酸同源性为82%,与猪源糜蛋白酶的氨基酸序列同源仅为43%。现有动物源糜蛋白酶不仅存在引入动物源性病毒的风险,还会因异源蛋白进入人体后可能会引起免疫反应,这大大增加了用药的安全风险。
5.人糜蛋白酶原为一条含有263个氨基酸的肽链,在体内激活过程中首先通过信号肽到达胞外,信号肽经肽酶水解后蛋白分子所含氨基酸数变为245,即糜蛋白酶原。当糜蛋白酶原被运输到小肠后才会被胰蛋白酶激活形成活性形式。
6.无动物源性和人源化的生物制品是目前生物医药行业的发展趋势。从1982年第一个无动物源性的重组人胰岛素替代从动物胰脏中提取,到2008年第一个无血浆制品重组凝血酶上市,再到2020年第一个无动物源性植物源重组人血清白蛋白在美国完成1期临床研究。研发无动物源性和人源化的糜蛋白酶符合生物药物的发展趋势。
7.国内外目前尚没有重组人糜蛋白酶的医药产品上市。专利cn104342423a公开了一种高活性重组人糜蛋白酶的制备方法和应用,该方法是采用大肠杆菌表达重组人糜蛋白酶的包涵体,经变性和复性处理后,通过离子交换色谱层析获得较高纯度的重组人糜蛋白酶。
技术实现要素:
8.本发明利用水稻胚乳细胞生物反应器来高效表达重组人糜蛋白酶原,从基因工程水稻稻谷中提取和纯化重组人糜蛋白酶原,然后通过激活获得具有生物活性的重组人糜蛋
白酶。
9.本发明的一个目的是在基因工程水稻稻谷中提供一种高效表达重组人糜蛋白酶原的方法,包括以下步骤:
10.(1)合成如seq id no.1所示的经水稻密码子优化的人糜蛋白酶原基因序列;
11.(2)构建水稻胚乳细胞特异性表达的重组人糜蛋白酶原表达载体;
12.(3)将步骤2所获得载体转化到水稻品种的愈伤再生组织中;
13.(4)培养上述愈伤再生组织,经筛选和诱导获得转重组人糜蛋白酶原基因工程水稻植株;
14.(5)培养重组人糜蛋白酶原基因工程水稻植株,获得重组人糜蛋白酶原基因工程水稻稻谷。
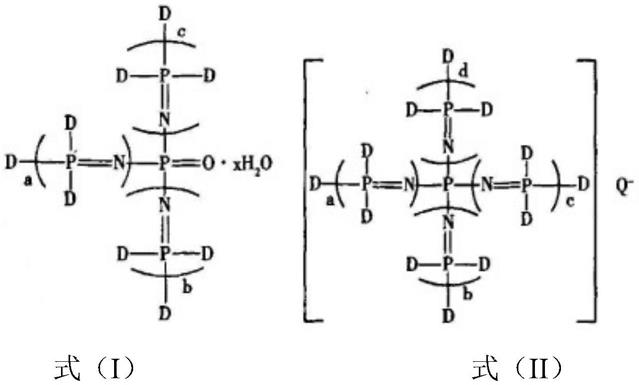
15.其中重组人糜蛋白酶原表达载体优选具有如图3所示的结构。
16.本发明的另一个目的是提供一种从重组人糜蛋白酶原基因工程稻谷中制备重组人糜蛋白酶的方法,包括如下步骤:
17.提取、纯化重组人糜蛋白酶原的方法,包括以下步骤:
18.(1)从重组人糜蛋白原基因工程水稻稻谷中提取含有重组人糜蛋白酶原的粗提取物;
19.(2)将含有重组人糜蛋白原的粗提取物经unigel 80sp阳离子交换层析,得到初级产物;
20.(3)将初级产物经unigel 80q阴离子交换层析,得到纯化的重组人糜蛋白酶原;
21.将上述纯化后的重组人糜蛋白酶原经胰蛋白酶激活,冷冻干燥后,获得重组人糜蛋白酶。
22.进一步的,提取、纯化重组人糜蛋白酶原的方法方法包含以下步骤:
23.1)将重组人糜蛋白酶原基因工程稻谷脱壳加工成半精米,研磨成80~100目的米粉。将米粉与提取缓冲液以1:5(重量/体积,kg/l)的比例混合,于4~30℃提取1~16h后加入2~5%的珍珠岩压滤,滤液再经0.22μm滤膜过滤后即为重组人糜蛋白酶原的粗提取物。所述提取缓冲液的成分为:4.44~69.66g/l十二水合磷酸氢二钠、0.58~19.71g/l一水合柠檬酸,ph 2.5~8.0。
24.2)采用阳离子层析介质进行初级分离纯化,阳离子层析介质包括sp bestrose ff(博格隆(上海)生物技术有限公司)、unigel 80sp(苏州纳微科技股份有限公司)、unigel 80cm(苏州纳微科技股份有限公司)、unigel mmc 50s(苏州纳微科技股份有限公司)。优选使用unigel 80sp层析介质。在一种实施方式中,采用4~6倍柱体积(cv)的ph为3.0~3.5的磷酸氢二钠-柠檬酸的缓冲液,以300~600cm/h的线性流速平衡层析柱;以步骤1)的粗提取物为上样液,其中上样液ph为3.0~3.5,上样体积不超过74cv;用5~10倍柱体积、ph为3.5~4.0的磷酸氢二钠-柠檬酸缓冲液,以300~600cm/h的线性流速进行杂质蛋白的洗脱;用ph 3.9~4.1、含100~200mm氯化钠的磷酸氢二钠-柠檬酸缓冲液,以300~600cm/h的线性流速进行重组人糜蛋白酶原的洗脱,收集含有重组人糜蛋白酶原的洗脱液,获得含重组人糜蛋白酶原的初级产物;
25.3)采用阴离子层析介质进行精度纯化,阴离离子层析介质包括unigel 80q(苏州纳微科技股份有限公司)、nanogel 50q(苏州纳微科技股份有限公司)、mma-50s(苏州纳微
科技股份有限公司)、q bestrose ff(博格隆(上海)生物技术有限公司)、unigel 30q(苏州纳微科技股份有限公司)、q bestrose hp(博格隆(上海)生物技术有限公司)。优选使用unigel 80q层析介质。采用10~15倍柱体积的ph 7.9~8.1,电导1.5~2.0ms/cm的磷酸氢二钠-柠檬酸的缓冲液,以382~840cm/h的流速平衡柱子;将步骤2)的含重组人糜蛋白酶原的洗脱液用5~10kda超滤膜包(聚醚砜材质)适当浓缩,并用ph 7.9~8.1,电导1.5~2.0ms/cm的磷酸氢二钠-柠檬酸缓冲液透析至电导降低至1.5~2.5ms/cm,调节ph至7.9~8.1,作为此步层析的上样液;用ph6.5~8.0,含25~75mm氯化钠的磷酸氢二钠-柠檬酸缓冲液以382~840cm/h的流速进行洗脱,收集含有重组人糜蛋白酶原的洗脱液,获得纯度95%以上的的重组人糜蛋白酶原。
26.进一步的,本技术提供的重组人糜蛋白酶原激活的方法,包括以下步骤:
27.(1)在0.75~4mg/ml的重组人糜蛋白酶原溶液中按照0.05%~0.5%(w/w)的比例加入激活剂胰蛋白酶,2~8℃,静置激活36~72h。
28.(2)激活结束后,调节ph至2.5~3.5,以终止激活。
29.(3)将步骤2的重组人糜蛋白酶用5~10kda超滤膜包(聚醚砜材质)适当浓缩,并用超纯水透析至电导降低至0.5ms/cm以下,调节ph至5.5~6.5。装盘、冻干。
30.本发明也提供按照本发明方法用水稻胚乳细胞表达制备的重组人糜蛋白酶原。
31.与现有的技术相比,本发明的优点和积极效果是:
32.本发明人依托两大优势平台—水稻胚乳细胞蛋白质表达平台(oryz
hiexp
)和蛋白质纯化平台(oryz
pur
),采用水稻胚乳细胞高效表达重组人糜蛋白酶原,经过提取及两步层析后可获得sec-hplc纯度高于99%的重组人糜蛋白酶原。重组人糜蛋白酶原经活化后得到重组人糜蛋白酶,其活性可达1500u/mg以上,高于2020版中国药典1000u/mg的标准。本发明所述的生产工艺相比传统生产工艺,无动物源性材料、操作更为简单、生产时间短、安全性更高、环境友好,具有重要的应用前景,符合未来生物制药的发展趋势。
附图说明
33.图1.pospmp799质粒结构示意图。
34.图2.pospmp800质粒结构示意图。
35.图3.pospmp801质粒结构示意图。
36.图4.基因工程水稻部分植株的目的基因的pcr检测。其中m为dna标准分子量marker;1-23分别为t1代基因工程材料的不同植株;p为阳性对照质粒;红色箭头所指为目的基因。
37.图5.基因工程水稻部分株系稻谷表达量检测。其中m为dna标准分子量marker;2、7、8、9、16、20分别表示基因工程水稻选育过程中不同株系;红色箭头所指为目标蛋白。
38.图6.不同提取条件下重组人糜蛋白酶原粗提取物sds-page检测结果。其中m为标准分子量marker;a-c中的1-27分别表示表1中1-27不同提取条件。
39.图7.不同ph、温度及提取时间下重组人糜蛋白酶原粗提取物的电泳检测结果。其中m为标准分子量marker。
40.图8.unigel 80sp、unigel 80cm及unigel mmc 50s层析洗脱组分sds-page检测结果。其中a为unigel 80sp层析洗脱组分的sds-page检测结果;b为unigel80cm层析洗脱组分
的sds-page检测结果;c为unigel 50s层析洗脱组分的sds-page检测结果;m为标准分子量marker;wash表示洗杂;cip1和cip2分别表示再生1和再生2;ft2为再平衡时拖尾部分的穿透液。
41.图9.unigel 80sp穿透液电泳检测结果,其中m为标准分子量marker,l为层析上样液,25~36分别代表收集管的编号。
42.图10.ph4.0不同盐浓度洗杂层析组分sds-page检测结果。其中m为标准分子量marker;w1-1,w1-2为洗杂峰分段收集;elu为洗脱收集液;cip为再生液
43.图11.不同阴离子层析电泳检测结果。其中ft为穿透液;25、50、75、100、150分别表示不同含mm氯化钠的洗脱组分;红色箭头所示为目的蛋白。
44.图12.unigel 80q层析组分sds-page检测结果。其中m为标准分子量marker;l为上样液;ft为穿透液;w为洗杂收集液;elu为洗脱收集液;cip为再生液;还原即在电泳制样过程中加入β-巯基乙醇,非还原即为制样过程中不加β-巯基乙醇。
45.图13.unigel 80q层析不同洗脱条件层析收集液电泳检测。其中1表示还原状态下ph 6.5,50mm氯化钠洗脱收集液;2表示非还原下ph 6.5,50mm氯化钠洗脱收集液;3表示还原状态下ph 7.0,50mm氯化钠洗脱收集液;4表示还原状态下ph 7.0,25mm氯化钠洗脱收集液;5表示还原状态下ph 7.5,50mm氯化钠洗脱收集液;6表示还原状态下ph 8.0,50mm氯化钠洗脱收集液。
46.图14.三批小试工艺层析图谱。其中a为unigel 80sp层析图谱,b为unigel80q层析图谱;20200804、20200805、20200806分别表示不同的生产批号。
47.图15.三批小试电泳检测结果(还原),其中m为标准分子量marker;1表示20200804批,2表20200805批,3表示20200806批;还原表示制样过程中加入还原剂β-巯基乙醇。
48.图16.激活前重组人糜蛋白酶sec-hplc检测图谱。
49.图17.激活后重组人糜蛋白酶sec-hplc检测图谱。
50.图18.重组人糜蛋白酶sds-page检测结果。
具体实施方式
51.下文将通过实施例和附图以详细说明本发明的技术方案,从而更好地阐述本发明的特点和优势。所提供的实施例应被解释为对本发明方法的举例说明,而不以任何方式限制本发明揭示的技术方案。
52.以下实施例中使用的试剂和仪器,除特别说明以外,均为普通市售。
53.【实施例1】高效表达重组人糜蛋白酶原基因工程水稻的制备
54.1.重组人糜蛋白酶原基因表达载体的构建
55.本实施例选用水稻特异性启动子gt13a及其信号肽来介导重组人糜蛋白酶原基因在水稻胚乳细胞中的表达。根据人糜蛋白酶基因序列(genbank登记号:np_001897.4),委托南京金斯瑞生物科技有限公司根据水稻偏好的遗传密码子合成,具体如seqid no.1所示,经水稻偏好密码子优化后的核苷酸改变了15%,密码子改变了35%,但其相应的氨基酸序列没有变化,构建的质粒为pospmp799(图1)。本实施例选用水稻特异性启动子gt13a及其信号肽来介导人糜蛋白酶原基因在水稻胚乳细胞中的表达。将所述合成的经密码子优化的人糜蛋白酶原基因(seq id no.1)用mlyi和xhoi酶切后克隆到经naei和xhoi酶切的
pospmp003中,经t4连接酶构建一个中间载体质粒pospmp800(图2);然后用hindiii和ecori酶切pospmp800,将长度为2263bp的含gt13a启动子/信号肽序列以及密码子优化的人糜蛋白酶原基因和nos终止子的表达盒插入到经hindiii和ecori酶切双元表达载体pc1300,构建农杆介导菌质粒,命名为pospmp801(图3)。
56.2.基因工程水稻遗传转化
57.将pospmp801质粒转化到根癌农杆菌eha105(美国invitrogen公司),通过根癌农杆菌介导转化将pospmp801转化到水稻品种tp309的愈伤再生组织中,经培养、筛选和诱导后形成完整的植株。,具体方法如下:
58.(1)愈伤诱导
59.1)将成熟水稻种稻谷脱壳后用70%酒精浸泡灭菌1min,20%次氯酸钠再处理30min;
60.2)用灭菌无菌水清洗5-7次;
61.3)将处理好的稻谷接种到诱导培养基(n6培养基)上,每皿接种6-8粒;
62.4)在32℃光照处理大约5-7天。
63.(2)农杆菌制备
64.将含有表达载体pospmp801的农杆菌进行扩大培养。在卡拉霉素抗性平皿中涂菌,28℃培养箱中培养2-3天。
65.(3)用接种环取农杆菌单菌落挑取到悬浮培养基(aam液体培养基)中,在28℃摇菌(160rpm)培养。一般100ml培养基可用接种环刮入3至4环。
66.(4)农杆菌侵染(共培养)
67.1)将愈伤组织转移到灭菌的三角瓶中;
68.2)调整农杆菌悬浮液od600值于0.05~0.1之间;
69.3)将稻谷悬浮在aam培养基中,侵染1.5min,其间持续摇晃;
70.4)弃菌液,用无菌滤纸吸干多余的菌液,将愈伤组织取出置于无菌滤纸上沥干30~45min;
71.5)将无菌滤纸放在2n6-as培养基上。再将含有as(乙酰丁香酮,250mg/ml)的500μl aam滴在直径9cm的无菌滤纸上,将侵染过的愈伤放在滤纸上,25℃黑暗共培养3天。
72.(5)水洗和筛选
73.1)将经过共培养的愈伤组织转移到灭菌的三角瓶中;
74.2)用灭菌水清洗愈伤组织5-7次;
75.3)用含有0.5g/l浓度的头孢霉素灭菌水浸泡感染的愈伤组织约30min,然后于28℃,180-200rpm摇20-30min;
76.4)倒去含有抗生素的灭菌水,将三角瓶倒置于含滤纸的灭菌培养皿中大约15min;
77.5)将愈伤组织在灭菌的滤纸上晾干;
78.6)转移愈伤组织转移到含有hpt抗生素的筛选培养基上培养20-30天。
79.(6)愈伤组织分化
80.将经过20~30天选择,将具有hpt抗性愈伤组织转移到分化培养基(n6培养基)上,在26℃光照培养20-30天。
81.(7)生根
82.从分化培养基挑选出分化后的小苗,转移到含有1/2的ms培养基上进行生根,在28℃光照培养30天后,转移到田间生长。
83.3.基因工程水稻鉴定
84.(1)基因组dna的提取
85.取t0代hpt阳性再生苗的叶片约2cm,分别放入离心管,加入600μl ctab提取缓冲液(2%ctab,1.38mnacl,0.1m tris-hcl,20mm edta,ph8.0),在震荡破碎机破碎后,在65℃温浴60min,再加入等体积的氯仿/异戊醇,轻缓颠倒混合,12000rpm离心10min;将上清液转入另一新1.5ml离心管中,加入等体积的异丙醇,缓慢倒置混合,在室温下放置60min;12000rpm离心10min,去上清液,70%乙醇漂洗dna沉淀,风干后加入80μl的te缓冲液溶解dna,-20℃保存备用;
86.(2)pcr扩增
87.以苗期取叶片提取基因组dna,采用人糜蛋白酶原正向引物gt13a-f(seq id no.2:5
’-
cacatccatcattatccatccacc-3’)和反向引物ct-r(seq id no.3:5
’-
acttcgggttcttgaacacctt-3’)进行pcr扩增,产物理论大小为547bp,pcr鉴定含有目的基因的基因工程植株,pcr检测方法如下:
88.1)取1μl水稻基因组dna作为模板,设置阳性(质粒dna)和阴性(无菌水)对照;
89.2)pcr扩增反应体系包含2.5μl的10
×
buffer,;0.15μl的5u/μl的rtaq酶,4μl的2.5mm dntp,正向和反向引物各0.5μl;加ddh2o至25μl。
90.3)在94℃预变性5min,94℃变性30s,58℃退火反应30s,72℃延伸30s,35个循环,最后72℃延伸10min。
91.4)pcr扩增产物经1%琼脂胶电泳,eb染色后在凝胶成像仪里观察结果。
92.鉴定结果表明,通过根癌农杆菌介导转化获得56株独立的重组人糜蛋白酶原基因工程水稻。部分基因工程水稻目的基因pcr鉴定结果如图4所示。
93.4.重组人糜蛋白酶原的表达量的鉴定
94.将获得的重组人糜蛋白酶原阳性苗移栽到温室中生长至成熟,收种能够正常结实的单株。由于目前无市售的可用来定量检测重组人糜蛋白酶原含量的检测试验盒,故通过sds-page法初步筛选高表达的单株,剔除阴性单株。将高表达的单株作为候选单株继续种植,再次进行表达量比较及纯合子筛选,直至获得稳定高效表达重组人糜蛋白酶原的纯合株系。部分重组人糜蛋白酶原稻谷表达量的sds-page检测结果如图5所示。经初步估算,重组人糜蛋白酶的最高表达量可达2g/kg糙米以上。
95.seq id no.1:
[0096][0097]
seq id no.2:
[0098]5’-
cacatccatcattatccatccacc-3’[0099]
seq id no.3:
[0100]5’-
acttcgggttcttgaacacctt-3’[0101]
【实施2】从基因工程水稻中提取重组人糜蛋白酶原
[0102]
1.重组人糜蛋白酶原提取条件初步筛选
[0103]
将基因工程稻谷脱壳加工成半精米,研磨成80~100目的米粉。将米粉与不同ph的磷酸氢二钠-柠檬酸提取缓冲液以1:5(重量/体积,kg/l)的比例混合,按照表1所设计的提取条件进行提取。提取结束后,取上清液进行sds-page检测。结果显示,各提取条件,提取液中目的蛋白提取量无显著差异(见图6)。进一步分析发现,试验处理2、3、6、9、20、26的杂质蛋白相对较少,几乎无高分子杂质蛋白。其中以处理3(提取液ph 3.0,0mm nacl),提取时间8.5h,提取温度17℃时的纯度相对较高。通过上述结果可以看出,ph对目的蛋白的提取率无显著影响,但是对提取液中目的蛋白的纯度影响显著,ph越低,杂质越少;氯化钠浓度、提取时间及提取温度等对目的蛋白的提取率无显著影响。
[0104]
表1不同提取条件设计
[0105]
[0106][0107]
2.重组人糜蛋白酶原提取条件确定
[0108]
根据上述的初步筛选结果,进一步对提取条件进行优化。将基因工程稻谷脱壳加工成半精米,研磨成80~100目的米粉。将米粉以1:5(重量/体积,kg/l)分别采用ph2.5、ph3.0及ph3.5的磷酸氢二钠-柠檬酸提取缓冲液的比例混合,然后置于25℃提取1h。同时设计ph3.0的提取缓冲液分别于20℃、25℃及30℃搅拌提取1h、2h、4h。提取结束后,离心,取上清液进行sds-page检测。结果显示,各提取条件下,提取液中目的蛋白提取量无显著差异(图7)。从经济角度考虑,优选提取时间越短,温度20~30℃(室温),成本最低。因此,确定重组人糜蛋白酶原的提取条件:缓冲液(磷酸氢二钠-柠檬酸)ph2.5~3.5;提取时间1~2h;提取温度20~30℃。
[0109]
【实施例3】重组人糜蛋白酶原的阳离子层析介质初级纯化
[0110]
1.初级纯化阳离子层析介质的选择
[0111]
根据实施例2确定的提取条件制备含重组人糜蛋白酶原的粗提物,然后分别上样至装填有unigel 80sp、unigel 80cm、unigel mmc 50s层析介质的层析柱,随后采用不同ph的磷酸氢二钠-柠檬酸缓冲液进行梯度洗脱。结果显示上述3种层析介质,在ph梯度洗脱时,洗脱峰拖尾较为严重,分离度较差。电泳检测结果见图8,unigel 80cm穿透明显(图8b),即上样20cv即已过载。unigel mmc 50s在平衡过程中,拖尾严重,拖尾处可见有明显的目的蛋白脱落(图8c),目的蛋白在各ph条件下均有洗脱,主要集中在ph6.0和ph7.0洗脱组分中。unigel 80sp上样及再平衡过程未见目的蛋白脱落,目的蛋白主要集中在ph4.5和ph5.0的洗脱组分中,但这两个条件洗脱峰拖尾严重。考虑到unigel80cm载量低及unigel mmc50s再平衡拖尾严重且有目的蛋白损失,因此最终优选unigel 80sp作为初级纯化的层析介质。
[0112]
2阳离子unigel 80sp层析载量测定
[0113]
根据实例2确定的提取条件制备重组人糜蛋白酶原的粗提物(即上样液)。将重组
人糜蛋白酶原的粗提物上样(0.5ml/min流速)至1ml unigel 80sp层析柱中,当上样至20cv时,开始采用分布收集器按照约2ml/管自动收集穿透液。对收集的穿透液进行sds-page检测,结果如图9所示,收集液的27管即74cv(20 27
×
2=74cv)可见目的蛋白穿透。因此,在此上样条件下,unigel 80sp的最大载量为74cv。
[0114]
3阳离子unigel 80sp层析优化
[0115]
根据实施例2确定的提取条件制备重组人糜蛋白酶原的粗提物。将50ml(50cv)的重组人糜蛋白酶原粗提物上样至1ml unigel 80sp层析介质,然后用ph 4.0的含0~200mm氯化钠的磷酸氢二钠-柠檬酸缓冲液进行梯度洗脱。结果如图10所示,在ph4.0、0mm氯化钠洗杂条件下有微量的目的蛋白洗脱,当盐浓度提高至30mm氯化钠时,目的蛋白明显的从层析介质上被洗脱。由上可知,目的蛋白极易被洗脱,洗杂空间极小。考虑到ph 4.0,30mm氯化钠洗杂目的蛋白损失较多,且存在拖尾现象,而ph 4.0,0mm氯化钠洗杂时虽然有微量目的蛋白损失,但是可去除较多的杂质蛋白,同时洗杂峰与后续的洗脱峰(ph4.0,100mm氯化钠洗脱)有一定的分离度,因此,确定洗杂条件为ph 4.0,0mm氯化钠。由于ph 4.0,100mm氯化钠洗脱(收集体积27cv)和ph 4.0,150mm氯化钠洗脱(收集体积25cv)两种洗脱组分目的蛋白的纯度无显著差异,因此确定洗脱条件为ph 4.0,100~150mm氯化钠,优选ph 4.0,150mm氯化钠洗脱(洗脱体积相对较小)。
[0116]
【实施例4】重组人糜蛋白酶原的阴离子层析介质精细纯化
[0117]
根据实施例2和3确定的提取和阳离子层析条件制备重组人糜蛋白酶原的初级产物,由于第一步初级纯化采用阳离子介质,故第二步精细纯化拟采用阴离子介质。
[0118]
1.初级产物预处理
[0119]
首先将初级产物用5~10kda超滤膜包(聚醚砜材质)适当浓缩后,用ph7.9~8.1,电导1.5~2.0ms/cm的磷酸氢二钠-柠檬酸缓冲液或者磷酸盐缓冲液透析至电导为1.5~2.5ms/cm,调节ph至7.9~8.1,作为第2步层析的上样液。
[0120]
2.阴离子层析介质筛选
[0121]
将第1步预处理的上样液,以0.5ml/min的流速分别上样至装填有1ml阴离子层析介质unigel 80q、nanogel 50q、mma-50s、q bestrose ff的层析柱中,然后采用氯化钠梯度洗脱。结果如图11所示,目的蛋白与q系列的层析介质结合较弱,在较低电导下(25~50mm氯化钠),目的蛋白均逐渐洗脱,且洗脱峰拖尾现象严重,尤以q bestrose ff,25mm氯化钠可洗脱部分杂质,但目的蛋白不能被脱落。结果显示不论何种阴离子层析介质,最终洗脱液中目的蛋白的纯度基本相同(图11)。从层析介质成本及耐用性方面考虑,优选unigel 80q作为第2步层析介质。
[0122]
3.unigel 80q层析优化
[0123]
根据实施例2~3确定的条件,制备实施例4的层析上样液,然后以40ml(40cv)的上样量,上样至1ml unigel 80q层析柱,然后用ph7.9~8.1,含50mm氯化钠的磷酸氢二钠-柠檬酸(或者10mm的磷酸盐缓冲液)缓冲液进行洗脱。结果如图12所示,unigel 80q的洗脱液在还原状态下呈三条蛋白带,而在非还原条件下呈现单一条带。经分析,可能为重组人糜蛋白酶原在蛋白质表达、转运及储存过程中发生自激活现象。
[0124]
由于上述层析条件洗脱时收集体积大,说明洗脱强度低,阴离子层析可通过降低洗脱ph来提高洗脱强度,故拟通过降低洗脱液的ph对层析的洗脱条件进行优化。结果如表2
所示,当采用ph 6.5,50mm氯化钠,10mm磷酸盐缓冲液洗脱时,收集体积大大减小。经洗脱条件优化后,样品纯度无显著变化(见表2及图13)。
[0125]
综上所述,重组人糜乳蛋白酶的unigel 80q层析洗脱条件为:10mm磷酸盐缓冲液,ph6.5~8.0,25~50mm氯化钠。结合实施例6重组人糜蛋白酶的最优激活条件为:重组人糜蛋白酶原浓度1mg/ml,ph 8.0。ungel 80q的最优洗脱条件为10mm磷酸盐缓冲液,ph 8.0,50mm氯化钠(此洗脱条件收集液的蛋白质含量约为1mg/ml,而且收集液无需调节ph,可直接用于激活)。
[0126]
表2不同洗脱条件层析洗脱收集体积
[0127][0128]
【实施例5】重组人糜蛋白酶原三批小试工艺验证
[0129]
根据实施例2~4确定的最优提取、初步纯化及精细纯化条件,进行三批小试工艺验证,验证过程及验证结果如下所述。
[0130]
1.重组人糜蛋白酶原粗提取物制备(提取)
[0131]
称取500g重组人糜蛋白酶原米粉,加入2500ml含14.72g/l十二水合磷酸氢二钠、16.69g/l一水合柠檬酸提取缓冲液,在20~30℃下搅拌提取1~2h。提取结束后,加入2%~5%(w/v)助滤剂,采用正压过滤的方式进行压滤。初滤液经0.22μm滤膜过滤后,即为重组人糜蛋白酶原粗提取物(unigel 80sp层析上样液)。
[0132]
2.重组人糜蛋白酶原初步纯化
[0133]
采用4~6cv的ph 3.3~3.5的20.41g/l十二水合磷酸氢二钠、15.02g/l一水合柠檬酸缓冲液,以300~600cm/h的线性流速平衡填充有unigel 80sp,装柱高度19~21cm的xk16/40层析柱。以上述重组人糜蛋白酶原粗提取物为上样液进行上样,上样体积50cv。用8~10倍柱体积、ph 3.9~4.1的含7.61g/l十二水合磷酸氢二钠、12.91g/l一水合柠檬酸的缓冲液以300~600cm/h的线性流速进行杂质蛋白的洗脱;用ph 3.9~4.1的含150mm氯化钠的上述磷酸氢二钠-柠檬酸缓冲液,以300~600cm/h的线性流速进行重组人糜蛋白酶原的洗脱,收集含有重组人糜蛋白酶原的洗脱液,获得含重组人糜蛋白酶原的初级产物。
[0134]
3.重组人糜蛋白酶原精细纯化
[0135]
采用10~15倍柱体积的ph 7.9~8.1,电导1.5~2.0ms/cm的磷酸氢二钠-柠檬酸的缓冲液,以382~840cm/h的流速平衡填充有unigel 80q,装柱高度27~29cm的c10/40层析柱;将上述重组人糜蛋白酶原初级产物(即unigel 80sp层析收集液)用5~10kda超滤膜包(聚醚砜材质)适当浓缩,并用ph 7.9~8.1,电导1.5~2.0ms/cm的磷酸氢二钠-柠檬酸缓
冲液(或者相同ph的10mm磷酸盐缓冲液)透析至电导降低至1.5~2.5ms/cm,调节ph至7.9~8.1,作为此步层析的上样液;用ph为7.9~8.1,含50mm氯化钠、20.41g/l十二水合磷酸氢二钠、15.02g/l一水合柠檬酸的缓冲液以382~840cm/h的流速进行洗脱,收集含有重组人糜蛋白酶原的洗脱液,获得纯度95%以上的的重组人糜蛋白酶原(精纯产物)。层析图谱如图14所示,三批小试层析图谱基本一致。
[0136]
纯度及收率检测结果如表3所示,三批小试重组人糜蛋白酶原的纯度均大于95%,平均收率可达1.2g/kg基因工程水稻米粉,验证3批rsd值小于10%,说明该工艺一致性良好,质量可控。
[0137]
表3三批小试纯度及收率
[0138][0139]
【实施例6】重组人糜蛋白酶原的激活
[0140]
纯化后的重组人糜蛋白酶原是没有活性的,需要经过胰蛋白酶切去部分肽段后才形成具有生物学活性的重组人糜蛋白酶。因此需要通过酶解方式激活重组人糜蛋白酶。
[0141]
1.激活条件初步摸索
[0142]
将实施5制备的重组人糜蛋白酶原纯化样品(1mg/ml)按照10ml/管分为若干份,分别加入终浓度为0.5%、0.25%、0.125%、0.05%(w/w,胰蛋白酶/重组人糜蛋白酶原)的胰蛋白酶(活性≥2500u/mg),然后分别置于2~8℃及25
±
2.5℃静置激活。分别在激活的24h、32h、48h、56h、72h各取样1ml,加入2~3μl 50%hcl终止激活(ph 3~4),激活后的样品按照《中国药典》2020版所述方法进行活性检测。结果如表4所示,在2~8℃条件下加入不同浓度的胰蛋白酶分别激活24~72h后,重组人糜蛋白酶的酶活性均达到《中国药典》2020版的1000u/mg的要求,且不同浓度的胰蛋白酶以及各激活时间点的酶活性无明显的差异。但相同浓度的胰蛋白酶,在25℃条件下激活72h,重组人糜蛋白酶的活性极低,仅有200~300u/mg。
[0143]
表4不同激活条件重组人糜蛋白酶活性检测结果
[0144][0145][0146]
2激活条件优化
[0147]
为了优选重组人糜蛋白酶原的激活条件,在上述基础上对激活时重组人糜蛋白酶原的浓度(设置1~5mg/ml)、溶液的ph(7.0~8.5)进行优化。当胰蛋白酶加入量为0.1%(w/w),激活时溶液ph为8.0,在2~8℃条件下激活40h,发现随着激活前重组人糜蛋白酶原浓度的升高,重组人糜蛋白酶的活性逐渐降低(表5);当胰蛋白酶加入量为0.1%(w/w),不同ph下2~8℃激活40h,发现激活溶液ph为8.0时,重组人糜蛋白酶的活性相对最高(表6)。激活前后重组人糜蛋白酶(原)的sec-hplc如图16及图17所示,激活后重组人糜蛋白酶纯度达到95%,相比激活前重组人糜蛋白酶原99%的纯度,略微降低。
[0148]
因此确定最佳的激活条件为:重组人糜蛋白酶原浓度1~5mg/ml,优选1mg/ml。胰蛋白酶加入量0.05%~0.5%,优选0.1%;激活ph为7.0~8.5,优选ph 8.0。
[0149]
表5糜蛋白酶原浓度对激活后活性的影响
[0150][0151]
表6不同ph激活后活性的影响测定结果
[0152][0153]
【实施例8】重组人糜蛋白酶制剂研究
[0154]
糜蛋白酶在固体状态时比较稳定,但其溶液不稳定,因此,为了便于储存,需要对重组人糜蛋白酶进行冷冻干燥。将实施7激活后的重组人糜蛋白酶,采用5~10kda超滤膜包(聚醚砜材质)适当浓缩,并用超纯水超滤透析至电导为0.5ms/cm以下,然后用0.22μm的滤膜过滤,滤液分装后冷冻干燥。冻干成品为白色结晶性粉末,加水后可迅速溶解,经测定其效价为1500u/mg。制剂的电泳检测结果如图18所示,其中市售药物为上海上药第一生化药业有限公司生产的注射用糜蛋白酶(冻干粉针剂);usp对照品为美国药典糜蛋白酶标准品。
[0155]
在非还原状态下,重组人糜蛋白与usp对照品电泳行为一致,而市售药物存在部分降解片段;而在还原状态下,重组人糜蛋白酶呈现3条电泳条带,其中高分子条带疑似为部分未激活的重组人糜蛋白酶原。
[0156]
【实施例9】重组人糜蛋白酶的生产工艺
[0157]
由实施例1-8建立重组人糜蛋白的生产工艺如下:基因工程水稻的种植—稻谷加工(脱壳、磨粉)—提取—阳离子层析初步纯化—阴离子层析精细纯化—激活—浓缩、透析—调配—除菌过滤—灌装—冷冻干燥。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。