1.本发明涉及一种脂质体的其制备方法,特别是关于一种具有稳定包覆效性成分能力的脂质体的制备方法。
背景技术:
2.由于饮食文化的改变,使得外食或食用加工食品的人数逐渐上升。为了摄取满足人体的基本营养需求,有别于过去仅通过饮食天然食品获得所需的养分,营养补充剂渐渐出现在人们的生活之中。
3.营养补充剂的种类繁多,且其形态、剂型、摄取方式亦有多种选择。举例来说,营养补充剂可以为水溶性维生素、脂溶性维生素、矿物质、胶原蛋白等。并且,常见的营养补充剂的型态可以为粉末、胶囊、锭状(如,口服锭、嚼锭)、液态(如,气泡锭、冲剂)等,而不同型态或剂型的营养补充剂会影响其在人体消化道的吸收率及吸收速度。理论上由快而慢依序为液态、粉状、胶囊、锭状。此外,近年来营养补充剂亦针对吸收力发展为速效剂型及缓释剂型。
4.以维生素c(vitamin c,又称维他命c)为例。除了从蔬果中摄取到维生素c之外,也可从营养补充剂中摄取到维生素c。并且,常见的维生素c剂型包括口服锭、嚼锭、气泡锭、冲剂、粉末等。
技术实现要素:
5.在一些实施例中,一种具有稳定包覆效性成分能力的脂质体的制备方法,其包括搅拌混合液,以及以300巴(bar)~400巴均质混合液以形成脂质体悬浮液。混合液包括0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶及63.9125重量%~97.9重量%的溶剂。脂质体悬浮液包括多个脂质体。
6.在一些实施例中,溶剂为水。
7.在一些实施例中,混合液更包括5重量%~30重量%的效性成分。
8.在一些实施例中,效性成分的浓度为10重量%。
9.在一些实施例中,效性成分为维生素c。
10.在一些实施例中,搅拌混合液的步骤包括搅拌0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶及63.9125重量%~97.9重量%的溶剂以形成溶液;以及,以80目数(mesh)的网目过筛溶液以形成混合液。
11.在一些实施例中,均质混合液的步骤中的混合液的温度为40℃~60℃,且均质混合液以形成脂质体悬浮液的步骤包括以95℃灭菌混合液30分钟;以及,以300巴~400巴均质灭菌后的混合液以形成脂质体悬浮液,且脂质体悬浮液包括多个脂质体。
12.在一些实施例中,均质混合液的步骤中的均质温度为室温,且均质混合液以形成脂质体悬浮液的步骤包括以300巴~400巴均质混合液以形成脂质体悬浮液,且脂质体悬浮液包括多个脂质体;以及,以95℃灭菌脂质体悬浮液30分钟。
13.在一些实施例中,各脂质体具有中空状球体结构。
14.综上所述,任一实施例的具有稳定包覆效性成分能力的脂质体的制备方法系通过混合特定比例的卵磷脂、阿拉伯胶及水,并借由特定压力均质以形成脂质体悬浮液。其中,脂质体悬浮液含有结构稳定的多个脂质体。并且,任一实施例的具有稳定包覆效性成分能力的脂质体的制备方法可用以制备其内包覆有效性成分的脂质体。于此,所制备的脂质体的结构稳定,并可稳定包覆效性成分,且能用以提高其所包覆的效性成分的生物吸收率。
15.以下结合附图和具体实施例对本发明进行详细描述,但不作为对本发明的限定。
附图说明
16.图1是任一实施例中具有稳定包覆效性成分能力的脂质体的制备流程图;
17.图2是步骤s100的流程图;
18.图3是一些实施例中步骤s200的流程图;
19.图4是另一些实施例中步骤s200的流程图;
20.图5是一些实施例中的脂质体的剖视图;
21.图6是另一实施例中的脂质体的剖视图;
22.图7是又一实施例中的脂质体的剖视图;
23.图8是进行前杀处理的脂质体悬浮静置实验图;
24.图9是进行后杀处理的脂质体悬浮静置实验图;
25.图10是进行前杀处理的脂质体悬浮离心实验图;
26.图11是进行后杀处理的脂质体悬浮离心实验图;
27.图12是一实施例的脂质体的电子显微镜照片;
28.图13是另一实施例的脂质体的电子显微镜照片;以及
29.图14是受体血液中维生素c含量数据图。
30.其中,附图标记:
31.s100-s270:步骤
32.1:脂质体
33.10:包覆层/第一包覆层
34.101:第一磷脂质层
35.102:第二磷脂质层
36.20:内层空间/第一内层空间
37.11:第二包覆层
38.111:第一磷脂质层
39.112:第二磷脂质层
40.21:第二内层空间
41.13:第三包覆层
42.131:第一磷脂质层
43.132:第二磷脂质层
44.23:第三内层空间
45.l:外径
具体实施方式
46.请参阅图1及图5。在一些实施例中,首先,搅拌混合液(步骤s100),然后以300巴(bar)~400巴均质混合液以形成包括多个脂质体1的脂质体悬浮液(步骤s200)。其中,混合液包括0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶及63.9125重量%~97.9重量%的溶剂。
47.在一些实施例中,卵磷脂可以为但不限于大豆卵磷脂(solec f)。在一些实施例中,溶剂可以为但不限于水。在一些实施例中,混合液包括0.1重量%的大豆卵磷脂、2重量%~5重量%的阿拉伯胶及63.9125重量%~97.9重量%的水。举例来说,阿拉伯胶的浓度可以为2重量%、3重量%、4重量%及5重量%。
48.在一些实施例中,混合液更包括效性成分。如此,形成的脂质体1中会包覆此效性成分。举例来说,效性成分可以为维生素c(vitamin c)、虾青素、辅酶q10等。在一些实施例中,混合液包括0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶、5重量%~30重量%的效性成分及63.9125重量%~92.9重量%的溶剂。举例来说,效性成分的浓度为10重量%。
49.在一些实施例中,混合液更包括增稠剂。于此,增稠剂有助于保护脂质体1的结构。举例来说,增稠剂可以为关华豆胶、三仙胶(xanthan gum,或称玉米糖胶、黄原胶)或其组合。在一些实施例中,混合液包括0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶、5重量%~30重量%的效性成分、0.3175重量%~0.6175重量%的增稠剂及63.9125重量%~92.5825重量%的溶剂。举例来说,0.3175重量%~0.6175重量%的增稠剂包括0.0675重量%的关华豆胶及0.25重量%~0.55重量%的三仙胶。在一些示范例中,混合液包括0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶、10重量%的效性成分、0.0675重量%的关华豆胶、0.25重量%~0.55重量%的三仙胶及83.9125重量%~87.5825重量%的水。
50.在一些实施例中,混合液可更包括食品添加物。食品添加物可为甜味剂、酸化剂、防腐剂等。其中,甜味剂可以为蔗糖素、酸化剂可以为单水柠檬酸、以及防腐剂可以为己二烯酸钾。在一些实施例中,混合液包括0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶、5重量%~30重量%的效性成分、0.3175重量%~0.6175重量%的增稠剂、0.07重量%~0.37重量%的食品添加物及63.9125重量%~92.5125重量%的溶剂。举例来说,0.35重量%的食品添加物可以为0.3重量%的酸化剂及0.05重量%的防腐剂之组合,或者0.07重量%的食品添加物可以为0.02重量%的甜味剂及0.05重量%的防腐剂之组合。在一些示范例中,混合液包括0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶、10重量%的效性成分、0.0675重量%的关华豆胶、0.25重量%的三仙胶、0.05重量%的防腐剂、0.02重量%的甜味剂及84.5125重量%~87.5125重量%的水。在另一些示范例中,混合液包括0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶、10重量%的效性成分、0.0675重量%的关华豆胶、0.55重量%的三仙胶、0.05重量%的防腐剂、0.3重量%的酸化剂及83.9325重量%~86.9325重量%的水。
51.请参阅图2。在一些实施例中,步骤s100包括下列步骤:搅拌0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶及63.9125重量%~97.9重量%的溶剂以形成预混溶液(步骤s110),以及以80目数(mesh)的网目过筛预混溶液以形成混合液(步骤s120)。
52.于此,在一些实施例中,可依实际需求,利用力道较强的搅拌设备将除溶剂外的所有成分(以下称溶质)完全溶解于溶剂中。举例来说,可将所有溶质一次性加入溶剂中,抑或
是将不同溶质依序加入至溶剂中逐一溶解。
53.在步骤s110的一实施态样中,将0.1重量%的卵磷脂及2重量%~5重量%的阿拉伯胶加入至63.9125重量%~97.9重量%的溶剂中,并搅拌均匀以形成预混溶液。
54.于此,在另一些实施例中,当搅拌设备(如,震荡机)的力道较弱时,可依实际需求,将溶质之一的卵磷脂先行与部分溶剂以重量比(w/w)1:50混合,并于室温(25℃)下搅拌以将卵磷脂溶解于部分溶剂中以形成预混溶液(以下称第一预混溶液)。并且将除卵磷脂外的溶质溶解于其余溶剂之中,以形成预混溶液(以下称第二预混溶液)。待确认卵磷脂已完全溶解于部分溶剂,且其余溶质已完全溶解于其余溶剂后,将第一预混溶液与第二预混溶液二者混合并搅拌均匀以形成预混溶液(以下称第三预混溶液)。换言之,将溶质(如,卵磷脂、阿拉伯胶等)分别溶解于溶剂(如,水)中以形成第一预混溶液及第二预混溶液,接着将第一预混溶液及第二预混溶液混合以形成第三预混溶液。如此,有助于溶质充分溶解于溶剂。
55.在步骤s110的另一实施态样中,将0.1重量%的卵磷脂溶解于至少5重量%的溶剂形成第一预混溶液,并将其余溶质(如,2重量%~5重量%的阿拉伯胶)溶解于其余溶剂中(至多92.9重量%的溶剂)形成第二预混溶液后,将第一预混溶液及第二预混溶液再混合形成第三预混溶液,抑或是将0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶分别溶解于63.9125重量%~97.9重量%的溶剂中并逐一混合。
56.并且,于混合液形成后,以300巴~400巴均质混合液以形成脂质体悬浮液。于此,可分别于均质混合液的步骤(即,均质处理)之前或之后进行灭菌程序,如图4及图5所示。在一些实施例中,灭菌程序的设定值为87℃
±
2℃~95℃
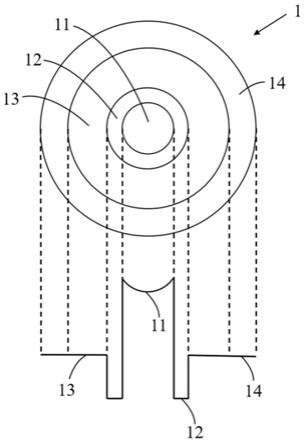
±
5℃灭菌30分钟。举例来说,于产在线,灭菌程序的设定值为87℃
±
2℃灭菌30分钟。
57.请参阅图3。在一些实施例中,步骤s200包括:以95℃灭菌混合液30分钟(步骤s210),以及以300巴~400巴均质灭菌后的混合液以形成脂质体悬浮液,其中灭菌后的混合液的温度为40℃~60℃(步骤s230)。换言之,于均质混合液的步骤之前进行灭菌程序的流程称为「前杀处理」。于此,「前杀处理」中欲进行均质处理的混合液的温度为40℃~60℃。举例来说,「前杀处理」中欲进行均质处理的混合液温度为50℃。
58.在一些示范例中,首先,将混合液以灭菌设备进行灭菌程序(即,步骤s210),待灭菌后的混合液降温至40℃~60℃时(如,50℃)时可进行均质处理(即,步骤s230),以形成脂质体悬浮液。
59.请参阅图4。在一些实施例中,步骤s200包括:于室温下,以300~400巴均质混合液以形成脂质体悬浮液(步骤s250),以及以95℃灭菌脂质体悬浮液30分钟(步骤s270)。换言之,于均质混合液的步骤之后进行灭菌程序的流程称为「后杀处理」。于此,「后杀处理」中的均质处理是于室温(25℃)下进行。
60.在一些示范例中,首先,将混合液于室温(25℃)下进行均质处理(即,步骤s250),以形成脂质体悬浮液。并于脂质体悬浮液形成后,进行灭菌程序(即,步骤s270)。
61.于此,通过300巴~400巴的压力进行均质处理,可将含有0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶及63.9125重量%~97.9重量%的溶剂的混合液充分乳化以形成为脂质体悬浮液。并且,脂质体悬浮液含有结构稳定的多个脂质体1。并且,由于所制备的脂质体1的结构稳定,因此脂质体1具有可稳定包覆效性成分的能力。
62.再者,通过特定压力(300巴~400巴)的均质处理,卵磷脂会形成有中空状结构的
脂质体1,如图5至图7所示。
63.请参阅图5至图7。在一些实施例中,脂质体1包括至少一包覆层10,各包覆层10具有双层膜构成的中空球体结构。双层膜包括第一磷脂质层101及第二磷脂质层102,第一磷脂质层101构成中空球体结构的外层,第二磷脂质层102构成中空球体结构的内层,且第一磷脂质层101与第二磷脂质层102并列。其中,第一磷脂质层101及第二磷脂质层102分别由多个磷脂质所构成,且各磷脂质具有亲水端及疏水端。举例来说,包覆层10内外两侧主要为各磷脂质的亲水端组成,而双层膜结构的中段主要为疏水端组成。换言之,第一磷脂质层101的多个磷脂质的亲水端朝外并构成包覆层10的外表面,且第二磷脂质层102的多个磷脂质的亲水端朝内并构成包覆层10的内表面。并且,第一磷脂质层101的多个磷脂质的疏水端与第二磷脂质层102的多个磷脂质的疏水端彼此相邻并排。
64.在一些实施例中,脂质体1包括1个包覆层10及1个内层空间20,如图5所示。在一些示范例中,脂质体1包括一包覆层10及一内层空间20。于此,包覆层的数量为1层,且此包覆层10的内侧形成一内层空间20。
65.在一些实施例中,脂质体1包括多个包覆层10及多个内层空间20,如图6及图7所示。请参阅图6,在一些示范例中,当脂质体1包括二个包覆层(以下称第一包覆层10及第二包覆层11)及二个内层空间(以下称第一内层空间20及第二内层空间21)。作为最外层的第一包覆层10包覆外径长度较小的第二包覆层11,且第一包覆层10及第二包覆层11之间形成第一内层空间20,并第二包覆层11的内侧形成第二内层空间21。其中,第一包覆层10的双层膜包括第一磷脂质层101及第二磷脂质层102,且第二包覆层11的双层膜包括第一磷脂质层111及第二磷脂质层112。
66.请参阅图7,在一些示范例中,当脂质体1包括三个包覆层(以下称第一包覆层10、第二包覆层11及第三包覆层13)及三个内层空间(以下称第一内层空间20、第二内层空间21及第三内层空间23)。作为最外层的第一包覆层10包覆外径长度较小的第二包覆层11,且第一包覆层10及第二包覆层11之间为第一内层空间20。并且,第二包覆层11包覆外径长度更小的第三包覆层13,且第二包覆层11及第三包覆层13之间为第二内层空间21,并第三包覆层13的内侧形成第三内层空间23。其中,第一包覆层10的双层膜包括第一磷脂质层101及第二磷脂质层102,第二包覆层11的双层膜包括第一磷脂质层111及第二磷脂质层112,且第三包覆层13的双层膜包括第一磷脂质层131及第二磷脂质层132。
67.需要特别说明的是,包覆层10及内层空间20的数量可以为但不限于2、3、4个,于此为例示做说明,但并不以此为限。
68.在一些实施例中,至少一包覆层10的内侧形成至少一内层空间20,且可用以包覆效性成分。因此,当脂质体1更包括效性成分时,效性成分可位于内层空间20中。
69.在一些实施例中,脂质体1为一中空状球体结构,且具有一内层空间20,用以包覆效性成分。在一些实施例中,脂质体1包括多个具有中空状球体结构的包覆层10,且各包覆层10依照体积大小由小至大依序包覆。并且,由于各包覆层10均为中空状,因此各包覆层10之间形成多个内层空间20。于此,各内层空间20可用以包覆效性成分。
70.在一些实施例中,至少一包覆层10的外径l长度为200奈米(nm)~400nm。举例来说,脂质体1的外径l可以为200nm、250nm、300nm、350nm及400nm。
71.于此,在一些实施例中,当以含有5重量%~30重量%的效性成分、0.1重量%的卵
磷脂、2重量%~5重量%的阿拉伯胶、63.9125重量%~92.9重量%的溶剂的混合液经由300巴~400巴均质处理形成含有结构稳定的多个脂质体1的脂质体悬浮液时,所得到的脂质体1,其结构稳定并可稳定包覆效性成分,进而可有效的保护其内的效性成分不受外在因素(如,消化液)影响。
72.并且,在一些实施例中,含有稳定包覆效性成分的多个脂质体1的脂质体悬浮液可作为食品(如,营养补充剂)、医药品等,或作为制作食品或医药品的材料。
73.于此,当受体服用含有其内包覆有效性成分(如,维生素c、虾青素、辅酶q10)的脂质体1的脂质体悬浮液所制成的营养补充剂时,脂质体1的稳定包覆结构能有效地降低受体消化环境对于效性成分的影响(如,破坏或降解),且脂质体1的双层磷脂质结构能使脂质体1能与受体细胞膜结合,并使脂质体1内的效性成分能有效地为受体肠道所吸收。
74.在一些示范例中,将0.1重量%的卵磷脂、2重量%~5重量%的阿拉伯胶、10重量%的维生素c及84.9重量%~87.9重量%的水混合并搅拌均匀以形成预混溶液。接着,将预混溶液以80目数的网目过筛以形成混合液。
75.在一实施态样中,将混合液以95℃
±
5℃灭菌30分钟,并以300巴~400巴均质灭菌后的混合液以形成脂质体悬浮液,且此脂质体悬浮液含有其内包覆有维生素c的多个脂质体1。
76.在另一实施态样中,以300巴~400巴均质混合液以形成脂质体悬浮液。接着,将脂质体悬浮液以95℃
±
5℃灭菌30分钟。于此,脂质体悬浮液含有其内稳定包覆有维生素c的多个脂质体1。
77.例1:含有维生素c的脂质体1的制备(前杀处理)
78.于此,依照表1的配方成分及配方比例配置6组的混合液。其中,对照组为c1组至c4组,而实验组为e1组至e2组。并且,c1至c4组及e1至e2组的灭菌程序是在均质处理之前进行。换言之,c1至c4组及e1至e2组的制备流程为前杀处理。
79.表1
[0080][0081]
于此,混合液总重量为100克。首先,将大豆卵磷脂与部分水以重量比(w/w)1:50混合,并于室温(25℃)下搅拌以确认卵磷脂溶解于部分水中,以形成第一预混溶液。并且,将阿拉伯胶、关华豆胶、三仙胶、蔗糖素、己二烯酸钾、维生素c及其余水混合以形成第二预混溶液。并且将第一预混溶液及第二预混溶液混合并搅拌均匀以确保大豆卵磷脂、阿拉伯胶、关华豆胶、三仙胶、蔗糖素、己二烯酸钾、维生素c完全溶解于水中,并以水定量使总重量为
100克,以形成第三预混溶液。接着,将定量后的第三预混溶液以80目数的网目过筛以形成混合液。于此,所有组别的各混合液中,皆含有10重量%的维生素c。
[0082]
接着,将混合液进行灭菌程序,且灭菌程序的设定值为95℃
±
5℃灭菌30分钟。待灭菌后的混合液降温至50℃时,以均质仪器(品牌:gea niro soavi,型号:panda plus)将降温后的混合液进行均质处理,以形成脂质体悬浮液,其中均质处理中设定的压力值为350巴。于此,脂质体悬浮液含有其内包覆有维生素c的多个脂质体1。
[0083]
例2:含有维生素c的脂质体1的制备(后杀处理)
[0084]
于此,依照表2的配方成分及配方比例配置6组的混合液。其中,对照组为c5组至c8组,而实验组为e3组至e4组。并且,c5至c8组及e3至e4组的灭菌程序是在均质处理之后进行。换言之,c5至c8组及e3至e4组的制备流程为后杀处理。
[0085]
表2
[0086][0087]
于此,混合液总重量为100克。首先,将大豆卵磷脂与部分水以重量比1:50(w/w)混合,并于室温(25℃)下搅拌以确认卵磷脂溶解于部分水中,以形成第一预混溶液。并且,将阿拉伯胶、关华豆胶、三仙胶、蔗糖素、己二烯酸钾、维生素c及其余水混合以形成第二预混溶液。并且将第一预混溶液及第二预混溶液混合并搅拌均匀以确保大豆卵磷脂、阿拉伯胶、关华豆胶、三仙胶、蔗糖素、己二烯酸钾、维生素c完全溶解于水中,并以水定量使总重量为100克,以形成第三预混溶液。接着,将定量后的第三预混溶液以80目数的网目过筛以形成混合液。于此,所有组别的混合液中,均含有10重量%的维生素c。
[0088]
接着,将混合液于室温(25℃)下以均质仪器(品牌:gea niro soavi,型号:panda plus)进行均质处理以形成脂质体悬浮液,其中均质处理中设定的压力值为350巴。并且,将脂质体悬浮液进行灭菌程序,且灭菌程序的设定值为95℃
±
5℃灭菌30分钟。于此,脂质体悬浮液含有其内包覆有维生素c的多个脂质体1。
[0089]
例3:静置脂质体1稳定性测试
[0090]
于此,将例1制备的各组脂质体悬浮液及例2制备的各组脂质体悬浮液于室温(25℃)下静置一天,以观察脂质体悬浮液是否出现分层现象。并且,若脂质体悬浮液为均匀的无分层液体,代表其内的脂质体1结构较稳定。反之,若脂质体悬浮液有明显分层且颜色较为混浊不均匀时,代表其含有的脂质体1的结构较不稳定。换言之,由于脂质体1的包覆层10破裂,并未形成脂质体1,进而使脂质体悬浮液产生明显分层的现象。
[0091]
请参阅图8。c1组及c3组的脂质体悬浮液产生明显分层,代表当混合液中含有1重
量%的大豆卵磷脂时,无论是3重量%或是5重量%的阿拉伯胶都无法将大豆卵磷脂与水混合均匀,即乳化作用不显著,且所得的脂质体1结构不稳定。c2组及c4组虽然无明显分层,但相较于e1及e2组,c2组及c4组的脂质体悬浮液较混浊。e1组及e2组的脂质体悬浮液无明显分层,代表当混合液中含有0.1重量%的大豆卵磷脂时,3重量%或是5重量%的阿拉伯胶即可有效的将大豆卵磷脂与水混合均匀,即乳化作用显著。由此可知,当混合液包含0.1重量%~0.5重量%的大豆卵磷脂及3重量%~5重量%的阿拉伯胶,且混合液经由前杀处理所得的脂质体悬浮液无明显分层。换言之,以0.1重量%的大豆卵磷脂及3重量%~5重量%的阿拉伯胶所制得的脂质体1的结构稳定性较佳。
[0092]
请参阅图9。c5组、c6组、c7组及c8组的脂质体悬浮液均产生明显分层,代表当混合液中含有0.5重量%或1重量%的大豆卵磷脂时,无论是3重量%或是5重量%的阿拉伯胶都无法将大豆卵磷脂与水混合均匀,即乳化作用不显著,且所得的脂质体1结构不稳定。相较于对照组,e3组及e4组的脂质体悬浮液无明显分层,代表当混合液中含有0.1重量%的大豆卵磷脂时,3重量%或是5重量%的阿拉伯胶即可有效的将大豆卵磷脂与水混合均匀,即乳化作用显著。由此可知,当混合液包含0.1重量%的大豆卵磷脂及3重量%~5重量%的阿拉伯胶,且混合液经由后杀处理所得的脂质体悬浮液无明显分层。换言之,以0.1重量%的大豆卵磷脂及3重量%~5重量%的阿拉伯胶所制得的脂质体1的结构稳定性较佳。
[0093]
例4:离心脂质体1稳定性测试
[0094]
于此,自例1制备的各组脂质体悬浮液及例2制备的各组脂质体悬浮液分别取1毫升至微量离心管中。并于20℃
±
5℃下以转速2000rpm离心1小时,以将脂质体悬浮液分离为上清液及沉淀物,如图10及图11所示。于此,当沉淀物与上清液的颜色明显差异时,代表脂质体悬浮液的乳化作用不佳,其含有的多个脂质体1的结构较不稳定。
[0095]
请参阅图10。c1组、c2组、c3组及c4组的脂质体悬浮液在离心后可见明显沉淀物,且沉淀物于上清液的颜色差异较明显,代表阿拉伯胶并未将大豆卵磷脂与水混合均匀,进而使所得的脂质体悬浮液产生分层的现象。相较于对照组,e1组及e2组的沉淀物较不明显,其沉淀物的颜色与其上清液的颜色差异较小,代表阿拉伯胶已将大豆卵磷脂与水混合均匀,进而使所得的脂质体悬浮液无产生分层的现象。由此可知,以0.1重量%的大豆卵磷脂及3重量%~5重量%的阿拉伯胶所制得的脂质体1的结构稳定性较佳。
[0096]
请参阅图11。c5组、c6组、c7组及c8组的脂质体悬浮液在离心后可见明显沉淀物,且沉淀物于上清液的颜色差异较明显,代表阿拉伯胶并未将大豆卵磷脂与水混合均匀,进而使所得的脂质体悬浮液产生分层的现象。相较于对照组,e3组及e4组的沉淀物较不明显,其沉淀物的颜色与其上清液的颜色差异较小,代表阿拉伯胶已将大豆卵磷脂与水混合均匀,进而使所得的脂质体悬浮液无产生分层的现象。由此可知,以0.1重量%的大豆卵磷脂及3重量%~5重量%的阿拉伯胶所制得的脂质体1的结构稳定性较佳。
[0097]
于此可知,无论制备流程中灭菌程序为前杀处理或后杀处理,以0.1重量%的大豆卵磷脂及3重量%~5重量%的阿拉伯胶所制得的脂质体悬浮液均无浮油现象,且其含有的多个脂质体1的结构均具有较高的稳定性。
[0098]
例5:维生素c含量测试
[0099]
于此,将例4离心后的各组脂质体悬浮液所得到的上清液及沉淀物作为检体分别进行维生素c含量检测。
c7组的沉淀物所量测到的维生素c的含量。由此可知,在同样的处理条件下,实验组的沉淀物所量测到的维生素c的含量明显高于对照组的沉淀物所量测到的维生素c的含量。
[0110]
于此,可知以0.1重量%的大豆卵磷脂及3重量%~5重量%的阿拉伯胶所制得的脂质体悬浮液中,含有稳定包覆维生素c的脂质体1且此脂质体1的结构稳定性较佳。并且,所含有的脂质体1可包覆较多的效性成分(如,维生素c)。
[0111]
例6:电子显微镜
[0112]
于此,依照表4的配方配置二组混合液,分别为实验组1及实验组2。其中,实验组1及实验组2的差异在于实验组1的混合液含有的阿拉伯胶为5克(5重量%)、水为84.5125克,而实验组2的混合液含有的阿拉伯胶为2克(2重量%)、水为87.5125克。其余成分的含量皆相同。接着,通过例2所述的制备步骤将配置好的混合液进行均质处理、灭菌程序等步骤,以形成脂质体悬浮液。
[0113]
表4
[0114][0115]
接着,利用低温穿透式电子显微镜(cryo-electron transmission microscopy,cryo-tem;品牌:jeol,型号:jem-1400)观察二组脂质体悬浮液中的脂质体1,如图12及图13所示。请参阅图12,脂质体1是以实验组1的配方配置的混合液(含有5重量%阿拉伯胶)所制得,其外形为球状,且外径l长度约为200nm~400nm。并且,由图12可知,同一组脂质体悬浮液中含有不同外径l长度的多个脂质体1。请参阅图13,脂质体1是以实验组2的配方配置的混合液(含有2重量%阿拉伯胶)所制得,其外形为球状,可明显观察到包覆层10及内层空间20。换言之,脂质体1的结构为中空状球体结构。并且,内层空间20中含有的深色物质为维生素c。由此可知,实验组1及实验组2所制得的脂质体悬浮液中均含有稳定包覆维生素c的脂质体1,且此脂质体1的结构稳定。
[0116]
于此,可知以0.1重量%的大豆卵磷脂及2重量%~5重量%的阿拉伯胶所制得的脂质体悬浮液中,均能含有稳定包覆维生素c的脂质体1且此脂质体1的结构为中空球体结构。
[0117]
例7:人体试验
[0118]
于此,依照表5的配方制备实验组及对照组的维生素c补充品(以下称待测样品)。其中实验组的待测样品是以脂质体型式包覆维生素c,而对照组的待测样品为单纯的维生素c溶液(非以脂质体型式包覆维生素c)。
[0119]
表5
[0120][0121]
其中,实验组的配置流程如下:将10mg的卵磷脂、500mg的阿拉伯胶、6.75mg的关华豆胶、55mg的玉米糖胶、30mg的柠檬酸、5mg的己二烯酸钾及1000mg的维生素c溶于8393.25mg的水中,并搅拌均匀以形成混合液。并将混合液于室温(25℃)下以350巴均质处理以形成脂质体悬浮液,接着将脂质体悬浮液以95℃
±
5℃灭菌30分钟。于此,将脂质体悬浮液制成液态包(10ml/包)作为实验组待测样品供受试者服用。
[0122]
其中,对照组的配置流程如下:将500mg的阿拉伯胶、6.75mg的关华豆胶、55mg的玉米糖胶、30mg的柠檬酸、5mg的己二烯酸钾及1000mg的维生素c溶于8403.25mg的水中,并搅拌均匀以形成混合液。接着将混合液以95℃
±
5℃灭菌30分钟。基此,将灭菌后的混合液制成液态包(10ml/包)作为对照组待测样品供受试者服用。
[0123]
受试者条件:20岁~60岁的健康成年人。
[0124]
受试者人数:10人。
[0125]
试验设计:受试者自身对照交叉试验。于服用其中一待测样品(实验组或对照组的液态包)后进行一次检测,接着于相隔14天后再服用另一待测样品(对照组或实验组的液态包),并进行二次检测。其中,每次检设前一天受试者需空腹8小时;检测当天将服用待测样品前视为0小时,并于服用待测样品后的0.5小时、1小时、2小时、3小时、4小时和8小时分别采血检测血液中维生素c浓度。
[0126]
检测方式:于服用待测样品后的0.5小时、1小时、2小时、3小时、4小时和8小时的6个时间点,使用含抗凝剂的绿头采血管收集受试者4毫升静脉血作为检体。将检体避光于室温(25℃)下静置30分钟。接着将静置后的检体于4℃以转速3500rpm离心10分钟以收集检体上清液(血浆),并将收集的血浆以生化比色法检测其内的维生素c含量。
[0127]
请参阅图14。受试者服用实验组待测样品8小时后,检测到的血液中维生素c含量为86.29μg
×
hr/ml,而受试者服用对照组待测样品8小时后,检测到的血液中维生素c含量为37.08μg
×
hr/ml。换言之,受试者吸收实验组的待测样品中的维生素c含量相较于对照组多了133%,代表以脂质体型式包覆维生素c的维生素c补充品能提高生物吸收率。
[0128]
由此可知,当以脂质体1包覆效性成分并制备效性成分的营养补充品时,脂质体1的包覆层10可保护位于内层空间20的效性成分,且以双层磷脂质构成的包覆层10有助于提高受体对于效性成分的生物吸收率。
[0129]
综上所述,根据本发明任一实施例的具有稳定包覆效性成分能力的脂质体1的制备方法可制备结构稳定的脂质体1,且此脂质体1具有良好且稳定的包覆能力。并且,任一实施例的具有稳定包覆效性成分能力的脂质体1的制备方法可用于制备结构稳定且可稳定包
覆效性成分的脂质体1。借此,通过任一实施例的具有稳定包覆效性成分能力的脂质体1的制备方法可提高脂质体1所包覆的效性成分的含量,且所制得脂质体1可提高受体对于此效性成分的生物吸收率。
[0130]
虽然本发明的技术内容已经以较佳实施例揭露如上,然其并非用以限定本发明,任何熟习此技艺者,在不脱离本发明之精神所作些许之更动与润饰,皆应涵盖于本发明的范畴内,因此本发明之保护范围当视后附之权利要求书所界定者为准。
[0131]
当然,本发明还可有其它多种实施例,在不背离本发明精神及其实质的情况下,熟悉本领域的技术人员可根据本发明作出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明权利要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。