用于免疫疗法的nk细胞组合物和制剂及其生产方法
1.相关申请的交叉引用
2.本技术要求2019年7月29日提交的美国临时申请号62/880,044、2019年8月28日提交的美国临时申请号62/892,779和2020年1月13日提交的美国临时申请号62/960,507的权益,它们的公开内容通过引用整体并入本文。
3.关于序列表的声明
4.与本技术相关的序列表以文本格式提供,以代替纸质副本,并在此通过引用并入本说明书中。包含序列表的所述文本文件名是72246_sequence_final_2020-07-28.txt。所述文本文件大小为144kb;创建于2020年7月28日;并正在通过efs-web随说明书一起提交。
技术领域
5.本公开提供了自然杀伤(nk)细胞组合物和/或制剂,以及制备和使用此类nk细胞组合物和/或制剂用于非自体免疫疗法的方法。所述nk细胞组合物和/或制剂可用于治疗广泛的病毒感染和细菌感染、癌症(包括实体瘤和恶性血液病(白血病、淋巴瘤))和其他疾病。
背景技术:
6.自然杀伤(nk)细胞是先天免疫系统的组成部分,对转化的靶细胞表现出多种细胞毒活性,例如产生某些细胞因子、直接细胞毒性和介导抗体依赖性细胞介导的细胞毒性(adcc)。nk细胞在宿主防御基本上任何病毒感染或癌症转化细胞和清除这些细胞方面发挥关键作用。此外,已经提出nk细胞作为各种疾病的免疫疗法(包括例如清除转化的癌细胞)的效应物。已经描述了用于产生nk细胞的各种方法,例如从诱导多能干细胞、外周血单个核细胞、外周血干细胞或祖细胞或脐带血干细胞或祖细胞产生。对于每种来源,nk细胞的特性取决于它们的产生方法。此类方法传统上依赖于多轮离体细胞分裂来产生足够数量的nk细胞,用于治疗目的。由此类过程产生的nk细胞在施用于病患后趋向于更成熟和/或更可能表现出耗竭。nk细胞耗竭可以表现为例如干扰素γ(ifnγ)、cd107a、颗粒酶b和/或穿孔素的产生减少、细胞裂解活性降低等。此类nk细胞在体内施用时可能活性更低或持久性较低。因此,仍然需要用于治疗目的的nk细胞群和包含所述nk细胞群的组合物,以及产生此类nk细胞群和/或组合物的方法,所述nk细胞群在施用于病患后表现出并保持更高水平的活性和/或持久性。
技术实现要素:
7.本公开提供了nk细胞制剂的组合物以及制备和使用此类用于免疫疗法的nk细胞组合物和/或制剂的方法。所述nk细胞组合物和/或制剂可用于治疗广泛的病毒感染、恶性肿瘤和其他疾病。所述nk细胞组合物和/或制剂可以由来源于多个人类供体(通常是至少两个或至少四个人类供体)或者完全匹配或部分匹配(错配)供体的cd56
(主要是nk)细胞组成。所述nk细胞组合物和/或制剂可以通过体外或离体扩增合并的、非hla匹配(未匹配)的cd34
造血干细胞和祖细胞(hspc),免疫匹配或部分免疫匹配(错配)的hspc,然后分化为
cd56
(主要是nk)细胞进行制备。重要的是,所得的nk细胞组合物和/或制剂,无论是免疫学上未匹配、匹配还是错配,都包含cd56
(主要是nk)细胞和cd56-(非nk)细胞的混合物。与现有技术中通常来源于成人供体可比较的nk细胞相比,通过所公开的方法产生的cd56
(nk)细胞是高效的,但较不成熟,因此在体内可能表现出更高细胞溶解活性和/或持久性。存在于本文所述的组合物和/或制剂中的非nk细胞,通常来源于骨髓并且支持nk细胞分化和活化,从而不需要外源性饲养细胞层。
8.在一些实施方案中,本公开的nk细胞组合物和/或制剂包含约50%至约80%的cd56
细胞和约50%至约20%的cd56-骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在产生所述cd56
期间产生的cd56-细胞被认为是cd56
细胞内源性的。在一些实施方案中,所述nk细胞组合物和/或制剂包含约50%至约85%的cd56
细胞和约50%至约15%的cd56-骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在一些实施方案中,通过所公开的方法产生的所述nk细胞组合物和/或制剂包含约55%至约65%的cd56
细胞和约45%至约35%的cd56-骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在一些实施方案中,所产生的nk细胞组合物和/或制剂包含约70%至约85%的cd56
细胞和约30%至约15%的cd56-骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。
9.上述cd56
亚群主要由nk细胞组成。除了cd56,所述cd56
细胞还可以高频率表达nkp30、nkp46、nkp44、nkg2a和/或颗粒酶b,中到高频率表达穿孔素和/或cd107a,低到中频率表达nkg2d,并且基本上没有表达杀伤细胞类免疫球蛋白受体(kir)。在一些实施方案中,所述cd56
细胞是kir-。(如本文所用,“kir
‑”是指kir家族成员kir2dl1、kir2ds1、kir2ds3、kir2ds5、kir2dl2、kir2dl3、kir2ds2、kir2ds4、kir3dl1和kir3ds1。)cd16(也称为fcγ受体iii(fcγriii))可以在通过本文描述的方法体外诱导分化的nk细胞上以低频率或中频率表达。在一些实施方案中,所述cd56-细胞中到高频率表达颗粒酶b,高频率表达cd107a且低频率表达穿孔素。在一些实施方案中,扩增的nk细胞组合物和/或制剂包含源自至少两个人类供体的细胞,与其他供体的hla类型不匹配且与将接受所述nk细胞的病患的hla类型不匹配。在其他实施方案中,所扩增的nk细胞组合物和/或制剂包含与受试者的hla类型免疫匹配的细胞。在其他实施方案中,所扩增的nk细胞组合物和/或制剂包含与所述受试者至少部分免疫匹配(错配)的细胞。
10.在一些实施方案中,提供了用于制备nk细胞组合物和/或制剂的体外或离体方法。所述方法通常包括选择多个脐带血和/或胎盘血单位,而无需相互免疫匹配;裂解或以其他方式消耗红细胞;消耗t细胞;富集cd34
造血干细胞和祖细胞(hspc);接着在扩增培养基中并在无饲养细胞的情况下培养富集cd34
的hspc足够长的时间以产生扩增的hspc细胞群,其中所扩增的hspc在所述扩增期间基本上不分化成cd56
(主要是nk)细胞;然后在含有细胞因子并且没有饲养细胞的分化培养基中培养所扩增的hspc细胞群足够的时间以产生包含约50至约80%cd56
细胞和约50至约20%内源性cd56细胞的nk细胞组合物和/或制剂。在一些实施方案中,nk细胞组合物和/或制剂包含约50%至约85%的cd56
细胞和约50%至约15%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在一些实施方案中,nk细胞组合物和/或制剂包含约55%至约65%的cd56
细胞和约45%至约35%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在一些实施方案中,nk细胞组合物和/或制剂包含约70%至约85%的cd56
细胞和约30%至约15%的cd56-骨髓衍生细胞,例如树
突细胞、巨噬细胞和粒细胞。所述cd56
亚群主要由nk细胞组成。除cd56外,所述cd56
细胞高频率表达nkp30、nkp46、nkp44、nkg2a和颗粒酶b,中到高频率表达穿孔素和cd107a,低到中频率表达nkg2d,并且基本上不表达kir。在一些实施方案中,所述cd56
细胞是kir-。(如本文所用,“kir
‑”是指kir2dl1、kir2ds1、kir2ds3、kir2ds5、kir2dl2、kir2dl3、kir2ds2、kir2ds4、kir3dl1和kir3ds1。)cd16以低或中频率表达。在一些实施方案中,所述cd56-细胞中到高频率表达颗粒酶b,高频率表达cd107a且低频率表达穿孔素。
11.在其他实施方案中,用于制备nk细胞组合物和/或制剂所述体外或离体方法包括,选择完全免疫匹配或错配的脐带血单位和/或胎盘血单位。可以通过本领域已知的任何方法进行免疫匹配。在选择所述脐带血和/或胎盘血单位之后,所述方法包括裂解或以其他方式消耗红细胞;消耗t细胞;富集cd34
造血干细胞和祖细胞(hspc);接着在扩增培养基中并在没有饲养细胞的情况下培养富集cd34
的hspc足够长的时间以产生扩增的hspc细胞群,其中所述扩增的hspc在所述扩增期间基本上不分化成cd56
(主要是nk)细胞;然后在含有细胞因子并且没有饲养细胞的分化培养基中培养所扩增的hspc细胞群足够长的时间以产生包含约50至约80%cd56
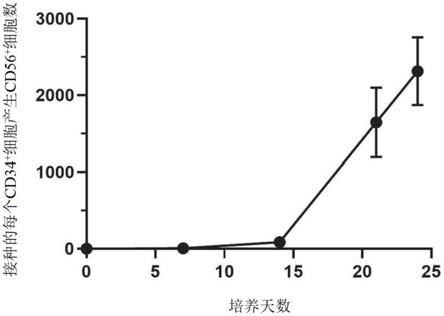
细胞和约50至约20%内源性cd56细胞的nk细胞组合物和/或制剂。在一些实施方案中,所述nk细胞组合物和/或制剂包含约50%至约85%的cd56
细胞和约50%至约15%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在一些实施方案中,所述nk细胞组合物和/或制剂包含约55%至约65%的cd56
细胞和约45%至约35%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在其他实施方案中,所述nk细胞组合物和/或制剂包含约70%至约85%的cd56
细胞和约30%至约15%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。所述cd56
亚群主要由nk细胞组成。除cd56外,所述cd56
细胞高频率表达nkp30、nkp46、nkp44、nkg2a和颗粒酶b,中到高频率表达穿孔素和cd107a,低到中频率表达nkg2d,并且基本上不表达kir。在一些实施方案中,所述cd56
细胞是kir-。(如本文所用,“kir
‑”是指kir2dl1、kir2ds1、kir2ds3、kir2ds5、kir2dl2、kir2dl3、kir2ds2、kir2ds4、kir3dl1和kir3ds1。)cd16也可以低或中频率表达。在一些实施方案中,所述cd56-细胞可以中到高频率表达颗粒酶b,高频率表达cd107a且低频率表达穿孔素。
12.在一些实施方案中,无论hspc是否源自未匹配、匹配或错配的脐带血单位,所述hspc扩增培养基在固相组织培养基质中包含白细胞介素-3(il-3)、白细胞介素-6(il-6)、血小板生成素(tpo)、flt-3配体(flt-3l)、干细胞因子(scf),所述固相组织培养基质预涂有notch配体和纤连蛋白或其片段。在一些实施方案中,添加到所述hspc体外或离体扩增培养基的唯一生长因子是il-3、il-6、tpo、flt-3l和scf。在一些实施方案中,所述hspc扩增培养基中的notch配体是delta1
ext-igg
。在一些实施方案中,所述纤连蛋白或其片段是重组人纤连蛋白或其片段。
13.现在扩增的hspc的分化包括它们的分离,以及所分离的hspc在补充有il-2和il-15以诱导分化的细胞培养基中的体外或离体培养。在一些实施方案中,添加到所述体外或离体分化培养基中的唯一细胞因子是il-2和il-15。在一些实施方案中,所述分化培养基中il-2和il-15的量为约25u/ml至约100u/ml的il-2和约25ng/ml至约50ng/ml的il-15。在其他实施方案中,所述分化培养基中il-2和il-15的量可以是约50u/ml的il-2和约40ng/ml的il-15。在一些实施方案中,所述分化培养基中的细胞因子包括il-2和il-15,其中其他细胞
因子,例如flt-3l、成纤维细胞生长因子2(fgf-2)、il-6、il-7、il-12、il-3、gm-csf、粒细胞集落刺激因子(g-csf)、白血病抑制因子(lif)、巨噬细胞抑制蛋白1α(mip-1α)、scf、il-21、il-18和4-1bbl(4-1bb配体),并不添加到所述分化培养基中。在一些实施方案中,所述分化培养基不包含除了所添加用于诱导所述nk细胞分化的il-2和il-15之外添加的细胞因子。
14.在本公开的某些实施方案中,在所述富集cd34
的hspc的扩增期间添加il-15以引发所述nk细胞组合物和/或制剂的分化。所述il-15可以在所述扩增阶段的最后4到7天添加。如果所述扩增阶段减少到7天,则用il-15引发可以在最后约4天进行。现在所扩增和引发的hspc的分化包括它们的分离,以及所分离的hspc在补充有il-2和il-15以诱导分化的细胞培养基中的体外或离体培养。在一些实施方案中,添加到所述体外或离体分化培养基中的唯一细胞因子是il-2和il-15。在一些实施方案中,所述分化培养基中il-2和il-15的量为约25u/ml至约100u/ml的il-2和约25ng/ml至约50ng/ml的il-15。在其他实施方案中,所述分化培养基中il-2和il-15的量可以是约50u/ml的il-2和约40ng/ml的il-15。在一些实施方案中,所述分化培养基中的细胞因子包括il-2和il-15,其中其他细胞因子,例如flt-3l、成纤维细胞生长因子2(fgf-2)、il-6、il-7、il-12、il-3、gm-csf、粒细胞集落刺激因子(g-csf)、白血病抑制因子(lif)、巨噬细胞抑制蛋白1α(mip-1α)、scf、il-21、il-18和4-1bbl(4-1bb配体),并不添加到所述分化培养基中。在一些实施方案中,所述分化培养基不包含除了所添加用于诱导nk细胞分化的il-2和il-15之外添加的细胞因子。
15.在本方法的某些实施方案中,用于补充所述分化培养基的非动物来源蛋白质是人ab血清、新鲜冷冻人血浆或人血小板裂解液。更进一步,在某些实施方案中,所述hspcs不是来源于体细胞、胚胎干细胞、外周血单个核细胞或诱导多能干细胞。
16.在本公开的某些实施方案中,所述方法产生nk细胞组合物和/或制剂,包含少于2%的cd3
细胞、少于2%的cd19
细胞和/或少于2%的cd34
细胞。所述组合物和/或制剂的cd56
细胞还高频率表达kir2dl4。在一些实施方案中,所述方法包括使用作为dxi的notch配体或notch特异性抗体。
17.在某些实施方案中,所述方法包括基因修饰所述nk细胞组合物和/或制剂。在某些具体实施方案中,所述基因修饰在所述扩增阶段进行,而在其他实施方案中,所述基因修饰在所述nk细胞分化之后进行。所述nk细胞组合物和/或制剂的细胞可以经基因修饰以表达抗原识别受体。在某些具体实施方案中,所述基因修饰是引入表达t细胞受体(tcr)或嵌合抗原受体(car)的多核苷酸。所述tcr或所述car可设计为特异性结合病毒抗原、细菌抗原或肿瘤特异性抗原或肿瘤相关抗原。
18.在所公开方法的某些实施方案中,所述病毒抗原存在于巨细胞病毒(cmv)、爱泼斯坦巴尔病毒(ebv)、人类免疫缺陷病毒(hiv)、单纯疱疹病毒(hsv)、肝炎病毒、寨卡病毒、流感病毒或冠状病毒中。在具体实施方案中,所述疱疹病毒是hsv 1或hsv2,所述肝炎病毒是甲型、乙型或丙型肝炎病毒,所述冠状病毒是sars-cov或sars-cov-2。
19.在某些其他实施方案中,所述car针对肿瘤特异性抗原或肿瘤相关抗原,所述抗原可以是cd19、ror1、her2、psma、psca、间皮素或cd20。
20.编码所述car的多核苷酸可以包含细胞内信号传导域,包含cd3zeta、cd28和4-1bb的信号传导域;至少一个共刺激域,包含cd27、cd28、4-1bb、2b4、dap10、dap12、ox40、cd30、cd40、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c或b7-h3的共刺激域;跨膜
域,包含cd8、cd28、cd3zeta、cd4、4-1bb、ox40、icos或nkg2d的跨膜域;以及间隔区,包含igg1的铰链区、免疫球蛋白的ch2ch3区、cd3的一部分、cd28的一部分或cd8的一部分。在一些实施方案中,所述car可以包含具有单克隆抗体fmc63的cdr的单链fv(scfv)。
21.在某些实施方案中,通过本文公开方法产生所述的nk细胞组合物和制剂可以配制用于输注到受试者中。
22.在本文公开的某些实施方案中,产生自然杀伤(nk)细胞组合物,用于免疫疗法。所述组合物可包含约50至约80%的cd56
细胞和约50至约20%的内源性cd56-细胞,或约50至约85%的cd56
细胞和约50至约15%的内源性cd56-细胞,其中所述cd56
细胞高频率表达nkp30、nkp46、nkp44、nkg2a、nkg2d和颗粒酶b,中到高频率表达穿孔素和cd107a,低到中频率表达cd16,并且基本不表达kir;并且其中所述cd56-细胞表达中到高频的颗粒酶b,高频率表达cd107a且低频率表达穿孔素,以及药学上可接受的载体。在具体实施方案中,所述nk细胞组合物不包含外源性饲养细胞。
23.在某些实施方案中,所述nk细胞组合物包含少于2%的cd3
细胞,和/或少于2%的cd19
细胞,和/或少于2%的cd34
细胞。在具体实施方案中,所述nk细胞组合物包含还高频率表达kir2dl4的cd56
细胞。
24.本文所述的nk细胞组合物可包含基因修饰的细胞。可以对所述组合物的基因修饰细胞进行基因修饰以表达抗原识别受体。这些抗原识别受体可以由引入的表达tcr或car的多核苷酸编码。在某些具体实施方案中,所述tcr或所述car可以特异性结合病毒抗原、细菌抗原或肿瘤相关抗原或肿瘤特异性抗原。在更具体的实施方案中,所述病毒抗原存在于巨细胞病毒(cmv)、爱泼斯坦巴尔病毒(ebv)、人类免疫缺陷病毒(hiv)、单纯疱疹病毒(hsv)、肝炎病毒、寨卡病毒、流感病毒或冠状病毒中。在更优选的实施方案中,所述疱疹病毒是hsv 1或hsv 2,所述肝炎病毒是甲型、乙型或丙型肝炎病毒,并且所述冠状病毒是sars-cov或sars-cov-2。
25.在某些实施方案中,所述nk细胞组合物和/或制剂包含tcr或car,所述tcr或car对肿瘤相关抗原或肿瘤特异性抗原具有特异性,所述抗原对以下具有特异性:碳酸酐酶ix(ca1x)、癌胚抗原(cea)、cd8、cd7、cd10、cd19、cd20、cd22、cd30、cd33、cll1、cd34、cd38、cd41、cd44、cd49c、cd49f、cd56、cd66c、cd73、cd74、cd104、cd133、cd138、cd123、cd142、cd44v6,抗原巨细胞病毒(cmv)感染的细胞抗原(例如,细胞表面抗原)、皮肤淋巴细胞相关抗原(cla;p-选择素糖蛋白配体1(psgl-1)的特化糖型)、上皮糖蛋白-2(egp-2)、上皮糖蛋白-40(egp-40)、上皮细胞粘附分子(epcam)、受体酪氨酸蛋白激酶erb-b2,3,4(erb-b2,3,4)、叶酸结合蛋白(fbp)、胎儿乙酰胆碱受体(achr)、叶酸受体-α、神经节苷脂g2(gd2)、神经节苷脂g3(gd3)、人表皮生长因子受体2(her2)、人端粒酶逆转录酶(htert)、白细胞介素-13受体亚基α-2(il-13ralpha2)、κ-轻链、激酶插入域受体(kdr)、lewis y(ley)、l1细胞粘附分子(l1cam)、黑色素瘤抗原家族a,1(mage-a1)、粘蛋白16(muc16)、粘蛋白1(muc1)、间皮素(msln)、erbb2、magea3、p53、mart1、gp100、蛋白酶3(pr1)、酪氨酸酶、生存素、htert、epha2、nkg2d配体、癌-睾丸抗原ny-es0-1、癌胚抗原(h5t4)、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(psma)、ror1、四跨膜蛋白8(tspan8)、肿瘤相关糖蛋白72(tag-72)、血管内皮生长因子r2(vegf-r2)、肾母细胞瘤蛋白(wt-1)、bcma、gpc3、nkcs1、egf1r、egfr-viii、crlf2和erbb。在更具体的实施方案中,所述肿瘤相关抗原或肿瘤特异性抗原是cd19、ror1、her2、
psma、psca、间皮素、crlf2或cd20。
26.在某些实施方案中,所述nk细胞包含抗原识别受体,所述抗原识别受体可以是car。在更具体的实施方案中,所述car可以包含cd3zeta、cd28和4-1bb的细胞内信号传导域;cd27、cd28、4-1bb、2b4、dap10、dap12、ox40、cd30、cd40、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c或b7-h3共刺激域的至少一个共刺激域;cd8、cd28、cd3zeta、cd4、4-1bb、ox40、icos或nkg2d的跨膜域;以及igg1的间隔区、免疫球蛋白的ch2ch3区、cd3的一部分、cd28的一部分或cd8的一部分。在某些实施方案中,
27.在某些实施方案中,所述nk细胞组合物还可以包含冷冻保护剂,并且所述nk细胞组合物被冷冻以备将来使用。在某些具体实施方案中,所述nk细胞组合物被配制用于输注到受试者中。所述配方可包含用于储存所述组合物的冷冻保护剂。所述nk细胞组合物可包含约5000万至约20亿个活细胞。在某些实施方案中,所述nk细胞组合物包含约5000万至约20亿个活cd56
细胞。
28.本公开还提供治疗有需要的受试者的方法,包括向所述受试者施用治疗有效量的上述nk细胞组合物。所述受试者可以患有例如表达肿瘤抗原的癌症,并且所述组合物的nk细胞表达与所述肿瘤抗原结合的抗原识别受体。在其他实施方案中,所述受试者患有病毒感染或细菌感染。在某些实施方案中,所述nk细胞组合物表达对肿瘤特异性抗原或相关抗原、病毒抗原或细菌抗原具有特异性的嵌合抗原受体。
附图说明
29.当结合附图时,通过参考以下详细描述,将更容易理解该方法和组合物和/或制剂的前述方面及许多附带优点,其中:
30.图1a和图1b显示了,按照实施例1中描述的方法生产的20批nk细胞组合物和/或制剂的结果。图1a显示了在28天培养过程(第一阶段和第二阶段)中cd56
细胞/起始cd34
细胞的增加。图1b展示了在28天细胞培养过程中cd56
细胞生成的增殖率。
31.图2显示了用人ab血清(habs)或人血小板裂解液(hpl)替代胎牛血清(fbs)对分化期间细胞扩增影响最小。
32.图3显示了用人ab血清(habs)或人血小板裂解液(hpl)替代fbs对产生的cd56
细胞百分比的影响最小。
33.图4显示了在培养第28天cd16
细胞相对于cd56
nk细胞的百分比,比较了培养的第二阶段(所述分化阶段)中使用的不同血清补充剂。
34.图5显示了在培养第28天nkp46
细胞相对于cd56
nk细胞的百分比,比较了培养的第二阶段中使用的不同血清补充剂。
35.图6显示了补充有hpl的培养物比补充有habs的培养物产生了更具细胞毒性的nk细胞群。
36.图7显示了补充有hpl的培养物比补充有habs的培养物产生了更具细胞毒性的nk细胞群。
37.图8显示了所述nk细胞组合物和/或制剂(称为nk细胞产品)对k562和a549靶细胞的活性相似(曲线中间用实心圆和三角形表示),并且比活化的成人nk细胞对a549靶细胞更有效。
38.图9显示了所述nk细胞组合物和/或制剂证明了对许多测试癌细胞系的细胞杀伤力。对于每个细胞系,左柱表示4小时的细胞毒性,右柱表示24小时的细胞毒性。所述k562细胞系是公认的nk细胞活性标准,可用作阳性对照。
39.图10展示了,与盐水注射对照相比,所述nk细胞产品能够减少肿瘤负荷。
40.图11a和图11b显示了体内小鼠模型的肿瘤反应。图11a是本研究的未处理对照(带有圆圈的线)和所述nk细胞组合物和/或制剂(带有正方形的线)的肿瘤大小随时间变化的曲线图。所述nk细胞组合物能够显著延迟肿瘤发展。图11b显示了所述nk细胞组合物持续存在并且在注射后37天可检测到,这通过检测肿瘤中的人cd45
细胞来测量。
41.图12a-12d显示用notch 1抗体扩增hspc(参见美国专利申请公开号2017/0107493,通过引用并入本文)与使用dxi扩增相当。
42.图13a和图13b显示nk细胞组合物和/或制剂(称为nk细胞产品)、k562或a549肿瘤细胞单独培养或一起培养三天。该研究一式三份地进行。三天后,通过luminex试验测定细胞因子水平。(所用测定的检测限为1pg/ml细胞因子)。当nk细胞组合物和/或制剂在有肿瘤细胞的情况下共培养时,ifnγ(图13a)和tnfα(图13b)水平均增加。这些结果表明,所述制剂中的nk细胞在有肿瘤细胞的情况下变得更有活性。
43.图14a-14e显示在第1、4、7、14或21天转导后观察到跨细胞谱系的转基因表达分布更加一致。
44.图15显示了包含tegfr作为选择标志物的表达构建体。s=gm-csf r的信号序列;v
l
=可变轻链;l=连接肽;vh=可变重链;h=人igg4的铰链间隔区;tm=cd28或nkg2d跨膜域;4-1bb=细胞内信号传导域;cd3zeta=细胞内信号传导域;2a=自切割肽。
45.图16显示了包含人il-15以支持nk细胞的表达构建体。s=gm-csf r的信号序列;v
l
=可变轻链;l=连接肽;vh=可变重链;h=人igg4的铰链间隔区;tm=cd28或nkg2d跨膜域;4-1bb=细胞内信号传导域;cd3zeta=细胞内信号传导域;2a=自切割肽。
46.图17a和图17b显示了在所述扩增阶段添加il-15以引发nk细胞分化使得cd56
细胞显著增加并且该过程是可再现的。这些图显示了以制造规模生产的4批nk细胞制剂的结果。图17a显示了在24天培养过程中(第一阶段和第二阶段)cd56
细胞/起始cd34
细胞的增加。图17b展示了在24天细胞培养过程中cd56
细胞生成的增殖率。
47.图18a至图18c显示了所述nk细胞制剂在长时间内连续杀死重复剂量的靶细胞的能力。图18a是新鲜的nk细胞制剂。图18b是冷冻保存和解冻的nk细胞制剂,图18c是新鲜nk细胞制剂每3天接受重复剂量的靶细胞共10天的试验。
48.图19显示了nk细胞制剂在kasumi-1 aml弥漫性肿瘤模型中的活性。通过生物发光成像测量kasumi-1肿瘤负荷,在经或未经nk细胞制剂处理的nsg小鼠中对该模型进行了测试。与注射缓冲液的对照治疗相比,所述nk细胞制剂显著抑制了肿瘤发展。
49.图20显示了图19中使用的所述kasumi 1aml模型中nsg小鼠的存活率。与注射缓冲液对照的小鼠相比,所述nk细胞制剂显著延长了小鼠的中位存活期。
50.图21显示了在转导的cd56
和cd56-细胞中,基于流式细胞仪的tcd19转基因表达检测作为car表达的间接度量。统计图显示了在用表达间皮素靶向car和由ef1alpha启动子驱动的截短cd19(tcd19)胞外域的慢病毒载体转导后,培养第28天细胞中cd56表达和tcd19表达的频率。在扩增的第7天,使用30的moi转导大量细胞两次,相隔3小时。
51.图22显示在24小时体外细胞毒性试验中,msln car-nk细胞或对照nk细胞对nomo-1或nomo-1
msln-/-aml肿瘤细胞的细胞毒活性。所述msln car-nk细胞对表达msln的nomo-1细胞的肿瘤细胞杀伤显著且特异性增加,但对nomo-1
msln-/-肿瘤细胞没有这种情况。对照nk细胞对所述nomo-1细胞 /-msln敲除物没有观察到杀伤力的差异。
52.图23显示了在富集cd56
细胞中,基于流式细胞仪的tcd19转基因表达检测作为car表达的间接度量。统计图显示了在用表达间皮素靶向car和由ef1alpha启动子驱动的截短cd19(tcd19)胞外域的慢病毒载体转导后,培养第27天细胞中cd56表达和tcd19表达(tx
)的频率。cd56
细胞通过磁珠分离富集,并在分化阶段培养的第23天使用40的moi进行转导。
53.图24显示了在24小时体外细胞毒性试验中,car-nk细胞或对照nk细胞对nomo-1细胞或nomo-1
msln-/-细胞的细胞毒活性。所述msln car-nk细胞对所述msln表达nomo-1细胞的肿瘤细胞杀伤显著且特异性增加,但对nomo-1
msln-/-细胞没有这种情况。对照nk细胞对nomo-1细胞 /-msln敲除物没有观察到杀伤力的差异。
具体实施方式
54.尽管与本文所述方法和材料类似或等效的任何方法和材料均可用于本发明细胞组合物和/或制剂的实践或测试,但本文还是描述了某些优选方法和材料。就本公开而言,下列术语定义如下。
55.如本文所用,“扩增的hspc”是指造血干细胞或干细胞和祖细胞,已经由用于离体扩增所述造血干细胞或造血干细胞和祖细胞的技术处理,该技术已被证明会使得(i)如此扩增的细胞等分试样中造血干细胞或造血干细胞和祖细胞的数量增加,或(ii)通过有限稀释分析确定的重度联合免疫缺陷(scid)再增殖细胞数量增加,如注入如此扩增细胞的等分试样的非肥胖糖尿病(nod)/scid小鼠中增强的植入效果所示。这些是相对于未进行扩增技术处理细胞的等分试样所看到的。(参见美国专利申请公开号2013/0095079;德莱尼(delaney)等人,《自然医学》(nature med.)16(2):232-236,2010)。通常,所述造血干细胞或干细胞和祖细胞是cd34
。在一些实施方案中,所述造血干细胞或造血干细胞和祖细胞来源于人脐带血和/或人胎盘血。在一些实施方案中,所扩增的干细胞使用notch-激动剂扩增方法制备。在一些实施方案中,所扩增的干细胞使用delta1
ext-igg
(dxi)扩增方法制备。
56.如本文所用,“化疗方案”是指限定要使用的药物、它们的剂量、治疗的频率和持续时间以及其他考虑因素的化疗方案。这样的方案可以将几种化疗药物与化疗联合。今天用于化疗的大多数药物是细胞抑制药物或细胞毒性药物。
57.本公开提供了包含自然杀伤(nk)细胞制剂的组合物以及使用此类nk细胞组合物和/或制剂用于免疫疗法的方法。所述nk细胞组合物和/或制剂可用于治疗广泛的病毒感染、恶性肿瘤和其他疾病,包括血液和非血液恶性肿瘤。nk细胞组合物和/或制剂由合并的、扩增的cd34
造血干细胞和祖细胞(hspc)产生。通常,在离体扩增之前或之后,组合或合并至少两种或多种,或最多至少四种不同人类供体的hspc,以产生扩增的hspc细胞群。然后将所扩增的细胞群离体分化以产生包含cd56
和cd56-细胞混合物的nk细胞组合物和/或制剂。所述cd56
细胞主要是nk细胞。构成所述细胞组合物和/或制剂一部分的所述cd56-细胞通常来源于骨髓并且在分化期间支持nk细胞分化和活化。在cd56
的离体生成期间产生的所述
cd56-细胞被认为是所述cd56
细胞内源性的。
58.在一些实施方案中,所述nk细胞组合物和/或制剂包含约50%至约80%的cd56
细胞和约50%至约20%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在一些实施方案中,所述nk细胞组合物和/或制剂包含约50%至约85%的cd56
细胞和约50%至约15%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在一些实施方案中,所述nk细胞组合物和/或制剂包含约55%至约65%的cd56
细胞和约45%至约35%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在一些实施方案中,所述nk细胞组合物和/或制剂包含约70%至约85%的cd56
细胞和约30%至约15%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。
59.除了cd56,所述cd56
细胞还可以高频率表达自然杀伤细胞蛋白nkp30、nkp46、nkp44和nkg2a,以及颗粒酶b;中到高频率表达穿孔素和cd107a;低到中频率表达nkg2d;并且基本上不表达kir。在一些实施方案中,所述cd56
细胞是kir-。(如本文所用,“kir
‑”是指kir2dl1、kir2ds1、kir2ds3、kir2ds5、kir2dl2、kir2dl3、kir2ds2、kir2ds4、kir3dl1和kir3ds1)。在一些实施方案中,cd16以低频率表达。在一些实施方案中,cd16以中频率表达。在一些实施方案中,所述cd56-细胞中到高频率表达颗粒酶b,高频率表达cd107a且低频率表达穿孔素。
60.在一些实施方案中,通过本文所述的方法产生的nk细胞组合物和/或制剂具有以下特征。
61.各种nk标志物的表达频率如下表所示。
62.表1.nk细胞标志物表达的频率
[0063][0064]
高表达是指约60%至约100%的频率。中表达是指约20%至约60%的频率。低表达是指约1%至约20%的频率。基本上不表达是指小于1%的表达频率。如本文所用,“kir
‑”是指kir2dl1、kir2ds1、kir2ds3、kir2ds5、kir2dl2、kir2dl3、kir2ds2、kir2ds4、kir3dl1和kir3ds1。
[0065]
在一些实施方案中,所述cd56
和cd56-细胞的标志物范围如表2和表3中所述:
[0066]
表2.cd56
细胞的nk细胞标志物范围
[0067][0068]
表3.cd56-细胞的nk细胞标志物范围
[0069][0070][0071]
在一些实施方案中,nk细胞组合物和/或制剂含有少于2%的cd3
细胞(t细胞)。在一些实施方案中,所述nk细胞组合物和/或制剂含有少于1%的cd3
细胞(t细胞)。在一些实施方案中,所述nk细胞组合物和/或制剂含有少于2%的cd19
细胞(b细胞)。在一些实施方案中,所述nk细胞组合物和/或制剂含有少于1%的cd19
细胞(b细胞)。在一些实施方案中,所述nk细胞组合物和/或制剂含有少于2%的cd34
细胞。在一些实施方案中,所述nk细胞组合物和/或制剂含有少于1%的cd34
细胞(hspc)。在一些实施方案中,所述nk细胞组合物和/或制剂含有少于2%的cd19
细胞(b细胞)、少于2%的cd3
(t细胞)和少于2%的cd34
细胞(hspc)。在一些实施方案中,所述nk细胞组合物和/或制剂含有少于1%的cd19
细胞、少于1%的cd3
(t细胞)和少于1%的cd34
细胞(hspc)。
[0072]
在人体中,nk细胞受克隆分布的杀伤性类免疫球蛋白受体(kir)的调节,这些受体识别由不同的人体白细胞抗原(hla)i类等位基因显示的同种异型决定簇。抑制性kir通常占优势并阻止nk细胞杀死自体细胞。通过本方法制备所述的nk细胞组合物和/或制剂缺乏mhc i类抑制信号。虽然表达高水平的nkg2a,但所述nk细胞组合物和/或制剂在体外可能比成人nk细胞更有活性。
[0073]
通过本文公开方法产生的所述nk细胞组合物和/或制剂的受体表型还可以包括高频率表达的天然细胞毒性受体nkp30、nkp44、nkp46,而所述cd56
细胞低至中频率表达nkg2d。本发明所述nk细胞组合物和/或制剂的cd56
细胞还可以通过低至中频率cd16表达识别。
[0074]
通过以与活化外周血nk细胞相似或更高的水平裂解各种肿瘤细胞系的能力也可以识别本公开分化的nk细胞(这在实施例中进一步描述)。因此,可以测量培养中细胞的细胞毒性能力,以验证nk细胞组合物和/或制剂的特征。
[0075]
如本公开方法中所述的离体制备分化的nk细胞包括两个单独的阶段,其中第一阶段涉及扩增hspc以产生扩增的hspc,并且其中第一阶段之后是第二阶段,在此期间,所扩增的hspc被分化形成nk细胞组合物和/或制剂。与现有技术相比,在任一阶段均不使用饲养细胞。
[0076]
所扩增的hspc包含已离体扩增(例如,用notch配体)并耗竭t细胞和红细胞的造血干细胞或干细胞和祖细胞。所扩增的hspc通常是cd34
造血干细胞或干细胞和祖细胞,并且通常来源于不是hla匹配的不同人类来源。在一些实施方案中,所扩增的hspc是不同人脐带血来源和/或胎盘血来源的cd34
造血干细胞或干细胞和祖细胞。所述造血干细胞或干细胞和祖细胞包含多种hla类型,因为hspc在合并之前彼此不匹配。如本文所用,耗竭t细胞是指在扩增的hspc中少于2%的cd3
细胞(t细胞),或少于1%的cd3
细胞(t细胞),或少于0.5%的cd3
细胞(t细胞),或少于0.1%cd3
细胞(t细胞)。
[0077]
在某些实施方案中,所述造血干细胞或造血干细胞和祖细胞已与病患进行免疫匹配,该病患将接受作为免疫疗法的所述nk细胞组合物和/或制剂。所述免疫匹配可以是完全匹配或至多2、3或有时4种免疫型的部分错配。在包含所述造血干细胞或造血干细胞和祖细胞的大多数组合物中,已经在最常见的hla抗原(例如hla a-2、hla-b7等)或通过hla连接进行的高频率组合匹配。将根据要治疗的病患群体来选择匹配。
[0078]
在一些实施方案中,所述cd34
造血干细胞或造血干细胞和祖细胞源自脐带血和/或胎盘血(人脐带血或人胎盘血)。这种血液可以通过本领域已知的方法获得。参见例如美国专利号5,004,681和7,147,626以及美国专利申请公开号2013/0095079,讨论在人出生时收集脐带血和胎盘血。脐带血和/或人胎盘血采集是在无菌条件下进行的。在采集时,脐带血和/或胎盘血可以与抗凝剂混合,例如cpd(柠檬酸盐-磷酸盐-葡萄糖)、acd(酸性柠檬酸盐-葡萄糖)、阿尔塞维(alsever)溶液(阿尔塞维(alsever)等人,《纽约州医学杂志》(n.y st.j.med.)41:126,1941)、德高文(de gowin)溶液(德高文(de gowin)等人,《美国医学会杂志》(j.am.med.ass.)114:850,1940)、edglugate-mg(史密斯(smith)等人,《胸心血管外科杂志》(j.thorac.cardiovasc.surg.)38:573,1959)、劳斯-特纳(rous-turner)溶液(劳斯(rous)和特纳(turner)),《实验医学杂志》(j.exp.med.)23:219,1916)、其他葡萄糖混合物、肝素、双香豆酸乙酯等。参见,一般地胡恩(hurn),《血液储存》(storage of blood),学术出版社(academic press),纽约,pp.26-160,1968)。在一个实施方案中,可以使用acd。
[0079]
脐带血可以优选地通过从脐带直接引流和/或通过从递送的胎盘的根部和扩增静脉处针吸获得。优选地,所收集的人脐带血和/或胎盘血没有受到污染(例如,细菌或病毒),特别是病毒污染。
[0080]
在采集所述脐带血之前,可以确定产妇的健康史以识别脐带血细胞可能造成的风险,例如传播遗传病或传染病,如癌症、白血病、免疫疾病、神经系统疾病、肝炎或hiv/aids。收集的脐带血可以经过测试,例如,细胞活性、hla分型、abo/rh分型、cd34
细胞计数和有核细胞总计数中的一种或多种。
[0081]
一旦脐带血和/或胎盘血在出生时从人类供体收集,就要对血液进行处理以产生
富集的hspc。优选地,所述hspc是cd34
细胞或主要是cd34
细胞。所述hspc通常耗竭了t细胞和红细胞,从而获得富集的hspc。如本文所用,耗竭t细胞是指存在少于约2%的cd3
细胞、少于约1%的cd3
细胞,或少于约0.5%的cd3
细胞,或少于约0.1%的cd3
细胞。因此,富集是指细胞群中hspc的百分比增加的过程(相对于富集程序之前在细胞群中的百分比)。纯化是富集的一个示例。
[0082]
在进行富集处理之前,所收集的脐带血和/或胎盘血可以是新鲜的,也可以是先前冷冻保存的。本领域已知用于细胞分离/选择的任何合适技术都可以用于hspc的富集。可以使用依赖于差异表达细胞表面标志物的方法。例如,表达细胞表面标志物cd34的细胞可以使用cd34特异性的单克隆抗体进行阳性选择,从而将表达cd34的细胞与不表达cd34的细胞分离。此外,所采用的分离技术优选地使要选择细胞的活性最大化。所采用的特定技术取决于分离效率、方法的细胞毒性、操作的简洁性和速度,以及精密设备和/或技术技能的必要性。
[0083]
分离程序可以包括磁分离(使用抗体预涂的磁珠)、亲和层析,以及用附着到固体基质(例如培养板)上的抗体“淘选”,或其他方便的技术。进行准确分离/选择的技术包括荧光激活细胞分选仪,其可以具有不同的复杂度,例如,多个颜色通道、低角度和钝角光散射检测通道、阻抗通道等。
[0084]
选择过程中使用的抗体可以轻松分离特定细胞类型,并且可以与标志物(例如磁珠)缀合,从而实现直接分离;生物素,可以通过粘附到与支持物结合的亲和素或链霉亲和素来去除;荧光染料,可与荧光激活细胞分选仪一起使用等。可以采用任何不会过度损害剩余细胞活性的技术。
[0085]
在优选的实施方案中,新鲜脐带血单位或冷冻和解冻的脐带血单位使用直接或间接与磁性颗粒缀合的抗cd34抗体与磁性细胞分离器进行处理以富集cd34
hspc,例如,所述磁性细胞分离器可以是细胞分离系统(德国贝尔吉施格拉德巴赫市的美天旎生物技术公司(miltenyi biotec(美天旎生物技术公司)),它采用由氧化铁和与特定单克隆抗体结合的葡聚糖组成的纳米级超顺磁性颗粒。细胞分离器是封闭的无菌系统,配备一次性使用的管组。所述一次性管组可用于处理单个单位的所收集的脐带血和/或胎盘血以富集cd34
hspc,然后丢弃。
[0086]
在典型的实施方案中,可以在富集hspc之前合并两个或多个,或最多至少四个或多个脐带血和/或胎盘血单位。在另一个实施方案中,cd34
hspc的单个群可以在富集所述hspc后合并。在具体实施方案中,合并的脐带血和/或胎盘血单位或hspc群的数量为2、4、5、6、7、8、9、10、15、20、25、30、35,或40,或至少前述数字中的任何一个。合并的单个hspc群的数量可以取决于例如每个单个群中的细胞数量,和/或特定病患和预期免疫疗法所需的细胞数量。在一些实施方案中,所述细胞池包含2至8、4至8、2至10、4至10、4至20或4至25,并且不超过20或25个脐带血和/或胎盘血单位,或cd34
hspc群。在典型的实施方案中,可以合并脐带血和/或胎盘血单位或造血干细胞或干细胞和祖细胞群,而不考虑hspc的hla型。在一些实施方案中,组合细胞池中的细胞而不考虑种族或民族。在一些实施方案中,所述细胞池中的细胞来源于相同种族(例如非洲裔美国人、高加索人、亚洲人、西班牙裔、美洲原住民、澳大利亚土著、因纽特人、太平洋人岛民)个体的脐带血和/或胎盘血,或来源于相同民族(例如爱尔兰人、意大利人、印度人、日本人、中国人、俄罗斯人等)个体的脐带血和/或胎盘
血。在不太常见的实施方案中,所述细胞可以来自与所述病患匹配或部分匹配的单个细胞群。如果有足够数量的匹配或部分匹配单位可用,则可以合并所述单位;但是,考虑到有时很难找到与特定病患匹配的单位,因此通常不会对匹配或错配的单位进行合并。
[0087]
通常,在富集hspc之前,分离所述脐带血和/或胎盘血的红细胞和白细胞。在一些实施方案中,红细胞的耗竭是指将红细胞从白细胞中分离出来。一旦发生红细胞和白细胞的分离,可以丢弃所述红细胞部分,并且可以处理所述白细胞部分,例如,在如上所述的磁性细胞分离器中以富集cd34
hspc。所述白细胞部分和所述红细胞部分的分离可以通过本领域已知的任何方法进行,包括例如离心技术。可以使用的其他分离方法包括使用市售产品ficoll
tm
或ficoll-paque
tm
或percoll
tm
(新泽西州皮斯卡塔韦市的通用电气医疗保健公司(ge healthcare))。ficoll-paque
tm
通常放置在锥形管的底部,全血在上面分层。离心后,所述锥形管中从上到下可见以下层:血浆和其他成分(一层单核细胞),称为血沉棕黄层,包含单核细胞(白细胞),以及应当以颗粒形式存在的红细胞和粒细胞。这种分离技术可以轻松收获单核细胞。
[0088]
任选地,在cd34
细胞选择之前,可以检查所述脐带血和/或胎盘血单位的等分试样的有核细胞总计数和/或cd34
细胞含量。在具体实施方案中,在所述cd34
细胞选择之后,cd34
和cd34-细胞部分都被回收。任选地,即使通常不进行所述cd34
细胞与其他脐带血和/或胎盘血细胞的hla匹配,也可以从所述cd34-细胞部分的样本中提取dna,用于初始hla分型和未来的嵌合研究。
[0089]
所述富集cd34
的hspc可以在扩增之前进行后续处理,例如,通过在合适的细胞培养基中悬浮进行储存或运输。在优选的实施方案中,细胞培养基是适合维持cd34
hspc活性的细胞培养基。例如,所述细胞培养基可以是无血清、无细胞因子的造血干细胞或干细胞和祖细胞培养基,其中添加了例如以下浓度的生长因子:50-300ng/ml的干细胞因子(scf)、50-300ng/ml的flt-3受体配体(flt3l)、50-100ng/ml的血小板生成素(tpo)、50-100ng/ml的白细胞介素-6(il-6)和10ng/ml的白细胞介素-3(il-3)。在更具体的实施方案中,所述细胞培养基含有300ng/ml的干细胞因子、300ng/ml的flt-3受体配体、100ng/ml的tpo、100ng/ml的il-6和10ng/ml的il-3;或50ng/ml的scf、50ng/ml的flt-3l、50ng/ml的tpo、50ng/ml的il-6和10ng/ml的il-3。在另一个优选的实施方案中,所述细胞培养基包括无血清的造血干细胞或干细胞和祖细胞培养基(例如,stemspan
tm
无血清扩增培养基或stemspan
tm
无血清扩增培养基ii(不列颠哥伦比亚省温哥华市的干细胞技术公司(stemcell technologies))),或由它们组成,所述培养基补充有10ng/ml重组人白细胞介素-3(rhil-3)、50ng/ml重组人白细胞介素-6(rhil-6)、50ng/ml重组人血小板生成素(rhtpo)、50ng/ml重组人flt-3配体(rhflt-3l)、50ng/ml和重组人干细胞因子(rhscf)。在另一个优选的实施方案中,所述细胞培养基由无血清造血干细胞或干细胞和祖细胞培养基(例如,stemspan无血清扩增培养基ii(sfem ii,不列颠哥伦比亚省温哥华市的干细胞技术公司))组成,所述培养基补充有重组人rhscf、rhflt-3l、rhtpo、rhil-6(终浓度各为50ng/ml)和rhil-3(终浓度为10ng/ml)。
[0090]
在具体的实施方案中,所述脐带血和/或胎盘血单位是经红细胞耗竭的,并且测定红细胞耗竭部分中的cd34
细胞数量。在一些实施方案中,红细胞耗竭是指将红细胞从白细胞中分离或将红细胞从cd34
细胞中分离。优选地,包含超过350万个cd34
细胞的脐带血和/或胎盘血单位经上述富集方法处理。
[0091]
在根据上述富集方法或本领域已知的其他方法分离所述hspc(例如,出生时从人体采集的人脐带血和/或人胎盘血)后,将富集的hspc扩增以增加hspc(例如cd34
hspc)的数量。在细胞生长条件下(例如,促进有丝分裂的条件)于扩增培养基中培养所述hspc,使所述hspc生长和分裂(增殖)以获得扩增的cd34
hspc群。在所述hspc的扩增期间,hspc向nk细胞的分化最少(即,少于2%或少于1%的所得细胞是nk细胞)。在一个实施方案中,在扩增之前或之后,可以将各自来源于单个人出生时的脐带血和/或胎盘血的hspc单个群合并,而不匹配其他hspc的hla类型。在另一个实施方案中,所述hspc在合并之前被扩增。优选地,用于扩增的技术是,已显示相对于未扩增的hspc群,使得扩增的hspc中造血干细胞或造血干细胞和祖细胞(例如cd34
细胞)数量增加的技术,其中未扩增的细胞群和扩增的细胞群来自相同来源的hspc的不同等分试样,其中所述扩增的hspc而不是未扩增的hspc经所述扩增技术处理。
[0092]
扩增技术包括但不限于美国专利号7,399,633b2中描述的技术;美国专利申请公开号2013/0095079;德莱尼(delaney)等人,《自然医学》(nature med.)16(2):232-236,2010(通过引用并入本文);以及下面描述的技术。
[0093]
在一些实施方案中,所述hspc在生长因子存在下,于无血清且适合培养造血干细胞或干细胞和祖细胞的扩增培养基中进行体外或离体培养,并处于细胞生长条件(例如,促进有丝分裂的条件),从而使所述hspc增殖以产生扩增的hspc群。
[0094]
在示例性实施方案中,适合于扩增造血干细胞或干细胞和祖细胞的所述扩增培养基是具有如下所述notch配体和生长因子的无血清培养基,例如含有非动物来源的bsa、重组人胰岛素、人转铁蛋白、2-巯基乙醇和其他补充物的iscove's mdm培养基。在其他实施方案中,所述造血干细胞或干细胞和祖细胞培养基是stemspan
tm
无血清扩增培养基(不列颠哥伦比亚省温哥华市的干细胞技术公司),或stemspan
tm
无血清扩增培养基ii(不列颠哥伦比亚省温哥华市的干细胞技术公司)。
[0095]
在一些实施方案中,所述hspc在存有一定量notch配体(即,有效抑制分化的notch功能激动剂)——通常是notch功能的固定化激动剂的扩增培养基中培养,并处于细胞生长条件(例如,促进有丝分裂的条件),以使所述hspc增殖以产生扩增的hspc群。在所述扩增阶段,hspc向nk细胞的分化最小化(即,少于2%或少于1%的所得细胞是nk细胞)。在更优选的实施方案中,所述扩增培养基含有一定量的notch功能激动剂,可有效抑制分化和生长因子,并且所述hspc处于细胞生长条件(例如,促进有丝分裂的条件),使得所述造血干或造血干和祖细胞增殖以获得扩增的造血干细胞或干细胞和祖细胞群。所扩增的造血干细胞或干细胞和祖细胞群通常在扩增后转移到分化细胞培养基中。任选地,所述notch配体在所述分化阶段之前灭活或从所扩增的hspc细胞群中去除(例如,通过分离或稀释)。
[0096]
在一些实施方案中,培养所述造血干细胞或干细胞和祖细胞以扩增2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25天或更长时间;或者,优选地,培养所述造血干细胞或干细胞和祖细胞以扩增至少10天或约7至约14天。在一些实施方案中,将所述造血干细胞或干细胞和祖细胞培养约7天、约14天、约13天或约15天。应该注意的是,所述扩增的持续时间将取决于,实现所需或最大细胞数量同时保持产生所需细胞制剂所需的干细胞和祖细胞免疫表型质量/特征的水平。如果细胞增殖停止、活性下降或所述细胞开始大量丧失hspc的质量/特征,则将停止扩增。
[0097]
用于扩增所述造血干细胞或干细胞和祖细胞的示例性离体培养条件包括在无血清扩增培养基中,于存在纤连蛋白片段和与人igg(delta1
ext-igg
)fc域融合的delta蛋白胞外域的情况下,培养细胞7至14天,所述扩增培养基补充有以下人生长因子:scf、flt-3l、tpo、il-6和il-3。优选地,上述生长因子以以下浓度存在:50-300ng/ml scf、50-300ng/ml flt-3l、50-100ng/ml tpo、50-100ng/ml il-6和10ng/ml il-3。在更具体的实施方案中,使用300ng/ml scf、300ng/ml flt-3l、100ng/ml tpo、100ng/ml il-6和10ng/ml il-3,或50ng/ml scf、50ng/ml flt-3l、50ng/ml tpo、50ng/ml il-6和10ng/ml il-3。在更优选的实施方案中,所述扩增培养基(例如,stemspan
tm
无血清扩增培养基(不列颠哥伦比亚省温哥华市的干细胞技术公司))含有10ng/ml重组人白细胞介素-3(rhil-3)、50ng/ml rhil-6、50ng/ml rhtpo、50ng/ml rhflt-3l、50ng/ml和rhscf,或由它们组成。在另一个更优选的实施方案中,所述扩增培养基(例如,stemspan
tm
无血清扩增培养基ii(sfem ii,不列颠哥伦比亚省温哥华市的干细胞技术公司))含有rhscf、rhflt-3l、rhtpo、rhil-6(终浓度均为50ng/ml)和rhil-3(终浓度为10ng/mln),或由它们组成。
[0098]
在一些实施方案中,所述notch配体是dxi(delta1
ext-igg
),并且所述扩增阶段按如下进行:将delta1
ext-igg
(dxi)固定在细胞培养皿的表面上。在具体实施方案中,所述细胞培养皿在4℃下涂覆2.5μg/ml delta1
ext-igg
和5μg/ml(也称为rfn-ch-296的重组人纤连蛋白片段)的磷酸盐缓冲盐水过夜(或在37℃下至少2小时),然后加入富集的造血干细胞或干细胞和祖细胞。优选地,所述扩增培养基(例如,stemspan
tm
无血清扩增培养基或stemspan
tm
无血清扩增培养基ii(不列颠哥伦比亚省温哥华市的干细胞技术公司))补充有10ng/ml rhil-3、50ng/ml rhil-6、50ng/ml rhtpo、50ng/ml rhflt-3l和50ng/ml rhscf。
[0099]
在一些实施方案中,所述扩增培养基不包括除rhil-3、rhil-6、rhtpo、rhflt-3l和rhscf之外的生长因子。在一些实施方案中,所述扩增培养基不含以下添加的生长因子或细胞因子:il-7、gm-csf、g-csf、lif、mip-1a、il-2或il-15。在一些实施方案中,所述扩增培养基不含有以下添加的生长因子或细胞因子:il-7、gm-csf、g-csf、lif、mip-1a或il-2。在一些实施方案中,所述扩增培养基不含芳烃受体激动剂,例如美国专利号9,175,266或美国专利申请公开号2018/0237749中描述的芳烃受体激动剂;两者均以引用方式并入本文。
[0100]
在扩增所述造血干细胞或干细胞和祖细胞后,可以确定细胞和活cd34
细胞的总数。例如,在扩增期间的第14天,可以采集样本以确定活体的有核细胞总计数。此外,通过多参数流式细胞仪可以确定cd34
细胞的总数,从而确定所述样本中cd34
细胞的百分比。通常情况下,未使cd34
细胞绝对数量增加至少10倍的培养物将被终止。在优选的实施方案中,可以丢弃包含少于5000万个cd34
活细胞的那些群。
[0101]
活性可以通过本领域已知的任何方法确定,例如通过台盼蓝排除法或7-aad排除法。活cd34
细胞的百分比可以通过流式细胞仪和使用被活细胞排除的染色剂来评估。活cd34
细胞的百分比=所述样本等分试样中排除7-aad(或其他适当染色剂)的cd34
细胞数除以所述等分试样的总细胞数(tnc;活细胞和非活细胞)。所述样本中活cd34
细胞数可以计算如下:活cd34
细胞数=样本的tnc x所述样本中活cd34
细胞的百分比。活cd34
细胞在富集或扩增期间的增加比例可以计算如下:培养后活cd34
细胞总数/预培养活cd34
细胞总数。
[0102]
在一些实施方案中,所述造血干细胞或干细胞和祖细胞通过如上所述在扩增培养
基中,并存在notch功能激动剂和一种或多种生长因子或细胞因子的情况下离体培养给定时间段扩增所述造血干细胞或干细胞和祖细胞。notch功能激动剂,也称为notch激动剂或notch配体,是促进,即引起或增强notch通路功能激活的试剂。如本文所用,“notch功能”是指由notch信号传导(信号转导)通路介导的功能,包括但不限于notch胞内域的核转位、rbp-jκ或其果蝇同源物无毛抑制因子的核转位;分裂复合体增强子(例如mastermind)的bhlh基因的激活;hes-1基因或kbf2(也称为cbf1)基因的激活;果蝇成神经细胞分离的抑制;和notch与delta、jagged/serrate、fringe、deltex或rbp-jκ/无毛抑制因子或其同源物或类似物的结合。一般见科潘(kopan)等人,《细胞》(cell)137:216-233,2009的评论文章,讨论notch信号转导通路及其对激活的影响;另见雅里奥(jarriault)等人,《分子和细胞生物学》(mol.cell.biol.)18:7423-7431,1998。
[0103]
notch激活是通过细胞接触notch激动剂进行的。所述notch功能激动剂可以是但不限于固定在固相上的分子。示例性的notch激动剂是与notch胞外域结合并激活notch信号转导的胞外结合配体delta和serrate,或者是与notch胞外域结合并激活notch信号转导的delta或serrate片段。delta和serrate的核酸序列和氨基酸序列已经从包括人类在内的几个物种中分离出来,这些是本领域已知的,并且公开于国际专利公开号wo 93/12141、wo 96/27610、wo 97/01571,和格雷(gray)等人,《美国皮肤病理学杂志》(am.j.path.)154:785-794,1999.(全部内容以引用方式并入本文)。
[0104]
在优选的实施方案中,所述notch激动剂是由融合到myc表位标签蛋白质的胞外域组成的delta或serrate蛋白的固定化片段(分别为delta
ext-myc
或serrate
ext-myc
),或由融合到igg的fc部分的蛋白质胞外域组成的delta或serrate蛋白的固定化片段(分别为delta
ext-igg
或serrate
ext-igg)
。notch激动剂包括但不限于notch蛋白及其类似物和衍生物(包括片段);作为所述notch通路其他元件的蛋白质及其类似物和衍生物(包括片段);notch激动剂的抗体和含有其结合区的此类抗体的片段或其他衍生物;编码所述蛋白质和衍生物或类似物的核酸;以及与notch蛋白或所述notch通路中其他蛋白结合或以其他方式相互作用从而促进notch通路活性的蛋白质及其衍生物和类似物。此类激动剂包括但不限于,包含胞内域的notch蛋白及其衍生物、编码前述物质的notch核酸和包含notch配体的notch相互作用域(例如,delta或serrate的胞外域)的蛋白质。其他激动剂包括但不限于rbpjκ/无毛抑制因子或deltex。fringe可用于增强notch活性,例如与delta蛋白结合使用。这些蛋白质、其片段和衍生物可以被重组表达和分离,或者可以被化学合成。
[0105]
在又一个实施方案中,所述notch激动剂是与所述notch信号传导通路成员结合的肽模拟物或肽类似物或有机分子。这种激动剂可以通过选自本领域已知的结合测定来识别,例如瑞贝(rebay)等人,《细胞》(cell)67:687-699,1991和国际专利公开号wo 92/19734中描述的细胞聚集测定。(两者都通过引用并入本文)。
[0106]
在优选的实施方案中,所述激动剂是一种蛋白质,由至少一个由notch相互作用基因编码的蛋白质片段组成,该片段介导与notch蛋白质或notch片段的结合,该notch片段包含负责与所述激动剂蛋白结合的notch区域,例如notch的类表皮生长因子重复序列11和12。如本文所用,notch相互作用基因是指基因notch、delta、serrate、rbpjκ、无毛抑制因子和deltex,以及所述delta/serrate家族或deltex家族的其他成员(可通过序列同源性或遗传相互作用识别),以及更一般地,基因的“notch级联反应”或“notch组”成员,这通过分子
相互作用(例如,体外结合),或遗传相互作用(如表型所示,例如在果蝇中)识别。含有负责与notch结合的区域的notch结合蛋白片段描述于美国专利号5,648,464、5,849,869,和5,856,441中(均以引用方式并入本文)。
[0107]
本文所述方法所用的notch激动剂可以以商业方式获得、通过重组表达生产或化学合成。
[0108]
在具体的实施方案中,使所述细胞接触notch激动剂不是通过与在细胞表面上重组表达notch配体的其他细胞(例如饲养层)培育来完成,而是通过接触无细胞的notch配体,例如与notch的无细胞配体一起培育来完成,所述无细胞配体固定在固相的表面上,例如固定在组织培养皿的表面上。
[0109]
在具体实施方案中,notch活性通过notch配体(例如,delta、serrate)与notch受体胞外部分的结合来促进。notch信号传导似乎是由notch的胞外域与其配体之间的物理相互作用触发的,这些配体要么与相邻细胞膜结合,要么固定在固相表面上。全长配体是notch的激动剂,因为它们在一个细胞上的表达会触发激活邻近细胞中表达所述notch受体的通路。已固定在固相表面(例如组织培养板)的可溶性截短delta或serrate分子,包含所述蛋白质的胞外域或其notch结合部分,是特别优选的notch通路激动剂。此类可溶性蛋白质可以通过抗体或相互作用蛋白质固定在固相表面上,例如针对表位标签(例如由抗体9e10识别的myc表位标签)的抗体,通过所述表位标签将delta或serrate表达为融合蛋白,或与表位标签(例如,与蛋白a结合的免疫球蛋白表位标签)相互作用的蛋白质,通过所述表位标签将delta或serrate表达为融合蛋白。
[0110]
在另一个具体实施方案中,并如阿尔塔瓦尼斯-察科纳斯(artavanis-tsakonas)等人的美国专利号5,780,300所述,notch激动剂包括促进或激活细胞过程的试剂,例如,notch加工所需的类弗林蛋白酶转化酶、库兹巴尼亚蛋白(kuzbanian)、被认为是激活notch上游或平行于notch的notch通路所需的金属蛋白酶-解整合素(adam)(施隆多夫(schlondorff)和布洛贝尔(blobel),《细胞科学杂志》(j.cell sci.)112:3603-3617,1999),或者更一般地说,细胞运输和加工蛋白质,例如在细胞区室之间移动所需的rab gtp酶家族(有关rab gtp酶的综述,请参见奥尔科宁(olkkonen)和斯滕马克(stenmark),《国际细胞学评论》(int.rev.cytol.)176:1-185,1997),这些细胞过程介导激活notch或notch信号传导通路成员所需的成熟或加工步骤。所述激动剂可以是增强上述过程之一活性的任何分子,例如编码弗林蛋白酶、库兹巴尼亚蛋白或rab蛋白的核酸,或其片段或衍生物或显性活性突变体,或与上述蛋白质结合并激活其功能的肽模拟物或肽类似物或有机分子。
[0111]
美国专利5,780,300进一步公开了可用于激活所述notch通路的notch激动剂分子类别(及其鉴定方法),例如触发notch锚蛋白重复序列与rbp-jκ解离,从而促进rbp-jκ从细胞质转移到细胞核的分子。
[0112]
在一些优选实施方案中,使用包括dxi的扩增方法。所述notch激动剂dxi是delta的固定化片段,该片段由以下的胞外域组成:融合到igg的fc部分的蛋白质(delta
ext-igg
或dxi),如美国专利号7,399,633中所述;或是固定的notch-1或notch-2特异性抗体,如美国专利号10,208,286中所述。优选地,delta1
ext-igg
固定在所述细胞培养皿的表面。在具体实施方案中,所述细胞培养皿在4℃下用2.5μg/ml delta1
ext-igg
和5μg/ml(也称为rfn-ch-296的重组人纤连蛋白片段)的磷酸盐缓冲盐水涂覆过夜(或在37℃下至少2小
时),然后加入造血干细胞或干细胞和祖细胞。优选地,所述细胞培养基是无血清的造血干细胞培养基(例如,stemspan
tm
无血清扩增培养基或stemspan
tm
无血清扩增培养基ii(不列颠哥伦比亚省温哥华市的干细胞技术公司)),补充有10ng/ml rhil-3、50ng/ml rhil-6、50ng/ml rhtpo、50ng/ml rhflt-3l和50ng/ml rhscf。在该实施方案中,所述造血干细胞或干细胞和祖细胞培养7至14天。
[0113]
在某些实施方案中,相对于所述富集程序之前的细胞群,cd34
细胞数量在扩增的hspc中所占的百分比增加至少25倍、50倍、75倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍或至少350倍,并且优选为100-200倍或100-400倍。
[0114]
一旦获得扩增的造血干细胞或干细胞和祖细胞,就可以收集所扩增的造血干细胞或干细胞和祖细胞群(扩增的hspc)并冷冻保存,或者可以直接用于第二阶段以产生所述nk细胞组合物和/或制剂。
[0115]
所述nk细胞组合物和/或制剂是由扩增的hspc在所述过程第二阶段的分化产生的。在所述分化阶段,所述hspc在含有一定量的一种或多种细胞因子的分化培养基中培养,所述细胞因子有效诱导和引导hspc分化成nk细胞。
[0116]
在一些实施方案中,所述分化培养基中的所述细胞因子是il-2和il-15。在一些实施方案中,所述分化培养基中仅有的细胞因子是il-2和il-15。在一些实施方案中,所述分化培养基中il-2和il-15的量约25u/ml至约100u/ml的il-2和约25ng/ml至约50ng/ml的il-15。在一些实施方案中,所述分化培养基中il-2和il-15的量是约50u/ml的il-2和约40ng/ml的il-15。在一些实施方案中,所述分化培养基中的细胞因子包括il-2和il-15,其中其他细胞因子,例如flt-3l、fgf-2、il-6、il-7、il-12、il-3、gm-csf、g-csf、lif、mip-1α、scf、il-21、il-18和4-1bbl(4-1bb配体)并不添加到所述分化培养基中。在一些实施方案中,所述分化培养基不含添加的除il-2和il-15之外的细胞因子。
[0117]
在一个实施方案中,所述分化培养基还包括补充物,例如人血清或血浆,或提供广谱大分子、类脂物质和微量元素的载体蛋白、附着和扩散因子、激素,以及促进细胞生长和健康的生长因子的另一种蛋白质流体。在造血干细胞的早期细胞培养方法中,胎牛血清(fbs)被用作这种细胞培养补充物;然而,牛蛋白不能用于人类医药产品。因此,已经使用了各种人体生物流体,包括例如人血清、血浆、新鲜冷冻血浆、血小板裂解液等。在本方法的某些实施方案中,已使用人ab血清。在特别优选的实施方案中,使用了血小板裂解液。在一些实施方案中,所述分化培养基中包含约2.5%至约10%的人血小板裂解液。例如,所述分化培养基可包含约3%、约4%、约5%、约6%、约7%、约8%、约9%或多于约9%的人血小板裂解液。在包含人血小板裂解液的实施方案中,所述人血小板裂解液是通过诸如但不限于冷冻和解冻循环(例如1到6个循环)、超声处理、溶剂/去污剂处理或用钙或凝血酶活化的过程由人血小板(例如富血小板血浆(prp)、通过单采术收集的过期血小板等)产生的。人血小板可以源自多个不同个体的自体收集物和/或同种异体收集物。所述人血小板裂解液可以在考虑或不考虑影响组成和生物活性的以下因素的情况下使用:例如但不限于血浆含量、生长因子含量、供体年龄和性别、血小板计数、生产过程、是否存在肝素或抗凝剂、纤维蛋白原耗竭、是否存在细胞组分、是否存在代谢物、血型、储存条件(例如持续时间和/或温度)、减少/灭活病原体/病毒的处理等。(比贝克,k.(bieback,k.)等人,《输血》(transfusion)59:3448-3460,2019)。此外,所述人血小板裂解液可以是从商业来源或通过生产商业上可接受
的人血小板裂解液组合物的任何其他方法获得的可接受的组合物,该商业来源已经如所述处理了所述组合物。在一些实施方案中,新鲜冷冻血浆或约2.5%至约10%的人ab血清可以包含在所述分化培养基中而不是所述血小板裂解液中。在一些实施方案中,所述分化培养基不包括饲养层或饲养细胞。在一些实施方案中,所述分化培养基不含胎牛血清(fbs)、胎儿牛血清(fcs)和其他动物来源的产品并且不包括饲养细胞或饲养细胞层。
[0118]
尽管本文公开的方法通常且优选不使用饲养细胞层,但使用这种饲养细胞层确实不会改变本文所述方法的优点。如本文所用,“饲养细胞层”、“饲养层”或“饲养细胞”是指一类外源性细胞,与第二类细胞(例如,hspc)共培养,以提供所述第二类细胞可以维持的环境并且分化或增殖。不受任何理论束缚,饲养细胞可以向所述第二类细胞提供例如肽、多肽、电信号、有机分子、核酸分子、生长因子、其他因子(例如细胞因子)和代谢营养物。
[0119]
在本方法的优选实施方案中,所述nk细胞组合物和/或制剂不包含外源添加的细胞,例如外源性抗原呈递细胞(例如,树突细胞)。如本文所用,所述外源性细胞是指并非源自扩增和/或分化的hspc的细胞。
[0120]
所述hspc在所述分化培养基中体外或离体培养的时间足以产生所述nk细胞组合物和/或制剂。在一些实施方案中,所述分化的时间段为约7至21天、约7至14天、约12至16天、约14至16天、约7天或约14天。所选择的时间段可以取决于培养时使用的温度、所使用细胞因子的浓度和其他因素。
[0121]
所述分化nk细胞的状态可以通过流式细胞仪监测,并通过用抗cd56抗体染色所述细胞来确定cd56
细胞的发育。
[0122]
所得nk细胞组合物和/或制剂可含有约50%至约80%的cd56
细胞和约50%至约20%的内源性cd56-细胞。在一些实施方案中,所述nk细胞组合物和/或制剂包含约50%至约85%的cd56
细胞和约50%至约15%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。在一些实施方案中,所述nk细胞组合物和/或制剂包含约55%至约65%的cd56
细胞和约45%至约35%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。所述cd56
细胞主要是nk细胞。在一些实施方案中,所述nk细胞组合物和/或制剂包含约70%至约85%的cd56
细胞和约30%至约15%的cd56-内源性骨髓衍生细胞,例如树突细胞、巨噬细胞和粒细胞。除了cd56,所述cd56
细胞还高频率表达nkp30、nkp46、nkp44、nkg2a和颗粒酶b;中到高频率表达穿孔素和cd107a;低到中频率表达nkg2d;并且基本上不表达kir。在一些实施方案中,所述cd56
细胞是kir-。(如本文所用,“kir
‑”是指kir2dl1、kir2ds1、kir2ds3、kir2ds5、kir2dl2、kir2dl3、kir2ds2、kir2ds4、kir3dl1和kir3ds1。)cd16以低至中频率表达。在一些实施方案中,所述cd56-细胞中到高频率表达粒酶b;高频率表达cd107a,并且低频率表达穿孔素。
[0123]
在细胞于所述分化培养基中培养足够长的时间以产生所述nk细胞组合物和/或制剂后,群中所得的cd56
(主要是nk)细胞通常是未成熟但功能正常的nk细胞,类似于但不同于天然存在于人体中的nk细胞。在一些实施方案中,所述nk细胞组合物和/或制剂中的cd56
(主要是nk)细胞在使用或储存之前没有进一步分化。
[0124]
在某个实施方案中,已经发现在所述扩增阶段用il-15引发hspc以进行nk细胞分化增加了在最终nk细胞组合物和/或制剂中获得cd56
细胞的数量。通常,在所述扩增阶段的最后约4至约7天期间添加所述il-15。在所述扩增阶段大约为7天的情况下,在最后大约4
天进行引发。使用这种方法增加的cd56
细胞总数可高达50%或更多,甚至高达58%或更多。所述扩增阶段和所述分化阶段的其余步骤仍然如上所述。在这个实施方案中,il-15可以以约40ng/ml至约100ng/ml或更多的量添加。
[0125]
包含通过上述方法任一种产生的组合物和/或制剂的nk细胞可以经基因工程改造以表达所关注的一种或多种分子,例如蛋白质、核酸或碳水化合物。在一些实施方案中,包含所述组合物和/或制剂的所述nk细胞经基因工程改造以表达所关注的蛋白质,例如蛋白质、多肽或肽(统称为蛋白质)。在一些实施方案中,所述蛋白质是抗原识别受体、其他细胞表面蛋白质或细胞内分子。所述组合物和/或制剂的nk细胞可以在所述扩增阶段之前或期间和/或所述分化阶段期间或之后进行基因修饰。在典型的实施方案中,所述nk细胞在所述扩增阶段期间进行基因工程改造。在一些实施方案中,在所述分化阶段期间或之后对所述nk细胞进行基因工程改造。
[0126]
可以对包含所述组合物和/或制剂的所述nk细胞进行基因工程改造以表达与所关注的抗原结合的抗原识别受体。在某些实施方案中,所述抗原识别受体是嵌合抗原受体(car)。在某些实施方案中,所述抗原识别受体是t细胞受体(tcr)。所述抗原识别受体可以结合例如肿瘤特异性抗原或肿瘤相关抗原或病原体抗原。
[0127]
在某些实施方案中,所述抗原识别受体与肿瘤相关抗原或肿瘤特异性抗原结合。任何合适的肿瘤相关抗原或肿瘤特异性抗原(例如,抗原肽)都可以用于本文所述的实施方案中。抗原的来源包括但不限于与癌症和/或白血病(例如,aml)(肿瘤相关抗原或肿瘤特异性抗原)相关的蛋白质。抗原可以表达为肽或完整蛋白质或其部分。所述完整蛋白质或其部分可以是天然蛋白质或其变体,例如突变体形式。肿瘤抗原的非限制性示例包括碳酸酐酶ix(caix)、癌胚抗原(cea)、cd8、cd7、cd10、cd19、cd20、cd22、cd30、cd33、cll1、cd34、cd38、cd41、cd44、cd49c、cd49f、cd56、cd66c、cd73、cd74、cd104、cd133、cd138、cd123、cd142、cd44v6、巨细胞病毒(cmv)感染的细胞抗原(例如,细胞表面抗原)、皮肤淋巴细胞相关抗原(cla;p-选择素糖蛋白配体-1(psgl-1)的特化糖型)、上皮糖蛋白-2(egp-2)、上皮糖蛋白-40(egp-40)、上皮细胞粘附分子(epcam)、受体酪氨酸蛋白激酶erb的糖型-b2,3,4(erb-b2,3,4)、叶酸结合蛋白(fbp)、胎儿乙酰胆碱受体(achr)、叶酸受体-α、神经节苷脂g2(gd2)、神经节苷脂g3(gd3)、人表皮生长因子受体2(her2)、人端粒酶逆转录酶(htert)、白细胞介素-13受体亚基α-2(il-13ralpha2)、κ-轻链、激酶插入域受体(kdr)、lewis y(ley)、l1细胞粘附分子(l1cam)、黑色素瘤抗原家族a,1(mage-a1)、粘蛋白16(muc16)、粘蛋白1(muc1)、间皮素(msln)、erbb2、magea3、p53、mart1、gp100、蛋白酶3(pr1)、酪氨酸酶、生存素、htert、epha2、nkg2d配体、癌-睾丸抗原ny-es0-1、癌胚抗原(h5t4)、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(psma)、ror1、四跨膜蛋白8(tspan8)、肿瘤相关糖蛋白72(tag-72)、血管内皮生长因子r2(vegf-r2)、肾母细胞瘤蛋白(wt-1)、类细胞因子受体因子2(crlf2)、bcma、gpc3、nkcs1、egf1r、egfr-viii和erbb。
[0128]
在一些实施方案中,所述肿瘤抗原是cd19、ror1、her2、psma、psca、间皮素(msln)或cd20。在一些实施方案中,所述肿瘤抗原是cd19、cd20、cd33、msln或类细胞因子受体因子2(crlf2),它们表达于白血病或淋巴瘤。
[0129]
在一些实施方案中,所述抗原与白血病相关或特异于白血病,例如急性淋巴细胞性白血病(all)、急性骨髓性白血病(aml)、慢性淋巴细胞性白血病(cll)或慢性骨髓性白血
病(cml)。在优选实施方案中,靶标与aml相关或特异于aml。在优选的实施方案中,所述抗原与aml相关或特异于aml。所述抗原可以是但不限于蛋白质、非蛋白质、新生抗原、翻译后修饰抗原、肽-mhc抗原和/或过表达抗原。
[0130]
在某些实施方案中,所述aml特异性或相关抗原是aml1-eto、dek-can、早幼粒细胞白血病-视黄酸受体α(pml-rarα)、类fms酪氨酸激酶3-内部串联重复(flt3-itd)、类fms-酪氨酸激酶3(flt3)、核磷蛋白1(npm1)、aurora a激酶(aura)、b细胞淋巴瘤-2(bcl-2)、bax抑制剂1(bl-1)、b淋巴瘤mo-mlv插入区1同源物(bmi1)、brca1-相关蛋白(brap)、慢性骨髓性白血病(cml)28(cml28)、cml66、细胞周期蛋白b1、细胞周期蛋白e、细胞色素p450 1b1(cyp1b1)、eto/mtg8(8q上的骨髓易位基因)、碳酸酐酶ix(caix)、g250/caix、同源框a9(hoxa9)、人端粒酶逆转录酶(htert)、骨髓细胞白血病序列1(mcl-1)、间皮素(msln)、次要组织相容性抗原(mhag)(例如淋巴限制性组织相容性抗原1(lrh-1))、髓过氧化物酶、m期磷蛋白11(mpp11)、粘蛋白1(muc1)、核仁和纺锤体相关蛋白1(nusap1)、癌胚抗原-未成熟层粘连蛋白受体蛋白(ofa/ilrp)、蛋白酶3、g蛋白信号调节因子5(rgs5)、透明质酸介导的运动受体(rhamm)、滑膜肉瘤x断点2-相互作用蛋白(ssx2ip)、生存素、肾母细胞瘤1蛋白(wt1)、细胞周期蛋白a1、黑色素瘤抗原(mage)、per arnt sim域包含1(pasd1)、黑色素瘤中优先表达的抗原(prame)、肾抗原-1(rage-1)、热休克dnaj蛋白同源物2(hsj2)、myc-相关锌指蛋白(maz)、肾细胞癌抗原(ny-ren60)、特别关注的新cys-his蛋白(pinch)、j-κ重组信号结合蛋白1(rbpjk)、突触融合蛋白、甲基溶血磷脂酸(mlpa)、α-半乳糖神经酰胺(a-galcer)、lewis y抗原(ley)、异柠檬酸脱氢酶1(idh1(r132))、异柠檬酸脱氢酶2(idh2(r140))、核仁磷酸化蛋白1突变体(npm1mut)、notch信号分子异构体(notch变体)、透明质酸受体异构体(cd44v6)、磷酸化肽、蛋白酪氨酸磷酸酶iva型成员3(prl3)、hla-a2-限制性蛋白酶3肽(pr1/hla-a2)、hla-a2-限制性20肾母细胞瘤肽(wt1/hla-a2)、白细胞介素12受体β1(il12rb1)和/或免疫球蛋白超家族成员(cd96)。(哥斯瓦米(goswami)等人,《药靶研究最新进展》(curr.drug targets)18:296-303,2017)。
[0131]
在某些实施方案中,所述抗原识别受体结合病原体抗原,例如用于治疗和/或预防病原体感染或其他传染病,例如在免疫功能低下的受试者中。在某些实施方案中,病原体包括能够引起疾病的病毒、细菌、真菌、寄生虫或原生动物。
[0132]
病毒的非限制性示例包括逆转录病毒科病毒(例如,人类免疫缺陷病毒,例如hiv-1和其他分离株,例如hiv-lp);小核糖核酸病毒科病毒(例如,脊髓灰质炎病毒、甲型肝炎病毒、肠道病毒、人类柯萨奇病毒、鼻病毒、埃可病毒);杯状病毒科病毒(例如,引起肠胃炎的毒株);披膜病毒科病毒(例如,马脑炎病毒、风疹病毒);黄病毒科病毒(例如,登革热病毒、脑炎病毒、黄热病病毒、寨卡病毒);冠状病毒科病毒(例如,冠状病毒,包括sars-cov和sars-cov-2);弹状病毒科病毒(例如,水泡性口炎病毒、狂犬病病毒);丝状病毒科病毒(例如,埃博拉病毒);副粘病毒科病毒(例如,副流感病毒、腮腺炎病毒、麻疹病毒、呼吸道合胞病毒);正粘病毒科病毒(例如流感病毒);布尼亚病毒科病毒(例如,汉坦病毒、布尼亚病毒、白蛉病毒和奈拉病毒);沙粒病毒科病毒(出血热病毒);呼肠孤病毒科病毒(例如,呼肠孤病毒、环状病毒和轮状病毒);双核糖核酸病病毒科病毒;嗜肝病毒科病毒(乙型肝炎病毒);细小病毒科病毒(细小病毒);巴波多病毒科病毒(乳头瘤病毒、多瘤病毒);腺病毒科病毒(大多数腺病毒);疱疹病毒科病毒(单纯疱疹病毒(hsv)1和2、水痘带状疱疹病毒、巨细胞病毒
(cmv)、疱疹病毒);痘病毒科病毒(天花病毒、牛痘病毒、痘病毒);和虹彩病毒科(例如,非洲猪瘟病毒);和未分类的病毒(例如,丁型肝炎的病原体(被认为是乙型肝炎病毒的缺陷卫星病毒)、非甲型非乙型肝炎的病原体(1类=内部传播;2类=肠外传播(即丙型肝炎);诺瓦克病毒和相关病毒,以及星状病毒)。
[0133]
在某些实施方案中,所述病原体抗原是存在于巨细胞病毒(cmv)、爱泼斯坦巴尔病毒(ebv)、人类免疫缺陷病毒(hiv)、单纯疱疹病毒(hsv1或hsv2)、肝炎病毒(甲肝、乙肝或丙肝)、寨卡病毒、流感病毒或冠状病毒(sars-cov或sars-cov-2)中的病毒抗原。在优选的实施方案中,所述病毒抗原对hiv、hsv 1或2,寨卡病毒,甲型、乙型或丙型肝炎,sars-cov或sars-cov-2具有特异性或与之相关。
[0134]
细菌的非限制性示例包括巴氏杆菌属细菌、葡萄球菌属细菌、链球菌属细菌、大肠杆菌、假单胞菌属细菌和沙门氏菌属细菌。感染性细菌的具体示例包括但不限于幽门螺杆菌、伯氏疏螺旋体、嗜肺军团菌、分枝杆菌属(例如,结核分枝杆菌、鸟分枝杆菌、胞内分枝杆菌、堪赛分枝杆菌、戈登分枝杆菌)、金黄色葡萄球菌、淋病奈瑟菌、脑膜炎奈瑟菌、单核细胞增生李斯特菌、化脓性链球菌(a型链球菌)、无乳链球菌(b型链球菌)、链球菌(草绿色链球菌组)、粪链球菌、牛链球菌、链球菌(厌氧菌属)、肺炎链球菌、致病性弯曲杆菌、肠球菌、流感嗜血杆菌、炭疽杆菌、白喉棒状杆菌、棒状杆菌、丹毒丝菌、产气荚膜梭菌、破伤风杆菌、产气肠杆菌、肺炎克雷伯菌、多杀性巴氏杆菌、类杆菌、具核梭杆菌、串珠链杆菌、雅司螺旋体、钩端螺旋体、立克次体和以色列放线菌。
[0135]
在某些实施方案中,所述抗原识别受体是tcr。tcr是一种二硫键连接的异二聚体蛋白质,由两条可变链组成,表达为具有不变cd3链分子的复合物的一部分。发现tcr位于t细胞表面,负责将抗原识别为与主要组织相容性复合体(mhc)分子结合的肽。在某些实施方案中,所述tcr包含α链和β链(分别由tra和trb编码)。在某些实施方案中,所述tcr包含γ链和δ链(分别由trg和trd编码)。
[0136]
tcr的每条链由两个胞外域组成:可变(v)区和恒定(c)区。所述恒定区靠近细胞膜,然后是跨膜区和短的胞质尾区。所述可变区与所述肽/mhc复合体结合。两条链的可变域均具有三个互补决定区(cdr)。
[0137]
在某些实施方案中,tcr可以形成具有三个二聚信号模块的受体复合物:cd3delta/epsilon、cd3gamma/epsilon和cd247zeta/zeta或zeta/eta。当tcr复合物与其抗原和mhc(肽/mhc)结合时,表达所述tcr复合物的t细胞被激活。
[0138]
在某些实施方案中,包含所述组合物和/或制剂的nk细胞经基因修饰以表达重组tcr。在某些实施方案中,所述tcr是非天然存在的tcr。在某些实施方案中,所述tcr与任何天然存在tcr的不同之处在于至少一个氨基酸残基。在某些实施方案中,所述tcr与任何天然存在tcr的不同之处在于至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、40、50、60、70、80、90、100或多个氨基酸残基。在某些实施方案中,所述tcr由天然存在的tcr经至少一个氨基酸残基修饰而成。在某些实施方案中,所述tcr由天然存在的tcr经至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、40、50、60、70、80、90、100或多个氨基酸残基修饰而成。
[0139]
在一些实施方案中,所述tcr特异性结合巨细胞病毒(cmv)、腺病毒、人疱疹病毒6(hhv6)、bk病毒、爱泼斯坦巴尔病毒(ebv)、hiv或sars(sars-cov或sars-cov-2)的抗原。
[0140]
在某些实施方案中,所述抗原识别受体是嵌合抗原受体(car)。car是一种工程化受体,其使细胞具有所关注的特异性,例如本文所述的nk细胞组合物和/或制剂的细胞。car可用于将单克隆抗体的特异性移植到本文所述的nk细胞组合物和/或制剂的nk细胞上,其中通过例如逆转录病毒载体促进其编码序列的转移。
[0141]
如前所述,扩增的hspc可以如前所述进行分化,形成car-hspc细胞和car-nk细胞。所述car-hspc包括经工程改造以表达所述car受体的hspc,其表达工程改造的car受体。所述car-nk细胞包括经工程改造以表达所述car受体的nk细胞,其表达经工程改造的car受体。
[0142]
几代car包括以下car。“第一代”car通常由融合至跨膜域、融合至所述t细胞受体链的细胞质/细胞内信号传导域的细胞外抗原结合域(例如,单链可变片段(scfv))组成。“第一代”car通常具有来自cd3zeta链的细胞内信号传导域,该传导域是内源性tcr信号的主要传递介质。“第一代”car可以提供从头抗原识别,并通过单个融合分子中的cd3zeta链信号传导域激活细胞,独立于hla介导的抗原呈递。“第二代”car将来自各种共刺激分子(例如cd28、4-1bb、icos、ox40或2b4)的细胞内信号传导域添加到所述car的胞质尾区,从而向细胞提供额外的信号。“第二代”car包括实现共刺激(例如,cd28、4-1bb或2b4)和激活(cd3zeta)的car。临床前研究表明,“第二代”car可以提高t细胞的抗肿瘤活性。例如,“第二代”car修饰的t细胞的强大功效在靶向慢性淋巴细胞白血病(cll)和急性淋巴细胞白血病(all)病患的cd19分子的临床试验中得到证实。“第三代”car包括实现多种共刺激(例如,cd28和4-1bb)和激活(cd3zeta)的car。
[0143]
在一些实施方案中,共刺激域可以是cd27、cd28、4-1bb(cd137)、ox40(cd134)、cd30、cd40、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c和/或b7-h3共刺激域。在一些实施方案中,共刺激域可以是cd27、cd28、4-1bb(cd137)、ox40(cd134)、dap10、dap12、icos和/或2b4。在一些实施方案中,共刺激域可以是cd27、cd28、4-1bb、2b4、dap10、dap12、ox40、cd30、cd40、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c和/或b7-h3共刺激域。在一些实施方案中,细胞内信号传导域可以是cd3zeta、cd28和/或4-1bb的域。
[0144]
在某些非限制性实施方案中,所述car的细胞外抗原结合域(例如,具体为scfv或其类似物)以约2
×
10-7
m或更小的解离常数(kd)结合抗原。在某些实施方案中,所述kd为约1x10-7
m或更小、约5x10-8
m或更小、约1x10-8
m或更小、约5x10-9
m或更小,或约1x10-9
m或更小。
[0145]
结合抗原靶向的car的细胞外抗原结合域(例如,scfv或其类似物)可以通过例如酶联免疫吸附试验(elisa)、放射免疫试验(ria)、facs分析、生物试验(例如,生长抑制)或蛋白质印迹试验确定。这些试验中的每一种通常通过使用对所关注复合物特异的标记试剂(例如抗体或scfv)来检测所特别关注的蛋白质-抗体复合物的存在。例如,可对所述scfv进行放射性标记并用于放射免疫试验(ria)(参见例如温特劳布(weintraub),b.,《放射免疫实验原理》(principles of radioimmunoassays),放射配体试验技术的第七次培训课程,内分泌学会,1986年3月,在此通过引用并入本文)。放射性同位素可以通过诸如使用伽马计数器或闪烁计数器或通过放射自显影等手段来检测。在某些实施方案中,所述car的细胞外抗原结合域用荧光标志物标记。荧光标志物的非限制性示例包括绿色荧光蛋白(gfp)、蓝色荧光蛋白(例如,ebfp、ebfp2、azurite和mkalama1)、青色荧光蛋白(例如,ecfp、cerulean和
cypet)和黄色荧光蛋白(例如,yfp、citrine、venus和ypet)。
[0146]
car可以包含细胞外抗原结合域、跨膜域和细胞内信号转导域,其中所述细胞外抗原结合域特异性结合抗原,例如肿瘤抗原或病原体抗原,包括例如病毒或细菌抗原。
[0147]
在某些实施方案中,所述细胞外抗原结合域特异性结合抗原。在某些实施方案中,所述细胞外抗原结合域是scfv。在某些实施方案中,所述scfv是人scfv。在某些实施方案中,所述scfv是人源化的scfv。在某些实施方案中,所述细胞外抗原结合域是fab,其任选地是被交联。在某些实施方案中,所述细胞外结合域是f(ab')2。在某些实施方案中,前述分子的任一种可以被包含在具有异源序列的融合蛋白中以形成所述细胞外抗原结合域。在某些实施方案中,通过用抗原-fc融合蛋白筛选scfv噬菌体文库来识别所述scfv。在某些实施方案中,所述抗原是肿瘤抗原。在某些实施方案中,所述抗原是病原体抗原,包括例如病毒抗原或细菌抗原。
[0148]
在某些实施方案中,所述细胞外结合域是特异性结合cd19的scfv,例如来源于fmc63抗体或4g7抗体的scfv。在一些实施方案中,所述scfv包含所述fmc63抗体的cdr:rasqdiskyln的cdrl1序列(seq id no:1)、srlhsgv的cdrl2序列(seq id no:2)、gntlpytfg的cdrl3序列(seq id no:3)、dygvs的cdrh1序列(seq id no:4)、vtwgsettyynsalks的cdrh2序列(seq id no:5)和yamdywg的cdrh3序列(seq id no:6);或rasqdiskyln的cdrl1序列(seq id no:1)、srlhsgv的cdrl2序列(seq id no:2)、gntlpytfg的cdrl3序列(seq id no:3)、dygvs的cdrh1序列(seq id no:4)、dnsksq的cdrh2序列(seq id no:63)和yamdywg的cdrh3序列(seq id no:6)。在一些实施方案中,细胞外结合域是来源于或包含抗体fmc63的重链和轻链可变区的scfv。抗体fmc63的重链和轻链可变区分别显示在seq id no:64和seq id no:65中。
[0149]
seq id no:64fmc63重链可变区
[0150]
evklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvss
[0151]
seq id no:65fmc63轻链可变区
[0152]
diqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleit
[0153]
在一些实施方案中,scfv包含由seq id no:25和seq id no:26或seq id no:27所示的cd19单克隆抗体4g7的重链和轻链cdr。在一些实施方案中,所述细胞外抗原结合域包含seq id no:25和26或在seq id no:25和27所示的重链和轻链可变区cdr。在一些实施方案中,scfv来源于所述cd19单克隆抗体4g7,优选包含通过柔性连接肽连接在一起的cd19单克隆抗体4g7的部分结合域、所述cd19单克隆抗体4g7免疫球蛋白γ1重链(seq id no:25)的部分可变区和所述cd19单克隆抗体4g7免疫球蛋白κ轻链(seq id no:26或seq id no:27)的可变片段。在具体实施方案中,所述柔性连接肽具有seq id no:28所示的氨基酸序列。在一些实施方案中,所述细胞外抗原结合域包含由seq id no:25和seq id no:26,或seq id no:25和seq id no:27所示的重链和轻链可变区cdr。
[0154]
seq id no:25-抗人cd19单克隆抗体4g7重链可变区:
[0155]
evqlqqsgpelikpgasvkmsckasgytftsyvmhwvkqkpgqglewigyinpyndgtkynekfkgkatltsdkssstaymelssltsedsavyycargtyyygsrvfdywgqgttltvss
[0156]
seq id no:26-抗人cd19单克隆抗体4g7免疫球蛋白κ轻链可变区:
[0157]
divmtqaapsipvtpgesvsiscrssksllnsngntylywflqrpgqspqlliyrmsnlasgvpdrfsgsgsgtaftlrisrveaedvgvyycmqhleypftfgagtklelkrad
[0158]
seq id no:27抗人cd19单克隆抗体4g7免疫球蛋白κ轻链可变区:
[0159]
divmtqaapsipvtpgesvsiscrssksllnsngntylywflqrpgqspqlliyrmsnlasgvpdrfsgsgsgtaftlrisrveaedvgvyycmqhleypftfgagtklelkrsdp
[0160]
seq id no:28柔性连接肽:
[0161]
ggggsggggsggggs
[0162]
在一些实施方案中,scfv来源于cla(皮肤淋巴细胞抗原)单克隆抗体并且包含由seq id no:29和seq id no:30所示的cla单克隆抗体的重链和轻链可变分别区(参见美国专利申请公开号2019/0209611;通过引用并入本文)。在一些实施方案中,所述细胞外抗原结合域包含由seq id no:29和seq id no:30所示的重链和轻链可变区cdr。
[0163]
seq id no:29cla vh(重链可变区)
[0164]
evqlvesggglvqpgnslklscsasgftfssygmhwirqapgegldwvayissssgtvyadavkarftisrdnakntlylqlnslksedtaiyycaraqnwdlfdywgqgvmvtvss
[0165]
seq id no:30cla vl(轻链可变区)
[0166]
qimltqqaeslwispgervsitcrasqsllytdgkhylswyqqkpgqttkaliyhasvrtdgvptrfigsgsgteftlsiehvqpedfaiyyclqtlkspftfgsgtkleik
[0167]
在一些实施方案中,scfv来源于cd142单克隆抗体并且包含分别由seq id no:31和32所示的cd142单克隆抗体的重链和轻链可变区(参见美国专利申请公开号2019/0209611,通过引用并入本文)。在一些实施方案中,所述细胞外抗原结合域包含由seq id no:31和seq id no:32所示的重链和轻链可变区cdr。
[0168]
seq id no:31cd142 vh(重链可变区)
[0169]
qvqlkqsgpglvqpsqslsitctvsgfslsnygvhwvrqspgkglewlgviwsggstdynvafisrliitkdnsksqvflkmnslqaddtaiyfcarttgsvfnamdhwgqgtsvtvss
[0170]
seq id no:32cd142 vl(轻链可变区)
[0171]
qivltqspalmsaspgekv
t
mtcsasssvtymywyqqkprsspkpwiyltsnlasgvparfsgsgsgtsysltissveaedaatyycqqwssnpltfgagtklelk
[0172]
在一些实施方案中,scfv来源于cd73单克隆抗体并且包含分别由seq id no:33和34所示的cd73单克隆抗体的重链和轻链可变区(参见美国专利申请公开号2019/0209611,通过引用并入本文)。在一些实施方案中,所述细胞外抗原结合域包含由seq id no:33和seq id no:34所示的重链和轻链可变区cdr。
[0173]
seq id no:33cd73 vh(重链可变区)
[0174]
evqlqqsgaelvkpgasvklsctasgfnikdtyihwvkqrpeqglewigridpatgnteydpkfqgkatitadtssntaylhlssltsedtavyycargyygssyppwfaywgqgtlvtvsa
[0175]
seq id no:34cd73 vl(轻链可变区)
[0176]
divmtqshkfmstsvgdrvsitckasqdvgsavawyqqkpgqspklliywastrhtgvpdrftgsgsgtdftltisnvqsedladyfcqqyssypltfgagtklelk
[0177]
在一些实施方案中,scfv来源于cd49c单克隆抗体并且包含分别由seq id no:35
和36所示的cd49c单克隆抗体的重链和轻链可变区(参见美国专利申请公开号2019/0209611;通过引用并入本文)。在一些实施方案中,所述细胞外抗原结合域包含由seq id no:35和seq id no:36所示的重链和轻链可变区cdr。
[0178]
seq id no:35cd49c vh(重链可变区)
[0179]
evqlqqsgaelvkpgasvklsctasgfnikdtymhwvkqrpeqglewigridpanghtkydpkfqgkatitadtssnaaylqlnsltsedtavyycarrvayamdywgqgtsvtvss
[0180]
seq id no:36cd49c vl(轻链可变区)
[0181]
envltqspaimsaspgekvtmtcsasssvtymhwyqqksstspklwiydtsklasgvpgrfsgsgsgnsysltissmeaedvatyccfqgsgypltfgggtkleik
[0182]
在一些实施方案中,scfv来源于cd66c单克隆抗体并且包含分别由seq id no:37和38所示的cd66c单克隆抗体的重链和轻链可变区(参见美国专利申请公开号2019/0209611,通过引用并入本文)。在一些实施方案中,所述细胞外抗原结合域包含seq id no:37和seq id no:38所示的重链和轻链可变区cdr。
[0183]
seq id no:37cd66c vh(重链可变区)
[0184]
qvtlkesgpgilkpsqtlsltcsfsgfslstsgmgvgwirqpsgkslewlahiwwnderyynpslknqltiskdtsrnqvflkitsvdtadtatyycarsprgyfdywghgttltvss
[0185]
seq id no:38cd66c vl(轻链可变区)
[0186]
divmtqsqkfmstsvgdrvsvtckasqnvvtnvawyqqtpgqspkaliysasyrysgvpdrfsgsgsgtdftltisnvqsgdlaeyfcqqynsypltfgagtklelk
[0187]
在一些实施方案中,scfv来源于cd104单克隆抗体并且包含分别由seq id no:39和40所示的cd104单克隆抗体的重链和轻链可变区(参见美国专利申请公开号2019/0209611;通过引用并入本文)。在一些实施方案中,所述细胞外抗原结合域包含seq id no:39和seq id no:40所示的重链和轻链可变区cdr。
[0188]
seq id no:39cd104 vh(重链可变区)
[0189]
qvnllqsgaalvkpgasvklsckasgytftdyyifwvkqshgkslewigyinpnsgstnynekfkrkatlsvdkstntaymelsrltsedsatyyctrrayygynpfdywgqgvmvtvss
[0190]
seq id no:40cd104 vl(轻链可变区)
[0191]
diqmtqtpssmpaslgervtiscrasrginnylswyqqnldgtikpliyytsnlqsgvpsrfsgsgsgtdysltisslepedfamyycqqydsspwtfgggtklelk
[0192]
在一些实施方案中,scfv来源于cd318单克隆抗体并且包含分别由seq id no:41和seq id no:42所示的cd318单克隆抗体的重链和轻链可变区(参见美国专利申请公布号2019/0209611;通过引用并入本文)。在一些实施方案中,所述细胞外抗原结合域包含seq id no:41和seq id no:42所示的重链和轻链可变区cdr。
[0193]
seq id no:41cd318 vh(重链可变区)
[0194]
evqlqqsgaelvrpgalvklsckasgfnikdyyihwvkqrpeqglewigwidpenghtiydpkfqgkasitadtssntaylqlssltsedtavyycarltgttyamdywgqgtsvtvss
[0195]
seq id no:42cd318 vl(轻链可变区)
[0196]
divmtqshkfmstsvgdrvsitckasqdvstavawyqqksgqspklliywastrhtgvpdrftgsgsgtdytltisvqaedlalyycqqhystpytfgggtkleik
[0197]
在一些实施方案中,scfv来源于tspan8单克隆抗体并且包含分别由seq id no:43和44所示的tspan8单克隆抗体的重链和轻链可变区(参见美国专利申请公开号2019/0209611;通过引用并入本文)。在一些实施方案中,所述细胞外抗原结合域包含由seq id no:43和seq id no:44所示的重链和轻链可变区cdr。
[0198]
seq id no:43tspan8 vh(重链可变区)
[0199]
evkllesggglvqpggsmrlscaasgftftdfymnwirqpagkapewlgfirnkasgytteynpsvkgrftisrdntqnmlylqmntlraedtatyycarahsyygydyfdywgqgvmvtvss
[0200]
seq id no:44tspan8 vl(轻链可变区)
[0201]
diqmtqspaslsasleeivtitcqasqdignwlswyqqkpgkspqlliygatsladgvpsrfsgsrsgtqyslkisrlqvediriyyclqaysapwtfgggtklelk
[0202]
在一些实施方案中,针对cla的scfv具有由seq id no:45或seq id no:46所示的氨基酸序列(参见美国专利申请公开号2019/0209611;通过引用并入本文)。
[0203]
seq id no:45cla特异性scfv vh-连接肽-vl
[0204]
evqlvesggglvqpgnslklscsasgftfssygmhwirqapgegldwvayissssgtvyadavkarftisrdnakntlylqlnslksedtaiyycaraqnwdlfdywgqgvmvtvssggggsggggsggggsqimltqqaeslwispgervsitcrasqsllytdgkhylswyqqkpgqttkaliyhasvrtdgvptrfigsgsgteftlsiehvqpedfaiyyclqtlkspftfgsgtkleik
[0205]
seq id no:46cla特异性scfv vl-连接肽-vh
[0206]
qimltqqaeslwispgervsitcrasqsllytdgkhylswyqqkpgqttkaliyhasvrtdgvptrfigsgsgteftlsiehvqpedfaiyyclqtlkspftfgsgtkleikgggggsggggsggggsevqlvesggglvqpgnslklscsasgftfssygmhwirqapgegldwvayissssgtvyadavkarftisrdnakntlylqlnslksedtaiyycaraqnwdlfdywgqgvmvtvss
[0207]
在一些实施方案中,针对cd142的scfv具有由seq id no:47或seq id no:48所示的氨基酸序列(参见美国专利申请公开号2019/0209611;通过引用并入本文)。
[0208]
seq id no:47cd142特异性car序列vh-连接肽-vl
[0209]
qvqlkqsgpglvqpsqslsitctvsgfslsnygvhwvrqspgkglewlgviwsggstdynvafisrliitkdnsksqvflkmnslqaddtaiyfcarttgsvfnamhwgqgtsvtvssgggggsggggsggggsqivltqspalmsaspgekvtmtcsasssvtymywyqqkprsspkpwiyltsnlasgvparfsgsgsgtsysltissveaedaatyycqqwssnpltfgagtklelk
[0210]
seq id no:48cd142特异性car序列vl-连接肽-vh
[0211]
qivltqspalmsaspgekvtmtcsasssvtymywyqqkprsspkpwiyltsnlasgvparfsgsgsgtsysltissveaedaatyycqqwssnpltfgagtklelkggggsggggsgggggsqvqlkqsgpglvqpsqslsitctvsgfslsnygvhwvrqspgkglewlgviwsggstdynvafisrliitkdnsksqvflkmnslqaddtaiyfcarttgsvfnamdhwgqgtsvtvss
[0212]
在一些实施方案中,针对cd73的scfv具有由seq id no:49或seq id no:50所示的氨基酸序列(参见美国专利申请公开号2019/0209611;通过引用并入本文)。
[0213]
seq id no:49cd73特异性car序列vh-连接肽-vl
[0214]
evqlqqsgaelvkpgasvklsctasgfnikdtyihwvkqrpeqglewigridpatgnteydpkfqgkatitadtssntaylhlssltsedtavyycargyygssyppwfaywgqgtlvtvsaggggsggggsggggsdivmtqshk
fmstsvgdrvsitckasqdvgsavawyqqkpgqspklliywastrhtgvpdrftgsgsgtdftltisnvqsedladyfcqqyssypltfgagtklelk
[0215]
seq id no:50cd73特异性car序列vl-连接肽-vh
[0216]
divmtqshkfmstsvgdrvsitckasqdvgsavawyqqkpgqspklliywastrhtgvpdrftgsgsgtdftltisnvqsedladyfcqqyssypltfgagtklelkgggggsggggsggggsevqlqqsgaelvkpgasvklsctasgfnikdtyihwvkqrpeqglewigridpatgnteydpkfqgkatitadtssntaylhlssltsedtavyycargyygssyppwfaywgqgtlvtvsa
[0217]
在一些实施方案中,针对cd49c的scfv具有seq id no:51或seq id no:52所示的氨基酸序列(参见美国专利申请公开号2019/0209611;通过引用并入本文)。
[0218]
seq id no:51cd49c特异性car序列vh-连接肽-vl
[0219]
evqlqqsgaelvkpgasvklsctasgfnikdtymhwvkqrpeqglewigridpanghtkydpkfqgkatitadtssnaaylqlnsltsedtavyycarrvayamdywgqgtsvtvssgggggsggggsggggsenvltqspaimsaspgekvtmtcsasssvtymhwyqqksstspklwiydtsklasgvpgrfsgsgsgnsysltissmeaedvatyccfqgsgypltfgggtkleik
[0220]
seq id no:52cd49c特异性car序列vl-连接肽-vh
[0221]
envltqspaimsaspgekvtmtcsasssvtymhwyqqksstspklwiydtsklasgvpgrfsgsgsgnsysltissmeaedvatyccfqgsgypltfgggtkleikgggggsggggsggggsevqlqqsgaelvkpgasvklsctasgfnikdtymhwvkqrpeqglewigridpanghtkydpkfqgkatitadtsgtsnaaylqlnsltsedtavyycarrvayamdywgqgtsvtvss
[0222]
在一些实施方案中,针对cd66c的scfv具有由seq id no:53或seq id no:54所示的氨基酸序列(参见美国专利申请公开号2019/0209611;通过引用并入本文)。
[0223]
seq id no:53cd66c特异性car序列vh-连接肽-vl
[0224]
qvtlkesgpgilkpsqtlsltcsfsgfslstsgmgvgwirqpsgkslewlahiwwnderyynpslknqltiskdtsrnqvflkitsvdttadtatyycarsprgyfdywghgttltvssggggsggggsggggsdivmtqsqkfmstsvgdrvsvtckasqnvvtnvawyqqtpgqspkaliysasyrysgvpdrfsgsgsgtdftltisnvqsgdlaeyfcqqynsypltfgagtklelk
[0225]
seq id no:54cd66c特异性car序列vl-连接肽-vh
[0226]
divmtqsqkfmstsvgdrvsvtckasqnvvtnvawyqqtpgqspkaliysasyrysgvpdrfsgsgsgtdftltisnvqsgdlaeyfcqqynsypltfgagtklelkgggggsggggsggggsqvtlkesgpgilkpsqtlsltcsfsgfslstsgmgvgwirqpsgkslewlahiwwnderyynpslknqltiskdtsrnqvflkitsvdtadtatyycarsprgyfdywghgttltvss
[0227]
在一些实施方案中,针对cd104的scfv具有由seq id no:55或seq id no:56所示的氨基酸序列(参见美国专利申请公开号2019/0209611;通过引用并入本文)。
[0228]
seq id no:55cd104特异性car序列vh-连接肽-vl
[0229]
qvnllqsgaalvkpgasvklsckasgytftdyyifwvkqshgkslewigyinpnsgstnynekfkrkatlsvdkstntaymelsrltsedsatyyctrrayygynpfdywgqgvmvtvssggggsggggsggggsdiqmtqtpssmpaslgervtiscrasrginnylswyqqnldgtikpliyytsnlqsgvpsrfsgsgsgtdysltisslepedfamyycqqydsspwtfgggtklelk
[0230]
seq id no:56cd104特异性car序列vl-连接肽-vh
[0231]
diqmtqtpssmpaslgervtiscrasrginnylswyqqnldgtikpliyytsnlqsgvpsrfsgsgsgtdysltisslepedfamyycqqydsspwtfgggtklelkgggggsggggsggggsqvnllqsgaalvkpgasvklsckasgytftdyyifwvkqshgkslewigyinpnsgstnynekfkrkatlsvdkrassntaymelsrltsedsatyyctrrayygynpfdywgqgvmvtvss
[0232]
在一些实施方案中,针对cd318的scfv具有由seq id no:57或seq id no:58所示的氨基酸序列(参见美国专利申请公开号2019/0209611;通过引用并入本文)。
[0233]
seq id no:57cd318特异性car序列vh-连接肽-vl
[0234]
evqlqqsgaelvrpgalvklsckasgfnikdyyihwvkqrpeqglewigwidpenghtiydpkfqgkasitadtssntaylqlssltsedtavyycarltgttyamdywgqgtsvtvssggggsggggsggggsdivmtqshkfmstsvgdrvsitckasqdvstavawyqqksgqspklliywastrhtgvpdrftgsgsgtdytltissvqaedlalyycqqhystpytfgggtkleik
[0235]
seq id no:58cd318特异性car序列vl-连接肽-vh
[0236]
divmtqshkfmstsvgdrvsitckasqdvstavawyqqksgqspklliywastrhtgvpdrftgsgsgtdytltsvqaedlalyycqqhystpytfgggtkleikgggggsggggsggggsevqlqqsgaelvrpgalvklsckasgfnikdyyihwvkqrpeqglewigwidpenghtiydpkfqgkasitadtssntaylqlssltsedtavyycarltgttyamdywgqgtsvtvss
[0237]
在一些实施方案中,针对tspan8的scfv具有由seq id no:59或seq id no:60所示的氨基酸序列(参见美国专利申请公开号2019/0209611;通过引用并入本文)。
[0238]
seq id no:59tspan8特异性car序列vh-连接肽-vl
[0239]
evkllesggglvqpggsmrlscaasgftftdfymnwirqpagkapewlgfirnkasgytteynpsvkgrftisrdntqnmlylqmntlraedtatyycarahsyygydyfdywgqgvmvtvssggggsggggsggggsdiqmtqspaslsasleeivtitcqasqdignwlswyqqkpgkspqlliygatsladgvpsrfsgsrsgtqyslkisrlqvediriyyclqaysapwtfgggtklelk
[0240]
seq id no:60tspan8特异性car序列vl-连接肽-vh
[0241]
diqmtqspaslsasleeivtitcqasqdignwlswyqqkpgkspqlliygatsladgvpsrfsgsrsgtqyslkisrlqvediriyyclqaysapwtfgggtklelkgggggsggggsggggsevkllesggglvqpggsmrlscaasgftftdfymnwirqpagkapewlgfirnkasgytteynpsvkgrftisrdntqnmlylqmntlraedtatyycarahsyygydyfdywgqgvmvtvss
[0242]
car的跨膜域
[0243]
在一些实施方案中,所述car的跨膜域包含跨越至少一部分膜的疏水性α螺旋。不同的跨膜域使得受体稳定性不同。在抗原识别后,受体聚集并将信号传递给细胞。所述car的跨膜域可以包含例如cd8多肽、cd28多肽、cd3zeta多肽、cd4多肽、4-1bb多肽、ox40多肽、icos多肽、nkg2d多肽、合成肽(不基于与免疫反应相关的蛋白质)或它们的组合。
[0244]
在某些实施方案中,所述跨膜域包含cd8多肽。在某些实施方案中,所述cd8多肽具有的氨基酸序列与ncbi参考编号为np_001139345.1,seq id no:7的序列(本文中的序列同一性可以使用标准软件如blast或fasta确定)或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。如本文所用,“保守氨基酸取代”是指氨基酸取代,其中一个氨基酸被另一个在电子方面相似的氨基酸取代。例如,具有疏水侧链的氨基酸可以取代同样具
有疏水侧链的不同氨基酸(例如,亮氨酸取代异亮氨酸,丙氨酸取代缬氨酸等);具有酸性链的氨基酸可以取代也具有酸性侧链的不同氨基酸(例如,天冬氨酸取代谷氨酸等);具有碱性链的氨基酸可以取代同样具有碱性侧链的不同氨基酸(例如,赖氨酸取代精氨酸等);并且具有极性侧链的氨基酸可以取代同样具有极性侧链的不同氨基酸(例如,丝氨酸取代苏氨酸等)。在某些实施方案中,所述cd8多肽具有的氨基酸序列可以是seq id no:7的连续部分,其长度为至少20个氨基酸,或至少30个氨基酸,或至少40个氨基酸,或至少50个氨基酸,和至多235个氨基酸。备选地或附加地,在非限制性的各种实施方案中,所述cd8多肽包含或具有seq id no:7的氨基酸1至235、1至50、50至100、100至150、150至200或200至235的氨基酸序列。在某些实施方案中,car包含跨膜域,其包含人cd8多肽,所述人cd8多肽包含seq id no:7的氨基酸137至209的氨基酸序列。
[0245]
seq id no:7:
[0246]
malpvtalllplalllhaarpsqfrvspldrtwnlgetvelkcqvllsnptsgcswlfqprgaaasptfllylsqnkpkaaegldtqrfsgkrlgdtfvltlsdfrrenegyyfcsalsnsimyfshfvpvflpakptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnhrnrrrvckcprpvvksgdkpslsaryv
[0247]
在某些实施方案中,所述cd8多肽具有的氨基酸序列与ncbi参考编号为aaa92533.1,seq id no:8的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可以任选地包含至多一个或至多两个或至多三个保守氨基酸取代。在某些实施方案中,所述cd8多肽具有的氨基酸序列可以是seq id no:8的连续部分,其长度为至少约20个氨基酸,或至少约30个氨基酸,或至少约40个氨基酸,或至少约50个氨基酸,或为至少约60个氨基酸,或至少约70个氨基酸,或至少约100个氨基酸,或至少约200个氨基酸,以及至多247个氨基酸。备选地或附加地,在非限制性的各种实施方案中,所述cd8多肽包含或具有seq id no:8的氨基酸1至247、1至50、50至100、100至150、150至200、151至219或200至247的氨基酸序列。在某些实施方案中,所述car包含跨膜域,其包含鼠cd8多肽,所述鼠cd8多肽包含seq id no:8的氨基酸151至219的氨基酸序列。
[0248]
seq id no:8:
[0249]
maspltrelslnlllmgesiilgsgeakpqapelrifpkkmdaelgqkvdlvcevlgsvsqgcswlfqnsssklpqptfvvymasshnkitwdeklnssklfsavrdtnnkyvltlnkfskenegyyfcsvisnsvmyfssvvpvlqkvnstttkpvlrtpspvhptgtsqpqrpedcrprgsvkgtgldfacdiyiwaplagicvapllsliitlicyhrsrkrvckcprplvrqegkprpsekiv
[0250]
在某些实施方案中,所述cd8多肽包含或具有由seq id no:9所示的氨基酸序列。
[0251]
seq id no:9:
[0252]
stttkpvlrtpspvhptgtsqpqrpedcrprgsvkgtgldfacdiyiwaplagicvalllsliitlicy
[0253]
在某些实施方案中,car的跨膜域包含cd28多肽。所述cd28多肽具有的氨基酸序列可以与ncbi参考编号为p10747或np_006130(seq id no:10)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。在非限制性的某些实施方案中,所述cd28多肽具有的氨基酸序列可以是seq id no:10的连续部分,其长度为至少20个氨基酸,或至少30个氨基酸,或至少40个氨基酸,或至少50个氨基酸,以及至多220个氨基酸。备选地或附加
地,在非限制性的各种实施方案中,所述cd28多肽具有seq id no:10的氨基酸1至220、1至50、50至100、100至150、114至220、150至200或200至220的氨基酸序列。在某些实施方案中,包含在目前公开的car跨膜域中的cd28多肽具有seq id no:10氨基酸153至179的氨基酸序列。
[0254]
seq id no:10:
[0255]
mlrlllalnlfpsiqvtgnkilvkqspmlvaydnavnlsckysynlfsrefraslhkgldsavevcvvygnysqqlqvysktgfncdgklgnesvtfylqnlyvnqtdiyfckievmypppyldneksngtiihvkgkhlcpsplfpgpskpfwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrs
[0256]
在某些实施方案中,car的跨膜域包含nkg2d多肽。所述nkg2d多肽具有的氨基酸序列可以与ncbi参考编号为np_0031386.2(seq id no:66)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。在非限制性的某些实施方案中,所述nkg2d多肽具有的氨基酸序列可以是seq id no:66的连续部分,其长度为至少20个氨基酸,或至少30个氨基酸,或至少40个氨基酸,或至少50个氨基酸,以及至多216个氨基酸。在某些实施方案中,所述nkg2d多肽包含seq id no:10的跨膜域(例如,氨基酸52-72)。
[0257]
seq id no:66:
[0258]
mgwirgrrsrhswemsefhnynldlkksdfstrwqkqrcpvvkskcrenaspfffccfiavamgirfiimvtiwsavflnslfnqevqipltesycgpcpknwicyknncyqffdesknwyesqascmsqnasllkvyskedqdllklvksyhwmglvhiptngswqwedgsilspnlltiiemqkgdcalyassfkgyiencstpntyicmqrtv
[0259]
在一些实施方案中,car的跨膜域包含cd3zeta(cd3ζ)多肽。所述cd3zeta多肽的跨膜域具有的氨基酸序列可以与ncbi参考编号为np_932170(seq id no:11)、seq id no:12或seq id no:13所示的cd3zeta跨膜域序列至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。
[0260]
在一些实施方案中,car的跨膜域包含cd4多肽。所述cd4多肽的跨膜域具有的氨基酸序列可以与ncbi参考编号为np_000607.1、np_001181943.1或np_001181946.1(各自通过引用并入本文)所示的cd4跨膜域的序列至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。
[0261]
在一些实施方案中,car的跨膜域包含4-1bb多肽。所述4-1bb多肽的跨膜域具有的氨基酸序列可以与ncbi参考编号为p41273(通过引用并入本文)或np_001552.2(seq id no:18)所示的4-1bb跨膜域的序列至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%相同,和/或可以任选地包含至多一个或至多两个或至多三个保守氨基酸取代。
[0262]
在一些实施方案中,car的跨膜域包含ox40多肽。所述ox40多肽的跨膜域具有的氨基酸序列可以与ncbi参考编号为np_003318.1(通过引用并入本文)所示的ox40跨膜域的序列至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%相同,和/或可以任选地包含至多一个或至多两个或至多三个保守氨基酸取代。
[0263]
在一些实施方案中,car的跨膜域包含icos多肽。所述icos多肽的跨膜域具有的氨
基酸序列可以与ncbi参考编号为np_036224.1(通过引用并入本文)所示的icos跨膜域的序列至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。
[0264]
间隔区
[0265]
在某些非限制性实施方案中,car还可包含将所述细胞外抗原结合域与所述跨膜域连接的间隔区。所述间隔区可以足够灵活以使得所述抗原结合域取向为不同方向以促进抗原识别。所述间隔区可以是igg1(genpept参考编号:p01857.1,通过引用并入本文)的铰链区,或免疫球蛋白(例如,igg4(genpept参考编号:p01861.1,通过引用并入本文)的ch2ch3区和cd3的一部分、cd28多肽的一部分(例如,seq id no:10的一部分)、cd8多肽的一部分(例如,seq id no:7的一部分,或seq id no:8的一部分),前述任一种的变体(与其至少约80%、至少约85%、至少约90%或至少约95%相同),或合成的间隔序列。
[0266]
car的细胞内信号传导域
[0267]
在某些非限制性实施方案中,所述car的细胞内信号传导域可以包含cd3zeta(cd3ζ)多肽,其可以激活或刺激细胞(例如,淋巴谱系的细胞,例如,nk细胞)。cd3ζ包含3个基于免疫受体酪氨酸的激活基序(itam),并在结合抗原后将激活信号传递给所述细胞(例如,淋巴谱系的细胞,例如nk细胞)。在某些实施方案中,所述cd3zeta多肽具有的氨基酸序列与ncbi参考编号为np_932170(seq id no:11)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。在某些非限制性实施方案中,所述cd3ζ多肽包含或具有的氨基酸序列是seq id no:11的连续部分,其长度为至少20个氨基酸,或至少30个氨基酸,或至少40个氨基酸,或至少50个氨基酸,和至多164个氨基酸。备选地或附加地,在非限制性各种实施方案中,所述cd3zeta多肽包含或具有seq id no:11的氨基酸1至164、1至50、50至100、100至150或150至164的氨基酸序列。在某些实施方案中,所述cd3ζ多肽包含或具有seq id no:11的氨基酸52至164的氨基酸序列。
[0268]
seq id no:11:
[0269]
mkwkalftaailqaqlpiteaqsfglldpklcylldgilfiygviltalflrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkpqrrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0270]
在某些实施方案中,所述cd3zeta多肽具有的氨基酸序列与ncbi参考编号为np_001106864.2(seq id no:12)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。在某些非限制性实施方案中,所述cd3zeta多肽具有的氨基酸序列可以是seq id no:12的连续部分,其长度为至少约20个氨基酸,或至少约30个氨基酸,或至少约40个氨基酸,或至少约50个氨基酸,或至少约90个氨基酸,或至少约100个氨基酸,以及至多188个氨基酸。备选地或附加地,在非限制性的各种实施方案中,所述cd3ζ多肽包含或具有seq id no:12的氨基酸1至164、1至50、50至100、52至142、100至150或150至188的氨基酸序列。在某些实施方案中,所述cd3zeta多肽包含或具有seq id no:12的氨基酸52至142的氨基酸序列。
[0271]
seq id no:12:
[0272]
mkwkvsvlacilhvrfpgaeaqsfglldpklcylldgilfiygviitalylrakfsrsaetaanlqdpnqlynelnlgrreeydvlekkrardpemggkqrrrnpqegvynalqkdkmaeayseigtkgerrrgkghdglyqdshfqavqfgnrreregseltrtlglrarpkacrhkkplslpaavs
[0273]
在某些实施方案中,所述cd3zeta多肽包含或具有由seq id no:13所示的氨基酸序列。
[0274]
seq id no:13:
[0275]
rakfsrsaetaanlqdpnqlynelnlgrreeydvlekkrardpemggkqqrrrnpqegvynalqkdkmaeayseigtkgerrrgkghdglyqglstatkdtydalhmqtlapr
[0276]
在某些非限制性实施方案中,所述car的细胞内信号传导域还包含至少一个共刺激信号传导区。在某些实施方案中,所述共刺激区包含至少一种可以最佳激活淋巴细胞的共刺激分子。如本文所用,“共刺激分子”是指淋巴细胞对抗原的有效反应所需的除抗原受体或其配体以外的细胞表面分子。所述至少一个共刺激信号传导区可以包括,例如,cd28多肽、4-1bb多肽、ox40多肽、icos多肽、dap-10多肽、dap-12多肽、2b4多肽,或它们的组合。所述共刺激分子可以与共刺激配体结合,该配体是一种在细胞表面表达的蛋白质,在与其受体结合后会产生共刺激反应,即,影响当抗原与其car分子结合时产生刺激的细胞内反应。共刺激配体包括但不限于cd80、cd86、cd70、ox40l和4-1bbl。作为一个示例,4-1bb配体(即,4-1bbl)可以结合4-1bb(也称为“cd137”)以提供细胞内信号,该信号与car信号结合诱导nk细胞的效应细胞功能。包含细胞内信号传导域的car公开于美国专利号7,446,190中(通过引用并入本文),该细胞内信号传导域包含共刺激信号传导区,其包含4-1bb、icos或dap-10;(即编码4-1bb的核苷酸序列由seq id no:15中所示并且所述蛋白质序列在np_001551.2中所示;编码icos的核苷酸序列在seq id no:16中所示并且所述蛋白质序列由np_036224.1中所示,编码dap-10的核苷酸序列由seq id no:17中所示,并且所述蛋白质序列在np_055081.1中所示),美国专利号7,446,190和参考蛋白质序列的全部内容通过引用并入本文。
[0277]
seq id no:15-4-1bb
[0278]
atgggaaacagctgttacaacatagtagccactctgttgctggtcctcaactttgagaggacaagatcattgcaggatccttgtagtaactgcccagctggtacattctgtgataataacaggaatcagatttgcagtccctgtcctccaaatagtttctccagcgcaggtggacaaaggacctgtgacatatgcaggcagtgtaaaggtgttttcaggaccaggaaggagtgttcctccaccagcaatgcagagtgtgactgcactccagggtttcactgcctgggggcaggatgcagcatgtgtgaacggattgtaaacaaggtcaagaactgacaaaaaaaggttgtaaagactgttgctttgggacatttaacgatcagaaacgtggcatctgtcgaccctggacaaactgttctttggatggaaagtctgtgcttgtgaatgggacgaaggagagggacgtggtctgtggaccatctccagccgacctctctccgggagcatcctctgtgaccccgcctgcccctgcgagagagccaggacactctccgcagatcatctccttctttcttgcgctgacgtcgactgcgttgctcttcctgctgttcttcctcacgctccgtttctctgttgttaaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactgtga
[0279]
seq id no:16-icos
[0280]
atgaagtcaggcctctggtatttctttctcttctgcttgcgcattaaagttttaacaggagaaatcaatggttctgccaattatgagatgtttatatttcacaacggaggtgtacaaattttatgcaaatatcctgacattgtcca
gcaatttaaaatgcagttgctgaaaaggggggcaaatactctgcgatctcactaagacaaaaggaagtggaaacacagtgtccattaagagtctgaaattctgccattctcagttatccaacaacagtgtctctttttttctacaaccttggaccattctcatgccaactattacttctgcaacctatcaatttttgatcctcctccttttaaagtaactcttacaggaggatatttgcatatttatgaaatcacaactttgttgccagctgaagttctggttacccataggatgtgcagcctttgttgtagtctgcattttgggatgcatacttatttgttggcttacaaaaaagaagtattcatccagtgtgcacgaccctaacggtgaatacatgttcatgagagcagtgaacacagccaaaaaatctagactcacagatgtgaccctataa
[0281]
seq id no:17-dap-10
[0282]
atgatccatctgggtcacatcctcttcctgcttttgctcccagtggctgcagctcagacgaccccaggagagagatcatcactccctgccttttaccctggcacttcaggctcctgttccggatgtgggtccctctctctgccgctcctggcaggcctcgtggctgctgatgcggtggcatcgctgctcatcgtgggggcggtgttcctgtgcgcacgcccacgccgcagccccgcccaagaagatggcaaagtctacatcaacatgccaggcaggggctga
[0283]
在某些实施方案中,所述car的细胞内信号传导域包含共刺激信号传导区,其包含cd28多肽。所述cd28多肽具有的氨基酸序列可以与ncbi参考编号为p10747(通过引用并入本文)或np_006130(seq id no:10)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。在非限制性的某些实施方案中,所述cd28多肽具有的氨基酸序列是seq id no:10的连续部分,其长度为至少20个氨基酸,或至少30个氨基酸,或至少40个氨基酸,或至少50个氨基酸,以及至多220个氨基酸。备选地或附加地,在非限制性的各种实施方案中,所述cd28多肽具有的氨基酸序列是seq id no:10的氨基酸1至220、1至50、50至100、100至150、114至220、150至200或200至220。在某些实施方案中,所述car的细胞内信号传导域包含共刺激信号传导区,其包含氨基酸序列是seq id no:10的氨基酸180至220的cd28多肽。
[0284]
在某些实施方案中,所述cd28多肽具有的氨基酸序列与ncbi参考编号为np_031668.3(seq id no:14)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。在非限制性某些实施方案中,所述cd28多肽具有的氨基酸序列是seq id no:14的连续部分,其长度为至少约20个氨基酸,或至少约30个氨基酸,或至少约40个氨基酸,或至少约50个氨基酸,以及至多218个氨基酸。备选地或附加地,在非限制性的各种实施方案中,所述cd28多肽具有的氨基酸序列是seq id no:14的氨基酸1至218、1至50、50至100、100至150、114至220、150至200、178至218,或200至220。在某些实施方案中,目前公开car的共刺激信号传导区包含cd28多肽,其包含或具有seq id no:14的氨基酸178至218。
[0285]
seq id no:14:
[0286]
mtlrllflalnffsvqvtenkilvkqspllvvdsnevslscrysynllakefraslykgvnsdvevcvgngnftyqpqfrsnaefncdgdfdnetvtfrlwnlhvnhtdiyfckiefmypppyldnersngtiihikekhlchtqsspklfwalvvvagvlfcygllvtvalcviwtnsrrnrllqsdymnmtprrpgltrkpyqpyapardfaayrp
[0287]
在某些实施方案中,所述car的细胞内信号传导域包含共刺激信号传导区,其包含两种共刺激分子:cd28和4-1bb或cd28和ox40。
[0288]
4-1bb可作为肿瘤坏死因子(tnf)配体并具有刺激活性。所述4-1bb多肽具有的氨基酸序列可以与ncbi参考编号为p41273(通过引用并入本文)或np_001552.2(seq id no:
18)所示序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。
[0289]
seq id no:18:
[0290]
mgnscynivatlllvlnfertrslqdpcsncpagtfcdnnrnqicspcppnsfssaggqrtcdicrqckgvfrtrkecsstsnaecdctpgfhclgagcsmceqdckqgqeltkkgckdccfgtfndqkrgicrpwtncsldgkssvlvngtkerdvvcgpspadlspgassvtppaparepghspqiisfflaltstallfllffltlrfsvvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel
[0291]
ox40多肽具有的氨基酸序列可以与ncbi参考编号为p43489(通过引用并入本文)或np_003318.1(seq id no:19)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。
[0292]
seq id no:19:
[0293]
mcvgarrlgrgpcaallllglglstvtglhcvgdtypsndrcchecrpgngmvsrcsrsqntvcrpcgpgfyndvvsskpckpctwcnlrsgserkqlctatqdtvcrcragtqpldsykpgvdcapcppghfspgdnqackpwtnctlagkhtlqpasnssdaicedrdppatqpqetqgpparpitvqpteawprtsqgpstrpvevpggravaailglglvlgllgplaillalyllrrdqrlppdahkppgggsfrtpiqeqadahstlaki
[0294]
icos多肽具有的氨基酸序列可以与ncbi参考编号为np_036224.1(seq id no:20)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守氨基酸取代。
[0295]
seq id no:20:
[0296]
mksglwyfflfclrikvltgeingsanyemfifhnggvqilckypdivqqfkmqllkggqilcdliktkgsgntvsikslkfchsqlsnnsvsfflynldhshanyyfcnlsifdpppfkvtliggylhiyesqlccqlkfwlpigcaafvvvcilgcilicwltkkkysssvhdpngeymfmravntakksrltdvtl
[0297]
dap-12多肽具有的氨基酸序列可以与ncbi参考编号为np_003323.1、np_001166986.1、np_001166985.1或np_937758.1(均以引用方式并入本文)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可任选地包含多达一个或多达两个或至多三个保守氨基酸取代。
[0298]
2b4多肽具有的共刺激区的氨基酸序列可以与ncbi参考编号为np_057466.1、np_001160135.1或np_001160136.1(均以引用的方式并入本文)的序列或其片段至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同,和/或可任选地包含至多一个或至多两个或至多三个保守性氨基酸取代。
[0299]
额外的基因
[0300]
在一些实施方案中,car构建体还包括编码额外基因产品(例如细胞因子或转染标志物)的基因。在一些实施方案中,所述额外基因编码细胞因子,例如人il-15(美国专利号9,931,377;seq id no:68)、il-18或il-12。在一些实施方案中,所述额外基因编码转染标志物或自杀基因,例如截短的egfr(tegfr)(参见wo2011/056894;seq id no:67)或icaps9(wo2013/040371),它们的序列通过引用并入本文。
[0301]
seq id no:67-tegfr
[0302]
rkvcngigigefkdslsinatnikhfknctsisgdlhilpvafrgdsfthtppldpqeldilktvkeit
gflliqawpenrtdlhafenleiirgrtkqhgqfslavvslnitslglrslkeisdgdviisgnknlcyantinwkklfgtsgqktkiisnrgensckatgqvchalcspegcwgpeprdcvscrnvsrgrecvdkcnllegeprefvenseciqchpeclpqamnitctgrgpdnciqcahyidgphcvktcpagvmgenntlvwkyadaghvchlchpnctygctgpglegcptngpkipsiatgmvgalllllvvalgiglfm
[0303]
seq id no:68-il-15
[0304]
riskphlrsisiqcylclllnshflteagihvfilgcfsaglpkteanwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgcckeceeleeknikeflqsfvhivqmfints
[0305]
示例性car构建体
[0306]
在某些实施方案中,car包含结合cd19的细胞外抗原结合域、包含cd28多肽的跨膜域,以及包含cd3zeta多肽的细胞内信号传导域和包含cd28多肽的共刺激信号传导区。在某些实施方案中,所述car被指定为1928z。在某些实施方案中,1928z是与由seq id no:21所示氨基酸序列至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同的蛋白质。所述蛋白质序列包括氨基酸1-18处的cd8前导序列,并且能够结合人cd19。
[0307]
seq id no:21
[0308]
malpvtalllplalllhaevklqqsgaelvrpgssvkisckasgyafssywmnwvkqrpgqglewigqiypgdgdtnyngkfkgqatltadkssstaymqlsgltsedsavyfcarktissvvdfyfdywgqgttvtvssggggsggggsggggsdieltqspkfmstsvgdrvsvtckasqnvgtnvawyqqkpgqspkpliysatyrnsgvpdrftgsgsgtdftltitnvqskdladyfcqqynrypytsgggtkleikraaaievmypppyldneksngtiihvkgkhlcpsplfpgpskpfwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrsrvkfsrsaeppayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0309]
在另一个实施方案中,提供car,其具有与cd19结合的细胞外抗原结合域、人igg4的铰链间隔区、包含cd28跨膜域的跨膜域、4-1bb共刺激信号传导区和cd3ζ细胞内信号传导域。在某些实施方案中,所述car被指定为1928z1。在某些实施方案中,1928z1是与由seq id no:22所示氨基酸序列至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相同的蛋白质。
[0310]
seq id no:22
[0311]
mlllvtslllcelphpafllipdiqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitgstsgsgkpgsgegstkgevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvsseskygppcppcpmfwvlvvvggvlacysllvtvafiifwvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprl
[0312]
在某些实施方案中,car包含结合muc16的细胞外抗原结合域、包含cd28多肽的跨膜域、包含cd3zeta多肽的细胞内信号传导域和包含cd28多肽的共刺激信号传导区。在某些实施方案中,所述car被指定为4h1128z。在某些实施方案中,4h1128z是与由seq id no:23所示氨基酸序列至少约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%相
同的蛋白质。所述蛋白质在氨基酸1-18处包含cd8前导序列,并与muc-16胞外域结合。
[0313]
seq id no:23
[0314]
malpvtalllplalllhaevklqesgggfvkpggslkvscaasgftfssyamswvrlspemrlewvatissaggyifysdsvqgrftisrdnakntlhlqmgslrsgdtamyycarqgfgnygdyyamdywgqgttvtvssggggsggggsggggsdieltqspsslavsagekvtmsckssqsllnsrtrknqlawyqqkpgqspelliywastrqsgvpdrftgsgsgtdftltissvqaedlavyycqqsynlltfgpgtkleikraaaievmypppyldneksngtiihvkgkhlcpsplfpgpskpfwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrsrvkfsrsaeppayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0315]
在某些实施方案中,car包含结合cd19的细胞外抗原结合域、包含cd8多肽的跨膜域,以及包含cd3zeta多肽的细胞内信号传导域和包含4-1bb多肽的共刺激信号传导区。在某些实施方案中,所述car是19bbz。所述19bbz多肽的示例性蛋白质序列由seq id no:24所示。
[0316]
seq id no:24:
[0317]
malpvtalllplalllhaevklqqsgaelvrpgssvkisckasgyafssywmnwvkqrpgqglewigqiypgdgdtnyngkfkgqatltadkssstaymqlsgltsedsavyfcarktissvvdfyfdywgqgttvtvssggggsggggsggggsdieltqspkfmstsvgdrvsvtckasqnvgtnvawyqqkpgqspkpliysatyrnsgvpdrftgsgsgtdftltitnvqskdladyfcqqynrypytsgggtkleikraaaptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsaeppayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0318]
在某些实施方案中,提供car,其具有结合cd19的细胞外抗原结合域、人igg4的铰链间隔区、包含cd28跨膜域的跨膜域、4-1bb共刺激信号传导区和cd3zeta细胞内信号传导域。示例性cd19 car蛋白序列还包括通过自切割2a肽附接到所述car羧基末端部分的截短egfr(tegfr)多肽,并且由seq id no:61所示。
[0319]
seq id no:61:
[0320]
mlllvtslllcelphpafllipdiqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitgstsgsgkpgsgegstkgevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvsseskygppcppcpmfwvlvvvggvlacysllvtvafiifwvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprlegggegrgslltcgdveenpgprmlllvtslllcelphpaflliprkvcngigigefkdslsinatnikhfknctsisgdlhilpvafrgdsfthtppldpqeldilktvkeitgflliqawpenrtdlhafenleiirgrtkqhgqfslavvslnitslglrslkeisdgdviisgnknlcyantinwkklfgtsgqktkiisnrgensckatgqvchalcspegcwgpeprdcvscrnvsrgrecvdkcnllegeprefvenseciqchpeclpqamnitctgrgpdnciqcahyidgphcvktcpagvmgenntlvwkyadaghvchlchpnctygctgpglegcptngpkipsiatgmvgalllllvvalgiglfm
[0321]
在某些实施方案中,提供car,其具有与cd19结合的细胞外抗原结合域、人igg4的
铰链间隔区、cd28跨膜域的跨膜域、4-1bb共刺激信号传导区和cd3ζ细胞内信号传导域。示例性cd19 car蛋白序列,还包括通过自切割2a肽附接到所述car羧基末端部分的人il-15,并且由seq id no:62所示。
[0322]
seq id no:62:
[0323]
mlllvtslllcelphpafllipdiqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitgstsgsgkpgsgegstkgevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvsseskygppcppcpmfwvlvvvggvlacysllvtvafiifwvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprlegggegrgslltcgdveenpgprmriskphlrsisiqcylclllnshflteagihvfilgcfsaglpkteanwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints
[0324]
可编码seq id no:62中构建体的相应核酸序列由seq id no:69所示。
[0325]
seq id no:69:
[0326]
atgctgctgctggtgaccagcctgctgctgtgcgagctgccccaccccgcctttctgctgatccccgacatccagatgacccagaccacctccagcctgagcgccagcctgggcgaccgggtgaccatcagctgccgggccagccaggacatcagcaagtacctgaactggtatcagcagaagcccgacggcaccgtcaagctgctgatctaccacaccagccggctgcacagcggcgtgcccagccggtttagcggcagcggctccggcaccgactacagcctgaccatctccaacctggaacaggaagatatcgccacctacttttgccagcagggcaacacactgccctacacctttggcggcggaacaaagctggaaatcaccggcagcacctccggcagcggcaagcctggcagcggcgagggcagcaccaagggcgaggtgaagctgcaggaaagcggccctggcctggtggcccccagccagagcctgagcgtgacctgcaccgtgagcggcgtgagcctgcccgactacggcgtgagctggatccggcagccccccaggaagggcctggaatggctgggcgtgatctggggcagcgagaccacctactacaacagcgccctgaagagccggctgaccatcatcaaggacaacagcaagagccaggtgttcctgaagatgaacagcctgcagaccgacgacaccgccatctactactgcgccaagcactactactacggcggcagctacgccatggactactggggccagggcaccagcgtgaccgtgagcagcgaatctaagtacggaccgccctgccccccttgccctatgttctgggtgctggtggtggtcggaggcgtgctggcctgctacagcctgctggtcaccgtggccttcatcatcttttgggtgaaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactgagggtgaagttcagcagaagcgccgacgcccctgcctaccagcagggccagaatcagctgtacaacgagctgaacctgggcagaagggaagagtacgacgtcctggataagcggagaggccgggaccctgagatgggcggcaagcctcggcggaagaacccccaggaaggcctgtataacgaactgcagaaagacaagatggccgaggcctacagcgagatcggcatgaagggcgagcggaggcggggcaagggccacgacggcctgtatcagggcctgtccaccgccaccaaggatacctacgacgccctgcacatgcaggccctgcccccaaggctcgagggcggcggagagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccctaggatgcggatttccaaacctcacctgcgctctatctctatccagtgctatctgtgcctgctgctgaactcacatttcctgaccgaagccggcatccacgtgttcatcctgggctgcttttccgccggcctgccaaagaccgaggcaaactgggtgaatgtgatctctgacctgaagaagatcgaggatctgatccagagcatgcacatcgacgccaccctgtacacagagtccgatgtgcacccttcttgcaaggtgacagccatgaagtgtttcctgctggagctgcaggtcatcagcctggagagcggcgacgcctctatccacgataccgtggagaacctgatcatcctggccaacaatagcctgagcagcaacggcaatgtga
cagagtccggctgcaaggagtgtgaggagctggaggagaagaatatcaaagagttcctgcagtcattcgtccatatcgtccagatgtttatcaatacctcctaa
[0327]
在某些实施方案中,提供了car,其具有与cd19结合的细胞外抗原结合域、人igg4的铰链间隔区、cd28跨膜域的跨膜域、2b4共刺激信号传导区和cd3zeta细胞内信号传导域。示例性cd19 car蛋白序列还包括通过自切割2a肽附接到car羧基末端部分的人il-15,并由seq id no:70所示。
[0328]
seq id no:70:
[0329]
mlllvtslllcelphpafllipdiqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitgstsgsgkpgsgegstkgevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvsseskygppcppcpmfwvlvvvggvlacysllvtvafiifwvwrrkrkekqsetspkefltiyedvkdlktrrnheqeqtfpgggstiysmiqsqssaptsqepaytlysliqpsrksgsrkrnhspsfnstiyevigksqpkaqnparlsrkelenfdvysrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprlegggegrgslltcgdveenpgprmriskphlrsisiqcylclllnshflteagihvfilgcfsaglpkteanwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints
[0330]
编码seq id no:70构建体的相应核酸序列由seq id no:71所示。
[0331]
seq id no:71:
[0332]
atgctgctgctggtgaccagcctgctgctgtgcgagctgccccaccccgcctttctgctgatccccgacatccagatgacccagaccacctccagcctgagcgccagcctgggcgaccgggtgaccatcagctgccgggccagccaggacatcagcaagtacctgaactggtatcagcagaagcccgacggcaccgtcaagctgctgatctaccacaccagccggctgcacagcggcgtgcccagccggtttagcggcagcggctccggcaccgactacagcctgaccatctccaacctggaacaggaagatatcgccacctacttttgccagcagggcaacacactgccctacacctttggcggcggaacaaagctggaaatcaccggcagcacctccggcagcggcaagcctggcagcggcgagggcagcaccaagggcgaggtgaagctgcaggaaagcggccctggcctggtggcccccagccagagcctgagcgtgacctgcaccgtgagcggcgtgagcctgcccgactacggcgtgagctggatccggcagccccccaggaagggcctggaatggctgggcgtgatctggggcagcgagaccacctactacaacagcgccctgaagagccggctgaccatcatcaaggacaacagcaagagccaggtgttcctgaagatgaacagcctgcagaccgacgacaccgccatctactactgcgccaagcactactactacggcggcagctacgccatggactactggggccagggcaccagcgtgaccgtgagcagcgaatctaagtacggaccgccctgccccccttgccctatgttctgggtgctggtggtggtcggaggcgtgctggcctgctacagcctgctggtcaccgtggccttcatcatcttttgggtgtggaggaggaagaggaaggagaagcagagcgagacaagccctaaggagtttctgacaatctatgaagacgtgaaggacctgaagacacggagaaaccacgagcaggagcagaccttccctggaggaggcagcacaatctactccatgatccagtctcagagcagcgcccccacctcccaggagcctgcctacacactgtatagcctgatccagccatcccggaagtctggcagcaggaagcgcaaccactccccctcttttaattctaccatctatgaagtgatcggcaagagccagcccaaggcacagaaccccgcacgactgagcaggaaggaactggagaactttgatgtctactctagggtgaagttcagcagaagcgccgacgcccctgcctaccagcagggccagaatcagctgtacaacgagctgaacctgggcagaagggaagagtacgacgtcctggataagcggagaggccgggaccctgagatgggcggcaagcctcggcggaagaacccccaggaaggcctgtataacgaactgcagaaagacaagatggccgaggcctacagcgagatcggcatgaagggcgagcggaggcggggcaa
gggccacgacggcctgtatcagggcctgtccaccgccaccaaggatacctacgacgccctgcacatgcaggccctgcccccaaggctcgagggcggcggagagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccctaggatgcggatttccaaacctcacctgcgctctatctctatccagtgctatctgtgcctgctgctgaactcacatttcctgaccgaagccggcatccacgtgttcatcctgggctgcttttccgccggcctgccaaagaccgaggcaaactgggtgaatgtgatctctgacctgaagaagatcgaggatctgatccagagcatgcacatcgacgccaccctgtacacagagtccgatgtgcacccttcttgcaaggtgacagccatgaagtgtttcctgctggagctgcaggtcatcagcctggagagcggcgacgcctctatccacgataccgtggagaacctgatcatcctggccaacaatagcctgagcagcaacggcaatgtgacagagtccggctgcaaggagtgtgaggagctggaggagaagaatatcaaagagttcctgcagtcattcgtccatatcgtccagatgtttatcaatacctcctaa
[0333]
在某些实施方案中,提供了car,其具有结合cd19的细胞外抗原结合域、人igg4的铰链间隔区、nkg2d跨膜域的跨膜域、4-1bb共刺激信号传导区和cd3zeta细胞内信号传导域。以前使用过nkg2d跨膜域(许(xu)等人,《血液学与肿瘤学杂志》(j.hematol.oncol.)12:49,2019),但有些人认为由于nkgd2是一种ii型膜蛋白,它应该以相反的取向插入。示例性cd19 car蛋白序列还包括通过自切割2a肽附接到所述car羧基末端部分的人il-15,并由seq id no:72所示。
[0334]
seq id no:72:
[0335]
mlllvtslllcelphpafllipdiqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitgstsgsgkpgsgegstkgevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvsseskygppcppcppfffccfiavamgirfiimvtkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprlegggegrgslltcgdveenpgprmriskphlrsisiqcylclllnshflteagihvfilgcfsaglpkteanwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints
[0336]
编码seq id no:72构建体的相应核酸序列由seq id no:73所示。
[0337]
seq id no:73:
[0338]
atgctgctgctggtgaccagcctgctgctgtgcgagctgccccaccccgcctttctgctgatccccgacatccagatgacccagaccacctccagcctgagcgccagcctgggcgaccgggtgaccatcagctgccgggccagccaggacatcagcaagtacctgaactggtatcagcagaagcccgacggcaccgtcaagctgctgatctaccacaccagccggctgcacagcggcgtgcccagccggtttagcggcagcggctccggcaccgactacagcctgaccatctccaacctggaacaggaagatatcgccacctacttttgccagcagggcaacacactgccctacacctttggcggcggaacaaagctggaaatcaccggcagcacctccggcagcggcaagcctggcagcggcgagggcagcaccaagggcgaggtgaagctgcaggaaagcggccctggcctggtggcccccagccagagcctgagcgtgacctgcaccgtgagcggcgtgagcctgcccgactacggcgtgagctggatccggcagccccccaggaagggcctggaatggctgggcgtgatctggggcagcgagaccacctactacaacagcgccctgaagagccggctgaccatcatcaaggacaacagcaagagccaggtgttcctgaagatgaacagcctgcagaccgacgacaccgccatctactactgcgccaagcactactactacggcggcagctacgccatggactactggggccagggcaccagcgtgaccgtgagcagcgaatctaagtacggaccgccctgccccccttgccctcccttctttttctgctgttttatcgccgtggctatgggcatccggttcatcatcatggtgaccaaacggggcagaaaga
aactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactgagggtgaagttcagcagaagcgccgacgcccctgcctaccagcagggccagaatcagctgtacaacgagctgaacctgggcagaagggaagagtacgacgtcctggataagcggagaggccgggaccctgagatgggcggcaagcctcggcggaagaacccccaggaaggcctgtataacgaactgcagaaagacaagatggccgaggcctacagcgagatcggcatgaagggcgagcggaggcggggcaagggccacgacggcctgtatcagggcctgtccaccgccaccaaggatacctacgacgccctgcacatgcaggccctgcccccaaggctcgagggcggcggagagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccctaggatgcggatttccaaacctcacctgcgctctatctctatccagtgctatctgtgcctgctgctgaactcacatttcctgaccgaagccggcatccacgtgttcatcctgggctgcttttccgccggcctgccaaagaccgaggcaaactgggtgaatgtgatctctgacctgaagaagatcgaggatctgatccagagcatgcacatcgacgccaccctgtacacagagtccgatgtgcacccttcttgcaaggtgacagccatgaagtgtttcctgctggagctgcaggtcatcagcctggagagcggcgacgcctctatccacgataccgtggagaacctgatcatcctggccaacaatagcctgagcagcaacggcaatgtgacagagtccggctgcaaggagtgtgaggagctggaggagaagaatatcaaagagttcctgcagtcattcgtccatatcgtccagatgtttatcaatacctcctaa
[0339]
在某些实施方案中,提供了car,其具有与cd19结合的细胞外抗原结合域、人igg4的铰链间隔区、nkg2d跨膜域的跨膜域、2b4共刺激信号传导区和cd3ζ细胞内信号传导域。示例性cd19 car蛋白序列,还包括通过自切割2a肽附接到所述car羧基末端部分的人il-15,并由seq id no:74所示。
[0340]
seq id no:74:
[0341]
mlllvtslllcelphpafllipdiqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitgstsgsgkpgsgegstkgevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvsseskygppcppcppfffccfiavamgirfiimvtwrrkrkekqsetspkefltiyedvkdlktrrnheqeqtfpgggstiysmiqsqssaptsqepaytlysliqpsrksgsrkrnhspsfnstiyevigksqpkaqnparlsrkelenfdvysrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprlegggegrgslltcgdveenpgprmriskphlrsisiqcylclllnshflteagihvfilgcfsaglpkteanwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints
[0342]
编码seq id no:74构建体的相应核酸序列由seq id no:75所示。
[0343]
seq id no:75:
[0344]
atgctgctgctggtgaccagcctgctgctgtgcgagctgccccaccccgcctttctgctgatccccgacatccagatgacccagaccacctccagcctgagcgccagcctgggcgaccgggtgaccatcagctgccgggccagccaggacatcagcaagtacctgaactggtatcagcagaagcccgacggcaccgtcaagctgctgatctaccacaccagccggctgcacagcggcgtgcccagccggtttagcggcagcggctccggcaccgactacagcctgaccatctccaacctggaacaggaagatatcgccacctacttttgccagcagggcaacacactgccctacacctttggcggcggaacaaagctggaaatcaccggcagcacctccggcagcggcaagcctggcagcggcgagggcagcaccaagggcgaggtgaagctgcaggaaagcggccctggcctggtggcccccagccagagcctgagcgtgacctgcaccgtgagcggcgtgagcctgcccgactacggcgtgagctggatccggcagccccccaggaagggcctggaatggctgggcgtgatctggggcagcgagac
cacctactacaacagcgccctgaagagccggctgaccatcatcaaggacaacagcaagagccaggtgttcctgaagatgaacagcctgcagaccgacgacaccgccatctactactgcgccaagcactactactacggcggcagctacgccatggactactggggccagggcaccagcgtgaccgtgagcagcgaatctaagtacggaccgccctgccccccttgccctcccttctttttctgctgttttatcgccgtggctatgggcatccggttcatcatcatggtgacctggaggaggaagaggaaggagaagcagagcgagacaagccctaaggagtttctgacaatctatgaagacgtgaaggacctgaagacacggagaaaccacgagcaggagcagaccttccctggaggaggcagcacaatctactccatgatccagtctcagagcagcgcccccacctcccaggagcctgcctacacactgtatagcctgatccagccatcccggaagtctggcagcaggaagcgcaaccactccccctcttttaattctaccatctatgaagtgatcggcaagagccagcccaaggcacagaaccccgcacgactgagcaggaaggaactggagaactttgatgtctactctagggtgaagttcagcagaagcgccgacgcccctgcctaccagcagggccagaatcagctgtacaacgagctgaacctgggcagaagggaagagtacgacgtcctggataagcggagaggccgggaccctgagatgggcggcaagcctcggcggaagaacccccaggaaggcctgtataacgaactgcagaaagacaagatggccgaggcctacagcgagatcggcatgaagggcgagcggaggcggggcaagggccacgacggcctgtatcagggcctgtccaccgccaccaaggatacctacgacgccctgcacatgcaggccctgcccccaaggctcgagggcggcggagagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccctaggatgcggatttccaaacctcacctgcgctctatctctatccagtgctatctgtgcctgctgctgaactcacatttcctgaccgaagccggcatccacgtgttcatcctgggctgcttttccgccggcctgccaaagaccgaggcaaactgggtgaatgtgatctctgacctgaagaagatcgaggatctgatccagagcatgcacatcgacgccaccctgtacacagagtccgatgtgcacccttcttgcaaggtgacagccatgaagtgtttcctgctggagctgcaggtcatcagcctggagagcggcgacgcctctatccacgataccgtggagaacctgatcatcctggccaacaatagcctgagcagcaacggcaatgtgacagagtccggctgcaaggagtgtgaggagctggaggagaagaatatcaaagagttcctgcagtcattcgtccatatcgtccagatgtttatcaatacctcctaa
[0345]
表达构建体
[0346]
在某些实施方案中,car可以进一步从包含诱导型启动子的核酸表达,用于在人细胞中表达核酸序列。用于表达car基因的启动子可以是组成型启动子,例如泛素c(ubic)、pgk、ef-1alpha、mnd(一种合成病毒启动子,包含具有骨髓增殖性肉瘤病毒增强子的修饰的莫洛尼鼠白血病病毒长末端重复序列的u3区)或鸡β肌动蛋白的启动子。
[0347]
制备用于免疫疗法的基因修饰的nk细胞组合物和/或制剂的方法包括将编码抗原识别受体(例如car)的多核苷酸引入所述cd56
(主要是nk)细胞中。编码所需分子的所述多核苷酸可以在扩增之前、期间或之后引入所述hspc,或在分化之前、期间或之后引入hspc或nk细胞组合物和/或制剂中。一些实施方案涉及通过用至少一种编码car、tcr或其他抗原识别受体的多核苷酸转化、转导或转染hspc或nk细胞组合物和/或制剂,并在所述细胞中表达所述多核苷酸来工程改造nk细胞组合物和/或制剂的方法。可以通过包括以下的本领域已知任何方法将编码基因的所需多核苷酸引入hspc或其他细胞:转染、电穿孔、显微注射、脂转染、磷酸钙介导的转染、用含有所述基因序列的病毒或噬菌体载体感染、细胞融合、染色体介导的基因转移、微细胞介导的基因转移、原生质球融合、使用crispr或其他稀有切割核酸内切酶(例如,tale-核酸酶或cas9核酸内切酶)等。本领域已知许多用于将外源基因引入细胞的技术(参见例如洛夫勒(loeffler)和贝尔(behr),《酶学方法》(meth.enzymol.)217:599-618,1993;科恩(cohen)等人,《酶学方法》(meth.enzymol.)217:618-644,1993;克莱恩(cline),《药理学和治疗学》(pharmac.ther.)29:69-92,1985)并且可以使用,前提是受体
细胞的必要生理功能不被破坏。该技术应该能够将所述基因稳定地转移到细胞中,从而使基因可被细胞表达,并且优选可被其细胞后代遗传和表达。在一些实施方案中,所述转移方法包括将选择标志物或标签序列转移至所述细胞。然后将所述细胞进行选择以分离那些已经吸收并表达所转移基因的细胞。在一个优选的实施方案中,鉴于可在细胞中稳定表达,所述多核苷酸或基因被包含在慢病毒载体中。
[0348]
在一个实施方案中,在所述扩增阶段期间和分化之前将抗原识别受体(例如,car或tcr)引入hspc,以形成表达抗原识别受体的hspc和/或表达抗原识别受体的nk细胞。在优选的实施方案中,在所述扩增阶段期间和分化之前将所述抗原识别受体car引入hspc,以形成car-hspc和/或car-nk细胞。在另一个实施方案中,抗原识别受体(例如,car或tcr)在扩增后和所述分化阶段期间被引入分离的富集cd56
nk细胞,以形成表达抗原识别受体的hspc和/或表达抗原识别受体的nk细胞。在优选的实施方案中,所述抗原识别受体car在扩增后和在分化阶段期间被引入分离的富集cd56
nk细胞,以形成car-hspc和/或car-nk细胞。上述的抗原识别受体引入、car引入、细胞扩增、细胞分化分别如上文和下文所述进行。
[0349]
上述不同的方法涉及将car或另一抗原识别受体引入细胞。作为非限制性示例,car或tcr可以作为由一种质粒载体编码的转基因引入。所述质粒载体还可以含有选择标志物,该选择标志物能够识别和/或选择接受所述载体的细胞。
[0350]
由于将编码多肽的多核苷酸引入所述细胞中,所述多肽(例如car或tcr)可以在所述细胞中原位合成。
[0351]
用于将多核苷酸构建体病毒介导地引入细胞的方法是本领域已知的,并且包括作为非限制性示例的重组病毒载体(例如,逆转录病毒、腺病毒)。
[0352]
nk细胞组合物和/或制剂的冷冻保存
[0353]
nk细胞组合物和/或制剂,无论是否进行基因工程处理,都可以分隔并冷冻在一个或多个袋子(或单位)中。在优选的实施方案中,将总数为约50至约5亿个细胞冷冻在单个袋子(或单位)中。在另一个优选的实施方案中,将约100至约5亿个细胞冷冻在单个袋子(或单位)中。在其他优选实施方案中,将约50、100、200、300、400或4亿个细胞冷冻在单个袋子(或单位)中。在一些实施方案中,单个袋子(或单位)每剂含有约5000万至约20亿个活细胞。在一些实施方案中,单个袋子(或单位)包含约1亿、约2亿、约3亿、约4亿、约5亿、约6亿、约7.5亿、约10亿、约15亿或约20亿个活细胞。在一些实施方案中,单个袋子每剂包含约5000万至约20亿个活cd56
细胞。在一些实施方案中,单个袋子(或单位)包含约1亿、约2亿、约3亿、约4亿、约5亿、约6亿、约7.5亿、约10亿、约15亿或约20亿个活cd56
细胞。
[0354]
在优选的实施方案中,所述nk细胞组合物和/或制剂被冷冻或冷冻保存。在另一个实施方案中,所述nk细胞组合物和/或制剂是新鲜的,即所述细胞在扩增或冷冻保存之前之前没有被冷冻。术语“冷冻/冷冻”(frozen/freezing)和“冷冻保存/冷冻保存/冷冻保存”(cryopreserved/cryopreserving/cryopreservation)在本技术中可互换使用。冷冻保存可以通过本领域已知的以活体形式保存细胞的任何方法进行。细胞的冷冻通常具有破坏性,因为在冷却时,细胞内的水会冻结,从而导致由细胞膜上的渗透作用、细胞脱水、溶质浓缩和冰晶形成造成的损伤。当冰在细胞外形成时,可用的水从溶液中去除并从所述细胞中抽出,导致渗透性脱水并使溶质浓度升高,最终破坏细胞。有关讨论,请参见马祖尔(mazur),p.,《低温生物学》(cryobiology)14:251-272,1977。
[0355]
这些有害影响可以通过(a)使用冷冻保护剂,(b)控制冷冻速度,以及(c)在足够低的温度下储存以尽量减少降解反应来规避。
[0356]
可以使用的冷冻保护剂包括但不限于二甲基亚砜(dmso)(洛夫洛克(lovelock)和毕晓普(bishop),《自然》(nature)183:1394-1395,1959;阿什伍德-史密斯(ashwood-smith),《自然》(nature)190:1204-1205,1961);甘油、聚乙烯吡咯烷(林弗雷特(rinfret),《纽约科学院年报》(ann.n.y.acad.sci.)85:576,1960);聚乙二醇(斯洛维特(sloviter)和拉夫丁(ravdin),《自然》(nature)196:548,1962);白蛋白、葡聚糖、蔗糖、乙二醇、异赤藓糖醇、d-核糖醇、d-甘露醇(罗维(rowe)等人,《联邦会议记录》(fed.proc.)21:157,1962);d-山梨糖醇、异肌醇、d-乳糖、氯化胆碱(本德(bender)等人,《应用生理学杂志》(j.appl.physiol.)15:520,1960);氨基酸(潘特兰(phan the tran)和本德(bender),1960,《实验细胞研究》(exp.cell res.)20:651,1960);甲醇、乙酰胺、甘油单乙酸酯(洛夫洛克(lovelock),《生物化学期刊》(biochem.j.)56:265,1954);无机盐(潘特兰(phan the tran)和本德(bender),《实验性的生物与医学刊物》(proc.soc.exp.biol.med.)104:388,1960;潘特兰(phan the tran)和本德(bender),《放射生物学》(radiobiology),《第三届澳大利亚放射生物学会议论文集》(proceedings of the third australian conference on radiobiology),伊尔伯里(ilbery)编辑,巴特沃思,伦敦,p.59,1961)和cs5或cs10(华盛顿州博塞尔的生物生命解决方案公司(biolife solutions inc.))。在优选实施方案中,使用了dmso。例如,dmso以对细胞无毒的浓度使用。此外,dmso包含至多约20%的所述组合物、至多约15%的所述组合物、至多约10%的所述组合物、至多约5%的所述组合物、至多约2%的所述组合物、至多约1%的所述组合物或至多约0.5%的所述组合物。在一些实施方案中,添加血浆(例如,至多约20至25%的浓度)可以增强dmso的保护作用。在一些实施方案中,添加人蛋白质,例如人血清白蛋白(例如,至多约2至10%的浓度)可以增强dmso的保护作用。在添加dmso后,细胞应保持在0℃直至冷冻,因为约1%的dmso浓度在4℃以上的温度下可能有毒。
[0357]
在另一个实施方案中,使用含有20%dmso和8%人血清白蛋白(hsa)的pbs,或其他合适的细胞冷冻培养基。然后将该混合物用培养基按1:1稀释,使dmso和hsa的最终浓度分别为10%和4%。然后将该混合物中的细胞以每分钟1摄氏度的速度冷冻到-80℃,并储存在液氮储罐的气相中。
[0358]
受控的缓慢冷却速率可能很重要。不同的冷冻保护剂(拉帕茨(rapatz)等人,《低温生物学》(cryobiology)5(1):18-25,1968)和不同的细胞类型具有不同的最佳冷却速率(关于冷却速度对骨髓干细胞存活率以及它们移植潜力的影响,参见例如罗维(rowe)和林弗雷特(rinfret),《血液》(blood)20:636,1962;罗维(rowe),《低温生物学》(cryobiology)3(1):12-18,1966;刘易斯(lewis)等人,《输血》(transfusion)7(1):17-32,1967;和马祖尔(mazur),《科学》(science)168:939-949,1970)。水变成冰的融合阶段的热量应保持在最低限度。冷却程序可以通过使用例如可编程冷冻装置或本领域已知的甲醇浴程序来进行。
[0359]
可编程冷冻设备能够确定最佳冷却速率并有利于进行标准可重复冷却过程。诸如cryomed或planar之类的可编程控速冷冻机能够将冷冻方案调整到所需的冷却速率曲线。例如,对于10%dmso和20%血浆中的骨髓细胞,最佳速率是从0℃到-80℃每分钟1℃到3℃。在优选的实施方案中,可以使用这种从0℃到-80℃每分钟1℃到3℃的冷却速率。容纳所述
细胞的容器必须在低温下保持稳定,并能够快速传热以有效控制冷冻和解冻。密封的塑料小瓶(例如,nunc,wheaton)或玻璃安瓿可用于多个小剂量(1-2ml)或较大剂量(例如,5至30ml),而大容量(20至200ml)可以在聚烯烃袋(例如,del-med)或乙烯醋酸乙烯酯冷冻袋(例如,origen)中冷冻,这些袋子夹在金属板之间,以便在冷却期间中更好地进行热传递。例如,骨髓细胞袋已通过放入-80℃冷冻机中成功冷冻,冷冻速度约为3℃/分钟。
[0360]
在备选的实施方案中,可以使用甲醇浴冷却法。所述甲醇浴法非常适合对多个小物项进行大规模的常规冷冻保存。该方法不需要手动控制冷冻速率,也不需要记录器来监测速率。在优选的实施方案中,dmso处理的细胞在冰上预冷并转移到含有冷冻甲醇的托盘中,该托盘置于-80℃的机械制冷机(例如harris或revco)中。所述甲醇浴和样本的热电偶测量表明所需的冷却速率为每分钟1℃至3℃。至少两小时后,试样已达到-80℃的温度,可以直接浸入液氮(-196℃)中永久储存。
[0361]
彻底冷冻后,可将所述nk细胞组合物和/或制剂快速转移到长期低温储存容器中。在优选实施方案中,样本低温储存在液氮(-196℃)或其蒸气中(在约-140℃和-180℃之间)。在另一个优选实施方案中,样本低温储存在液氮气相(例如,在约-140℃至-180℃)中。高效液氮制冷机的使用极大地利于这种储存,这种制冷机类似于具有极低真空度和内部超级绝缘的大型容器,从而最大限度地减少了热泄漏和氮损失。
[0362]
合适的托架系统是市售的,可用于对单个样本进行编目、存储和检索。
[0363]
其他冷冻保存活细胞的方法,或对这些方法进行修改,都是可以的,并着眼于使用(例如,冷金属镜技术;利夫西(livesey)和林纳(linner),《自然》(nature)327:255,1987;林纳(linner)等人,《组织化学与细胞化学杂志》(j.histochem.cytochem.)34(9):1123-1135,1986;也参见森坎(senkan)等人的美国专利号4,199,022、施瓦茨(schwartz)的美国专利号3,753,357、法希(fahy)的美国专利号4,559,298)。
[0364]
冷冻保存或冷冻的细胞优选快速解冻(例如,在保持在37℃至41℃的水浴中),并在解冻后立即冷却。在具体的实施方案中,可以将装有所述冷冻细胞的小瓶浸入温水浴中直至其颈部并轻轻旋转,以确保细胞悬浮液在解冻时混合并增加从温水到内部冰块的热传递。一旦冰完全融化,立即将所述小瓶放入冰中。
[0365]
在一个实施方案中,将冷冻保存的nk细胞组合物和/或制剂解冻,并将完整的制剂或其一部分输注到有需要的人或动物病患(例如,患有白血病,例如aml;另一种血液恶性肿瘤;病毒感染(例如,hiv、hsv1或1,甲型、乙型或丙型肝炎,寨卡病毒,sars-cov或sars-cov-2等);或本文公开的其他感染)。与处理解冻细胞有关的一些程序是可以利用的,在本领域中是已知的,并且如果需要可以使用。
[0366]
可能需要处理所述细胞以防止在解冻时细胞结块。为了防止结块,各种程序在本领域是众所周知的并且可以用于所公开的方法,包括但不限于在冷冻之前和/或之后添加dnase(史匹哲(spitzer)等人,《癌症》(cancer)45:3075-3085,1980)、低分子量葡聚糖和柠檬酸盐,和/或羟乙基淀粉(斯蒂夫(stiff)等人,《低温生物学》(cryobiology)20:17-24,1983)等。
[0367]
如果所述冷冻保护剂对人体有毒,则应在治疗性使用解冻的nk细胞组合物和/或制剂之前去除。在使用dmso作为所述冷冻保存剂的实施方案中,优选省去该步骤以避免细胞损失。然而,在需要去除所述冷冻保护剂的情况下,优选在解冻时完成去除。
[0368]
例如,去除所述冷冻保护剂可以通过稀释以使所述冷冻保护剂的浓度微不足道。这可以通过添加培养基来完成,如果需要,随后进行一个或多个循环离心以沉淀细胞、去除上清液和重新悬浮细胞。例如,所解冻细胞中的细胞内dmso可以减少到不会对所恢复细胞产生不利影响的水平(小于1%)。这最好缓慢进行,以尽量减少在去除dmso期间发生的潜在破坏性渗透梯度。
[0369]
去除所述冷冻保护剂后,细胞计数(例如,通过使用血细胞计数器)和活性测试(例如,通过台盼蓝排除法;库赫勒(kuchler),《细胞培养和病毒学中的生物化学方法》(biochemistry methods in cell culture and virology),道登、哈钦森和罗斯公司(dowden,hutchinson&ross),斯特劳兹堡,宾夕法尼亚州,pp.18-19,1977;《医学研究方法》(methods in medical research),艾森(eisen)等人,编辑,第10卷,年鉴医学出版公司(year book medical publishers,inc.),芝加哥,pp.39-47,1964)可用于确认细胞存活率。活抗原(例如cd56)阳性细胞的百分比可以通过计算从细胞等分试样中排除7-aad(或活细胞排除的其他合适染料)的抗原阳性细胞的数量,除以所述细胞等分试样中的有核细胞总计数(tnc)(包括活细胞和非活细胞)来确定。然后可以通过将活抗原阳性细胞的百分比乘以所述tnc来确定活抗原阳性细胞的数量。
[0370]
在冷冻保存之前和/或解冻之后,可以确定有核细胞的总数,或者在具体实施方案中,可以确定cd56
细胞的总数。例如,有核细胞总计数可以通过使用血细胞计数器和排除台盼蓝染料来进行。具有高细胞性的样本可以稀释到适合手动计数的浓度范围。产品的最终细胞计数会针对任何稀释因子进行校正。
[0371]
有核细胞总计数等于每毫升活有核细胞数x产品体积(ml)。可以确定所述样本中cd56
阳性细胞的数量,例如,通过使用与荧光染料缀合的抗cd56单克隆抗体的流式细胞仪。
[0372]
所述nk细胞组合物和/或制剂可用于治疗实体瘤、造血系统恶性肿瘤、病毒性疾病、细菌感染等的免疫疗法。在一些实施方案中,施用所述nk细胞组合物和/或制剂以抑制有需要的受试者(也称为病患)的肿瘤生长。根据本发明该方面的方法通过向所述受试者施用治疗有效量的nk细胞组合物和/或制剂来实现。如本文所用,“治疗”(treating)或“治疗”(treatment)包括但不限于施用nk细胞组合物和/或制剂以减少或延迟疾病的症状、并发症或生化指标的出现,从而减轻症状或阻止或抑制疾病、病症或病况(例如,癌症、转移性癌症、转移性实体瘤、病毒或细菌症状)的进一步发展。治疗可以是预防性的,即作为佐剂(以防止疾病复发或延迟疾病发作,或防止其临床或亚临床症状的表现)或在疾病表现后治疗性地抑制或减轻症状。
[0373]
在一个实施方案中,以有效减少或消除癌症(例如实体瘤)或恶性血液病(例如白血病或淋巴瘤等),或预防它们发生或复发的量施用nk细胞组合物和/或制剂。“有效减少或消除实体瘤或恶性血液病或防止它们发生或复发的量”或“有效减少或消除过度增殖性疾病或防止其发生或复发的量”是指,nk细胞组合物和/或制剂的量,其在治疗肿瘤疾病状态或过度增殖性疾病后改善受试者的结果或存活率,这通过病患测试数据、存活率数据、肿瘤标志物水平的升高或抑制、基于遗传档案或暴露于环境因素的易感性降低来测量。“抑制肿瘤生长”是指减小肿瘤细胞的大小或减弱活性或数量。“癌症”、“恶性肿瘤”、“实体瘤”或“过度增殖性疾病”用作同义词,指的是以细胞不受控制的异常增殖;受影响的细胞局部或通过
血流和淋巴系统扩散到身体其他部位(即转移)的能力;以及任何其他特征结构和/或分子特征的为特征的多种疾病中的任何一种。“癌性细胞”、“恶性细胞”或“实体瘤细胞”被理解为具有特定结构特性、缺乏分化并且能够侵袭和转移的细胞。“癌症”是指在哺乳动物中发现的所有类型的癌症或赘生物或恶性肿瘤,包括癌和肉瘤。示例有乳腺癌、肺癌、非小细胞肺癌、胃癌、脑癌、头颈癌、髓母细胞瘤、骨癌、肝癌、结肠癌、泌尿生殖系统癌、膀胱癌、泌尿癌、肾癌、睾丸癌、子宫癌、卵巢癌、宫颈癌或前列腺癌,以及黑色素瘤、间皮瘤和肉瘤(参见迪芬达(devita)等人,(编辑),《肿瘤学的癌症原理与实践》(cancer principles and practice of oncology),第6版,利平科特
·
威廉姆斯和威尔金斯集团(lippincott williams&wilkins),费城,宾夕法尼亚,2001;出于所有目的,该参考文献全文以引用的方式并入本文)。“过度增殖性疾病”是指细胞增殖比正常组织生长更快的任何疾病或病症。因此,过度增殖细胞是比正常细胞增殖更快的细胞。
[0374]“实体瘤”包括但不限于肉瘤、黑素瘤、癌或其他实体瘤癌症。“肉瘤”是指由类似胚胎结缔组织的物质组成并且通常由嵌入纤维状或均质物质的紧密堆积的细胞组成的肿瘤。肉瘤包括但不限于软骨肉瘤、纤维肉瘤、淋巴肉瘤、黑色素肉瘤、粘液肉瘤、骨肉瘤、艾伯内西氏肉瘤、脂肪肉瘤、脂肪肉瘤、腺泡状软组织肉瘤、成釉细胞肉瘤、葡萄状肉瘤、绿色肉瘤、绒毛膜癌、胚胎肉瘤、肾母细胞瘤、子宫内膜肉瘤、间质肉瘤、尤文肉瘤、筋膜肉瘤、成纤维细胞肉瘤、巨细胞肉瘤、粒细胞肉瘤、霍奇金肉瘤、特发性多发性色素沉着性出血性肉瘤、b细胞免疫母细胞肉瘤、t细胞免疫母细胞肉瘤、詹森肉瘤、卡波西肉瘤、库普弗细胞肉瘤、血管肉瘤、白血病肉瘤、恶性间充质肉瘤、骨旁肉瘤、网织细胞肉瘤、劳斯肉瘤、浆囊肉瘤、滑膜肉瘤和毛细血管扩增肉瘤。
[0375]“黑色素瘤”是指由皮肤和其他器官的黑色素细胞系统产生的肿瘤。黑素瘤包括例如肢端黑色素瘤、无色素黑色素瘤、良性幼年性黑色素瘤、克劳德曼黑素瘤、s91黑色素瘤、哈-帕二氏黑色素瘤、幼年性黑色素瘤、恶性雀斑样痣黑色素瘤、恶性黑色素瘤、结节性黑色素瘤、甲下黑色素瘤和浅表扩散性黑色素瘤。
[0376]“癌”是指由倾向于浸润周围组织并引起转移的上皮细胞组成的恶性新生长物。示例性癌包括例如腺泡癌、腺泡状癌、囊性腺样癌、腺样囊状癌、腺癌、肾上腺皮质癌、肺泡癌、肺泡细胞癌、基底细胞癌、基底上皮细胞癌、类基底细胞癌、基底鳞状细胞癌、支气管肺泡癌、细支气管癌、支气管肺癌、脑样癌、胆管细胞癌、绒毛膜癌、胶样癌、粉刺癌、子宫体癌、筛状癌、铠甲状癌、皮肤癌、柱状细胞癌、柱状细胞癌、导管癌、硬癌、胚胎性癌、髓样癌、表皮样癌、腺样上皮癌、外生性癌、溃疡性癌、纤维癌、胶样癌、胶状癌、巨细胞性癌、巨细胞癌、腺癌、粒层细胞癌、发母质癌、多血癌、肝细胞癌、许特莱氏细胞腺癌、玻璃样癌、肾透明细胞样癌、婴儿胚胎性癌、原位癌、表皮内癌、上皮内癌、克龙派切尔癌、库尔契茨基氏细胞癌、大细胞癌、豆状癌(lenticular carcinoma/carcinoma lenticulare)、脂肪瘤、淋巴上皮癌、髓样癌(carcinoma medullare/medullary carcinoma)、黑色素癌、粘液癌(mucous carcinoma/carcinoma muciparum)、粘液细胞癌、脉络丛脑膜炎癌、粘液癌(carcinoma mucosum/mucous carcinoma)、粘液瘤样癌、鼻咽癌、燕麦细胞癌、骨化性癌、骨样癌、乳头状癌、门静脉癌、前侵袭癌、棘细胞癌、髓样癌(pultaceous carcinoma)、肾细胞癌、储备细胞癌、肉瘤样癌、硬癌(scirrhous carcinoma)、阴囊癌、印戒细胞癌、单纯癌、小细胞癌、球状细胞癌、梭形细胞癌、海绵状癌、鳞状癌、鳞状细胞癌、线状癌(string carcinoma)、毛细血
管扩增癌、毛细血管瘤、移行细胞癌、结节性皮癌(carcinoma tuberosum/tuberous carcinoma)、疣状癌和绒毛状癌。
[0377]“白血病”是指造血器官的进行性恶性疾病,通常以血液和骨髓中白细胞及其前体的增殖和发育异常为特征。白血病的临床分类通常基于(1)疾病的持续时间和特征——急性白血病或慢性白血病;(2)涉及的细胞类型;骨髓细胞(骨髓性细胞)、淋巴(淋巴生成细胞)或单核细胞;(3)血液中异常细胞数量的增加或不增加——白血病或白细胞缺乏(亚白血病)。白血病包括,例如,急性非淋巴细胞白血病、急性骨髓性白血病、慢性淋巴细胞白血病、急性粒细胞性白血病、慢性粒细胞白血病、急性早幼粒细胞白血病、成人t细胞白血病、非白血性白血病、白细胞不增多性白血病、嗜碱性母细胞白血病、牛白血病、慢性粒细胞白血病、皮肤白血病、干细胞性白血病、嗜酸性粒细胞白血病、格罗斯氏白血病(gross'leukemia)、毛细胞白血病、成血细胞性白血病(hemoblastic leukemia/hemocytoblastic leukemia)、组织细胞性白血病、干细胞白血病、急性单核细胞性白血病、白细胞减少性白血病,淋巴性白血病、淋巴性白血病、淋巴母细胞性白血病、淋巴细胞性白血病、淋巴原性白血病、淋巴样白血病、淋巴肉瘤细胞白血病、肥大细胞白血病、巨核细胞性白血病、小骨髓母细胞性白血病、单核细胞性白血病、骨髓母细胞白血病、髓细胞性白血症、髓细胞粒细胞性白血病、骨髓单核细胞性白血病、内格利白血病(naegeli leukemia)、浆细胞白血病、浆细胞性白血病、前髓细胞性白血病、里德尔细胞白血病(riedercellleukemia)、席林氏白血病(schilling'sleukemia)、干细胞白血病、亚白血病性白血病和未分化细胞白血病。
[0378]
其他癌症包括例如霍奇金病、非霍奇金淋巴瘤、多发性骨髓瘤、成神经细胞瘤、乳腺癌、卵巢癌、肺癌、横纹肌肉瘤、原发性血小板增多症、原发性巨球蛋白血症、小细胞肺肿瘤、原发性脑肿瘤、胃癌、结肠癌、恶性胰腺胰岛素瘤、恶性类癌、膀胱癌、癌前皮肤病变、睾丸癌、淋巴瘤、甲状腺癌、神经母细胞瘤、食道癌、泌尿生殖道癌、恶性高钙血症、宫颈癌、子宫内膜癌、肾上腺皮质癌、前列腺癌症。
[0379]
在另一个实施方案中,提供了一种抑制有需要的受试者病毒感染的方法。该方法通过向受试者施用治疗量的nk细胞组合物和/或制剂而来实现。适合用nk细胞组合物和/或制剂治疗的病毒感染包括但不限于hiv、淋巴细胞脉络丛脑膜炎病毒(lcmv)、巨细胞病毒(cmv)、牛痘病毒、冠状病毒(sars-cov和sars-cov-2)、流感和副流感病毒、寨卡病毒、肝炎(包括甲型肝炎、乙型肝炎、丙型肝炎、非甲型非乙型肝炎等)病毒、单纯疱疹病毒(hsv 1或hsv 2)、带状疱疹病毒和泰累尔氏病毒。适合用nk细胞组合物和/或制剂治疗的其他传染病包括但不限于寄生虫感染,例如疟原虫、利什曼原虫和弓形虫感染,以及细菌感染,例如分枝杆菌和李斯特菌(有关nk细胞治疗病毒、细菌和原生动物疾病的综述参见,祖基尼(zucchini)等人,《抗感染治疗专家评审》(exp.rev.anti-infect.ther.)6:867-885,2008,该文献通过引用并入本文)。
[0380]
根据本发明的一些方面,提供了包含用于治疗疾病的nk细胞制剂的药物组合物。例如,将所述nk细胞制剂与药学上可接受的载体一起配制以形成用于治疗例如转移性癌症、实体瘤、恶性血液病、过度增殖性疾病、任何病毒感染、细菌感染等的nk细胞组合物.
[0381]
将治疗性应用、组合物或药物施用于疑似患有或已经患有此类疾病的受试者,提供量足以治愈或部分阻止所述疾病症状(生化症状、组织学症状和/或行为症状),包括它们的并发症和疾病发展中的中间病理表型。足以完成这种治疗方法的量被定义为治疗有效剂
量。在治疗方案中,nk细胞组合物和/或制剂通常以数种剂量施用,直到获得足够的抗增殖反应。通常,监测所述抗增殖反应,如果抗增殖反应开始减弱,则给予重复剂量。
[0382]
nk细胞组合物和/或制剂用于治疗如本文所述疾病(例如转移性癌症、实体瘤、恶性血液病、过度增殖性疾病、任何病毒感染、细菌感染等)的有效剂量取决于以下因素,包括施用方式、作用靶位、病患的生理状态、病患是人还是动物、所施用的其他药物以及治疗是预防性的还是治疗性的。通常,病患是人,但也可以治疗包括转基因哺乳动物在内的非人哺乳动物。需要调整治疗剂量以优化安全性和有效性。
[0383]
对于施用治疗性nk细胞组合物和/或制剂,剂量范围通常为每剂约50至约5亿个总细胞。在一些实施方案中,剂量为每剂约50、100、200、300、400或4亿个细胞。在一些实施方案中,所述nk细胞组合物和/或制剂的剂量可以是每剂约5000万至约20亿个活细胞。在一些实施方案中,所述nk细胞组合物和/或制剂的剂量包含约1亿、约2亿、约3亿、约4亿、约5亿、约6亿、约7.5亿、约10亿、约15亿或约20亿个活细胞。在一些实施方案中,所述nk细胞组合物和/或制剂的剂量可以是每剂量约5000万至约20亿个活cd56
细胞。在一些实施方案中,所述nk细胞组合物和/或制剂的剂量包含约1亿、约2亿、约3亿、约4亿、约5亿、约6亿、约7.5亿、约10亿、约15亿或约20亿个活cd56
细胞。
[0384]
示例性治疗方案需要约每周一次、两次或者甚至三次,每两周一次、两次或者甚至三次,约每月一次,约每3至6个月一次,或约每6至12个月一次施用。可以多次施用nk细胞组合物和/或制剂。单次剂量之间的间隔可以是几天、一周、一月、一年或这些时间段的某种组合。间隔也可以是不规律的,并通过测量病患体内所述nk细胞组合物和/或制剂的血液水平来指示。或者,所述nk细胞组合物和/或制剂可以作为缓释配方施用,在这种情况下需要较小的施用频率。剂量和频率取决于病患体内所述nk细胞组合物和/或制剂的半衰期。施用的剂量和频率可以根据治疗是预防性的还是治疗性的而变化。在预防性应用中,在较长时间内以相对不频繁的间隔施用相对低的剂量。一些病患在余生中继续接受治疗。在治疗性应用中,有时需要以相对短的间隔使用相对高的剂量,直到疾病的进展减弱或终止,并且优选直到病患表现出疾病症状或疾病适应症的部分或完全改善。此后,可通过预防性方案施用于该病患。
[0385]
用于治疗疾病例如转移性癌症、实体瘤、恶性血液病、过度增殖性疾病、任何病毒感染、细菌感染等的nk细胞组合物和/或制剂的组合物可以通过静脉内、囊内、动脉内、颅内或腹膜内方式施用。
[0386]
在一些实施方案中,在化疗方案之后施用nk细胞组合物和/或制剂。所述化疗方案可以是单剂或多剂方案。在一些实施方案中,所述化疗方案是诱导方案或巩固方案。在一些实施方案中,所述化疗方案是挽救方案。
[0387]
在一些实施方案中,固定剂量的nk细胞组合物和/或制剂可以在化疗方案(例如诱导方案)或其周期之后施用。还可以在巩固方案或其周期之后施用固定剂量的nk细胞组合物和/或制剂。还可以在挽救方案或其周期之后施用固定剂量的nk细胞组合物和/或制剂。在一些实施方案中,可以在第二诱导方案或其周期之后施用固定剂量的nk细胞组合物和/或制剂,或如果需要或必要,在诱导方案的第二周期之后施用。在一些实施方案中,可以在第二巩固方案或其周期之后施用固定剂量的nk细胞组合物和/或制剂,或者在巩固方案的第二周期后施用是需要或必要的。在一些实施方案中,可以在第二挽救方案或其周期之后
施用固定剂量的nk细胞组合物和/或制剂,或者在挽救方案的第二周期后施用是需要或必要的。
[0388]
实施例
[0389]
本发明的范围不受本文所述的具体实施方案的限制。实际上,根据本文的描述和附图,除了本文描述的修改之外,本发明的各种修改对于本领域技术人员将是显而易见的。此类修改旨在落入所附权利要求的范围内。
[0390]
本文引用了各种出版物,包括专利、专利申请出版物和科学文献,出于所有目的,所公开内容以引用的方式整体并入。虽然已经示出和描述了说明性实施方案,但是应当理解,在不背离本发明的精神和范围的情况下可以在此做出各种改变。
[0391]
实施例1:产生nk细胞组合物和/或制剂
[0392]
本实施例描述了nk细胞制剂的生产和储存以及将其配制成nk细胞组合物。
[0393]
脐带血/胎盘血单位(cbu)在出生时从人类供体收集。通常,所述cbu在收集后会被冷冻,并且所选定的cbu在使用前符合供体资格并且完全符合条件。然后将收集的血液与抗凝剂混合以防止凝结。将血液在4℃下隔离保存在受监控的制冷机中。对收到的单位进行了评估,并确定了要进行扩增处理的单位。
[0394]
第一阶段涉及造血干细胞和祖细胞的扩增。将富集cd34
的造血干细胞和祖细胞(hspc)接种到经过组织培养处理的塑料容器(thermo scientific nunc
tm
easyflask
tm
)中。如美国专利申请公开号2013/0095079(通过引用并入本文)中所述,由合并的脐带血单位制备富集的cd34
hspc。通常,在cd34
细胞富集之前或之后,将至少4脐带血单位的cd34
细胞合并。
[0395]
所述组织培养处理的塑料容器预涂有重组人纤连蛋白片段(宝生物公司(takara bio,inc.));重组人纤连蛋白片段,5μg/ml和0.8μg/cm2表面积)和notch激动剂(delta1
extigg
,2.5μg/ml和0.4μg/cm2表面积)的dpbs(gibco)溶液。培养基由设计并适合于培养和扩增造血细胞的无血清细胞培养基(stemspan
tm
无血清扩增培养基ii(sfem ii;干细胞技术公司))组成,该培养基补充有rhscf(美天旎生物技术)、flt-3l(美天旎生物技术)、tpo(美天旎生物技术)和il-6(美天旎生物技术)和10ng/ml il-3(美天旎生物技术)各50ng/ml。细胞培养14天,适当时将所述细胞传代到更大体积的培养容器中以保持细胞密度《2x106个细胞/ml。
[0396]
产生相同细胞制剂的第一阶段扩增培养的替代方案包括用2.5至10μg/ml纯化的抗人notch 1抗体(生物传奇公司(biolegend),leaf
tm
纯化,克隆mhn1-519)代替delta1
extigg
作为所述notch激动剂。
[0397]
所述培养过程的第二阶段将扩增的造血干细胞和祖细胞分化为nk细胞表型。在14天扩增阶段结束时(如上),收集所有细胞并重新接种到组织培养处理的塑料容器中,而没有涂覆所述notch激动剂(delta1
extigg
或)。所述培养基包含rpmi1640(gibco),补充有5至10%热灭活胎牛血清(fbs;gibco)、40ng/ml rhil-15(peprotech(佩普罗技术公司))和50u/ml rhil-2(佩普罗技术公司)。细胞再培养至多14天,适当时将所述细胞传代到更大体积的培养容器中以保持细胞密度《2x106个细胞/ml。
[0398]
除cd56外,所述cd56
细胞高频率表达nkp30、nkp46、nkp44、nkg2a和颗粒酶b,中到高频率表达穿孔素和cd107a,低到中频率表达nkg2d,并且基本上不表达kir。在那些测试的
批次中,发现所述cd56
细胞是kir-。(如本文所用,“kir
‑”是指kir2dl1、kir2ds1、kir2ds3、kir2ds5、kir2dl2、kir2dl3、kir2ds2、kir2ds4、kir3dl1和kir3ds1。)cd16以低至中频率表达。在测试的那些批次中,所述cd56细胞中到高频率表达颗粒酶b,高频率表达cd107a,并且低频率表达穿孔素。参见上表1。上表2也显示了示例性nk细胞制剂中cd56
细胞的表型属性。
[0399]
所述nk细胞制剂还包括大约25%到50%的cd56-细胞。这些细胞主要来源于骨髓,可以包括树突细胞、巨噬细胞和粒细胞。在所述nk细胞制剂的cd56-细胞中,以下细胞表面标志物以指定频率表达:颗粒酶b以中频率表达,cd107a以高频率表达。上表3显示了示例性nk细胞制剂中cd56-细胞的表型属性。
[0400]
图1a显示了在28天培养过程(第一阶段(扩增)和第二阶段(分化))中cd56
细胞/起始cd34
细胞的增加。图1b展示了在28天细胞培养过程中cd56
细胞生成的增殖率。图1a和图1b显示了按照上述过程生产的20批nk细胞制剂的结果。
[0401]
实施例2:生产不含动物来源血清的nk细胞制剂。
[0402]
为了避免使用动物来源的血清,用于生产nk细胞制剂的第二阶段培养(分化)的替代方案涉及用热灭活的人ab血清(硅谷生物医学公司(valley biomedical))或人血小板裂解液(米尔溪生命科学公司(mill creek life sciences))替代胎牛血清(fbs)。申请人出乎意料地能够在实施例1所述方法第二阶段(分化阶段)中替代热灭活的人ab血清或人血小板裂解液。
[0403]
用人ab血清(habs)或人血小板裂解液(hpl)替代fbs对分化期间细胞扩增(图2)或产生的cd56
细胞数量(图3)影响很小。hpl保持培养物的扩增比habs稍好,但在所述fbs、habs和hpl培养物中产生的细胞表型非常相似。
[0404]
图4和图5显示了培养第28天的cd16
细胞百分比(图4)和nkp46
细胞百分比(图5),两者均作为cd56
细胞的百分比,比较了培养第二阶段中使用的不同血清补充剂。
[0405]
使用nk细胞制剂和k562靶细胞进行体外细胞毒性分析,以比较在第二阶段中用各种血清补充剂(fbs、habs或hpl)培养的nk细胞制剂。图6和图7显示补充hpl的培养物比补充habs的培养物产生了更具细胞毒性的nk细胞群。
[0406]
实施例3:用nk细胞制剂进行体外细胞毒性试验
[0407]
使用第28天nk细胞制剂或k562激活的成人外周血nk细胞作为效应细胞(e)进行体外细胞毒性试验。如上所述制备所述nk细胞制剂。荧光标记的k562细胞(慢性骨髓性白血病细胞系)或a549细胞(肺癌细胞系)被包括作为靶细胞(t)。将所述细胞以图8所示的e:t比在37℃下共培育4小时。然后用4',6-二脒基-2-苯基吲哚(dapi)标记细胞,荧光靶细胞用dapi共标记,通过流式细胞仪分析确定为垂死的靶细胞和死亡的靶细胞。
[0408]
图8显示了所述nk细胞制剂(称为nk细胞产品)对k562靶细胞和a549靶细胞具有相似的活性(用实心圆圈和实心三角形标示的曲线)。相比之下,用k562细胞激活的成人外周血nk细胞(称为k562激活的成人pb nk细胞)对k562靶细胞有活性(有空心圆圈的顶部曲线),但对a549靶细胞没有活性(有空心三角形的底部线)。该研究证明了所述nk细胞制剂对各种靶细胞具有活性的能力。
[0409]
实施例4:使用nk细胞制剂的额外体外试验
[0410]
所述nk细胞制剂的细胞毒性在标准体外细胞杀伤试验(如上文实施例3中所述)中
针对一系列骨髓细胞白血病(类似于aml)细胞系进行测试。图9展示了所述nk细胞制剂对这些癌细胞系的多种细胞系表现出细胞杀伤作用。在图9中,对于每种细胞系,左柱表示4小时的细胞毒性,右柱表示24小时的细胞毒性。所述k562细胞系是公认的nk细胞活性标准,可用作阳性对照。
[0411]
实施例5:用nk细胞制剂进行体内小鼠异种移植试验
[0412]
通过测量u-87肿瘤负荷,在进行或未进行nk细胞制剂治疗的nsg小鼠中测试了nk细胞制剂在u-87胶质母细胞瘤模型中的活性。u-87细胞用(一种由engelbreth-holm-swarm(ehs)小鼠肉瘤细胞分泌的凝胶状蛋白质混合物,旨在比拟许多组织中发现的复杂细胞外环境并作为培养细胞的底物)皮下注射到测试nsg小鼠的后胁腹(2x106细胞/小鼠)并使其生长9天以形成可测量的肿瘤,然后每只小鼠进行肿瘤内注射1x107个细胞的nk细胞制剂(称为nk细胞产品或组合物)。以2至3次/周的频率通过卡尺测量评估肿瘤生长。图10表明,与盐水注射对照相比,所述nk细胞产品能够减少肿瘤负荷。
[0413]
图11显示了本研究中未处理对照(带圆圈的线)和所述nk细胞制剂(带正方形的线)的肿瘤大小随时间变化的曲线图。所述nk细胞制剂能够使肿瘤发展显著延迟(图11)。所述nk细胞制剂持续存在并且在注射后37天可检测到,这通过检测肿瘤中的人cd45
细胞来测量(图11)。
[0414]
实施例6:使用notch 1或notch 2特异性抗体扩增cd34
hspc。
[0415]
如上(实施例1)所述,cd34
hspc的扩增在标准底物hspc的扩增在标准底物或在5μg/ml抗notch1抗体(抗notch 1ab)或在5μg/ml抗notch1 ab上进行。图12a-d显示用notch 1或notch 2抗体扩增hspc(参见美国专利申请公开号2017/0107493,通过引用并入本文)与使用dxi的扩增相当。
[0416]
实施例7:在有肿瘤细胞的情况下通过nk细胞制剂释放细胞因子。
[0417]
进行这项研究是为了测定在有和没有k562或a549肿瘤细胞的情况下,nk细胞制剂对细胞因子干扰素γ(ifnγ)或肿瘤坏死因子α(tnfα)的表达。图13显示了通过上述方法产生的nk细胞制剂(称为nk细胞产品)或k562或a549肿瘤细胞单独培养,或一起培养三天。该研究是一式三份进行的。三天后,通过luminex试验测定细胞因子水平。(检测限为1pg/ml细胞因子。)如图13所示,当在有肿瘤细胞的情况下共培养nk细胞制剂时,ifnγ(图13a)和tnfα(图13b)水平均增加。这些结果表明,所述制剂中的nk细胞在有肿瘤细胞的情况下变得更加活跃。
[0418]
实施例8:生产基因修饰nk细胞制剂的转导时间进程。
[0419]
进行这项研究是为了测定在扩增和分化阶段期间进行基因修饰的合适时间。gfp(绿色荧光蛋白)慢病毒与vsvg(水泡性口炎病毒)或cocal假型病毒包膜糖蛋白用于在扩增阶段(第1、4、7或14天)或nk分化阶段(第21天)的不同时间点使用2种不同的感染复数(moi)转导cd34
脐带血细胞,并在28天的nk细胞培养过程中持续。在第28天,对不同细胞群(包括cd56、cd16、cd14、cd15和cd7)进行免疫表型分析。图14显示在第1、4或7天转导后观察到更加一致的跨细胞谱系分布。
[0420]
实施例9:制备靶向人cd19表达细胞的car构建体
[0421]
制备了包含抗cd19 scfv(fmc63)、人igg4的铰链区、cd28跨膜域、4-1bb共刺激域和cd3zeta细胞内信号传导域的car构建体。所述表达构建体包括作为选择标志物的tegfr(图15)或人il-15(图16)。通常如实施例8中所述,将所述car构建体转导到hspc中。
[0422]
实施例10:制备和表征所述扩增阶段期间用il-15引发的nk细胞
[0423]
该实施例描述了在所述第一阶段扩增期添加了il-15的nk细胞制剂的生产和表征。
[0424]
第一阶段涉及造血干细胞和祖细胞的扩增。将富集cd34
的造血干细胞和祖细胞(hspc)接种到组织培养处理的塑料容器(thermo scientific nunc
tm
easyflask
tm
)中。如上所述制备富集的cd34
hspc。所述组织培养处理的塑料容器预涂有重组人纤连蛋白片段(宝生物公司;重组人纤连蛋白片段,5μg/ml和0.8μg/cm2表面积)和notch激动剂(delta1
extigg
;2.5μg/ml和0.4μg/cm2表面积)的dpbs(gibco)溶液。培养基包含适合和适用于造血细胞培养和扩增的细胞培养基(stemspan
tm
无血清扩增培养基ii(sfem ii;干细胞技术公司)),该培养基补充有rhscf(美天旎生物技术公司)、flt-3l(美天旎生物技术公司)、tpo(美天旎生物技术公司)和il-6(美天旎生物技术公司)和10ng/ml il-3(美天旎生物技术公司)各50ng/ml。细胞培养14天,适当时将细胞传代到更大体积的培养容器中以保持细胞密度《2x106个细胞/ml。通过在第7天至第14天或第10天至第14天添加40ng/ml的il-15(佩普罗泰克公司(pepro tech))来引发扩增培养物。
[0425]
所述培养过程的第二阶段将扩增的造血干细胞和祖细胞分化为nk细胞表型。在14天扩增阶段(上述第一阶段)结束时,收集所有细胞并以1000ml培养基1x106个细胞/ml的细胞密度重新接种到培养容器中(g-rex100m容器,威尔逊沃尔夫公司(wilsonwolf)),没有notch激动剂(delta1
extigg
或)涂层。所述培养基包含rpmi 1640(gibco),补充有5%人血小板裂解液(hpl;米尔溪生命科学公司)、40ng/ml rhil-15(佩普罗技术公司)和50u/ml rhil-2(佩普罗技术公司)。细胞再培养10天,用新鲜的分化培养基替换容器中50%的培养基7天进入分化阶段。
[0426]
除了cd56,所述cd56
细胞高频率表达nkp30、nkp46、nkp44和nkg2a,中频率表达cd16、nkp44和nkg2d。
[0427]
表4显示了通过该方法产生的示例性nk细胞制剂中cd56
细胞的表型属性。
[0428]
表4.cd56
细胞的表型属性
[0429][0430]
所述nk细胞制剂还包括大约26%的cd56细胞。与上述现有方法一样,这些细胞主要来源于骨髓,可以包括树突细胞、巨噬细胞和粒细胞。表5显示了通过该方法产生的示例性nk细胞制剂中cd56-细胞的表型属性。
[0431]
表5.cd56-细胞的表型属性
[0432]
cd56-细胞频率(平均值
±
标准差)cd14-cd15
6.46
±
1.26cd14
cd15
6.96
±
1.19cd14
cd15-0.55
±
0.19cd14-cd15-(细胞亚群如下)cd11b
cd11c
3.67
±
1.08hla-dr
4.06
±
0.65cd7
0.50
±
0.14cd33
1.83
±
0.81cd34
0.13
±
0.14未识别的0.61
±
0.21
[0433]
图17a和图17b显示了按照上述方法以制造规模生产的4批nk细胞制剂的结果。图17a显示了在24天培养过程(第一阶段和第二阶段)中cd56
细胞/起始cd34
细胞的增加。图17b展示了在24天细胞培养过程中cd56
细胞生成的增殖率。
[0434]
实施例11:用il-15引发产生的nk细胞制剂进行体外细胞杀伤
[0435]
在本实施例中,证实了用il-15引发产生的所述nk细胞制剂连续杀死重复剂量靶细胞的能力。在对实施例3中所述的标准体外细胞杀伤试验的修改中,连续杀伤试验在较长的时间内进行。在本实施例中,细胞杀伤试验使用kasumi-1骨髓细胞白血病细胞系(类似于aml)。新鲜nk细胞制剂(图18a)或冷冻保存和解冻的nk细胞制剂(图18b)在开始时被接种到试验中,并每24小时接受重复剂量的靶细胞,总共三天,每次攻击后24小时进行所述靶细胞的特异性细胞死亡分析。使用新鲜nk细胞制剂进行额外的试验,所述新鲜nk细胞制剂每3天接受重复剂量的靶细胞,总共10天(图18c),每次攻击后24小时进行靶细胞特异性细胞死亡分析。在每个试验期间,所述新鲜的nk细胞制剂与冷冻保存和解冻的nk细胞制剂均实现了针对重复靶标添加的剂量依赖性细胞杀伤,证明了所述nk细胞连续杀伤靶细胞至少10天的能力。
[0436]
实施例12:使用nk细胞制剂进行体内小鼠aml异种移植试验
[0437]
通过测量kasumi-1肿瘤负荷和动物存活率,在进行或未进行nk细胞制剂治疗的nsg小鼠中测试所述nk细胞制剂在kasumi-1 aml弥漫性肿瘤模型中的活性。萤火虫荧光素酶表达kasumi-1细胞在第0天静脉注射到nsg小鼠的尾静脉(2x106细胞/小鼠),然后在第2天和第6天每只小鼠静脉注射两剂2x107细胞的nk细胞制剂。每周通过生物发光成像评估肿瘤生长1至2次。与注射缓冲液的对照处理相比,所述nk细胞制剂抑制了肿瘤发展(图19,p值:*=《0.05,**=《0.01,***=《0.001)并显著延长了小鼠的中位生存期。(图20;83.5天与70天,对数秩检验p=《0.01)。
[0438]
实施例13:产生间皮素car nk细胞——扩增阶段期间的转导
[0439]
在第一阶段(所述扩增阶段)的第7天,hspc用表达间皮素靶向嵌合抗原受体(car)的慢病毒转导。使用ef1alpha启动子驱动该car的表达。该构建体还包含截短的cd19(tcd19)胞外域,由相同的启动子表达并通过t2a自切割域与所述car序列分离。将0.5ml培养基中1x106个细胞/ml接种于24孔板中,该孔板预涂有重组人纤连蛋白片段(宝生物公司;
重组人纤连蛋白片段,5μg/ml和0.8μg/cm2表面积)和notch激动剂(delta1
ext-igg
,2.5μg/ml和0.4μg/cm2表面积)的dpbs(gibco)溶液。培养基包含适合造血细胞生长和扩增的培养基(stemspan
tm
无血清扩增培养基ii(sfem ii;干细胞技术公司)),该培养基补充有人scf(美天旎生物技术公司)、flt-3配体(美天旎生物技术公司)、tpo(美天旎生物技术公司)和il-6(美天旎生物技术公司)和10ng/ml il-3(美天旎生物技术公司)各50ng/ml。使用30的感染复数(moi)将8μg/ml硫酸鱼精蛋白(密理博西格玛公司(millipore sigma))与慢病毒溶液一起添加。3小时后,将moi为30的慢病毒第二次添加到孔中。细胞在5%co2培养箱中于37℃下培养过夜。在第8天,通过稀释sfem ii培养基中细胞和上述5种生长因子将细胞传代到预涂有和delta1
ext-igg
的更大体积的容器(6-孔板)中,以保持细胞密度《2x106细胞/ml。在第14天,收集所述细胞并以1x106细胞/ml的密度重新接种到没有所述delta1
ext-igg
或涂层的组织培养容器(t25组织培养瓶)中。分化培养基包含rpmi 1640(gibco),补充有5%人血小板裂解液(hpl)(米尔溪生命科学公司)、40ng/ml rhil-15(佩普罗技术公司)和50u/ml rhil-2(佩普罗技术公司)。细胞再培养14天,在第21天用新鲜的分化培养基替换容器中50%的培养基。
[0440]
在第28天,收集所述car nk细胞制剂并通过流式细胞仪评估car表达,并在体外对两种不同的绿色荧光蛋白(gfp-)表达nomo-1aml肿瘤靶细胞进行细胞毒性试验。亲本nomo-1细胞系内源性表达car所靶向的间皮素。在同一细胞系(nomo-1
msln-/-)中制备了间皮素的敲除物。
[0441]
car表达通过流式细胞仪使用抗cd19抗体间接检测细胞表面来评估。细胞为76%cd56
和27%tcd19
(图21)。
[0442]
在体外细胞毒性试验中,通过在rpmi 10%fbs 40ng/ml il-15 50u/ml il-2中与两种nomo-1靶细胞(亲本和间皮素敲除物)的每一种共培养,car转导nk细胞和模拟转导对照nk细胞作为效应细胞进行测试。e:t比在0.3到20之间,试验进行24小时。在培育结束时,用dapi溶液标记细胞,并通过流式细胞仪分析靶细胞的gfp荧光和死细胞的dapi荧光,以确定特异性细胞死亡百分比。
[0443]
结果表明,与所述nomo-1
msln-/-细胞相比,间皮素car-nk细胞表现出,对亲本nomo-1细胞杀伤显著且特异性增加(高达55%)。用对照nk细胞针对任一nomo-1细胞系观察到类似的低水平杀伤(图22)。
[0444]
实施例14:产生间皮素car nk细胞——nk细胞分化后的转导
[0445]
在本实施例中,cd34
富集的非免疫匹配的细胞池通过第一阶段(扩增)和第二阶段(分化)进行了如上处理。在完全分化后,用car构建体转导所述nk细胞。
[0446]
具体是,在所述分化阶段期间,第二阶段的第23天,使用基于免疫磁性微珠的柱分离方案(cd56微珠,人类,美天旎生物技术公司)从大量细胞富集人cd56
nk细胞。用实施例12中描述的相同慢病毒转导富集的nk细胞(》96%cd56
)。将2ml分化培养基中1x106细胞/ml与8μg/ml硫酸鱼精蛋白和慢病毒一起接种在6-孔板中,moi为40。细胞在5%co2培养箱中于37℃下培养过夜。在第24天,一半的培养基体积被新鲜培养基替换。
[0447]
在第27天,收集nk细胞制剂并通过流式细胞仪,在针对实施例13中描述的亲本nomo-1和nomo-1
msln-/-靶细胞进行体外细胞毒性试验中评估car表达。car表达通过流式细胞仪使用抗cd19抗体间接检测细胞表面来评估。细胞是》99%cd56
和40%tcd19
(图23)。
[0448]
在体外细胞毒性试验中,通过在rpmi 10%fbs 40ng/ml il-15 50u/ml il-2中与两种nomo-1靶细胞(亲本和间皮素敲除物)的每一种共培养,将car转导的nk细胞和模拟转导的对照nk细胞作为效应细胞测试。e:t比在0.3到10之间,试验进行24小时。在培育结束时,用dapi标记细胞并通过流式细胞仪分析靶细胞的gfp荧光和死细胞的dapi荧光,以确定特异性细胞死亡百分比。
[0449]
结果表明,与所述nomo-1
msln-/-靶细胞相比,间皮素car-nk细胞表现出,对亲本nomo-1靶细胞杀伤显著且特异性增强(高达27%)。用对照nk细胞针对任一nomo-1靶细胞系观察到类似的低水平杀伤(图24)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
