1.本发明涉及外泌体的分离和检测方法、以及分离和检测试剂盒。
背景技术:
2.已知细胞将被称为外泌体的、在其内部包含蛋白质、核酸、脂质、糖等各种细胞内容物的、由脂双层膜形成的小泡释放到细胞外。外泌体作为成为用于知晓生物体病况的重要线索的物质而被关注,在以癌为代表的各种疾病中的研究盛行。
3.另一方面,波形蛋白为对于细胞质形成而言重要的蛋白质之一,作为细胞内的上皮间质转化(emt)的标志物是已知的。明确了在癌细胞中波形蛋白过表达,其表达量与癌的进展具有相关。在特定的环境下波形蛋白移动到细胞表面。该移动到细胞表面的波形蛋白被称为细胞表面波形蛋白(csv)。
4.明确了csv参与自身免疫障碍、病毒感染、癌,由于在活化巨噬细胞、血小板、发生了凋亡的t淋巴细胞中csv表达,因此csv与炎症性疾病有关。最近,报导了将抗csv抗体、与针对作为癌肿瘤的诊断标志物已知的上皮细胞黏附分子(epcam、cd326)的抗体组合,来检测外周血循环肿瘤细胞(ctc)的方法(例如,参照非专利文献1)。
5.现有技术文献
6.非专利文献
7.非专利文献1:satelli a et al,“circulating tumor cell enumeration using a combination of epcam and cell-surface vimentin based methods for monitoring breast cancer therapeutic response.”,clin chem.,vo.61,issue 1,pp.259-266,2015.
技术实现要素:
8.发明所要解决的课题
9.然而,ctc在血液中仅存在极少量,以癌诊断或伴随诊断作为目的的ctc的抗原标志物的检测是困难的。
10.本发明是鉴于上述情况而提出的,其提供能够在癌诊断或伴随诊断中利用的分离和检测外泌体的方法、以及在该方法中使用的试剂盒。
11.用于解决课题的手段
12.即,本发明包含以下方案。
13.(1)一种外泌体的分离和检测方法,包括下述工序:
14.复合体形成工序,使生物体试样、与包含针对在癌细胞表面表达的抗原的特异性结合物质的捕获用分子接触,形成外泌体与上述捕获用分子的复合体;以及
15.检测工序,使上述复合体、与包含针对在癌细胞表面表达的抗原的特异性结合物质和标记物质的检测用分子接触,将上述复合体用上述检测用分子进行检测,
16.上述捕获用分子和上述检测用分子中的至少任一方的分子中,上述在癌细胞表面
表达的抗原是csv。
17.(2)根据(1)所述的方法,对上述csv的特异性结合物质是抗csv抗体。
18.(3)根据(1)或(2)所述的方法,上述捕获用分子中的针对在癌细胞表面表达的抗原的特异性结合物质是抗csv抗体,上述检测用分子中的针对在癌细胞表面表达的抗原的特异性结合物质是抗csv抗体、抗epcam抗体或抗pd-l1抗体。
19.(4)根据(1)或(2)所述的方法,上述检测用分子中的针对在癌细胞表面表达的抗原的特异性结合物质是抗csv抗体,上述捕获用分子中的针对在癌细胞表面表达的抗原的特异性结合物质是抗csv抗体、抗epcam抗体或抗pd-l1抗体。
20.(5)根据(1)~(4)中任一项所述的方法,上述捕获用分子被固定于磁性粒子。
21.(6)根据(1)~(5)中任一项所述的方法,在上述复合体形成工序之后、并且上述检测工序之前,进一步包括下述洗涤工序:
22.添加洗涤液,将除上述复合体以外的杂质除去。
23.(7)根据(1)~(6)中任一项所述的方法,在上述检测工序中,使上述复合体、与上述检测用分子接触,接着,添加洗涤液,将除上述检测用分子结合了的上述复合体以外的杂质除去后,将上述复合体用上述检测用分子进行检测。
24.(8)一种外泌体的分离和检测试剂盒,其具备:
25.包含针对在癌细胞表面表达的抗原的特异性结合物质的捕获用分子;以及
26.包含针对在癌细胞表面表达的抗原的特异性结合物质和标记物质的检测用分子,
27.上述捕获用分子和上述检测用分子中的至少任一方的分子中,上述在癌细胞表面表达的抗原是csv。
28.(9)根据(8)所述的试剂盒,对上述在细胞表面表达的抗原的特异性结合物质是抗csv抗体。
29.(10)根据(8)或(9)所述的试剂盒,上述捕获用分子中的针对在癌细胞表面表达的抗原的特异性结合物质是抗csv抗体,上述检测用分子中的针对在癌细胞表面表达的抗原的特异性结合物质是抗csv抗体、抗epcam抗体或抗pd-l1抗体。
30.(11)根据(8)或(9)所述的试剂盒,上述检测用分子中的针对在癌细胞表面表达的抗原的特异性结合物质是抗csv抗体,上述捕获用分子中的针对在癌细胞表面表达的抗原的特异性结合物质是抗csv抗体、抗epcam抗体或抗pd-l1抗体。
31.(12)根据(8)~(11)中任一项所述的试剂盒,上述捕获用分子被固定于磁性粒子。
32.(13)根据(8)~(12)中任一项所述的试剂盒,其为癌的诊断用。
33.(14)根据(8)~(13)中任一项所述的试剂盒,其为早期癌的诊断用。
34.(15)根据(8)~(14)中任一项所述的试剂盒,其为肺癌的诊断用。
35.(16)根据(8)~(12)中任一项所述的试剂盒,其为伴随诊断用。
36.发明的效果
37.根据上述方案的外泌体的分离和检测方法、以及分离和检测试剂盒,能够分离和检测外泌体,能够在癌诊断或伴随诊断中利用。
附图说明
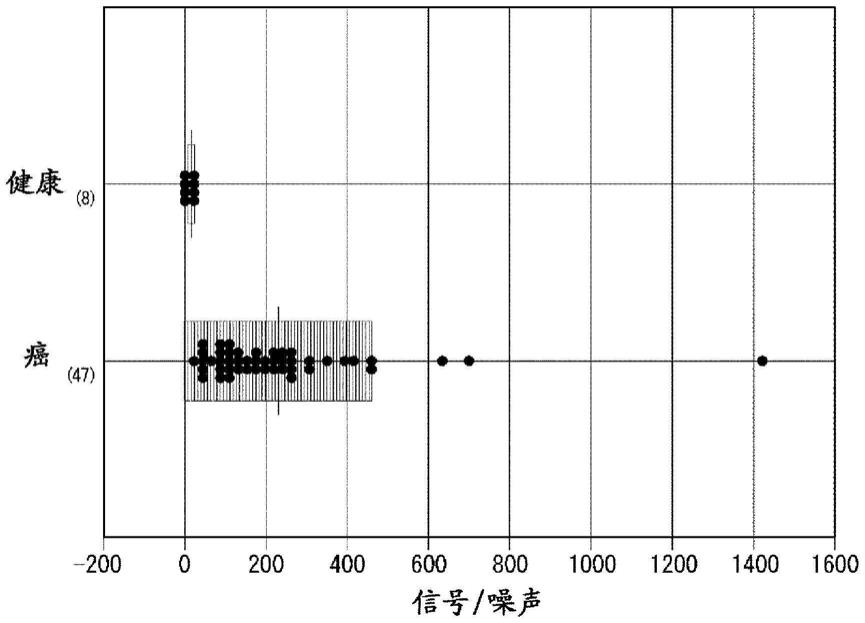
38.图1为显示分析例1中的肺癌患者样本或健康者样本中的csv阳性外泌体的测定结
果的图。图中,()内的数值表示病例数。
39.图2为显示根据图1所示的测定结果制成的roc曲线的图。
40.图3为显示分析例2中的肺癌患者样本或健康者样本中的csv和epcam阳性外泌体的测定结果的图。图中,()内的数值表示病例数。
41.图4为显示根据图3所示的测定结果制成的roc曲线的图。
42.图5为显示分析例3中的肺癌患者样本或健康者样本中的csv和pd-l1阳性外泌体的测定结果的图。图中,()内的数值表示病例数。
43.图6为显示根据图5所示的测定结果制成的roc曲线的图。
44.图7a为将图1所示的测定结果以肺癌的种类进行了分类的图。图中,()内的数值表示病例数。
45.图7b为将图3所示的测定结果以肺癌的种类进行了分类的图。图中,()内的数值表示病例数。其中,ad组的(12000)表示信号/噪声值。
46.图7c为将图5所示的测定结果以肺癌的种类进行了分类的图。图中,()内的数值表示病例数。
47.图8a为将图1所示的测定结果以肺癌的病理病期进行了分类的图。图中,()内的数值表示病例数。
48.图8b为将图3所示的测定结果以肺癌的病理病期进行了分类的图。图中,()内的数值表示病例数。其中,iii组的(12000)表示信号/噪声值。
49.图8c为将图5所示的测定结果以肺癌的病理病期进行了分类的图。图中,()内的数值表示病例数。
50.图9a为将图1所示的测定结果以腺癌或鳞状细胞癌的病理病期进行了分类的图。图中,()内的数值表示病例数。
51.图9b为将图3所示的测定结果以腺癌或鳞状细胞癌的病理病期进行了分类的图。图中,()内的数值表示病例数。其中,腺癌iii组的(12000)表示信号/噪声值。
52.图9c为将图5所示的测定结果以腺癌或鳞状细胞癌的病理病期进行了分类的图。图中,()内的数值表示病例数。
53.图10为显示实施例4中的肺癌患者样本或健康者样本中的csv阳性外泌体、csv和epcam阳性外泌体、以及csv和gpc3阳性外泌体的测定结果的图。
54.图11为显示实施例5中的csv/pd-l1评价体系和pd-l1/csv评价体系中的csv和pd-l1阳性外泌体的测定结果的图。
具体实施方式
55.以下,显示实施方式进一步详细地说明本发明,但本发明不受以下实施方式任何限定。
56.<外泌体的分离和检测方法>
57.在一实施方式中,本发明提供包含复合体形成工序、和检测工序的外泌体的分离和检测方法。
58.在复合体形成工序中,使生物体试样、与包含针对在癌细胞表面表达的抗原的特异性结合物质的捕获用分子接触,形成外泌体与上述捕获用分子的复合体。
59.在检测工序中,使上述复合体、与包含针对在癌细胞表面表达的抗原的特异性结合物质和标记物质的检测用分子接触,将上述复合体用上述检测用分子进行检测。
60.上述捕获用分子和上述检测用分子中的至少任一方的分子中,在癌细胞表面表达的抗原是细胞表面波形蛋白(csv)。
61.发明者们发现csv主要在从癌细胞释放的外泌体的表面表达,从而完成了本发明。
62.在以往的ctc的抗原标志物的检测法中,由于在血液10ml中仅包含1个以上且10个以下左右的ctc,因此检测需要大量的血液试样,以癌诊断作为目的而检测ctc的抗原标志物是困难的。特别是,在癌诊断和伴随诊断中,要求诊断的迅速性、准确性,但ctc的抗原标志物的检测不能满足该需求。
63.与此相对,在本发明的一实施方式涉及的外泌体的分离和检测方法(以下,有时仅简写为“本实施方式的分离和检测方法”)中,外泌体由于在血液数十μl左右的试样中包含对于测定而言充分的量,因此作为癌诊断或伴随诊断的检测对象是适合的。此外,通过将存在于1个外泌体的抗原标志物之中的csv与已知的癌抗原标志物组合而作为靶标,可以将从癌细胞释放的外泌体特异性地分离。由此,可以提高癌诊断的准确度。进一步,通过作为与csv组合的已知的癌抗原标志物选择成为治疗药的靶标的癌抗原,从而可以进行伴随诊断。
64.接着,对本实施方式的分离和检测方法的各工序详细说明。
65.[复合体形成工序]
[0066]
在复合体形成工序中,使生物体试样、与包含针对在癌细胞表面表达的抗原的特异性结合物质的捕获用分子接触。通过该接触,形成外泌体与上述捕获用分子的复合体。
[0067]
作为生物体试样,可举出例如,体液、细胞培养上清液、组织细胞的破碎液等各种液体。其中,优选为体液、或细胞培养上清液。作为体液,可举出全血、血清、血浆、各种血细胞、血块、血小板等、以及尿、精液、母乳、汗、间质液、间质性淋巴液、骨髓液、组织液、唾液、胃液、关节液、胸腔积液、胆汁、腹水、羊水等。其中,优选为血浆。另外,血浆可以是通过柠檬酸、肝素、edta等抗凝剂进行了处理的。
[0068]
生物体试样所来源的种类没有特别限定,可举出人、小鼠、大鼠、兔、犬、猪、绵羊、牛、马、骆驼、猴等。它们之中,优选为来源于人的试样。此外,作为种与体液的组合,优选为来源于人的血浆。
[0069]
上述生物体试样可以使用预先添加于公知的缓冲液等而预先进行了前处理的,但也可以直接使用从生物体摄取的。即,根据本实施方式的分离和检测方法,可以不进行通过peg沉淀法、使用了超离心机等的分析法等进行的前处理,而简便地进行外泌体的选择性分离。
[0070]
生物体试样的量可以适当调整,例如,可以为1μl以上且50μl以下,例如,可以为1μl以上且20μl以下。
[0071]
在复合体形成工序中使用的捕获用分子包含针对在癌细胞表面表达的抗原的特异性结合物质。从癌细胞释放的外泌体由于在其表面具有在癌细胞表面表达的抗原,因此通过使用对该抗原的特异性结合物质,可以捕获从癌细胞释放的外泌体。
[0072]
作为在癌细胞表面表达的抗原,是指已知与正常细胞相比在癌细胞中高表达的抗原、或已知仅在癌细胞中特异性地表达的抗原。作为这样的抗原,可举出例如,细胞表面波形蛋白(csv)、上皮细胞黏附分子(epcam、cd326)、程序性细胞死亡配体-1(pd-l1)、磷脂酰
肌醇蛋白聚糖-3(gpc3)、磷脂酰肌醇蛋白聚糖-1(gpc1)、癌胚抗原(cea)、cd4、cd5、cd16、cd19、cd20、cd22、cd30、cd33、cd38、cd44、cd52、cd123、cd171、癌抗原125、密封蛋白18、受体型酪氨酸激酶ror1、唾液酸le
x-i(slx)、唾液酸路易斯抗原a(ca19-9)、免疫共刺激蛋白质b7同源物6(b7h6)、细胞表面糖蛋白(cs-1)、受体型酪氨酸激酶3(flt3)、前列腺特异性膜抗原(psma)、b细胞成熟抗原(bcma)、维尔姆斯瘤1(wt1)、ny-eso-1、陷窝蛋白-1、fas配体(fasl)、tnf相关凋亡诱导配体(trail)、galectine3、cd151、四次跨膜蛋白8、表皮生长因子受体(egfr)、her2、核糖体结合蛋白2(rpn2)、cd44、tgf-β,但不限定于此。
[0073]
人的上述各种在癌细胞表面表达的抗原的碱基序列和氨基酸序列的信息可以从genbank等数据库获得。人csv(作为波形蛋白)的氨基酸序列例如作为genbank的登记号np_003371.2而被公开。人epcam的氨基酸序列例如作为genbank的登记号np_002345.2而被公开。人pd-l1的氨基酸序列例如作为genbank的登记号np_054862.1而被公开。人gpc3的氨基酸序列例如作为genbank的登记号np_001158089.1而被公开。
[0074]
捕获用分子包含对上述抗原的特异性结合物质。
[0075]
作为特异性结合物质,可举出例如,与抗原特异性地结合的物质。作为与抗原特异性地结合的物质,可举出例如,抗体、适配体等。
[0076]
作为抗体,只要具有对癌细胞上的抗原序列(表位)的结合能力即可,具体而言,可举出例如,抗csv抗体、抗epcam抗体、抗pd-l1抗体、抗gpc3抗体。这些抗体可以为单克隆抗体,也可以为多克隆抗体,但优选为单克隆抗体。进一步,这些抗体可以为双特异性抗体。作为抗体的种类,可举出例如,igg、igm,但更优选为igg。此外,抗体可以为人源化抗体等嵌合抗体。抗体可以为例如来源于小鼠、兔、牛、猪、马、绵羊、山羊等哺乳动物、鸡等鸟类、人等动物种的抗体,没有特别限制。抗体例如可以从来源于上述动物种的血清通过以往公知的方法来制备,也可以从使用公知的抗体基因序列信息而合成的载体制备抗体,也可以使用市售的抗体。作为市售的抗csv单克隆抗体,可举出abnova社制的小鼠抗人csv单克隆抗体(同种型:igg2b,κ)等。
[0077]
此外,作为抗体,也可以使用抗体片段。作为抗体片段,可举出例如,fv、fab、fab’、f(ab’)2、rigg、scfv等。
[0078]
所谓适配体,是具有针对靶标物质的特异性结合能力的物质。作为适配体,可举出核酸适配体、肽适配体等。与抗原具有特异性结合能力的核酸适配体例如可以通过systematic evolution of ligand by exponential enrichment(指数富集的配体系统进化技术)(selex)法来挑选。此外,与抗原具有特异性结合能力的肽适配体例如可以通过使用了酵母的two-hybrid(双杂交)法来挑选。
[0079]
此外,在抗原是csv的情况下,也可以使用已知具有对csv的结合能力的nkp46蛋白质等作为特异性结合物质。
[0080]
捕获用分子优选被固定于固相载体。
[0081]
作为固相载体的材质,可举出例如,聚苯乙烯类、聚乙烯类、聚丙烯类、聚酯类、聚(甲基)丙烯腈类、苯乙烯-丁二烯共聚物、聚(甲基)丙烯酸酯类、氟树脂、交联葡聚糖、多糖等高分子化合物;玻璃;金属;磁性体;包含磁性体的树脂组合物;它们的组合。
[0082]
此外,固相载体的形状没有特别限定,可举出例如,托盘状、球状、粒子状、纤维状、棒状、盘状、容器状、微流路。
[0083]
在本工序中,从固液分离、洗涤的容易性的观点考虑,优选使用磁性粒子作为固相载体。
[0084]
作为上述磁性粒子,可举出例如,由四三氧化铁(fe3o4)、三氧化二铁(γ-fe2o3)、各种铁氧体、铁、锰、镍、钴、铬等金属形成的磁性体微粒,和由这些金属的合金形成的磁性体微粒,以及树脂中包含这些磁性体微粒的磁性粒子。作为树脂,可举出例如,疏水性聚合物、亲水性聚合物等。
[0085]
其中,优选为树脂中包含磁性体的磁性粒子,更优选为在包含超顺磁性微粒的母粒子的表面形成了聚合物层的磁性粒子。可举出例如,日本特开2008-32411号公报(参考文献1)所记载的、在包含超顺磁性微粒的母粒子的表面形成了疏水性的第1聚合物层、在该第1聚合物层上形成了至少表面具有缩水甘油基的第2聚合物层、通过将该缩水甘油基进行化学修饰而导入了极性基的磁性粒子。
[0086]
这里,作为超顺磁性微粒,粒径20nm以下(优选为粒径5nm以上且20nm以下)的氧化铁系的微粒是代表性的,可举出以xfe2o4(x=mn、co、ni、mg、cu、li
0.5
fe
0.5
等)表示的铁氧体、以fe3o4表示的磁铁矿、γ-fe2o3,从饱和磁化强、并且剩余磁化少方面考虑,优选包含γ-fe2o3和fe3o4中的任一者。
[0087]
此外,用于形成上述疏水性的第1聚合物层的单体大致区分为单官能性单体、交联性单体。
[0088]
作为上述单官能性单体,可举出例如,苯乙烯、α-甲基苯乙烯、卤代苯乙烯等芳香族乙烯基系单体;丙烯酸甲酯、甲基丙烯酸甲酯、丙烯酸乙酯、甲基丙烯酸乙酯、丙烯酸硬脂基酯、甲基丙烯酸硬脂基酯、丙烯酸环己酯、甲基丙烯酸环己酯、丙烯酸异冰片基酯、甲基丙烯酸异冰片基酯等烯属不饱和羧酸烷基酯系单体。
[0089]
此外,作为上述交联性单体,可举出例如,乙二醇二丙烯酸酯、乙二醇二甲基丙烯酸酯、三羟甲基丙烷三丙烯酸酯、三羟甲基丙烷三甲基丙烯酸酯、季戊四醇三丙烯酸酯、季戊四醇三甲基丙烯酸酯、二季戊四醇六丙烯酸酯、二季戊四醇六甲基丙烯酸酯等多官能性(甲基)丙烯酸酯;丁二烯、异戊二烯等共轭二烯烃、以及二乙烯基苯、邻苯二甲酸二烯丙酯、丙烯酸烯丙酯、甲基丙烯酸烯丙酯。
[0090]
此外,用于形成上述第2聚合物层的单体以向粒子表面导入官能团作为主要目的,包含含有缩水甘油基的单体。作为含有缩水甘油基的单体的含量,在用于形成第2聚合物层的单体中,优选为20质量%以上。这里,作为包含缩水甘油基的共聚性单体,可举出丙烯酸缩水甘油酯、甲基丙烯酸缩水甘油酯、烯丙基缩水甘油基醚等。
[0091]
作为通过将第2聚合物层的缩水甘油基进行化学修饰而导入的极性基,优选为能够与针对在癌细胞表面表达的抗原的特异性结合物质反应的官能团,更优选为包含1个以上选自氧原子、氮原子和硫原子中的至少1种原子的基团。其中,更优选为氨基、醛基、羧基、或活性酯基。特别是,在磁性粒子的第2聚合物层具有上述极性基和2,3-二羟基丙基的情况下,与针对在癌细胞表面表达的抗原的特异性结合物质(特别是,针对在癌细胞表面表达的抗原的抗体)的结合性变得良好。
[0092]
作为将针对在癌细胞表面表达的抗原的特异性结合物质与固相载体结合的方法,使用物理吸附法,共价键合法、离子键合法这样的化学结合的方法等。作为物理吸附法,可举出在固相载体直接固定针对在癌细胞表面表达的抗原的特异性结合物质的方法、与白蛋
白等其它蛋白质化学结合后进行吸附而固定的方法等。作为进行化学结合的方法,可举出:利用导入到固相载体表面的、能够与针对在癌细胞表面表达的抗原的特异性结合物质反应的官能团,在固相载体上直接结合的方法;在固相载体与针对在癌细胞表面表达的抗原的特异性结合物质之间通过化学结合而导入间隔物分子(碳二亚胺化合物等)后结合的方法;使针对在癌细胞表面表达的抗原的特异性结合物质与白蛋白等其它蛋白质结合后,将该蛋白质与固相载体化学结合的方法等。
[0093]
复合体形成工序除了上述各成分以外,可以根据需要使用盐类、白蛋白等蛋白质、表面活性剂等而进行。
[0094]
复合体形成工序中的反应温度通常为2℃以上且42℃以下的范围内,反应时间通常为5分钟以上且24小时以下。在2℃以上且8℃以下进行反应的情况下,反应时间优选为8小时以上且30小时以下,在室温(20℃)以上且42℃以下进行反应的情况下,反应时间优选为5分钟以上且4小时以下。
[0095]
在复合体形成工序中,体系中的ph没有特别限定,但优选为ph5以上且10以下的范围,更优选为ph6以上且8以下的范围。为了维持目标的ph,通常使用缓冲液,可举出例如,磷酸缓冲液、三(羟基甲基)氨基甲烷缓冲液、hepes缓冲液、mes缓冲液。
[0096]
[检测工序]
[0097]
在检测工序中,使上述复合体、与包含针对在癌细胞表面表达的抗原的特异性结合物质和标记物质的检测用分子接触。通过该接触,使上述检测用分子与上述复合体中的外泌体结合,将上述复合体用上述检测用分子进行检测。
[0098]
检测用分子包含针对在癌细胞表面表达的抗原的特异性结合物质和标记物质。其中,检测用分子优选包含结合有标记物质的针对在癌细胞表面表达的抗原的特异性结合物质。
[0099]
作为针对在癌细胞表面表达的抗原的特异性结合物质,可举出与在上述“捕获用分子”中例示的物质同样的物质。捕获用分子所具有的特异性结合物质、与检测用分子所具有的特异性结合物质可以相同,也可以不同。在捕获用分子所具有的特异性结合物质、与检测用分子所具有的特异性结合物质相同的情况下,该特异性结合物质是针对csv的特异性结合物质,优选为抗csv抗体。
[0100]
此外,在捕获用分子所具有的特异性结合物质或检测用分子所具有的特异性结合物质为抗体的情况下,它们也可以使用由双特异性抗体形成的抗体,或者,也可以使用抗原不同的多个抗体的混合物。
[0101]
此外,优选上述捕获用分子所具有的特异性结合物质是抗csv抗体,上述检测用分子所具有的特异性结合物质是抗csv抗体、抗epcam抗体或抗pd-l1抗体。
[0102]
此外,也优选上述检测用分子所具有的特异性结合物质是抗csv抗体,上述捕获用分子所具有的特异性结合物质是抗csv抗体、抗epcam抗体或抗pd-l1抗体。
[0103]
通过捕获用分子所具有的特异性结合物质、与检测用分子所具有的特异性结合物质为上述组合,从而如后述实施例所示那样,可以将外泌体以高准确度进行检测。
[0104]
作为标记物质,可举出例如,生物素、抗生物素蛋白、链霉亲和素、中性亲和素(neutravidin)、谷胱甘肽-s-转移酶、谷胱甘肽、碱性磷酸酶(alp)、荧光色素、聚乙二醇、苯六甲酸等电荷分子等。在标记物质为alp的情况下,通过添加alp发光底物,从而可以将外泌
体以高准确度进行检测。作为alp发光底物,可举出例如,对硝基苯基磷酸(pnp)、4-甲基伞形酮基磷酸(4mup)、3-(2
’‑
螺金刚烷)4-甲氧基-4-(3
”‑
磷酰氧基)苯基-1,2-二氧杂环丁烷(amppd)、3-(4-甲氧基螺{1,2-二氧杂环丁烷-3,2
’‑
(5
’‑
氯)三环[3.3.1.1
3,7
]癸烷}-4-基)苯基磷酸酯二钠(cspd)、2-氯-5-(4-甲氧基螺{1,2-二氧杂环丁烷-3,2
’‑
(5
’‑
氯)-三环[3.3.1.1
3,7
]癸烷}-4-基)-1-苯基磷酸酯
·
二钠(cdp-star)。
[0105]
检测工序中的检测方法只要通过免疫测定法进行即可,可举出例如,酶免疫测定法(eia)、elisa、化学发光酶免疫测定法(cleia)、荧光免疫测定法(fia)、放射线免疫测定法(ria)、发光免疫测定法、免疫印迹法、蛋白质印迹法,在特异性结合物质为抗体的情况下,从可以简便且灵敏度好地检测抗体的方面考虑,优选为cleia法或elisa法。作为elisa法,可举出竞争法、夹心法等。
[0106]
显示使用cleia法的情况下的分离和检测方法的一例。首先,在将针对在癌细胞表面表达的抗原的抗体与固相载体结合而使捕获用分子固定后,使生物体试样接触而使复合体形成。在其中添加包含结合了标记物质的针对在癌细胞表面表达的抗原的抗体的检测用分子,形成进一步的复合体。进而,通过检测所形成的复合体中的标记量,从而可以测定来源于生物体试样所包含的外泌体的信号。
[0107]
本实施方式的分离和检测方法除了上述复合体形成工序和上述检测工序以外,还可以具备其它工序。
[0108]
例如,在上述复合体形成工序之后、并且上述检测工序之前,可以具备洗涤工序。
[0109]
在洗涤工序中,将在上述复合体形成工序中形成的外泌体与捕获用分子的复合体进行洗涤。由此,除去未反应的成分等杂质。
[0110]
上述洗涤工序通常根据作为捕获用分子的构成成分的固相载体的形状而具有不同的方法。如磁性粒子那样在固相载体为粒子状的情况下,可举出例如在洗涤液中使磁性粒子分散而洗涤的方法,或在集磁的状态下通过浸渍而洗涤的方法。另一方面,在固相载体为微孔板那样的形态的情况下,可举出对板重复进行洗涤液的分注和吸引而洗涤的方法。
[0111]
此外,在固相载体为磁性粒子的情况下,作为洗涤工序,优选包含:将磁性粒子通过磁力进行集中而将磁性粒子与液相分离的集磁工序;以及使在该集磁工序中被分离了的磁性粒子分散在洗涤液中的分散工序。由此,可以将未反应的物质、试样中的杂质从磁性粒子表面效率更好地洗涤和分离除去。
[0112]
具体而言,只要通过使磁场作用于反应容器,使磁性粒子附着于反应容器壁而收集后,将反应上清液除去,进一步根据需要加入洗涤液,同样地使磁场作用后将上清液除去,重复该操作从而进行即可。
[0113]
作为洗涤液,优选为包含表面活性剂和在上述复合体形成工序中举出的缓冲液的洗涤液。洗涤液的ph优选为ph5以上且10以下的范围,更优选为ph6以上且8以下的范围。具体而言,可举出相对于溶液的总质量包含0.1质量%的tween20的tris缓冲盐水(tbs)等。
[0114]
此外,在上述检测工序中,也可以在使上述复合体、与包含针对在癌细胞表面表达的抗原的特异性结合物质和标记物质的检测用分子接触后,添加洗涤液,将结合了上述检测用分子的上述复合体进行洗涤。由此,可以将未反应的物质、试样中的杂质除去,可以将上述复合体用上述检测用分子以更高灵敏度进行检测。
[0115]
此外,在本实施方式的分离和检测方法中,如后述实施例所示那样,可以通过使用
2种以上捕获用分子和检测用分子的组合,同时实施各工序,来更提高外泌体的检测灵敏度。
[0116]
<外泌体的分离和检测试剂盒>
[0117]
本发明的一实施方式涉及的外泌体的分离和检测试剂盒(以下,有时仅简写为“本实施方式的分离和检测试剂盒”)具备捕获用分子、和检测用分子。捕获用分子包含针对在癌细胞表面表达的抗原的特异性结合物质。检测用分子包含针对在癌细胞表面表达的抗原的特异性结合物质和标记物质。上述捕获用分子和上述检测用分子中的至少任一方的分子中,在癌细胞表面表达的抗原是csv。
[0118]
作为捕获用分子和检测用分子,与上述“外泌体的分离和检测方法”中例示的同样。
[0119]
本实施方式的分离和检测试剂盒除了捕获用分子、和检测用分子以外,可以进一步具备洗涤液。作为洗涤液,与上述“外泌体的分离和检测方法”中例示的同样。
[0120]
<使用用途>
[0121]
本实施方式的分离和检测方法、以及分离和检测试剂盒适合用于癌的诊断、特别是早期癌的诊断。即,在一实施方式中,本发明提供癌的判定方法,包括下述判定工序:将使用从受检者采集的生物体试样通过上述分离和检测方法检测到的外泌体来源的信号、与从对照者采集的生物体试样中的成为背景的外泌体来源的信号进行对比,在受检者试样中的外泌体来源的信号与对照者试样中的外泌体来源的信号(背景)相比强的情况下,判定为受检者患有癌。
[0122]
此外,上述分离和检测试剂盒可以换言作癌的诊断用试剂盒。
[0123]
作为成为诊断对象的癌,可举出大肠癌、乳癌、子宫内膜癌、宫颈癌、卵巢癌、胰癌、胃癌、食道癌、肝癌、肺癌、肾癌、皮肤癌等,但其中优选为肺癌。
[0124]
在判定工序中,关于通过上述检测工序而测定的受检者试样中的外泌体来源的信号,基于对照者试样中的外泌体来源的信号进行统计学分析,进行比较,从而可以判定受检者是否患有癌。例如,在受检者试样中的外泌体来源的信号与对照者试样中的外泌体来源的信号相比强的情况下,判断为患有癌的可能性高。另外,判定工序中的对照者为与受检者同年龄段和同性别且未患癌的人的平均,对照者中的外泌体来源的信号可以与受检者中的外泌体来源的信号一起测定,也可以使用由另行预先测定的值获得的统计值。
[0125]
此外,本实施方式的分离和检测方法、以及分离和检测试剂盒在用于选定癌治疗药的伴随诊断中适合使用。即,在一实施方式中,本发明提供癌治疗药的选定方法,包括下述选定工序:将使用从受检者采集的生物体试样通过上述分离和检测方法而检测到的特定的癌抗原是阳性的外泌体来源的信号、与从对照者采集的生物体试样中的特定的癌抗原是阳性的外泌体来源的信号进行对比,在受检者中的特定的癌抗原是阳性的外泌体来源的信号与对照者中的特定的癌抗原是阳性的外泌体来源的信号为同等程度、或与对照者中的特定的癌抗原是阳性的外泌体来源的信号相比强的情况下,选定以该特定的癌抗原作为分子靶标的癌治疗药作为用于受检者的癌治疗药。
[0126]
此外,上述分离和检测试剂盒可以换言作癌治疗药的伴随诊断用试剂盒。
[0127]
在选定工序中,关于在上述检测工序中测定的受检者试样中的外泌体来源的信号,基于对照者试样中的外泌体来源的信号进行统计学分析,进行比较,从而可以选定用于
受检者的癌治疗药。例如,在受检者试样中的特定的癌抗原是阳性的外泌体来源的信号与对照者试样中的该癌抗原是阳性的外泌体来源的信号相比为同等程度或高的情况下,可以选定将以该癌抗原作为分子靶标的癌治疗药作为受检者所使用的癌治疗药。另外,选定工序中的对照者为与受检者同年龄段和同性别的人,并且为通过成为候选的癌治疗药而获得了治疗效果的癌患者的平均,对照者中的特定的癌抗原是阳性的外泌体来源的信号可以使用由在对照者中在给药前测定的值获得的统计值。
[0128]
此外,外泌体由于从各种细胞例如免疫系统的细胞、各种癌细胞被分泌,因此通过测定癌治疗药的施与前后的血中外泌体的变化(除了仅存在量的增减以外,还包含膜蛋白质的量的变动),从而可以评价患者中的药效。即,在一实施方式中,本发明提供癌治疗药的药效评价方法,包括下述评价工序:对于使用从癌治疗药的施与前和施与后的受检者采集的生物体试样通过上述分离和检测方法检测到的外泌体来源的信号,在从癌治疗药的施与后的受检者采集的生物体试样中的外泌体来源的信号与从癌治疗药的施与前的受检者采集的生物体试样中的外泌体来源的信号相比低的情况下,评价为癌治疗药显示药效的可能性高。
[0129]
在评价工序中,对于通过上述分离和检测方法检测到的外泌体来源的信号,基于从癌治疗药的施与前的受检者采集的生物体试样中的外泌体来源的信号进行统计学分析,进行比较。分析方法没有特别限定,可以使用公知的方法。此外,关于之后的判定,例如,在从癌治疗药的施与后的受检者采集的生物体试样中的外泌体来源的信号与从施与前的受检者采集的生物体试样中的外泌体来源的信号相比低的情况下,可以评价为该癌治疗药具有抑制癌的效果的可能性高。
[0130]
实施例
[0131]
以下,举出实施例详细地说明本发明,但本发明不限定于这些实施例。
[0132]
<样品的制备>
[0133]
[肝素血浆样本的制备]
[0134]
从健康者或肺癌患者采血到加有肝素钠的采血管中,进行室温、1500~1800
×
g、15分钟离心,将上清液回收到其它容器中,作为肝素血浆样本。直到使用时为止在-80℃下保存。
[0135]
<外泌体的测定方法>
[0136]
后述实施例和比较例中的外泌体的测定通过化学发光酶免疫测定法(cleia法)测定发光强度来进行。以下对各实施例中的测定方法详细说明。
[0137]
[测定方法a]
[0138]
(csv/csv评价体系中的采用cleia法的发光强度测定)
[0139]
预先将肝素血浆样本各自适当用含有2%(w/v)bsa和150mm nacl的50mm tris缓冲液稀释,制成试样溶液。在96孔白色微孔板(
コーニング
社制)中,添加结合了抗csv抗体(目录号:h00007431-m08,abnova社制)的0.05%(w/v)的抗体结合磁性粒子(由jsr社在magnosphere ms300/carboxyl(编号:msp-s300-ca,jsr
ライフサイエンス
社制)中将抗体敏化)分散液25μl/孔,接着,添加了试样溶液25μl/孔。进一步,添加了含有碱性磷酸酶标记抗csv抗体(由jsr社将目录号:h00007431-m08、abnova社制标记)的溶液25μl/孔。然后,将96孔白色微孔板在25℃下搅拌20分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレ
ックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。进一步添加tbs 50μl,在25℃下搅拌5分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。接着,添加发光底物(lsi社制,底物液(r5),cdp-star)50μl,在5分钟后使用发光测定机(promega社制glomax(注册商标)discover system)测定了发光强度。
[0140]
[测定方法b]
[0141]
(epcam/csv评价体系中的采用cleia法的发光强度测定)
[0142]
预先将肝素血浆样本各自适当用含有2%(w/v)bsa和150mm nacl的50mm tris缓冲液稀释,制成试样溶液。在96孔白色微孔板(
コーニング
社制)中,添加结合了抗epcam抗体(jsr社制)的0.05%(w/v)的抗体结合磁性粒子(由jsr社在magnosphere ms300/carboxyl(编号:msp-s300-ca,jsr
ライフサイエンス
社制)中将抗体敏化)分散液25μl/孔,接着,添加了试样溶液25μl/孔。进一步,添加了含有碱性磷酸酶标记抗csv抗体(由jsr社将目录号:h00007431-m08、abnova社制进行标记)的溶液25μl/孔。然后,将96孔白色微孔板在25℃下搅拌20分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。进一步添加tbs 50μl,在25℃下搅拌5分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。接着,添加发光底物(lsi社制,底物液(r5),cdp-star)50μl/孔,在5分钟后使用发光测定机(promega社制glomax(注册商标)discover system)测定了发光强度。
[0143]
[测定方法c]
[0144]
(csv/pd-l1评价体系中的采用cleia法的发光强度测定)
[0145]
预先将肝素血浆样本各自适当用含有2%(w/v)bsa和150mm nacl的50mm tris缓冲液稀释,制成试样溶液。在96孔白色微孔板(
コーニング
社制)中,添加结合了抗csv抗体(目录号:h00007431-m08,abnova社制)的0.05%(w/v)的抗体结合磁性粒子(由jsr社在magnosphere ms300/carboxyl(编号:msp-s300-ca,jsr
ライフサイエンス
社制)中将抗体敏化)分散液25μl,接着,添加了试样溶液25μl。进一步,添加了含有碱性磷酸酶标记抗pd-l1抗体(由jsr社标记mbl社制抗体)的溶液25μl/孔。然后,将96孔白色微孔板在25℃下搅拌20分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。进一步添加tbs 50μl,在25℃下搅拌5分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。接着,添加发光底物(lsi社制,底物液(r5),cdp-star)50μl/孔,在5分钟后使用发光测定机(promega社制glomax(注册商标)discover system)测定了发光强度。
[0146]
<肺癌患者样本中的csv阳性外泌体的测定>
[0147]
[实施例1]
[0148]
将包含1期或2期的早期肺癌患者的肺癌患者肝素血浆样本(47例)作为试样溶液,对各自按照上述测定方法a进行了测定。算出将各试样的测定值除以空白的值而得的值(s/n:信号/噪声比)。
[0149]
[比较例1]
[0150]
将健康者肝素血浆样本(8例)作为试样溶液,对各自按照上述测定方法a进行了测定。算出将各试样的测定值除以空白的值而得的值(s/n)。
[0151]
[分析例1]
[0152]
将实施例1和比较例1的结果示于图1中。在图1中,“健康”为健康者肝素血浆样本,“癌”为肺癌患者肝素血浆样本。在以后的附图中也同样。此外,将根据图1所示的测定结果制成的roc曲线示于图2中。
[0153]
将在比较例1中获得的健康者的s/n作为对照组,将在实施例1中获得的肺癌患者的s/n作为被判别组进行了验证,结果如果为截止值29.47,则灵敏度(特异度)变为0.98,提示出可以将肺癌患者识别为健康者。
[0154]
[实施例2]
[0155]
将包含1期或2期的早期肺癌患者的肺癌患者肝素血浆样本(47例)作为试样溶液,对各自按照上述测定方法b进行了测定。算出将各试样的测定值除以空白的值而得的值(s/n)。
[0156]
[比较例2]
[0157]
将健康者肝素血浆样本(8例)作为试样溶液,对各自按照上述测定方法b进行了测定。算出将各试样的测定值除以空白的值而得的值(s/n)。
[0158]
[分析例2]
[0159]
将实施例2和比较例2的结果示于图3中。此外,将根据图3所示的测定结果制成的roc曲线示于图4中。
[0160]
将在比较例2中获得的健康者的s/n作为对照组,将在实施例2中获得的肺癌患者的s/n作为被判别组而进行了验证,结果如果为截止值4.00,则灵敏度(特异度)变为1.00,提示出可以将肺癌患者识别为健康者。
[0161]
[实施例3]
[0162]
将包含1期或2期的早期肺癌患者的肺癌患者肝素血浆样本(47例)作为试样溶液,对各自按照上述测定方法c进行了测定。算出将各试样的测定值除以空白的值而得的值(s/n)。
[0163]
[比较例3]
[0164]
将健康者肝素血浆样本(8例)作为试样溶液,对各自按照上述测定方法c进行了测定。算出将各试样的测定值除以空白的值而得的值(s/n)。
[0165]
[分析例3]
[0166]
将实施例3和比较例3的结果示于图5中。此外,将根据图5所示的测定结果制成的roc曲线示于图6中。
[0167]
将在比较例3中获得的健康者的s/n作为对照组,将在实施例3中获得的肺癌患者的s/n作为被判别组进行了验证,结果如果为截止值2.91,则灵敏度(特异度)变为0.94,提示出可以将肺癌患者识别为健康者。
[0168]
[分析例4]
[0169]
对于实施例1和比较例1、实施例2和比较例2、实施例3和比较例3的测定结果分别根据肺癌的种类进行了分类。将结果示于图7a(实施例1和比较例1:csv/csv评价体系)、图7b(实施例2和比较例2:epcam/csv评价体系)和图7c(实施例3和比较例3:csv/pd-l1评价体
系)中。在图7a~图7c中,“ad”为adenocarcinoma的简写,为腺癌。“sq”为squamous的简写,为鳞状细胞癌。“大”为大细胞癌。“小”为小细胞肺癌。
[0170]
在图7a~图7b中,关于肺癌患者的s/n,在任一癌种中都与健康者的s/n相比显示高值。
[0171]
[分析例5]
[0172]
对于实施例1和比较例1、实施例2和比较例2、实施例3和比较例3的测定结果分别根据病理病期进行了分类。将结果示于图8a(实施例1和比较例1:csv/csv评价体系)、图8b(实施例2和比较例2:epcam/csv评价体系)和图8c(实施例3和比较例3:csv/pd-l1评价体系)中。在图8a~图8c中,病理病期如下所述。在以后的附图中也同样。
[0173]
(病理病期)
[0174]
按照日本肺癌学会编:肺癌取扱
い
規約(肺癌操作章程)第8版tnm臨床病期分類(tnm临床病期分类)进行。
[0175]
根据图8a~图8c,关于肺癌患者的s/n,从病理病期的早期起与健康者的s/n相比为高值,关于肺癌患者,直到i~iv期为止无论病理病期如何,都可以识别为健康者。
[0176]
[分析例6]
[0177]
关于实施例1和比较例1、实施例2和比较例2、实施例3和比较例3的测定结果中的腺癌患者和鳞状细胞癌患者的测定结果,根据病理病期进行了分类。将结果示于图9a(实施例1和比较例1:csv/csv评价体系)、图9b(实施例2和比较例2:epcam/csv评价体系)和图9c(实施例3和比较例3:csv/pd-l1评价体系)中。
[0178]
根据图9a~图9c,关于腺癌患者和鳞状细胞癌患者的s/n,从病理病期的早期起观察到值变高的倾向。因此,提示出通过将针对在癌细胞表面表达的抗原的抗体与抗csv抗体组合了的评价体系,可以将腺癌患者和鳞状细胞癌患者识别为健康者。
[0179]
此外,对肺癌患者肝素血浆样本测定了作为现有的肺癌标志物的癌胚抗原(cea)、鳞状细胞癌相关抗原(scc)、唾液酸le
x-i抗原(slx)、神经特异性烯醇化酶(nse)、胃泌素释放肽前体(pro grp)和细胞角蛋白19片段(cyfra)的浓度。接着,关于实施例1和比较例1的csv/csv评价体系、实施例2和比较例2的epcam/csv评价体系、以及实施例3和比较例3的csv/pd-l1评价体系,分别研究了与上述现有的肺癌标志物的相关,但未见相关。
[0180]
进一步,关于实施例1和比较例1的csv/csv评价体系、实施例2和比较例2的epcam/csv评价体系、以及实施例3和比较例3的csv/pd-l1评价体系,研究了各评价体系间的相关,但未见相关。
[0181]
另外,在上述相关的研究中,将epcam/csv评价体系的s/n=12000的样本作为异常值排除在外而进行了研究。
[0182]
由此,通过将现有的标志物与本评价体系、或本评价体系多个组合而进行,从而可以提高癌的诊断的准确度。
[0183]
[实施例4]
[0184]
预先将健康者肝素血浆样本和肺癌患者肝素库血浆样本分别适当用含有2%(w/v)bsa和150mm nacl的50mm tris缓冲液稀释,制成试样溶液。在96孔白色微孔板(
コーニング
社制)中,将结合了抗csv抗体(目录号:h00007431-m08,abnova社制)、抗epcam抗体(jsr社制)、或抗磷脂酰肌醇蛋白聚糖-3抗体(抗gpc3抗体)(mbl社制)的任一个的0.05%(w/v)
的抗体结合磁性粒子(由jsr社在magnosphere ms300/carboxyl(编号:msp-s300-ca,jsr
ライフサイエンス
社制)中将抗体敏化)分散液(3种)分别在不同的孔中添加各25μl/孔,接着,添加了试样溶液25μl/孔。进一步,添加了含有碱性磷酸酶标记抗csv抗体(由jsr社将目录号:h00007431-m08、abnova社制标记)的溶液25μl/孔。然后,将96孔白色微孔板在25℃下搅拌20分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。进一步添加tbs 50μl,在25℃下搅拌5分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。接着,添加发光底物(lsi社制,底物液(r5),cdp-star)50μl/孔,在5分钟后使用发光测定机(promega社制glomax(注册商标)discover system)测定了发光强度。算出将各试样的测定值除以空白的值而得的值(s/n)。将结果示于图10中。在图10中,“捕获”为捕获用分子,“检测”为检测用分子。
[0185]
根据图10,即使将作为与epcam不同的癌抗原的gpc3与csv的共表达作为标志物,也可以构建评价体系,因此提示出通过将针对在癌细胞表面表达的抗原的抗体与抗csv抗体组合了的评价体系,可以将肺癌患者识别为健康者。
[0186]
[实施例5]
[0187]
预先,将健康者肝素血浆样本用含有2%(w/v)bsa和150mm nacl的50mm tris缓冲液稀释,制成试样溶液。在96孔白色微孔板(
コーニング
社制)中,添加结合了抗pd-l1抗体(mbl社制)的0.05%(w/v)的抗体结合磁性粒子(由jsr社在magnosphere ms300/carboxyl(编号:msp-s300-ca,jsr
ライフサイエンス
社制)中将抗体敏化)分散液25μl/孔,接着,添加试样溶液25μl/孔。进一步,添加了碱性磷酸酶标记抗csv抗体(由jsr社将目录号:h00007431-m08、abnova社制标记)溶液25μl/孔。然后,将96孔白色微孔板在25℃下搅拌20分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。进一步添加tbs 50μl,在25℃下搅拌5分钟,接着,使用微孔板洗板机(
テカン
社制
ハイドロフレックス
)一边进行集磁一边用洗涤缓冲液(包含0.1质量%的tween20的tbs)洗涤反应后的粒子5次。接着,添加发光底物(lsi社制,底物液(r5),cdp-star)50μl/孔,在5分钟后使用发光测定机(promega社制glomax(注册商标)discover system)测定了发光强度(以下,有时将该评价体系称为“csv/pd-l1评价体系”)。
[0188]
另行代替结合了抗pd-l1抗体(mbl社制)的0.05%(w/v)的抗体结合磁性粒子(由jsr社在magnosphere ms300/carboxyl(编号:msp-s300-ca,jsr
ライフサイエンス
社制)中将抗体敏化)分散液,而使用了结合了抗csv抗体(目录号:h00007431-m08、abnova社制标记)的0.05%(w/v)的抗体结合磁性粒子(由jsr社在magnosphere ms300/carboxyl(编号:msp-s300-ca,jsr
ライフサイエンス
社制)中将抗体敏化)分散液,代替碱性磷酸酶标记抗csv抗体(由jsr社将目录号:h00007431-m08,abnova社制以),而使用了碱性磷酸酶标记抗pd-l1抗体(由jsr社将mbl社制抗体标记),除此以外,使用与上述“csv/pd-l1评价体系”同样的方法,测定了发光强度(以下,将该评价体系有时称为“pd-l1/csv评价体系”)。将结果示于图11中。在图11中,“捕获”为捕获用分子,“检测”为检测用分子。
[0189]
根据图11,将“csv/pd-l1评价体系”和“pd-l1/csv评价体系”的强度进行了比较,
结果提示出即使使捕获用分子与检测用分子的组合相反,也能够构建评价体系。
[0190]
产业可利用性
[0191]
根据本实施方式的外泌体的分离和检测方法、以及分离和检测试剂盒,可以将外泌体分离,可以利用于癌诊断、伴随诊断。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。