施用抗siglec-8抗体和皮质类固醇的方法
相关申请的交叉引用
1.本技术要求2019年8月2日提交的美国临时申请序列号62/882,330的优先权,所述申请通过引用以其整体并入本文。ascii文本文件序列表的提交
2.以下以ascii文本文件提交的内容通过引用以其整体并入本文:计算机可读形式(crf)的序列表(文件名:701712001240seqlist.txt,记录日期:2020年7月20日,大小:113kb)。
技术领域
3.本公开文本涉及适合于施用包含与人siglec-8结合的抗体的组合物的方法和试剂盒,例如,施用至有需要的人。在一些实施方案中,在第一剂量的包含所述抗siglec-8抗体的组合物之前至少6小时、至少12小时或12-24小时施用皮质类固醇。
背景技术:
4.siglec(唾液酸结合免疫球蛋白样凝集素)是主要在白细胞上发现的单次跨膜细胞表面蛋白,并且其特征为其对附接至细胞表面糖缀合物的唾液酸的特异性。siglec家族含有在哺乳动物中发现的至少15个成员(pillai等人,annu rev immunol.,2012,30:357-392)。这些成员包括唾液酸黏附素(sialoadhesion)(siglec-1)、cd22(siglec-2)、cd33(siglec-3)、髓磷脂相关糖蛋白(siglec-4)、siglec-5、obbp1(siglec-6)、airm1(siglec-7)、saf-2(siglec-8)和cd329(siglec-9)。siglec-8,在人中但不在小鼠中表达的成员,最初是作为鉴定新型人嗜酸性粒细胞蛋白质的成果的一部分而被发现的。除了由嗜酸性粒细胞表达以外,它也由肥大细胞和嗜碱性粒细胞表达。siglec-8识别硫酸化聚糖,即,6'-磺基-唾液酰基lewis x或6'-磺基-唾液酰基-n-乙酰基-s-氨基乳糖苷,并且含有显示抑制肥大细胞功能的细胞内免疫受体酪氨酸抑制基序(itim)结构域。
5.与肥大细胞一起,嗜酸性粒细胞可以促进具有有益的功能作用的炎症反应,如控制特定组织部位的感染。在炎症反应期间,嗜酸性粒细胞的细胞凋亡可以通过存活促进细胞因子如il-3和gm-csf的活性而被抑制。然而,未因细胞凋亡而快速去除的激活的嗜酸性粒细胞的增加可以导致在已经发炎的部位的嗜酸性粒细胞颗粒蛋白的释放,这可能损伤组织并引起进一步加重的炎症。已经显示几种疾病与嗜酸性粒细胞激活相关联,如churg strauss综合征、类风湿性关节炎和过敏性哮喘(wechsler等人,j allergy clin immunol.,2012,130(3):563-71)。目前存在对可以控制炎症中涉及的免疫细胞的活性(如嗜酸性粒细胞和肥大细胞的活性)的疗法的需要。
6.先前研究已经证实,在siglec-8与针对siglec-8的细胞外部分产生的特异性鼠抗体交联时,嗜酸性粒细胞经历细胞凋亡(nutku等人,blood,2003,336:918-24)。这些抗体描述于美国专利号8,207,305、美国专利号8,197,811、美国专利号7,871,612和美国专利号7,557,191中。人源化抗siglec-8抗体描述于美国专利号9,546,215中。
7.与人siglec-8结合的抗体处于在健康志愿者以及患有惰性系统性肥大细胞增多症(ism)、慢性荨麻疹和过敏性结膜炎的患者中进行的临床测试中。迄今,抗siglec-8抗体治疗具有良好耐受,其中最常观察到的不良事件是输注相关反应(irr)。虽然大多数irr是轻度至中度的,但仍然存在对改进抗siglec-8抗体治疗的方法的需要,例如,通过预防irr和/或减轻irr的严重程度来实现。
8.本文中引用的所有参考文献,包括专利申请、专利公开案和科学文献均通过引用以其整体并入本文,如同每个单独的参考文献被具体地且单独地指示通过引用并入。
技术实现要素:
9.为了满足这种和其他需求,本公开文本尤其涉及施用包含与人siglec-8结合的抗体的组合物的方法。
10.因此,本公开文本的某些方面涉及用于将包含与人siglec-8结合的抗体的组合物施用至有需要的个体的方法。在一些实施方案中,所述方法包括将皮质类固醇施用至所述个体;以及在施用所述皮质类固醇之后至少6小时,向所述个体施用第一剂量的包含与人siglec-8结合的抗体的组合物。在一些实施方案中,所述方法包括向所述个体施用第一剂量的包含与人siglec-8结合的抗体的组合物,其中在所述第一剂量的施用之前至少6小时将皮质类固醇施用至所述个体。在一些实施方案中,所述方法包括向所述个体施用第一剂量的所述组合物,其中将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前至少6小时将皮质类固醇施用至所述个体。在一些实施方案中,所述个体是人。
11.在一些实施方案中,在所述第一剂量的施用之前至少12小时将所述皮质类固醇施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前24小时内将所述皮质类固醇施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前12-24小时将所述皮质类固醇施用至所述个体。在一些实施方案中,所述皮质类固醇是泼尼松、可的松、地塞米松、氢化可的松、甲泼尼龙或泼尼松龙。在一些实施方案中,在所述第一剂量的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)或12-24小时将大于0.5mg/kg泼尼松施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)或12-24小时将0.5mg/kg至1mg/kg泼尼松施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)或12-24小时将1mg/kg泼尼松施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)或12-24小时将80mg泼尼松施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)或12-24小时将60mg泼尼松施用至所述个体。在一些实施方案中,所述皮质类固醇是由所述个体自我施用。在一些实施方案中,给所述个体口服施用所述皮质类固醇。在一些实施方案中,如与在没有将所述皮质类固醇在之前至少6小时施用的情况下所述第一剂量的施用相比,将所述皮质类固醇在所述第一剂量的施用之前至少6小时施用降低所述个体中输注相关反应(irr)的风险和/或严重性。在一些实施方案中,如与在没有将所述皮质类固醇在之前至少12小时施用的情况下所述第一剂量的施用相比,将
所述皮质类固醇在所述第一剂量的施用之前至少12小时施用降低所述个体中输注相关反应(irr)的风险和/或严重性。在一些实施方案中,如与在没有将所述皮质类固醇在之前12-24小时施用的情况下所述第一剂量的施用相比,将所述皮质类固醇在所述第一剂量的施用之前12-24小时施用降低所述个体中输注相关反应(irr)的风险和/或严重性。
12.在根据本文所述的任何实施方案的一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以0.1mg/kg与10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以约1mg/kg与约3mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以1mg/kg或3mg/kg施用至所述个体。在一些实施方案中,将所述第一剂量的组合物静脉内施用至所述个体。在一些实施方案中,将所述第一剂量的组合物皮下施用至所述个体。
13.在一些实施方案中,将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。在一些实施方案中,在所述输注的前2小时中将所述第一剂量的总体积的小于50%施用至所述个体。在一些实施方案中,在所述输注的前2小时中将所述第一剂量的总体积的小于30%施用至所述个体。在一些实施方案中,将所述第一剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:1ml/小时持续15分钟、5ml/小时持续15分钟、10ml/小时持续30分钟、15ml/小时持续30分钟、25ml/小时持续30分钟、30ml/小时持续30分钟、35ml/小时持续30分钟以及40ml/小时持续62分钟。在一些实施方案中,如与所述第一剂量通过静脉内输注经小于约4小时的时间段的施用相比,所述第一剂量的组合物通过静脉内输注经约4小时的时间段的施用降低所述个体中输注相关反应(irr)的风险。在一些实施方案中,如与所述第一剂量通过静脉内输注经小于约4小时的时间段的施用相比,所述第一剂量的组合物通过静脉内输注经约4小时的时间段的施用降低所述个体中输注相关反应(irr)的严重性。
14.在根据本文所述的任何实施方案的一些实施方案中,所述方法还包括在所述第一剂量的施用之前1-2小时将皮质类固醇施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前1-2小时施用至所述个体的皮质类固醇是泼尼松、可的松、地塞米松、氢化可的松、甲泼尼龙或泼尼松龙。在一些实施方案中,在所述第一剂量的施用之前1-2小时将大于0.5mg/kg泼尼松施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前1-2小时将0.5mg/kg至1mg/kg泼尼松施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前1-2小时将大于1mg/kg泼尼松施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前1-2小时将60mg或80mg泼尼松施用至所述个体。在一些实施方案中,给所述个体口服施用所述皮质类固醇。在一些实施方案中,在所述第一剂量的施用之前1-2小时施用至所述个体的皮质类固醇是甲泼尼龙。在一些实施方案中,在所述第一剂量的施用之前1-2小时将100mg甲泼尼龙施用至所述个体。在一些实施方案中,将所述皮质类固醇静脉内施用至所述个体。在一些实施方案中,所述方法还包括在所述第一剂量的施用之前1-2小时将抗组胺施用至所述个体。在一些实施方案中,所述抗组胺是西替利嗪。在一些实施方案中,在所述第一剂量的施用之前1-2小时将10mg西替利嗪施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前不小于40分钟且不超过180分钟将10mg西替利嗪施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前40分钟至180分钟(例如,包括40分钟和180分钟)将10mg西替利嗪施用至所述个体。在一些实施方案中,给所述个体口服施用所述抗组
2小时施用至所述个体的皮质类固醇是甲泼尼龙。在一些实施方案中,在所述第二剂量的施用之前1-2小时将100mg甲泼尼龙施用至所述个体。在一些实施方案中,所述方法还包括在所述第二剂量的施用之前1-2小时将抗组胺施用至所述个体。在一些实施方案中,在所述第二剂量的施用之前1-2小时将10mg西替利嗪施用至所述个体。在一些实施方案中,给所述个体口服施用所述抗组胺。在一些实施方案中,所述方法还包括在所述第二剂量的施用之前1-2小时将解热药或非甾体抗炎药(nsaid)施用至所述个体。在一些实施方案中,所述解热药是对乙酰氨基酚。在一些实施方案中,在所述第二剂量的施用之前1-2小时将975-1000mg对乙酰氨基酚施用至所述个体。在一些实施方案中,给所述个体口服施用所述解热药或nsaid。
16.在根据本文所述的任何实施方案的一些实施方案中,所述方法还包括向所述个体施用第三剂量的包含与人siglec-8结合的抗体的组合物。在一些实施方案中,将所述第三剂量在所述第二剂量之后约28天施用至所述个体。在一些实施方案中,将所述第三剂量在所述第二剂量之后约4周施用至所述个体。在一些实施方案中,将所述第三剂量在所述第一剂量之后约56天施用至所述个体。在一些实施方案中,将所述第三剂量在所述第一剂量之后约8周施用至所述个体。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约2小时至约4小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约1小时至约4小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约2小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:10ml/小时持续30分钟、25ml/小时持续15分钟、40ml/小时持续15分钟、55ml/小时持续15分钟、70ml/小时持续15分钟、85ml/小时持续15分钟以及100ml/小时持续16分钟。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约3小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:2ml/小时持续30分钟、10ml/小时持续30分钟、20ml/小时持续30分钟、40ml/小时持续30分钟以及60ml/小时持续64分钟。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:1ml/小时持续15分钟、5ml/小时持续15分钟、10ml/小时持续30分钟、15ml/小时持续30分钟、25ml/小时持续30分钟、30ml/小时持续30分钟、35ml/小时持续30分钟以及40ml/小时持续62分钟。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约1小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:24ml/小时持续15分钟和125.3ml/小时持续45分钟。在一些实施方案中,在没有在所述第三剂量的施用之前至少6小时、至少12小时、6-24小时或12-24小时将皮质类固醇施用至所述个体的情况下,将所述第三剂量施用至所述个体。在一些实施方案中,在所述第三剂量的施用之前1-2小时、至少6小时、至少12小时、6-24小时或12-24小时将皮质类固醇施用至所述个体。在一些实施方案中,所述方法包括:在第1天向所述个体施用第一剂量的所述组合物,其中将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体(任选地其中在所述第一剂量的施用之前至少6小时将皮质类固醇施用至所述个体);第29天(
±
3天)向所述个体施用第二剂量的所述组合物,其中将所述第二剂量的组合物通过静脉内输注经约
4小时的时间段施用至所述个体;以及在第57天(
±
3天)向所述个体施用第三剂量的所述组合物,其中将所述第三剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述)。在一些实施方案中,所述方法包括:在第1周向所述个体施用第一剂量的所述组合物,其中将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体(任选地其中在所述第一剂量的施用之前至少6小时将皮质类固醇施用至所述个体);在第4周(
±
3天)向所述个体施用第二剂量的所述组合物,其中将所述第二剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体;以及在第8周(
±
3天)向所述个体施用第三剂量的所述组合物,其中将所述第三剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述)。
17.在根据本文所述的任何实施方案的一些实施方案中,所述方法还包括向所述个体施用第四剂量的包含与人siglec-8结合的抗体的组合物。在一些实施方案中,将所述第四剂量在所述第三剂量之后约28天施用至所述个体。在一些实施方案中,将所述第四剂量在所述第三剂量之后约4周施用至所述个体。在一些实施方案中,将所述第四剂量在所述第二剂量之后约56天施用至所述个体。在一些实施方案中,将所述第四剂量在所述第二剂量之后约8周施用至所述个体。在一些实施方案中,将所述第四剂量在所述第一剂量之后约84天施用至所述个体。在一些实施方案中,将所述第四剂量在所述第一剂量之后约12周施用至所述个体。在一些实施方案中,将所述第四剂量的组合物通过静脉内输注经约2小时至约4小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量的组合物通过静脉内输注经约1小时至约4小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量的组合物通过静脉内输注经约2小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:10ml/小时持续30分钟、25ml/小时持续15分钟、40ml/小时持续15分钟、55ml/小时持续15分钟、70ml/小时持续15分钟、85ml/小时持续15分钟以及100ml/小时持续16分钟。在一些实施方案中,将所述第四剂量的组合物通过静脉内输注经约3小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:2ml/小时持续30分钟、10ml/小时持续30分钟、20ml/小时持续30分钟、40ml/小时持续30分钟以及60ml/小时持续64分钟。在一些实施方案中,将所述第四剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:1ml/小时持续15分钟、5ml/小时持续15分钟、10ml/小时持续30分钟、15ml/小时持续30分钟、25ml/小时持续30分钟、30ml/小时持续30分钟、35ml/小时持续30分钟以及40ml/小时持续62分钟。在一些实施方案中,将所述第四剂量的组合物通过静脉内输注经约1小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:24ml/小时持续15分钟和125.3ml/小时持续45分钟。在一些实施方案中,所述方法包括:在第1天向所述个体施用第一剂量的所述组合物,其中将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体(任选地其中在所述第一剂量的施用之前至少6小时将皮质类固醇施用至所述个体);第29天(
±
3天)向所述个体施用第二剂量的所述组合物,其中将所述第二剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体;在第57天(
±
3天)向
所述个体施用第三剂量的所述组合物,其中将所述第三剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述);以及在第85天(
±
3天)向所述个体施用第四剂量的所述组合物,其中将所述第四剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述)。在一些实施方案中,所述方法包括:在第1周向所述个体施用第一剂量的所述组合物,其中将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体(任选地其中在所述第一剂量的施用之前至少6小时将皮质类固醇施用至所述个体);在第4周(
±
3天)向所述个体施用第二剂量的所述组合物,其中将所述第二剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体;在第8周(
±
3天)向所述个体施用第三剂量的所述组合物,其中将所述第三剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述);以及在第12周(
±
3天)向所述个体施用第四剂量的所述组合物,其中将所述第四剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述)。在一些实施方案中,所述方法包括:在第1天向所述个体施用第一剂量的所述组合物,其中将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体(任选地其中在所述第一剂量的施用之前至少6小时将皮质类固醇施用至所述个体);第29天(
±
3天)向所述个体施用第二剂量的所述组合物,其中将所述第二剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体;在第57天(
±
3天)向所述个体施用第三剂量的所述组合物,其中将所述第三剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述);在第85天(
±
3天)向所述个体施用第四剂量的所述组合物,其中将所述第四剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述);在第113天(
±
3天)向所述个体施用第五剂量的所述组合物,其中将所述第五剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述);以及在第141天(
±
3天)向所述个体施用第六剂量的所述组合物,其中将所述第六剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述)。在一些实施方案中,所述方法包括:在第1周向所述个体施用第一剂量的所述组合物,其中将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体(任选地其中在所述第一剂量的施用之前至少6小时将皮质类固醇施用至所述个体);在第4周(
±
3天)向所述个体施用第二剂量的所述组合物,其中将所述第二剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体;在第8周(
±
3天)向所述个体施用第三剂量的所述组合物,其中将所述第三剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述);在第12周(
±
3天)向所述个体施用第四剂量的所述组合物,其中将所述第四剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述);在第16周(
±
3天)向所述个体施用第五剂量的所述组合物,其中将所述第五剂量的组
合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述);以及在第20周(
±
3天)向所述个体施用第六剂量的所述组合物,其中将所述第六剂量的组合物通过静脉内输注经约1至约4小时、约2至约4小时或者约1小时、2小时或4小时中的任一项的时间段施用至所述个体(例如,如本文所述)。
18.在根据本文所述的任何实施方案的一些实施方案中,所述个体患有或已经被诊断为患有特征为以下中的一种或多种的疾病或障碍:激活的嗜酸性粒细胞的增加、增加的表达siglec-8的肥大细胞的活性、嗜酸性粒细胞和/或肥大细胞的增加或者增加的嗜酸性粒细胞和/或肥大细胞的激活。在一些实施方案中,所述个体患有或已被诊断为患有选自以下的疾病或障碍:伴随哮喘的慢性鼻窦炎、阿司匹林加重性呼吸系统疾病、伴随鼻窦疾病的成人发病的非特应性哮喘、慢性阻塞性肺病、纤维化疾病、纤维化前疾病、晚期系统性肥大细胞增多症、惰性系统性肥大细胞增多症(ism)、炎性肠病(ibd)、嗜酸细胞性食管炎(eoe)、嗜酸细胞性胃炎(eg)、嗜酸细胞性胃肠炎(ege)、嗜酸细胞性十二指肠炎、嗜酸细胞性结肠炎(eoc)、肥大细胞胃炎或肥大细胞胃肠炎、伴随肥大细胞升高的胃炎或胃肠炎、伴随肥大细胞升高的肠易激综合征、功能性胃肠疾病、过敏性结膜炎、巨乳头状结膜炎、慢性荨麻疹、变应性支气管肺曲菌病(abpa)、过敏性哮喘、具有嗜酸性粒细胞或肥大细胞表型的哮喘、嗜酸性肉芽肿性多血管炎(egpa)、乳糜泻、胃轻瘫、嗜酸细胞增多综合征、特应性皮炎、过敏反应、血管性水肿、肥大细胞激活综合征/障碍以及嗜酸细胞性筋膜炎。在一些实施方案中,本公开文本的方法用于治疗患有或已被诊断为患有选自以下的疾病或障碍的个体:伴随哮喘的慢性鼻窦炎、阿司匹林加重性呼吸系统疾病、伴随鼻窦疾病的成人发病的非特应性哮喘、慢性阻塞性肺病、纤维化疾病、纤维化前疾病、晚期系统性肥大细胞增多症、惰性系统性肥大细胞增多症(ism)、炎性肠病(ibd)、嗜酸细胞性食管炎(eoe)、嗜酸细胞性胃炎(eg)、嗜酸细胞性胃肠炎(ege)、嗜酸细胞性结肠炎(eoc)、嗜酸细胞性十二指肠炎、肥大细胞胃炎或肥大细胞胃肠炎、伴随肥大细胞升高的胃炎或胃肠炎、伴随肥大细胞升高的肠易激综合征、功能性胃肠疾病、过敏性结膜炎、巨乳头状结膜炎、慢性荨麻疹、变应性支气管肺曲菌病(abpa)、过敏性哮喘、具有嗜酸性粒细胞或肥大细胞表型的哮喘、嗜酸性肉芽肿性多血管炎(egpa)、乳糜泻、胃轻瘫、嗜酸细胞增多综合征、特应性皮炎、过敏反应、血管性水肿、肥大细胞激活综合征/障碍以及嗜酸细胞性筋膜炎。在一些实施方案中,所述个体是人。在一些实施方案中,在所述组合物的施用之前,所述个体已进行针对上述适应症中的一种或多种(例如,eg、ege或eoe)的先前治疗(例如,护理标准治疗)但失败。在一些实施方案中,在所述组合物的施用之前,所述个体已进行针对上述适应症中的一种或多种(例如,eg、ege或eoe)的先前治疗(例如,护理标准治疗)但疾病症状未被充分控制。先前治疗的非限制性例子尤其包括质子泵抑制剂(ppi)、全身或局部皮质类固醇和/或饮食。
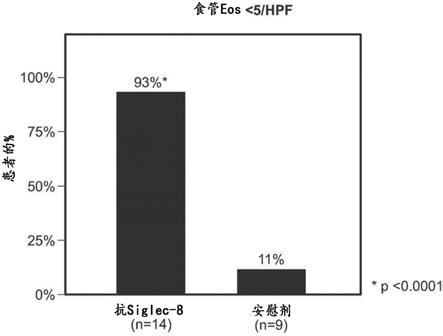
19.在根据本文所述的任何实施方案的一些实施方案中,如与所述组合物的施用之前的嗜酸性粒细胞计数相比,所述方法导致嗜酸性粒细胞计数的减少,例如,在从所述个体(对于组织嗜酸性粒细胞计数)或外周血(对于血液嗜酸性粒细胞计数)获得的活检样品中。例如,所述个体可能患有eg、ege和/或eoe,并且所述活检样品来自胃粘膜或十二指肠粘膜。在一些实施方案中,如与所述组合物的施用之前的组织嗜酸性粒细胞计数相比,所述方法导致组织嗜酸性粒细胞计数的至少75%、至少80%、至少85%或至少90%减少,例如,在从
患有eg、ege和/或eoe的个体获得的活检样品(例如,来自食道、胃粘膜或十二指肠粘膜)中。在一些实施方案中,如与所述组合物的施用之前所述个体中的一种或多种症状(例如,患有eg、ege和/或eoe的个体中腹痛、恶心、腹泻、呕吐、饭前饱腹感、食欲不振、腹部绞痛和胃气胀中的一种或多种)相比,所述方法导致所述个体中一种或多种症状的减少。在一些实施方案中,如与所述组合物的施用之前所述个体中的一种或多种症状(例如,患有eg、ege和/或eoe的个体中腹痛、恶心、腹泻、呕吐、饭前饱腹感、食欲不振、腹部绞痛和胃气胀中的一种或多种)相比,所述方法导致所述个体中一种或多种症状的严重性和/或频率的至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%或至少90%的降低。在一些实施方案中,所述方法导致至少50%、至少60%或至少70%的反应率,例如,在患有eg、ege和/或eoe的个体中。在一些实施方案中,反应率反映如与所述组合物的施用之前相比,具有组织活检嗜酸性粒细胞计数的减少和/或症状的减少的个体的百分比。在一些实施方案中,如与所述组合物的施用之前所述个体中吞咽困难的严重性相比,所述方法导致所述个体中吞咽困难的严重性的至少30%、至少35%、至少40%、至少45%或至少50%的降低(例如,在患有eg、ege和/或eoe的个体中)。
20.在根据本文所述的任何实施方案的一些实施方案中,所述抗体包含fc区和连接至所述fc区的n-糖苷连接的碳水化合物链,其中所述组合物中的抗体的小于50%的n-糖苷连接的碳水化合物链含有岩藻糖残基。在一些实施方案中,所述组合物中所述抗体的n-糖苷连接的碳水化合物链基本上均不含岩藻糖残基。在一些实施方案中,所述抗体包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:61的氨基酸序列的hvr-h1、(ii)含有seq id no:62的氨基酸序列的hvr-h2以及(iii)含有seq id no:63的氨基酸序列的hvr-h3;和/或其中所述轻链可变区包含(i)含有seq id no:64的氨基酸序列的hvr-l1、(ii)含有seq id no:65的氨基酸序列的hvr-l2以及(iii)含有seq id no:66的氨基酸序列的hvr-l3。在一些实施方案中,所述抗体包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:61的氨基酸序列的hvr-h1、(ii)含有seq id no:62的氨基酸序列的hvr-h2以及(iii)含有选自seq id no:67-70的氨基酸序列的hvr-h3;和/或其中所述轻链可变区包含(i)含有seq id no:64的氨基酸序列的hvr-l1、(ii)含有seq id no:65的氨基酸序列的hvr-l2以及(iii)含有seq id no:71的氨基酸序列的hvr-l3。在一些实施方案中,所述抗体包含含有seq id no:6的氨基酸序列的重链可变区;和/或含有选自seq id no:16或21的氨基酸序列的轻链可变区。在一些实施方案中,所述抗体包含含有选自seq id no:11-14的氨基酸序列的重链可变区;和/或含有选自seq id no:23-24的氨基酸序列的轻链可变区。在一些实施方案中,所述抗体包含含有选自seq id no:2-14的氨基酸序列的重链可变区;和/或含有选自seq id no:16-24的氨基酸序列的轻链可变区。在一些实施方案中,所述抗体包含含有选自seq id no:2-10的氨基酸序列的重链可变区;和/或含有选自seq id no:16-22的氨基酸序列的轻链可变区。在一些实施方案中,所述抗体包含:(a)重链可变区,所述重链可变区包含:(1)含有选自seq id no:26-29的氨基酸序列的hc-fr1;(2)含有seq id no:61的氨基酸序列的hvr-h1;(3)含有选自seq id no:31-36的氨基酸序列的hc-fr2;(4)含有seq id no:62的氨基酸序列的hvr-h2;(5)含有选自seq id no:38-43的氨基酸序列的hc-fr3;(6)含有seq id no:63的氨基酸序列的hvr-h3;以及(7)含有选自seq id no:45-46的氨基酸序列的hc-fr4;和/或(b)轻链可变区,所述轻链可变区包含:(1)
含有选自seq id no:48-49的氨基酸序列的lc-fr1;(2)含有seq id no:64的氨基酸序列的hvr-l1;(3)含有选自seq id no:51-53的氨基酸序列的lc-fr2;(4)含有seq id no:65的氨基酸序列的hvr-l2;(5)含有选自seq id no:55-58的氨基酸序列的lc-fr3;(6)含有seq id no:66的氨基酸序列的hvr-l3;以及(7)含有seq id no:60的氨基酸序列的lc-fr4。在一些实施方案中,所述抗体包含:(a)重链可变区,所述重链可变区包含:(1)含有seq id no:26的氨基酸序列的hc-fr1;(2)含有seq id no:61的氨基酸序列的hvr-h1;(3)含有seq id no:34的氨基酸序列的hc-fr2;(4)含有seq id no:62的氨基酸序列的hvr-h2;(5)含有seq id no:38的氨基酸序列的hc-fr3;(6)含有seq id no:63的氨基酸序列的hvr-h3;以及(7)含有seq id no:45的氨基酸序列的hc-fr4;和/或(b)轻链可变区,所述轻链可变区包含:(1)含有seq id no:48的氨基酸序列的lc-fr1;(2)含有seq id no:64的氨基酸序列的hvr-l1;(3)含有seq id no:51的氨基酸序列的lc-fr2;(4)含有seq id no:65的氨基酸序列的hvr-l2;(5)含有seq id no:55的氨基酸序列的lc-fr3;(6)含有seq id no:66的氨基酸序列的hvr-l3;以及(7)含有seq id no:60的氨基酸序列的lc-fr4。在一些实施方案中,所述抗体包含:(a)重链可变区,所述重链可变区包含:(1)含有seq id no:26的氨基酸序列的hc-fr1;(2)含有seq id no:61的氨基酸序列的hvr-h1;(3)含有seq id no:34的氨基酸序列的hc-fr2;(4)含有seq id no:62的氨基酸序列的hvr-h2;(5)含有seq id no:38的氨基酸序列的hc-fr3;(6)含有seq id no:63的氨基酸序列的hvr-h3;以及(7)含有seq id no:45的氨基酸序列的hc-fr4;和/或(b)轻链可变区,所述轻链可变区包含:(1)含有seq id no:48的氨基酸序列的lc-fr1;(2)含有seq id no:64的氨基酸序列的hvr-l1;(3)含有seq id no:51的氨基酸序列的lc-fr2;(4)含有seq id no:65的氨基酸序列的hvr-l2;(5)含有seq id no:58的氨基酸序列的lc-fr3;(6)含有seq id no:66的氨基酸序列的hvr-l3;以及(7)含有seq id no:60的氨基酸序列的lc-fr4。在一些实施方案中,所述抗体包含:重链可变区,所述重链可变区包含(i)含有seq id no:88的氨基酸序列的hvr-h1,(ii)含有seq id no:91的氨基酸序列的hvr-h2,以及(iii)含有seq id no:94的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:97的氨基酸序列的hvr-l1,(ii)含有seq id no:100的氨基酸序列的hvr-l2,以及(iii)含有seq id no:103的氨基酸序列的hvr-l3;重链可变区,所述重链可变区包含(i)含有seq id no:89的氨基酸序列的hvr-h1,(ii)含有seq id no:92的氨基酸序列的hvr-h2,以及(iii)含有seq id no:95的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:98的氨基酸序列的hvr-l1,(ii)含有seq id no:101的氨基酸序列的hvr-l2,以及(iii)含有seq id no:104的氨基酸序列的hvr-l3;或者重链可变区,所述重链可变区包含(i)含有seq id no:90的氨基酸序列的hvr-h1,(ii)含有seq id no:93的氨基酸序列的hvr-h2,以及(iii)含有seq id no:96的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:99的氨基酸序列的hvr-l1,(ii)含有seq id no:102的氨基酸序列的hvr-l2,以及(iii)含有seq id no:105的氨基酸序列的hvr-l3。在一些实施方案中,所述抗体包含:含有seq id no:106的氨基酸序列的重链可变区;和/或含有seq id no:109的氨基酸序列的轻链可变区;含有seq id no:107的氨基酸序列的重链可变区;和/或含有seq id no:110的氨基酸序列的轻链可变区;或者含有seq id no:108的氨基酸序列的重链可变区;和/或含有seq id no:111的氨基酸序列的轻链可变区。在一些实施方案中,所述抗体与人siglec-8和非人灵
长类动物siglec-8结合。在一些实施方案中,所述非人灵长类动物是狒狒。在一些实施方案中,所述抗体与人siglec-8的结构域1中的表位结合,其中结构域1包含seq id no:112的氨基酸序列。在一些实施方案中,所述抗体与人siglec-8的结构域3中的表位结合,其中结构域3包含seq id no:114的氨基酸序列。在一些实施方案中,所述抗体与抗体4f11结合至相同表位。在一些实施方案中,所述抗体与人siglec-8的结构域2或结构域3中的表位结合。在一些实施方案中,结构域2包含seq id no:113的氨基酸序列。在一些实施方案中,所述抗体与抗体1c3结合至相同表位。在一些实施方案中,结构域3包含seq id no:114的氨基酸序列。在一些实施方案中,所述抗体与抗体1h10结合至相同表位。在一些实施方案中,所述抗体与人siglec-8的结构域1中的表位结合并且与抗体4f11竞争结合至siglec-8。在一些实施方案中,所述抗体不与抗体2e2竞争结合至siglec-8。在一些实施方案中,所述抗体不是抗体2e2。在一些实施方案中,结构域1包含seq id no:112的氨基酸序列。在一些实施方案中,所述抗体是人抗体、人源化抗体或嵌合抗体。在一些实施方案中,所述抗体包含含有人igg fc区的重链fc区。在一些实施方案中,所述人igg fc区包含人igg1fc区。在一些实施方案中,所述人igg1fc区是未岩藻糖基化的。在一些实施方案中,所述人igg fc区包含人igg4fc区。在一些实施方案中,所述人igg4fc区包含氨基酸取代s228p,其中氨基酸残基按照kabat中的eu索引来编号。在一些实施方案中,所述抗体耗尽血液嗜酸性粒细胞和/或抑制肥大细胞激活。在一些实施方案中,所述抗体已经被工程化以改进抗体依赖性细胞介导的细胞毒性(adcc)活性。在一些实施方案中,所述抗体包含fc区中改进adcc活性的至少一个氨基酸取代。在一些实施方案中,所述抗体的至少一条或两条重链是未岩藻糖基化的。在一些实施方案中,所述抗体包含含有seq id no:75的氨基酸序列的重链;和/或含有选自seq id no:76或77的氨基酸序列的轻链。在一些实施方案中,所述抗体是利仑特力单抗(lirentelimab)。在一些实施方案中,所述抗体是单克隆抗体。在一些实施方案中,所述组合物包含所述抗体和药学上可接受的载体。
21.本文还提供包含药物和药品说明书的试剂盒或制品,所述药物包含含有与人siglec-8结合的抗体的组合物,所述药品说明书包含用于根据上文实施方案中的任一项在有需要的个体中施用所述药物的说明书。
22.应当理解,可以将本文描述的各种实施方案的一个、一些或所有特性组合,以形成本公开文本的其他实施方案。本公开文本的这些和其他方面对于本领域技术人员将变得清楚。通过下文详细说明进一步描述本公开文本的这些和其他实施方案。
附图说明
23.图1显示,所有治疗组都符合检查使用抗siglec-8抗体对患有eg和/或ege的患者的治疗的2期研究的主要终点。
24.图2显示,所有治疗组都符合所述2期研究的总症状得分(tss)次要终点。
25.图3显示针对使用抗siglec-8抗体的治疗测量的所有症状中的改进。
26.图4显示,所有治疗组都符合所述2期研究的反应者次要终点。治疗反应者被定义为在第13-14周组织活检嗜酸性粒细胞计数的减少》75%且症状的减少(tss)》30%。
27.图5显示患有嗜酸细胞性食管炎(eoe)的患者中的显著嗜酸性粒细胞减少。
28.图6显示患有eoe的患者中吞咽困难的实质性改进。
29.图7显示所述2期研究的安全性结果。应注意,与使用安慰剂的23%相比,超过61%的用抗siglec-8抗体治疗的患者展示输注相关反应(irr)。然而,95%的irr是轻度至中度的,并且未观察到其他严重不良事件(ae)。
具体实施方式
i.定义
30.应理解,本公开文本并不限于特定的组合物或生物系统,它们当然是可变的。还应理解,本文中所用术语仅用于描述特定实施方案的目的,并且不旨在具有限制性。除非上下文另外明确规定,否则如在本说明书和所附权利要求中所用的,单数形式“一个/一种(a)”、“一个/一种(an)”和“所述”包括复数指示物。因此,例如,提及“一种分子”任选地包括两种或更多种此类分子的组合等。
31.如本文所用的术语“约”是指本技术领域的技术人员容易知晓的对应值的通常误差范围。本文提及“约”某一值或参数时包括(并描述)涉及该值或参数本身的实施方案。
32.应理解,本公开文本的方面和实施方案包括“包含方面和实施方案”、“由方面和实施方案组成”和“基本上由方面和实施方案组成”。
33.术语“抗体”包括多克隆抗体、单克隆抗体(包括具有免疫球蛋白fc区的全长抗体)、具有多表位特异性的抗体组合物、多特异性抗体(例如双特异性抗体、双抗体和单链分子)、以及抗体片段(例如fab、f(ab')2和fv)。术语“免疫球蛋白”(ig)在本文中与“抗体”可互换使用。
34.基本的4链抗体单元是异四聚体的糖蛋白,其由两条相同的轻(l)链和两条相同的重(h)链构成。igm抗体由5个基本的异四聚体单元连同另外的称为j链的多肽组成,并且含有10个抗原结合位点,而iga抗体包含2-5个基本的4链单元,其可以聚合以与j链相组合形成多价组合体(assemblage)。在igg的情况下,所述4链单元通常为约150,000道尔顿。每条l链通过一个共价二硫键与h链连接,而两条h链通过一个或多个二硫键相互连接,这取决于h链同种型。每条h和l链还具有规则间隔的链内二硫桥键。每条h链在n末端具有可变结构域(vh),随后是每条α和γ链的三个恒定结构域(ch)以及μ和ε同种型的四个ch结构域。每条l链在n末端具有可变结构域(v
l
),随后是在其另一端的恒定结构域。所述v
l
与所述vh对齐并且所述c
l
与重链的首个恒定结构域(ch1)对齐。据信特定的氨基酸残基在轻链和重链可变结构域之间形成界面。vh和v
l
的配对一起形成单个抗原结合位点。关于不同类别抗体的结构和特性,参见例如basic and clinical immunology,第8版,daniel p.sties,abba i.terr和tristram g.parsolw(编辑),appleton&lange,norwalk,ct,1994,第71页和第6章。
35.基于它们恒定域的氨基酸序列,可以将来自任何脊椎动物物种的l链分配到两种清楚区分的类型(称为κ和λ)之一。根据其重链(ch)的恒定结构域的氨基酸序列,可以将免疫球蛋白分配到不同的类别或同种型。存在五类免疫球蛋白:iga、igd、ige、igg和igm,具有分别称为α、δ、ε、γ和μ的重链。基于ch序列和功能的差异相对较小,γ和α类别被进一步分为亚类,例如,人表达以下亚类:igg1、igg2、igg3、igg4、iga1和iga2。igg1抗体可以以多种多态性变体存在,称作同种异型(综述于jefferis和lefranc2009.mabs第1卷第4期1-7中),其中任一种适用于本公开文本中。人群中的常见同种异型变体是通过字母a、f、n、z表示的那些。
[0036]“分离的”抗体指已经从其产生环境(例如天然或重组)的组分中鉴定、分开和/或回收的抗体。在一些实施方案中,分离的多肽与来自其产生环境的所有其他组分都没有关联。其产生环境的污染组分(如由重组转染细胞产生的组分)是通常会干扰抗体的研究、诊断或治疗用途的材料,并且可以包括酶、激素和其他蛋白质溶质或非蛋白质溶质。在一些实施方案中,所述多肽被纯化:(1)至大于95重量%的抗体,如通过例如lowry方法测定的,并且在一些实施方案中,至大于99重量%;(1)至通过使用转杯式测序仪足以获得n末端或内部氨基酸序列的至少15个残基的程度,或(3)至使用考马斯蓝或银染在非还原或还原条件下通过sds-page测得的同质性。分离的抗体包括重组细胞内的原位抗体,因为抗体的天然环境的至少一种组分将不存在。然而,通常通过至少一个纯化步骤来制备分离的多肽或抗体。
[0037]
如本文所用的术语“单克隆抗体”是指从基本上同质的抗体群获得的抗体,即,除了可能少量存在的可能的天然存在的突变和/或翻译后修饰(例如异构化、酰胺化)之外,构成所述群体的各个抗体是相同的。在一些实施方案中,单克隆抗体在重链和/或轻链处具有c末端切割。例如,在重链和/或轻链的c末端处切割1、2、3、4或5个氨基酸残基。在一些实施方案中,所述c末端切割从重链去除c末端赖氨酸。在一些实施方案中,单克隆抗体在重链和/或轻链处具有n末端切割。例如,在重链和/或轻链的n末端处切割1、2、3、4或5个氨基酸残基。在一些实施方案中,单克隆抗体是高度特异性的,针对单一抗原位点。在一些实施方案中,单克隆抗体是高度特异性的,针对多个抗原性位点(如双特异性抗体或多特异性抗体)。修饰语“单克隆”指示抗体的特征为:其是从基本上同质的抗体群体获得,并且不应解释为需要通过任何特定方法产生抗体。例如,要根据本公开文本使用的单克隆抗体可通过多种技术来制备,包括例如杂交瘤法、重组dna法、噬菌体展示技术,以及用于在具有部分或全部的人免疫球蛋白基因座或编码人免疫球蛋白序列的基因的动物中生成人或类人抗体的技术。
[0038]
术语“裸抗体”是指未与细胞毒性部分或放射性标记缀合的抗体。
[0039]
术语“全长抗体”、“完整抗体(intact antibody)”或“整个抗体(whole antibody)”可互换使用,以指代呈基本上完整形式的抗体,与抗体片段相反。具体地,整个抗体包括具有重链和轻链(包括fc区)的抗体。恒定结构域可以是天然序列恒定结构域(例如,人天然序列恒定结构域)或其氨基酸序列变体。在一些情况下,完整抗体可以具有一种或多种效应物功能。
[0040]“抗体片段”包含完整抗体的一部分、所述完整抗体的抗原结合区和/或可变区。抗体片段的例子包括fab、fab'、f(ab')2和fv片段;双抗体;线性抗体(参见美国专利号5,641,870,实施例2;zapata等人,protein eng.8(10):1057-1062[1995]);单链抗体分子和从抗体片段形成的多特异性抗体。
[0041]
抗体的木瓜蛋白酶消化产生两个相同的抗原结合片段,称为“fab”片段,和残留的“fc”片段,这一名称反映了容易结晶的能力。fab片段由整条l链连同h链的可变区结构域(vh)和一条重链的首个恒定结构域(ch1)组成。就抗原结合而言,每个fab片段是单价的,即,它具有单个抗原结合位点。抗体的胃蛋白酶处理产生单个大的f(ab')2片段,其大致对应于具有不同抗原结合活性的两个二硫键连接的fab片段,并且仍然能够交联抗原。fab'片段与fab片段的不同之处在于在所述ch1结构域的羧基末端具有一些另外的残基,包括来自抗体
596(1992)。还参见例如,vaswani和hamilton,ann.allergy,asthma&immunol.1:105-115(1998);harris,biochem.soc.transactions 23:1035-1038(1995);hurle和gross,curr.op.biotech.5:428-433(1994);以及美国专利号6,982,321和7,087,409。在一些实施方案中,人源化抗体针对单一抗原性位点。在一些实施方案中,人源化抗体针对多个抗原性位点。替代性的人源化方法描述于美国专利号7,981,843和美国专利申请公开号2006/0134098中。
[0048]
抗体的“可变区”或“可变结构域”是指抗体重链或轻链的氨基末端结构域。重链和轻链的可变结构域可以分别称为“vh”和“vl”。这些结构域通常是抗体中最可变的部分(相对于同一类别的其他抗体)并且含有抗原结合位点。
[0049]
当在本文中使用时,术语“高变区”、“hvr”或“hv”是指抗体可变结构域中序列高变和/或形成结构上确定的环的区域。通常,抗体包含六个hvr:三个在vh中(h1、h2、h3),并且三个在vl中(l1、l2、l3)。在天然抗体中,h3和l3显示出六个hvr的最大多样性,并且特别是相信h3在将良好的特异性赋予抗体方面发挥独特的作用。参见例如,xu等人immunity 13:37-45(2000);johnson和wu,methods in molecular biology 248:1-25(lo,编辑,human press,托托瓦,新泽西州,2003)。事实上,仅由重链组成的天然存在的骆驼抗体在不存在轻链时是有功能的且稳定的。参见例如,hamers-casterman等人,nature 363:446-448(1993)以及sheriff等人,nature struct.biol.3:733-736(1996)。
[0050]
本文使用并且涵盖许多hvr描绘。作为kabat互补决定区(cdr)的hvr是基于序列变异性,并且是最常用的(kabat等人,sequences of proteins of immunological interest,第5版public health service,national institute of health,贝塞斯达,马里兰州(1991))。chothia hvr代替地指结构环的位置(chothia和lesk j.mol.biol.196:901-917(1987))。“contact”hvr是基于对可得复杂晶体结构的分析。来自这些hvr中的每一个的残基描述于下文中。
[0051]
除非另有指示,否则可变结构域残基(hvr残基和框架区残基)是根据上文kabat等人编号的。
[0052]“框架”或“fr”残基是除了如本文定义的hvr残基以外的那些可变结构域残基。
[0053]
表述“如kabat中的可变结构域残基编号”或“如kabat中的氨基酸位置编号”及其变体是指kabat等人(同上)中的用于抗体编译的重链可变结构域或轻链可变结构域的编号系统。使用此编号系统,实际线性氨基酸序列可以含有较少的或另外的氨基酸,所述氨基酸对应于可变结构域的fr或hvr的缩短或插入。例如,重链可变结构域可以包括在h2的残基52之后的单一氨基酸插入(根据kabat的残基52a)和重链fr残基82之后插入的残基(例如,根据kabat的残基82a、82b和82c等)。可以通过将抗体序列同源性区域与“标准”kabat编号的
序列比对来确定给定抗体的残基的kabat编号。
[0054]
出于本文目的,“受体人框架”是包含源自人免疫球蛋白框架或人共有框架的vl或vh框架的氨基酸序列的框架。“源自”人免疫球蛋白框架或人共有框架的受体人框架可以包含其相同的氨基酸序列,或者它可以含有预先存在的氨基酸序列变化。在一些实施方案中,预先存在的氨基酸变化的数量是10个或更少、9个或更少、8个或更少、7个或更少、6个或更少、5个或更少、4个或更少、3个或更少或者2个或更少。
[0055]
关于参考多肽序列的“氨基酸序列同一性百分比(%)”定义为在用以实现最大百分比序列同一性并且不将任何保守取代视为序列同一性的一部分而比对序列和引入缺口(如果需要)后,候选序列中与所述参考多肽序列中的氨基酸残基相同的氨基酸残基的百分比。用于确定氨基酸序列同一性百分比的目的的比对可以以本领域熟知的多种方式来实现,例如,使用公众可获得的计算机软件,如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员可以确定用于比对序列的适当参数,包括对所比较序列的全长实现最大比对所需的任何算法。例如,给定氨基酸序列a对/与/相对于给定氨基酸序列b的氨基酸序列同一性%(或者这可以用短语表示为对/与/相对于给定氨基酸序列b具有或包含特定%氨基酸序列同一性的给定氨基酸序列a)计算如下:分数x/y乘100其中x是由序列在所述程序的a和b比对中得分为相同匹配的氨基酸残基数,且其中y是b中的氨基酸残基总数。应理解,如果氨基酸序列a的长度与氨基酸序列b的长度不相等,则a相对于b的氨基酸序列同一性%将不等于b相对于a的氨基酸序列同一性%。
[0056]
与特定多肽或特定多肽上的表位“结合”或“特异性结合”或者对其“具有特异性”的抗体是与该特定多肽或特定多肽上的表位结合且基本上不与任何其他多肽或多肽表位结合的抗体。在一些实施方案中,如通过本领域已知方法(例如,酶联免疫吸附测定(elisa))测量的,本文所述的抗siglec-8抗体(例如,与人siglec-8结合的抗体)对无关的非siglec-8多肽的结合低于所述抗体对siglec-8的结合的约10%。在一些实施方案中,与siglec-8结合的抗体(例如,与人siglec-8结合的抗体)具有≤1μm、≤100nm、≤10nm、≤2nm、≤1nm、≤0.7nm、≤0.6nm、≤0.5nm、≤0.1nm、≤0.01nm或≤0.001nm(例如10-8
m或更小,例如10-8
m至10-13
m,例如10-9
m至10-13
m)的解离常数(kd)。
[0057]
术语“抗siglec-8抗体”或“与人siglec-8结合的抗体”是指与人siglec-8的多肽或表位结合而基本上不与无关的非siglec-8多肽的任何其他多肽或表位结合的抗体。
[0058]
如本文所用,术语“siglec-8”是指人siglec-8蛋白。所述术语还包括天然存在的siglec-8变体,包括剪接变体或等位基因变体。一种示例性人siglec-8的氨基酸序列示于seq id no:72中。另一种示例性人siglec-8的氨基酸序列示于seq id no:73中。在一些实施方案中,人siglec-8蛋白包含与免疫球蛋白fc区融合的人siglec-8细胞外结构域。与免疫球蛋白fc区融合的示例性人siglec-8细胞外结构域的氨基酸序列示于seq id no:74中。seq id no:74中加下划线的氨基酸序列指示siglec-8fc融合蛋白氨基酸序列的fc区。人siglec-8氨基酸序列gyllqvqelvtvqeglcvhvpcsfsypqdgwtdsdpvhgywfragdrpyqdapvatnnpdrevqaetqgrfqllgdiwsndcslsirdarkrdkgsyffrlergsmkwsyksqlnyktkqlsvfvtalthrpdililgtlesghsrnltcsvpwackqgtppmiswigasvsspgpttarssvltltpkpqdhgtsltcqvtlpgtgvtttstvrldvsy
ppwnltmtvfqgdatastalgngsslsvlegqslrlvcavnsnpparlswtrgsltlcpsrssnpgllelprvhvrdegeftcraqnaqgsqhislslslqnegtgtsrpvsqvtlaavggagatalaflsfciifiivrscrkksarpaagvgdtgmedakairgsasqgplteswkdgnplkkpppavapssgeegelhyatlsfhkvkpqdpqgqeatdseyseikihkretaetqaclrnhnpsskevrg(seq id no:72)人siglec-8氨基酸序列gyllqvqelvtvqeglcvhvpcsfsypqdgwtdsdpvhgywfragdrpyqdapvatnnpdrevqaetqgrfqllgdiwsndcslsirdarkrdkgsyffrlergsmkwsyksqlnyktkqlsvfvtalthrpdililgtlesghprnltcsvpwackqgtppmiswigasvsspgpttarssvltltpkpqdhgtsltcqvtlpgtgvtttstvrldvsyppwnltmtvfqgdatastalgngsslsvlegqslrlvcavnsnpparlswtrgsltlcpsrssnpgllelprvhvrdegeftcraqnaqgsqhislslslqnegtgtsrpvsqvtlaavggagatalaflsfciifiivrscrkksarpaagvgdtgmedakairgsasqgplteswkdgnplkkpppavapssgeegelhyatlsfhkvkpqdpqgqeatdseyseikihkretaetqaclrnhnpsskevrg(seq id no:73)siglec-8fc融合蛋白氨基酸序列gyllqvqelvtvqeglcvhvpcsfsypqdgwtdsdpvhgywfragdrpyqdapvatnnpdrevqaetqgrfqllgdiwsndcslsirdarkrdkgsyffrlergsmkwsyksqlnyktkqlsvfvtalthrpdililgtlesghsrnltcsvpwackqgtppmiswigasvsspgpttarssvltltpkpqdhgtsltcqvtlpgtgvtttstvrldvsyppwnltmtvfqgdatastalgngsslsvlegqslrlvcavnsnpparlswtrgsltlcpsrssnpgllelprvhvrdegeftcraqnaqgsqhislslslqnegtgtsrpvsqvtlaavggiegrsdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:74)
[0059]“诱导凋亡”的或“凋亡性的”抗体是如通过标准凋亡测定所确定,诱导程序性细胞死亡的那些抗体,所述标准凋亡测定如膜联蛋白v结合、dna断裂、细胞收缩、内质网扩张、细胞碎裂和/或膜囊泡(称作凋亡小体)形成。例如,本公开文本的抗siglec-8抗体(例如,与人siglec-8结合的抗体)的凋亡活性可通过用膜联蛋白v对细胞染色来显示。
[0060]
抗体“效应子功能”是指归因于抗体fc区(天然序列fc区或氨基酸序列变体fc区)且随抗体同种型而变化的那些生物活性。抗体效应子功能的例子包括:c1q结合和补体依赖性细胞毒性;fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;细胞表面受体(例如,b细胞受体)下调;以及b细胞激活。
[0061]“抗体依赖性细胞介导的细胞毒性”或“adcc”是指其中结合到某些细胞毒性细胞(例如自然杀伤(nk)细胞、嗜中性粒细胞和巨噬细胞)上存在的fc受体(fcr)上的分泌ig使得这些细胞毒性效应细胞能够与携带抗原的靶细胞特异性结合,随后用细胞毒素杀死靶细胞的细胞毒性形式。所述抗体“武装”细胞毒性细胞,并且是通过此机制杀死靶细胞所要求的。介导adcc的原代细胞nk细胞仅表达fcγriii,而单核细胞表达fcγri、fcγrii和fcγriii。造血细胞上的fc表达归纳于ravetch和kinet,annu.rev.immunol.9:457-92(1991)的第464页上的表3中。在一些实施方案中,本文描述的抗siglec-8抗体(例如,与人siglec-8结合的抗体)增强adcc。为了评估目的分子的adcc活性,可以进行体外adcc测定,如美国专利号5,500,362或5,821,337中所述的体外adcc测定。用于此类测定的有用效应细胞包括外周血单个核细胞(pbmc)和自然杀伤(nk)细胞。可替代地或另外地,可以在体内(例如,在动
物模型中,如在clynes等人,pnas usa 95:652-656(1998)中所披露的动物模型中)评估目的分子的adcc活性。改变adcc活性和其他抗体特性的其他fc变体包括以下文献中披露的那些:ghetie等人,nat biotech.15:637-40,1997;duncan等人,nature 332:563-564,1988;lund等人,j.immunol 147:2657-2662,1991;lund等人,mol immunol 29:53-59,1992;alegre等人,transplantation 57:1537-1543,1994;hutchins等人,proc natl.acad sci usa 92:11980-11984,1995;jefferis等人,immunol lett.44:111-117,1995;lund等人,faseb j9:115-119,1995;jefferis等人,immunol lett 54:101-104,1996;lund等人,j immunol 157:4963-4969,1996;armour等人,eur j immunol29:2613-2624,1999;idusogie等人,j immunol 164:4178-4184,200;reddy等人,j immunol164:1925-1933,2000;xu等人,cell immunol 200:16-26,2000;idusogie等人,j immunol166:2571-2575,2001;shields等人,j biol chem 276:6591-6604,2001;jefferis等人,immunol lett 82:57-65.2002;presta等人,biochem soc trans 30:487-490,2002;lazar等人,proc.natl.acad.sci.usa 103:4005-4010,2006;美国专利号5,624,821;5,885,573;5,677,425;6,165,745;6,277,375;5,869,046;6,121,022;5,624,821;5,648,260;6,194,551;6,737,056;6,821,505;6,277,375;7,335,742;和7,317,091。
[0062]
本文的术语“fc区”用于定义免疫球蛋白重链的c末端区,包括天然序列fc区和变体fc区。尽管免疫球蛋白重链的fc区的边界可以变化,但是人igg重链fc区通常被定义为从位置cys226或从pro230处的氨基酸残基延伸至其羧基末端。用于本公开文本的抗体的合适的天然序列fc区包括人igg1、igg2、igg3和igg4。可以引入单一氨基酸取代(根据kabat编号的s228p;称为igg4pro)以消除在重组igg4抗体中观察到的异质性。参见angal,s.等人(1993)mol immunol 30,105-108。
[0063]“未岩藻糖基化的”或“缺乏岩藻糖的”抗体是指包含如下fc区的糖基化抗体变体,其中附接至fc区的碳水化合物结构具有减少的岩藻糖或缺乏岩藻糖。在一些实施方案中,具有减少的岩藻糖或缺乏岩藻糖的抗体具有改善的adcc功能。相对于细胞系中产生的相同抗体上岩藻糖的量,未岩藻糖基化的或缺乏岩藻糖的抗体具有减少的岩藻糖。在一些实施方案中,本文中考虑的未岩藻糖基化的或缺乏岩藻糖的抗体组合物是如下组合物,其中少于约50%的附接至组合物中抗体的fc区的n连接的聚糖包含岩藻糖。
[0064]
术语“岩藻糖基化”或“岩藻糖基化的”是指在附接至抗体肽主链的寡糖内存在岩藻糖残基。具体而言,岩藻糖基化的抗体在附接至抗体fc区的n连接的寡糖之一或二者中最内部n-乙酰基葡糖胺(glcnac)残基处(例如,人igg1fc结构域的位置asn 297(fc区残基的eu编号))包含α(l,6)连接的岩藻糖。由于免疫球蛋白中的微小序列变异,asn297也可以位于位置297的上游或下游约 3个氨基酸处,即在位置294位与位置300之间。
[0065]“岩藻糖基化程度”是岩藻糖基化的寡糖相对于通过本领域已知方法鉴定的所有寡糖的百分比,例如,在经n-糖苷酶f处理的抗体组合物中通过基质辅助激光解吸-电离飞行时间质谱术(maldi tof ms)评估的。在“完全岩藻糖基化的抗体”的组合物中,基本上所有寡糖都包含岩藻糖残基,即是岩藻糖基化的。在一些实施方案中,完全岩藻糖基化的抗体的组合物中岩藻糖基化程度为至少约90%。因此,这种组合物中的单独抗体通常在fc区的两个n连接的寡糖的每一个中包含岩藻糖残基。相反,在“完全未岩藻糖基化的”抗体的组合物中,寡糖基本上都没有岩藻糖基化,而且这种组合物中的单独抗体在fc区的两个n连接的
寡糖的任一个中不含岩藻糖残基。在一些实施方案中,完全未岩藻糖基化的抗体的组合物具有少于约10%的岩藻糖基化的程度。在“部分岩藻糖基化的抗体”的组合物中,只有部分寡糖包含岩藻糖。这种组合物中的单独抗体在fc区中没有、有一个或有两个n连接的寡糖可以包含岩藻糖残基,前提是所述组合物包含的基本上所有单独抗体在fc区中n连接的寡糖中都不缺乏岩藻糖残基,并且基本上所有单独抗体在fc区中的两个n连接的寡糖中都不含岩藻糖残基。在一个实施方案中,部分岩藻糖基化的抗体的组合物具有约10%至约80%(例如约50%至约80%、约60%至约80%、或约70%至约80%)的岩藻糖基化的程度。
[0066]
如本文所用的“结合亲和力”是指在分子(例如,抗体)的单一结合位点与其结合配偶体(例如,抗原)之间非共价相互作用的强度。在一些实施方案中,抗体对siglec-8(其可以是二聚体,如本文所述的siglec-8-fc融合蛋白)的结合亲和力通常可以通过解离常数(kd)来表示。亲和力可以通过本领域已知的常见方法(包括本文所述的那些)来测量。
[0067]
如本文所用的“结合亲合力”是指分子(例如,抗体)的多个结合位点与其结合配偶体(例如,抗原)的结合强度。
[0068]
编码本文的抗体的“分离的”核酸分子是已经鉴定且与产生它的环境中通常与之相连的至少一种污染物核酸分子分开的核酸分子。在一些实施方案中,分离的核酸与同产生环境相关的所有组分都没有关联。编码本文的多肽和抗体的分离的核酸分子的形式所呈形式不同于在自然界中发现它的形式或设定。因此,分离的核酸分子与细胞中天然存在的编码本文多肽和抗体的核酸不同。
[0069]
术语“药物配制品”是指如下制剂:其所呈形式允许活性成分的生物活性有效,并且不含对将被施用所述配制品的个体具有不可接受的毒性的另外的组分。此类配制品是无菌的。
[0070]
如本文所用的“载体”包括药学上可接受的载体、赋形剂或稳定剂,它们在所采用的剂量和浓度下对暴露于其的细胞或哺乳动物是无毒的。通常,生理学上可接受的载体是ph缓冲水溶液。生理学上可接受的载体的例子包括缓冲液,如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸;低分子量(小于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖醇,如甘露醇或山梨糖醇;成盐反离子,如钠;和/或非离子型表面活性剂,如tween
tm
、聚乙二醇(peg)和pluronics
tm
。
[0071]
如本文所用,术语“治疗(treatment)”或“治疗(treating)”是指设计用于在临床病理学的过程期间改变所治疗个体或细胞的自然进程的临床干预。所需治疗效果包括降低疾病进展速率、改善或缓和疾病状态、以及消退或改进的预后。例如,如果与疾病相关的一种或多种症状被减轻或消除,则个体被成功“治疗”。例如,如果治疗导致提高患有疾病的那些人的生活质量、减少治疗疾病所需的其他药物的剂量、降低疾病复发的频率、减轻疾病的严重程度、延迟疾病的发展或进展和/或延长个体的存活时间,则个体被成功“治疗”。
[0072]
如本文所用,“与
……
结合”或“与
……
组合”是指除了一种治疗模态以外,施用另一种治疗模态。因此,“与
……
结合”或“与
……
组合”是指在向个体施用一种治疗模态之前、期间或之后,施用另一种治疗模态。
[0073]
如本文所用,术语“预防(prevention)”或“预防(preventing)”包括针对个体中疾
病的发生或复发提供预防。个体可能易患疾病、对疾病易感、或有患上疾病的风险,但尚未被诊断为患有所述疾病。在一些实施方案中,本文所述的抗siglec-8抗体(例如,与人siglec-8结合的抗体)用于延缓疾病的发展。
[0074]
如本文所用,“有风险”患上疾病的个体可以具有或可以没有可检测疾病或疾病的症状,并且在本文所述的治疗方法之前可以展示或可以不展示可检测疾病或疾病的症状。如本领域已知,“有风险”表示个体具有一种或多种风险因子,它们是与病症的发展有关的可测量参数。具有这些风险因子中的一种或多种的个体患上疾病的概率高于不具有这些风险因子中的一种或多种的个体。
[0075]“有效量”是指至少在必需的剂量和时间段下,有效实现所需的或指示的效果(包括治疗或预防结果)的量。有效量可以在一次或多次施用中提供。“治疗有效量”是至少实现特定疾病的可测量改善所需的最小浓度。本文中的治疗有效量可以多种因素而变化,所述因素如疾病状态、患者的年龄、性别和体重,以及抗体在个体中引发所需反应的能力。治疗有效量还可以是其中治疗上有益的效果超过抗体的任何毒性或有害影响的量。“预防有效量”是指在必需的剂量和时间段下,有效实现所需预防结果的量。通常但不是必需地,因为预防剂量是在疾病之前或在疾病的较早期阶段对个体使用,所以预防有效量可以小于治疗有效量。
[0076]“长期”施用是指与短期模式相反,以连续模式施用一种或多种药剂,以将初始治疗效果(活性)维持延长的时间段。“间歇”施用是如下治疗:其并非不中断地连续进行,而是呈周期性的。
[0077]
术语“药品说明书”用于指代通常在治疗产品的商业包装中所包括的说明书,所述说明书含有关于使用此类治疗产品的适应症、用法、剂量、施用、组合疗法、禁忌症和/或警告的信息。
[0078]
如本文所用,“个体”或“受试者”是哺乳动物。用于治疗目的的“哺乳动物”包括人、家畜和农场动物,以及动物园、运动或宠物动物,如狗、马、兔、牛、猪、仓鼠、沙鼠、小鼠、雪貂、大鼠、猫等。在一些实施方案中,个体或受试者是人。ii.方法
[0079]
本文提供用于将包含与人siglec-8结合的抗体的组合物施用至个体的方法,其中在所述第一剂量的组合物(即,包含与人siglec-8结合的抗体)的施用之前至少6小时将皮质类固醇施用至所述个体。在一些实施方案中,所述方法包括将皮质类固醇施用至所述个体,然后在施用所述皮质类固醇之后至少6小时向所述个体施用第一剂量的所述组合物(即,包含与人siglec-8结合的抗体)。在一些实施方案中,在所述组合物的施用之前至少12小时将所述皮质类固醇施用至所述个体。在一些实施方案中,在所述组合物的施用之前24小时(例如,之前6-24小时,或之前12-24小时)内将所述皮质类固醇施用至所述个体。不希望受限于理论,认为皮质类固醇施用可以帮助降低与所述抗siglec-8抗体的施用相关的irr的风险和/或严重性。在一些实施方案中,所述个体是人。
[0080]
本文提供用于将包含与人siglec-8结合的抗体的组合物施用至个体的方法,其中将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。在一些实施方案中,在所述第一剂量的组合物(即,包含与人siglec-8结合的抗体)的施用之前至少6小时将皮质类固醇施用至所述个体。在一些实施方案中,所述方法包括将皮质类固醇施用
至所述个体,然后在施用所述皮质类固醇之后至少6小时向所述个体施用第一剂量的所述组合物(即,包含与人siglec-8结合的抗体),其中将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。不希望受限于理论,认为对于所述第一剂量较长的输注时间和/或较慢的输注速率可以帮助降低与所述抗siglec-8抗体的施用相关的irr的风险和/或严重性。在一些实施方案中,所述个体是人。
[0081]
在一些实施方案中,所述皮质类固醇是泼尼松。在一些实施方案中,所述皮质类固醇是甲泼尼龙、氢化可的松或地塞米松。在一些实施方案中,所述皮质类固醇是泼尼松、可的松、地塞米松、氢化可的松、甲泼尼龙或泼尼松龙。在一些实施方案中,所述皮质类固醇由用所述抗siglec-8抗体治疗的个体自我施用。在一些实施方案中,口服施用所述皮质类固醇。
[0082]
在一些实施方案中,所述皮质类固醇(例如,泼尼松)是以大于0.5mg/kg或约1mg/kg的剂量来施用。在一些实施方案中,所述皮质类固醇(例如,泼尼松)是以80mg的剂量来施用。例如,在一些实施方案中,所述方法包括在所述第一剂量的抗siglec-8抗体的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)、6-24小时或12-24小时向所述个体施用大于0.5mg/kg泼尼松。在一些实施方案中,所述方法包括在所述第一剂量的抗siglec-8抗体的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)、6-24小时或12-24小时向所述个体施用0.5mg/kg至1mg/kg泼尼松。在一些实施方案中,所述方法包括在所述第一剂量的抗siglec-8抗体的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)、6-24小时或12-24小时向所述个体施用1mg/kg泼尼松。在一些实施方案中,所述方法包括在所述第一剂量的抗siglec-8抗体的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)、6-24小时或12-24小时向所述个体施用60mg或80mg泼尼松。
[0083]
在一些实施方案中,如与在没有将所述皮质类固醇在之前至少6小时施用的情况下所述第一剂量的施用相比,将所述皮质类固醇在所述第一剂量的施用之前至少6小时施用降低所述个体中输注相关反应(irr)的风险。在一些实施方案中,如与在没有将所述皮质类固醇在之前至少12小时施用的情况下所述第一剂量的施用相比,将所述皮质类固醇在所述第一剂量的施用之前至少12小时施用降低所述个体中输注相关反应(irr)的风险。在一些实施方案中,如与在没有将所述皮质类固醇在之前12-24小时施用的情况下所述第一剂量的施用相比,将所述皮质类固醇在所述第一剂量的施用之前12-24小时施用降低所述个体中输注相关反应(irr)的风险。在一些实施方案中,如与在没有将所述皮质类固醇在之前至少6小时施用的情况下所述第一剂量的施用相比,将所述皮质类固醇在所述第一剂量的施用之前至少6小时施用降低所述个体中输注相关反应(irr)的严重性。在一些实施方案中,如与在没有将所述皮质类固醇在之前至少12小时施用的情况下所述第一剂量的施用相比,将所述皮质类固醇在所述第一剂量的施用之前至少12小时施用降低所述个体中输注相关反应(irr)的严重性。在一些实施方案中,如与在没有将所述皮质类固醇在之前12-24小时施用的情况下所述第一剂量的施用相比,将所述皮质类固醇在所述第一剂量的施用之前12-24小时施用降低所述个体中输注相关反应(irr)的严重性。
[0084]
在一些实施方案中,将所述第一剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。在一些实施方案中,在所述输注的前2小时中将所述第一剂量的总体积
的小于50%施用至所述个体。在一些实施方案中,在所述输注的前2小时中将所述第一剂量的总体积的小于30%施用至所述个体。在一些实施方案中,将所述第一剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:1ml/小时持续15分钟、5ml/小时持续15分钟、10ml/小时持续30分钟、15ml/小时持续30分钟、25ml/小时持续30分钟、30ml/小时持续30分钟、35ml/小时持续30分钟以及40ml/小时持续62分钟。在一些实施方案中,将所述第一剂量通过静脉内输注根据表a中显示的时间表施用至所述个体。表a.用于4小时输注的输注速率时间表。
[0085]
在一些实施方案中,如与所述第一剂量通过静脉内输注经小于约4小时的时间段的施用相比,所述第一剂量的组合物通过静脉内输注经约4小时的时间段的施用降低所述个体中输注相关反应(irr)的风险。在一些实施方案中,如与所述第一剂量通过静脉内输注经小于约4小时的时间段的施用相比,所述第一剂量的组合物通过静脉内输注经约4小时的时间段的施用降低所述个体中输注相关反应(irr)的严重性。
[0086]
在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以0.1mg/kg与10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以1mg/kg与10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以0.1mg/kg与3mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以0.1mg/kg与1mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以约1mg/kg与约3mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以1mg/kg施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以3mg/kg施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以约0.1mg/kg、0.5mg/kg、1.0mg/kg、1.5mg/kg、2.0mg/kg、2.5mg/kg、3.0mg/kg、3.5mg/kg、4.0mg/kg、4.5mg/kg、5.0mg/kg、5.5mg/kg、6.0mg/kg、6.5mg/kg、7.0mg/kg、7.5mg/kg、8.0mg/kg、8.5mg/kg、9.0mg/kg、9.5mg/kg或10.0mg/kg中的任一个施用至所述个体。
[0087]
在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中经由静脉内或皮下途径施用至所述个体。
[0088]
在一些实施方案中,所述方法还包括在所述第一剂量的施用之前1-2小时将皮质类固醇施用至所述个体。也就是说,所述方法可以包括在所述第一剂量的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)、6-24小时或12-24小时施用皮质类固醇,以及在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时施用皮质类固醇。在一些实施方案中,所述皮质类固醇是泼尼松。在一些实施方案中,所
述皮质类固醇是甲泼尼龙。在一些实施方案中,所述皮质类固醇是氢化可的松或地塞米松。在一些实施方案中,口服施用所述皮质类固醇。在一些实施方案中,静脉内施用所述皮质类固醇。在一些实施方案中,所述皮质类固醇(例如,泼尼松)是在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时以大于0.5mg/kg的剂量来施用。在一些实施方案中,所述皮质类固醇(例如,泼尼松)是在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时以约1mg/kg的剂量来施用。在一些实施方案中,所述皮质类固醇(例如,泼尼松)是在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时以80mg的剂量来施用。在一些实施方案中,将所述皮质类固醇(例如,甲泼尼龙)在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时以100mg的剂量施用。
[0089]
在一些实施方案中,所述方法还包括在所述第一剂量的施用之前1-2小时将抗组胺施用至所述个体。在一些实施方案中,所述方法可以包括在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时施用抗组胺。在一些实施方案中,所述抗组胺是在一些实施方案中,口服施用所述抗组胺。在一些实施方案中,所述抗组胺(例如,西替利嗪)是在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时以10mg的剂量来施用。在一些实施方案中,所述抗组胺(例如,西替利嗪)是在所述第一剂量的施用之前40分钟至180分钟以10mg的剂量来施用。
[0090]
在一些实施方案中,所述方法还包括在所述第一剂量的施用之前1-2小时将解热药或非甾体抗炎药(nsaid)施用至所述个体。在一些实施方案中,所述方法可以包括在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时施用解热药或nsaid。在一些实施方案中,所述解热药或nsaid是对乙酰氨基酚。在一些实施方案中,口服施用所述解热药或nsaid。在一些实施方案中,所述解热药或nsaid(例如,对乙酰氨基酚)是在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时以975-1000mg的剂量来施用。
[0091]
在根据本文所述的任何实施方案的一些实施方案中,所述方法还包括向所述个体施用第二剂量的包含与人siglec-8结合的抗体的组合物。例如,可以将所述第二剂量在所述第一剂量的施用之后约28天、约4周或约1个月施用。在一些实施方案中,在没有在所述第二剂量的施用之前至少6小时、至少12小时、6-24小时或12-24小时将皮质类固醇施用至所述个体的情况下,将所述第二剂量施用至所述个体。也就是说,在一些实施方案中,将皮质类固醇在仅所述第一剂量而无后续剂量的抗siglec-8抗体的施用之前至少6小时、至少12小时、6-24小时或12-24小时施用至所述个体。
[0092]
在一些实施方案中,将所述第二剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。在一些实施方案中,在所述输注的前2小时中将所述第二剂量的总体积的小于50%施用至所述个体。在一些实施方案中,在所述输注的前2小时中将所述第二剂量的总体积的小于30%施用至所述个体。在一些实施方案中,将所述第二剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:1ml/小时持续15分钟、5ml/小时持续15分钟、10ml/小时持续30分钟、15ml/小时持续30分钟、25ml/小时持续30分钟、30ml/小时持续30分钟、35ml/小时持续30分钟以及40ml/小时持续62分钟。在一些实施方案中,将所述第二剂量通过静脉内输注根据表a中显示的时间表施用至所述个体。在一些实施方案中,将所述第一剂量和所述第二剂量通过静脉内输注根据表a中显示的时间表施用至所述个体。
[0093]
在一些实施方案中,将与人siglec-8结合的所述抗体在所述第二剂量(和任选地任何后续剂量)中以0.1mg/kg与10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第二剂量(和任选地任何后续剂量)中以1mg/kg与10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第二剂量(和任选地任何后续剂量)中以0.1mg/kg与3mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第二剂量(和任选地任何后续剂量)中以0.1mg/kg与1mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第二剂量(和任选地任何后续剂量)中以约1mg/kg与约3mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第二剂量(和任选地任何后续剂量)中以1mg/kg施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第二剂量(和任选地任何后续剂量)中以3mg/kg施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第二剂量(和任选地任何后续剂量)中以约0.1mg/kg、0.5mg/kg、1.0mg/kg、1.5mg/kg、2.0mg/kg、2.5mg/kg、3.0mg/kg、3.5mg/kg、4.0mg/kg、4.5mg/kg、5.0mg/kg、5.5mg/kg、6.0mg/kg、6.5mg/kg、7.0mg/kg、7.5mg/kg、8.0mg/kg、8.5mg/kg、9.0mg/kg、9.5mg/kg或10.0mg/kg中的任一个施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以约0.1mg/kg与约1mg/kg之间且在所述第二剂量中以约3mg/kg与约10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以约1mg/kg与约3mg/kg之间且在所述第二剂量中以约1mg/kg与约3mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以1mg/kg且在所述第二剂量中以3mg/kg施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以3mg/kg且在所述第二剂量中以10mg/kg施用至所述个体。
[0094]
在一些实施方案中,将与人siglec-8结合的所述抗体在所述第二剂量(和任选地任何后续剂量)中经由静脉内或皮下途径施用至所述个体。
[0095]
在一些实施方案中,在没有在所述第二剂量的施用之前至少6小时、至少12小时、24小时内、6-24小时或12-24小时施用皮质类固醇的情况下,施用所述第二剂量。在其他实施方案中,在所述第二剂量的施用之前至少6小时、至少12小时、24小时内、6-24小时或12-24小时将皮质类固醇施用至所述个体。在一些实施方案中,所述皮质类固醇是泼尼松。在一些实施方案中,所述皮质类固醇是甲泼尼龙、氢化可的松或地塞米松。在一些实施方案中,所述皮质类固醇由用所述抗siglec-8抗体治疗的个体自我施用。在一些实施方案中,口服施用所述皮质类固醇。在一些实施方案中,所述皮质类固醇(例如,泼尼松)是以大于0.5mg/kg或约1mg/kg的剂量来施用。在一些实施方案中,所述皮质类固醇(例如,泼尼松)是以80mg的剂量来施用。例如,在一些实施方案中,所述方法包括在所述第二剂量的抗siglec-8抗体的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)、6-24小时或12-24小时向所述个体施用大于0.5mg/kg泼尼松。在一些实施方案中,所述方法包括在所述第二剂量的抗siglec-8抗体的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)、6-24小时或12-24小时向所述个体施用1mg/kg泼尼松。在一些实施方案中,所述方法包括在所述第二剂量的抗siglec-8抗体的施用之前至少6小时(且任选地在24小时内)、至少12小时(且任选地在24小时内)、6-24小时或12-24小时向所述个体施
用80mg泼尼松。在一些实施方案中,如与在没有将所述皮质类固醇在之前至少6小时施用的情况下所述第二剂量的施用相比,将所述皮质类固醇在所述第二剂量的施用之前至少6小时施用降低所述个体中输注相关反应(irr)的风险。在一些实施方案中,如与在没有将所述皮质类固醇在之前至少12小时施用的情况下所述第二剂量的施用相比,将所述皮质类固醇在所述第二剂量的施用之前至少12小时施用降低所述个体中输注相关反应(irr)的风险。在一些实施方案中,如与在没有将所述皮质类固醇在之前12-24小时施用的情况下所述第二剂量的施用相比,将所述皮质类固醇在所述第二剂量的施用之前12-24小时施用降低所述个体中输注相关反应(irr)的风险。在一些实施方案中,如与在没有将所述皮质类固醇在之前至少6小时施用的情况下所述第二剂量的施用相比,将所述皮质类固醇在所述第二剂量的施用之前至少6小时施用降低所述个体中输注相关反应(irr)的严重性。在一些实施方案中,如与在没有将所述皮质类固醇在之前至少12小时施用的情况下所述第二剂量的施用相比,将所述皮质类固醇在所述第二剂量的施用之前至少12小时施用降低所述个体中输注相关反应(irr)的严重性。在一些实施方案中,如与在没有将所述皮质类固醇在之前12-24小时施用的情况下所述第二剂量的施用相比,将所述皮质类固醇在所述第二剂量的施用之前12-24小时施用降低所述个体中输注相关反应(irr)的严重性。在一些实施方案中,在所述第一剂量和所述第二剂量的施用之前至少6小时、至少12小时、24小时内、6-24小时或12-24小时将皮质类固醇施用至所述个体。在一些实施方案中,在所述第一剂量和所述第二剂量的施用之前至少6小时、至少12小时、24小时内、6-24小时或12-24小时,但不在所述抗siglec-8抗体的任何后续剂量之前,将皮质类固醇施用至所述个体。
[0096]
在一些实施方案中,所述方法还包括在所述第二剂量(和任选地任何后续剂量)的施用之前1-2小时将皮质类固醇施用至所述个体。在一些实施方案中,在所述第一剂量的施用之前1-2小时施用至所述个体的皮质类固醇是甲泼尼龙。在一些实施方案中,在所述第一剂量的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时将100mg甲泼尼龙施用至所述个体(例如,静脉内)。
[0097]
在一些实施方案中,所述方法还包括在所述第二剂量(和任选地任何后续剂量)的施用之前1-2小时将抗组胺施用至所述个体。在一些实施方案中,所述方法可以包括在所述第二剂量(和任选地任何后续剂量)的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时施用抗组胺。在一些实施方案中,所述抗组胺是西替利嗪。在一些实施方案中,口服施用所述抗组胺。在一些实施方案中,所述抗组胺(例如,西替利嗪)是在所述第二剂量(和任选地任何后续剂量)的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时以10mg的剂量来施用。
[0098]
在一些实施方案中,所述方法还包括在所述第二剂量(和任选地任何后续剂量)的施用之前1-2小时将解热药或非甾体抗炎药(nsaid)施用至所述个体。在一些实施方案中,所述方法可以包括在所述第二剂量(和任选地任何后续剂量)的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时施用解热药或nsaid。在一些实施方案中,所述解热药或nsaid是对乙酰氨基酚。在一些实施方案中,口服施用所述解热药或nsaid。在一些实施方案中,所述解热药或nsaid(例如,对乙酰氨基酚)是在所述第二剂量(和任选地任何后续剂量)的施用之前1小时内、约1小时、2小时内、约2小时或1-2小时以975-1000mg的剂量来施用。
[0099]
在根据本文所述的任何实施方案的一些实施方案中,所述方法还包括向所述个体
施用第三剂量的包含与人siglec-8结合的抗体的组合物(例如,在如本文所述的第二剂量的施用之后)。例如,可以将所述第三剂量在所述第二剂量的施用之后约28天、约4周或约1个月和/或在所述第一剂量的施用之后约56天、约8周或约2个月施用。在一些实施方案中,在没有在所述第三剂量的施用之前至少6小时、至少12小时、6-24小时或12-24小时将皮质类固醇施用至所述个体的情况下,将所述第三剂量施用至所述个体。
[0100]
在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约2小时至约4小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约1小时至约4小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约2小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:10ml/小时持续30分钟、25ml/小时持续15分钟、40ml/小时持续15分钟、55ml/小时持续15分钟、70ml/小时持续15分钟、85ml/小时持续15分钟以及100ml/小时持续16分钟。在一些实施方案中,将所述第三剂量通过静脉内输注根据表b中显示的时间表施用至所述个体。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约3小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:2ml/小时持续30分钟、10ml/小时持续30分钟、20ml/小时持续30分钟、40ml/小时持续30分钟以及60ml/小时持续64分钟。在一些实施方案中,将所述第三剂量通过静脉内输注根据表c中显示的时间表施用至所述个体。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:1ml/小时持续15分钟、5ml/小时持续15分钟、10ml/小时持续30分钟、15ml/小时持续30分钟、25ml/小时持续30分钟、30ml/小时持续30分钟、35ml/小时持续30分钟以及40ml/小时持续62分钟。在一些实施方案中,将所述第三剂量通过静脉内输注根据表a中显示的时间表施用至所述个体。在一些实施方案中,将所述第三剂量的组合物通过静脉内输注经约1小时的时间段施用至所述个体。在一些实施方案中,将所述第三剂量通过静脉内输注根据以下时间表按时间顺序施用至所述个体:24ml/小时持续15分钟和125.3ml/小时持续45分钟。在一些实施方案中,将所述第三剂量通过静脉内输注根据表d中显示的时间表施用至所述个体。表b.用于2小时输注的输注速率时间表。表c.用于3小时输注的输注速率时间表。
表d.用于1小时输注的输注速率时间表。
[0101]
在一些实施方案中,将所述第一剂量和所述第二剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体,并且将所述第三剂量的组合物通过静脉内输注经约1小时至约4小时的时间段施用至所述个体。例如,在一些实施方案中,将所述第一剂量、所述第二剂量和所述第三剂量通过静脉内输注经约4小时的时间段施用至所述个体,例如,根据表a来施用。在一些实施方案中,将所述第一剂量和所述第二剂量通过静脉内输注经约4小时的时间段施用至所述个体,例如,根据表a来施用,并且将所述第三剂量通过静脉内输注经约3小时的时间段施用至所述个体,例如,根据表c来施用。在一些实施方案中,将所述第一剂量和所述第二剂量通过静脉内输注经约4小时的时间段施用至所述个体,例如,根据表a来施用,并且将所述第三剂量通过静脉内输注经约2小时的时间段施用至所述个体,例如,根据表b来施用。在一些实施方案中,将所述第一剂量和所述第二剂量通过静脉内输注经约4小时的时间段施用至所述个体,例如,根据表a来施用,并且将所述第三剂量通过静脉内输注经约1小时的时间段施用至所述个体,例如,根据表d来施用。例如,如果在所述第一剂量和/或所述第二剂量的施用之后没有发生输注相关反应或发生一种或多种轻度输注相关反应,则可以将所述第三剂量在更短的输注时间中施用至所述个体,例如,根据医师的判断。
[0102]
在一些实施方案中,将与人siglec-8结合的所述抗体在所述第三剂量中以0.1mg/kg与10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第三剂量中以1mg/kg与10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第三剂量中以3mg/kg施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第三剂量中以1mg/kg施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以1mg/kg施用至所述个体,之后在所述第二剂量和所述第三剂量中以3mg/kg施用。
[0103]
在根据本文所述的任何实施方案的一些实施方案中,所述方法还包括向所述个体施用第四剂量的包含与人siglec-8结合的抗体的组合物(例如,在如本文所述的第三剂量的施用之后)。例如,可以将所述第四剂量在以下时间施用:在所述第三剂量的施用之后约28天、约4周或约1个月;在所述第二剂量的施用之后约56天、约8周或约2个月;和/或在所述第一剂量的施用之后约84天、约12周或约3个月。在一些实施方案中,在没有在所述第三剂量的施用之前至少6小时、至少12小时、6-24小时或12-24小时将皮质类固醇施用至所述个体的情况下,将所述第四剂量施用至所述个体。在一些实施方案中,将六个剂量或更多的包含与人siglec-8结合的抗体的组合物施用至所述个体(例如,每28天、每4周或每个月施用)。
[0104]
在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静
脉内输注经约2小时至约4小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注经约1小时至约4小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注经约2小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注根据以下时间表按时间顺序施用至所述个体:10ml/小时持续30分钟、25ml/小时持续15分钟、40ml/小时持续15分钟、55ml/小时持续15分钟、70ml/小时持续15分钟、85ml/小时持续15分钟以及100ml/小时持续16分钟。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注根据表b中显示的时间表施用至所述个体。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注经约3小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注根据以下时间表按时间顺序施用至所述个体:2ml/小时持续30分钟、10ml/小时持续30分钟、20ml/小时持续30分钟、40ml/小时持续30分钟以及60ml/小时持续64分钟。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注根据表c中显示的时间表施用至所述个体。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注根据以下时间表按时间顺序施用至所述个体:1ml/小时持续15分钟、5ml/小时持续15分钟、10ml/小时持续30分钟、15ml/小时持续30分钟、25ml/小时持续30分钟、30ml/小时持续30分钟、35ml/小时持续30分钟以及40ml/小时持续62分钟。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注根据表a中显示的时间表施用至所述个体。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注经约1小时的时间段施用至所述个体。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注根据以下时间表按时间顺序施用至所述个体:24ml/小时持续15分钟和125.3ml/小时持续45分钟。在一些实施方案中,将所述第四剂量和/或一个或多个后续剂量的组合物通过静脉内输注根据表d中显示的时间表施用至所述个体。
[0105]
在一些实施方案中,将所述第一剂量和所述第二剂量的组合物通过静脉内输注经约4小时的时间段施用至所述个体,并且将所述第三剂量和所述第四剂量的组合物通过静脉内输注经约1小时至约4小时的时间段施用至所述个体。例如,在一些实施方案中,将所述第一剂量、所述第二剂量、所述第三剂量和所述第四剂量通过静脉内输注经约4小时的时间段施用至所述个体,例如,根据表a来施用。在一些实施方案中,将所述第一剂量和所述第二剂量通过静脉内输注经约4小时的时间段施用至所述个体,例如,根据表a来施用,并且将所述第三剂量和/或所述第四剂量通过静脉内输注经约3小时的时间段施用至所述个体,例如,根据表c来施用。在一些实施方案中,将所述第一剂量和所述第二剂量通过静脉内输注经约4小时的时间段施用至所述个体,例如,根据表a来施用,并且将所述第三剂量和/或所述第四剂量通过静脉内输注经约2小时的时间段施用至所述个体,例如,根据表b来施用。在一些实施方案中,将所述第一剂量和所述第二剂量通过静脉内输注经约4小时的时间段施用至所述个体,例如,根据表a来施用,并且将所述第三剂量和/或所述第四剂量通过静脉内输注经约1小时的时间段施用至所述个体,例如,根据表d来施用。在一些实施方案中,将所
述第一剂量和所述第二剂量通过静脉内输注经约4小时的时间段(例如,根据表a)施用至所述个体,之后4个后续剂量(例如,每28天、每4周或每个月施用)通过静脉内输注经约1小时至约4小时的时间段(例如,根据表b、c或d)施用至所述个体。例如,如果在所述第一剂量和/或所述第二第三剂量的施用之后没有发生输注相关反应或发生一种或多种轻度输注相关反应,则可以将所述第三剂量、所述第四剂量和/或一个或多个后续剂量在更短的输注时间中施用至所述个体,例如,根据医师的判断。
[0106]
在一些实施方案中,将与人siglec-8结合的所述抗体在所述第四剂量中以0.1mg/kg与10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第四剂量中以1mg/kg与10mg/kg之间施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第四剂量中以3mg/kg施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第四剂量中以1mg/kg施用至所述个体。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以1mg/kg施用至所述个体,之后在所述第二剂量、所述第三剂量和所述第四剂量中以3mg/kg施用。在一些实施方案中,将与人siglec-8结合的所述抗体在所述第一剂量中以1mg/kg施用至所述个体,之后对于5个后续剂量(例如,每28天、每4周或每个月施用)以3mg/kg施用。
[0107]
本文所述的与人siglec-8结合的抗体可以单独地或与其他药剂组合地用于本文所述的方法中。上述这样的组合疗法涵盖组合施用(其中两种或更多种治疗剂包括于同一配制品或单独配制品中)和单独施用,在单独施用的情形中,本公开文本的抗体的施用可以在一种或多种另外的治疗剂的施用之前、同时和/或之后进行。在一些实施方案中,本文所述的抗siglec-8抗体的施用和一种或多种另外的治疗剂的施用在彼此的约一个月、约两个月、约三个月、约四个月、约五个月或约六个月内进行。在一些实施方案中,本文所述的抗siglec-8抗体的施用和一种或多种另外的治疗剂的施用在彼此的约一周、约两周或约三周内进行。在一些实施方案中,本文所述的抗siglec-8抗体的施用和一种或多种另外的治疗剂的施用在彼此的约一天、约两天、约三天、约四天、约五天或约六天内进行。
[0108]
本公开文本的方法可以用于多种适应症,例如,用于嗜酸性粒细胞和/或肥大细胞相关疾病或障碍的治疗。在一些实施方案中,要根据本公开文本的方法治疗的个体患有或已被诊断为患有特征为以下中的一种或多种的疾病或障碍:激活的嗜酸性粒细胞的增加、增加的表达siglec-8的肥大细胞的活性、嗜酸性粒细胞和/或肥大细胞的增加或者增加的嗜酸性粒细胞和/或肥大细胞的激活。在一些实施方案中,要根据本公开文本的方法治疗的个体患有或已被诊断为患有选自以下的一种或多种疾病或障碍:伴随哮喘的慢性鼻窦炎、阿司匹林加重性呼吸系统疾病、伴随鼻窦疾病的成人发病的非特应性哮喘、慢性阻塞性肺病、纤维化疾病、纤维化前疾病、晚期系统性肥大细胞增多症、惰性系统性肥大细胞增多症(ism)、炎性肠病(ibd)、嗜酸细胞性食管炎(eoe)、嗜酸细胞性胃炎(eg)、嗜酸细胞性胃肠炎(ege)、嗜酸细胞性结肠炎(eoc)、嗜酸细胞性十二指肠炎、肥大细胞胃炎或肥大细胞胃肠炎、伴随肥大细胞升高的胃炎或胃肠炎、伴随肥大细胞升高的肠易激综合征、功能性胃肠疾病、过敏性结膜炎、巨乳头状结膜炎、慢性荨麻疹、变应性支气管肺曲菌病(abpa)、过敏性哮喘、具有嗜酸性粒细胞或肥大细胞表型的哮喘、嗜酸性肉芽肿性多血管炎(egpa)、乳糜泻、胃轻瘫、嗜酸细胞增多综合征、特应性皮炎、过敏反应、血管性水肿、肥大细胞激活综合征/障碍以及嗜酸细胞性筋膜炎。在一些实施方案中,要根据本公开文本的方法治疗的个体是
人。在一些实施方案中,在所述组合物的施用之前,所述个体已进行针对上述适应症中的一种或多种(例如,eg、ege或eoe)的先前治疗(例如,护理标准治疗)但失败。在一些实施方案中,在所述组合物的施用之前,所述个体已进行针对上述适应症中的一种或多种(例如,eg、ege或eoe)的先前治疗(例如,护理标准治疗)但疾病症状未被充分控制。先前治疗的非限制性例子尤其包括质子泵抑制剂(ppi)、全身或局部皮质类固醇和/或饮食。
[0109]
在根据本文所述的任何实施方案的一些实施方案中,如与所述组合物的施用之前的嗜酸性粒细胞计数相比,所述方法导致嗜酸性粒细胞计数的减少,例如,在从所述个体(对于组织嗜酸性粒细胞计数)或外周血(对于血液嗜酸性粒细胞计数)获得的活检样品中。例如,所述个体可能患有eg、ege和/或eoe,并且所述活检样品来自胃粘膜或十二指肠粘膜。在一些实施方案中,如与所述组合物的施用之前的组织嗜酸性粒细胞计数相比,所述方法导致组织嗜酸性粒细胞计数的至少75%、至少80%、至少85%或至少90%减少,例如,在从患有eg、ege和/或eoe的个体获得的活检样品(例如,来自食道、胃粘膜或十二指肠粘膜)中。在一些实施方案中,如与所述组合物的施用之前所述个体中的一种或多种症状(例如,患有eg、ege和/或eoe的个体中腹痛、恶心、腹泻、呕吐、饭前饱腹感、食欲不振、腹部绞痛和胃气胀中的一种或多种)相比,所述方法导致所述个体中一种或多种症状的减少。在一些实施方案中,如与所述组合物的施用之前所述个体中的一种或多种症状(例如,患有eg、ege和/或eoe的个体中腹痛、恶心、腹泻、呕吐、饭前饱腹感、食欲不振、腹部绞痛和胃气胀中的一种或多种)相比,所述方法导致所述个体中一种或多种症状的严重性和/或频率的至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%或至少90%的降低。在一些实施方案中,所述方法导致至少50%、至少60%或至少70%的反应率,例如,在患有eg、ege和/或eoe的个体中。在一些实施方案中,反应率反映如与所述组合物的施用之前相比,具有组织活检嗜酸性粒细胞计数的减少和/或症状的减少的个体的百分比。在一些实施方案中,反应率反映如与所述组合物的施用之前相比,具有组织活检嗜酸性粒细胞计数的》75%减少和症状的》30%减少的个体的百分比。在一些实施方案中,如与所述组合物的施用之前所述个体中吞咽困难的严重性相比,所述方法导致所述个体中吞咽困难的严重性的至少30%、至少35%、至少40%、至少45%或至少50%的降低(例如,在患有eg、ege和/或eoe的个体中)。抗体
[0110]
本公开文本的某些方面提供与人siglec-8结合的分离的抗体(例如,与人siglec-8结合的激动剂抗体)。在一些实施方案中,本文所述的抗siglec-8抗体具有以下特征中的一种或多种:(1)结合人siglec-8;(2)结合人siglec-8的细胞外结构域;(3)以比小鼠抗体2e2和/或小鼠抗体2c4更高的亲和力结合人siglec-8;(4)以比小鼠抗体2e2和/或小鼠抗体2c4更高的亲合力结合人siglec-8;(5)在热漂移测定中的tm为约70℃-72℃或更高;(6)具有降低的岩藻糖基化程度或是未岩藻糖基化的;(7)结合在嗜酸性粒细胞上表达的人siglec-8并且诱导嗜酸性粒细胞凋亡;(8)结合在肥大细胞上表达的人siglec-8并且耗尽或减少肥大细胞的数量;(9)结合在肥大细胞上表达的人siglec-8并且抑制肥大细胞的fcεri依赖性活性(例如,组胺释放、pgd2释放、ca
2
通量和/或β-氨基己糖苷酶释放等);(10)已经被工程化以改善adcc活性;(11)结合在肥大细胞上表达的人siglec-8并且通过adcc活性(在体外和/或体内)杀死肥大细胞;(12)与人和非人灵长类动物的siglec-8结合;(13)与人
siglec-8的结构域1、结构域2和/或结构域3结合,或者结合包含人siglec-8的结构域1、结构域2和/或结构域3的siglec-8多肽(例如,本文所述的融合蛋白);以及(14)耗尽激活的嗜酸性粒细胞,其ec
50
低于小鼠抗体2e2或2c4的ec
50
。美国专利号9,546,215和/或wo 2015089117中描述的任何抗体可以在本文提供的方法、组合物和试剂盒中得到应用。
[0111]
在一方面,本公开文本提供与人siglec-8结合的抗体。在一些实施方案中,人siglec-8包含seq id no:72的氨基酸序列。在一些实施方案中,人siglec-8包含seq id no:73的氨基酸序列。在一些实施方案中,本文所述的抗体与在肥大细胞上表达的人siglec-8结合,并且耗尽或减少肥大细胞的数量。在一些实施方案中,本文所述的抗体与在肥大细胞上表达的人siglec-8结合,并且抑制肥大细胞介导的活性。
[0112]
在一方面,本发明提供与人siglec-8结合的抗体。在一些实施方案中,人siglec-8包含seq id no:72的氨基酸序列。在一些实施方案中,人siglec-8包含seq id no:73的氨基酸序列。在一些实施方案中,本文所述的抗体与人siglec-8的结构域1中的表位结合,其中结构域1包含seq id no:112的氨基酸序列。在一些实施方案中,本文所述的抗体与人siglec-8的结构域2中的表位结合,其中结构域2包含seq id no:113的氨基酸序列。在一些实施方案中,本文所述的抗体与人siglec-8的结构域3中的表位结合,其中结构域3包含seq id no:114的氨基酸序列。在一些实施方案中,本文所述的抗体与包含seq id no:116的氨基酸的融合蛋白结合,但是不与包含seq id no:115的氨基酸的融合蛋白结合。在一些实施方案中,本文所述的抗体与包含seq id no:117的氨基酸的融合蛋白结合,但是不与包含seq id no:115的氨基酸的融合蛋白结合。在一些实施方案中,本文所述的抗体与包含seq id no:117的氨基酸的融合蛋白结合,但是不与包含seq id no:116的氨基酸的融合蛋白结合。在一些实施方案中,本文所述的抗体与人siglec-8的细胞外结构域中的线性表位结合。在一些实施方案中,本文所述的抗体与人siglec-8的细胞外结构域中的构象表位结合。在一些实施方案中,本文所述的抗体与在嗜酸性粒细胞上表达的人siglec-8结合,并且诱导嗜酸性粒细胞凋亡。在一些实施方案中,本文所述的抗体与在肥大细胞上表达的人siglec-8结合,并且耗尽肥大细胞。在一些实施方案中,本文所述的抗体与在肥大细胞上表达的人siglec-8结合,并且抑制肥大细胞介导的活性。在一些实施方案中,本文所述的抗体与在肥大细胞上表达的人siglec-8结合,并且通过adcc活性杀死肥大细胞。在一些实施方案中,本文所述的抗体耗尽肥大细胞并且抑制肥大细胞激活。在一些实施方案中,本文的抗体耗尽激活的嗜酸性粒细胞并且抑制肥大细胞激活。在一些实施方案中,本文的抗体(例如,未岩藻糖基化抗siglec-8抗体)耗尽血液嗜酸性粒细胞并且抑制肥大细胞激活。在一些实施方案中,本文的抗体(例如,未岩藻糖基化抗siglec-8抗体)耗尽来自外周血的嗜酸性粒细胞并且抑制肥大细胞激活。
[0113]
本文提供分离的抗siglec-8抗体,其与人siglec-8和非人灵长类动物siglec-8结合。具有灵长类动物交叉反应性的抗体的鉴定对于非人灵长类动物中抗siglec-8抗体的临床前测试将是有用的。在一方面,本发明提供与非人灵长类动物siglec-8结合的抗体。在一方面,本发明提供与人siglec-8和非人灵长类动物siglec-8结合的抗体。在一些实施方案中,非人灵长类动物siglec-8包含seq id no:118的氨基酸序列或其一部分。在一些实施方案中,非人灵长类动物siglec-8包含seq id no:119的氨基酸序列或其一部分。在一些实施方案中,非人灵长类动物是狒狒(例如,东非狒狒(papio anubis))。在一些实施方案中,与
人siglec-8和非人灵长类动物siglec-8结合的抗体与人siglec-8的结构域1中的表位结合。在另一个实施方案中,人siglec-8的结构域1包含seq id no:112的氨基酸序列。在一些实施方案中,与人siglec-8和非人灵长类动物siglec-8结合的抗体与人siglec-8的结构域3中的表位结合。在另一个实施方案中,人siglec-8的结构域3包含seq id no:114的氨基酸序列。在一些实施方案中,与人siglec-8和非人灵长类动物siglec-8结合的抗体是人源化抗体、嵌合抗体或人抗体。在一些实施方案中,与人siglec-8和非人灵长类动物siglec-8结合的抗体是鼠抗体。在一些实施方案中,与人siglec-8和非人灵长类动物siglec-8结合的抗体是人igg1抗体。
[0114]
在一方面,本文所述的抗siglec-8抗体是单克隆抗体。在一方面,本文所述的抗siglec-8抗体是抗体片段(包括抗原结合片段),例如,fab、fab'-sh、fv、scfv或(fab')2片段。在一方面,本文所述的抗siglec-8抗体包含抗体片段(包括抗原结合片段),例如,fab、fab'-sh、fv、scfv或(fab')2片段。在一方面,本文所述的抗siglec-8抗体是嵌合、人源化或人抗体。在一方面,本文所述的任何抗siglec-8抗体被纯化。
[0115]
在一方面,提供与鼠2e2抗体和鼠2c4抗体竞争结合至siglec-8的抗siglec-8抗体。还提供与鼠2e2抗体和鼠2c4抗体结合至相同表位的抗siglec-8抗体。针对siglec-8的鼠抗体,即2e2和2c4抗体,描述于以下文献中:美国专利号8,207,305;美国专利号8,197,811、美国专利号7,871,612和美国专利号7,557,191。
[0116]
在一方面,提供与本文所述的任何抗siglec-8抗体(例如heka、hekf、1c3、1h10、4f11、2c4、2e2)竞争结合至siglec-8的抗siglec-8抗体。还提供与本文所述的任何抗siglec-8抗体(例如heka、hekf、1c3、1h10、4f11、2c4、2e2)结合至相同表位的抗siglec-8抗体。
[0117]
在本公开文本的一方面,提供编码抗siglec-8抗体的多核苷酸。在某些实施方案中,提供包含编码抗siglec-8抗体的多核苷酸的载体。在某些实施方案中,提供包含此类载体的宿主细胞。在本公开文本的另一方面,提供包含抗siglec-8抗体的组合物或编码抗siglec-8抗体的多核苷酸。在某些实施方案中,本公开文本的组合物是用于本公开文本的嗜酸性粒细胞或肥大细胞相关疾病或障碍的治疗的药物配制品。
[0118]
在一方面,本文提供抗siglec-8抗体,其包含鼠抗体2c4的1、2、3、4、5或6个hvr序列。在一方面,本文提供抗siglec-8抗体,其包含鼠抗体2e2的1、2、3、4、5或6个hvr序列。在一些实施方案中,hvr是kabat cdr或chothia cdr。
[0119]
在一方面,本文提供抗siglec-8抗体,其包含鼠抗体1c3的1、2、3、4、5或6个hvr序列。在一方面,本文提供抗siglec-8抗体,其包含鼠抗体4f11的1、2、3、4、5或6个hvr序列。在一方面,本文提供抗siglec-8抗体,其包含鼠抗体1h10的1、2、3、4、5或6个hvr序列。在一些实施方案中,hvr是kabat cdr或chothia cdr。
[0120]
在一些实施方案中,本文所述的抗体与人siglec-8的结构域1中的表位结合,其中结构域1包含seq id no:112的氨基酸序列。在一些实施方案中,本文所述的抗体与人siglec-8的结构域2中的表位结合,其中结构域2包含seq id no:113的氨基酸序列。在一些实施方案中,本文所述的抗体与人siglec-8的结构域3中的表位结合,其中结构域3包含seq id no:114的氨基酸序列。
[0121]
在一些实施方案中,本文所述的抗体与包含seq id no:116的氨基酸的融合蛋白
结合,但是不与包含seq id no:115的氨基酸的融合蛋白结合。在一些实施方案中,本文所述的抗体与包含seq id no:117的氨基酸的融合蛋白结合,但是不与包含seq id no:115的氨基酸的融合蛋白结合。在一些实施方案中,本文所述的抗体与包含seq id no:117的氨基酸的融合蛋白结合,但是不与包含seq id no:116的氨基酸的融合蛋白结合。
[0122]
在另一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:88的氨基酸序列的hvr-h1,(ii)含有seq id no:91的氨基酸序列的hvr-h2,以及(iii)含有seq id no:94的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:97的氨基酸序列的hvr-l1,(ii)含有seq id no:100的氨基酸序列的hvr-l2,以及(iii)含有seq id no:103的氨基酸序列的hvr-l3。在一些实施方案中,本文所述的抗体与人siglec-8的结构域2中的表位结合,其中结构域2包含seq id no:113的氨基酸序列。
[0123]
在另一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:89的氨基酸序列的hvr-h1,(ii)含有seq id no:92的氨基酸序列的hvr-h2,以及(iii)含有seq id no:95的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:98的氨基酸序列的hvr-l1,(ii)含有seq id no:101的氨基酸序列的hvr-l2,以及(iii)含有seq id no:104的氨基酸序列的hvr-l3。在一些实施方案中,本文所述的抗体与人siglec-8的结构域3中的表位结合,其中结构域3包含seq id no:114的氨基酸序列。在一些实施方案中,本文所述的抗体与人siglec-8和非人灵长类动物siglec-8结合。
[0124]
在另一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:90的氨基酸序列的hvr-h1,(ii)含有seq id no:93的氨基酸序列的hvr-h2,以及(iii)含有seq id no:96的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:99的氨基酸序列的hvr-l1,(ii)含有seq id no:102的氨基酸序列的hvr-l2,以及(iii)含有seq id no:105的氨基酸序列的hvr-l3。在一些实施方案中,本文所述的抗体与人siglec-8的结构域1中的表位结合,其中结构域1包含seq id no:112的氨基酸序列。在一些实施方案中,本文所述的抗体与人siglec-8和非人灵长类动物siglec-8结合。
[0125]
在一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:61的氨基酸序列的hvr-h1,(ii)含有seq id no:62的氨基酸序列的hvr-h2,以及(iii)含有seq id no:63的氨基酸序列的hvr-h3;和/或其中所述轻链可变区包含(i)含有seq id no:64的氨基酸序列的hvr-l1,(ii)含有seq id no:65的氨基酸序列的hvr-l2,以及(iii)含有seq id no:66的氨基酸序列的hvr-l3。
[0126]
在一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:61的氨基酸序列的hvr-h1,(ii)含有seq id no:62的氨基酸序列的hvr-h2,以及(iii)含有选自seq id no:67-70的氨基酸序列的hvr-h3;和/或其中所述轻链可变区包含(i)含有seq id no:64的氨基酸序列的hvr-l1,(ii)含有seq id no:65的氨基酸序列的hvr-l2,以及(iii)含有seq id no:66的氨基酸序列的hvr-l3。
[0127]
在一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:61的氨基酸序列的hvr-h1,(ii)含有seq id no:62的
氨基酸序列的hvr-h2,以及(iii)含有seq id no:63的氨基酸序列的hvr-h3;和/或其中所述轻链可变区包含(i)含有seq id no:64的氨基酸序列的hvr-l1,(ii)含有seq id no:65的氨基酸序列的hvr-l2,以及(iii)含有seq id no:71的氨基酸序列的hvr-l3。
[0128]
在另一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:61的氨基酸序列的hvr-h1,(ii)含有seq id no:62的氨基酸序列的hvr-h2,以及(iii)含有选自seq id no:67-70的氨基酸序列的hvr-h3;和/或其中所述轻链可变区包含(i)含有seq id no:64的氨基酸序列的hvr-l1,(ii)含有seq id no:65的氨基酸序列的hvr-l2,以及(iii)含有seq id no:71的氨基酸序列的hvr-l3。
[0129]
在另一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:88的氨基酸序列的hvr-h1,(ii)含有seq id no:91的氨基酸序列的hvr-h2,以及(iii)含有seq id no:94的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:97的氨基酸序列的hvr-l1,(ii)含有seq id no:100的氨基酸序列的hvr-l2,以及(iii)含有seq id no:103的氨基酸序列的hvr-l3。
[0130]
在另一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:89的氨基酸序列的hvr-h1,(ii)含有seq id no:92的氨基酸序列的hvr-h2,以及(iii)含有seq id no:95的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:98的氨基酸序列的hvr-l1,(ii)含有seq id no:101的氨基酸序列的hvr-l2,以及(iii)含有seq id no:104的氨基酸序列的hvr-l3。
[0131]
在另一方面,本文提供抗siglec-8抗体,其包含重链可变区和轻链可变区,其中所述重链可变区包含(i)含有seq id no:90的氨基酸序列的hvr-h1,(ii)含有seq id no:93的氨基酸序列的hvr-h2,以及(iii)含有seq id no:96的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:99的氨基酸序列的hvr-l1,(ii)含有seq id no:102的氨基酸序列的hvr-l2,以及(iii)含有seq id no:105的氨基酸序列的hvr-l3。
[0132]
本文所述的抗siglec-8抗体可以包含任何合适的框架可变结构域序列,前提是所述抗体保留结合人siglec-8的能力。如本文所用,重链框架区称为“hc-fr1-fr4”,并且轻链框架区称为“lc-fr1-fr4”。在一些实施方案中,抗siglec-8抗体包含seq id no:26、34、38和45的重链可变结构域框架序列(分别是hc-fr1、hc-fr2、hc-fr3和hc-fr4)。在一些实施方案中,抗siglec-8抗体包含seq id no:48、51、55和60的轻链可变结构域框架序列(分别是lc-fr1、lc-fr2、lc-fr3和lc-fr4)。在一些实施方案中,抗siglec-8抗体包含seq id no:48、51、58和60的轻链可变结构域框架序列(分别是lc-fr1、lc-fr2、lc-fr3和lc-fr4)。
[0133]
在一个实施方案中,抗siglec-8抗体包含含有框架序列和高变区的重链可变结构域,其中所述框架序列分别包含hc-fr1-hc-fr4序列seq id no:26-29(hc-fr1)、seq id no:31-36(hc-fr2)、seq id no:38-43(hc-fr3)和seq id no:45或46(hc-fr4);hvr-h1包含seq id no:61的氨基酸序列;hvr-h2包含seq id no:62的氨基酸序列;并且hvr-h3包含seq id no:63的氨基酸序列。在一个实施方案中,抗siglec-8抗体包含含有框架序列和高变区的重链可变结构域,其中所述框架序列分别包含hc-fr1-hc-fr4序列seq id no:26-29(hc-fr1)、seq id no:31-36(hc-fr2)、seq id no:38-43(hc-fr3)和seq id no:45或46(hc-fr4);hvr-h1包含seq id no:61的氨基酸序列;hvr-h2包含seq id no:62的氨基酸序列;并且hvr-h3包含选自seq id no:67-70的氨基酸序列。在一个实施方案中,抗siglec-8抗体包
no:40);rfsiskdnskntvylqmnslraedtavyycar(seq id no:41);rvtisvdtsknqfslklssvtaadtavyycar(seq id no:42);或者rlsiskdnsknqvslklssvtaadtavyycar(seq id no:43));以及d)hc-fr4(wgqgttvtvss(seq id no:45);或者wgqgtlvtvss(seq id no:46))。
[0137]
在一些实施方案中,轻链hvr序列包含以下:a)hvr-l1(satssvsymh(seq id no:64));b)hvr-l2(stsnlas(seq id no:65));以及c)hvr-l3(qqrssypft(seq id no:66);或者qqrssypyt(seq id no:71))。
[0138]
在一些实施方案中,轻链hvr序列包含以下:a)hvr-l1(sasssvsymh(seq id no:97);rasqditnyln(seq id no:98);或者sasssvsymy(seq id no:99));b)hvr-l2(dtsklay(seq id no:100);ftsrlhs(seq id no:101);或者dtsslas(seq id no:102));以及c)hvr-l3(qqwssnppt(seq id no:103);qqgntlpwt(seq id no:104);或者qqwnsdpyt(seq id no:105))。
[0139]
在一些实施方案中,所述抗体包含:重链可变区,所述重链可变区包含(i)含有seq id no:88的氨基酸序列的hvr-h1,(ii)含有seq id no:91的氨基酸序列的hvr-h2,以及(iii)含有seq id no:94的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:97的氨基酸序列的hvr-l1,(ii)含有seq id no:100的氨基酸序列的hvr-l2,以及(iii)含有seq id no:103的氨基酸序列的hvr-l3;重链可变区,所述重链可变区包含(i)含有seq id no:89的氨基酸序列的hvr-h1,(ii)含有seq id no:92的氨基酸序列的hvr-h2,以及(iii)含有seq id no:95的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:98的氨基酸序列的hvr-l1,(ii)含有seq id no:101的氨基酸序列的hvr-l2,以及(iii)含有seq id no:104的氨基酸序列的hvr-l3;或者重链可变区,所述重链可变区包含(i)含有seq id no:90的氨基酸序列的hvr-h1,(ii)含有seq id no:93的氨基酸序列的hvr-h2,以及(iii)含有seq id no:96的氨基酸序列的hvr-h3;和/或轻链可变区,所述轻链可变区包含(i)含有seq id no:99的氨基酸序列的hvr-l1,(ii)含有seq id no:102的氨基酸序列的hvr-l2,以及(iii)含有seq id no:105的氨基酸序列的hvr-l3。
[0140]
在一些实施方案中,轻链fr序列包含以下:a)lc-fr1(eivltqspatlslspgeratlsc(seq id no:48);或者eiiltqspatlslspgeratlsc(seq id no:49));b)lc-fr2(wfqqkpgqaprlliy(seq id no:51);wfqqkpgqaprlwiy(seq id no:52);或者wyqqkpgqaprlliy(seq id no:53));c)lc-fr3(giparfsgsgsgtdftltisslepedfavyyc(seq id no:55);gvparfsgsgsgtdytltisslepedfavyyc(seq id no:56);gvparfsgsgsgtdftltisslepedfavyyc(seq id no:57);或者giparfsgsgsgtdytltisslepedfavyyc(seq id no:58));以及d)lc-fr4(fgpgtkldik(seq id no:60))。
no:106-108的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列。在一些实施方案中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列相对于参考序列含有取代、插入或缺失,但是包含该氨基酸序列的抗体保留与人siglec-8结合的能力。在一些实施方案中,所述取代、插入或缺失(例如,1、2、3、4或5个氨基酸)发生在hvr外部的区域中(即,在fr中)。在一些实施方案中,抗siglec-8抗体包含重链可变结构域,所述重链可变结构域包含seq id no:6的氨基酸序列。在一些实施方案中,抗siglec-8抗体包含重链可变结构域,所述重链可变结构域包含选自seq id no:106-108的氨基酸序列。
[0145]
在一些实施方案中,本文提供抗siglec-8抗体,其包含轻链可变结构域,所述轻链可变结构域包含具有与选自seq id no:16-24的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列。在一些实施方案中,本文提供抗siglec-8抗体,其包含轻链可变结构域,所述轻链可变结构域包含具有与选自seq id no:109-111的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列。在一些实施方案中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列相对于参考序列含有取代、插入或缺失,但是包含该氨基酸序列的抗体保留与人siglec-8结合的能力。在一些实施方案中,所述取代、插入或缺失(例如,1、2、3、4或5个氨基酸)发生在hvr外部的区域中(即,在fr中)。在一些实施方案中,抗siglec-8抗体包含轻链可变结构域,所述轻链可变结构域包含seq id no:16或21的氨基酸序列。在一些实施方案中,抗siglec-8抗体包含重链可变结构域,所述重链可变结构域包含选自seq id no:109-111的氨基酸序列。
[0146]
在一方面,本公开文本提供抗siglec-8抗体,其包含(a)选自表1中所示的那些的一个、两个或三个vh hvr,和/或(b)选自表1中所示的那些的一个、两个或三个vl hvr。
[0147]
在一方面,本公开文本提供抗siglec-8抗体,其包含(a)选自表2中所示的那些的一个、两个或三个vh hvr,和/或(b)选自表2中所示的那些的一个、两个或三个vl hvr。
[0148]
在一方面,本公开文本提供抗siglec-8抗体,其包含(a)选自表3中所示的那些的一个、两个、三个或四个vh fr,和/或(b)选自表3中所示的那些的一个、两个、三个或四个vl fr。
[0149]
在一些实施方案中,本文提供抗siglec-8抗体,其包含表4中所示抗体(例如,haka抗体、hakb抗体、hakc抗体等)的重链可变结构域和/或轻链可变结构域。表1.抗体的hvr的氨基酸序列
表2.来自鼠1c3、1h10和4f11抗体的hvr的氨基酸序列表3.抗体的fr的氨基酸序列
表4.抗体的可变区的氨基酸序列
[0150]
存在五类免疫球蛋白:iga、igd、ige、igg和igm,具有分别称为α、δ、ε、γ和μ的重链。γ和α类别被进一步分为多个亚类,例如,人表达以下亚类:igg1、igg2、igg3、igg4、iga1和iga2。igg1抗体可以以称为同种异型的多个多态性变体存在(综述于jefferis和lefranc 2009.mabs第1卷第4期1-7),其中的任一个都适合用于本文的一些实施方案中。人群中的常见同种异型变体是通过字母a、f、n、z或其组合表示的那些。在本文的任一实施方案中,抗体可以包含含有人igg fc区的重链fc区。在其他实施方案中,人igg fc区包含人igg1或igg4。在一些实施方案中,抗体是igg1抗体。在一些实施方案中,抗体是igg4抗体。在一些实施方案中,人igg4包含氨基酸取代s228p,其中所述氨基酸残基按照kabat中的eu索引编号。在一些实施方案中,人igg1包含seq id no:78的氨基酸序列。在一些实施方案中,人igg4包含seq id no:79的氨基酸序列。
[0151]
在一些实施方案中,本文提供抗siglec-8抗体,其包含含有seq id no:75的氨基酸序列的重链;和/或含有选自seq id no:76或77的氨基酸序列的轻链。在一些实施方案中,抗体可以包含含有seq id no:87的氨基酸序列的重链;和/或含有seq id no:76的氨基酸序列的轻链。在一些实施方案中,抗siglec-8抗体是利仑特力单抗。在一些实施方案中,抗siglec-8抗体诱导激活的嗜酸性粒细胞凋亡。在一些实施方案中,抗siglec-8抗体诱导静息嗜酸性粒细胞凋亡。在一些实施方案中,抗siglec-8抗体耗尽激活的嗜酸性粒细胞并且抑制肥大细胞激活。在一些实施方案中,抗siglec-8抗体耗尽或减少肥大细胞并且抑制肥大细胞激活。在一些实施方案中,抗siglec-8抗体耗尽或减少肥大细胞的数量。在一些实施方案中,抗siglec-8抗体通过adcc活性杀伤肥大细胞。在一些实施方案中,抗体耗尽或减少组织中表达siglec-8的肥大细胞。在一些实施方案中,抗体耗尽或减少生物流体中表达siglec-8的肥大细胞。1.抗体亲和力
[0152]
在一些方面,如与小鼠抗体2e2和/或小鼠抗体2c4相比,本文所述的抗siglec-8抗体以大致相同或更高的亲和力和/或更高的亲合力与人siglec-8结合。在某些实施方案中,本文提供的抗siglec-8抗体的解离常数(kd)≤1μm、≤150nm、≤100nm、≤50nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm或≤0.001nm(例如10-8m或更小,例如10-8m至10-13m,例如10-9m至10-13m)。在一些实施方案中,本文所述的抗siglec-8抗体以比小鼠抗体2e2和/或小鼠抗体2c4高约1.5倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍或约10倍的亲和力与人siglec-8结合。在一些实施方案中,抗siglec-8抗体包含含有seq id no:6的氨基酸序列的重链可变区;和/或含有选自seq id no:16或21的氨基酸序列的轻链可变区。
[0153]
在一个实施方案中,抗siglec-8抗体的结合亲和力可以通过表面等离子体共振测定来确定。例如,kd或kd值可以通过在25℃下使用biacore
tm-2000或biacore
tm-3000(biacore,inc.,皮斯卡塔韦,新泽西州)以固定的抗原cm5芯片以约10个反应单位(ru)来测
量。简单来说,根据供应商的说明书,用n-乙基-n'-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)激活羧甲基化葡聚糖生物传感器芯片(cm5,inc.)。用10mm乙酸钠,ph 4.8稀释捕获抗体(例如抗人fc),之后以30μl/分钟的流速注射,并且用抗siglec-8抗体进一步固定。对于动力学测量,于25℃以大约25μl/min的流速在含0.05%tween 20的pbs(pbst)中注射二聚siglec-8的两倍连续稀释液。使用简单的一对一langmuir结合模型(评价软件3.2版)通过同时拟合结合和解离传感图来计算结合速率(k
on
)和解离速率(k
off
)。将平衡解离常数(kd)计算为比率k解离/k缔合。参见例如,chen,y.,等人,(1999)j.mol.biol.293:865-881。
[0154]
在另一实施方案中,可以使用生物层干涉法来确定抗siglec-8抗体针对siglec-8的亲和力。在示例性测定中,将siglec-8-fc标记的蛋白固定到抗人捕获传感器上,并且与渐增浓度的小鼠、嵌合或人源化抗siglec-8fab片段一起孵育,以使用仪器(如例如,octet red 384系统(fortebio))获得亲和力测量。
[0155]
例如,抗siglec-8抗体的结合亲和力还可以通过munson等人,anal.biochem.,107:220(1980)中所述的scatchard分析使用相关领域中熟知的标准技术来确定。还参见scatchard,g.,ann.n.y.acad.sci.51:660(1947)。2.抗体亲合力
[0156]
在一些实施方案中,抗siglec-8抗体的结合亲合力可以通过表面等离子体共振测定来确定。例如,kd或kd值可以通过使用biacore t100来测量。将捕获抗体(例如,山羊抗人fc和山羊抗小鼠fc)固定在cm5芯片上。可以用抗人或抗小鼠抗体固定流动池。于某个温度以某个流速进行测定,例如于25℃下以30μl/min的流速进行。以多种浓度在测定缓冲液中稀释二聚siglec-8,例如,以范围为15nm至1.88pm的浓度来稀释。捕获抗体,并且进行高效注射,随后解离。用缓冲液(例如,50mm甘氨酸ph 1.5)使流动池再生。以空参考池和多次测定缓冲液注射作为空白,并且用1:1全局拟合参数分析结果。3.竞争测定
[0157]
可以使用竞争测定来确定两种抗体是否通过识别相同的或空间重叠的表位而结合相同表位,或者一种抗体竞争性抑制另一种抗体与抗原的结合。这些测定是本领域已知的。通常,在多孔板上固定抗原或抗原表达细胞,并且测量未标记抗体阻断已标记抗体结合的能力。此类竞争测定的常用标记是放射性标记或酶标记。在一些实施方案中,本文所述的抗siglec-8抗体与本文所述的2e2抗体竞争结合细胞(例如,肥大细胞)的细胞表面上存在的表位。在一些实施方案中,本文所述的抗siglec-8抗体与包含含有seq id no:1的氨基酸序列的重链可变结构域和含有seq id no:15的氨基酸序列的轻链可变区的抗体竞争结合细胞(例如,肥大细胞)的细胞表面上存在的表位。在一些实施方案中,本文所述的抗siglec-8抗体与本文所述的2c4抗体竞争结合细胞(例如,肥大细胞)的细胞表面上存在的表位。在一些实施方案中,本文所述的抗siglec-8抗体与包含含有seq id no:2的氨基酸序列的重链可变结构域(如发现于美国专利号8,207,305中)和含有seq id no:4的氨基酸序列的轻链可变区(如发现于美国专利号8,207,305中)的抗体竞争结合细胞(例如,肥大细胞)的细胞表面上存在的表位。4.热稳定性
[0158]
在一些方面,本文所述的抗siglec-8在热漂移测定中具有至少约70℃、至少约71
℃或至少约72℃的解链温度(tm)。在示例性热漂移测定中,在qpcr热循环仪中将包含人源化抗siglec-8抗体的样品与荧光染料(sypro orange)一起孵育71个循环,每个循环升高1℃,以确定tm。在一些实施方案中,如与小鼠2e2抗体和/或小鼠2c4抗体相比,抗siglec-8抗体具有相似或更高的tm。在一些实施方案中,抗siglec-8抗体包含含有seq id no:6的氨基酸序列的重链可变区;和/或含有选自seq id no:16或21的氨基酸序列的轻链可变区。在一些实施方案中,如与嵌合2c4抗体相比,抗siglec-8抗体具有相同或更高的tm。在一些实施方案中,如与具有包含seq id no:84的氨基酸序列的重链和包含seq id no:85的氨基酸序列的轻链的抗体相比,抗siglec-8抗体具有相同或更高的tm。5.生物活性测定
[0159]
在一些实施方案中,本文所述的抗siglec-8抗体耗尽嗜酸性粒细胞并且抑制肥大细胞。用于评估细胞凋亡的测定是本领域公知的,例如用膜联蛋白v染色和tunnel测定。
[0160]
在一些实施方案中,本文所述的抗siglec-8抗体诱导adcc活性。在一些实施方案中,本文所述的抗siglec-8抗体通过adcc活性杀伤表达siglec-8的嗜酸性粒细胞。在一些实施方案中,组合物包含未岩藻糖基化(即,无岩藻糖基化)的抗siglec-8抗体。在一些实施方案中,如与包含部分岩藻糖基化的抗siglec-8抗体的组合物相比,包含本文所述的未岩藻糖基化的抗siglec-8抗体的组合物增强针对表达siglec-8的嗜酸性粒细胞的adcc活性。用于评估adcc活性的测定是本领域公知的且在本文中进行了描述。在示例性测定中,为了测量adcc活性,使用效应细胞和靶细胞。效应细胞的例子包括自然杀伤(nk)细胞、大颗粒淋巴细胞(lgl)、淋巴因子激活的杀伤(lak)细胞以及包括nk和lgl的pbmc,或者在细胞表面上具有fc受体的白细胞,如嗜中性粒细胞、嗜酸性粒细胞和巨噬细胞。效应细胞可以从包括患有目的疾病的个体在内的任何来源分离。靶细胞是在细胞表面上表达要评价的抗体可以识别的抗原的任何细胞。这种靶细胞的例子是在细胞表面上表达siglec-8的嗜酸性粒细胞。这种靶细胞的另一个例子是在细胞表面上表达siglec-8的细胞系(例如,ramos细胞系)(例如,ramos 2c10)。可以用使得能检测细胞裂解的试剂标记靶细胞。用于标记的试剂的例子包括放射性物质,如铬酸钠(na
251
cro4)。参见例如,immunology,14,181(1968);j.immunol.methods.,172,227(1994);以及j.immunol.methods.,184,29(1995)。
[0161]
在示例性测定中,为了评估抗siglec-8抗体对肥大细胞的adcc和细胞凋亡活性,根据公开的方案从人组织或生物流体分离人肥大细胞(guhl等人,biosci.biotechnol.biochem.,2011,75:382-384;kulka等人,in current protocols in immunology,2001,(john wiley&sons,inc.))或从人造血干细胞分化人肥大细胞,例如如yokoi等人,j allergy clin immunol.,2008,121:499-505所述。将纯化的肥大细胞重悬在无菌96孔u形底板中的完全rpmi培养基中,并且在存在或不存在抗siglec-8抗体的情况下,以范围在0.0001ng/ml与10μg/ml之间的浓度孵育30分钟。在有或没有纯化的自然杀伤(nk)细胞或新鲜pbl的情况下,将样品再孵育4至48小时,以诱导adcc。使用荧光缀合的抗体检测肥大细胞(cd117和fcεr1)且使用膜联蛋白-v和7aad区分活细胞和死细胞或濒死细胞,通过流式细胞术分析通过细胞凋亡或adcc进行的细胞杀伤。膜联蛋白-v和7aad染色是按照制造商的说明书进行的。
[0162]
在一些方面,本文所述的抗siglec-8抗体抑制肥大细胞介导的活性。已经使用肥大细胞类胰蛋白酶作为总肥大细胞数量和激活的生物标记。例如,可以测量血液或尿中的
总活性类胰蛋白酶以及组胺、n-甲基组胺和11-β-前列腺素f2以评估肥大细胞的减少。示例性肥大细胞活性测定参见例如美国专利申请公开号us 20110293631。e.抗体制备
[0163]
本文所述的抗体(例如,与人siglec-8结合的抗体)是使用本领域中用于生成抗体的可用技术来制备,其示例性方法更详细地描述于以下章节中。1.抗体片段
[0164]
本公开文本涵盖抗体片段。抗体片段可以通过传统方式(如酶促消化)或通过重组技术来生成。在某些情况下,使用抗体片段而不是完整抗体有优势。关于某些抗体片段的综述参见hudson等人(2003)nat.med.9:129-134。
[0165]
已经开发了用于产生抗体片段的多种技术。传统上,通过蛋白水解消化完整抗体来衍生这些片段(参见例如,morimoto等人,journal of biochemical and biophysical methods 24:107-117(1992);以及brennan等人,science 229:81(1985))。然而,现在可直接由重组宿主细胞产生这些片段。fab、fv和scfv抗体片段都可以在大肠杆菌(e.coli)中表达并由大肠杆菌分泌,从而允许容易地产生大量的这些片段。可以从上文讨论的抗体噬菌体文库分离抗体片段。可替代地,可以直接从大肠杆菌回收fab'-sh片段并且化学偶联以形成f(ab')2片段(carter等人,bio/technology 10:163-167(1992))。根据另一种方法,可以直接从重组宿主细胞培养物分离f(ab')2片段。包含补救受体结合表位残基的具有增加的体内半衰期的fab和f(ab')2片段描述于美国专利号5,869,046中。用于产生抗体片段的其他技术对于熟练从业人员会是显而易见的。在某些实施方案中,抗体是单链fv片段(scfv)。参见wo 93/16185;美国专利号5,571,894;以及5,587,458。fv和scfv是具有缺少恒定区的完整结合位点的唯一种类;因此,它们可能适合于在体内使用期间减少非特异性结合。可以构建scfv融合蛋白以产生效应蛋白在scfv的氨基末端或羧基末端的融合物。参见antibody engineering,编辑borrebaeck,上文。例如,抗体片段也可以是“线性抗体”,例如,如美国专利号5,641,870中所述。此类线性抗体可以是单特异性或双特异性的。2.人源化抗体
[0166]
本公开文本涵盖人源化抗体。用于人源化非人抗体的各种方法是本领域已知的。例如,人源化抗体可以具有一个或多个从非人来源引入其中的氨基酸残基。这些非人氨基酸残基通常被称为“输入”残基,其通常取自“输入”可变结构域。基本上可以遵循winter的方法通过用高变区序列取代人抗体的相应序列进行人源化(jones等人(1986)nature 321:522-525;riechmann等人(1988)nature 332:323-327;verhoeyen等人(1988)science 239:1534-1536)。因此,此类“人源化”抗体是嵌合抗体(美国专利号4,816,567),其中显著少于完整的人可变结构域已经被来自非人物种的相应序列所取代。在实践中,人源化抗体通常是如下人抗体,其中一些高变区残基和可能的一些fr残基被来自啮齿动物抗体中类似位点的残基取代。
[0167]
要用于制备人源化抗体的轻链和重链二者的人可变结构域的选择对于降低抗原性可能是重要的。根据所谓的“最佳拟合”方法,针对已知人可变结构域序列的整个文库对啮齿动物(例如,小鼠)抗体的可变结构域序列进行筛选。然后接受与啮齿动物的序列最接近的人序列作为人源化抗体的人框架(sims等人(1993)j.immunol.151:2296;chothia等人(1987)j.mol.biol.196:901)。另一种方法使用由轻链或重链的特定亚组的所有人抗体的
共有序列衍生的特定框架。相同框架可以用于几种不同的人源化抗体(carter等人(1992)proc.natl.acad.sci.usa,89:4285;presta等人(1993)j.immunol.,151:2623)。
[0168]
通常还期望,被人源化的抗体保留对抗原的高亲和力和其他有利的生物特性。为了达到此目的,根据一种方法,通过使用亲本序列和人源化序列的三维模型分析亲本序列和各种概念性人源化产物的过程来制备人源化抗体。免疫球蛋白三维模型是普遍可得的,并且是本领域技术人员熟悉的。可以获得说明并展示所选候选免疫球蛋白序列的可能三维构象结构的计算机程序。检查这些展示允许分析残基在候选免疫球蛋白序列发挥功能中的可能作用,即分析影响候选免疫球蛋白结合其抗原的能力的残基。通过这种方式,可以从受体序列和输入序列选择并组合fr残基,从而实现所需的抗体特征,如增加的对一种或多种靶抗原的亲和力。通常,高变区残基直接且最实质地参与对抗原结合的影响。3.人抗体
[0169]
本公开文本的人抗siglec-8抗体可以通过将选自人来源的噬菌体展示文库的一个或多个fv克隆可变结构域序列与已知的一个或多个人恒定结构域序列组合来构建。可替代地,可以通过杂交瘤方法来制备本公开文本的人单克隆抗siglec-8抗体。用于产生人单克隆抗体的人骨髓瘤和小鼠-人种间骨髓瘤细胞系已经描述于例如以下文献中:kozbor j.immunol.,133:3001(1984);brodeur等人,monoclonal antibody production techniques and applications,第51-63页(marcel dekker,inc.,纽约,1987);以及boerner等人,j.immunol.,147:86(1991)。
[0170]
有可能产生能够在不存在内源免疫球蛋白产生的情况下在免疫后产生人抗体的完整组库的转基因动物(例如,小鼠)。例如,已经描述,嵌合和种系突变体小鼠中抗体重链接合区(jh)基因的纯合缺失导致对内源抗体产生的完全抑制。在此类种系突变体小鼠中转移人种系免疫球蛋白基因阵列会导致在抗原激发后产生人抗体。参见例如,jakobovits等人,proc.natl.acad.sci.usa,90:2551(1993);jakobovits等人,nature,362:255(1993);bruggermann等人,year in immunol.,7:33(1993)。
[0171]
基因改组也可以用于从非人(例如,啮齿动物)抗体衍生人抗体,其中人抗体具有与起始非人抗体相似的亲和力和特异性。根据这种方法(其也称为“表位印迹”),通过如本文描述的噬菌体展示技术获得的非人抗体片段的重链或轻链可变区被人v结构域基因组库替代,产生非人链/人链scfv或fab嵌合体群。用抗原进行的选择导致如下非人链/人链嵌合scfv或fab的分离,其中人链在一级噬菌体展示克隆中消除相应的非人链后恢复了抗原结合位点,即表位决定人链配偶体的选择。在重复所述过程以替代剩余非人链时,得到人抗体(参见1993年4月1日公开的pct wo 93/06213)。与传统的通过cdr移植进行的非人抗体的人源化不同,此技术提供完全人抗体,它们不含非人起源的fr或cdr残基。4.双特异性抗体
[0172]
双特异性抗体是对至少两种不同抗原具有结合特异性的单克隆抗体。在某些实施方案中,双特异性抗体是人抗体或人源化抗体。在某些实施方案中,一种结合特异性是针对siglec-8,并且另一种是针对任何其他抗原。在某些实施方案中,双特异性抗体可以与siglec-8的两种不同表位结合。双特异性抗体还可以用于将细胞毒性剂定位至表达siglec-8的细胞。可以将双特异性抗体制备成全长抗体或抗体片段(例如f(ab')2双特异性抗体)。
[0173]
用于制备双特异性抗体的方法是本领域已知的。参见milstein和cuello,nature,305:537(1983);1993年5月13日公开的wo 93/08829;以及traunecker等人,embo j.,10:3655(1991)。关于生成双特异性抗体的进一步详情参见例如suresh等人,methods in enzymology,121:210(1986)。双特异性抗体包括交联抗体或“异源缀合物”抗体。例如,异源缀合物中的一种抗体可以与抗生物素蛋白偶联,另一种抗体与生物素偶联。可以使用任何便利的交联方法制备异源缀合物抗体。合适的交联剂是本领域中熟知的,并且与多种交联技术一起披露于美国专利号4,676,980中。5.单一结构域抗体
[0174]
在一些实施方案中,本公开文本的抗体是单一结构域抗体。单一结构域抗体是包含抗体的重链可变结构域的全部或一部分或者轻链可变结构域的全部或一部分的单一多肽链。在某些实施方案中,单一结构域抗体是人单一结构域抗体(domantis,inc.,沃尔瑟姆,马萨诸塞州;参见例如,美国专利号6,248,516b1)。在一个实施方案中,单一结构域抗体由抗体的重链可变结构域的全部或一部分组成。6.抗体变体
[0175]
在一些实施方案中,考虑本文所述抗体的一种或多种氨基酸序列修饰。例如,可能希望改善抗体的结合亲和力和/或其他生物特性。抗体的氨基酸序列变体可以通过将适当变化引入编码抗体的核苷酸序列中或者通过肽合成来制备。此类修饰包括例如抗体氨基酸序列内残基的缺失和/或插入和/或取代。可以进行缺失、插入和取代的任何组合以获得最终构建体,前提是最终构建体具有所需特征。可以在制备序列时在主题抗体氨基酸序列中引入氨基酸改变。
[0176]
用于鉴定抗体中作为优选诱变位置的某些残基或区域的有用方法被称为“丙氨酸扫描诱变”,如cunningham和wells(1989)science,244:1081-1085所述。在此,鉴定残基或靶残基组(例如,带电荷的残基,如arg、asp、his、lys和glu),并且用中性或带负电荷的氨基酸(例如,丙氨酸或聚丙氨酸)替代以影响氨基酸与抗原的相互作用。然后通过在或对取代位点引入进一步的变体或其他变体,完善显示对取代的功能敏感性的那些氨基酸位置。因此,尽管预先确定用于引入氨基酸序列变异的位点,但不需要预先确定突变本身的性质。例如,为了分析给定位点处突变的性能,在靶密码子或区域处进行丙氨酸扫描或随机诱变,并且针对所需活性筛选所表达的免疫球蛋白。
[0177]
氨基酸序列插入包括氨基末端和/或羧基末端融合(长度范围为一个残基至含有一百个或更多个残基的多肽),以及单一或多个氨基酸残基的序列内插入。末端插入的例子包括具有n末端甲硫氨酰残基的抗体。抗体分子的其他插入变体包括增加抗体血清半衰期的酶或多肽与抗体n末端或c末端的融合。
[0178]
在一些实施方案中,单克隆抗体在重链和/或轻链处具有c末端切割。例如,在重链和/或轻链的c末端处切割1、2、3、4或5个氨基酸残基。在一些实施方案中,所述c末端切割从重链去除c末端赖氨酸。在一些实施方案中,单克隆抗体在重链和/或轻链处具有n末端切割。例如,在重链和/或轻链的n末端处切割1、2、3、4或5个氨基酸残基。在一些实施方案中,单克隆抗体的截短形式可以通过重组技术制备。
[0179]
在某些实施方案中,本公开文本的抗体发生改变以提高或降低抗体糖基化的程度。多肽的糖基化通常是n连接的或是o连接的。n连接的是指碳水化合物部分附接至天冬酰
胺残基的侧链。三肽序列天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸(其中x是除脯氨酸外的任何氨基酸)是碳水化合物部分酶促附接至天冬酰胺侧链的识别序列。因此,这些三肽序列中任一种在多肽中的存在产生潜在的糖基化位点。o连接的糖基化是指糖n-乙酰半乳糖胺、半乳糖或木糖中的一种附接至羟基氨基酸,所述羟基氨基酸最常见的是丝氨酸或苏氨酸,但是也可以使用5-羟基脯氨酸或5-羟基赖氨酸。
[0180]
抗体中糖基化位点的添加或缺失可以通过改变氨基酸序列,使得产生或去除一个或多个上述三肽序列(用于n连接的糖基化位点)来便利地完成。还可以通过初始抗体序列中一个或多个丝氨酸或苏氨酸残基的添加、缺失或取代来进行改变(用于o连接的糖基化位点)。
[0181]
在抗体包含fc区的情况下,可以改变附接至它的碳水化合物。例如,有缺少岩藻糖的成熟碳水化合物结构附接至抗体fc区的抗体描述于美国专利申请号us 2003/0157108(presta,l.)中。还参见us 2004/0093621(kyowa hakko kogyo co.,ltd)。有碳水化合物中的等分n-乙酰葡糖胺(glcnac)附接至抗体fc区的抗体在以下文献中有所提及:jean-mairet等人的wo 2003/011878和umana等人的美国专利号6,602,684。有寡糖中的至少一个半乳糖残基附接至抗体fc区的抗体报道于patel等人的wo 1997/30087中。关于有改变的碳水化合物附接至其fc区的抗体还参见wo 1998/58964(raju,s.)和wo 1999/22764(raju,s.)。关于具有修饰的糖基化的抗原结合分子还参见us 2005/0123546(umana等人)。
[0182]
在某些实施方案中,糖基化变体包含fc区,其中附接至fc区的碳水化合物结构缺乏岩藻糖。此类变体具有改善的adcc功能。任选地,fc区还包含其中的进一步改善adcc的一个或多个氨基酸取代,例如,fc区第298位、第333位和/或第334位的取代(残基的eu编号)。涉及“脱岩藻糖基化的”或“缺乏岩藻糖的”抗体的出版物的例子包括:us 2003/0157108;wo 2000/61739;wo 2001/29246;us 2003/0115614;us 2002/0164328;us 2004/0093621;us 2004/0132140;us 2004/0110704;us 2004/0110282;us 2004/0109865;wo 2003/085119;wo 2003/084570;wo 2005/035586;wo 2005/035778;wo 2005/053742;okazaki等人j.mol.biol.336:1239-1249(2004);yamane-ohnuki等人biotech.bioeng.87:614(2004)。产生脱岩藻糖基化抗体的细胞系的例子包括蛋白质岩藻糖基化缺陷的lec13 cho细胞(ripka等人arch.biochem.biophys.249:533-545(1986);美国专利申请号us 2003/0157108 a1,presta,l;以及wo 2004/056312 a1,adams等人,尤其在实施例11中),以及敲除细胞系,如α-1,6-岩藻糖基转移酶基因fut8敲除的cho细胞(yamane-ohnuki等人biotech.bioeng.87:614(2004)),以及过表达β1,4-n-乙酰葡糖胺基转移酶iii(gnt-iii)和高尔基μ-甘露糖苷酶ii(manii)的细胞。
[0183]
本文中考虑如下抗体,其相对于野生型cho细胞中产生的相同抗体上岩藻糖的量,具有减少的岩藻糖。例如,抗体中岩藻糖的量比如果由天然cho细胞(例如,产生天然糖基化模式的cho细胞,如含有天然fut8基因的cho细胞)产生的情况下原本会具有的量更低。在某些实施方案中,本文提供的抗siglec-8抗体是如下的抗体,其中所述抗体上少于约50%、40%、30%、20%、10%、5%或1%的n连接的聚糖包含岩藻糖。在某些实施方案中,本文提供的抗siglec-8抗体是如下抗体,其中所述抗体上n连接的聚糖均不包含岩藻糖,即其中所述抗体完全不含岩藻糖,或者没有岩藻糖,或者是未岩藻糖基化的,或者是无岩藻糖基化的。可以通过相对于如通过maldi-tof质谱法所测量的附接至asn297的所有糖结构(例如,复杂
结构、杂合结构和高甘露糖结构)的总和,计算asn297处糖链内岩藻糖的平均量来确定岩藻糖的量,例如如wo 2008/077546中所描述。asn297是指大致位于fc区中第297位(fc区残基的eu编号)的天冬酰胺残基;然而,asn297也可以由于抗体中的微小序列变异而位于第297位上游或下游的约
±
3个氨基酸处,即在第294位与第300位之间。在一些实施方案中,所述抗体的至少一条或两条重链是未岩藻糖基化的。
[0184]
在一个实施方案中,改变抗体以改善其血清半衰期。为了增加抗体的血清半衰期,可以将补救受体结合表位掺入抗体(尤其是抗体片段)中,如例如美国专利号5,739,277中所述。如本文所用,术语“补救受体结合表位”是指igg分子(例如,igg1、igg2、igg3或igg4)的fc区中负责增加igg分子的体内血清半衰期的表位(us 2003/0190311、美国专利号6,821,505;美国专利号6,165,745;美国专利号5,624,821;美国专利号5,648,260;美国专利号6,165,745;美国专利号5,834,597)。
[0185]
变体的另一种类型是氨基酸取代变体。这些变体在抗体分子中有至少一个氨基酸残基被不同的残基替代。用于取代诱变的目的位点包括高变区,但是也考虑fr改变。保守取代示于表5中“优选取代”标题下。如果此类取代导致生物活性的所需变化,则可以引入更多实质性变化并筛选产物,所述实质性变化在表5中命名为“示例性取代”,或者如下文根据氨基酸类别进一步描述。表5.原始残基示例性取代优选取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;asp,lys;argglnasp(d)glu;asnglucys(c)ser;alasergln(q)asn;gluasnglu(e)asp;glnaspgly(g)alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;phe;正亮氨酸leuleu(l)正亮氨酸;ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)trp;leu;val;ile;ala;tyrtyrpro(p)alaalaser(s)thrthrthr(t)val;sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;ala;正亮氨酸leu
[0186]
对抗体的生物特性的实质性修饰通过选择取代来实现,所述取代对维持以下的作
用显著不同:(a)取代区域中多肽主链的结构,例如,呈片状或螺旋构象;(b)分子在靶位点处的电荷或疏水性;或者(c)侧链的体积。可以根据侧链特性的相似性将氨基酸分组(a.l.lehninger,biochemistry,第二版,第73-75页,worth publishers,纽约(1975)):(1)非极性的:ala(a)、val(v)、leu(l)、ile(i)、pro(p)、phe(f)、trp(w)、met(m)(2)不带电荷的极性的:gly(g)、ser(s)、thr(t)、cys(c)、tyr(y)、asn(n)、gln(q)(3)酸性的:asp(d)、glu(e)(4)碱性的:lys(k)、arg(r)、his(h)
[0187]
可替代地,可以基于共同的侧链特性,将天然存在的残基分组:(1)疏水性的:正亮氨酸、met、ala、val、leu、ile;(2)中性亲水性的:cys、ser、thr、asn、gln;(3)酸性的:asp、glu;(4)碱性的:his、lys、arg;(5)影响链取向的残基:gly、pro;(6)芳香族:trp、tyr、phe。
[0188]
非保守取代将需要将这些类别之一的成员交换为另一种类别。还可以将此类取代的残基引入保守取代位点中,或者引入其余(非保守)位点中。
[0189]
一种类型的取代变体涉及取代亲本抗体(例如,人源化或人抗体)的一个或多个高变区残基。通常,选择用于进一步开发的一种或多种所得变体将相对于生成所述变体的亲本抗体具有修饰的(例如,改善的)生物特性。用于生成此类取代变体的便利方式涉及使用噬菌体展示进行亲和力成熟。简言之,使几个高变区位点(例如,6-7个位点)突变,以在每个位点处生成所有可能的氨基酸取代。如此生成的抗体由丝状噬菌体颗粒展示为与每个颗粒内包装的噬菌体外壳蛋白(例如,m13的基因iii产物)的至少一部分的融合物。然后针对其生物活性(例如,结合亲和力)筛选噬菌体展示的变体。为了鉴定用于修饰的候选高变区位点,可以进行扫描诱变(例如,丙氨酸扫描)以鉴定对抗原结合有重大贡献的高变区残基。可替代地或另外地,分析抗原-抗体复合物的晶体结构以鉴定抗体与抗原之间的接触点可能是有益的。此类接触残基和邻近残基是根据本领域已知的技术(包括本文详述的那些)进行取代的候选位点。一旦生成此类变体,使用本领域已知的技术(包括本文所述的那些)使变体组经历筛选,并且可以选择在一种或多种相关测定中具有优良特性的抗体用于进一步开发。
[0190]
编码抗体的氨基酸序列变体的核酸分子是通过本领域中已知的多种方法来制备。这些方法包括但不限于从天然来源分离(在天然存在的氨基酸序列变体的情况下),或者通过对抗体的早期制备变体或非变体形式进行寡核苷酸介导的(或定点)诱变、pcr诱变和盒式诱变来制备。
[0191]
可能期望在本公开文本的抗体的fc区中引入一个或多个氨基酸修饰,从而生成fc区变体。fc区变体可以包含在一个或多个氨基酸位置(包括铰链半胱氨酸的位置)包含氨基酸修饰(例如,取代)的人fc区序列(例如,人igg1、igg2、igg3或igg4fc区)。在一些实施方案中,fc区变体包含人igg4fc区。在另一实施方案中,人igg4fc区包含氨基酸取代s228p,其中所述氨基酸残基按照kabat中的eu索引编号。
[0192]
根据此说明书和本领域的教导,考虑在一些实施方案中,本公开文本的抗体如与
野生型对应抗体相比可以包含一个或多个改变(例如,在fc区中)。然而,如与其野生型对应抗体相比,这些抗体将保留治疗效用所需的基本上相同的特征。例如,认为可以在fc区中进行某些改变,所述改变将导致c1q结合和/或补体依赖性细胞毒性(cdc)改变(即,改善或降低),例如,如wo99/51642中所述。关于fc区变体的其他例子,还参见duncan&winter nature 322:738-40(1988);美国专利号5,648,260;美国专利号5,624,821;以及wo 94/29351。wo 00/42072(presta)和wo 2004/056312(lowman)描述了与fcr的结合改善或降低的抗体变体。这些专利公开案的内容通过引用明确并入本文。还参见shields等人j.biol.chem.9(2):6591-6604(2001)。具有增加的半衰期以及改进的与新生儿fc受体(fcrn)的结合(其负责将母体igg转移至胎儿)(guyer等人,j.immunol.117:587(1976)和kim等人,j.immunol.24:249(1994))的抗体描述于us2005/0014934a1(hinton等人)中。这些抗体包含其中具有一个或多个取代的fc区,所述一个或多个取代改善fc区与fcrn的结合。具有改变的fc区氨基酸序列以及增加的或降低的c1q结合能力的多肽变体描述于美国专利号6,194,551b1、wo99/51642中。那些专利公开案的内容通过引用明确并入本文。还参见idusogie等人j.immunol.164:4178-4184(2000)。7.载体、宿主细胞和重组方法
[0193]
对于本公开文本的抗体的重组产生,分离编码它的核酸,并且将其插入可复制载体中,用于进一步克隆(dna扩增)或用于表达。使用常规程序(例如,通过使用能够与编码抗体重链和轻链的基因特异性结合的寡核苷酸探针)容易地分离编码抗体的dna并且测序。许多载体是可用的。载体的选择部分取决于要使用的宿主细胞。通常,宿主细胞是原核或真核(通常是哺乳动物)起源的。应理解,任何同种型的恒定区可用于此目的,包括igg、igm、iga、igd和ige恒定区,并且此类恒定区可以从任何人或动物物种获得。使用原核宿主细胞生成抗体:a)载体构建
[0194]
可以使用标准重组技术来获得编码本公开文本的抗体的多肽组分的多核苷酸序列。可以从抗体产生细胞(如杂交瘤细胞)分离所需多核苷酸序列并且测序。可替代地,可以使用核苷酸合成仪或pcr技术合成多核苷酸。一旦获得,将编码多肽的序列插入能够在原核宿主中复制并表达异源多核苷酸的重组载体中。本领域可获得的且已知的许多载体可以用于本公开文本的目的。适当载体的选择将主要取决于要插入载体的核酸的大小和要用载体转化的特定宿主细胞。每种载体含有多种组分,这取决于其功能(异源多核苷酸的扩增或表达或二者)及其与所驻留特定宿主细胞的相容性。载体组分通常包括但不限于:复制起点、选择标记基因、启动子、核糖体结合位点(rbs)、信号序列、异源核酸插入物和转录终止序列。
[0195]
通常,含有源自与宿主细胞相容的物种的复制子和控制序列的质粒载体与这些宿主结合使用。载体通常携带复制位点,以及能够在转化细胞中提供表型选择的标记序列。例如,通常用源自大肠杆菌物种的质粒pbr322来转化大肠杆菌。pbr322含有编码氨苄青霉素(amp)和四环素(tet)抗性的基因,并且由此提供轻松鉴定转化细胞的方式。pbr322、其衍生物或其他微生物质粒或噬菌体还可以含有或者被修饰以含有可以由微生物生物体用于表达内源蛋白质的启动子。用于表达特定抗体的pbr322衍生物的例子详细描述于carter等人,美国专利号5,648,237中。
[0196]
另外,可以使用含有与宿主微生物相容的复制子和控制序列的噬菌体载体作为与这些宿主结合的转化载体。例如,噬菌体(如λgem.tm.-11)可以用于制备可以用于转化易感宿主细胞(如大肠杆菌le392)的重组载体。
[0197]
本公开文本的表达载体可以包含两个或更多个启动子-顺反子对,它们编码每一种多肽组分。启动子是位于顺反子上游(5')的非翻译调节序列,它调节所述顺反子的表达。原核启动子通常分成两类:诱导型和组成型。诱导型启动子是响应于培养条件的变化(例如,营养物的存在或不存在,或者温度变化)而启动受其控制的升高水平的顺反子转录的启动子。
[0198]
被多种潜在宿主细胞识别的大量启动子是公知的。通过经由限制酶消化从来源dna去除启动子并将分离的启动子序列插入本公开文本的载体中,可以将选择的启动子与编码轻链或重链的顺反子dna可操作地连接。天然启动子序列和许多异源启动子二者都可以用于引导靶基因的扩增和/或表达。在一些实施方案中,使用异源启动子,因为如与天然靶多肽启动子相比,它们通常允许所表达靶基因的更高转录和更高产量。
[0199]
适用于原核宿主的启动子包括phoa启动子、β-半乳糖苷酶和乳糖启动子系统、色氨酸(trp)启动子系统和杂合启动子(如tac或trc启动子)。然而,在细菌中有功能的其他启动子(如其他已知的细菌或噬菌体启动子)也是合适的。它们的核苷酸序列已被公开,从而使得熟练工作人员能够使用接头或衔接子将它们与编码靶轻链和重链的顺反子可操作地连接(siebenlist等人(1980)cell 20:269),以供应任何所需限制位点。
[0200]
在本公开文本的一方面,重组载体内的每个顺反子都包含分泌信号序列组分以引导所表达多肽跨膜易位。通常,信号序列可以是载体的组分,或者它可以是插入载体中的靶多肽dna的一部分。选择用于本公开文本的目的的信号序列应为被宿主细胞识别和加工(即,通过信号肽酶切割)的信号序列。对于不识别和加工异源多肽的天然信号序列的原核宿主细胞,将所述信号序列用原核信号序列取代,所述原核信号序列选自例如碱性磷酸酶、青霉素酶、ipp或热稳定的肠毒素ii(stii)前导序列、lamb、phoe、pelb、ompa和mbp。在本公开文本的一个实施方案中,用于表达系统的两个顺反子中的信号序列是stii信号序列或其变体。
[0201]
在另一方面,根据本公开文本的免疫球蛋白的产生可以在宿主细胞的胞质中进行,因此不需要在每个顺反子内存在分泌信号序列。在这方面,在细胞质内表达、折叠和装配免疫球蛋白轻链和重链,以形成功能性免疫球蛋白。某些宿主菌株(例如,大肠杆菌trxb菌株)提供有利于二硫键形成的胞质条件,从而允许所表达蛋白质亚基的正确折叠和装配。proba和pluckthun gene,159:203(1995)。
[0202]
本公开文本的抗体还可以通过使用如下表达系统来产生,在所述表达系统中,可以调节所表达多肽组分的定量比率,以使分泌的且正确装配的本公开文本的抗体的产量最大化。这种调节至少部分是通过同时调节多肽组分的翻译强度而实现的。
[0203]
用于调节翻译强度的一种技术披露于simmons等人,美国专利号5,840,523中。它利用顺反子内的翻译起始区(tir)的变体。对于给定tir,可以产生具有一系列翻译强度的一系列氨基酸或核酸序列变体,从而提供针对特定链的所需表达水平调整此因素的便利方式。可以通过常规诱变技术导致可以改变氨基酸序列的密码子变化来生成tir变体。在某些实施方案中,核苷酸序列中的变化是沉默的。tir中的改变可以包括例如shine-dalgarno序
列的数量或间距的改变以及信号序列中的改变。用于生成突变体信号序列的一种方法是在编码序列的开端生成不改变信号序列的氨基酸序列的“密码子库”(即,变化是沉默的)。这可以通过改变每个密码子的第三核苷酸位置来实现;另外,一些氨基酸(如亮氨酸、丝氨酸和精氨酸)具有多个第一和第二位置,这可能在建库中增加复杂性。这种诱变方法详细描述于以下文献中:yansura等人(1992)methods:a companion to methods in enzymol.4:151-158。
[0204]
在一个实施方案中,对于载体中的每个顺反子,生成具有一系列tir强度的载体组。这个有限的组提供在多种tir强度组合下每条链的表达水平以及所需抗体产物的产量的比较。可以通过对报告基因的表达水平进行定量来确定tir强度,如simmons等人的美国专利号5,840,523中所详述。基于翻译强度的比较,选择所需单独tir以在本公开文本的表达载体构建体中组合。
[0205]
适合于表达本公开文本的抗体的原核宿主细胞包括古细菌和真细菌,如革兰氏阴性或革兰氏阳性生物体。有用细菌的例子包括埃希菌属(例如,大肠杆菌)、芽孢杆菌属(例如,枯草芽孢杆菌)、肠杆菌属、假单胞菌属物种(例如,铜绿假单胞菌)、鼠伤寒沙门氏菌、粘质沙雷氏菌、克雷伯氏菌属、变形菌属、志贺氏菌属、根瘤菌属、透明颤菌属或副球菌属。在一个实施方案中,使用革兰氏阴性细胞。在一个实施方案中,使用大肠杆菌细胞作为本公开文本的宿主。大肠杆菌菌株的例子包括菌株w3110(bachmann,cellular and molecular biology,第2卷(washington,d.c.:american society for microbiology,1987),第1190-1219页;atcc保藏号27,325)及其衍生物,包括具有基因型w3110δfhua(δtona)ptr3 lac iq lacl8 δomptδ(nmpc-fepe)degp41 kanr的菌株33d3(美国专利号5,639,635)。其他菌株及其衍生物(如大肠杆菌294(atcc 31,446)、大肠杆菌b、大肠杆菌λ1776(atcc 31,537)和大肠杆菌rv308(atcc 31,608))也是合适的。这些例子是说明性的而非限制性的。用于构建具有限定基因型的任何上述细菌的衍生物的方法是本领域中已知的,并且描述于例如以下文献中:bass等人,proteins,8:309-314(1990)。通常需要考虑复制子在细菌细胞中的可复制性来选择适当细菌。例如,在使用熟知质粒(如pbr322、pbr325、pacyc177或pkn410)供应复制子时,可以合适地使用大肠杆菌、沙雷菌或沙门菌物种作为宿主。通常,宿主细胞应分泌最小量的蛋白水解酶,而且可以将另外的蛋白酶抑制剂合意地掺入细胞培养中。b)抗体产生
[0206]
用上述表达载体转化宿主细胞,并且在视需要修改的常规营养培养基中培养,用于诱导启动子,选择转化子或扩增编码所需序列的基因。
[0207]
转化意指将dna引入原核宿主中,使得所述dna可复制,其作为染色体外元件或者通过染色体整合子来复制。根据所用宿主细胞,使用对于此类细胞适当的标准技术进行转化。采用氯化钙的钙处理通常用于含有坚固细胞壁屏障的细菌细胞。另一种转化方法采用聚乙二醇/dmso。使用的又另一种技术是电穿孔。
[0208]
使用于产生本公开文本的多肽的原核细胞在本领域中已知且适合于培养选择的宿主细胞的培养基中生长。合适的培养基的例子包括添加了必需营养补充物的luria broth(lb)培养基。在一些实施方案中,培养基还含有基于表达载体的构建而选择的选择剂,以选择性地允许含有所述表达载体的原核细胞生长。例如,将氨苄青霉素添加至培养基用于表达氨苄青霉素抗性基因的细胞的生长。
[0209]
除了碳、氮和无机磷酸盐来源以外,还可以以适当浓度包括任何必需补充物,其是单独地或作为与另一种补充物或培养基(如复合氮源)的混合物引入。任选地,培养基可以含有选自谷胱甘肽、半胱氨酸、胱胺、巯基乙酸盐、二硫赤藓糖醇和二硫苏糖醇的一种或多种还原剂。
[0210]
在合适的温度下培养原核宿主细胞。在某些实施方案中,对于大肠杆菌生长,生长温度的范围为约20℃至约39℃;约25℃至约37℃;或约30℃。培养基的ph可以是范围为约5至约9的任何ph,主要取决于宿主生物体。在某些实施方案中,对于大肠杆菌,ph为约6.8至约7.4,或者约7.0。
[0211]
如果在本公开文本的表达载体中使用诱导型启动子,则在适合于激活启动子的条件下诱导蛋白质表达。在本公开文本的一方面,使用phoa启动子用于控制多肽的转录。因此,在磷酸盐限制培养基中培养转化的宿主细胞以供诱导。在某些实施方案中,磷酸盐限制培养基是c.r.a.p.培养基(参见例如,simmons等人,j.immunol.methods(2002),263:133-147)。根据所采用的载体构建体,可以采用多种其他诱导物,如本领域中已知。
[0212]
在一个实施方案中,所表达的本公开文本的多肽分泌到宿主细胞的周质中并且从中回收。蛋白质回收通常涉及破坏微生物,通常通过诸如渗压震扰、超声处理或裂解等方式。一旦细胞遭到破坏,可以通过离心或过滤去除细胞碎片或完整细胞。可以通过例如亲和树脂色谱进一步纯化蛋白质。可替代地,可以将蛋白质转运至培养基中并从中分离。可以从培养物去除细胞,并且将培养物上清液过滤并浓缩,用于进一步纯化所产生的蛋白质。可以使用公知的方法(如聚丙烯酰胺凝胶电泳(page)和蛋白质印迹测定)进一步分离和鉴定所表达的多肽。
[0213]
在本公开文本的一方面,通过发酵工艺大量进行抗体产生。多种大规模补料-分批发酵程序可用于产生重组蛋白。大规模发酵具有至少1000升的容量,并且在某些实施方案中具有约1,000至100,000升的容量。这些发酵罐使用搅拌器叶轮来分配氧和营养物,尤其是葡萄糖。小规模发酵通常是指在体积容量不超过大约100升的发酵罐中进行的发酵,并且范围可以是约1升至约100升。
[0214]
在发酵工艺中,通常在细胞已经在合适的条件下生长至所需密度(例如,od550为约180-220,在此阶段细胞处于早期稳定期)后,启动对蛋白质表达的诱导。如本领域中已知和上文所述,根据所采用的载体构建体,可以使用多种诱导物。可以在诱导前使细胞生长较短的时间。通常将细胞诱导约12-50小时,但是可以使用更长或更短的诱导时间。
[0215]
为了改进本公开文本的多肽的产量和质量,可以修改多个发酵条件。例如,为了改进所分泌抗体多肽的正确装配和折叠,可以使用过表达伴侣蛋白(如dsb蛋白(dsba、dsbb、dsbc、dsbd和/或dsbg)或fkpa(具有伴侣活性的肽基脯氨酰-顺式,反式-异构酶))的另外的载体共转化宿主原核细胞。已经证明伴侣蛋白有助于在细菌宿主细胞中产生的异源蛋白质的正确折叠和溶解性。chen等人(1999)j.biol.chem.274:19601-19605;georgiou等人,美国专利号6,083,715;georgiou等人,美国专利号6,027,888;bothmann和pluckthun(2000)j.biol.chem.275:17100-17105;ramm和pluckthun(2000)j.biol.chem.275:17106-17113;arie等人(2001)mol.microbiol.39:199-210。
[0216]
为了将表达的异源蛋白质(尤其是对蛋白水解敏感的那些异源蛋白质)的蛋白水解降至最低,可以将蛋白水解酶缺陷的某些宿主菌株用于本公开文本。例如,可以修饰宿主
细胞菌株,以在编码已知细菌蛋白酶(如蛋白酶iii、ompt、degp、tsp、蛋白酶i、蛋白酶mi、蛋白酶v、蛋白酶vi及其组合)的基因中实现一个或多个遗传突变。一些大肠杆菌蛋白酶缺陷菌株是可用的并且描述于例如以下文献中:joly等人(1998),上文;georgiou等人,美国专利号5,264,365;georgiou等人,美国专利号5,508,192;hara等人,microbial drug resistance,2:63-72(1996)。
[0217]
在一个实施方案中,在本公开文本的表达系统中使用蛋白水解酶缺陷且用过表达一种或多种伴侣蛋白的质粒转化的大肠杆菌菌株作为宿主细胞。c)抗体纯化
[0218]
在一个实施方案中,进一步纯化本文中产生的抗体蛋白以获得基本上均质的制剂,用于进一步测定和使用。可以采用本领域中已知的标准蛋白质纯化方法。以下程序是合适的纯化程序的示例:在免疫亲和或离子交换柱上分级、乙醇沉淀、反相hplc、二氧化硅或阳离子交换树脂(如deae)上的色谱、色谱聚焦、sds-page、硫酸铵沉淀,以及使用例如sephadex g-75的凝胶过滤。
[0219]
在一方面,将固定在固相上的蛋白a用于本公开文本抗体产物的免疫亲和纯化。蛋白a是来自金黄色葡萄球菌(staphylococcus aureas)的41kd细胞壁蛋白,其以高亲和力结合至抗体fc区。lindmark等人(1983)j.immunol.meth.62:1-13。固定有蛋白a的固相可以是包含玻璃或二氧化硅表面的柱,或者控孔玻璃柱或硅酸柱。在一些应用中,用试剂(如甘油)涂布柱,以可能地防止污染物的非特异性粘附。
[0220]
作为纯化的第一步骤,可以将源自如上所述的细胞培养的制剂施加到固定蛋白a的固相上,以允许目的抗体特异性结合至蛋白a。然后洗涤固相以去除与固相非特异性结合的污染物。最后,通过洗脱从固相回收目的抗体。使用真核宿主细胞生成抗体:
[0221]
用于真核宿主细胞的载体通常包括以下非限制性组分中的一种或多种:信号序列、复制起点、一种或多种标记基因、增强子元件、启动子和转录终止序列。a)信号序列组分
[0222]
用于真核宿主细胞中的载体还可以在目的成熟蛋白或多肽的n末端含有信号序列或具有特异性切割位点的其他多肽。选择的异源信号序列可以是被宿主细胞识别并加工(即,通过信号肽酶切割)的信号序列。在哺乳动物细胞表达中,哺乳动物信号序列以及病毒分泌前导序列(例如,单纯疱疹gd信号)是可用的。将这种前体区域的dna在阅读框中连接至编码抗体的dna。b)复制起点
[0223]
通常,哺乳动物表达载体不需要复制起点组分。例如,sv40起点通常可能仅因其含有早期启动子才被使用。c)选择基因组分
[0224]
表达和克隆载体可以含有选择基因,也称为选择性标记。典型的选择基因编码如下蛋白质,所述蛋白质:(a)赋予对抗生素或其他毒素(例如,氨苄青霉素、新霉素、甲氨蝶呤或四环素)的抗性,(b)在相关的情况下,补充营养缺陷型缺陷,或者(c)供应无法从复合培养基获得的关键营养物。
[0225]
选择方案的一个例子利用药物来阻止宿主细胞的生长。用异源基因成功转化的那
些细胞产生赋予抗药性的蛋白质,因而幸免于选择方案。此类显性选择的例子使用药物新霉素、霉酚酸和潮霉素。
[0226]
哺乳动物细胞的合适选择性标记的另一个例子是使得能够鉴定有能力摄取抗体核酸的细胞的那些选择性标记,如dhfr、胸苷激酶、金属硫蛋白i和ii、灵长类动物金属硫蛋白基因、腺苷脱氨酶、鸟氨酸脱羧酶等。
[0227]
例如,在一些实施方案中,首先通过将所有转化子在含有甲氨蝶呤(mtx,dhfr的竞争性拮抗剂)的培养基中进行培养来鉴定用dhfr选择基因转化的细胞。在一些实施方案中,在采用野生型dhfr时,适当的宿主细胞是dhfr活性缺陷的中国仓鼠卵巢(cho)细胞系(例如,atcc crl-9096)。
[0228]
可替代地,可以通过在含有针对选择性标记的选择剂(如氨基糖苷抗生素,例如,卡那霉素、新霉素或g418)的培养基中的细胞生长来选择用编码抗体、野生型dhfr蛋白和另一种选择性标记(如氨基糖苷3'-磷酸转移酶(aph))的dna序列转化或共转化的宿主细胞(特别是含有内源dhfr的野生型宿主)。参见美国专利号4,965,199。宿主细胞可以包括ns0、chok1、chok1sv或衍生物,包括谷氨酰胺合成酶(gs)缺陷的细胞系。使用gs作为哺乳动物细胞的选择性标记的方法描述于美国专利号5,122,464和美国专利号5,891,693中。d)启动子组分
[0229]
表达和克隆载体通常含有由宿主生物体识别且与编码目的多肽(例如,抗体)的核酸可操作连接的启动子。已知真核细胞的启动子序列。例如,事实上,所有真核基因都具有富at区,它位于转录起始位点上游大约25至30个碱基处。在许多基因的转录起点上游70至80个碱基处发现的另一个序列是cncaat区,其中n可以是任何核苷酸。在大多数真核基因的3'端是aataaa序列,它可能是将聚a尾添加至编码序列3'端的信号。在某些实施方案中,可以以合适的方式将任何或所有这些序列插入真核表达载体中。
[0230]
在哺乳动物宿主细胞中自载体转录受到例如从以下获得的启动子的控制:病毒基因组,如多瘤病毒、禽痘病毒、腺病毒(如2型腺病毒)、牛乳头瘤病毒、禽类肉瘤病毒、巨细胞病毒、逆转录病毒、乙肝病毒和猿猴病毒40(sv40);异源哺乳动物启动子,例如,肌动蛋白启动子或免疫球蛋白启动子;热休克启动子,前提是此类启动子与宿主细胞系统相容。
[0231]
便利地以sv40限制性片段的形式获得sv40病毒的早期和晚期启动子,所述片段还含有sv40病毒复制起点。便利地以hindiii e限制性片段的形式获得人巨细胞病毒的立即早期启动子。使用牛乳头瘤病毒作为载体在哺乳动物宿主中表达dna的系统披露于美国专利号4,419,446中。该系统的修改形式描述于美国专利号4,601,978中。还参见reyes等人,nature 297:598-601(1982),其描述在小鼠细胞中在来自单纯疱疹病毒的胸苷激酶启动子的控制下表达人β-干扰素cdna。可替代地,可以使用劳氏肉瘤病毒长末端重复序列作为启动子。e)增强子元件组分
[0232]
通常通过将增强子序列插入载体中来增加高等真核细胞对编码本公开文本抗体的dna的转录。现在已知来自哺乳动物基因(球蛋白、弹性蛋白酶、白蛋白、甲胎蛋白和胰岛素)的许多增强子序列。然而,通常,将使用来自真核细胞病毒的增强子。例子包括sv40复制起点晚期侧的增强子(bp 100-270)、人巨细胞病毒早期启动子增强子、小鼠巨细胞病毒早期启动子增强子、多瘤病毒复制起点晚期侧的增强子和腺病毒增强子。还参见yaniv,
nature 297:17-18(1982),其描述用于激活真核启动子的增强子元件。可以将增强子剪接到载体中抗体多肽编码序列的5'或3'位置,但是通常位于启动子的5'位点。f)转录终止组分
[0233]
在真核宿主细胞中使用的表达载体还可以含有终止转录和稳定mrna所需的序列。此类序列通常可从真核或病毒dna或cdna的非翻译区的5'和偶尔的3'获得。这些区域含有在编码抗体的mrna的非翻译部分中转录成聚腺苷酸化片段的核苷酸区段。一种有用的转录终止组分是牛生长激素聚腺苷酸化区域。参见wo94/11026和其中披露的表达载体。g)宿主细胞的选择和转化
[0234]
用于克隆或表达本文载体中的dna的合适宿主细胞包括本文所述的高等真核细胞,包括脊椎动物宿主细胞。脊椎动物细胞在培养(组织培养)中的繁殖已经成为常规程序。有用的哺乳动物宿主细胞系的例子是用sv40转化的猴肾cv1系(cos-7,atcc crl 1651);人胚肾系(293细胞或被亚克隆用于在悬浮培养中生长的293细胞,graham等人,j.gen virol.36:59(1977));幼仓鼠肾细胞(bhk,atcc ccl 10);中国仓鼠卵巢细胞/-dhfr(cho,urlaub等人,proc.natl.acad.sci.usa 77:4216(1980));小鼠支持细胞(tm4,mather,biol.reprod.23:243-251(1980));猴肾细胞(cv1,atcc ccl 70);非洲绿猴肾细胞(vero-76,atcc crl-1587);人宫颈癌细胞(hela,atcc ccl 2);犬肾细胞(mdck,atcc ccl 34);水牛鼠(buffalo rat)肝细胞(brl 3a,atcc crl1442);人肺细胞(w138,atcc ccl 75);人肝细胞(hep g2,hb 8065);小鼠乳房肿瘤(mmt 060562,atcc ccl51);tri细胞(mather等人,annals n.y.acad.sci.383:44-68(1982));mrc 5细胞;fs4细胞;chok1细胞、chok1sv细胞或衍生物和人肝细胞瘤系(hep g2)。
[0235]
将宿主细胞用上述表达或克隆载体转化用于抗体产生,并且在视需要修改的常规营养培养基中培养用于诱导启动子、选择转化子或扩增编码所需序列的基因。h)培养宿主细胞
[0236]
可以在多种培养基中培养用于产生本公开文本抗体的宿主细胞。可商购的培养基,如ham's f10(sigma)、最低要素培养基((mem),sigma)、rpmi-1640(sigma)和杜尔贝科氏改良伊格培养基((dmem),sigma),适合于培养宿主细胞。另外,可以使用以下文献中所述的任何培养基作为宿主细胞的培养基:ham等人,meth.enz.58:44(1979);barnes等人,anal.biochem.102:255(1980);美国专利号4,767,704、4,657,866、4,927,762、4,560,655或5,122,469;wo 90/03430;wo 87/00195;或美国专利再颁30,985。任何这些培养基可根据需要补充激素和/或其他生长因子(如胰岛素、运铁蛋白或表皮生长因子)、盐(如氯化钠、钙、镁和磷酸盐)、缓冲液(如hepes)、核苷酸(如腺苷和胸苷)、抗生素(如gentamycin
tm
药物)、痕量元素(定义为通常以微摩尔范围的终浓度存在的无机化合物)和葡萄糖或等效能源。还可以适当浓度包括本领域技术人员将知的任何其他补充物。培养条件(如温度、ph等)是先前用于表达所选宿主细胞的那些条件,并且对于普通技术人员是清楚的。i)抗体的纯化
[0237]
在使用重组技术时,抗体可以在细胞内产生,或者直接分泌到培养基中。如果在细胞内产生抗体,作为第一步骤,可以例如通过离心或超滤去除微粒碎片,即宿主细胞或裂解的片段。在抗体被分泌到培养基中的情况下,可以首先使用市售蛋白质浓缩过滤器(例如,amicon或millipore pellicon超滤单元)浓缩来自此类表达系统的上清液。可以在任何前
述步骤中包括蛋白酶抑制剂(如pmsf)以抑制蛋白水解,并且可以包括抗生素以防止外来污染物生长。
[0238]
可以使用例如羟磷灰石色谱、凝胶电泳、透析和亲和色谱来纯化从细胞制备的抗体组合物,其中亲和色谱是便利的技术。蛋白a作为亲和配体的适用性取决于抗体中存在的任何免疫球蛋白fc结构域的种类和同种型。蛋白a可以用于纯化基于人γ1、γ2或γ4重链的抗体(lindmark等人,j.immunol.methods 62:1-13(1983))。推荐蛋白g用于所有小鼠同种型以及用于人γ3(guss等人,embo j.5:15671575(1986))。亲和配体所附接的基质可以是琼脂糖,但是可以使用其他基质。机械稳定的基质(如控孔玻璃或聚(苯乙烯二乙烯基)苯)允许比用琼脂糖可实现的更快的流速和更短的加工时间。在抗体包含ch3结构域的情况下,bakerbond abx
tm
树脂(j.t.baker,菲利普斯堡,新泽西州)可用于纯化。取决于要回收的抗体,也可使用其他蛋白质纯化技术,如在离子交换柱上分级、乙醇沉淀、反相hplc、二氧化硅上的色谱、肝素sepharose
tm
上的色谱、阴离子或阳离子交换树脂(如聚天冬氨酸柱)上的色谱、色谱聚焦、sds-page和硫酸铵沉淀。
[0239]
在任何一个或多个初步纯化步骤之后,可以使包含目的抗体和污染物的混合物经历进一步纯化,例如,通过低ph疏水相互作用色谱,使用ph在约2.5-4.5之间的洗脱缓冲液,在低盐浓度(例如,约0-0.25m盐)下进行。
[0240]
通常,用于制备供研究、测试和临床使用的抗体的各种方法是本领域已完善建立的,与上述方法一致,和/或被本领域技术人员认为适合于特定的目的抗体。未岩藻糖基化抗体的产生
[0241]
本文提供用于制备岩藻糖基化的程度降低的抗体的方法。例如,本文中考虑的方法包括但不限于使用蛋白质岩藻糖基化缺陷的细胞系(例如,lec13cho细胞、α-1,6-岩藻糖基转移酶基因敲除的cho细胞、过表达β1,4-n-乙酰基葡糖胺基转移酶iii且进一步过表达高尔基μ-甘露糖苷酶ii的细胞等),以及在用于产生抗体的细胞培养基中添加一种或多种岩藻糖类似物。参见ripka等人arch.biochem.biophys.249:533-545(1986);美国专利申请号us 2003/0157108 a1,presta,l;wo 2004/056312 a1;yamane-ohnuki等人biotech.bioeng.87:614(2004);以及美国专利号8,574,907。用于降低抗体的岩藻糖含量的另外的技术包括美国专利申请公开号2012/0214975中所述的glymaxx技术。用于降低抗体的岩藻糖含量的另外的技术还包括在用于产生抗体的细胞培养基中添加一种或多种糖苷酶抑制剂。糖苷酶抑制剂包括α-葡萄糖苷酶i、α-葡萄糖苷酶ii和α-甘露糖苷酶i。在一些实施方案中,糖苷酶抑制剂是α-甘露糖苷酶i的抑制剂(例如,几夫碱(kifunensine))。
[0242]
如本文所用,“核心岩藻糖基化”是指在n连接的聚糖的还原性末端对n-乙酰基葡糖胺(“glcnac”)添加岩藻糖(“岩藻糖基化”)。还提供通过此类方法产生的抗体及其组合物。
[0243]
在一些实施方案中,结合至fc区(或结构域)的复合n-糖苷连接的糖链的岩藻糖基化降低。如本文所用,“复合n-糖苷连接的糖链”通常结合至天冬酰胺297(根据kabat编号),但复合n-糖苷连接的糖链也可以连接至其他天冬酰胺残基。“复合n-糖苷连接的糖链”排除其中在核心结构的非还原性末端只掺入甘露糖的高甘露糖型的糖链,但是包括1)复合型,其中核心结构的非还原性末端侧具有一个或多个半乳糖-n-乙酰基葡糖胺(也称作“gal-glcnac”)分支且gal-glcnac的非还原性末端侧任选地具有唾液酸、两分型n-乙酰基葡糖胺
等;或者2)杂合型,其中核心结构的非还原性末端侧具有高甘露糖n-糖苷连接的糖链和复合n-糖苷连接的糖链两种分支。
[0244]
在一些实施方案中,“复合n-糖苷连接的糖链”包括复合型,其中核心结构的非还原末端侧具有零个、一个或多个半乳糖-n-乙酰基氨基葡萄糖(也称为“gal-glcnac”)分支并且gal-glcnac的非还原末端侧任选地进一步具有诸如唾液酸、两分型n-乙酰基氨基葡萄糖等结构。
[0245]
根据本发明方法,一种或多种复合n-糖苷连接的糖链中通常只掺入少量岩藻糖。例如,在各种实施方案中,组合物中少于约60%、少于约50%、少于约40%、少于约30%、少于约20%、少于约15%、少于约10%、少于约5%或少于约1%的抗体具有岩藻糖所致的核心岩藻糖基化。在一些实施方案中,组合物中基本上没有(即,少于约0.5%)抗体具有岩藻糖所致的核心岩藻糖基化。在一些实施方案中,组合物中多于约40%、多于约50%、多于约60%、多于约70%、多于约80%、多于约90%、多于约91%、多于约92%、多于约93%、多于约94%、多于约95%、多于约96%、多于约97%、多于约98%、或多于约99%的抗体是未岩藻糖基化的。
[0246]
在一些实施方案中,本文提供如下抗体,其中基本上没有(即,少于约0.5%)的n-糖苷连接的碳水化合物链含有岩藻糖残基。在一些实施方案中,本文提供如下抗体,其中所述抗体的至少一条或两条重链是未岩藻糖基化的。
[0247]
如上所述,可以利用多种哺乳动物宿主-表达载体系统来表达抗体。在一些实施方案中,培养基未补充岩藻糖。在一些实施方案中,将有效量的岩藻糖类似物添加至培养基中。在此上下文中,“有效量”是指类似物足以将抗体的复合n-糖苷-连接的糖链中的岩藻糖掺入降低至少约10%、至少约20%、至少约30%、至少约40%或至少约50%的量。在一些实施方案中,如与从在不存在岩藻糖类似物的情况下培养的宿主细胞产生的抗体相比,通过本发明方法产生的抗体包含至少约10%、至少约20%、至少约30%、至少约40%或至少约50%核心未岩藻糖基化的蛋白(例如,缺少核心岩藻糖基化)。
[0248]
可以确定岩藻糖没有结合至糖链的还原性末端中的n-乙酰基葡糖胺的糖链与岩藻糖结合至糖链的还原性末端中的n-乙酰基葡糖胺的糖链的含量(例如,比率),例如,如实施例中所述。其他方法包括肼解或酶消化(参见例如,biochemical experimentation methods 23:method for studying glycoprotein sugar chain(japan scientific societies press),reiko takahashi编辑(1989)),荧光标记或放射性同位素标记释放的糖链,然后通过色谱分离标记的糖链。也可以通过用hpaec-pad方法分析链来确定释放的糖链的组成(参见例如,j.liq chromatogr.6:1557(1983))。(通常参见美国专利申请公开号2004/0110282)。iii.组合物
[0249]
在一些方面,本文还提供包含本文所述的任何抗siglec-8抗体(例如,与siglec-8结合的抗体)的组合物(例如,药物组合物)。在一些方面,本文提供包含本文所述的抗siglec-8抗体的组合物,其中所述抗体包含fc区和与所述fc区连接的n-糖苷连接的碳水化合物链,其中少于约50%的所述n-糖苷连接的碳水化合物链含有岩藻糖残基。在一些实施方案中,抗体包含fc区和与所述fc区连接的n-糖苷连接的碳水化合物链,其中少于约45%、约40%、约35%、约30%、约25%、约20%或约15%的n-糖苷连接的碳水化合物链含有岩藻
糖残基。在一些方面,本文提供包含本文所述的抗siglec-8抗体的组合物,其中所述抗体包含fc区和与所述fc区连接的n-糖苷连接的碳水化合物链,其中基本上没有n-糖苷连接的碳水化合物链含有岩藻糖残基。
[0250]
通过将具有所需纯度的活性成分与任选的药学上可接受的载体、赋形剂或稳定剂混合来制备治疗配制品以供储存(remington:the science and practice of pharmacy,第20版,lippincott williams&wiklins,pub.,gennaro编辑,费城,宾夕法尼亚州2000)。可接受的载体、赋形剂或稳定剂在所用剂量和浓度下对接受者是无毒的,并且包括缓冲液、抗氧化剂(包括抗坏血酸、甲硫氨酸、维生素e、偏亚硫酸氢钠);防腐剂、等渗剂、稳定剂、金属络合物(例如,zn-蛋白质络合物);螯合剂(如edta)和/或非离子表面活性剂。
[0251]
可以使用缓冲液将ph控制在优化治疗有效性的范围内,尤其在稳定性依赖于ph的情况下。缓冲液可以以范围为约50mm至约250mm的浓度存在。用于本公开文本的合适的缓冲液包括有机酸和无机酸二者及其盐。例如,柠檬酸盐、磷酸盐、琥珀酸盐、酒石酸盐、富马酸盐、葡糖酸盐、草酸盐、乳酸盐、乙酸盐。另外,缓冲液可以由组氨酸和三甲胺盐(如tris)构成。
[0252]
可以添加防腐剂来防止微生物生长,并且通常以约0.2%-1.0%(w/v)的范围存在。用于本公开文本的合适的防腐剂包括十八烷基二甲基苄基氯化铵;六甲氯铵;苯扎卤铵(例如,苯扎氯铵、苯扎溴铵、苯扎碘铵)、苄索氯铵;硫柳汞、苯酚、丁醇或苄基醇;对羟基苯甲酸烷基酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇、3-戊醇和间甲酚。
[0253]
可以存在张力剂(有时称为“稳定剂”)以调整或维持组合物中液体的张力。当与大的带电荷的生物分子(如蛋白质和抗体)一起使用时,它们通常被称为“稳定剂”,因为它们可以与氨基酸侧链的带电荷的基团相互作用,从而减小分子间和分子内相互作用的可能性。等渗剂可以以约0.1%至约25%(以重量计)之间或约1%至约5%(以重量计)之间的任何量存在,其中考虑到其他成分的相对量。在一些实施方案中,张力剂包括多元糖醇、三元或更高级糖醇,如甘油、赤藓糖醇、阿糖醇、木糖醇、山梨醇和甘露醇。
[0254]
另外的赋形剂包括可以用作以下中的一种或多种的药剂:(1)膨胀剂,(2)溶解度增强剂,(3)稳定剂,以及(4)防止变性或粘附至容器壁的药剂。此类赋形剂包括:多元糖醇(上面列举的);氨基酸,如丙氨酸、甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸、赖氨酸、鸟氨酸、亮氨酸、2-苯丙氨酸、谷氨酸、苏氨酸等;有机糖或糖醇,如蔗糖、乳糖、乳糖醇、海藻糖、水苏糖、甘露糖、山梨糖、木糖、核糖、核糖醇、肌肉肌糖、肌肉肌醇、半乳糖、半乳糖醇、甘油、环醇(例如,肌醇)、聚乙二醇;含硫还原剂,如脲、谷胱甘肽、硫辛酸、硫代乙醇酸钠、硫代甘油、α-单硫代甘油和硫代硫酸钠;低分子量蛋白质,如人血清白蛋白、牛血清白蛋白、明胶或其他免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;单糖(例如,木糖、甘露糖、果糖、葡萄糖;二糖(例如乳糖、麦芽糖、蔗糖);三糖,如棉子糖;以及多糖,如糊精或葡聚糖。
[0255]
可以存在非离子表面活性剂或洗涤剂(也称为“润湿剂”)以帮助溶解治疗剂以及保护治疗性蛋白免于发生搅动诱导的聚集,这也允许配制品暴露于剪切表面应力而不引起活性治疗蛋白或抗体的变性。非离子表面活性剂以约0.05mg/ml至约1.0mg/ml或约0.07mg/ml至约0.2mg/ml的范围存在。在一些实施方案中,非离子型表面活性剂以约0.001%至约0.1%w/v或约0.01%至约0.1%w/v或约0.01%至约0.025%w/v的范围存在。
[0256]
合适的非离子表面活性剂包括聚山梨醇酯(20、40、60、65、80等),泊洛沙姆(184、188等),多元醇,聚氧乙烯脱水山梨糖醇单醚(-20、-80等),聚桂醇400,聚烃氧40硬脂酸酯,聚氧乙烯氢化蓖麻油10、50和60,单硬脂酸甘油酯,蔗糖脂肪酸酯,甲基纤维素和羧甲基纤维素。可以使用的阴离子洗涤剂包括十二烷基硫酸钠、二辛基磺基琥珀酸钠和二辛基磺酸钠。阳离子洗涤剂包括苯扎氯铵或苄索氯铵。
[0257]
为了配制品用于体内施用,它们必须是无菌的。通过无菌滤膜过滤,可以使得配制品变成无菌的。通常将本文中的治疗性组合物置入具有无菌存取口的容器中,例如,静脉内溶液袋或具有皮下注射针可刺穿的塞子的小瓶。
[0258]
施用途径是根据已知且可接受的方法,如通过单次或多次推注或者以合适的方式长时间输注,例如,通过皮下、静脉内、腹膜内、肌内、动脉内、病灶内或关节内途径注射或输注,局部施用,吸入或通过持续释放或延长释放方式。在一些实施方案中,通过静脉内输注施用本公开文本的组合物或抗体,每月一次,持续3个或更多个月。
[0259]
本文中的配制品还可以根据所治疗特定适应症的需要含有超过一种活性化合物,优选地具有互补活性的那些,所述活性彼此不会造成不良影响。此类活性化合物以合适的方式以对于预定目的有效的量组合存在。iv.制品或试剂盒
[0260]
在另一方面,提供包含本文所述的抗siglec-8抗体(例如,与人siglec-8结合的抗体)的制品或试剂盒。制品或试剂盒还可以包含将抗体用于本公开文本的方法中的说明书。在某些实施方案中,所述个体是人。
[0261]
所述制品或试剂盒还可以包含容器。合适的容器包括例如瓶子、小瓶(例如,双室小瓶)、注射器(如单室或双室注射器)和试管。容器可以由各种材料(如玻璃或塑料)形成。所述容器容纳所述配制品。
[0262]
制品或试剂盒还可以包含在容器上或与容器相联的标签或药品说明书,所述标签或药品说明书可以指示重构和/或使用配制品的说明。标签或药品说明书还可以指示,所述配制品用于或意图用于皮下、静脉内或其他施用方式,用于治疗和/或预防个体中本公开文本的疾病或障碍。容纳配制品的容器可以是一次性小瓶或多次使用的小瓶,其允许重复施用重构的配制品。制品或试剂盒还可以包含含有合适的稀释剂的第二容器。制品或试剂盒还可以包括从商业、治疗和用户角度来看期望的其他材料,包括其他缓冲液、稀释剂、过滤器、针、注射器和具有使用说明书的药品说明书。
[0263]
在具体实施方案中,本公开文本提供用于单一剂量施用单元的试剂盒。此类试剂盒包含治疗性抗体的水性配制品的容器,包括单室或多室预装填注射器。示例性预装填注射器可以从vetter gmbh(雷根斯堡,德国)获得。
[0264]
在另一个实施方案中,本文提供制品或试剂盒,其包含用于在自动注射器装置中施用的本文所述的配制品。自动注射器可以描述为在启动后无需患者或施用者另外的必需动作就会递送其内容物的注射装置。当递送速率必须恒定并且递送时间大于少许片刻的时候,它们特别适于治疗性配制品的自我用药。
[0265]
在另一方面,提供包含本文所述的抗siglec-8抗体(例如,与人siglec-8结合的抗体)的制品或试剂盒。制品或试剂盒还可以包含将抗体用于本公开文本的方法中的说明书。
[0266]
应理解,本文所述的方面和实施方案仅用于说明目的,并且根据它们进行的各种修改或变化将为本领域技术人员知晓,并且应包括在本技术的精神和范围内以及所附权利要求的范围内。实施例
[0267]
通过参考下述实施例,将更全面地理解本公开文本。然而,所述实施例不应被解读为限制本公开文本的范围。应理解,本文所描述的实施例和实施方案仅用于说明目的,并且根据它们进行的各种修改或变化将为本领域技术人员知晓,并且应包括在本技术的精神和范围以及所附权利要求的范围内。实施例1:用于评价抗siglec-8抗体治疗在患有嗜酸细胞性胃炎和/或嗜酸细胞性胃肠炎的患者中的安全性和耐受性的2期研究的结果
[0268]
此实施例描述检查使用人源化的未岩藻糖基化的igg1单克隆抗siglec-8抗体(heka)对患有嗜酸细胞性胃炎(eg)和/或嗜酸细胞性胃肠炎(ege)的患者的治疗的2期的结果。具体而言,此研究评价抗siglec-8抗体在患有eg和/或ege的患者中的安全性和耐受性。
[0269]
eg和/或ege代表罕见类型的嗜酸细胞性胃肠障碍并且特征为由于嗜酸性粒细胞的片状浸润或弥漫性浸润至胃(eg)或者胃和小肠(ege)的层中所致的慢性炎症(prussin,c.(2014)gastroenterol.clin.north.am.43:317-327;reed,c.等人(2015)dig.liver dis.47:197-201;zhang,m.和li,y.(2017)j.gastroenterol.hepatol.32:64-72)。在没有嗜酸性粒细胞增多症的任何其他病因的情况下,基于临床表现(胃肠症状)结合来自胃和小肠的活检样本中增加的组织嗜酸性粒细胞来做出诊断。据信胃肠症状是由于从激活的嗜酸性粒细胞以及可能从肥大细胞释放炎症介质所致,并且可能根据嗜酸细胞性浸润物在胃肠道中的层和/或位置而变化。症状一般包括恶心、呕吐、腹痛、腹泻、胃气胀、早饱和体重减轻(alhmoud,t.等人(2016)dig.dis.sci.61:2585-2592;lopez-medina,g.等人(2015)case rep.gastrointest.med.2015:1-5;mansoor,e.等人(2017)clin.gastroenterol.hepatol.15:1733-1741;reed,c.等人(2015)dig.liver dis.47:197-201)。对于1至64岁的患者,eg和ege的患病率被估计分别为6.3/100,000和8.4/100,000(jensen,e.等人(2016)j.pediatr.gastroenterol.nutr.62:36-42)。eg的总患病率被估计为5.1/100,000人(mansoor,e.等人(2017)clin.gastroenterol.hepatol.15:1733-1741)。
[0270]
不存在由fda批准的对eg和/或ege的治疗。当前疗法和疾病管理包括质子泵抑制剂、抗组胺、限制/要素饮食、全身或口服皮质类固醇以及免疫调节性生物制品的偶尔超说明书使用。质子泵抑制剂在患有eg和/或ege的患者中益处很小或没有益处但是在患有嗜酸细胞性食管炎的患者中可以观察到部分益处(katz,p.等人(2013)am.j.gastroenterol.108:308-328)。限制/要素饮食被认为对于长期治疗是不可持续的,并且更多地用于提供营养,尽管症状持续。全身或口服的皮质类固醇可以提供症状缓解,但是由于其多种副作用而不是用于长期治疗的解决方案。
[0271]
siglec-8具有有限的组织分布,选择性地在嗜酸性粒细胞、肥大细胞的表面上以及(以较低水平)在嗜碱性粒细胞上表达。抗siglec-8抗体与siglec-8的结合诱导抑制肥大细胞激活并且可以在嗜酸性粒细胞中导致细胞凋亡的信号。在效应细胞(如自然杀伤细胞)的存在下,与siglec-8结合的抗siglec-8抗体通过抗体依赖性细胞介导的细胞毒性(adcc)
耗尽循环嗜酸性粒细胞。不希望受限于理论,认为这种活性概况可以在这些细胞类型具有作用的疾病如嗜酸细胞性胃炎(eg)和/或嗜酸细胞性胃肠炎(ege)中提供临床益处。研究设计
[0272]
此项研究是随机的、双盲的、安慰剂对照的研究。研究中入组的患者显示eg和/或ege的中度至重度症状。所有患者报告在3周的pro收集中的至少2周期间在患者报告结局(pro)问卷上针对腹痛、腹泻和/或恶心所记录的平均每周得分≥3(按照0-10的量表)。每个资格考察(qualifying)周完成最少四份问卷。
[0273]
此外,所有患者进行针对eg/ege症状的护理标准治疗但失败或者疾病症状未被充分控制,所述治疗尤其可以包括质子泵抑制剂(ppi)、全身或局部皮质类固醇和/或饮食。
[0274]
另外,在没有胃嗜酸性粒细胞增多症的任何其他病因(例如,寄生虫或其他感染或恶性肿瘤)的情况下,每名患者通过胃镜检查术(egd)被确认患有eg和/或ege,如通过来自在筛选阶段期间进行的egd的胃粘膜的嗜酸性粒细胞增多症(在5个hpf中≥30个嗜酸性粒细胞/hpf)和/或十二指肠粘膜的嗜酸性粒细胞增多症(在3个hpf中≥30个嗜酸性粒细胞/hpf)所定义。关于更多细节,参见clinicaltrials.gov标识符nct03496571。
[0275]
65名患者在3个组中入组。在第一组中,22名患者按以下剂量接受抗siglec-8抗体(未岩藻糖基化的igg1抗体heka):0.3mg/kg用于第一剂量,并且1.0mg/kg用于第二剂量、第三剂量和第四剂量(“低剂量”)。在第二组中,22名患者按以下剂量接受抗siglec-8抗体:0.3mg/kg用于第一剂量,1.0mg/kg用于第二剂量,并且3.0mg/kg用于第三剂量和第四剂量(“高剂量”)。第三组中的患者接受安慰剂。所有剂量都是每月提供。
[0276]
主要终点是在接受治疗或安慰剂之前和之后在gi活检物中观察到的每个hpf的嗜酸性粒细胞的变化百分比。嗜酸性粒细胞计数的平均变化百分比是通过将治疗第14周的计数与基线计数相比较来计算。
[0277]
次要终点包括治疗反应者的百分比和如通过pro问卷所报告的症状的变化(二者均比较第13-14周与基线),以及对共病嗜酸细胞性食管炎(eoe)的探索性评估。通过pro问卷报告的症状包括腹痛、恶心、腹泻、呕吐、饭前饱腹感、食欲不振、腹部绞痛和胃气胀。所述8种症状中的每一种是按0至10的量表来测量(总分可以是80分)。这个问卷捕获了eg/ege的最显著的症状。治疗反应者被定义为根据第13-14周的pro问卷,组织活检嗜酸性粒细胞计数减少》75%且总症状得分(tss)减小》30%。这些终点被设计为显示(1)组织嗜酸性粒细胞耗尽,(2)症状改进,以及(3)在相同个体中出现的这些作用。结果
[0278]
此项研究被完成并且符合所有预先设定的主要和次要终点。
[0279]
治疗组中的患者的平均基线gi嗜酸性粒细胞计数是78,并且安慰剂组中的患者的平均基线gi嗜酸性粒细胞计数是75。治疗组中的患者的平均基线tss是34,并且安慰剂组中的患者的平均基线tss是30。
[0280]
图1显示,用抗siglec-8抗体治疗的所有组都符合主要终点。对于《0.0001的p值,两个治疗组的嗜酸性粒细胞计数从基线至第13-14周的平均减少为95%。这包括在高剂量组的患者中观察到的97%减少,以及在低剂量组的患者中观察到的95%减少。相比之下,观察到安慰剂组显示嗜酸性粒细胞计数的平均增加为10%。重要的是,39名接受抗siglec-8抗体的患者中有37名(95%)的胃和十二指肠嗜酸性粒细胞计数《30/hpf。
[0281]
图2显示,用抗siglec-8抗体治疗的所有组也都符合tss次要终点。对于0.0012的p值,两个治疗组的tss从基线至第13-14周的平均减小为54%。这包括在高剂量组的患者中观察到的58%减小,以及在低剂量组的患者中观察到的49%减小。相比之下,观察到安慰剂组显示tss的平均减小仅为24%。重要的是,在第一次输注后第1天观察到症状的统计学上显著的改进,并且在整个研究期间维持所述改进。
[0282]
在接受抗siglec-8抗体的患者中观察到所有症状的改进。图3显示对于来自高剂量组患者的pro问卷中的每种症状,tss从基线至治疗结束时的减小百分比。
[0283]
图4显示,用抗siglec-8抗体治疗的所有组也都符合反应者次要终点。对于0.0008的p值,用抗siglec-8抗体治疗的所有患者中的反应者百分比为69%。这包括在高剂量组患者中观察到的70%反应者,以及在低剂量组患者中观察到的68%反应者。相比之下,安慰剂组中仅5%是反应者。
[0284]
在患有eoe的患者中还观察到明显的嗜酸性粒细胞减少。如图5中所示,14名用抗siglec-8抗体治疗的eoe患者中有13名(93%)在治疗第14周显示《5个嗜酸性粒细胞/hpf,相比之下,安慰剂组中为11%。另外,抗siglec-8治疗还导致吞咽困难的实质性改进(图6)。这些结果证实了在抗siglec-8治疗后eoe的组织学和症状改进二者,从而为针对此适应症使用抗siglec-8抗体治疗提供了强有力的概念验证。安全性
[0285]
在91%的接受抗siglec-8抗体治疗的患者中见到至少1种治疗中出现的不良事件(ae),相比之下,在安慰剂组中为82%(图7)。抗siglec-8抗体治疗大体上耐受良好。在61%的接受抗siglec-8抗体的患者中观察到irr,相比之下,在安慰剂组中为23%。95%的irr是轻度至中度(例如,潮红、发热感、头痛、恶心、头晕)。一例药物相关的严重ae是irr,但是患者在24小时内康复且无其他后遗症。未观察到其他明显ae。实施例2:用于评价抗siglec-8抗体治疗在患有嗜酸细胞性胃炎和/或嗜酸细胞性胃肠炎的患者中的安全性和耐受性的2期、多中心、开放标签扩展研究
[0286]
基于2期研究的最大入组,大约60名患者在此项扩展研究中入组。完成所述2期研究的患者具有以开放标签方式接受抗siglec-8抗体的选择。
[0287]
对于第一次输注施用1mg/kg抗siglec-8抗体(未岩藻糖基化的igg1抗体heka),此后随之每4周施用3mg/kg的剂量。患者接受抗siglec-8抗体的最多8次输注,每28(
±
3)天施用。
[0288]
在ak002的第一次输注之前,在输注之前12-24小时给予80mg口服泼尼松,并且在输注之前约1小时给予solumedrol(100mg iv)、西替利嗪(10mg口服)和对乙酰氨基酚(975-1000mg口服)。
[0289]
在此项进行中的扩展研究中,已经在每个第一抗siglec-8抗体剂量(如上所述)之前12-24小时施用皮质类固醇。迄今,在58名患者中尚未观察到irr。序列除非另有说明,否则所有多肽序列都是从n末端至c末端呈现。除非另有说明,否则所有核酸序列都是从5'至3'呈现。小鼠2e2重链可变结构域的氨基酸序列qvqlkesgpglvapsqslsitctvsgfsltiygahwvrqppgkglewlgviwaggstnynsalmsrls
iskdnsksqvflkinslqtddtalyycardgsspyyysmeywgqgtsvtvss(seq id no:1)2e2 rha重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvsviwaggstnynsalmsrftiskdnskntvylqmnslraedtavyycardgsspyyysmeywgqgttvtvss(seq id no:2)2e2 rhb重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscavsgfsltiygahwvrqapgkglewlgviwaggstnynsalmsrlsiskdnskntvylqmnslraedtavyycardgsspyyysmeywgqgttvtvss(seq id no:3)2e2 rhc重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscavsgfsltiygahwvrqapgkglewvsviwaggstnynsalmsrftiskdnskntvylqmnslraedtavyycardgsspyyysmeywgqgttvtvss(seq id no:4)2e2 rhd重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewlsviwaggstnynsalmsrftiskdnskntvylqmnslraedtavyycardgsspyyysmeywgqgttvtvss(seq id no:5)2e2 rhe重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvgviwaggstnynsalmsrftiskdnskntvylqmnslraedtavyycardgsspyyysmeywgqgttvtvss(seq id no:6)2e2 rhf重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvsviwaggstnynsalmsrltiskdnskntvylqmnslraedtavyycardgsspyyysmeywgqgttvtvss(seq id no:7)2e2 rhg重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvsviwaggstnynsalmsrfsiskdnskntvylqmnslraedtavyycardgsspyyysmeywgqgttvtvss(seq id no:8)2e2 rha2重链可变结构域的氨基酸序列qvqlqesgpglvkpsetlsltctvsggsisiygahwirqppgkglewigviwaggstnynsalmsrvtisvdtsknqfslklssvtaadtavyycardgsspyyysmeywgqgtlvtvss(seq id no:9)2e2 rhb2重链可变结构域的氨基酸序列qvqlqesgpglvkpsetlsltctvsgfsltiygahwvrqppgkglewlgviwaggstnynsalmsrlsiskdnsknqvslklssvtaadtavyycardgsspyyysmeywgqgtlvtvss(seq id no:10)2e2 rhe s-g突变体重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvgviwaggstnynsalmsrftiskdnskntvylqmnslraedtavyycardgsspyyygmeywgqgttvtvss(seq id no:11)2e2 rhe e-d重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvgviwaggstnynsalmsrftiskdnskntvylqmnslraedtavyycardgsspyyysmdywgqgttvtvss(seq id no:12)2e2 rhe y-v重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvgviwaggstnynsalmsrftiskdnskntvylqmnslraedtavyycardgsspyyysmevwgqgttvtvss(seq id no:13)2e2 rhe三重突变体重链可变结构域的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvgviwaggstnynsalmsrft
iskdnskntvylqmnslraedtavyycardgsspyyygmdvwgqgttvtvss(seq id no:14)小鼠2e2轻链可变结构域的氨基酸序列qiiltqspaimsaspgekvsitcsatssvsymhwfqqkpgtspklwiystsnlasgvpvrfsgsgsgtsysltisrmeaedaatyycqqrssypftfgsgtkleik(seq id no:15)2e2 rka轻链可变结构域的氨基酸序列eivltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlliystsnlasgiparfsgsgsgtdftltisslepedfavyycqqrssypftfgpgtkldik(seq id no:16)2e2 rkb轻链可变结构域的氨基酸序列eiiltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlwiystsnlasgvparfsgsgsgtdytltisslepedfavyycqqrssypftfgpgtkldik(seq id no:17)2e2 rkc轻链可变结构域的氨基酸序列eiiltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlliystsnlasgiparfsgsgsgtdftltisslepedfavyycqqrssypftfgpgtkldik(seq id no:18)2e2 rkd轻链可变结构域的氨基酸序列eivltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlwiystsnlasgiparfsgsgsgtdftltisslepedfavyycqqrssypftfgpgtkldik(seq id no:19)2e2 rke轻链可变结构域的氨基酸序列eivltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlliystsnlasgvparfsgsgsgtdftltisslepedfavyycqqrssypftfgpgtkldik(seq id no:20)2e2 rkf轻链可变结构域的氨基酸序列eivltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlliystsnlasgiparfsgsgsgtdytltisslepedfavyycqqrssypftfgpgtkldik(seq id no:21)2e2 rkg轻链可变结构域的氨基酸序列eivltqspatlslspgeratlscsatssvsymhwyqqkpgqaprlliystsnlasgiparfsgsgsgtdftltisslepedfavyycqqrssypftfgpgtkldik(seq id no:22)2e2 rka f-y突变体轻链可变结构域的氨基酸序列eivltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlliystsnlasgiparfsgsgsgtdftltisslepedfavyycqqrssypytfgpgtkldik(seq id no:23)2e2 rkf f-y突变体轻链可变结构域的氨基酸序列eivltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlliystsnlasgiparfsgsgsgtdytltisslepedfavyycqqrssypytfgpgtkldik(seq id no:24)heka重链和hekf重链的氨基酸序列evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvgviwaggstnynsalmsrftiskdnskntvylqmnslraedtavyycardgsspyyysmeywgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:75)
heka轻链的氨基酸序列eivltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlliystsnlasgiparfsgsgsgtdftltisslepedfavyycqqrssypftfgpgtkldikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:76)hekf轻链的氨基酸序列eivltqspatlslspgeratlscsatssvsymhwfqqkpgqaprlliystsnlasgiparfsgsgsgtdytltisslepedfavyycqqrssypftfgpgtkldikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:77)igg1重链恒定区的氨基酸序列astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:78)igg4重链恒定区的氨基酸序列astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslg(seq id no:79)igκ轻链恒定区的氨基酸序列rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:80)鼠2c4和2e2 igg1重链的氨基酸序列qvqlkrasgpglvapsqslsitctvsgfsltiygahwvrqppgkglewlgviwaggstnynsalmsrlsiskdnsksqvflkinslqtddtalyycardgsspyyysmeywgqgtsvtvssakttppsvyplapgsaaqtnsmvtlgclvkgyfpepvtvtwnsgslssgvhtfpavlesdlytlsssvtvpssprpsetvtcnvahpasstkvdkkivprdcgckpcictvpevssvfifppkpkdvltitltpkvtcvvvdiskddpevqfswfvddvevhtaqtqpreeqfnstfrsvselpimhqdwlngkefkcrvnsaafpapiektisktkgrpkapqvytipppkeqmakdkvsltcmitdffpeditvewqwngqpaenykntqpimntngsyfvysklnvqksnweagntftcsvlheglhnhhtekslshspg(seq id no:81)鼠2c4κ轻链的氨基酸序列eiiltqspaimsaspgekvsitcsatssvsymhwfqqkpgtspklwiystsnlasgvpvrfsgsgsgtsysltisrmeaedaatyycqqrssypftfgsgtkleikadaaptvsifppsseqltsggasvvcflnnfypkdinvkwkidgserqngvlnswtdqdskdstysmsstltltkdeyerhnsytceathktstspivksfnrnec(seq id no:82)鼠2e2κ轻链的氨基酸序列
qiiltqspaimsaspgekvsitcsatssvsymhwfqqkpgtspklwiystsnlasgvpvrfsgsgsgtsysltisrmeaedaatyycqqrssypftfgsgtkleikadaaptvsifppsseqltsggasvvcflnnfypkdinvkwkidgserqngvlnswtdqdskdstysmsstltltkdeyerhnsytceathktstspivksfnrnec(seq id no:83)嵌合2c4和2e2 igg1重链的氨基酸序列qvqlkrasgpglvapsqslsitctvsgfsltiygahwvrqppgkglewlgviwaggstnynsalmsrlsiskdnsksqvflkinslqtddtalyycardgsspyyysmeywgqgtsvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:84)嵌合2c4κ轻链的氨基酸序列eiiltqspaimsaspgekvsitcsatssvsymhwfqqkpgtspklwiystsnlasgvpvrfsgsgsgtsysltisrmeaedaatyycqqrssypftfgsgtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:85)嵌合2e2κ轻链的氨基酸序列qiiltqspaimsaspgekvsitcsatssvsymhwfqqkpgtspklwiystsnlasgvpvrfsgsgsgtsysltisrmeaedaatyycqqrssypftfgsgtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:86)heka igg4重链的氨基酸序列(igg4含有s228p突变)evqlvesggglvqpggslrlscaasgfsltiygahwvrqapgkglewvgviwaggstnynsalmsrftiskdnskntvylqmnslraedtavyycardgsspyyysmeywgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslg(seq id no:87)小鼠1c3重链可变结构域的氨基酸序列(根据chothia编号,加下划线的残基包含cdr h1和h2)evqvvesggdlvksggslklscaasgfpfssyamswvrqtpdkrlewvaiissggsytyysdsvkgrftisrdnakntlylqmsslksedtamyycarhetaqaawfaywgqgtlvtvsa(seq id no:106)小鼠1h10重链可变结构域的氨基酸序列(根据chothia编号,加下划线的残基包含cdr h1和h2)evqlqqsgaelvrpgasvklsctasgfnikdyymywvkqrpeqglewigriapedgdteyapkfqgkatvtadtssntaylhlssltsedtavyycttegnyygssildywgqgttltvss(seq id no:107)小鼠4f11重链可变结构域的氨基酸序列(根据chothia编号,加下划线的残基包含
cdr h1和h2)qvqlqqsgaelvkpgasvkisckasgyafrsswmnwvkqrpgkglewigqiypgddytnyngkfkgkvtltadrssstaymqlssltsedsavyfcarlgpygpfadwgqgtlvtvsa(seq id no:108)小鼠1c3轻链可变结构域的氨基酸序列qivltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklaygvparfsgsgsgtsysltissmeaedaatyycqqwssnpptfgggtkleik(seq id no:109)小鼠1h10轻链可变结构域的氨基酸序列diqmtqttsslsaslgdrvtiscrasqditnylnwyqqkpdgtvklliyftsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpwtfgggtkleik(seq id no:110)小鼠4f11轻链可变结构域的氨基酸序列qivltqspaivsaspgekvtmtcsasssvsymywyqqrpgssprlliydtsslasgvpvrfsgsgsgtsysltisriesedaanyycqqwnsdpytfgggtkleik(seq id no:111)
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。