1.本发明涉及具有亲水性基团的改性聚碳二亚胺化合物。
背景技术:
2.作为与含有羧基的树脂中的羧基的反应性高、显示优异的固化性能的固化剂,已知环氧化合物、噁唑啉化合物、碳二亚胺化合物。
3.这些中,特别是碳二亚胺化合物具有如下优点:由于自身的耐热性高,因此固化物也显示优异的耐热性。
4.另一方面,碳二亚胺化合物由于其反应性高,因此与树脂混合后的可使用时间短,需要在使用前即刻混合,而且存在保管时凝胶化的问题。
5.为了解决这些问题,开发出了将聚碳二亚胺封闭以提高保存稳定性的手法,例如,在专利文献1中,提出了将碳二亚胺基的一部分采用具有不饱和键的反应性化合物接枝的方法。
6.但是,如果是该方法,由于碳二亚胺基残存,因此不能消灭自交联反应。
7.另外,作为提高使碳二亚胺化合物与树脂混合时的保存稳定性的方法,在专利文献2中,提出了包含将聚碳二亚胺化合物的碳二亚胺基用具有碳数4以上的直链或分支链烷基的二烷基胺改性的聚胍的单液型环氧树脂组合物。如果是该方法,对于环氧树脂,在单液化时也显示优异的保存稳定性,能够在比较低的温度下使其固化。
8.但是,专利文献2的改性聚碳二亚胺化合物在固化时改性胺没有解离,因此聚胍必然有助于固化反应,难以使含有羧基的树脂固化。
9.在专利文献3中,提出了将末端用亲水性化合物封闭的聚碳二亚胺用仲胺改性的、水溶性或水分散性的聚碳二亚胺胺改性物。
10.但是,对于在专利文献3中使用的仲胺而言,要使其解离以挥发除去时需要比较高的温度,因此如果是在水性或水分散系中一般使用的低温的干燥条件,担心固化反应没有进行,不能发挥性能。
11.现有技术文献
12.专利文献
13.专利文献1:日本特开平7-330849号公报
14.专利文献2:日本特开2000-136231号公报
15.专利文献3:日本特开2013-112755号公报
技术实现要素:
16.发明要解决的课题
17.本发明鉴于这样的实际情况而完成,目的在于提供具有作为固化剂的潜在性、在比较低的温度下封闭脱离而显现出碳二亚胺基的活性的、具有亲水性基团的改性聚碳二亚胺化合物。
18.用于解决课题的手段
19.本发明人为了实现上述目的而反复深入研究,结果发现:通过将具有亲水性基团的聚碳二亚胺化合物的碳二亚胺基用具有环内仲胺氮的芳族杂环化合物改性,将碳二亚胺基封闭,从而在比较低的温度下封闭脱离,碳二亚胺基再生,使作为含有羧基的树脂等的固化剂的性能显现,完成了本发明。
20.即,本发明提供:
21.1.改性聚碳二亚胺化合物,其中,末端用亲水性化合物封闭的二异氰酸酯化合物来源的聚碳二亚胺的碳二亚胺基的至少一部分用具有环内仲胺氮的芳族杂环化合物改性而成;
22.2. 1的改性聚碳二亚胺化合物,其中,所述芳族杂环化合物包含2个以上的环内氮;
23.3. 1或2的改性聚碳二亚胺化合物,其中,所述芳族杂环化合物为选自吡唑化合物和咪唑化合物中的1种或2种以上;
24.4. 3的改性聚碳二亚胺化合物,其中,所述芳族杂环化合物为选自3,5-二甲基吡唑、2-甲基咪唑和咪唑中的1种或2种以上;
25.5. 1~4中任一项的改性聚碳二亚胺化合物,其中,所述二异氰酸酯化合物为芳族二异氰酸酯化合物;
26.6. 5的改性聚碳二亚胺化合物,其中,所述芳族二异氰酸酯化合物为选自2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、2,4
’‑
二苯基甲烷二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯、和邻-联甲苯胺二异氰酸酯中的1种或2种以上;
27.7.固化剂,其包含1~6中任一项的改性聚碳二亚胺化合物;
28.8.固化性树脂组合物,其包含:7的固化剂、和含有选自羧基、氨基和羟基中的反应性基团的树脂;
29.9. 8的热固化性树脂组合物,其中,相对于所述树脂的反应性基团当量,所述固化剂的含量为0.5~1.5当量;
30.10. 8或9的热固化性树脂组合物,其中,所述含有反应性基团的树脂为选自聚氨酯树脂、聚酰胺树脂、丙烯酸系树脂、醋酸乙烯酯树脂、聚烯烃树脂和聚酰亚胺树脂中的1种或2种以上。
31.发明的效果
32.本发明的改性聚碳二亚胺化合物由于用具有环内仲胺氮的芳族杂环化合物将碳二亚胺基封闭,因此改性后的胍的活性氢的电子密度降低,能够用低温且短时间使其解离。
33.具有这样的特征的本发明的改性聚碳二亚胺适合用作含有羧基的树脂等含有与碳二亚胺基的反应性基团的树脂的固化剂。包含本发明的改性聚碳二亚胺的固化剂与含有羧基等反应性基团的树脂的混合液不会在非常缓和的温度条件下固化,干燥后能够在缓和的条件下固化。
34.另外,将本发明的改性聚碳二亚胺化合物与含有羧基等反应性基团的水性或水分散树脂混合而成的组合物也具有适用期长的特征。
具体实施方式
35.以下对本发明更详细地说明。
36.本发明涉及的改性聚碳二亚胺化合物的特征在于,末端用亲水性化合物封闭的二异氰酸酯化合物来源的聚碳二亚胺的碳二亚胺基的至少一部分用具有环内仲胺氮的芳族杂环化合物改性而成。
37.(1)二异氰酸酯化合物
38.成为本发明的改性聚碳二亚胺化合物的原料的二异氰酸酯化合物并无特别限定,能够从现有公知的各种二异氰酸酯化合物中适当地选择使用。
39.作为其具体例,可列举出六亚甲基二异氰酸酯、1,4-四亚甲基二异氰酸酯、2-甲基戊烷-1,5-二异氰酸酯、赖氨酸二异氰酸酯等脂肪族异氰酸酯;异佛尔酮二异氰酸酯、降冰片烷二异氰酸酯、氢化甲苯二异氰酸酯、氢化二甲苯二异氰酸酯、氢化二苯基甲烷二异氰酸酯、氢化四甲基二甲苯二异氰酸酯等脂环式二异氰酸酯;2,4
’‑
二苯基甲烷二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯、4,4
’‑
二苯基醚二异氰酸酯、对苯二异氰酸酯、间苯二异氰酸酯、3,3
’‑
二甲氧基-4,4
’‑
联苯二异氰酸酯、邻-联甲苯胺二异氰酸酯、萘二异氰酸酯、2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、3,3
’‑
二甲基-4,4
’‑
二苯基醚二异氰酸酯、3,3
’‑
二甲基-4,4
’‑
二苯基醚二异氰酸酯等芳族二异氰酸酯等,这些可单独使用1种,也可将2种以上组合使用。
40.这些中,从得到耐热性优异的聚碳二亚胺化合物的方面出发,优选芳族二异氰酸酯,更优选2,4
’‑
二苯基甲烷二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯、2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、邻-联甲苯胺二异氰酸酯。
41.(2)亲水性化合物
42.用作封端剂的亲水性化合物只要是具有亲水性、同时与二异氰酸酯化合物或聚碳二亚胺化合物的末端的异氰酸酯基具有反应性的亲水性有机化合物,则并无特别限定。
43.作为亲水性化合物的具体例,可列举由下述通式(a)表示的用烷氧基或苯氧基封端的聚氧化烯、由下述通式(b)表示的二烷基氨基醇、由下述通式(c)表示的羟基羧酸烷基酯、由下述通式(d)表示的二烷基氨基烷基胺、由下述通式(e)表示的烷基磺酸盐等,但并不限于这些。
44.r
1-o-(ch
2-chr
2-o)
m-h
ꢀꢀꢀꢀ
(a)
45.(r3)
2-n-ch
2-chr
4-oh
ꢀꢀꢀꢀꢀꢀ
(b)
46.r
5-o-co-chr
6-oh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(c)
47.(r7)
2-n-r
8-nh2ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(d)
48.ho-r
9-so3m
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(e)
49.(式(a)中,r1表示碳数1~4的烷基或苯基,r2表示氢原子或碳数1~4的烷基,m表示1~30的整数。式(b)中,r3表示碳数1~4的烷基,r4表示氢原子或碳数1~4的烷基。式(c)中,r5表示碳数1~3的烷基,r6表示氢原子或碳数1~3的烷基。式(d)中,r7表示碳数1~4的烷基,r8表示氢原子或碳数1~4的烷基。式(e)中,r9表示碳数1~10的亚烷基,m表示na、k等碱金属。)
50.作为碳数1~4的烷基的具体例,可列举出甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基。
51.作为碳数1~3的烷基的具体例,可列举出甲基、乙基、正丙基、异丙基。
52.作为碳数1~10的亚烷基的具体例,可列举出亚甲基、亚乙基、亚丙基、三亚甲基、四亚甲基、五亚甲基、六亚甲基、七亚甲基、八亚甲基、九亚甲基、十亚甲基等。
53.再有,由上述通式(a)~(e)表示的亲水性化合物可单独使用,也可将2种以上组合使用。
54.在聚碳二亚胺的聚合度大的情形、如后所述使聚碳二亚胺作为树脂交联剂时使用的水性介质中的水的比率高的情形等、为了使聚碳二亚胺在水性介质中溶解或分散而需要赋予更高的亲水性的情形下,作为亲水性化合物,在上述通式(a)~(e)中,优选亲水性优异的由上述通式(a)表示的用烷氧基或苯氧基封端的聚氧化烯。
55.作为由上述通式(a)表示的聚氧化烯的具体例,可列举出聚乙二醇单甲基醚、聚乙二醇单乙基醚、聚丙二醇单甲基醚、聚丙二醇单乙基醚、聚丙二醇单苯基醚等,特别优选聚乙二醇单甲基醚。
56.再有,对于本发明的聚碳二亚胺化合物而言,除了上述亲水性化合物以外,能够将可与末端异氰酸酯基反应、其单独不能对聚碳二亚胺赋予充分的亲水性的化合物作为其他封端剂并用。
57.其他封端剂与上述亲水性化合物混合,在显示出聚碳二亚胺能够在水性介质中溶解的亲水性的范围使用。
58.作为其他封端剂,只要是与二异氰酸酯化合物或聚碳二亚胺的末端的异氰酸酯基具有反应性的化合物,则并无特别限定。
59.作为其他封端剂,可列举出具有与异氰酸酯基反应的官能团的、脂肪族化合物、芳族化合物、脂环族化合物等,作为其具体例,可列举出具有-oh基的甲醇、乙醇、苯酚、环己醇、n-甲基乙醇胺等;具有=nh基的二乙胺、二环己胺等;具有-nh2基的丁胺、环己胺等;具有-cooh基的丙酸、苯甲酸、环己甲酸等;具有-sh基的乙硫醇、烯丙硫醇、苯硫酚等;具有环氧基的化合物等。
60.再有,其他封端剂可单独地使用,也可将2种以上组合使用。
61.另外,为了将聚碳二亚胺的末端封闭,控制其聚合度,可使用单异氰酸酯作为封端剂。
62.作为单异氰酸酯的具体例,可列举出苯异氰酸酯、对-硝基苯异氰酸酯、对-或间-甲苯异氰酸酯、对-甲酰基苯异氰酸酯、对-异丙基苯异氰酸酯等,这些可单独地使用,也可将2种以上组合使用。
63.这些中,优选对-异丙基苯异氰酸酯。
64.末端异氰酸酯基与封端剂的反应通过在25℃左右的常温下将二异氰酸酯化合物或聚碳二亚胺与封端剂混合从而容易地进行,根据需要可加热。
65.此时,对于要封闭的末端异氰酸酯基,优选使用当量的封端剂(亲水性化合物和根据需要使用的其他封端剂的合计),另外,反应优选在非活性气体气氛下进行。
66.(3)聚碳二亚胺化合物
67.本发明中使用的二异氰酸酯化合物来源的聚碳二亚胺化合物具有由下述通式(1)表示的基团。
68.[化1]
[0069][0070]
(式中,r表示从二异氰酸酯化合物中去除了nco基的残基。)
[0071]
另外,本发明中使用的聚碳二亚胺化合物可为使用至少1种二异氰酸酯化合物合成的、在分子中具有至少2个以上的碳二亚胺基的聚碳二亚胺共聚物。
[0072]
作为这样的共聚物,能够使聚碳二亚胺与例如聚醚多元醇、聚酯多元醇、聚碳酸酯多元醇、聚丁二烯二醇等共聚而得到。
[0073]
上述聚碳二亚胺化合物能够采用以二异氰酸酯化合物为原料的各种方法制造,作为制法的代表例,可列举出采用与二异氰酸酯化合物的脱二氧化碳相伴的脱碳酸缩合反应来制造异氰酸酯末端聚碳二亚胺的方法(美国专利第2941956号说明书、日本特公昭47-33279号公报、j.org.chem,28、2069-2075(1963)、chemical review1981、第81卷,第4期,第619-621页等)。
[0074]
在二异氰酸酯化合物的脱碳酸缩合反应中,通常使用碳二亚胺化催化剂。
[0075]
作为碳二亚胺化催化剂的具体例,可列举出1-苯基-2-磷烯-1-氧化物、3-甲基-1-苯基-2-磷烯-1-氧化物、1-乙基-2-磷烯-1-氧化物、3-甲基-2-磷烯-1-氧化物、和它们的3-磷烯异构体等磷烯氧化物等,这些可单独地使用,也可将2种以上组合使用。
[0076]
这些中,从反应性的方面出发,优选3-甲基-1-苯基-2-磷烯-1-氧化物。
[0077]
就碳二亚胺化催化剂的量而言,相对于二异氰酸酯化合物,通常为0.1~1.0质量%。
[0078]
上述脱碳酸缩合反应能够无溶剂地进行,但也可使用溶剂。
[0079]
作为可使用的溶剂的具体例,可列举出四氢呋喃、1,3-二噁烷、二氧戊环等脂环式醚;苯、甲苯、二甲苯、乙基苯等芳族烃;氯苯、二氯苯、三氯苯、四氯乙烯(
パークレン
)、三氯乙烷、二氯乙烷等卤代烃;醋酸乙酯、醋酸丁酯等酯化合物;甲乙酮、甲基异丁基酮、环己酮等酮化合物等,这些可单独地使用,也可将2种以上组合使用。
[0080]
这些中,优选环己酮、四氢呋喃。
[0081]
对反应温度并无特别限定,优选40~200℃,更优选50~130℃。另外,在溶剂中进行反应的情况下,优选40℃~溶剂的沸点。
[0082]
在溶剂中进行反应的情况下,对二异氰酸酯化合物的浓度并无特别限定,如果考虑抑制凝胶化、同时高效率地进行反应,优选5~55质量%,更优选5~40质量%。
[0083]
另外,对反应体系内的固体成分浓度也无特别限定,优选5~55质量%,更优选20~50质量%。
[0084]
特别地,在使二异氰酸酯化合物与封端剂反应而进行了末端的封闭后添加催化剂进行碳二亚胺化的情况下,反应温度优选40~180℃,更优选50~100℃。
[0085]
另外,这种情况下,溶剂中的二异氰酸酯化合物的浓度优选5~55质量%,更优选20~50质量%。
[0086]
对本发明中使用的聚碳二亚胺的聚合度并无特别限定,如果考虑提高在水中的溶解性、分散性、同时高效地抑制在水性介质中的凝胶化,优选2~15,更优选3~12。
[0087]
再有,在制造本发明的聚碳二亚胺化合物时,可将在分子中具有2个以上羟基的多元醇并用。通过引入多元醇成分,从而缓和本发明的改性碳二亚胺化合物的强凝集力,能够
改善与水系溶剂的亲和性。
[0088]
作为这样的多元醇,例如可列举出聚酯多元醇、聚醚多元醇、聚碳酸酯多元醇、蓖麻油多元醇、长链脂肪族二醇等。
[0089]
作为蓖麻油多元醇,只要是以蓖麻油为原料衍生的产物即可,作为其具体例,可列举出uric h-30、uric h-62、uric y-403(以上为伊藤制油(株)制造)、hs 2g-120、hs sg-160r、hs 2g-270b、hs 2b-5500、hs ka-001(以上为丰国制油(株)制造)等。
[0090]
作为聚醚多元醇,可列举出聚乙二醇、聚丙二醇、聚四亚甲基二醇等,作为其具体例,可列举出sunnix pp-400、sunnix pp-1000、sunnix pp-2000(以上为三洋化成工业(株)制造)、
ユニオール
pb-500、
ユニオール
pb-700(以上为日油(株)制造)等。
[0091]
这些中,从相容性的观点出发,优选蓖麻油多元醇,更优选官能团数2的蓖麻油多元醇。
[0092]
(4)具有环内仲胺氮的芳族杂环化合物
[0093]
在本发明中,在上述的聚碳二亚胺化合物的改性中使用的芳族杂环化合物为具有环内仲胺氮的芳族杂环化合物。其中,所谓具有环内仲胺氮的芳族杂环化合物,是指在杂环内具有胺的芳族杂环化合物。
[0094]
芳族杂环化合物只要具有环内仲胺氮,则并无特别限定,作为其具体例,可列举出吡咯化合物、吡唑化合物、咪唑化合物、三唑化合物等,如果考虑进一步降低由改性聚碳二亚胺化合物的解离开始温度,优选环内氮的数为2以上的芳族杂环化合物,更优选吡唑化合物、咪唑化合物。
[0095]
作为吡唑化合物的具体例,可列举出吡唑、3-甲基吡唑、4-甲基吡唑、3,5-二甲基吡唑等。
[0096]
作为咪唑化合物的具体例,可列举出咪唑、2-甲基咪唑、2-乙基-4-甲基-咪唑、2-苯基咪唑、2-苯基-4-甲基咪唑等。
[0097]
这些中,优选3,5-二甲基吡唑、2-甲基咪唑、咪唑。
[0098]
(5)聚碳二亚胺化合物的改性
[0099]
本发明的改性聚碳二亚胺化合物通过用具有环内仲胺氮的芳族杂环化合物将聚碳二亚胺化合物改性而得到。
[0100]
该改性能够通过将具有环内仲胺氮的芳族杂环化合物与聚碳二亚胺化合物以芳族杂环化合物相对于碳二亚胺基成为规定的当量的方式混合进行反应而进行。
[0101]
该反应也能够在无溶剂下进行,但优选使用水系溶剂。
[0102]
在使用水系溶剂的情况下,例如,可将聚碳二亚胺化合物与水系溶剂混合,向其中添加具有环内仲胺氮的芳族杂环化合物以致相对于碳二亚胺基成为规定的当量,使其反应。
[0103]
具有环内仲胺氮的芳族杂环化合物的使用量只要能发挥固化剂所要求的性能,则并无特别限制,相对于碳二亚胺基1当量,优选1~2当量,如果考虑减少未反应的芳族杂环化合物、在加热处理时使胺容易除去,更优选1~1.5当量。
[0104]
对反应温度并无特别限定,如果考虑高效地进行反应、同时抑制副反应,优选常温(25℃左右)或40~120℃。
[0105]
反应时间因反应温度而变动,因此不能一概地规定,通常为0.1~2小时左右。
[0106]
再有,优选边搅拌边进行上述反应。
[0107]
作为用于胺改性反应的上述水系溶剂,可以只是水,也可以只是水合性液体化合物,还可以是水与水合性液体化合物的混合溶剂。
[0108]
作为水合性液体化合物的具体例,可列举出乙二醇单甲基醚、乙二醇单乙基醚、乙二醇单丁基醚、二甘醇单乙基醚、二甘醇单丁基醚、丙二醇单甲基醚、二丙二醇单甲基醚等聚亚烷基二醇单烷基醚类;二甘醇二甲基醚、三甘醇二甲基醚、二丙二醇二甲基醚等聚亚烷基二醇二烷基醚类;乙二醇单甲基醚乙酸酯、乙二醇单乙基醚乙酸酯、乙二醇单丁基醚乙酸酯、二甘醇单乙基醚乙酸酯、二甘醇单丁基醚乙酸酯、丙二醇单甲基醚乙酸酯、二丙二醇单甲基醚乙酸酯等聚亚烷基二醇单烷基醚乙酸酯类;乙二醇二乙酸酯、丙二醇二乙酸酯等聚亚烷基二醇二乙酸酯类;乙二醇单苯基醚、丙二醇单苯基醚等聚亚烷基二醇单苯基醚类;丙醇、丁醇、己醇、辛醇等一元醇类、n-甲基-2-吡咯烷酮(nmp)、n-乙基-2-吡咯烷酮(nep)等n-取代酰胺类;2,2,4-三甲基-1,3-戊二醇单异丁酸酯等,这些可单独地使用,也可将2种以上组合使用。
[0109]
(6)固化剂和热固化性树脂组合物
[0110]
以上说明的本发明的改性聚碳二亚胺化合物能够适合用作树脂的固化剂、固化促进剂。具体地,包含本发明的改性聚碳二亚胺的固化剂作为含有与碳二亚胺基交联反应的反应性基团的树脂的固化剂发挥作用。
[0111]
作为这样的树脂的具体例,可列举出在分子中具有羧基的含有羧基的树脂、在分子中具有氨基的含有氨基的树脂、在分子中具有羟基的含有羟基的树脂等。
[0112]
从与碳二亚胺基的交联反应的容易性的方面出发,作为含有反应性基团的树脂,优选含有反应性基团的、聚氨酯树脂、聚酰胺树脂、丙烯酸系树脂、醋酸乙烯酯树脂、聚烯烃树脂、聚酰亚胺树脂。
[0113]
本发明的热固化性树脂组合物包含上述的树脂、和本发明的固化剂。
[0114]
本发明的改性聚碳二亚胺化合物由于用具有环内仲胺氮的芳族杂环化合物将碳二亚胺基封闭,因此改性后的胍的活性氢的电子密度降低,能够用低温且短时间使其解离。
[0115]
包含这样的固化剂的本发明的热固化性树脂组合物不会在非常缓和的温度条件下固化,干燥后,能够在缓和的条件下使其固化,而且适用期长,因此长期保存性、处理性优异。
[0116]
在本发明的热固化性树脂组合物中,就固化剂的含量而言,只要发挥所期望的固化性,则并无特别限定,如果考虑使树脂的固化性适当,相对于主剂(上述树脂)的反应性基团当量,优选0.5~1.5当量,更优选0.8~1.2当量。即使使固化剂的含量比1.5当量大,效果也没有太大的变化。
[0117]
再有,本发明的热固化性树脂组合物根据其用途等,根据需要能够适当地配合各种添加成分,例如颜料、填充剂、流平剂、表面活性剂、分散剂、增塑剂、紫外线吸收剂、抗氧化剂等。
[0118]
通过将本发明的热固化性树脂组合物在规定的基材上涂布,形成涂布层,使其固化,从而能够制作涂膜(膜)。
[0119]
这种情况下,作为涂布法,能够适当地采用现有公知的方法,例如能够采用毛刷涂布、棉球涂布、喷射涂布、热喷涂、无气喷涂、辊涂、帘式流涂、流涂、浸涂、刀刃涂布等。
[0120]
在形成涂布层后,为了促进交联反应,可进行加热处理。对加热方法并无特别限制,例如能够使用电加热炉、红外线加热炉、高频可燃炉等。
[0121]
实施例
[0122]
以下列举出实施例和比较例,对本发明更具体地说明,但本发明并不限于下述的实施例。
[0123]
[1]改性聚碳二亚胺化合物的合成
[0124]
[实施例1-1]
[0125]
将甲苯二异氰酸酯(以下记为tdi、cosmonate t-80、三井化学(株)制造)100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)105质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌3小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0126]
将得到的聚碳二亚胺化合物和水495质量份混合,向其中添加2-甲基咪唑(以下称为2mz。curezol 2mz-h、四国化成工业(株)制造)43.2质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了2mz改性聚碳二亚胺化合物p1(n=5、碳二亚胺当量385g/摩尔)。
[0127]
[实施例1-2]
[0128]
将二苯基甲烷二异氰酸酯[以下记为mdi(2,4
’‑
mdi 54%与4,4
’‑
mdi46%的混合物、下同)、millionate nm、东曹(株)制造]100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)64.0质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0129]
将得到的聚碳二亚胺化合物和水409质量份混合,向其中添加2mz(curezol 2mz-h、四国化成工业(株)制造)28.9质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了2mz改性聚碳二亚胺化合物p2(n=4、碳二亚胺当量469g/摩尔)。
[0130]
[实施例1-3]
[0131]
将tdi100质量份、聚乙二醇单甲基醚(分子量400、blaunon mp-400、青木油脂工业(株)制造)79.0质量份、聚丙二醇(分子量400、sunnix pp-400、三洋化成工业(株)制造)22.7质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0132]
将得到的聚碳二亚胺化合物和水513质量份混合,向其中添加2mz(curezol 2mz-h、四国化成工业(株)制造)38.9质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了2mz改性聚碳二亚胺化合物p3(n=6、碳二亚胺当量438g/摩
尔)。
[0133]
[实施例1-4]
[0134]
将mdi100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)62.9质量份、蓖麻油多元醇(分子量700、uric y-403、伊藤制油(株)制造)25.1质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0135]
将得到的聚碳二亚胺化合物和水530质量份混合,向其中添加2mz(curezol 2mz-h、四国化成工业(株)制造)25.8质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了2mz改性聚碳二亚胺化合物p4(n=5、碳二亚胺当量666g/摩尔)。
[0136]
[实施例1-5]
[0137]
将tdi 100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)52.7质量份、蓖麻油多元醇(分子量700、uric y-403、伊藤制油(株)制造)17.7质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0138]
将得到的聚碳二亚胺化合物和丙二醇单甲基醚440质量份混合,向其中添加2mz(curezol 2mz-h、四国化成工业(株)制造)43.2质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了2mz改性聚碳二亚胺化合物p5(n=10、碳二亚胺当量345g/摩尔)。
[0139]
[实施例1-6]
[0140]
将tdi100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)52.7质量份、蓖麻油多元醇(分子量700、uric y-403、伊藤制油(株)制造)17.7质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0141]
将得到的聚碳二亚胺化合物与丙二醇单甲基醚和水的混合溶剂(1/1、wt/wt)440质量份混合,向其中添加2mz(curezol 2mz-h、四国化成工业(株)制造)43.2质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了2mz改性聚碳二亚胺化合物p6(n=10、碳二亚胺当量345g/摩尔)。
[0142]
[实施例1-7]
[0143]
将tdi 100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)65.7质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌3小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺
化合物。
[0144]
将得到的聚碳二亚胺化合物和水369质量份混合,向其中添加3,5-二甲基吡唑(以下称为dmp。japan finechem inc.制造)52.0质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dmp改性聚碳二亚胺化合物p7(n=6、碳二亚胺当量292g/摩尔)。
[0145]
[实施例1-8]
[0146]
将tdi 100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)63.2质量份、蓖麻油多元醇(分子量700、uric y-403、伊藤制油(株)制造)25.4质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0147]
将得到的聚碳二亚胺化合物和水499质量份混合,向其中添加dmp(japan finechem inc.制造)36.4质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dmp改性聚碳二亚胺化合物p8(n=8、碳二亚胺当量399g/摩尔)。
[0148]
[实施例1-9]
[0149]
将mdi100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)73.3质量份、聚丙二醇(分子量400、sunnix pp-400、三洋化成工业(株)制造)19.6质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0150]
将得到的聚碳二亚胺化合物和水522质量份混合,向其中添加dmp(japan finechem inc.制造)28.2质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dmp改性聚碳二亚胺化合物p9(n=4、碳二亚胺当量706g/摩尔)。
[0151]
[实施例1-10]
[0152]
将tdi 100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)52.7质量份、蓖麻油多元醇(分子量700、uric y-403、伊藤制油(株)制造)17.7质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0153]
将得到的聚碳二亚胺化合物和乙基二甘醇乙酸酯432质量份混合,向其中添加dmp(japan finechem inc.制造)50.6质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dmp改性聚碳二亚胺化合物p10(n=10、碳二亚胺当量345g/摩尔)。
[0154]
[实施例1-11]
[0155]
将tdi 100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工
业(株)制造)52.7质量份、蓖麻油多元醇(分子量700、uric y-403、伊藤制油(株)制造)17.7质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0156]
将得到的聚碳二亚胺化合物和乙基二甘醇乙酸酯和水的混合溶剂(1/1、wt/wt)432质量份混合,向其中添加dmp(japan finechem inc.制造)50.6质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dmp改性聚碳二亚胺化合物p11(n=10、碳二亚胺当量345g/摩尔)。
[0157]
[实施例1-12]
[0158]
将tdi 100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)105质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌3小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0159]
将得到的聚碳二亚胺化合物和水503质量份混合,向其中添加咪唑(以下称为imz。curezol siz、四国化成工业(株)制造)35.8质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成,波长210cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了imz改性聚碳二亚胺化合物p12(n=5、碳二亚胺当量385g/摩尔)。
[0160]
[比较例1-1]
[0161]
将tdi 100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)105质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌3小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0162]
将得到的聚碳二亚胺化合物和水485质量份混合,向其中添加二异丙胺(以下称为dipa)53.2质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长210cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dipa改性聚碳二亚胺化合物p13(n=5、碳二亚胺当量385g/摩尔)。
[0163]
[比较例1-2]
[0164]
将mdi 100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)64.0质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0165]
将得到的聚碳二亚胺化合物和水403质量份混合,向其中添加dipa35.6质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dipa改性聚碳
二亚胺化合物p14(n=4、碳二亚胺当量469g/摩尔)。
[0166]
[比较例1-3]
[0167]
将tdi 100质量份、聚乙二醇单甲基醚(分子量400、blaunon mp-400、青木油脂工业(株)制造)79.0质量份、聚丙二醇(分子量400、sunnix pp-400、三洋化成工业(株)制造)22.7质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0168]
将得到的聚碳二亚胺化合物和水504质量份混合,向其中添加dipa47.9质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成、波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dipa改性聚碳二亚胺化合物p15(n=6、碳二亚胺当量438g/摩尔)。
[0169]
[比较例1-4]
[0170]
将tdi100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)52.7质量份、蓖麻油多元醇(分子量700、uric y-403、伊藤制油(株)制造)17.7质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0171]
将得到的聚碳二亚胺化合物和乙基二甘醇乙酸酯和水的混合溶剂(1/1、wt/wt)432质量份混合,向其中添加dipa50.6质量份,冷却到室温后搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成,波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dipa改性聚碳二亚胺化合物p16(n=10、碳二亚胺当量345g/摩尔)。
[0172]
[比较例1-5]
[0173]
将tdi 100质量份、聚乙二醇单甲基醚(分子量550、blaunon mp-550、青木油脂工业(株)制造)52.7质量份、蓖麻油多元醇(分子量700、uric y-403、伊藤制油(株)制造)17.7质量份和碳二亚胺化催化剂(3-甲基-苯基-2-磷烯-1-氧化物)1.0质量份放入带有回流管和搅拌器的反应容器中,在氮气流下80℃下搅拌4小时,通过红外吸收(ir)光谱测定确认波长2270cm-1
左右的异氰酸酯基产生的吸收峰大体消失,得到了聚碳二亚胺化合物。
[0174]
将得到的聚碳二亚胺化合物和乙基二甘醇乙酸酯432质量份混合,向其中添加dipa50.6质量份,冷却到室温后,搅拌5小时,通过红外吸收(ir)光谱测定确认波长1740cm-1
左右的胍基产生的吸收峰生成,波长2150cm-1
左右的碳二亚胺基产生的吸收峰大体消失,得到了dipa改性聚碳二亚胺化合物p17(n=10、碳二亚胺当量345g/摩尔)。
[0175]
[胺的解离性]
[0176]
将上述各实施例和比较例中得到的改性聚碳二亚胺化合物在120℃下加热10分钟,通过红外吸收(ir)光谱测定确认了波长2150cm-1
左右的碳二亚胺基产生的吸收峰。将改性前的聚碳二亚胺化合物的碳二亚胺基的峰设为100%,算出加热后胺解离而生成的碳二亚胺基的峰的比例。将结果示于表1中。再有,将生成的峰的比例为80%以上评价为
○
,将不到80%评价为
×
。
[0177]
[表1]
[0178] 胺的解离性实施例1-1
○
实施例1-2
○
实施例1-3
○
实施例1-4
○
实施例1-5
○
实施例1-6
○
实施例1-7
○
实施例1-8
○
实施例1-9
○
实施例1-10
○
实施例1-11
○
实施例1-12
○
比较例1-1
×
比较例1-2
×
比较例1-3
×
比较例1-4
×
比较例1-5
×
[0179]
如表1中所示那样,可知实施例1-1~1-12中得到的改性聚碳二亚胺化合物与比较例的改性聚碳二亚胺化合物相比,胺的解离性优异。
[0180]
[2]热固化性聚氨酯树脂组合物和固化物的制造
[0181]
[实施例2-1~2-12,比较例2-1~2-5]
[0182]
将实施例1-1~1-12和比较例1-1~1-5中得到的改性聚碳二亚胺化合物与含有羧基的水性聚氨酯树脂(suncure777、lubrizol公司制造、固体成分35质量%)以羧基与碳二亚胺基的当量比1:1混合,制备热固化性聚氨酯树脂组合物。
[0183]
(1)适用期测定
[0184]
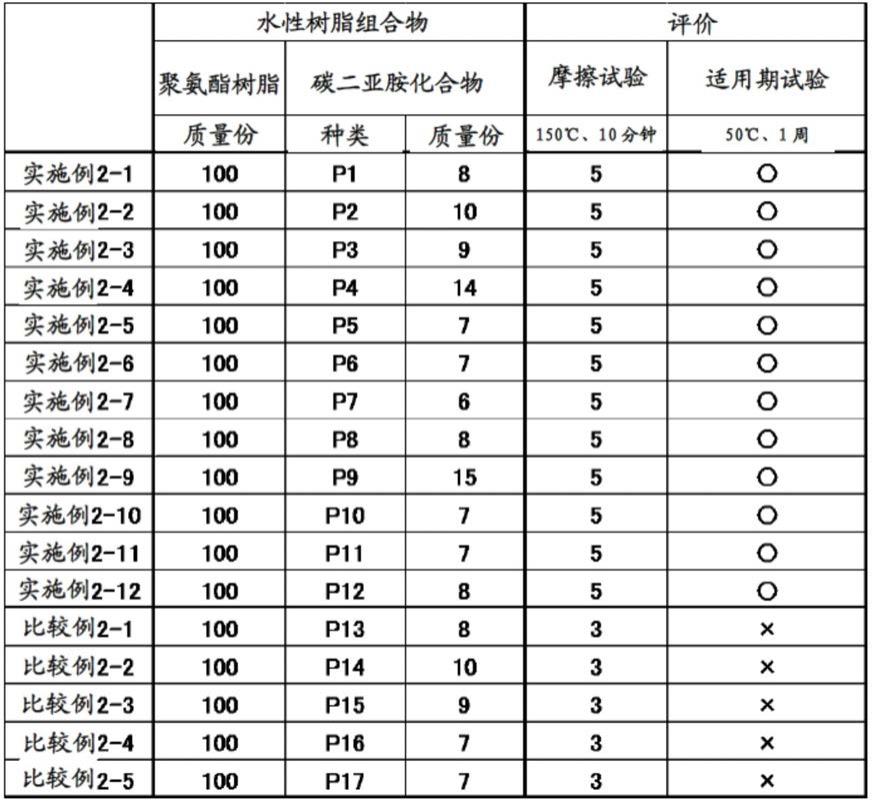
对于实施例2-1~2-12和比较例2-1~2-5中制备的热固化性聚氨酯树脂组合物,观察了在50℃下放置1周后的状态。将结果示于表2中。将保持液态的情形评价为〇,将固化的情形评价为
×
(下同)。
[0185]
(2)摩擦试验
[0186]
将实施例2-1~2-12和比较例2-1~2-5中制备的热固化性聚氨酯树脂组合物流延至铝板,在70℃下干燥5分钟,制作了厚20μm的涂膜。然后,将该涂膜在150℃下加热10分钟,固化,制作膜。
[0187]
对于得到的膜,将乙醇用于溶剂,以载荷900g/cm2采用摩擦试验机er-1b(suga test instruments co.,ltd.制造)进行了双重摩擦。将结果一并示于表2。评价根据以下的白化点数进行(下同)。
[0188]
5:没有变化
[0189]
4:轻微白化
[0190]
3:有白化
test instruments co.,ltd.制造)进行了双重摩擦。将结果一并示于表3。
[0204]
[表3]
[0205][0206]
如表2和3中所示那样,可知各实施例中制备的热固化性树脂组合物的适用期良好,同时在150℃、30分钟的条件下充分地固化。
[0207]
即,可知通过用规定的含有胺的芳族杂环化合物对碳二亚胺基进行改性,从而能够有效率地防止混合后的凝胶化、固化,结果适用期提高,另外,能够用低温且短时间使改性中使用的胺解离,结果在150℃、30分钟这样的平稳的条件下迅速地固化,得到固化膜。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。