:
1.本发明属于天然产物领域,具体涉及两个大环内酯化合物及其在制备抗菌、抗菌药物中的应用。
背景技术:
2.病源耐药菌如耐万古霉素肠球菌(vre)、耐甲氧西林金黄色葡萄球菌(mrsa)自上世纪中期被发现后,随即在全球蔓延。耐药菌感染具有高发病率和高死亡率的特点,占用并损耗了大量社会医疗资源,因此人类对抗耐药菌的新型抗生素需求日益迫切。同时,癌症严重威胁着人类健康与生命。
3.深海放线菌所处的极端生存环境,促使其进化出适应极端环境的独特代谢途径,具备了产生结构新颖、活性机制独特的化合物的潜能,一直以来是药物开发的重要资源。以放线菌体内次级代谢途径为基础,通过合成生物学技术对活性先导化合物进行改造,对微生物药物开发具有重大意义。放线菌次级代谢产物中,有一类大环内酯类化合物,具有广泛的生物活性,包括抗肿瘤、抗菌、抗病毒等多种生物活性,具备良好的成药潜力。
4.以深海来源海洋放线菌为研究对象,对其大环内酯类活性次级代谢产物途径进行研究并改造,为缓解当前人类所处的抗耐药菌、抗癌症药物缺乏的困境将产生积极的推进作用。
技术实现要素:
5.本发明的第一个目的是提供具有抗菌、抗癌活性的两个大环内酯化合物及其药用盐。
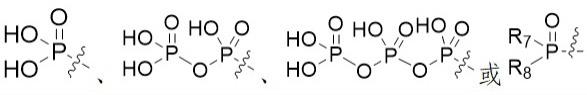
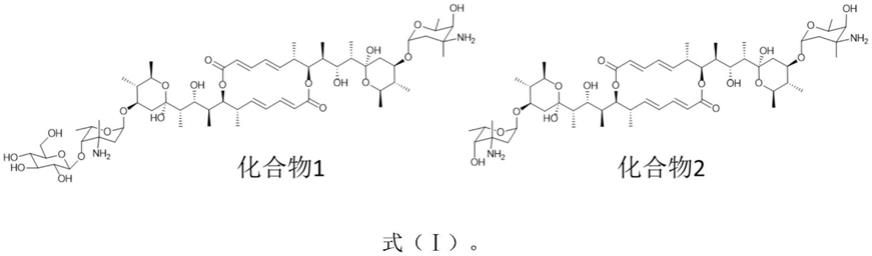
6.本发明的两个大环内酯化合物或其药用盐,其结构如式(ⅰ)所示:
[0007][0008]
本发明人通过对从深海底泥来源稀有放线菌pseudonocardia sp.scsio 07407发酵提取物进行抑菌活性筛选和hplc-dad图谱分析,发现其在紫外光谱254nm处具有大环内酯类化合物特征吸收峰的次级代谢产物组分具有明显的抑菌活性。进而,通过摇床放大发酵、萃取、分离纯化,得到一个大环内酯类化合物1;通过基因敲除技术,进一步对其葡萄糖基转移酶基因orf292进行敲除,对获得的敲除突变株pseudonocardia sp.scsio 07407-δ292放大发酵、萃取、分离纯化,得到另一个脱葡萄糖基大环内酯类化合物2。通过hresims( ),1d、 2d nmr等技术,确定两个单体为新颖大环内酯类化合物,具体结构如式(ⅰ)所示。
[0009]
通过对化合物1和化合物2的抑菌活性评价,发现其对金黄色葡萄球菌及其耐药菌屎肠球菌及其耐药菌、粪链球菌、溶血葡萄球或枯草芽孢杆菌有显著的抑制活性,具有开发抗菌药物先导化合物的潜力。
[0010]
对化合物1进行肿瘤细胞毒活性测试,发现其对选用人结直肠癌细胞(rko),肝癌细胞(hepg2),子宫颈癌细胞(hela),白血病细胞(hl60),非小细胞肺癌(a549),乳腺癌(mcf-7)等具有良好的活性,且优于抗肿瘤药物顺铂,具有开发为抗癌药物先导化合物的潜力。
[0011]
因此本发明的第二个目的是提供化合物1或化合物2在制备抗菌或抗癌药物中的应用。
[0012]
所述的抗菌药物抗革兰氏阳性菌,优选为抗金黄色葡萄球菌及其耐药菌、屎肠球菌及其耐药菌、粪链球菌、溶血葡萄球菌或枯草芽孢杆菌的药物。
[0013]
所述的抗癌药物是抗结直肠癌、肝癌、宫颈癌、白血病、非小细胞肺癌或乳腺癌的药物。
[0014]
本发明的第三个目的是提供一种抗菌、抗癌药物,其特征在于,包括有效量的作为活性成份的如式(ⅰ)所示的化合物1或化合物2,或其药用盐,和药学上可以接受的载体。
[0015]
本发明的第四个目的是提供一种上述大环内酯化合物的制备方法,其特征在于,所述的化合物1是从pseudonocardia sp.scsio 07407 gdmcc no:62195的发酵培养物中分离得到的,化合物2是pseudonocardia sp.scsio 07407-δ292的发酵培养物中分离得到的,所述的 pseudonocardia sp.scsio 07407-δ292是将pseudonocardia sp.scsio 07407 gdmcc no: 62195的葡萄糖基转移酶敲除后获得的突变株,所述的葡萄糖基转移酶的核苷酸序列如seqid no.1(ncbi accession number:om632674)所示。
[0016]
本发明的第五个目的是提供pseudonocardia sp.scsio 07407 gdmcc no:62195在制备化合物1中的应用。
[0017]
本发明的第六个目的是提供pseudonocardia sp.scsio 07407-δ292在制备化合物2中的应用,所述的pseudonocardia sp.scsio 07407-δ292是将pseudonocardia sp.scsio 07407gdmcc no:62195的葡萄糖基转移酶敲除后获得的突变株,所述的葡萄糖基转移酶的核苷酸序列如seq id no.1(ncbi accession number:om632674)所示。
[0018]
本发明的第七个目的是提供pseudonocardia sp.scsio 07407,保藏编号:gdmcc no: 62195。
[0019]
本发明的大环内酯化合物-化合物1和化合物2是海洋来源的新颖化合物,对测试的致病细菌和癌症细胞具有显著的抑制作用,因此本发明为开发新的抑菌、抗癌药物提供了备选化合物,对建设我国的“蓝色药库”意义重大。
[0020]
本发明的深海底泥来源稀有放线菌pseudonocardia sp.scsio 07407于2022年1月10日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市先烈中路100号大院 59号楼5楼,广东省科学院微生物研究所,邮政编码:510070,保藏编号:gdmcc no:62195。
附图说明:
[0021]
图1是化合物1的1h nmr(500mhz)图谱,溶剂为:氘代meod;
[0022]
图2是化合物1的
13
cnmr(125mhz)图谱,溶剂为:氘代meod;
[0023]
图3是化合物2的1hnmr(700mhz)图谱,溶剂为:氘代meod;
[0024]
图4是化合物2的
13
cnmr(175mhz)图谱,溶剂为:氘代meod。
具体实施方式:
[0025]
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
[0026]
实施例1:
[0027]
构建突变株pseudonocardiasp.scsio07407-δ292
[0028]
一、pseudonocardiasp.scsio07407遗传操作体系的构建
[0029]
1.构建基因组文库
[0030]
基因组文库的构建方法参照supercos1cosmidvectorkit和gigapckiiixlpackingextract操作手册进行。对pseudonocardiasp.scsio07407使用tsb液体培养基培养2天后收集菌体,按成熟的酚氯仿抽提法提取其基因组dna,取适量的高纯度dna进行不同的酶切时间、不同sau3ai酶浓度的酶切处理,确定出最佳的反应时间、酶反应浓度后进行同体系的多管酶切并进行去磷酸化处理;同时用xbai限制性内切酶处理supercosi载体,酶切完后同样进行去磷酸化处理;再对去磷酸化后的supercos1载体进行bamhi酶切。对于片段回收,均使用成熟的酚氯仿抽提法进行。最后用双酶切的supercosi载体与sau3ai酶切处理和去磷酸化的基因组dna使用t4连接酶室温连接、体外噬菌体包装及侵染宿主菌株e.colile392。把侵染后的菌株涂布在含有100μg/ml卡那霉素的抗性平板上,随机挑取约2000个克隆保存在96孔板中,完成菌株的基因组文库的构建。
[0031]
2.含有目标葡萄糖基转移酶基因orf292的cosmid的筛选及获得
[0032]
pseudonocardiasp.scsio07407基因组完成图的测序工作交由上海凌恩生物有限公司完成。根据凌恩生物有限公司提供菌株基因组完整序列,结合在线生物信息学软件和化合物1的结构特征,我们获得了化合物1的生物合成基因簇,其中orf292基因(其核苷酸序列如seqidno.1所示,ncbiaccessionnumber:om632674)为目标葡萄糖基转移酶基因。为了确定orf292基因在化合物1生物合成过程中的功能,我们对其分别进行基因的敲除。根据pcr-targeting操作要求,为了得到能够对orf292进行敲除的cosmid,我们在orf292基因序列的上下游设计了两对筛库引物,分别为上游的292-f1(5
′‑
gaaatcgacctcaaagcggc-3
′
)和292-r1(5
′‑
aggtcgtcgtcgatatcaac-3
′
)和下游的292-f2(5
′‑
ccgcttcgtcgtcggctaca-3
′
)和292-r2(5
′‑
ggtggtggtcatgcgctccc-3
′
)。利用这两对引物,从构建的基因组文库中利用pcr技术筛选阳性克隆。pcr程序如下:95℃5min;95℃45s,58℃45s,72℃60s,30个循环;72℃10min。其中筛选到多个阳性克隆,通过末端测序,我们选定第21号96孔板对应(4,g)位置的克隆(命名为cosmid214g),进行下一步的orf292基因的敲除。
[0033]
3.orf292基因缺失突变菌株pseudonocardiasp.scsio07407的构建
[0034]
orf292基因的失活是采用了λ-red介导的pcr-targeting技术。包含有orf292基因的cosmid214g被转化入e.colibw25113/pij790中,得到e.colibw25113/pij790/cosmid214g。以已被ecori和hindiii酶解过的pij773质粒片段为模板,用与orf292基因分别具有39bp同源臂的敲除引物(delf:5'-cgccaccatcgggacccgggcccgcgcggcctccaggacat
tccggggatccgtcgacc-3',delr:5'-gtggtggcggacatggtcgggcgcgggcaccgcgtcacctgtaggctggagctgcttc-3'大写字母部分代表与orf292基因同源)扩增出带有野生型39bp同源臂的apr抗性片段aac(3)iv-orit抗性片段的pcr扩增反应。将扩增好的aac(3)iv-orit抗性片段电转化入e.colibw25113/pij790/cosmid214g感受态细胞中,通过λ-red介导的同源重组得到改造后的重组cosmid,并将该质粒命名为pcosmid216c-δorf292。用orf292基因的pcr-targeting验证引物(id-orf292-f:5'-ctcgcccaggtccagctcag-3',id-orf292-r:5'-cggtcacatcaaccccaccc-3')进行pcr扩增(95℃5min;95℃45s,58℃45s,72℃2min,30个循环;72℃10min)确定重组cosmid的正确性。随后,重组pcosmid214g-δorf292转入用于接合转移的大肠杆菌e.coliet12567/puz8002中,从而得到转入重组质粒的e.coliet12567/puz8002,命名为e.coliet12567/puz8002/porf292,该菌株即为用于介导野生型菌株接合转移的大肠杆菌。
[0035]
接合转移的过程如下:将野生型pseudonocardiasp.scsio07407的孢子在tsb液体培养基中,28℃震荡培养1-2小时,使其孢子萌发;e.coliet12567/puz8002/porf292在加有卡那霉素(kan,终浓度为50μg/ml)、氯霉素(cml,终浓度为25μg/ml)和阿伯拉霉素(apr,终浓度为50μg/ml)的lb培养液中培养至光密度值od=0.6时离心收集细胞,用无菌的lb液体培养基洗涤两次,加入500μl液体无菌lb重悬后与萌发后的野生型混合。将混合液涂布于加有10mmmgso4和3%的海盐的ms固体培养基上;在28℃生长18小时后,每个固体培养基平板上涂布1ml加有三甲氧苄胺嘧啶和阿普拉霉素的抗生素药物的无菌水进行覆盖以杀死e.coliet12567/puz8002/porf292,其中含甲氧苄氨嘧啶(tmp,50mg/ml)30μl,阿伯拉霉素(apr,50mg/ml)30μl,覆盖后的平板继续在28℃培养箱下生长7-9天,直到接合子出现;双交换突变菌株pseudonocardiasp.scsio07407-δ292通过其对阿普拉霉素的抗性表型而被筛选出来,同时使用与之前构建pcosmid-δorf292相同的验证引物(id-orf292-f,id-orf292-r)进行pcr扩增证实筛选出来的突变株为双交换突变株,由此得到orf292葡萄糖基转移酶基因缺失突变的pseudonocardiasp.scsio07407,命名为双交换突变菌株pseudonocardiasp.scsio07407-δ292。该菌株使用m-isp3培养基(与实施例2中的种子培养基配方一致)进一步发酵验证,证实其不再生产带有葡萄糖基的化合物1转而积累不含有葡萄糖基的化合物2。
[0036]
实施例2:
[0037]
如式(ⅰ)所示的化合物1和化合物2的制备和结构鉴定
[0038]
一、如式(ⅰ)所示的化合物1和化合物2的制备
[0039]
1.种子培养:
[0040]
(1)种子培养基配方:以质量分数100%计,包括可溶性淀粉2%,玉米粉0.5%,麦芽提取物1%,麦芽糖1%,葡萄糖1%,微量元素(zncl2:0.8g/l,fecl3·
6h2o:4g/l,cucl2·
h2o:0.2g/l,nab4o7·
10h2o:0.2g/l,mncl2·
4h2o:0.2g/l,溶剂为水)0.01%,粗海盐0.3%,ph7.2-7.4,caco30.2%,余量为水。按照配方将称量好的上述物质溶解、混匀,以每瓶50ml分装于250ml的锥形瓶中,于115℃灭菌30分钟,作为种子培养基。
[0041]
(2)种子固体培养基配方:以质量分数100%计,包括葡萄糖0.4%,麦芽提取物1%,酵母提取物0.5%,粗海盐0.3%,ph7.2-7.4,技术琼脂粉1.5%,余量为水。按照配方将称量好的上述物质溶解、混匀,于115℃灭菌30分钟,倒平板后作为种子固体培养基,于28℃
静置培养。
[0042]
(3)种子的培养:分别将种子固体培养基上培养7天的菌株pseudonocardia sp.scsio07407、pseudonocardia sp.scsio 07407-δ292的菌丝体分别接入到上述种子培养基中,以200 rpm的转速、在28℃下、摇床培养36小时得种子培养液。
[0043]
2.放大发酵培养:
[0044]
(1)放大发酵培养基配方:以总质量分数100%计,包括可溶性淀粉2%,玉米粉0.5%,麦芽提取物1%,麦芽糖1%,葡萄糖1%,微量元素(同种子培养基)0.01%,粗海盐0.3%, ph7.2-7.4,caco30.2%,大孔树脂(xad-16)2%,余量为水。按照配方将称量好的上述物质溶解、混匀,配置总体积约20l,然后以每瓶200ml分装于1000ml的锥形瓶中,于115℃灭菌30分钟,作为放大发酵培养基。
[0045]
(2)发酵培养:
[0046]
在无菌条件下,将培养好的种子培养液分别接种于放大发酵培养基中,每1000ml锥形瓶(含约200ml放大发酵培养基)接种半瓶种子培养液(约25ml),以200rpm的转速、在28℃下、摇床培养7天得海洋稀有放线菌pseudonocardia sp.scsio 07407、突变株 pseudonocardia sp.scsio 07407-δ292发酵产物。
[0047]
3.提取分离:
[0048]
将结束发酵的菌株pseudonocardia sp.scsio 07407的发酵产物,以3900rpm离心10min,得沉淀菌丝体与大孔树脂混合物。沉淀菌丝体与大孔树脂混合物用共计2l食品级乙醇萃取4 次,乙醇萃取液在35℃下减压浓缩得粗提物浸膏。该浸膏用100-200目硅胶分离,经拌样、干法装柱后,采用氯仿/甲醇体系(c/m,100/0,98/2,96/4,94/6,92/8,90/10,80/20,70/30,50/50 v/v)梯度洗脱顺序得9个组分(a1-a9)。组分a5-a9(c/m,92/8,90/10,80/20,70/30,50/50, v/v洗脱馏分)合并,进一步用使用反相ods中压mplc在254nm检测波长,15ml/min的流速下梯度洗脱(ch3cn/h2o在120min内从20/80-100/0,v/v),每10min为一个馏分,顺序共得到12个馏分(b1-b12)。将组分b4-b7(30-70min洗脱馏分)分别用反相色谱柱 ymc-packods-a(250
×
20mm,5μm)进行制备,制备流速为2.5ml/min,检测波长为254nm,在20min内以a/b:20/80%-80/20%v/v的比例进行线性梯度洗脱(a:水,b:乙腈)。最终在保留时间为15.6min处得到化合物1(20.3mg)。
[0049]
对于突变株pseudonocardia sp.scsio 07407-δ292的发酵产物,以3900rpm离心10min,得沉淀菌丝体与大孔树脂混合物。沉淀菌丝体与大孔树脂混合物用共计2l食品级乙醇萃取4 次,乙醇萃取液在35℃下减压浓缩得粗提物浸膏。该浸膏用100-200目硅胶分离,经拌样、干法装柱后,采用氯仿/甲醇体系(c/m,100/0,98/2,96/4,94/6,92/8,90/10,80/20,70/30,50/50 v/v)梯度洗脱顺序得9个组分(a1-a9)。经过hplc-dad检测,合并组分a4-a7(c/m,94/6, 92/8,90/10,80/20,v/v洗脱馏分),进一步用使用反相ods中压mplc在254nm检测波长, 15ml/min的流速下梯度洗脱(ch3cn/h2o在120min内从20/80-100/0,v/v),每10min 为一个馏分,共得到12个馏分(b1-b12)。将组分b4-b6(30-60min洗脱馏分)分别用反相色谱柱ymc-pack ods-a(250
×
20mm,5μm)进行制备,制备流速为2.5ml/min,检测波长为254nm,在20min内以a/b:20/80%-80/20%v/v的比例进行线性梯度洗脱(a:水, b:乙腈)。最终在保留时间为16.7min处得到化合物2(4.3mg)。
[0050]
二、化合物1和化合物2的理化数据
[0051]
对化合物1和化合物2进行结构分析测试,得到以下理化性质数据:
[0052]
化合物1:棕色无定形粉末,[α]
25d-12.21(c0.01,meoh);uv(meoh)λ
max
(logε)254(3.80)nm;ir(atr)ν
max
3393,2974,2359,1654,1624,1458,1375,1205,984,679cm-1
;1h及
13
cnmr谱图见图1-2;( )-hresimsm/z1185.6910[m h]
(calcdforc
60h100
n2o
21
,1184.68).
[0053]
化合物2:棕色无定形粉末,[α]
25d-12.11(c0.01,meoh);uv(meoh)λ
max
(logε)254(3.80)nm;ir(atr)ν
max
3391,2976,2359,1654,1614,1459,1365,1201,984,681cm-1
;1h及
13
cnmr谱图见图3-4;( )-hresimsm/z[m h]
1023.6385(calcdforc
54h90
n2o
16
,1022.63).
[0054]
根据以上理化数据分析可知,化合物1和化合物2的结构如式(ⅰ)。
[0055][0056]
实施例3:
[0057]
对实施例1的大环内酯化合物-化合物1和化合物2的抑菌实验。
[0058]
用金黄色葡萄球菌及其耐药菌(staphylococcusaureus)、屎肠球菌及其耐药菌(enterococcusfaecium)、粪链球菌(enterococcusfaecalis)、溶血葡萄球菌(staphylococcushaemolyticus)或枯草芽孢杆菌(bacillussubtilis)做为测试细菌,参照clsi的微孔板法对化合物1-2进行100μl体系测试活性。具体为:
[0059]
1)细菌培养:以lb液体培养基培养实验菌,当其生长8-12h至约0.5个mcfarland浓度(1
×
108cfu)时备用。并配置好一定浓度的样品溶液和阳性对照溶液,阳性对照选用氨苄西林、盐酸万古霉素两种(水溶)。
[0060]
2)配置样品与稀释菌液。将样品(化合物1或2)配置成3200μg/ml,均以dmso溶解。将菌液合理稀释,保证最终测试浓度约为5
×
104cfu/ml。
[0061]
3)加lb液体培养基。用排枪往96孔板中加lb液体培养基,第1列加92μl、第12列加100μl无菌lb液体培养基,其余各列加入50μl无菌lb液体培养基,第11列和第12列分别作为阳性和阴性对照。
[0062]
4)加样品(药品):吸取8μl事先配好的样品溶液或阳性对照溶液(也以dmso溶解),加入第1列。将排枪体积设置为50μl,将第1列的测试药物小心上下吸取4-5次,以混合均匀,期间要防止用力过猛溅出。
[0063]
5)混匀样品(药品)。用排枪从第一列中吸取50μl,加入到对应的第二列中,上下吸取小心4-5次,混匀后再吸取50μl加入第三排。依次类推,直到稀释至第10列,从第10列中取出50μl弃掉。
[0064]
6)活性测试。向1-11列每孔加入50μl稀释的实验菌液。此时,第1列至第10列药物浓度分别为128,64、32、16、8、4、2、1、0.5、0.25μg/ml,测试菌测试浓度约为5
×
104cfu/ml。盖上盖子,轻微震荡,置于37℃培养箱培养12-18小时,第11列做无药物菌液对照,加入8μl事先配好的菌液,第12列做空白对照,确定出每个样品的mic值。
[0065]
每个样品做3个平行。实验结果见表1。
[0066]
由表1可见,化合物1和2对所测试的24株病原菌均具有显著的抑菌活性,且都优于阳性对照氨苄西林并与盐酸万古霉素活性相当,为以此为基础进行耐药性抗生素的研发提供了支持。
[0067]
表1:化合物1-2对24株测试细菌的mic值(μg/ml)
[0068][0069][0070]
实施例3:
[0071]
对实施例1的大环内酯化合物-化合物1的抗癌细胞实验
[0072]
采用cck8法测定化合物1的细胞毒活性。本实验所用的肿瘤细胞为人结直肠癌细胞 (rko),肝癌细胞(hepg2、lo2、a549),子宫颈癌细胞(hela),白血病细胞(hl60),非小细胞肺癌细胞(a549),乳腺癌细胞(mcf-7)和正常肺上皮细胞(beas-2b)。本发明将化合物1用二甲基亚砜溶解得浓度为20mmol/l的母液,再用细胞株对应的培养基稀释至所需浓度。取对数生长期的上述各细胞,以3000个/孔,将细胞接种于96孔板中并对每个浓度梯度做5个副孔,另外设置3个空白调零,于37℃、5%co2培养箱中培养24小时。待细胞贴壁后,每孔按所需浓度梯度加入配好的化合物1溶液,阴性对照加入等体积的培养基,每孔液体总体积100μl。置37℃、5%co2培养箱中培养48小时后,每孔加入10μl cck8,置于培养箱3小时后,用酶标仪测定450nm处的吸光值(a),用以下公式计算药物作用后的细胞活性,细胞生长的抑制率,采用graphpad prism 5.0软件计算对肿瘤细胞半数致死浓度 (ic50值)。
[0073]
细胞活性(%)=a样品组/a阴性对照组
×
100%
[0074]
实验结果如表2所示,化合物1处理细胞48小时后,发现其对所测试对8种癌症细胞具有明显抑制活性,且部分优于抗癌药物顺铂,具有进一步开发为抗癌药物先导化合物潜力。
[0075]
表2:化合物1的细胞毒活性(ic
50
,μm)
[0076][0077]
综上所述,本发明为研制新型抗菌、抗癌症药物提供了新的先导化合物,在此基础上,对进一步开发中国海洋药物资源具有重要的意义。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。