用于人类癌症综合功能分析的遗传药典
交叉引用
1.本技术要求于2019年6月21日提交的美国临时专利申请系列号62/865,047的权益,且其以引用方式全文并入本文。序列表
2.本技术包含一个序列表,该序列表已经以ascii格式电子提交,并以引用形式全文并入本文。在2020年6月18日创建的所述ascii副本命名为56322-701_601_sl.txt,且其长度为732,058个字节。
背景技术:
3.人类癌症是非常异质的,其在dna序列、表观基因组景观图、rna表达和蛋白质水平上都不同,造成细胞行为中的巨大组合复杂性。尽管在我们的分子靶向抗癌疗法的医疗设备中有引人瞩目的进展,但癌细胞行为下的极端分子复杂性导致我们在预测哪些患者将受益于任何特定疗法的能力方面存在着显著不足。缺乏预测患者反应的有效手段直接导致无效的治疗周期,给患者带来巨大的机会成本及给患者和医疗保健支付者带来巨大的经济成本。
技术实现要素:
4.目前公开的方法试图通过确定哪种分子靶向疗法对特定患者的疾病有效,从而提供合理且个性化的治疗选择。一方面,该方法包括确定患者的癌细胞对干扰物(perturbagen)库的功能易感性,所述干扰物库对已知肿瘤药物库的作用进行建模。代表性的干扰物包括能够敲除或敲低编码已知肿瘤药物的蛋白质靶标的基因的基因编辑或沉默系统的组分。例如,干扰物可以包括基因调节剂,例如用于基于crispr的基因编辑的指导rna序列,或用于基因沉默的rnai。因此,功能易感性分析的示例性方法包括用基因调节剂库修饰患者的癌细胞,所述基因调节剂库能够敲低或敲除编码已知肿瘤药物库的蛋白质靶标的基因的功能。在一些方法中,所有这些基因的功能被敲低或敲除,使得可以询问患者的癌症对所有可用的分子靶向疗法的易感性。可以通过下一代测序技术筛选修饰的癌细胞,以确定个体遗传干扰物对患者癌细胞活力的影响。与干扰物相关的降低癌细胞活力的肿瘤药物可以被选作推定的治疗药物,使得可以个性化选择癌症治疗药物。
5.一方面,本文提供了治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用选自治疗分子库的治疗分子;其中所述治疗分子通过包括以下步骤的方法进行选择:修饰来自所述受试者的癌细胞以敲低或敲除多个基因的功能,所述多个基因中的每个基因编码所述治疗分子库中的治疗分子的蛋白质靶标,其中如果所述治疗分子敲低或敲除编码所选择的治疗分子的蛋白质靶标的基因的功能损害癌细胞活力,则选择所述治疗分子。在一些实施方案中,治疗分子库包含表2的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。在一些实施方案中,治疗分子库包含表3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。在一些实施方案中,所述多个
基因中的一个或多个编码表5b的蛋白质。在一些实施方案中,所述多个基因中的一个或多个编码表5a的蛋白质。在一些实施方案中,所述多个基因中的一个或多个编码表5c的蛋白质。在一些实施方案中,所述多个基因中的一个或多个编码表5d的蛋白质。在一些实施方案中,所述多个基因中的一个或多个编码表4的蛋白质。在一些实施方案中,所述多个基因中的一个或多个编码表3的蛋白质。
6.另一方面,本文提供了治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用选自治疗分子库的治疗分子;其中所述受试者的癌症已通过包括以下步骤的方法确定对所选择的治疗分子敏感:(a)使来自所述受试者的癌细胞样品与基因调节剂库接触,以产生多个修饰的癌细胞,其中每个修饰的癌细胞含有一种或多种所述基因调节剂,并且每种基因调节剂能够敲低或敲除编码所述治疗分子库中治疗分子的蛋白质靶标的基因的功能,和(b)对所述多个修饰的癌细胞进行测序,其中损害细胞活力的基因调节剂将具有比不损害细胞活力的基因调节剂更少的序列读取,并且被损害细胞活力的所述基因调节剂敲低或敲除的所述基因编码被所述选择的治疗分子靶向的所述蛋白质。在一些实施方案中,在测序之前,多个修饰的癌细胞中的一个或多个已增殖。在一些实施方案中,增殖包括在2d体外培养物中维持修饰的癌细胞。在一些实施方案中,增殖包括在3d体外培养物中维持修饰的癌细胞。在一些实施方案中,增殖包括体内维持修饰的癌细胞。在一些实施方案中,增殖发生在动物模型内。在一些实施方案中,所述动物是啮齿动物。在一些实施方案中,所述癌细胞是原代癌细胞。
7.在一些实施方案中,接触包括通过病毒或非病毒递送方法将一种或多种基因调节剂引入各癌细胞。在一些实施方案中,所述库中的一种或多种基因调节剂在病毒载体上进行编码。在一些实施方案中,所述病毒载体包括慢病毒载体、腺病毒载体或腺相关病毒载体。在一些实施方案中,所述非病毒递送方法包括转座酶介导的转座。
8.在一些实施方案中,所述库包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的基因调节剂。在一些实施方案中,所述基因调节剂库中的一种或多种基因调节剂包含与编码表3-5d所示蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。在一些实施方案中,所述基因调节剂文中的一种或多种基因调节剂包含与编码表5b所示蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。在一些实施方案中,所述基因调节剂库中的一种或多种基因调节剂包含与编码表5c所示蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。在一些实施方案中,所述基因调节剂库中的一种或多种基因调节剂包含与编码表5d所示蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。在一些实施方案中,所述同源性为至少约90%序列同源性。在一些实施方案中,所述同源性为至少约90%序列同一性。在一些实施方案中,治疗分子库包含表2的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。在一些实施方案中,治疗分子库包含表3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。
9.在一些实施方案中,所述癌症包括选自以下组的至少一种癌症:急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、肾上腺皮质癌、aids相关癌症、卡波西肉瘤、aids相关淋巴瘤、原发性cns淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎/横纹肌样肿瘤、中枢神经系统癌症、皮肤基底细胞癌、胆管癌、膀胱癌、骨癌、脑瘤、乳腺癌、支气管肿瘤、伯基特
淋巴瘤、类癌瘤、心脏肿瘤、中枢神经系统癌症、胚胎瘤、生殖细胞肿瘤、原发性cns淋巴瘤、宫颈癌、胆管上皮癌、脊索瘤、慢性淋巴细胞白血病(cll)、慢性髓性白血病(cml)、慢性骨髓增生性肿瘤、结肠直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤、原位导管癌(dcis)、胚胎瘤、中枢神经系统癌症、子宫内膜癌、室管膜瘤、食管癌、鼻腔神经胶质瘤、尤文肉瘤、颅外生殖细胞肿瘤、性腺外生殖细胞瘤、眼癌、眼内黑素瘤、视网膜母细胞瘤、输卵管癌、骨纤维组织细胞瘤、骨肉瘤、胆囊癌、胃癌、胃肠道类癌肿瘤、胃肠道间质瘤(gist)、睾丸癌、妊娠滋养细胞疾病、毛细胞白血病、头颈癌、心脏肿瘤、肝细胞癌、霍奇金淋巴瘤、喉咽癌、眼内黑素瘤、胰岛细胞肿瘤、胰腺神经内分泌肿瘤、肾癌、朗格汉斯细胞组织细胞增多症、喉癌、白血病、唇和口腔癌、肝癌、肺癌(非小细胞和小细胞)、淋巴瘤、男性乳腺癌、骨恶性纤维组织细胞瘤和骨肉瘤、黑素瘤、眼内黑素瘤、merkel细胞癌、间皮瘤、转移癌、转移性鳞状颈癌伴隐匿性原发性、中线道癌伴nut基因改变、口腔癌、多发性内分泌肿瘤综合征、多发性骨髓瘤/浆细胞肿瘤、蕈样真菌病、骨髓增生异常综合征、骨髓增生异常/骨髓增生性肿瘤、骨髓性白血病、慢性(cml)、髓细胞性白血病、急性(aml)、鼻腔和鼻旁窦癌、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌、口咽癌、卵巢癌、胰腺癌、胰腺神经内分泌肿瘤(胰岛细胞肿瘤)、乳头瘤病、副神经节瘤、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、浆细胞瘤/多发性骨髓瘤、胸膜肺母细胞瘤、原发性中枢神经系统(cns)淋巴瘤、原发性腹膜癌、前列腺癌、直肠癌、复发性癌症、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤、横纹肌肉瘤、血管瘤、骨肉瘤、软组织肉瘤、子宫肉瘤、sezary综合症、皮肤癌、小肠癌、皮肤鳞状细胞癌、伴有隐匿原发性的鳞状颈癌、胃癌、t-细胞淋巴瘤、睾丸癌、喉癌、鼻咽癌、口咽癌、下咽癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管的移行细胞癌、输尿管和肾盂、尿道癌、子宫癌、子宫内膜癌、子宫肉瘤、阴道癌、血管瘤、外阴癌、wilms瘤和其它儿童肾肿瘤。
10.在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:1-2789,2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:1526-2789的序列具有至少约90%同源性的指导rna(grna)序列。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。在一些实施方案中,至少约90%同源性为至少约90%同一性。在一些实施方案中,一种或多种基因调节剂包含指导rna(grna)序列,该grna序列与编码治疗分子库中的治疗分子的蛋白质靶标的基因的至少一部分具有同源性。在一些实施方案中,grna与基因的约10至约50个连续核苷酸具有同源性。在一些实施方案中,同源性为至少约90%序列同源性。在一些实施方案中,同源性为至少约90%序列同一性。在一些实施方案中,癌细胞样品与核酸内切酶接触。在一些实施方案中,核酸内切酶包括cas9或cas12a核酸内切酶。在一些实施方案中,cas9或cas12a核酸内切酶选自化脓链球菌(s.pyogenes)cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌(s.aureus)cas9(sacas9)、氨基酸球菌属种(acidaminococcus sp.)(ascpf1)、毛螺旋菌(lachnospiraceae bacterium)(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌(c.jejuni)cas9(cjcas9)、脑膜炎双球菌(n.meningitidis)(nmcas9)、嗜热链球菌(thermophilus)(stcas9)、齿垢密螺旋体(t.denticola)(tdcas9)和mad7。在一些实施方案中,核酸内切酶
不包含cas9或cas12a核酸内切酶。在一些实施方案中,grna位于载体内。在一些实施方案中,载体还包含病毒的遗传元件。在一些实施方案中,病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。在一些实施方案中,载体还包含辅助核酸序列。在一些实施方案中,辅助核酸序列包含编码标记物、抗生素抗性盒和表面表位表达盒的序列。在一些实施方案中,标记物是荧光标记物。在一些实施方案中,辅助核酸允许选择经修饰而含有一种或多种基因调节剂的癌细胞。
11.在一些实施方案中,一种或多种基因调节剂包含编码治疗分子库中的治疗分子的蛋白质靶标的基因的至少一部分具有同源性的短发夹rna(shrna)序列。在一些实施方案中,shrna与基因的约10至约50个连续核苷酸具有同源性。在一些实施方案中,同源性为至少约90%序列同源性。在一些实施方案中,同源性为至少约90%序列同一性。在一些实施方案中,shrna位于载体内。在一些实施方案中,载体还包含病毒的遗传元件。在一些实施方案中,病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。在一些实施方案中,载体还包含辅助核酸序列。在一些实施方案中,辅助核酸序列包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。在一些实施方案中,标记物是荧光标记物。在一些实施方案中,辅助核酸允许选择经修饰而含有一种或多种基因调节剂的癌细胞。
12.另一方面,本文提供了一种从患有癌症的受试者产生多个修饰的癌细胞的方法,所述方法包括将基因调节剂库递送至来自所述受试者的癌细胞样品,以产生所述多个修饰的癌细胞;其中每个修饰的癌细胞含有一种或多种所述基因调节剂,并且每种基因调节剂能够敲低或敲除编码蛋白质靶标库的蛋白质靶标的基因的功能。在一些实施方案中,一种或多种所述基因调节剂包含指导rna(grna)序列,所述序列与其功能在修饰的癌细胞中被敲低或敲除的基因的至少一部分具有同源性。在一些实施方案中,grna与基因的约10至约50个连续核苷酸具有同源性。在一些实施方案中,同源性为至少约90%序列同源性。在一些实施方案中,同源性为至少约90%序列同一性。在一些实施方案中,一种或多种基因调节剂各自包含与选自选自seq id nos:1-2789,2980-3071的序列至少约90%同源的指导rna(grna)序列。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:1526-2789的序列至少约90%同源的指导rna(grna)序列。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:2980-3071的序列至少约90%同源的指导rna(grna)序列。在一些实施方案中,同源性为至少约90%同一性。在一些实施方案中,癌细胞样品与核酸内切酶接触。在一些实施方案中,核酸内切酶包括cas9或cas12a核酸内切酶。在一些实施方案中,cas9或cas12a核酸内切酶选自化脓链球菌cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌cas9(sacas9)、氨基酸球菌属种(ascpf1)、毛螺旋菌(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌cas9(cjcas9)、脑膜炎双球菌(nmcas9)、嗜热链球菌(stcas9)、齿垢密螺旋体(tdcas9)和mad7。在一些实施方案中,核酸内切酶不包含cas9或cas12a核酸内切酶。在一些实施方案中,grna位于载体内。在一些实施方案中,载体还包含病毒的遗传元件。在一些实施方案中,病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘
病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。在一些实施方案中,载体还包含辅助核酸序列。在一些实施方案中,辅助核酸序列包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。在一些实施方案中,标记物是荧光标记物。在一些实施方案中,辅助核酸允许选择经修饰而含有一种或多种基因调节剂的癌细胞。
13.在一些实施方案中,一种或多种基因调节剂包含与其功能在修饰的癌细胞中被敲低或敲除的基因的至少一部分具有同源性的短发夹rna(shrna)序列。在一些实施方案中,shrna与基因的约10至约50个连续核苷酸具有同源性。在一些实施方案中,同源性为至少约90%序列同源性。在一些实施方案中,同源性为至少约90%序列同一性。在一些实施方案中,shrna位于载体内。在一些实施方案中,载体还包含病毒的遗传元件。在一些实施方案中,病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。在一些实施方案中,载体还包含辅助核酸序列。在一些实施方案中,辅助核酸序列包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。在一些实施方案中,标记物是荧光标记物。在一些实施方案中,辅助核酸允许选择经修饰而含有一种或多种基因调节剂的癌细胞。
14.在一些实施方案中,递送包括转座酶介导的转座。在一些实施方案中,癌细胞样品包括原代癌细胞。在一些实施方案中,癌细胞样品包含约105至约108个细胞。在一些实施方案中,库包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的基因调节剂。在一些实施方案中,至少约90%的基因调节剂以在平均基因调节剂量的约10%以内的量存在于库中。在一些实施方案中,蛋白质靶标库包含表5b的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5a的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5c的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5d的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表4的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,癌细胞样品已经被处理以保持细胞活力。
15.在一些实施方案中,方法还包括在递送基因调节剂库之前和/或之后制备癌细胞样品以保持细胞活力。在一些实施方案中,方法还包括使修饰的癌细胞增殖。在一些实施方案中,增殖包括在2d体外培养物中维持修饰的癌细胞。在一些实施方案中,增殖包括在3d体外培养物中维持修饰的癌细胞。在一些实施方案中,增殖包括体内维持修饰的癌细胞。在一些实施方案中,增殖在动物模型内进行。在一些实施方案中,动物模型是啮齿动物。
16.另一方面,本文提供了包含多个修饰的癌细胞的汇编,其中每个修饰的癌细胞含有一种或多种基因调节剂,并且每种基因调节剂能够敲低或敲除编码蛋白质靶标库的蛋白质靶标的基因的功能。在一些实施方案中,一种或多种基因调节剂中的至少一种包含选自
seq id nos:1-2789、2980-3071的序列。在一些实施方案中,一种或多种基因调节剂中的至少一种包含选自seq id nos:1526-2789的序列。在一些实施方案中,一种或多种基因调节剂中的至少一种包含选自seq id nos:2980-3071的序列。在一些实施方案中,一种或多种基因调节剂中的至少一种包含与选自seq id nos:1-2789、2980-3071的序列至少约90%同源的序列。在一些实施方案中,一种或多种基因调节剂中的至少一种包含与选自seq id nos:1526-2789的序列至少约90%同源的序列。在一些实施方案中,一种或多种基因调节剂中的至少一种包含与选自seq id nos:2980-3071的序列至少约90%同源的序列。在一些实施方案中,同源性为90%同一性。
17.在一些实施方案中,蛋白质靶标库包含表5b的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5a的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5c的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5d的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表4的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,一种或多种基因调节剂包含与其功能在经修饰的癌细胞中被敲低或敲除的基因的至少一部分具有同源性的指导rna(grna)序列。在一些实施方案中,grna与基因的约10至约50个连续核苷酸具有同源性。在一些实施方案中,同源性为至少约90%序列同源性。在一些实施方案中,同源性为至少约90%序列同一性。
18.在一些实施方案中,汇编包含核酸内切酶。在一些实施方案中,核酸内切酶包括cas9或cas12a核酸内切酶。在一些实施方案中,cas9或cas12a核酸内切酶选自化脓链球菌cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌cas9(sacas9)、氨基酸球菌属种(ascpf1)、毛螺旋菌(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌cas9(cjcas9)、脑膜炎双球菌(nmcas9)、嗜热链球菌(stcas9)、齿垢密螺旋体(tdcas9)和mad7。在一些实施方案中,核酸内切酶不包含cas9或cas12a核酸内切酶。
19.在一些实施方案中,grna位于载体内。在一些实施方案中,载体还包含病毒的遗传元件。在一些实施方案中,病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。在一些实施方案中,载体还包含辅助核酸序列。在一些实施方案中,辅助核酸序列包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。在一些实施方案中,标记物是荧光标记物。在一些实施方案中,辅助核酸允许选择修饰的癌细胞。
20.在一些实施方案中,一种或多种基因调节剂包含与其功能在经修饰的癌细胞中被敲低或敲除的基因的至少一部分具有同源性的短发夹rna(shrna)序列。在一些实施方案中,shrna与基因的约10至约50个连续核苷酸具有同源性。在一些实施方案中,同源性为至少约90%序列同源性。在一些实施方案中,同源性为至少约90%序列同一性。在一些实施方
案中,shrna位于载体内。在一些实施方案中,载体还包含病毒的遗传元件。在一些实施方案中,病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。在一些实施方案中,载体还包含辅助核酸序列。在一些实施方案中,辅助核酸序列包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。在一些实施方案中,标记物是荧光标记物。在一些实施方案中,辅助核酸允许选择修饰的癌细胞。在一些实施方案中,递送包括转座酶介导的转座。
21.在一些实施方案中,修饰的癌细胞是修饰的原代癌细胞。在一些实施方案中,汇编包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的基因调节剂。在一些实施方案中,汇编包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的修饰的癌细胞群。
22.另一方面,本文提供了一种评估遗传修饰来自受试者的癌细胞的功能效果的方法,所述方法包括:对多个修饰的癌细胞进行测序,其中每个修饰的癌细胞含有一种或多种基因调节剂,每种基因调节剂能够敲低或敲除编码蛋白质靶标库中的蛋白质靶标的基因的功能;并且其中损害细胞活力的基因调节剂将比不损害细胞活力的基因调节剂具有更少的序列读取。在一些实施方案中,方法包括确定哪些基因调节剂具有少于阈值数量的序列读取。在一些实施方案中,如果基因调节剂不损害细胞活力,则阈值数量的序列读取是预期数量的序列读取。在一些实施方案中,阈值数量的序列读取是多个修饰的癌细胞中的每种基因调节剂的平均数量的序列读取。
23.在一些实施方案中,方法包括将具有少于阈值数量的序列读取的各基因调节剂与蛋白质靶标库中的其相应的蛋白质靶标相关联。在一些实施方案中,方法包括将相应的蛋白质靶标与治疗分子相关联。在一些实施方案中,蛋白质靶标库包含表5b的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5a的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5c的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5d的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表4的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。
24.在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:1-2789、2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:1526-2789的序列具有至少约90%同源性的指导rna(grna)序列。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。在一些实施方案中,至少约90%同源性为至少约90%同一性。
25.另一方面,本文提供了一个包含多种基因调节剂的库,且每种基因调节剂能够敲
低或敲除编码蛋白质靶标库的蛋白质靶标的基因的功能。在一些实施方案中,多种基因调节剂能够敲低或敲除编码库中的蛋白质靶标的基因的至少约50%的功能。在一些实施方案中,至少约50%为至少约60%。在一些实施方案中,至少约60%为至少约70%。在一些实施方案中,至少约70%为至少约80%。在一些实施方案中,至少约80%为至少约90%。在一些实施方案中,蛋白质靶标库包含由能够治疗特定疾病或病况的已知药物靶向的所有已知蛋白质。在一些实施方案中,疾病或病况是癌症。在一些实施方案中,癌症包括选自以下组的至少一种癌症:急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、肾上腺皮质癌、aids相关癌症、卡波西肉瘤、aids相关淋巴瘤、原发性cns淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎/横纹肌样肿瘤、中枢神经系统癌症、皮肤基底细胞癌、胆管癌、膀胱癌、骨癌、脑瘤、乳腺癌、支气管肿瘤、伯基特淋巴瘤、类癌瘤、心脏肿瘤、中枢神经系统癌症、胚胎瘤、生殖细胞肿瘤、原发性cns淋巴瘤、宫颈癌、胆管上皮癌、脊索瘤、慢性淋巴细胞白血病(cll)、慢性髓性白血病(cml)、慢性骨髓增生性肿瘤、结肠直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤、原位导管癌(dcis)、胚胎瘤、中枢神经系统癌症、子宫内膜癌、室管膜瘤、食管癌、鼻腔神经胶质瘤、尤文肉瘤、颅外生殖细胞肿瘤、性腺外生殖细胞瘤、眼癌、眼内黑素瘤、视网膜母细胞瘤、输卵管癌、骨纤维组织细胞瘤、骨肉瘤、胆囊癌、胃癌、胃肠道类癌肿瘤、胃肠道间质瘤(gist)、睾丸癌、妊娠滋养细胞疾病、毛细胞白血病、头颈癌、心脏肿瘤、肝细胞癌、霍奇金淋巴瘤、喉咽癌、眼内黑素瘤、胰岛细胞肿瘤、胰腺神经内分泌肿瘤、肾癌、朗格汉斯细胞组织细胞增多症、喉癌、白血病、唇和口腔癌、肝癌、肺癌(非小细胞和小细胞)、淋巴瘤、男性乳腺癌、骨恶性纤维组织细胞瘤和骨肉瘤、黑素瘤、眼内黑素瘤、merkel细胞癌、间皮瘤、转移癌、转移性鳞状颈癌伴隐匿性原发性、中线道癌伴nut基因改变、口腔癌、多发性内分泌肿瘤综合征、多发性骨髓瘤/浆细胞肿瘤、蕈样真菌病、骨髓增生异常综合征、骨髓增生异常/骨髓增生性肿瘤、骨髓性白血病、慢性(cml)、髓细胞性白血病、急性(aml)、鼻腔和鼻旁窦癌、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌、口咽癌、卵巢癌、胰腺癌、胰腺神经内分泌肿瘤(胰岛细胞肿瘤)、乳头瘤病、副神经节瘤、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、浆细胞瘤/多发性骨髓瘤、胸膜肺母细胞瘤、原发性中枢神经系统(cns)淋巴瘤、原发性腹膜癌、前列腺癌、直肠癌、复发性癌症、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤、横纹肌肉瘤、血管瘤、骨肉瘤、软组织肉瘤、子宫肉瘤、sezary综合症、皮肤癌、小肠癌、皮肤鳞状细胞癌、伴有隐匿原发性的鳞状颈癌、胃癌、t-细胞淋巴瘤、睾丸癌、喉癌、鼻咽癌、口咽癌、下咽癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管的移行细胞癌、输尿管和肾盂、尿道癌、子宫癌、子宫内膜癌、子宫肉瘤、阴道癌、血管瘤、外阴癌、wilms瘤和其它儿童肾肿瘤。
26.在一些实施方案中,已知药物包括表2的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种药物。在一些实施方案中,已知药物包括表3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种药物。在一些实施方案中,蛋白质靶标库包含表5b的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5a的至少1、至少2、至少3、至少4、至少5、至少10或至少20个蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5c的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5d的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶
标库包含表4的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表3的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,多种基因调节剂中的一种或多种各自包含与选自seq id nos:1-2789、2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。在一些实施方案中,多种基因调节剂中的一种或多种各自包含与选自seq id nos:1526-2789的序列具有至少约90%同源性的指导rna(grna)序列。在一些实施方案中,多种基因调节剂中的一种或多种各自包含与选自seq id nos:2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。在一些实施方案中,至少约90%同源性为至少约90%同一性。
27.在一些实施方案中,多种基因调节剂能够敲低或敲除约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000或约100至约2,000个基因的功能。在一些实施方案中,库包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000或约100至约2,000种基因调节剂。
28.在一些实施方案中,至少一种基因调节剂能够敲除基因的功能。在一些实施方案中,至少一种基因调节剂包含与其功能被基因调节剂敲除的基因的至少一部分具有同源性的grna序列。在一些实施方案中,至少一种基因调节剂能够敲低基因的功能。在一些实施方案中,至少一种基因调节剂包含与其功能被基因调节剂敲低的基因的至少一部分具有同源性的shrna序列。在一些实施方案中,同源性为至少约90%序列同源性。在一些实施方案中,同源性为至少约90%序列同一性。在一些实施方案中,至少一部分是至少约15个连续核苷酸。
29.在一些实施方案中,至少一种基因调节剂位于载体中。在一些实施方案中,载体包含接头序列(adapter sequence)。在一些实施方案中,接头序列包含iis型限制性内切酶切割位点。在一些实施方案中,载体还包含病毒的遗传元件。在一些实施方案中,病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。在一些实施方案中,载体还包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。在一些实施方案中,标记物是荧光标记物。
附图说明
30.图1是本文所述的癌症功能易感性分析方法的临床工作流程。
31.图2是用于个性化功能基因组学的基于crispr的平台的示意图。
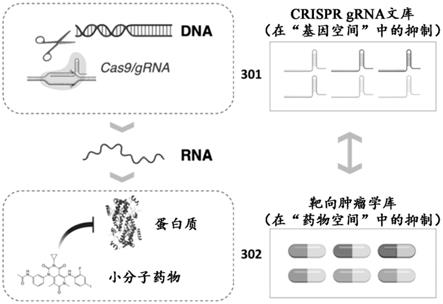
32.图3是通过crispr鉴定基因空间中癌症治疗缺陷的示意图。
33.图4是靶向肿瘤学crispr文库的特征表。
34.图5示出了合并质粒dna(左)和转导的细胞(右)中grna表示的分布。
35.图6a示出了含有感染的原代肿瘤细胞的3d胶原支架。
36.图6b示出了论证小肿瘤来源类器官/细胞器生长的重新分离的细胞。
37.图7示出了b2m的表达,表明以基于启动b2m的grna在grna文库中的相对丰度所预期的精确频率的b2m蛋白表达丧失。
38.图8为a549肺肿瘤细胞中crispr文库筛选的火山图。核心选择的基因以黑色圆圈
(top2a、tubb、rpl3、tubg1、psmb5)显示。阴性对照基因以灰色圆圈显示。
39.图9是原发性pdx衍生的人黑素瘤肿瘤细胞中crispr文库筛选的火山图。已知的黑素瘤驱动基因braf被认为一种治疗缺陷。阴性对照基因以灰色圆圈显示。
具体实施方式
40.在个性化癌症敏感性测试中的大多数先前努力都集中于用所提出的治疗性小分子在体外治疗肿瘤细胞。然而,许多研究已经证明癌细胞的体外行为与其相应的体内行为之间存在关键差异,包括癌细胞对各种分子路径抑制的反应。实际上,迄今为止用于化学敏感性测试的临床上最成功的方法之一利用原代患者来源的癌细胞向小鼠中的植入,随后用药物进行体内动物治疗。这种方法是有效的,但非常慢(6-12个月)、昂贵(与化合物和动物相关的商品成本;给药、分析的实践时间)且非全面(即仅可测试少数药物)。结果,该方法实际上是无法普及的。
41.超过300种分子靶向疗法被批准或正在研究用于治疗癌症。这些药物中的每一种(通常是低分子量化合物,或在某些情况下是抗体)与特定蛋白质靶标的功能结合,并且在几乎在所有情况下使特定蛋白质靶标的功能失活。虽然在个体患者的癌细胞上测试这些药物中的每一种以找到有效疗法在概念上是吸引人的,但由于以下多种原因其已经在过去几十年内被证明是受到内在限制的和次优的过程:(1)进行测试所需的细胞数量限制了可以测试的治疗方法(药物)的数量。(2)测试仅可在体外进行,其与进行临床治疗的体内环境显著不同。(3)准确的测试取决于对通常未知的体外药物稳定性和细胞接触的认知。因此,从体外化合物测试收集的数据不能反映可实现的体内组织接触。(4)与维护所有药物的经验证和更新的库存相关的商品的成本高。(5)测试不能以合并或多路复用格式执行,从而提高了成本并限制了产量。因此,这些方法原则上不能扩展到商业水平。(6)测试不能用于确认新的靶标,即那些还没有药物的靶标。
42.目前描述的方法通过将目前可用的一套抗癌治疗方法从“药物空间”转到“基因空间”而发挥作用。具体地,该方法取决于这样的关键的认识,即现有疗法的每个蛋白质靶标也可通过编码该蛋白质靶标的基因的诱变如通过基因编辑而被间接抑制。因此,所述“药物药典”可以替代地由“遗传药典”表示。遗传药典可以以遗传的形式表示整个靶向治疗前景(例如,对于肿瘤学前景,表示超过300种治疗分子)。这可以通过设计抑制性遗传元件而实现,例如分别对应于每种潜在治疗药物的蛋白质靶标的基因或mrna的sgrna(crispr)或shrna(rnai)。因此,遗传药典允许对癌细胞对已知肿瘤药物的功能易感性进行遗传测定,减轻了上述缺点并如表1所示。表1.用遗传药典减轻现有方法的缺点。
43.与化学药典将巨大的潜在药物空间(即所有lmw化学结构)降低到在实际实践中对治疗选择方法有用的规模相同,遗传药典将人类基因组的复杂性降低到适合在个性化诊断中实际使用的规模。通常来源于不足的活检或切除样本的患者来源细胞的有限可用性,以及在培养物中繁殖这些细胞的有限能力使得复杂性降低,并且利用了诊断应用中不可缺少的遗传药典。将较大的(例如全基因组)库用于个性化医疗完全是不可行的,且其到目前为止已经排除了将这些技术应用于精准医疗。
44.一方面,本文提供了确定疾病或病况对治疗剂库的易感性的方法,所述治疗剂库由模拟那些治疗剂的作用的干扰物库表示。图1中示出了对于癌症患者的功能易感性分析方法的临床工作流程。在初始步骤101中,从患者身上获取源自患者的原代癌细胞样品。在随后的步骤102中,将癌细胞与基因调节剂库接触,所述基因调节剂库通过编辑(例如基于crispr的方法)和/或沉默(例如sirna)编码这些蛋白质靶标的基因模拟具有已知蛋白质靶标的抗癌药物库的功能。通过体外2d培养、体外2.5d/3d培养或体内培养增殖所得的修饰的癌细胞。该步骤可包括使用改进的体内生长的3d体外模型、抑制基质细胞生长的方法、与自体或同种异体免疫细胞(例如t细胞)共培养或改进的体内异种移植物发育方法或其任意组合。为了评价每个基因干扰的影响,在随后的步骤103中,例如通过下一代测序技术(ngs)测试增殖的修饰的癌细胞,以获得关于哪些基因调节剂影响患者癌细胞的活力的读数。该步骤可包括使用成熟的内部参考校准丢失分析和校正样品间的变化。建立了确认有效的基因调节剂和/或相应的抗癌药物的临床小组104。诸如肿瘤科医生的临床医生或诸如肿瘤委员会的一组临床医生评估临床小组104,并且做出关于针对患者的治疗过程的临床决策106。为了协助所述临床决策106,未修饰的肿瘤本身可以进行dna测序105。
45.另一方面,本文所述的方法促进发现小组107的产生,其可以包括新发现的药物靶标,例如以帮助药物开发;新发现的已知药物的一种或多种用途(药物再利用);和/或与基于全外显子组测序的发现的功能相关性。这些发现可以与生物制药公司108配合以帮助扩展已知药物的药物适应症;已知药物的基于功能的临床试验;针对新发现的靶标的药物开发;和/或通过对未知意义的变异(vus)进行托孤来改进基于序列的分析。
46.图1所述方法还可包括设计在功能分析步骤102中使用的基因调节剂库。该设计可涉及通过生成对于癌症的所有靶向药物(药物库)的列表来定义完整靶向的药理学景观。作为一个实例,药物库包括表2的抗癌药物中的至少一种,例如,表2中列出的药物中的至少约5、10、20、50、100、150、200、250、300、400、500、1000或1500种。作为另一个实例,药物库包括表3的抗癌药物中的至少一种。在一些情况下,药物库包含表3的多种抗癌药物,例如,表3中列出的药物中的至少约5、10、20、50、100、150、200、250、300、400、500、1000或1500种。药物库可以包含用于特定类型癌症的所有靶向药物。如本文所用,“所有靶向药物”可指用于例如一般癌症或特定类型的癌症的特定适应症的所有fda批准的药物的至少约90%、95%或100%。所有靶向药物也可以包括试验药物,例如正在进行监管审查但尚未被批准的药物,以及在临床试验或临床前测试中使用的药物。
47.图1中所述的方法可以进一步包括确定药物库中的药物的蛋白和相关基因靶标,药物库如包括表2-3的一种或多种抗癌药物的药物库,例如表2的药物。这要求对于分析中所包括的每种药物,靶标是已知的或建议的。在如多激酶抑制剂的非特异性抑制剂的情况下,靶标可以包括多种基因靶标。作为非限制性实例,库包括表4-6b、6d的靶标中的至少一种。在一些情况下,库包括表4-6b、6d的多种靶标,例如表4-6b、6d中列出的靶标中的至少约5、10、20、50、100、150、200、250或300种。
48.图1所示功能分析中所用的基因调节剂库可通过选择靶向靶标库的基因的试剂来设计,例如,靶向编码表4-6b、6d中一种或多种靶标(例如表6d中的靶标)的基因的试剂。可以选择已经验证了抑制靶标的功效的试剂,从而提供更“紧凑”的库。在一个示例性实施方案中,库包含至少一种核酸,其包含选自seq id nos:1-2789,2980-3071的序列。在一些情况下,库包含选自seq id nos:1-2789,2980-3071的多个核酸序列。在一个示例性实施方案中,库包含至少一种核酸,其包含选自seq id nos:1526-2789的序列。在一些情况下,库包含选自seq id nos:1526-2789的多个核酸序列。在一个示例性实施方案中,库包含至少一种核酸,其包含选自seq id no:2980-3071的序列。在一些情况下,库包含选自seq id nos:2980-3071的多个核酸序列。在一些基于crispr的方法中,库包含对照grna序列,例如不具有人类基因组中的靶标的非切割性控制序列和/或靶向人类基因组的非遗传区域的切割序列。例如,库可以包含seq id nos:2790-2971(表6c)的一个或多个序列。试剂库可以以与在例如原代(直接源于患者的)癌细胞的细胞中使用相容的形式构建。该步骤可涉及使用新的病毒载体系统、使用非病毒方法将试剂递送至细胞,或使用新的基因编辑剂(例如,非cas9 crispr核酸酶)或其任何组合。
49.因此,本公开的示例性方法可以包括以下步骤中的一个或多个:(1)通过生成对于疾病或病况的所有靶向药物的列表(药物库)来定义完整靶向的药理学景观。(2)确定这些药物的蛋白质靶标,以及编码这些蛋白质靶标的基因(遗传药典)。(3)设计基因调节剂库以靶向编码这些蛋白质的基因。(4)以与在例如原代癌细胞的细胞中的使用相容的形式构建
库以及任何需要的基因沉默/编辑剂。(5)将库和任何需要的基因沉默/编辑剂递送至例如源自患者的原代癌细胞的细胞中。(6)繁殖经编辑的细胞。(7)例如通过基于下一代测序技术(ngs)的方法获得每种干扰物的影响的读数。(8)解释所得到的条形码分布以确定单个干扰物对患者的病变细胞的活力的影响。尽管已经就个性化癌症治疗举例说明了所述方法,但是这些方法也适合于治疗基于非癌症的疾病或病况。
50.图2中示出了利用本文所述的功能基因组学来识别患者特异性肿瘤治疗缺陷的非限制性示例性通用流程图。将直接从患者获得的或在小鼠中传代(pdx)后获得的源自患者的样品(201)使用对应于所需治疗药物集合的grna文库进行离解(202)和感染(203)。细胞在体外例如使用3d和/或细胞器方法可存活地维持,允许靶向必要的肿瘤调节剂的grna从群体中逐渐耗尽(“退出”)(204)。进行下一代测序技术以确认对应于从群体中耗尽的基因并且编码患者特异性药物靶标的耗尽的条形码(205)。在体内验证对应于患者特异性药物靶标的肿瘤药物(206)。如图3中的示意图所示,该方法充分利用了以下观点:每种临床使用的靶向肿瘤药物(302)的效果可以通过编码药物靶标(301)的相应基因的crispr介导的突变来建模。
51.在本说明书中,阐述了某些具体细节以便对各种实施方案进行透彻理解。然而,本领域技术人员将理解可以在没有这些细节的情况下实践所提供的实施方案。除非上下文另有要求,否则在整个说明书和所附权利要求书中,词语“包括”及其诸如“包含”和“含有”的变型应解释为开放的、包括性的含义,即“包括但不限于”。除非上下文另外清楚的规定,如本说明书和所附权利要求书中所用,单数形式“一个”、“一种”和“该(所述)”包括复数指代物。除非上下文另外明确的规定,还应当注意术语“或”包括“和/或”。此外,本文提供的标题仅为了方便,而不是对要求保护的实施方案的范围或含义进行解释。
52.当本文用于描述氨基酸序列或核酸序列时,相对于参考序列,术语“同源的”、“同源性”或“同源性百分比”可以使用karlin和altschul(proc.natl.acad.sci.usa 87:2264-2268,1990修改为proc.natl.acad.sci.usa 90:5873-5877,1993)所述的公式来确定。将该公式引入altschul等人(j mol biol.1990年10月5日;215(3):403-10;nucleic acids res.1997年9月1日;25(17):3389-402)的基本局部比对检索工具(blast)程序中。序列的同源性百分比可以使用自本技术的申请日起的blast的最新版本进行测定。序列的同一性百分比可以使用自本技术的申请日起的blast的最新版本进行测定。靶向药理学景观
53.一方面,本文提供了药理学景观,所述药理学景观包括具有已知蛋质质靶标的治疗剂库,称为药物库。药物库可以包括低分子量药物(例如分子量小于具约1kda)和生物药物(例如蛋白质,如抗体)。药物库可以包括适合于患者的特定疾病或病况(如癌症或自身免疫性疾病)的药物。在各种实施方案中,药物库包括fda批准的治疗剂,因此可以随着新药开发而普及。药物库可包括治疗特定疾病类型的所有或几乎所有的靶向药物,例如药物库包括至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或100%的已知fda批准的用于具有已知蛋白质靶标的特定疾病类型的药物。本文还提供了用于临床研究性疗法的集中库(例如,i-iii期临床测试中的疗法),以及感兴趣的特定靶标类别(例如,g蛋白偶联受体、激酶等)的库。
54.抗癌药物库
55.在某些实施方案中,设计包含两种或更多种疗法的药物库,所述疗法显示治疗癌症是有效的和/或已获得fda批准用于治疗癌症。在一些实施方案中,药物库包含至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少30、至少35、至少40、至少45、至少50、至少55、至少60、至少65、至少70、至少75、至少80、至少85、至少90、至少95、至少100、至少110、至少120、至少130、至少140、至少150、至少160、至少170、至少180、至少190、至少200、至少210、至少220、至少230、至少240、至少250、至少260、至少270、至少280、至少290或至少300种治疗剂。在一些实施方案中,药物库包含多达约100、多达约200、多达约300、多达约400、多达约500或多达约1000种治疗剂。一种或多种治疗剂可选自表2。一种或多种治疗剂可选自表3。
56.在某些实施方案中,设计包含两种或更多种对某一类型的癌症特异的癌症治疗剂的药物库。作为非限制性实例,药物库包含两种或更多种癌症治疗剂,所述癌症治疗剂显示对黑素瘤、甲状腺癌、结肠直肠癌、子宫内膜癌、肺癌、胰腺癌、乳腺癌、泌尿生殖癌、胃肠癌、卵巢癌或头颈癌或本文列出或本领域已知的任何癌症有效,和/或已获得fda批准用于治疗上述癌症。在一些实施方案中,癌症特异性药物库包含至少1种、至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种或至少10种治疗剂。在一些实施方案中,癌症特异性药物库包含多达约10、20、30、40、50、60、70、80、90或100种治疗剂。一种或多种治疗剂可选自表2。一种或多种治疗剂可选自表3。
57.在某些实施方案中,药物库包含至少一种选自表2的癌症治疗剂。药物库可以包括选自表2的至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少60、至少70、至少80、至少90、至少100、至少120、至少140、至少160、至少180、至少200、至少250、至少300、至少350、至少400、至少450、至少500、至少600、至少700、至少800或至少900种治疗剂。药物库可包含选自表2的至少一种癌症治疗剂,以及一种或多种fda批准的另外的癌症治疗剂。药物库可包含至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或100%的已知的fda批准的分子靶向抗癌药物。药物库可包含选自表2的至少一种癌症治疗剂,以及一种或多种正在接受fda批准和/或任何当前或已完成临床试验的另外的癌症治疗剂。
58.在某些实施方案中,药物库包含至少一种选自表3的癌症治疗剂。药物库可以包括选自表3的至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少60、至少70、至少80、至少90、至少100、至少120、至少140、至少160、至少180、至少200、至少250、至少300、至少350、至少400、至少450、至少500、至少600、至少700、至少800或至少900种治疗剂。药物库可包含选自表3的至少一种癌症治疗剂,以及一种或多种fda批准的另外的癌症治疗剂。药物库可包含至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或100%的已知的fda批准的分子靶向抗癌药物。药物库可包含选自表3的至少一种癌症治疗剂,以及一种或多种正在接受fda批准和/或是任何当前或已完成临床试验的另外的癌症治疗剂。
59.基因靶标库
60.本文还提供了遗传靶标库,其包含编码药物库中治疗剂所靶向的蛋白质的基因。对于如多激酶抑制剂的作为非特异性抑制剂的治疗剂,靶标可以包括多个基因靶标。靶向
基因的数量必须显著小于“全基因组”,以产生既可进行体外分析又可进行体内分析的紧凑库(compact library)。靶向基因的非限制性实例示于表4中。肿瘤学的靶向基因的非限制性实例示于表5a-6b、6d中。本文所述的靶向基因可以包含表5a中的至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少30个、至少35个、至少40个、至少45个、至少50个、至少55个、至少60个、至少65个、至少70个、至少75个、至少80个、至少85个、至少90个、至少95个、至少100个、至少110个、至少120个、至少130个、至少140个、至少150个、至少160个、至少170个、至少180个、至少190个、至少200个、至少210个、至少220个、至少230个、至少240个、至少250个、至少260个、至少270个、至少280个、至少290个或至少300个基因。本文所述的靶向基因可以包含表5b中的至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少30个、至少35个、至少40个、至少45个、至少50个、至少55个、至少60个、至少65个、至少70个、至少75个、至少80个、至少85个、至少90个、至少95个、至少100个、至少110个、至少120个、至少130个、至少140个、至少150个、至少160个、至少170个、至少180个、至少190个、至少200个、至少210个、至少220个、至少230个、至少240个、至少250个、至少260个、至少270个、至少280个、至少290个或至少300个基因。本文所述的靶向基因可以包含表5c中的至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少30个、至少35个、至少40个、至少45个、至少50个、至少55个、至少60个、至少65个、至少70个、至少75个、至少80个、至少85个、至少90个、至少95个、至少100个、至少110个、至少120个、至少130个、至少140个、至少150个、至少160个、至少170个、至少180个、至少190个、至少200个、至少210个、至少220个、至少230个、至少240个、至少250个、至少260个、至少270个、至少280个、至少290个或至少300个基因。本文所述的靶向基因可以包含来自表5d的至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个基因或全部基因。本文所述的靶向基因可以包含表6a中的至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少30个、至少35个、至少40个、至少45个、至少50个、至少55个、至少60个、至少65个、至少70个、至少75个、至少80个、至少85个、至少90个、至少95个、至少100个、至少110个、至少120个、至少130个、至少140个、至少150个、至少160个、至少170个、至少180个、至少190个、至少200个、至少210个、至少220个、至少230个、至少240个、至少250个、至少260个、至少270个、至少280个、至少290个或至少300个基因。本文所述的靶向基因可以包含表6b中的至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少
20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少30个、至少35个、至少40个、至少45个、至少50个、至少55个、至少60个、至少65个、至少70个、至少75个、至少80个、至少85个、至少90个、至少95个、至少100个、至少110个、至少120个、至少130个、至少140个、至少150个、至少160个、至少170个、至少180个、至少190个、至少200个、至少210个、至少220个、至少230个、至少240个、至少250个、至少260个、至少270个、至少280个、至少290个或至少300个基因。本文所述的靶向基因可以包含表6d的至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个基因或全部基因。在一些实施方案中,库包含一个或多个基因以验证成功的基因编辑。本文所述实验中使用的非限制性实例是b2m基因。
61.非限制性的示例性基因靶标库如实例中进一步描述的那样构建,并且在图4中表征为靶向316个独特基因。库所靶向的基因包括表5c中所列的基因。因此,本文提供了靶向表5c的一个或多个基因,例如表5c的至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50、60、70、80、90、100、120、140、160、180、200、220、240、260、280、300、310个或所有基因的库。
62.如实施方案中进一步描述的,构建了靶向23个独特基因的另一个非限制性示例性基因靶标库。库所靶向的基因包括表5d中所列的基因和b2m。因此,本文提供了靶向表5d的一个或多个基因,例如表5d的至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22个或全部基因的库。在一些情况下,基因靶标库包含用于验证目的的基因,例如b2m。遗传药典
63.一方面,本文提供了一种遗传元件库,其代表用于特定疾病或病况的现有药物的集合。这些遗传元件能够修饰患者细胞以模拟现有药物对患者的作用,从而进行个性化的全面功能分析。可以以合并的筛选形式进行分析,以允许平行筛选修饰作用。这种高度平行的功能基因组学方法被用于生物临床前研究,但并不适用于个性化治疗敏感性分析。另外,该方法使得能够在体内测试范例中全面评估治疗操作的影响,这对于本文先前指出的原因是至关重要的。
64.因此,本文公开了用于设计、构建和使用包含多种基因调节剂的遗传药典的方法,所述基因调节剂能够修饰患者细胞以敲除或敲低编码现有药物集合的蛋白质靶标的基因的功能。在一些实施方案中,遗传药典通过使用公开可获得的工具进行设计,例如公开可获得的用于基因编辑或基因沉默的方法和试剂。在一些实施方案中,这些试剂的子集可能效果很差,大多数将是可接受的,并且少数试剂将表现出优异的性能。预先选择经验证有效的试剂将在递送效率和产生更“紧凑”库方面是有利的,两者都减少了所需的源自患者的细胞的数量并提高了所产生的数据的质量。在一些实施方案中,设计包括选择最有效或有利的调节机制(例如crispr、rnai)。对于基于crispr的方法,设计包括选择最有利的rna-引导的核酸内切酶(例如,cas9相对cas12a相对mad7)。设计也可包括选择最有效的指导序列或种子序列。设计还可包括由单个载体表达为单个或多个转录单元的多个基因调节剂。例如,可构建多重grna以与基于cas12的核酸酶(例如cpf1)一起使用,从而产生高度紧凑的库。设计还可以包括库中的元件,其可确定、选择或富集转导细胞(例如,荧光标记物、抗生素抗性盒
和表面表位表达盒)。
65.遗传药典可以以与在例如原代癌细胞的源自患者的细胞中的使用相容的形式进行构建。在一些实施方案中,选择病毒递送方法以引入基因调节剂(例如,指导序列或种子序列)。病毒的非限制性实例包括慢病毒、腺病毒、腺相关病毒以及本文公开的其它病毒。在一些实施方案中,选择非病毒递送方法。作为非限制性实例,递送方法是转座酶介导的转座。库可以使用基因合成和合并的分子克隆技术的组合进行构建。可以对库进行质量控制分析以确保完全和近似相等地代表所需序列。在病毒递送方法的一些实施方案中,制备合并的高滴度病毒。在其它实施方案中,病毒以阵列形式递送以促进阵列筛选形式。
66.基因调节剂库
67.一方面,本文提供了包含多种基因调节剂的库,每种基因调节剂能够敲低或敲除编码蛋白质靶标库的蛋白质靶标的基因的功能。多种基因调节剂可以能够敲低或敲除编码库中蛋白质靶标的基因的至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或至少约95%的功能。在一些情况下,蛋白质靶标库包含由能够治疗特定疾病或病况的已知药物靶向的所有已知蛋白质。示例性的疾病或病况是癌症,如本文公开的或本领域已知的癌症。
68.在一些实施方案中,基因调节剂库能够敲低或敲除编码选自表5b的蛋白质靶标的一种或多种基因的功能。在一些情况下,蛋白质靶标包括表5b的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,基因调节剂库能够敲低或敲除编码选自表5a的蛋白质靶标的一种或多种基因的功能。在一些情况下,蛋白质靶标包括表5a的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,基因调节剂库能够敲低或敲除编码选自表5c的蛋白质靶标的一种或多种基因的功能。在一些情况下,蛋白质靶标包括表5c的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,基因调节剂库能够敲低或敲除编码选自表5d的蛋白质靶标的一种或多种基因的功能。在一些情况下,蛋白质靶标包括表5d的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些情况下,基因调节剂库能够敲低或敲除编码选自表2-3的一种或多种已知药物的蛋白质靶标的一种或多种基因的功能。在一些情况下,一种或多种已知药物包含表2-3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种药物。在一些情况下,基因调节剂库能够敲低或敲除编码选自表2的一种或多种已知药物的蛋白质靶标的一种或多种基因的功能。在一些情况下,一种或多种已知药物包含表2的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种药物。多种基因调节剂可以能够敲低或敲除约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000或约100至约2,000个基因的功能。库可包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000或约100至约2,000种基因调节剂。
69.至少一种基因调节剂能够敲除基因的功能。例如,至少一种基因调节剂是基于crispr的基因编辑系统的一部分。在一些情况下,多种基因调节剂中的一种或多种各自包含与选自seq id nos:1-2789,2980-3071的序列具有至少约90%同源性或同一性的grna序列。在一些情况下,多种基因调节剂中的一种或多种各自包含与选自seq id nos:1526-2789的序列具有至少约90%同源性或同一性的grna序列。在一些情况下,多种基因调节剂
中的一种或多种各自包含与选自seq id nos:2980-3071的序列具有至少约90%同源性或同一性的grna序列。在一些情况下,至少一种基因调节剂包含与其功能被基因调节剂敲除的基因的至少一部分具有同源性的grna序列。在一些实施方案中,基因调节剂包含一种或多种控制序列。作为非限制性实例,序列是在人类基因组中不具有靶标的grna控制序列。作为另一个非限制性实例,序列是靶向人类基因组的非遗传区域的grna控制序列。例如,库可以包含seq id nos:2790-2971的一个或多个序列(表6c)。包含靶向(例如表6c的ctrl-hg38序列)和非靶向(例如表6c的ctrl-non序列)对照grna能够评估dsdna断裂在无害基因组位置处的影响。在一些实施方案中,基因调节剂包含靶向基因以验证成功的基因编辑的grna。例如,如实施例和图7中所述,可以包括在聚焦库(seq id nos:2960-3071和2890-2905)中所有grna的6.25%处靶向细胞表面标记物b2m的grna。
70.至少一种基因调节剂能够敲低基因的功能。例如,至少一种基因调节剂包含与其功能被基因调节剂敲低的基因的至少一部分具有同源性的shrna序列。同源性可以是至少约90%的序列同源性或同一性。至少一部分可以是至少约15个连续核苷酸。
71.制备并表征了基因调节剂的非限制性示例性库(图4)。构建一个库用于基于crispr的基因编辑,其靶向316个独特基因,其中每个靶标具有4个指导rna。所用的指导rna列于表6b中。库还包括表6c的控制指导rna。构建了另一个基因调节剂库用于基于crispr的基因编辑,其靶向23个独特基因,其中每个靶标具有4个指导rna。后一个库中所用的指导rna列于表6d中。该库还包括具有seq id nos:2890-2905和2960-2979的表6c的指导rna。后一个库具有较小的规模,使得能够用如用原代癌细胞的较少的细胞数量进行筛选。
72.在一些实施方案中,基因调节剂库包含一种或多种靶向表5d中的基因的基因调节剂。在一些实施方案中,库包含一种或多种靶向表5d中的至少1种、至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种、至少10种、至少11种、至少12种、至少13种、至少14种、至少15种、至少16种、至少17种、至少18种、至少19种、至少20种、至少21种、至少22种或所有基因靶标的基因调节剂。在一个实施方案中,库包含表6d的至少1种、至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种、至少10种、至少11种、至少12种、至少13种、至少14种、至少15种、至少16种、至少17种、至少18种、至少19种、至少20种、至少21种、至少22种、至少23种、至少24种、至少25种、至少30种、至少35种、至少40种、至少45种、至少50种、至少55种、至少60种、至少65种、至少70种、至少75种、至少80种、至少85种、至少90种或所有grna。
73.在一些实施方案中,一种或多种基因调节剂被设计用于敲除或敲低如细胞的核心必需基因的阳性对照基因的功能。这种试剂可以用作库功能性的阳性对照。在一些实施方案中,一种或多种基因调节剂被设计用于敲除或敲低非靶向基因和/或靶向和非遗传基因的功能。这种基因调节剂可以用作阴性对照。非限制性对照基因调节剂提供于表6c中。
74.在一些实施方案中,一种或多种基因调节剂位于载体中。载体可以包含接头序列。接头序列可以包含iis型限制性内切酶切割位点,其可以允许goldengate组装克隆。接头序列可包含与目的载体相容的同源臂,从而允许通过基于如gibson组装的突出端(overhang)同源性的方法进行克隆。载体还可以包含病毒的遗传元件。病毒的非限制性实例包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)和人免疫缺陷
病毒(hiv)。载体还可以包含编码标记物、抗生素抗性盒或表面表位表达盒或其组合的序列。标记物可以是荧光标记物。
75.crispr
76.一方面,提供了包含多种基因调节剂的库,其中每种调节剂包含与靶基因同源的指导rna(grna)。靶基因可编码由已知治疗剂(例如,表2-3的治疗剂)靶向的蛋白。靶基因的非限制性实例列于表4-6b、6d中。在一些实施方案中,一种或多种grna包含与靶基因的至少约10、15或20个连续核碱基至少约85%、90%、95%或100%同源的序列。在一些实施方案中,一种或多种grna包含与选自表4-6b、6d的靶基因的至少约10、15或20个连续核碱基至少约85%、90%、95%或100%同源的序列。在一些实施方案中,库包含选自seq id nos:1-2789,2980-3071的一个或多个序列。在一些实施方案中,库包含与选自seq id nos:1-2789,2980-3071的序列具有至少约85%、90%、95%或100%同源性的一个或多个序列。在一些实施方案中,库包含选自seq id nos:1526-2789的一个或多个序列。在一些实施方案中,库包含与选自seq id nos:1526-2789的序列具有至少约85%、90%、95%或100%同源性的一个或多个序列。在一些实施方案中,库包含选自seq id nos:2790-2959一个或多个序列。在一些实施方案中,库包含与选自seq id nos:2790-2959的序列具有至少约85%、90%、95%或100%同源性的一个或多个序列。在一些实施方案中,库包含选自seq id nos:1526-2790的一个或多个序列。在一些实施方案中,库包含与选自seq id nos:1526-2790的序列具有至少约85%、90%、95%或100%同源性的一个或多个序列。在一些实施方案中,库包含选自seq id nos:2980-3071的一个或多个序列。在一些实施方案中,库包含与选自seq id nos:2980-3071的序列具有至少约85%、90%、95%或100%同源性的一个或多个序列。库可以包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000、约200至约2,000或约500至约2,000个不同的grna序列。在一些实施方案中,一种或多种grna序列在载体上编码。
77.在一些实施方案中,库还包含rna指导核酸内切酶,例如cas9、cas12、cas12a(或cpf1或mad7)、cas12b(或c2c1或cpf2)、cas12c(c2c3)、cas12d(或casy)、cas12e(或casx)、cas13、cas13a(或c2c2)、cas13b(或c2c6)、cas13c(或c2c7)、cas13d(或casrx)、cas14、cas14a、cas14b、cas14c、casl、caslb、cas2、cas3、cas4、cas5、cas5e(casd)、cas6、cas6e、cas6f、cas7、cas8a、cas8al、cas8a2、cas8b、cas8c、csnl、csxl2、cas10、cas10d、caslo、caslod、casf、casg、cash、csyl、csy2、csy3、csel(casa)、cse2(casb)、cse3(case)、cse4(casc)、cscl、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmrl、cmr3、cmr4、cmr5、cmr6、csbl、csb2、csb3、csxl7、csxl4、csxlo、csxl6、csax、csx3、csxl、csxl5、csfl、csf2、csf3、csf4、或cul966、或其衍生物、变体、片段或其任意组合。在一些实施方案中,核酸内切酶是cas9或cas12a家族,其可包括但不限于脓链球菌cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌cas9(sacas9)、氨基酸球菌属种(ascpf1)、毛螺旋菌(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌cas9(cjcas9)、脑膜炎双球菌(nmcas9)、嗜热链球菌(stcas9)、齿垢密螺旋体(tdcas9)和mad7。另外,适用于本文公开的库的其他rna指导核酸内切酶包括锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)、大范围核酸酶、rna结合蛋白(rbp)、重组酶、翻转酶、转座酶、argonaute(ago)蛋白(例如原核argonaute(pago)、古菌argonaute
(aago)和真核argonaute(eago))及其任何功能片段,及其任何组合。
78.在一些情况下,grna和/或核酸内切酶在载体上编码。在一些情况下,包含grna和/或核酸内切酶的载体包含病毒基因组的一个或多个特征。作为非限制性实例,病毒载体包括逆转录病毒载体、腺病毒载体、腺相关病毒载体(aav)、痘病毒载体、细小病毒载体、杆状病毒载体、麻疹病毒载体或单纯疱疹病毒载体(hsv)。在一些情况下,逆转录病毒载体包括γ逆转录病毒载体,例如源自莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)或鼠干细胞病毒(mscv)基因组的载体。在一些情况下,逆转录病毒载体包括慢病毒载体,例如源自人免疫缺陷病毒(hiv)基因组的慢病毒载体。在一些情况下,aav载体包括aav1、aav2、aav4、aav5、aav6、aav7、aav8或aav9血清型。在一些情况下,病毒载体是嵌合病毒载体,其包含来自两种或更多种病毒的病毒部分。在另外的情况下,病毒载体是重组病毒载体。
79.在一些实施方案中,载体包含用于选择的标记物,例如抗生素抗性盒或表面表位表达盒。在一些实施方案中,基因调节剂和核酸内切酶由单独的载体编码。作为非限制性实例,核酸内切酶通过腺病毒递送,而grna通过慢病毒递送。在一些实施方案中,核酸内切酶编码序列可以在两个载体之间分裂。例如,当构建如cas9的大核酸内切酶时,可以使用该方法。在一些实施方案中,基因调节剂由病毒载体编码,且核酸内切酶例如使用脂质或电穿孔技术以转染到靶细胞中的核糖核酸蛋白复合物的形式提供。
80.rnai
81.一方面,提供了包含多种基因调节剂的库,其中一种或多种调节剂包含与已知治疗剂(例如选自表2-3的治疗剂)靶向的蛋白质的靶mrna互补的短发夹rna(shrna)。靶蛋白的非限制性实例包括由表4-6b、6d中所列基因编码的靶蛋白。在一些实施方案中,一种或多种shrna各自包含与靶mrna的至少约10、15或20个连续核碱基至少约85%、90%、95%或100%互补的序列。在一些实施方案中,一种或多种shrna各自包含与编码选自表4-6b、6d的蛋白质的靶mrna的至少约10、15或20个连续核碱基至少约85%、90%、95%或100%互补的序列。库可以包含约10至约2,000、约50至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000个不同的shrna序列。基因修饰和细胞增殖
82.在本公开的一些方面,将包含多种基因调节剂的库递送至来自患有疾病或病况的受试者的细胞样品,以产生多种修饰的细胞。在示例性实施方案中,受试者患有癌症,并且细胞样品包含原代癌细胞。对于涉及癌细胞的一些实施方案,以保持癌细胞活力同时使细胞产量最大化的方式处理肿瘤样品。递送方法的非限制性实例包括病毒方法(例如,慢病毒、腺病毒或腺相关病毒)以及非病毒方法(例如,采用如piggybac或睡美人(sleeping beauty)的转座子的转座酶介导的转座,或如phi31的整合酶)。在一些实施方案中,以确保相等和充分的克隆表达同时最小化感染复数的方式进行病毒颗粒向细胞的递送。特别地,每个克隆在群体内表达的次数(“表达”)可能是决定最终分析灵敏地和特异性地检测体外或体内增殖后条形码丰度变化能力的关键因素。
83.遗传修饰的方法
84.用于从受试者产生多个修饰的癌细胞的示例性方法包括:将基因调节剂库递送至所述受试者的癌细胞样品,以产生多个修饰的癌细胞,其中每个修饰的癌细胞含有一种或
多种基因调节剂,并且每种基因调节剂能够敲低或敲除编码蛋白质靶标库的蛋白质靶标的基因的功能。
85.在一些实施方案中,用于产生多个修饰的癌细胞的方法包括基于crispr/核酸内切酶的基因编辑系统。例如,一种或多种基因调节剂包含与其功能在修饰的癌细胞中被敲除的基因的至少一部分具有同源性的grna序列。grna可以与基因的约10至约50个连续核苷酸具有同源性。同源性可以是至少约90%的序列同源性或同一性。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:1-2789,2980-3071的序列具有至少约90%同源性或同一性的grna序列。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:1526-2789的序列具有至少约90%同源性或同一性的grna序列。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:2790-2959的序列具有至少约90%同源性或同一性的grna序列。在一些实施方案中,一种或多种基因调节剂各自包含与选自seq id nos:2980-3071的序列具有至少约90%同源性或同一性的grna序列。grna可位于载体内,例如以用于如本文所述的病毒递送。
86.用于产生修饰的癌细胞的方法可进一步包括使癌细胞与核酸内切酶接触。核酸内切酶可以包括cas9或cas12a核酸内切酶。cas9或cas12a核酸内切酶的非限制性实例包括脓链球菌cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌cas9(sacas9)、氨基酸球菌属种(ascpf1)、毛螺旋菌(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌cas9(cjcas9)、脑膜炎双球菌(nmcas9)、嗜热链球菌(stcas9)、齿垢密螺旋体(tdcas9)和mad7。在一些情况下,核酸内切酶不包含cas9或cas12a核酸内切酶。
87.在一些实施方案中,用于产生多个修饰的癌细胞的方法包括rna干扰(rnai)基因沉默系统。例如,每种基因调节剂包含靶向编码来自蛋白质靶标库的蛋白质靶标的mrna的shrna序列。shrna可以与基因的约10至约50个连续核苷酸具有同源性。同源性可以是至少约90%的序列同源性或同一性。shrna可以位于载体内,例如用于如本文所述的病毒递送。
88.在一些实施方案中,基因调节剂库包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的基因调节剂。在一些情况下,至少约90%的基因调节剂以在平均基因调节剂量的约10%以内的量存在于库中。
89.在一些实施方案中,蛋白质靶标库包含表5b的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5a的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5c的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5d的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。
90.在一些实施方案中,癌细胞样品包括原代癌细胞。癌细胞样品可以包含约105至约108个细胞。癌细胞样品可以经过处理以保持细胞活力。因此,该方法还可以包括在递送基因调节剂库之前和/或之后制备癌细胞样品以保持细胞活力。该方法还可以进一步包括使修饰的癌细胞增殖。增殖可以包括在2d体外培养物中维持修饰的癌细胞。增殖可以包括在3d体外培养物中维持修饰的癌细胞。增殖可以包括体内维持修饰的癌细胞。在一些情况下,
增殖发生在如啮齿动物中的动物模型内。
91.crispr基因编辑
92.在一些实施方案中,使用基于crispr的基因编辑方法修饰细胞样品。基因编辑方法可以包括使细胞样品与多个grna序列接触,其中一个或多个grna与编码由治疗剂靶向的蛋白的靶基因具有序列同源性。靶基因的非限制性实例提供于表4-6b、6d。治疗剂的非限制性实例提供于表2-3中。在一些实施方案中,将细胞样品与选自seq id nos;1-2789,2980-3071的至少一个或多个grna序列接触。在一些实施方案中,将细胞样品与至少一个或多个grna序列接触,该grna序列的每一个与选自seq id nos:1-2789,2980-3071的序列具有至少约85%的同源性。在一些实施方案中,将细胞样品与选自seq id nos:2980-3071的至少一个或多个grna序列接触。在一些实施方案中,将细胞样品与至少一个或多个grna序列接触,该grna序列的每一个与选自seq id nos:2980-3071的序列具有至少约85%的同源性。在一些实施方案中,将细胞样品与选自seq id nos:1526-2789的至少一个或多个grna序列接触。在一些实施方案中,将细胞样品与至少一个或多个grna序列接触,该grna序列的每一个与选自seq id nos:1526-2789的序列具有至少约85%的同源性。在一些实施方案中,将细胞样品与选自seq id nos:1526-2959的至少一个或多个grna序列接触。在一些实施方案中,将细胞样品与至少一个或多个grna序列接触,该grna序列的每一个与选自seq id nos:1526-2959的序列具有至少约85%的同源性。在一些实施方案中,将细胞样品与选自seq id nos:2790-2959的至少一个或多个grna序列接触。在一些实施方案中,将细胞样品与至少一个或多个grna序列接触,该grna序列的每一个与选自seq id nos:2790-2959的序列具有至少约85%的同源性。细胞样品也与rna指导核酸内切酶接触,例如,cas9、cas12、cas12a(或cpf1或mad7)、cas12b(或c2c1或cpf2)、cas12c(c2c3)、cas12d(或casy)、cas12e(或casx)、cas13、cas13a(或c2c2)、cas13b(或c2c6)、cas13c(或c2c7)、cas13d(或casrx)、cas14、cas14a、cas14b、cas14c、casl、caslb、cas2、cas3、cas4、cas5、cas5e(casd)、cas6、cas6e、cas6f、cas7、cas8a、cas8al、cas8a2、cas8b、cas8c、csnl、csxl2、cas10、cas10d、caslo、caslod、casf、casg、cash、csyl、csy2、csy3、csel(casa)、cse2(casb)、cse3(case)、cse4(casc)、cscl、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmrl、cmr3、cmr4、cmr5、cmr6、csbl、csb2、csb3、csxl7、csxl4、csxlo、csxl6、csax、csx3、csxl、csxl5、csfl、csf2、csf3、csf4、cul966、锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)、大范围核酸酶、rna结合蛋白(rbp)、重组酶、翻转酶、转座酶、argonaute(ago)蛋白(例如原核argonaute(pago)、古菌argonaute(aago)和真核argonaute(eago))及其衍生物、其变体、其片段或其组合。
93.rnai
94.在一些实施方案中,使用rnai方法修饰细胞样品。在一些实施方案中,将细胞样品与多个shrna序列接触,每个shrna序列与治疗剂靶向的蛋白的靶mrna互补。靶蛋白的非限制性实例包括由表4-6b、6d中所列基因编码的靶蛋白。治疗剂的非限制性实例提供于表2-3中。
95.修饰的癌细胞的汇编
96.本文还提供修饰的癌细胞的汇编。示例性汇编包括多个修饰的癌细胞,其中每个修饰的癌细胞含有一种或多种基因调节剂,并且每种基因调节剂能够敲低或敲除编码来自
蛋白质靶标库的蛋白质靶标的基因的功能。在一些实施方案中,蛋白质靶标库包含表5b的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5c的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5d的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表5a的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表3的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,蛋白质靶标库包含表4的至少1、至少2、至少3、至少4、至少5、至少10或至少20种蛋白质靶标。在一些实施方案中,修饰的癌细胞是修饰的原代癌细胞。修饰的癌细胞可包含约10至约2,000、约50至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约100至约2,000或约500至约2,000种不同的修饰的癌细胞群。
97.修饰的癌细胞可包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的基因调节剂。一种或多种基因调节剂中的至少一种可以包含选自seq id nos:1-2789,2980-3071的序列。一种或多种基因调节剂中的至少一种可以包含与选自seq id nos:1-2789,2980-3071的序列至少约90%同源或相同的序列。一种或多种基因调节剂中的至少一种可以包含选自seq id nos:2980-3071的序列。一种或多种基因调节剂中的至少一种可以包含与选自seq id nos:2980-3071的序列至少约90%同源或相同的序列。一种或多种基因调节剂中的至少一种可以包含选自seq id nos:1526-2789的序列。一种或多种基因调节剂中的至少一种可以包含与选自seq id nos:1526-2789的序列至少约90%同源或相同的序列。一种或多种基因调节剂中的至少一种可以包含选自seq id nos:1526-2959的序列。一种或多种基因调节剂中的至少一种可以包含与选自seq id nos:1526-2959的序列至少约90%同源或相同的序列。一种或多种基因调节剂中的至少一种可以包含选自seq id nos:2790-2959的序列。一种或多种基因调节剂中的至少一种可以包含与选自seq id nos:2790-2959的序列至少约90%同源或相同的序列。
98.修饰的癌细胞可以已经使用基于crispr的方法通过基因编辑而修饰。由此,修饰的癌细胞所携带的基因调节剂可包含与其功能在修饰的癌细胞中被敲低或敲除的基因的至少一部分具有同源性的grna序列。在一些情况下,grna与基因的约10至约50个连续核苷酸具有同源性。同源性可以是至少约90%的序列同源性或同一性。shrna可以位于载体内,例如用于如本文所述的病毒递送。
99.例如,如果使用如crispr的基因编辑系统修饰细胞,则修饰的癌细胞也可以包含核酸内切酶。核酸内切酶可以包括cas9或cas12a核酸内切酶。cas9或cas12a核酸内切酶的非限制性实例包括化脓链球菌cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌cas9(sacas9)、氨基酸球菌属种(ascpf1)、毛螺旋菌(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌cas9(cjcas9)、脑膜炎双球菌(nmcas9)、嗜热链球菌(stcas9)、齿垢密螺旋体(tdcas9)和mad7。核酸内切酶可以不包括cas9或cas12a核酸内切酶。
100.修饰的癌细胞可以已经使用shrna基因调节剂通过基因沉默修饰。因此,一种或多种基因调节剂可包含shrna序列,该shrna序列与其功能在修饰的癌细胞中被敲低的基因的
至少一部分具有同源性。shrna可以与基因的约10至约50个连续核苷酸具有同源性。同源性可以是至少约90%的序列同源性或同一性。shrna可以位于载体内,例如用于如本文所述的病毒递送。
101.细胞增殖
102.一方面,本文提供了使多个遗传修饰的细胞增殖的方法。例如,使用如本文所述的crispr基因编辑系统或rnai来修饰基因修饰细胞。细胞可以是从原代癌细胞修饰的。在一些实施方案中,多个修饰的细胞以2d形式体外增殖、以3d形式体外增殖或体内增殖。3d体外形式的非限制性实例可以包括在悬浮液中、在细胞器培养物中或在微流体平台中增殖包埋在海绵基质(例如,基于胶原的)、支架、细胞外基质(ecm)条件(例如基底膜提取物或人工基底膜)中的细胞。构成用于细胞增殖的3d体外形式的示例性材料包括胶原、明胶、弹性蛋白、纤连蛋白、层粘连蛋白、玻连蛋白、聚赖氨酸、多聚鸟氨酸、硅酮、多糖聚合物如藻酸盐、琼脂、葡聚糖、角叉菜胶、壳聚糖、果胶、纤维素、结冷胶、黄原胶、支链淀粉、糖胺聚糖和任何片段化或衍生形式、透明质酸、类肝素、肝素、皮肤素、软骨素或任何水凝胶或生物相容性聚合物。对于使用癌细胞的体外方法,将所述癌细胞维持在既支持大细胞存活又允许来自诱导突变的选择压力的条件下。对于体内方法,选择使移植效率和存活率最大化的繁殖技术。在一些实施方案中,体内细胞增殖可包括通过异位移植或原位移植的源自患者的异种移植。另外,对于体内方法,修饰的癌细胞可被原位移植(例如,对于胰腺来源的肿瘤,在胰腺内移植)或异位移植(例如,对于胰腺来源的肿瘤,皮下移植)。筛选方法
103.一方面,提供了评估细胞样品中来自遗传药典的核酸序列的存在、不存在和/或数量的方法。遗传药典的效力在直接通过修饰的细胞(例如转导的癌细胞)的“条形码”计数读出对细胞生长的影响的能力方面变得明显。带有损害细胞活力的grna或shrna的细胞在总体群体中将表现更少(即,将“退出”);这表现为在指导/shrna序列的整个群体中grna/shrna序列本身出现的频率较低。该方法可以采用下一代测序技术(ngs),其是完善的、成本有效的、商业规模的、稳健的、高度定量的和高度服从于多重分析的。
104.测序可以用任何合适的测序技术进行,包括但不限于单分子实时(smrt)测序、聚合酶克隆测序、连接测序、可逆性末端终止测序、质子检测测序、离子半导体测序、纳米孔测序、电子测序、焦磷酸测序、克萨姆-吉尔伯特测序、链终止(例如桑格)测序、 s测序或合成测序。测序方法还包括下一代测序,例如,诸如illumina测序(例如,solexa)、罗氏454测序、离子激流测序和solid测序的现代测序技术。在一些情况下,下一代测序技术涉及高通量测序方法。也可使用本领域技术人员可用的其它测序方法。
105.解释所得到的条形码分布以确定单个干扰物对受试者细胞活力的影响。在一些实施方式中,原始测序读取计数(read count)被解释并且重新映射回到“药物空间”。例如,在上述假设的情况下,如果发现特定的grna在群体中比预期的更不普遍,其意味着由grna的基因靶标编码的蛋白质是患者癌细胞存活或增殖所需的。因此,靶向该蛋白质的药物(在上述步骤1中确定的)被认为是对患者潜在的更高价值的疗法。
106.一种评估来自受试者的遗传修饰的癌细胞的功能效果的示例性方法包括:对多个修饰的癌细胞进行测序,其中每个修饰的癌细胞含有一种或多种基因调节剂,每种基因调节剂能够敲低或敲除编码蛋白质靶标库中的蛋白质靶标的基因的功能;并且其中损害细胞
活力的基因调节剂将比不削损害胞活力的基因调节剂具有更少的序列读取。方法还可以包括确定哪些基因调节剂具有少于阈值数量的序列读取。如果基因调节剂不损害细胞活力,则阈值数量的序列读取可以是预期数量的序列读取。在一些情况下,阈值数量的序列读取是多个修饰的癌细胞中的每种基因调节剂的平均数量的序列读取。在一些实施方案中,方法还包括将具有少于阈值数量的序列读取的各基因调节剂与蛋白质靶标库中的其相应的蛋白质靶标相关联。方法还可以包括将相应的蛋白质靶标与治疗分子相关联。蛋白质靶标库可包含表5b的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。蛋白质靶标库可包含表5c的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。蛋白质靶标库可包含表5d的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。蛋白质靶标库可包含表5a的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标蛋白质靶标库可包含表3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。蛋白质靶标库可包含表4的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。一种或多种基因调节剂中的至少一种可包含与选自seq id nos:1-2789,2980-3071的序列具有至少约90%同源性或同一性的grna序列。一种或多种基因调节剂中的至少一种可包含与选自seq id nos:2980-3071的序列具有至少约90%同源性或同一性的grna序列。一种或多种基因调节剂中的至少一种可包含与选自seq id nos:1526-2789的序列具有至少约90%同源性或同一性的grna序列。治疗方法
107.本文还提供了治疗患有疾病或病况的受试者的方法,其中所述受试者已使用本文所述的方法确定对治疗剂敏感。在一些情况下,疾病或病状为癌症。癌症的非限制性实例包括急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、肾上腺皮质癌、aids相关癌症、卡波西肉瘤、aids相关淋巴瘤、原发性cns淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎/横纹肌样肿瘤、中枢神经系统癌症、皮肤基底细胞癌、胆管上皮癌、膀胱癌、骨癌、脑瘤、乳腺癌、支气管肿瘤、伯基特淋巴瘤、类癌瘤、心脏肿瘤、中枢神经系统癌症、胚胎瘤、生殖细胞肿瘤、原发性cns淋巴瘤、宫颈癌、胆管癌、脊索瘤、慢性淋巴细胞白血病(cll)、慢性髓性白血病(cml)、慢性骨髓增生性肿瘤、结肠直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤、原位导管癌(dcis)、胚胎瘤、中枢神经系统癌症、子宫内膜癌、室管膜瘤、食管癌、鼻腔神经胶质瘤、尤文肉瘤、颅外生殖细胞肿瘤、性腺外生殖细胞瘤、眼癌、眼内黑素瘤、视网膜母细胞瘤、输卵管癌、骨纤维组织细胞瘤、骨肉瘤、胆囊癌、胃癌、胃肠道类癌肿瘤、胃肠道间质瘤(gist)、睾丸癌、妊娠滋养细胞疾病、毛细胞白血病、头颈癌、心脏肿瘤、肝细胞癌、霍奇金淋巴瘤、喉咽癌、眼内黑素瘤、胰岛细胞肿瘤、胰腺神经内分泌肿瘤、肾癌、朗格汉斯细胞组织细胞增多症、喉癌、白血病、唇和口腔癌、肝癌、肺癌(非小细胞和小细胞)、淋巴瘤、男性乳腺癌、骨恶性纤维组织细胞瘤和骨肉瘤、黑素瘤、眼内黑素瘤、merkel细胞癌、间皮瘤、转移癌、转移性鳞状颈癌伴隐匿性原发性、中线道癌伴nut基因改变、口腔癌、多发性内分泌肿瘤综合征、多发性骨髓瘤/浆细胞肿瘤、蕈样真菌病、骨髓增生异常综合征、骨髓增生异常/骨髓增生性肿瘤、骨髓性白血病、慢性(cml)、髓细胞性白血病、急性(aml)、鼻腔和鼻旁窦癌、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌、口咽癌、卵巢癌、胰腺癌、胰腺神经内分泌肿瘤(胰岛细胞肿瘤)、乳头瘤病、副神经节瘤、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽
癌、嗜铬细胞瘤、垂体瘤、浆细胞瘤/多发性骨髓瘤、胸膜肺母细胞瘤、原发性中枢神经系统(cns)淋巴瘤、原发性腹膜癌、前列腺癌、直肠癌、复发性癌症、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤、横纹肌肉瘤、血管瘤、骨肉瘤、软组织肉瘤、子宫肉瘤、sezary综合症、皮肤癌、小肠癌、皮肤鳞状细胞癌、伴有隐匿原发性的鳞状颈癌、胃癌、t-细胞淋巴瘤、睾丸癌、喉癌、鼻咽癌、口咽癌、下咽癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管的移行细胞癌、输尿管和肾盂、尿道癌、子宫癌、子宫内膜癌、子宫肉瘤、阴道癌、血管瘤、外阴癌、wilms瘤和其它儿童肾肿瘤。在一些实施方案中,治疗剂选自表2a。在一些实施方案中,治疗剂选自表2b。在一些实施方案中,治疗剂选自表3。
108.用于治疗受试者的癌症的方法的非限制性实例包括:向所述受体者施用选自治疗分子库的治疗分子,其中所述治疗分子已通过包括以下步骤的方法进行选择:修饰来自所述受试者的癌细胞以敲低或敲除多个基因的功能,所述多个基因中的每个基因编码所述治疗分子库中的治疗分子的蛋白质靶标,其中如果所述治疗分子敲低或敲除编码所选择的治疗分子的蛋白质靶标的基因的功能损害癌细胞活力,则选择所述治疗分子。治疗分子库可以包含表2的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。治疗分子库可以包含表3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。多个基因中的一个或多个可编码表5b的蛋白质。多个基因中的一个或多个可编码表5a的蛋白质。多个基因中的一个或多个可编码表5c的蛋白质。多个基因中的一个或多个可编码表5d的蛋白质。多个基因中的一个或多个可编码表3的蛋白质。多个基因中的一个或多个可编码表4的蛋白质。
109.用于治疗癌症的另一种示例性方法包括:向受试者施用选自治疗分子库的治疗分子;其中所述受试者的癌症已通过包括以下步骤的方法确定对所选择的治疗分子敏感:(a)使来自所述受试者的癌细胞样品与基因调节剂库接触,以产生多个修饰的癌细胞,其中每个修饰的癌细胞含有一种或多种基因调节剂,并且每种基因调节剂能够敲低或敲除编码治疗分子库中的治疗分子的蛋白质靶标的基因的功能,和(b)对多个修饰的癌细胞进行测序,其中损害细胞活力的基因调节剂将具有比不损害细胞活力的基因调节剂更少的序列读取,并且被损害细胞活力的基因调节剂敲低或敲除的基因编码被选择的治疗分子靶向的蛋白质。在一些情况下,在测序之前多个修饰的癌细胞已增殖。增殖可以包括在2d体外培养物中维持修饰的癌细胞。增殖可以包括在3d体外培养物中维持修饰的癌细胞。增殖可以包括体内维持修饰的癌细胞。例如,如果动物是啮齿动物,则繁殖可以在该动物模型内进行。
110.在一些实施方案中,与基因调节剂库接触的癌细胞是原代癌细胞。接触可以包括通过病毒或非病毒递送方法将一种或多种基因调节剂导入各癌细胞。库中的每种基因调节剂可以在病毒载体上编码。在非限制性实施方案中,病毒载体包括慢病毒载体、腺病毒载体或腺相关病毒载体。示例性的非病毒递送方法包括转座酶介导的转座。
111.在一些实施方案中,治疗分子库包含表2的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。在一些实施方案中,治疗分子库包含表3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。在一些实施方案中,基因调节剂库包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的基因调节剂。在一些实施方案中,基因调节剂库中的一种或多种基因调节剂包含与编码表5b的蛋白质的基
因的至少约15个连续核苷酸同源的核酸序列。在一些实施方案中,基因调节剂库中的一种或多种基因调节剂包含与编码表5c的蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。在一些实施方案中,基因调节剂库中的一种或多种基因调节剂包含与编码表5a的蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。在一些实施方案中,基因调节剂库中的一种或多种基因调节剂包含与编码表5d的蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。在一些实施方案中,基因调节剂库中的一种或多种基因调节剂包含与编码表3的蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。在一些实施方案中,基因调节剂库中的一种或多种基因调节剂包含与编码表4的蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。同源性可以是至少约90%的序列同源性或同一性。
112.在一些情况下,一种或多种基因调节剂各自包含与选自seq id nos:1-1525的序列具有至少约90%同源性或同一性的grna序列。在一些情况下,一种或多种基因调节剂各自包含与选自seq id nos:1-2789,2980-3071的序列具有至少约90%同源性或同一性的grna序列。在一些情况下,一种或多种基因调节剂各自包含与选自seq id no:2980-3071的序列具有至少约90%同源性或同一性的grna序列。在一些情况下,一种或多种基因调节剂各自包含与选自seq id nos:1526-2789的序列具有至少约90%同源性或同一性的grna序列。在一些情况下,一种或多种基因调节剂各自包含与选自seq id nos:2790-2959的序列具有至少约90%同源性或同一性的grna序列。在一些实施方案中,各基因调节剂包含与编码治疗分子库中的治疗分子的蛋白质靶标的基因的至少一部分具有同源性的grna序列。grna可以与基因的约10至约50个连续核苷酸具有同源性。同源性可以是至少约90%的序列同源性或同一性。grna可位于载体内,例如以用于如本文所述的病毒递送。
113.测定对所选择的治疗分子的易感性的方法还可包括使细胞与核酸内切酶接触。在一些实施方案中,核酸内切酶包括cas9或cas12a核酸内切酶。cas9或cas12a核酸内切酶的非限制性实例包括脓链球菌cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌cas9(sacas9)、氨基酸球菌属种(ascpf1)、毛螺旋菌(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌cas9(cjcas9)、脑膜炎双球菌(nmcas9)、嗜热链球菌(stcas9)、齿垢密螺旋体(tdcas9)和mad7。在一些实施方案中,核酸内切酶不包含cas9或cas12a核酸内切酶。
114.在一些实施方案中,基因调节剂包含shrna序列,该shrna序列与编码治疗分子库中的治疗分子的蛋白质靶标的基因的至少一部分具有同源性。shrna可以包含与基因的约10至约50个连续核苷酸具有同源性。同源性可以是至少约90%的序列同源性或同一性。shrna可以位于载体内,例如用于如本文所述的病毒递送。
115.其他实施方案
116.(1)一种治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用选自治疗分子库的治疗分子;其中所述治疗分子通过包括以下步骤的方法进行选择:修饰来自所述受试者的癌细胞以敲低或敲除多个基因的功能,所述多个基因中的每个基因编码所述治疗分子库中的治疗分子的蛋白质靶标,其中如果所述治疗分子敲低或敲除编码所选择的治疗分子的蛋白质靶标的基因的功能损害癌细胞活力,则选择所述治疗分子。
117.(2)根据所述实施方案1所述的方法,其中所述治疗分子库包含表2-3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。
118.(3)根据实施方案1或实施方案2所述的方法,其中所述多个基因中的一个或多个编码表3-5d的蛋白质。
119.(4)一种治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用选自治疗分子库的治疗分子;其中所述受试者的癌症已通过包括以下步骤的方法确定对所选择的治疗分子敏感:(a)使来自所述受试者的癌细胞样品与基因调节剂库接触以产生多个修饰的癌细胞,其中每个修饰的癌细胞含有一种或多种所述基因调节剂,并且每种基因调节剂能够敲低或敲除编码所述治疗分子库中的治疗分子的蛋白质靶标的基因的功能,和(b)对所述多个修饰的癌细胞进行测序,其中损害细胞活力的基因调节剂将具有比不损害细胞活力的基因调节剂更少的序列读取,并且被损害细胞活力的所述基因调节剂敲低或敲除的所述基因编码被所选择的治疗分子靶向的所述蛋白质。
120.(5)根据实施方案4所述的方法,其中在测序之前,所述多个修饰的癌细胞中的一个或多个已增殖。
121.(6)根据实施方案5所述的方法,其中增殖包括在2d体外培养物中维持修饰的癌细胞。
122.(7)根据实施方案5所述的方法,其中增殖包括在3d体外培养物中维持修饰的癌细胞。
123.(8)根据实施方案5所述的方法,其中增殖包括体内维持修饰的癌细胞。
124.(9)根据实施方案8所述的方法,其中增值在动物模型内进行。
125.(10)根据实施方案9所述的方法,其中所述动物是啮齿动物。
126.(11)根据实施方案4-10中任一项所述的方法,其中所述癌细胞是原代癌细胞。
127.(12)根据实施方案4-11中任一项所述的方法,其中接触包括通过病毒或非病毒递送方法将所述一种或多种基因调节剂引入每个癌细胞中。
128.(13)根据实施方案12所述的方法,其中所述库中的一种或多种基因调节剂在病毒载体上编码。
129.(14)根据实施方案13所述的方法,其中所述病毒载体包括慢病毒载体、腺病毒载体或腺相关病毒载体。
130.(15)根据实施方案12所述的方法,其中所述非病毒递送方法包括转座酶介导的转座。
131.(16)根据实施方案4-15中任一项所述的方法,其中所述库包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的基因调节剂。
132.(17)根据实施方案4-16中任一项所述的方法,其中所述基因调节剂库中的一种或多种基因调节剂包含与编码表3-5d的蛋白质的基因的至少约15个连续核苷酸同源的核酸序列。
133.(18)根据实施方案17所述的方法,其中所述同源性为至少约90%序列同源性。
134.(19)根据实施方案18所述的方法,其中所述同源性为至少约90%序列同一性。
135.(20)根据实施方案4-19中任一项所述的方法,其中所述治疗分子库包含表2-3的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种治疗剂。
136.(21)根据实施方案4-20中任一项所述的方法,其中所述癌症包括选自包含以下组的至少一种癌症:急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、肾上腺皮质癌、aids相关癌症、卡波西肉瘤、aids相关淋巴瘤、原发性cns淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎/横纹肌样肿瘤、中枢神经系统癌症、皮肤基底细胞癌、胆管癌、膀胱癌、骨癌、脑瘤、乳腺癌、支气管肿瘤、伯基特淋巴瘤、类癌瘤、心脏肿瘤、中枢神经系统癌症、胚胎瘤、生殖细胞肿瘤、原发性cns淋巴瘤、宫颈癌、胆管上皮癌、脊索瘤、慢性淋巴细胞白血病(cll)、慢性髓性白血病(cml)、慢性骨髓增生性肿瘤、结肠直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤、原位导管癌(dcis)、胚胎瘤、中枢神经系统癌症、子宫内膜癌、室管膜瘤、食管癌、鼻腔神经胶质瘤、尤文肉瘤、颅外生殖细胞肿瘤、性腺外生殖细胞瘤、眼癌、眼内黑素瘤、视网膜母细胞瘤、输卵管癌、骨纤维组织细胞瘤、骨肉瘤、胆囊癌、胃癌、胃肠道类癌肿瘤、胃肠道间质瘤(gist)、睾丸癌、妊娠滋养细胞疾病、毛细胞白血病、头颈癌、心脏肿瘤、肝细胞癌、霍奇金淋巴瘤、喉咽癌、眼内黑素瘤、胰岛细胞肿瘤、胰腺神经内分泌肿瘤、肾癌、朗格汉斯细胞组织细胞增多症、喉癌、白血病、唇和口腔癌、肝癌、肺癌(非小细胞和小细胞)、淋巴瘤、男性乳腺癌、骨恶性纤维组织细胞瘤和骨肉瘤、黑素瘤、眼内黑素瘤、merkel细胞癌、间皮瘤、转移癌、转移性鳞状颈癌伴隐匿性原发性、中线道癌伴nut基因改变、口腔癌、多发性内分泌肿瘤综合征、多发性骨髓瘤/浆细胞肿瘤、蕈样真菌病、骨髓增生异常综合征、骨髓增生异常/骨髓增生性肿瘤、骨髓性白血病、慢性(cml)、髓细胞性白血病、急性(aml)、鼻腔和鼻旁窦癌、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌、口咽癌、卵巢癌、胰腺癌、胰腺神经内分泌肿瘤(胰岛细胞肿瘤)、乳头瘤病、副神经节瘤、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、浆细胞瘤/多发性骨髓瘤、胸膜肺母细胞瘤、原发性中枢神经系统(cns)淋巴瘤、原发性腹膜癌、前列腺癌、直肠癌、复发性癌症、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤、横纹肌肉瘤、血管瘤、骨肉瘤、软组织肉瘤、子宫肉瘤、sezary综合症、皮肤癌、小肠癌、皮肤鳞状细胞癌、伴有隐匿原发性的鳞状颈癌、胃癌、t-细胞淋巴瘤、睾丸癌、喉癌、鼻咽癌、口咽癌、下咽癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管的移行细胞癌、输尿管和肾盂、尿道癌、子宫癌、子宫内膜癌、子宫肉瘤、阴道癌、血管瘤、外阴癌、wilms瘤和其它儿童肾肿瘤。
137.(22)根据实施方案4-21中任一项所述的方法,其中所述基因调节剂中的一种或多种各自包含与选自seq id nos:1-1525、seq id nos:1-2789、seq id nos:1526-2789和/或seq id nos:2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。
138.(23)根据实施方案22所述的方法,其中所述至少约90%同源性为至少约90%同一性。
139.(24)根据实施方案4-23中任一项所述的方法,其中所述基因调节剂中的一种或多种包含与编码治疗分子库中的治疗分子的蛋白质靶标的基因的至少一部分具有同源性的指导rna(grna)序列。
140.(25)根据实施方案24所述的方法,其中所述grna与所述基因的约10至约50个连续核苷酸具有同源性。
141.(26)根据实施方案24或实施方案25所述的方法,其中所述同源性为至少约90%序列同源性。
142.(27)根据实施方案26所述的方法,其中所述同源性为至少约90%序列同一性。
143.(28)根据实施方案4-27中任一项所述的方法,其中所述癌细胞样品与核酸内切酶接触。
144.(29)根据实施方案28所述的方法,其中所述核酸内切酶包含cas9或cas12a核酸内切酶。
145.(30)根据实施方案29所述的方法,其中所述cas9或cas12a核酸内切酶选自化脓链球菌cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌cas9(sacas9)、氨基酸球菌属种(ascpf1)、毛螺旋菌(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌cas9(cjcas9)、脑膜炎双球菌(nmcas9)、嗜热链球菌(stcas9)、齿垢密螺旋体(tdcas9)和mad7。
146.(31)根据实施方案28所述的方法,其中所述核酸内切酶不包含cas9或cas12a核酸内切酶。
147.(32)根据实施方案24-31中任一项所述的方法,其中所述grna位于载体内。
148.(33)根据实施方案32所述的方法,其中所述载体还包含病毒的遗传元件。
149.(34)根据实施方案33所述的方法,其中所述病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。
150.(35)根据实施方案32-34中任一项所述的方法,其中所述载体还包含辅助核酸序列。
151.(36)根据实施方案35所述的方法,其中所述辅助核酸序列包含编码标记物、抗生素抗性盒和表面表位表达盒的序列。
152.(37)根据实施方案36所述的方法,其中所述标记物是荧光标记物。
153.(38)根据实施方案35-37中任一项所述的方法,其中所述辅助核酸允许选择经修饰而含有所述一种或多种基因调节剂的癌细胞。
154.(39)根据实施方案4-23中任一项所述的方法,其中所述基因调节剂中的一种或多种包含与编码所述治疗分子库中的治疗分子的蛋白质靶标的基因的至少一部分具有同源性的短发夹rna(shrna)序列。
155.(40)根据实施方案39所述的方法,其中所述shrna与所述基因的约10至约50个连续核苷酸具有同源性。
156.(41)根据实施方案39或实施方案40所述的方法,其中所述同源性为至少约90%序列同源性。
157.(42)根据实施方案41所述的方法,其中所述同源性为至少约90%序列同一性。
158.(43)根据实施方案39-42中任一项所述的方法,其中所述shrna位于载体内。
159.(44)根据实施方案43所述的方法,其中所述载体还包含病毒的遗传元件。
160.(45)根据实施方案44所述的方法,其中所述病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。
161.(46)根据实施方案43-45中任一项所述的方法,其中所述载体还包含辅助核酸序列。
162.(47)根据实施方案46所述的方法,其中所述辅助核酸序列包含编码标记物、抗生
素抗性盒或表面表位表达盒的序列。
163.(48)根据实施方案47所述的方法,其中所述标记物是荧光标记物。
164.(49)根据实施方案46-48中任一项所述的方法,其中所述辅助核酸允许选择经修饰而含有所述一种或多种基因调节剂的癌细胞。
165.(50)一种从患有癌症的受试者产生多个修饰的癌细胞的方法,所述方法包括将基因调节剂库递送至来自所述受试者的癌细胞样品以产生所述多个修饰的癌细胞;其中每个修饰的癌细胞含有一种或多种所述基因调节剂,并且每种基因调节剂能够敲低或敲除编码蛋白质靶标库的蛋白质靶标的基因的功能。
166.(51)根据实施方案50所述的方法,其中一种或多种所述基因调节剂包含指导rna(grna)序列,所述指导rna(grna)序列与其功能在所述修饰的癌细胞中被敲低或敲除的基因的至少一部分具有同源性。
167.(52)根据实施方案51所述的方法,其中所述grna与所述基因的约10至约50个连续核苷酸具有同源性。
168.(53)根据实施方案51或实施方案52所述的方法,其中所述同源性为至少约90%序列同源性。
169.(54)根据实施方案53所述的方法,其中所述同源性为至少约90%序列同一性。
170.(55)根据实施方案50所述的方法,其中所述基因调节剂中的一种或多种各自包含与选自seq id nos:1-1525、seq id nos:1-2789、seq id nos:1526-2789和/或seq id nos:2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。
171.(56)根据实施方案55所述的方法,其中所述同源性为至少约90%同一性。
172.(57)根据实施方案50-56中任一项所述的方法,其中所述癌细胞样品与核酸内切酶接触。
173.(58)根据实施方案57所述的方法,其中所述核酸内切酶包含cas9或cas12a核酸内切酶。
174.(59)根据实施方案58所述的方法,其中所述cas9或cas12a核酸内切酶选自化脓链球菌cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌cas9(sacas9)、氨基酸球菌属种(ascpf1)、毛螺旋菌(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌cas9(cjcas9)、脑膜炎双球菌(nmcas9)、嗜热链球菌(stcas9)、齿垢密螺旋体(tdcas9)和mad7。
175.(60)根据实施方案57所述的方法,其中所述核酸内切酶不包含cas9或cas12a核酸内切酶。
176.(61)根据实施方案51-56中任一项所述的方法,其中所述grna位于载体内。
177.(62)根据实施方案61所述的方法,其中所述载体还包含病毒的遗传元件。
178.(63)根据实施方案62所述的方法,其中所述病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。
179.(64)根据实施方案61-63中任一项所述的方法,其中所述载体还包含辅助核酸序列。
180.(65)根据实施方案64所述的方法,其中所述辅助核酸序列包含编码标记物、抗生
素抗性盒或表面表位表达盒的序列。
181.(66)根据实施方案65所述的方法,其中所述标记物是荧光标记物。
182.(67)根据实施方案64-66中任一项所述的方法,其中所述辅助核酸允许选择经修饰而含有所述一种或多种基因调节剂的癌细胞。
183.(68)根据实施方案50所述的方法,其中一种或多种所述基因调节剂包含与其功能在所述修饰的癌细胞中被敲低或敲除的基因的至少一部分具有同源性的短发夹rna(shrna)序列。
184.(69)根据实施方案68所述的方法,其中所述shrna与所述基因的约10至约50个连续核苷酸具有同源性。
185.(70)根据实施方案68或实施方案69所述的方法,其中所述同源性为至少约90%序列同源性。
186.(71)根据实施方案70所述的方法,其中所述同源性为至少约90%序列同一性。
187.(72)根据实施方案68-71中任一项所述的方法,其中所述shrna位于载体内。
188.(73)根据实施方案72所述的方法,其中所述载体还包含病毒的遗传元件。
189.(74)根据实施方案73所述的方法,其中所述病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。
190.(75)根据实施方案72-74中任一项所述的方法,其中所述载体还包含辅助核酸序列。
191.(76)根据实施方案75所述的方法,其中所述辅助核酸序列包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。
192.(77)根据实施方案76所述的方法,其中所述标记物是荧光标记物。
193.(78)根据实施方案75-77中任一项所述的方法,其中所述辅助核酸允许选择经修饰而含有所述一种或多种基因调节剂的癌细胞。
194.(79)根据实施方案50所述的方法,其中递送包括转座酶介导的转座。
195.(80)根据实施方案50-79中任一项所述的方法,其中所述癌细胞样品包括原代癌细胞。
196.(81)根据实施方案50-80中任一项所述的方法,其中所述癌细胞样品包含约105至约108个细胞。
197.(82)根据实施方案50-81中任一项所述的方法,其中所述库包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的基因调节剂。
198.(83)根据实施方案50-82中任一项所述的方法,其中至少约90%的所述基因调剂以在平均基因调节剂量的约10%以内的量存在于所述库中。
199.(84)根据实施方案50-83中任一项所述的方法,其中所述蛋白质靶标库包含表3-5d的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。
200.(85)根据实施方案50-84中任一项所述的方法,其中所述癌细胞样品已经被处理以保持细胞活力。
201.(86)根据实施方案50-85中任一项所述的方法,其还包括在递送所述基因调节剂
库之前和/或之后制备所述癌细胞样品以保持细胞活力。
202.(87)根据实施方案50-86中任一项所述的方法,其还包括使所述修饰的癌细胞增殖。
203.(88)根据实施方案87所述的方法,其中增殖包括在2d体外培养物中维持修饰的癌细胞。
204.(89)根据实施方案87所述的方法,其中增殖包括在3d体外培养物中维持修饰的癌细胞。
205.(90)根据实施方案87所述的方法,其中增殖包括体内维持修饰的癌细胞。
206.(91)根据实施方案90所述的方法,其中增殖在动物模型内进行。
207.(92)根据实施方案91所述的方法,其中所述动物模型是啮齿动物。
208.(93)一种包含多个修饰的癌细胞的汇编,其中每个修饰的癌细胞含有一种或多种基因调节剂,并且每种基因调节剂能够敲低或敲除编码蛋白质靶标库的蛋白质靶标的基因的功能。
209.(94)根据实施方案93所述的汇编,其中所述一种或多种基因调节剂中的至少一种包含选自seq id nos:1-1525、seq id nos:1-2789、seq id nos:1526-2789和/或seq id nos:2980-3071的序列。
210.(95)根据实施方案93所述的汇编,其中所述一种或多种基因调节剂中的至少一种包含与选自seq id nos:1-1525、seq id nos:1-2789、seq id nos:1526-2789和/或seq id nos:2980-3071的序列至少约90%同源的序列。
211.(96)根据实施方案95所述的汇编,其中所述同源性为90%同一性。
212.(97)根据实施方案93-96中任一项所述的汇编,其中所述蛋白质靶标库包含表3-5d的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。
213.(98)根据实施方案93-97中任一项所述的汇编,其中所述基因调节剂中的一种或多种包含与其功能在所述修饰的癌细胞中被敲低或敲除的基因的至少一部分具有同源性的指导rna(grna)序列。
214.(99)根据实施方案98所述的汇编,其中所述grna与所述基因的约10至约50个连续核苷酸具有同源性。
215.(100)根据实施方案98或实施方案99所述的汇编,其中所述同源性为至少约90%序列同源性。
216.(101)根据实施方案100所述的汇编,其中同源性为至少约90%序列同一性。
217.(102)根据实施方案93-101中任一项所述的汇编,进一步包含核酸内切酶。
218.(103)根据实施方案102所述的汇编,其中所述核酸内切酶包含cas9或cas12a核酸内切酶。
219.(104)根据实施方案103所述的汇编,其中所述cas9或cas12a核酸内切酶选自化脓链球菌cas9(spcas9)、spcas9 d1135e变体、spcas9 vrer变体、spcas9 eqr变体、xcas9、spcas9-ng、金黄色葡萄球菌cas9(sacas9)、氨基酸球菌属种(ascpf1)、毛螺旋菌(lbcpf1)、ascpf1 rr变体、lbcpf1 rr变体、ascpf1 rvr变体、空肠弯曲菌cas9(cjcas9)、脑膜炎双球菌(nmcas9)、嗜热链球菌(stcas9)、齿垢密螺旋体(tdcas9)和mad7。
220.(105)根据实施方案102所述的汇编,其中所述核酸内切酶不包含cas9或cas12a核
酸内切酶。
221.(106)根据实施方案98-105中任一项所述的汇编,其中所述grna位于载体内。
222.(107)根据实施方案106所述的汇编,其中所述载体还包含病毒的遗传元件。
223.(108)根据实施方案107所述的汇编,其中所述病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。
224.(109)根据实施方案106-108中任一项所述的汇编,其中所述载体还包含辅助核酸序列。
225.(110)根据实施方案109所述的汇编,其中所述辅助核酸序列包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。
226.(111)根据实施方案110所述的汇编,其中所述标记物是荧光标记物。
227.(112)根据实施方案109-111中任一项所述的汇编,其中所述辅助核酸允许选择所述修饰的癌细胞。
228.(113)根据实施方案93所述的汇编,其中所述基因调节剂中的一种或多种包含与其功能在所述修饰的癌细胞中被敲低或敲除的基因的至少一部分具有同源性的短发夹rna(shrna)序列。
229.(114)根据实施方案113所述的汇编,其中所述shrna与所述基因的约10至约50个连续核苷酸具有同源性。
230.(115)根据实施方案113或实施方案114所述的汇编,其中所述同源性为至少约90%序列同源性。
231.(116)根据实施方案115所述的汇编,其中所述同源性为至少约90%序列同一性。
232.(117)根据实施方案113-116中任一项所述的汇编,其中所述shrna位于载体内。
233.(118)根据实施方案117所述的汇编,其中所述载体还包含病毒的遗传元件。
234.(119)根据实施方案118所述的汇编,其中所述病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。
235.(120)根据实施方案117-119中任一项所述的汇编,其中所述载体还包含辅助核酸序列。
236.(121)根据实施方案120所述的汇编,其中所述辅助核酸序列包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。
237.(122)根据实施方案121所述的汇编,其中所述标记物是荧光标记物。
238.(123)根据实施方案120-122中任一项所述的汇编,其中所述辅助核酸允许选择所述修饰的癌细胞。
239.(124)根据实施方案93-105中任一项所述的汇编,其中递送包括转座酶介导的转座。
240.(125)根据实施方案93-124中任一项所述的汇编,其中所述修饰的癌细胞是修饰的原代癌细胞。
241.(126)根据实施方案93-125中任一项所述的汇编,其包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约
2,000或约500至约2,000种不同的基因调节剂。
242.(127)根据实施方案93-126中任一项所述的汇编,其包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000、约100至约2,000或约500至约2,000种不同的修饰的癌细胞群。
243.(128)一种评估遗传修饰来自受试者的的癌细胞的功能效果的方法,所述方法包括:对多个修饰的癌细胞进行测序,其中每个修饰的癌细胞含有一种或多种基因调节剂,每种基因调节剂能够敲低或敲除编码蛋白质靶标库中的蛋白质靶标的基因的功能;并且其中损害细胞活力的基因调节剂将比不损害细胞活力的基因调节剂具有更少的序列读取。
244.(129)根据实施方案128所述的方法,其还包括确定哪些基因调节剂具有少于阈值数量的序列读取。
245.(130)根据实施方案129所述的方法,其中如果所述基因调节剂不损害细胞活力,则所述阈值数量的序列读取是预期数量的序列读取。
246.(131)根据实施方案129所述的方法,其中所述阈值数量的序列读取是所述多个修饰的癌细胞中的每种基因调节剂的平均数量的序列读取。
247.(132)根据实施方案128-131中任一项所述的方法,其还包括将具有少于阈值数量的序列读取的各基因调节剂与所述蛋白质靶标库中的其相应的蛋白质靶标相关联。
248.(133)根据实施方案132所述的方法,其还包括将相应的蛋白质靶标与治疗分子相关联。
249.(134)根据实施方案128-133中任一项所述的方法,其中所述蛋白质靶标库包含表3-5d的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。
250.(135)根据实施方案128-134中任一项所述的方法,其中所述基因调节剂中的一种或多种各自包含与选自seq id nos:1-1525、seq id nos:1-2789、seq id nos:1526-2789和/或seq id nos:2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。
251.(136)根据实施方案135所述的方法,其中所述至少约90%同源性为至少约90%同一性。
252.(137)一种库,所述库包含多种基因调剂,每种基因调剂能够敲低或敲除编码蛋白质靶标库中的蛋白质靶标的基因的功能。
253.(138)根据实施方案137所述的库,其中所述多种基因调节剂能够敲低或敲除编码所述库中的蛋白质靶标的基因的至少约50%的功能。
254.(139)根据实施方案138所述的库,其中所述至少约50%为至少约60%。
255.(140)根据实施方案139所述的库,其中所述至少约60%为至少约70%。
256.(141)根据实施方案140所述的库,其中所述至少约70%是至少约80%。
257.(142)根据实施方案141所述的库,其中所述至少约80%是至少约90%。
258.(143)根据实施方案137-142中任一项所述的库,其中所述蛋白质靶标库包含由能够治疗特定疾病或病况的已知药物靶向的所有已知蛋白质。
259.(144)根据实施方案143所述的库,其中所述疾病或病况是癌症。
260.(145)根据实施方案144所述的库,其中所述癌症包括来自包含以下组的至少一种癌症:急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、肾上腺皮质癌、aids相关癌症、卡波西肉瘤、aids相关淋巴瘤、原发性cns淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、非典型畸
胎/横纹肌样肿瘤、中枢神经系统癌症、皮肤基底细胞癌、胆管癌、膀胱癌、骨癌、脑瘤、乳腺癌、支气管肿瘤、伯基特淋巴瘤、类癌瘤、心脏肿瘤、中枢神经系统癌症、胚胎瘤、生殖细胞肿瘤、原发性cns淋巴瘤、宫颈癌、胆管上皮癌、脊索瘤、慢性淋巴细胞白血病(cll)、慢性髓性白血病(cml)、慢性骨髓增生性肿瘤、结肠直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤、原位导管癌(dcis)、胚胎瘤、中枢神经系统癌症、子宫内膜癌、室管膜瘤、食管癌、鼻腔神经胶质瘤、尤文肉瘤、颅外生殖细胞肿瘤、性腺外生殖细胞瘤、眼癌、眼内黑素瘤、视网膜母细胞瘤、输卵管癌、骨纤维组织细胞瘤、骨肉瘤、胆囊癌、胃癌、胃肠道类癌肿瘤、胃肠道间质瘤(gist)、睾丸癌、妊娠滋养细胞疾病、毛细胞白血病、头颈癌、心脏肿瘤、肝细胞癌、霍奇金淋巴瘤、喉咽癌、眼内黑素瘤、胰岛细胞肿瘤、胰腺神经内分泌肿瘤、肾癌、朗格汉斯细胞组织细胞增多症、喉癌、白血病、唇和口腔癌、肝癌、肺癌(非小细胞和小细胞)、淋巴瘤、男性乳腺癌、骨恶性纤维组织细胞瘤和骨肉瘤、黑素瘤、眼内黑素瘤、merkel细胞癌、间皮瘤、转移癌、转移性鳞状颈癌伴隐匿性原发性、中线道癌伴nut基因改变、口腔癌、多发性内分泌肿瘤综合征、多发性骨髓瘤/浆细胞肿瘤、蕈样真菌病、骨髓增生异常综合征、骨髓增生异常/骨髓增生性肿瘤、骨髓性白血病、慢性(cml)、髓细胞性白血病、急性(aml)、鼻腔和鼻旁窦癌、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌、口咽癌、卵巢癌、胰腺癌、胰腺神经内分泌肿瘤(胰岛细胞肿瘤)、乳头瘤病、副神经节瘤、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、浆细胞瘤/多发性骨髓瘤、胸膜肺母细胞瘤、原发性中枢神经系统(cns)淋巴瘤、原发性腹膜癌、前列腺癌、直肠癌、复发性癌症、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤、横纹肌肉瘤、血管瘤、骨肉瘤、软组织肉瘤、子宫肉瘤、sezary综合症、皮肤癌、小肠癌、皮肤鳞状细胞癌、伴有隐匿原发性的鳞状颈癌、胃癌、t-细胞淋巴瘤、睾丸癌、喉癌、鼻咽癌、口咽癌、下咽癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管的移行细胞癌、输尿管和肾盂、尿道癌、子宫癌、子宫内膜癌、子宫肉瘤、阴道癌、血管瘤、外阴癌、wilms瘤和其它儿童肾肿瘤。
261.(146)根据实施方案143-145中任一项所述的库,其中所述已知药物包括表2-3中的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种药物。
262.(147)根据实施方案137-146中任一项所述的库,其中所述蛋白质靶标库包含表3-5d的至少1种、至少2种、至少3种、至少4种、至少5种、至少10种或至少20种蛋白质靶标。
263.(148)根据实施方案137-147中任一项所述的库,其中所述多种基因调节剂中的一种或多种各自包含与选自seq id nos:1-1525、seq id nos:1-2789、seq id nos:1526-2789或seq id nos:2980-3071的序列具有至少约90%同源性的指导rna(grna)序列。
264.(149)根据实施方案148所述的库,其中所述至少约90%同源性为至少约90%同一性。
265.(150)根据实施方案137-149中任一项所述的库,其中所述多种基因调节剂能够敲低或敲除约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000或约100至约2,000个基因的功能。
266.(151)根据实施方案137-150中任一项所述的库,其中所述库包含约10至约2,000、约10至约500、约10至约200、约10至约150、约50至约500、约50至约200、约50至约2,000或约100至约2,000种基因调节剂。
267.(152)根据实施方案137-151中任一项所述的库,其中至少一种所述基因调节剂能
够敲除基因的功能。
268.(153)根据实施方案152所述的库,其中至少一种所述基因调节剂包含与其功能被所述基因调节剂敲除的基因的至少一部分具有同源性的grna序列。
269.(154)根据实施方案137-147中任一项所述的库,其中至少一种所述基因调节剂能够敲低基因的功能。
270.(155)根据实施方案154所述的库,其中至少一种所述基因调节剂包含与其功能被所述基因调节剂敲减的基因的至少一部分具有同源性的shrna序列。
271.(156)根据实施方案153或实施方案155所述的库,其中所述同源性为至少约90%序列同源性。
272.(157)根据实施方案156所述的库,其中所述同源性为至少约90%序列同一性。
273.(158)根据实施方案155或实施方案156所述的库,其中所述至少一部分为至少约15个连续核苷酸。
274.(159)根据实施方案137-158中任一项所述的库,其中至少一种所述基因调节剂位于载体内。
275.(160)根据实施方案159所述的库,其中所述载体包含接头序列。
276.(161)根据实施方案160所述的库,其中所述接头序列包含iis型限制性内切酶切割位点。
277.(162)根据实施方案159-161中任一项所述的库,其中所述载体还包含病毒的遗传元件。
278.(163)根据实施方案162所述的库,其中所述病毒包括腺病毒、逆转录病毒、腺相关病毒(aav)、痘病毒、细小病毒、杆状病毒、麻疹病毒、单纯疱疹病毒(hsv)、莫洛尼鼠白血病病毒(momlv、mmlv、mulv或mlv)、鼠干细胞病毒(mscv)或人免疫缺陷病毒(hiv)或其组合。
279.(164)根据实施方案159-163中任一项所述的库,其中所述载体还包含编码标记物、抗生素抗性盒或表面表位表达盒的序列。
280.(165)根据实施方案164所述的库,其中所述标记物是荧光标记物。表
281.表2-3提供了示例性的治疗剂,其中的一种或多种可以是本文所述的药物库的成员。表2.示例性的癌症治疗剂。
表3.具有相关靶标的示例性的癌症治疗剂。
282.表4-5c提供了已知治疗剂的示例性的蛋白质靶标,其中的一种或多种可用于本文所述的靶标库。表4.治疗剂的基因靶标。
表5a.癌症治疗剂的基因靶标。
表5b.癌症治疗剂的基因靶标。
表5c.癌症治疗剂的基因靶标。
表5d.癌症治疗剂的基因靶标。
283.表6a-6c提供了基因调节剂的列表,其中的一种或多种可用于本文所述的细胞编辑方法中。表6a.基因调节剂库
表6b.基因调节剂库。
表6c.基因调节剂库。
表6d.基因调节剂库。
实施例实施例1:遗传药典
284.产生了包含表2b的分子靶向肿瘤药物的药物库。定期更新药物库以在识别出额外的靶向肿瘤药物时将其包含在所述药物库中。产生遗传药典以代表药物库的遗传靶标(表5b)。
285.设计了包含与每种基因靶标相关的指导rna(grna)序列的基因调节剂库。如表6a所示,为每种肿瘤药物靶标设计了五种潜在的grna序列,以产生具有seq id nos:1-1525的grna序列。构建基因调节剂库,使其包含选自seq id nos:1-1525的至少一种grna序列。使用病毒递送方法(用于cas核酸酶递送的腺病毒和用于grna递送的慢病毒)以与在原代癌细胞的使用相容的形式构建库。实施例2:癌症功能易感性分析
286.执行一种方法以确定患者的癌细胞对一种或多种干扰物的功能易感性,所述干扰物模拟实施例1中确定的靶向肿瘤药物的作用。包含选自seq id nos:1-1525的至少一种grna序列和相关的一种或多种基因编辑剂(例如,rna-引导的核酸酶)的库被递送至源自患者的原代癌细胞,以便基因修饰癌细胞。通过慢病毒递送cas核酸酶和grna。在该实施例中,通过使用基于crispr的方法的基因编辑进行遗传修饰。修饰的癌细胞在体内增殖,然而,所述方法可用于模拟体内环境的体外环境中。通过以合并或列阵形式筛选修饰的癌细胞来评估每个基因编辑的效果。执行下一代测序技术以确定单个干扰物对患者癌细胞活力的影响。选择与降低癌细胞活力的干扰物相关的一种或多种肿瘤药物作为患者的推定治疗剂。实施例3:基于crispr的个性化功能基因组学方法
287.利用图2中概述的功能基因组学执行用于确定患者特异性肿瘤治疗性缺陷的方法。将直接从患者获得的或在小鼠中传代(pdx)后获得的源于患者的样品使用对应于所需治疗药物集合的grna文库进行离解和感染。细胞在体外例如使用3d和/或细胞器方法可存活地维持,允许靶向必要的肿瘤调节剂的grna从群体中逐渐耗尽(“退出”)。该方法充分利用了以下观点:每种临床使用的靶向肿瘤药物的效果可以通过编码药物靶标的相应基因的crispr介导的突变来建模(图3)。
288.指导rna文库克隆
289.设计了具有1685个元件的指导rna(grna)文库,该元件具有针对药物靶基因的
1585个grna和100个对照grna(图4)。所述文库包含表6b的靶grna和具有表6c的seq id nos:2790-2959的对照grna。还包括靶向泛表达但并非必需的细胞表面分子β-2微球蛋白(b2m)的指导rna。20nt grna序列的两侧是含有对于iis型限制性酶bbs-i的识别位点的序列,而在bbs-i元件的外侧是可用于文库pcr扩增的引物结合位点。设计上游和下游bbs-i元件,使得pcr产物的bbs-i消化释放20bp grna编码序列,所述grna编码序列侧翼有与用于grna表达的目标载体中的相应突出部分相容的4bp突出部分。使用与文库寡核苷酸池中的引物结合位点互补的引物,可通过使用q5 dna聚合酶的pcr扩增所述文库10个周期。pcr产物用酶zymo clean&concentrate试剂盒进行纯化,之后使用通过bbs-i进行20个周期的37℃消化然后用t4-dna连接酶进行16℃连接,将pcr产物包含在goldengate克隆反应物中,以将所述文库引入目标载体用于grna表达。使用zymo clean & concentrate试剂盒进一步清洗goldengate克隆反应物,之后用于电穿孔至电感受态stbl-4细菌的多个反应中。将来自3-5次电穿孔的整个转化反应接种到600ml具有适当抗生素选择的lb中,并在30℃生长18小时以避免重组。收获细菌细胞,并使用zymo maxiprep试剂盒分离dna。通过对合并的质粒dna或转导的细胞的下一代测序技术测量条形码读取计数分布(图5),证明了接近完整的条形码表示和大致相等的读取计数分布。
290.制备了另一个针对药物靶基因的grna文库,其包含表6d的grna。该文库还包括具有针对b2m的seq id nos:2972-2979的grna,和具有seq id nos:2890-2905和2960-2971的对照grna。
291.病毒生产
292.根据制造商的说明书,使用lipofectamine-3000(thermo),通过用转移载体和第2代慢病毒包装质粒(dr8.9和pcmv-vsvg)以4:3:1的比例转染293ft细胞,产生含有编码grna文库和cas9的病毒基因组表达单元的慢病毒颗粒。转染六小时后,将培养基更换为含有10%fcs的dmem收获培养基。转染后30和54小时收获含有病毒的上清液,以2500rpm的转速离心5分钟以除去碎片,并在合并前通过45μm过滤器进行过滤。通过与10%终浓度的peg-8000孵育超过4小时,从培养上清液中沉淀病毒。将peg沉淀物以4000rpm的转速离心1小时,之后将沉淀物重悬于1/100的原始体积中。将等分试样贮存于-80℃直至使用。
293.肿瘤处理
294.使用无菌剃刀刀片在0.5ml消化混合物(含有1mg/ml胶原酶iv、10μm y27632和20μg/ml脱氧核糖核酸酶的dmem/f12)中将肿肿瘤块切碎。将这些切碎的肿瘤块在37℃消化30分钟,用10ml移液管研磨,然后在37℃再消化15分钟。将混合物通过100μm过滤器进行过滤。用facs缓冲液(含0.%bsa和1mm edta的pbs)洗涤细胞一次,并重悬于细胞器培养基中(含有10μm sb202190,1x hepes,1.25mm n-乙酰半胱氨酸,10mm烟酰胺,1x谷氨酰胺,1x原代细胞抗生素,5%knockout血清替代物,1x b27补充物,0.1nm霍乱毒素,0.5μm a83-01,10μm y27632,1μm pge2,10nm[leu15]-胃泌激素i,10ng/ml rhfgf10,10ng/ml rhfgf2,50ng/ml egf,0.3μg/ml氢化可的松的高级dmem/f12)。对于facs分析,采用190μl含有5nm topro-3的facs缓冲液稀释10μl细胞样品。
[0295]
肿瘤细胞感染和培养
[0296]
将细胞与慢病毒在细胞器培养基中在4μg/ml聚凝胺存在下以<1的目标moi进行混合,并在室温下孵育1小时。然后旋转悬浮液,将沉淀物重悬于最小体积的细胞器培养基
中,然后铺板于胶原海绵(ethicon)上进行3d培养(图6a)。细胞在37℃和5%co2下生长。每2天更换培养基。
[0297]
海绵收获
[0298]
在37℃下,用1mg/ml胶原酶iv在dmem-f12中消化海绵15分钟。对重新分离的细胞的分析证实了小肿瘤来源的类器官/细胞器的外生长(图6b)。保留少量样品用于facs(如上所述),剩余的样品以1200rpm的转速旋转5分钟。弃去所述上清液,将颗粒在-80℃冷冻以进行dna分离。使用直接偶联的抗b2m抗体分析β-2微球蛋白的表达(图7),证明基于grna文库中靶向b2m的grna的相对丰度,在预期的精确频率下b2m蛋白表达的丧失。
[0299]
癌细胞系培养物
[0300]
a549肺癌细胞(美国典型培养物保藏中心)在补充10%(v/v)胎牛血清、1x谷氨酰胺和1x抗生素/抗霉菌剂的杜尔贝科改良伊格尔培养基(gibco)中生长。
[0301]
dna制备、pcr和下一代测序技术(ngs)
[0302]
使用zymo quick-dna miniprep plus试剂盒分离基因组dna。使用q5 2x master mix和慢病毒载体特异性引物,使用5μg纯化的基因组dna作为第一轮pcr扩增的输入物。然后将10%的所得第一轮反应产物用作第二轮pcr扩增的输入物,其利用条形码引物以进行多重ngs读出。使用标准illumina测序引物(admera)在illumina miseq上分析样品。
[0303]
序列分析
[0304]
对应于pcr条形码的read1序列用于去多路复用,产生含有grna读取计数的单样本fasta文件。使用crisprhcoud2平台分析测序数据,产生cpm归一化的读取计数以及基于贝塔-伯努利模型的grna丰度的统计分析。数据被可视化为“火山”图(数据图),描述了统计显著性和grna丰度的倍数变化之间的关系。通常,在慢病毒转导后和体外培养期结束时立即进行grna丰度之间的比较。
[0305]
在a549肺癌细胞系中使用文库筛选分析丢失频率证明对应于已知必需基因(例如top2a、tubg1和其它基因)的grna的明显丢失,而非靶向对照grna证实没有相应的丰度降低(图8)。本实验中所用的文库包括如上所述的表6b-6c的grna(seq id nos:1526-2959)。
[0306]
在原发性人黑素瘤肿瘤样品中使用文库筛选分析丢失频率证明对应于已知的黑素瘤治疗缺陷(例如braf)的grna的明显丢失,而非靶向对照grna证明了没有相应的丰度降低(图9)。还确认了对应于推定癌症治疗缺陷的其他命中。如上所述,本实验中使用的文库包括表6d(seq id nos:2980-3071)以及表6c的seq id nos:2890-2905和2960-2979的grna。实施例4:个性化基因组分析的体内验证
[0307]
靶向实施例3中确定的推定的癌症治疗缺陷的肿瘤药物在患者癌症的体内动物模型中进行测试。选择在动物模型中显示治疗癌症的功效的药物以治疗患者的癌症。
[0308]
虽然本文已经示出和描述了优选的实施方案,但是对于本领域技术人员而言明显的是这些实施方案仅以示例的方式提供。在不脱离本技术的范围的情况下,本领域技术人员可想到许多变化、改变和替换。在实践本技术的范围时,可以采用对本文所述实施方案的各种替换。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。