一种耦合atp再生酶和聚谷氨酸合成酶的
γ-pga制备方法
技术领域
1.本发明属于生物领域,具体涉及一种耦合atp再生酶和聚谷氨酸合成酶的γ-pga制备方法。
背景技术:
2.γ-聚谷氨酸(γ-pga)是在微生物体内由谷氨酸单体通过γ-酰胺键缩合形成的天然聚合物,具有极好的成膜性、成纤维性、可塑性、保湿性、可生物降解性等优点,可作为水凝胶、保湿剂、成膜剂、增稠剂、分散剂、药物控释载体、基因载体、纳米创伤敷料等应用于化妆品、食品添加剂、环境治理、生物医学等领域,具有极好的商业价值。
3.微生物发酵法是目前制备γ-pga的主要方法。但发酵法制备聚γ-谷氨酸生产周期长(一般在70小时以上),底物谷氨酸转化率低(30-50%),且随菌种和发酵工艺不同,γ-pga产量(10g/l-120g/l)和分子量(10kda-1000kda)差异很大。开发高效、低成本、高产量的γ-pga生产工艺具有重要意义。
4.静息细胞(或酶)转化法以微生物整体细胞(或酶)作为反应催化剂,在保持发酵法条件温和、成本低等的基础上,比发酵法生产周期短、底物转化率高、反应体系简单、副产物较少,更易于后期产物提取与纯化,更利于工业化生产。然而迄今静息细胞(或酶)转化法制备γ-pga相关研究几乎未见报道。
5.随着γ-pga代谢途径的研究深入,人们发现γ-pga合成至少涉及pgs基因簇中3-4个基因(pgsbca或pgsbcae)。将该基因簇导入宿主细胞可大大增强宿主细胞产γ-pga的能力。发明人前期研究发现仅表达pgsb一个基因的工程菌或其酶能转化谷氨酸制备γ-pga,反应6h底物谷氨酸转化率超过70%,但制备过程中必须添加三磷酸腺苷(atp)。atp是生物体内最重要的高能磷酸化合物。工业上谷胱甘肽、茶氨酸、7-氨基头孢烷酸、谷氨酰-牛磺酸等多种重要生物活性物质或生化药物的酶促合成过程都需要atp的参与。atp价格昂贵,大量添加必然增加产品的生产成本,atp循环再生是酶工程发展的重要问题,也是制约工业生产是否经济的关键因素。
技术实现要素:
6.本发明的目的就是提供一种耦合atp再生酶和聚谷氨酸合成酶的γ-pga制备方法,酶反应和atp再生耦合,有效增加了γ-pga的产量,反应速率快、转化效率高,γ-pga生产成本与现有发酵制备法相当,为γ-pga的合成提供了新路径。具体为:先构建过表达聚谷氨酸合成酶的pgsb基因的一号重组菌、过表达多聚磷酸激酶的ppk2基因的二号重组菌;再将两种重组菌单独诱导培养后以一定比例混合获得混合菌;利用混合菌和优化的反应体系制备γ-聚谷氨酸。
7.本发明中,采用pgsb表示基因,其中“pgs”为斜体,采用pgsb表示蛋白,其他蛋白或基因采用同样的表达方式。
8.本发明的目的通过以下技术方案实现:
9.本发明提供一种耦合atp再生酶和聚谷氨酸合成酶的γ-pga制备方法,以谷氨酸、谷氨酸钠或谷氨酰胺为底物,酶法制备γ-聚谷氨酸,
10.所述酶法制备γ-聚谷氨酸的方式包括:联用生物酶,或者表达所述联用生物酶的重组载体、或者表达所述联用生物酶的转基因细胞系、或者表达所述联用生物酶的基因工程菌;
11.所述联用生物酶的氨基酸序列含有:
12.1)seq id no.1、seq id no.2所示的氨基酸序列;或者,
13.2)在seq id no.1限定的氨基酸序列基础上经碱基的缺失、取代、插入或突变而成,且具有催化谷氨酸或谷氨酸钠通过γ-酰胺键聚合成γ-pga活性的聚谷氨酸合成酶的氨基酸序列;或者谷氨酰胺转移酶的氨基酸序列;或者,
14.3)在seq id no.2限定的氨基酸序列基础上经碱基的缺失、取代、插入或突变而成,且具有催化atp再生活力的多聚磷酸激酶ppk;或者,
15.4)能用于催化atp再生的乙酸激酶、丙酮酸激酶、肌酸激酶的氨基酸序列其中,乙酸激酶蛋白的氨基酸序列如seq id no.5所示,肌酸激酶蛋白的氨基酸序列如seq id no.6所示。
16.在本发明的一个实施方式中,所述方法合成γ-pga的底物为谷氨酸、谷氨酸钠或谷氨酰胺;
17.所述方法利用的生物酶为如下(1)至(8)中任意一组或多组的生物酶:
18.(1)聚谷氨酸合成酶和多聚磷酸激酶ppk;
19.(2)聚谷氨酸合成酶和乙酸激酶;
20.(3)聚谷氨酸合成酶和丙酮酸激酶;
21.(4)聚谷氨酸合成酶和肌酸激酶;
22.(5)谷氨酰胺转移酶和多聚磷酸激酶ppk;
23.(6)谷氨酰胺转移酶和乙酸激酶;
24.(7)谷氨酰胺转移酶和丙酮酸激酶;
25.(8)谷氨酰胺转移酶和肌酸激酶。
26.在本发明的一个实施方式中,所述制备方法中的酶存在、利用形式包括如下(1)至(6)中任意一种:
27.(1)所述生物酶的任何一种组合;
28.(2)编码以下生物酶的基因:聚谷氨酸合成酶、多聚磷酸激酶、乙酸激酶、丙酮酸激酶、肌酸激酶;
29.(3)含有以下生物酶的基因:聚谷氨酸合成酶、多聚磷酸激酶、乙酸激酶、丙酮酸激酶、肌酸激酶;
30.(4)含有以下生物酶的基因的表达载体或克隆载体:聚谷氨酸合成酶、多聚磷酸激酶、乙酸激酶、丙酮酸激酶、肌酸激酶;
31.(5)含有以下生物酶的基因的转基因细胞系:聚谷氨酸合成酶、多聚磷酸激酶、乙酸激酶、丙酮酸激酶、肌酸激酶;
32.(6)含有以下生物酶的基因的基因工程菌:(聚谷氨酸合成酶、多聚磷酸激酶、乙酸激酶、丙酮酸激酶、肌酸激酶。
33.在本发明的一个实施方式中,所述联用生物酶选择为聚谷氨酸合成酶pgsb和多聚磷酸激酶ppk,其中,聚谷氨酸合成酶pgsb具有如seq id no.1所示的蛋白质序列,多聚磷酸激酶ppk2具有如seq id no.2所示的蛋白质序列。
34.在本发明的一个实施方式中,耦合atp再生酶和聚谷氨酸合成酶的γ-pga制备方法,具体包括以下步骤:
35.(a)获得过表达pgsb基因的一号重组菌,所述pgsb基因表达聚谷氨酸合成酶pgsb,该聚谷氨酸合成酶pgsb具有如seq id no.1所示的蛋白质序列;
36.(b)获得过表达ppk2基因的二号重组菌,所述ppk2基因表达多聚磷酸激酶ppk2,该多聚磷酸激酶为atp再生酶,该多聚磷酸激酶ppk2具有如seq id no.2所示的蛋白质序列;
37.(c)将步骤(a)得到的一号重组菌和步骤(b)得到的二号重组菌混合,获得混菌细胞,再催化含谷氨酸和/或谷氨酸盐的底物合成γ-聚谷氨酸。基因和蛋白的名称采用大小写进行区分。
38.步骤(a)中,过表达pgsb基因的一号重组菌的制备步骤为:
39.构建表达聚谷氨酸合成酶的pgsb基因的一号重组质粒,再将一号重组质粒转化入微生物上获得一号重组菌;
40.或利用基因组编辑技术将表达聚谷氨酸合成酶的pgsb基因整合到微生物的基因组上获得一号重组菌。
41.优选地,所述pgsb基因来源于枯草杆菌属中具有如seq id no.3所示的核苷酸序列或具有同源性与该序列在90%以上的氨基酸序列的pgsb基因。
42.步骤(a)中,将活化后的一号重组菌单独诱导培养至对数中期及以上收集得到一号菌体,具体诱导过程为:将一号重组菌置于摇床的活化培养基中活化过夜得到一号液体种子,摇床转速为200rpm,温度为37℃,活化培养基的配方是nacl 10g/l,酵母提取物5g/l和胰蛋白胨10g/l;
43.将活化的一号液体种子移至摇瓶增殖培养基中,在温度为37℃和转速为200rpm的摇床中培养至菌体浓度od
600
=0.6-0.8时,加入终浓度为0.4-0.8mm的异丙基硫代半乳糖苷及0.5-5mm的硫酸镁,在25℃下诱导表达14-16h,离心收集得到一号菌体。
44.步骤(b)中,过表达ppk2基因的二号重组菌的制备步骤为:
45.构建表达多聚磷酸激酶的ppk2基因的二号重组质粒,再将二号重组质粒转化入微生物上获得二号重组菌;
46.或利用基因组编辑技术将表达多聚磷酸激酶的ppk2基因整合到微生物的基因组上获得二号重组菌。
47.优选地,所述ppk2基因来源于红假单胞菌属或异常球菌属中具有如seq id no.4所示的核苷酸序列或具有同源性与该序列在90%以上的氨基酸序列的ppk2基因。
48.步骤(b)中,将活化后的二号重组菌单独诱导培养至对数中期及以上收集菌体得到二号菌体,具体诱导过程为:将二号重组菌置于摇床的活化培养基中活化过夜得到二号液体种子,摇床转速为200rpm,温度为37℃,活化培养基的配方是nacl 10g/l、酵母提取物5g/l和胰蛋白胨10g/l;
49.将活化的二号液体种子移至摇瓶增殖培养基中,在温度为37℃和转速为200rpm的摇床中培养至菌体浓度od
600
=0.6-0.8时,加入终浓度为0.4-0.8mm的异丙基硫代半乳糖苷
及0.5-5mm的硫酸镁,在25℃下诱导表达14-16h,离心收集得到二号菌体。
50.步骤(a)和步骤(b)中,微生物为大肠杆菌。
51.步骤(c)中,一号重组菌和二号重组菌可以是先混合后再培养一段时间,也可以先培养至所需的程度再混合。
52.步骤(c)中,一号重组菌和二号重组菌的重量比为8:1~2:1,优选为3:1~2:1。
53.步骤(c)中,混菌细胞在16-37℃,ph为6-8的条件下,孵育3-12h直接催化合成γ-聚谷氨酸。
54.步骤(c)中,所述催化合成的底物为谷氨酸和/或谷氨酸盐、镁离子(镁离子是两种酶的辅因子)、单磷酸腺苷和多聚磷酸盐的混合物。在二号重组菌、单磷酸腺苷和多聚磷酸盐的配合可使单磷酸腺苷转化成三磷酸腺苷,三磷酸腺苷又为一号重组菌产γ-pga提供能量并转化成单磷酸腺苷,使整个混合菌体系能够在谷氨酸或谷氨酸钠持续加入的情况下持续产γ-pga,并且该种体系对谷氨酸/谷氨酸钠的催化转化率远远大于含有一号重组菌和atp的体系对谷氨酸/谷氨酸钠的催化转化率。
55.优选地,镁离子、单磷酸腺苷、多聚磷酸盐的浓度比为1:1:0.5。这些底物溶解在磷酸盐溶液中,以便进行催化反应。
56.优选地,所述多聚磷酸盐包括六偏磷酸盐。
57.优选地,所述镁离子由七水合硫酸镁来提供。
58.本方法将目的基因整合到大肠杆菌等宿主细胞的基因组上,解决了重组菌培养过程中质粒易丢失的问题,并节省了培养菌体过程中抗生素的使用以及含抗生素废水的后续处理。本发明利用优化后的体系,在25℃下反应12h,50g/l谷氨酸钠转化获得44.25g/lγ-pga,谷氨酸钠的转化率为88.5%,时空转化速率最高达到4.34g/l/h。该时空转化速率(通过产量和发酵时间相除得到)较单菌(酶)静息转化法和目前所报道的枯草杆菌发酵法制备γ-pga提高了2.2-2.5倍。γ-pga生产成本与现有发酵制备法相当。总之,本发明为低成本、快速、高效制备γ-pga提供了一条新路径。
59.与现有技术相比,本发明具有以下优势:
60.1)酶制备方法节能、环保。
61.2)多酶体系协同制备γ-聚谷氨酸,得到产物γ-聚谷氨酸同时原位再生atp,atp的消耗与再生同时进行,使反应体系中仅初期需要投入浓度极低的atp,避免了大量atp的投入。
62.3)优化了γ-聚谷氨酸生产的反应条件,反应速度快,底物转化率高。
63.4)最大程度节约了原料、设备以及合成反应过程的成本。
附图说明
64.图1为pgsb基因的pcr扩增;
65.图2为重组质粒pet-22b-pgsb的酶切鉴定图;
66.图3为sds-page分析重组pgsb的表达,方框内粗的条带为目标重组蛋白所在位置。
67.图4为sds-page分析重组ppk2的表达,方框内粗的条带为目标重组蛋白所在位置;
68.图5为单重组菌与耦合双重组菌产γ-pga能力比较;
69.图6为pgsb与ppk2的重量比对谷氨酸转化率的影响;
no 3),m泳道为dna marker,各条带的大小自下而上依次为100、250、500、750、1000、1500、2000、3000、5000bp,1泳道为pgsb pcr产物。用限制性内切酶bamh1和nco1分别对目的基因pgsb和质粒载体pet-22b进行双酶切,电泳分离,割胶回收,获得含有相同粘性末端的基因片段和线性化质粒片段,将两者用t4-dna连接酶连接,得到一号重组质粒,将该质粒转化到e.coli bl21(de3)感受态细胞(为大肠杆菌)中,筛选阳性单克隆(如图2所示),获得重组菌株pet-22b-pgsb-bl21,即一号重组菌,置于50%甘油中保存,图2中m泳道为dnamarker,各条带的大小自下而上依次为100、250、500、750、1000、1500、2000bp,1泳道、2泳道、3泳道和4泳道为挑取四个单克隆的质粒的bamh1和nco1双酶切结果,由图可见,3泳道和4泳道的单克隆为阳性克隆。
78.根据ncbi数据库中deinococcus proteolyticus polyphosphate kinase的蛋白序列(wp_013615652,seq id no 2),按照大肠杆菌密码子偏爱性合成其ppk2基因,设计引物ppk2-f和ppk2-r(如表1所示),以合成的ppk2基因为模板(序列见seq id no 4),扩增deipr-ppk2基因,用切、接、转、增、检的方式构建重组质粒pet-duet-deipr-ppk2,即二号重组质粒,将该质粒转化到e.coli bl21(de3)感受态细胞(为大肠杆菌)中,获得重组菌株petduet-deipr-ppk2-bl21,即二号重组菌,置于50%甘油中保存。
79.实施例2:重组游离细胞的制备
80.将50%甘油保存的大肠菌株pet-22b-pgsb-bl21和pet-duet-deipr-ppk2-bl21分别按照1%体积比(体积比为加入的菌液体积占新培养液的体积比)的接种量放置于摇床的活化培养基中活化过夜,摇床转速为200rpm,温度为37℃,活化培养基的配方是nacl 10g/l,酵母提取物5g/l,胰蛋白胨10g/l。
81.将上述活化的种子(即上文在摇床中活化培养后得到的)按照2%体积比的接种量移至摇瓶增殖培养基(该增殖培养基的配方是k2hpo
4 9.4g/l,kh2po
4 2.2g/l,酵母提取物23.6g/l,胰蛋白胨11.8g/l,甘油4ml/l),在37℃,200rpm的摇床中培养至菌体浓度od
600
=0.6左右时,加入终浓度为0.4mm的异丙基硫代半乳糖苷及0.5mm的硫酸镁,在25℃下诱导表达14h,离心收集菌体,包括pet-22b-pgsb-bl21重组游离细胞和pet-duet-deipr-ppk2-bl21重组游离细胞,采用sds-page分析(图3为sds-page分析重组pgsb的表达,图4为sds-page分析重组ppk2的表达),之后在-20℃下保存,图3与图4中(两个图中方框指出的是目标蛋白表达位置),m泳道为蛋白marker,1泳道为诱导前,2泳道为诱导后,3泳道为诱导后上清,4泳道为诱导后沉淀;蛋白marker泳道中各标准蛋白条带的大小自小而大依次为14.4、18.4、25、35、45、66.2、116kda。
82.实施例3:一号重组菌静息细胞制备γ-pga实例1
83.采用实施例1所述方法依次构建一号重组质粒和一号重组菌;采用实施例2所述方法培养、诱导表达获得一号重组菌的静息细胞。
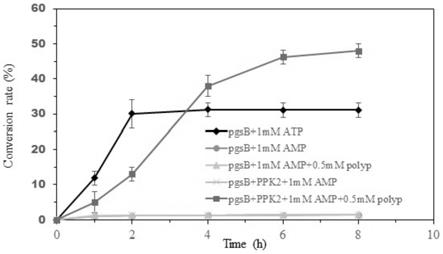
84.用浓度为0.1mol/l、ph为8的磷酸盐缓冲液重悬一号重组菌的静息细胞;将一号重组菌的静息细胞单独加入到含有1.7g/l谷氨酸,1mm atp,1mm mgso4的0.1mol/l ph为8的磷酸盐反应液中(磷酸盐起缓冲作用);在25℃、200rpm的摇床中恒温振荡反应8h,每隔1-2h取一次样;12000rpm的转速和4℃的温度下离心取上清,获得含有γ-pga的反应液;采用ctab法测定γ-pga的产量,转化率如图5所示(转化率公式为转化率=(初始谷氨酸/谷氨酸盐的浓度-某个时间点谷氨酸/谷氨酸盐的浓度)/初始谷氨酸/谷氨酸盐的浓度,某个时间
点谷氨酸/谷氨酸盐的浓度可由γ-pga的产量计算得到)。可见,反应前2h內,随时间的延长,γ-pga含量和谷氨酸转化率逐渐上升;2h后,谷氨酸转化率在30%左右趋于稳定状态,几乎不再增加。说明单独一号重组菌在atp的协同作用下,可以转化谷氨酸制备γ-pga。
85.实施例4:一号重组菌静息细胞制备γ-pga实例2
86.采用实施例1所述方法依次构建一号重组质粒和一号重组菌;采用实施例2所述方法培养、诱导表达获得一号重组菌的静息细胞。
87.用浓度为0.1mol/l、ph为8的磷酸盐缓冲液重悬一号重组菌的静息细胞;将一号重组菌的静息细胞单独加入到含有1.7g/l谷氨酸钠,1mm amp,1mm mgso4的0.1mol/l的ph为8的磷酸盐反应液中;在25℃、200rpm的摇床中恒温振荡反应8h,每隔1-2h取一次样;12000rpm的转速和4℃的温度下离心取上清,获得含有γ-pga的反应液;采用ctab法测定γ-pga的产量,转化率如图5所示。可见,整个测定的反应时间范围内,几乎没有γ-pga产生或谷氨酸转化。说明体系中有一号重组菌而缺乏atp时,虽有ppk2再生用底物amp,而没有atp再生酶ppk2情况下,一号重组菌不能合成γ-pga。
88.实施例5:一号重组菌静息细胞制备γ-pga实例3
89.采用实施例1所述方法依次构建一号重组质粒和一号重组菌;采用实施例2所述方法培养、诱导表达获得一号重组菌的静息细胞。
90.用浓度为0.1mol/l、ph为8的磷酸盐缓冲液重悬一号重组菌的静息细胞;将一号重组菌的静息细胞单独加入到含有1.7g/l谷氨酸钠,1mm amp,1mm mgso4,0.5mm多聚磷酸盐(polyp)的0.1mol/l的ph为8的磷酸盐反应液中;在25℃、200rpm的摇床中恒温振荡反应8h,每隔1-2h取一次样;12000rpm的转速和4℃的温度下离心取上清,获得含有γ-pga的反应液;采用ctab法测定γ-pga的产量,转化率如图5所示。可见,整个测定的反应时间范围内,几乎没有γ-pga产生或谷氨酸转化。说明体系中有一号重组菌而缺乏atp时,虽有ppk2再生用底物amp和多聚磷酸盐,而没有atp再生酶ppk2情况下,一号重组菌不能合成γ-pga。
91.实施例6一号重组菌与二号重组菌的混合静息细胞制备γ-pga实例1
92.采用实施例1所述方法依次构建一号重组质粒和二号重组质粒,一号重组菌和二号重组菌;采用实施例2所述方法培养、诱导表达获得一号重组菌和二号重组菌的静息细胞。
93.用浓度为0.1mol/l、ph为8的磷酸盐缓冲液分别重悬一号重组菌的静息细胞和二号重组菌的静息细胞;将一号重组菌的静息细胞和二号重组菌的静息细胞按3:1的质量比加入含有1.7g/l谷氨酸钠,1mm amp,1mm mgso4的0.1mol/l ph为8的磷酸盐反应液中;在25℃、200rpm的摇床中恒温振荡反应8h,每隔1-2h取一次样;12000rpm的转速和4℃的温度下离心取上清,获得含有γ-pga的反应液;采用ctab法测定γ-pga的产量,转化率如图5所示。可见,整个测定的反应时间范围内,几乎没有γ-pga产生或谷氨酸转化(即图5中实施例4、5、6的曲线基本重合)。说明有重组pgsb和ppk2而缺乏atp时,仅有ppk2再生用底物amp和多聚磷酸盐,因无法再生atp,重组静息细胞不能合成γ-pga。
94.实施例7:一号重组菌与二号重组菌的混合静息细胞制备γ-pga实例2
95.采用实施例1所述方法依次构建一号重组质粒和二号重组质粒,一号重组菌和二号重组菌;采用实施例2所述方法培养、诱导表达获得一号重组菌和二号重组菌的静息细胞。
96.用浓度为0.1mol/l、ph为8的磷酸盐缓冲液分别重悬一号重组菌的静息细胞和二号重组菌的静息细胞;将一号重组菌的静息细胞和二号重组菌的静息细胞按3:1的质量比加入到含有1.7g/l谷氨酸钠,1mm amp,1mm mgso4,0.5mm多聚磷酸盐(polyp)的0.1mol/l的ph为8的磷酸盐反应液中;在25℃、200rpm的摇床中恒温振荡反应8h,每隔1-2h取一次样;12000rpm的转速和4℃的温度下离心取上清,获得含有γ-pga的反应液;采用ctab法测定γ-pga的产量,转化率如图5所示。可见,整个测定的反应时间范围内,随反应时间的延长,γ-pga产生量或谷氨酸转化率前3h先快速上升,接着趋于平缓,随后几乎不再变化,最终谷氨酸转化率达30%。说明体系中有重组pgsb和ppk2而缺乏atp时,ppk2能利用底物amp和多聚磷酸盐再生出atp,恢复一号重组菌产γ-pga能力。由图5还可以看出,与在atp存在时单独一号重组菌的产γ-pga能力相比,混合菌产γ-pga能力前3.5h不如一号重组菌,3.5h后逐渐超过前者,8h底物谷氨酸转化率(51%)比前者(30%)增加了70%。
97.实施例8:一号重组菌与二号重组菌的混合静息细胞制备γ-pga实例3
98.采用实施例1所述方法依次构建一号重组质粒和二号重组质粒,一号重组菌和二号重组菌;采用实施例2所述方法培养、诱导表达获得一号重组菌和二号重组菌的静息细胞。
99.用浓度为0.1mol/l、ph为8的磷酸盐缓冲液分别重悬一号重组菌的静息细胞和二号重组菌的静息细胞;将一号重组菌的静息细胞和二号重组菌的静息细胞按8:1的质量比加入到ph为8且含有1.7g/l谷氨酸钠,1mm amp,1mm mgso4,0.5mm polyp的0.1mol/l的磷酸盐反应液中;在25℃、200rpm的摇床中恒温振荡反应8h,每隔1-2h取一次样;12000rpm的转速和4℃的温度下离心取上清,获得含有γ-pga的反应液;采用ctab法测定γ-pga的产量,转化率如图6所示。可见,整个测定的反应时间范围内,随反应时间的延长,γ-pga产生量或谷氨酸转化率前4h先快速上升,接着趋于平缓,随后几乎不再变化,最终谷氨酸转化率达16%。与一号重组菌的静息细胞和二号重组菌的静息细胞质量比为3:1的情况相比,后者(即实施例7)产γ-pga能力较强,说明重组pgsb和ppk2细胞比例会影响混合细胞产γ-pga水平。
100.实施例9:一号重组菌与二号重组菌的混合静息细胞制备γ-pga实例4
101.采用实施例1所述方法依次构建一号重组质粒和二号重组质粒,一号重组菌和二号重组菌;采用实施例2所述方法培养、诱导表达获得一号重组菌和二号重组菌的静息细胞。
102.用浓度为0.1mol/l、ph为8的磷酸盐缓冲液分别重悬一号重组菌的静息细胞和二号重组菌的静息细胞;将一号重组菌的静息细胞和二号重组菌的静息细胞按4:1的质量比加入到含有1.7g/l谷氨酸钠,1mm amp,1mm mgso4,0.5mm polyp的0.1mol/l的ph为8的磷酸盐反应液中;在25℃、200rpm的摇床中恒温振荡反应8h,每隔1-2h取一次样;12000rpm的转速和4℃的温度下离心取上清,获得含有γ-pga的反应液;采用ctab法测定γ-pga的产量,转化率如图6所示。可见,整个测定的反应时间范围内,随反应时间的延长,γ-pga产生量或谷氨酸转化率前4h先快速上升,接着趋于平缓,随后几乎不再变化,最终谷氨酸转化率达37%。该情况下,混合菌产γ-pga能力优于一号重组菌的静息细胞和二号重组菌的静息细胞质量比为8:1的情况,但低于一号重组菌的静息细胞和二号重组菌的静息细胞质量比为3:1的情况,说明重组pgsb和ppk2细胞比例会影响混合细胞产γ-pga水平。
103.实施例10:一号重组菌与二号重组菌的混合静息细胞制备γ-pga实例5
104.采用实施例1所述方法依次构建一号重组质粒和二号重组质粒,一号重组菌和二号重组菌;采用实施例2所述方法培养、诱导表达获得一号重组菌和二号重组菌的静息细胞。
105.用浓度为0.1mol/l、ph为8的磷酸盐缓冲液分别重悬一号重组菌的静息细胞和二号重组菌的静息细胞;将一号重组菌的静息细胞和二号重组菌的静息细胞按2:1的质量比加入到含有1.7g/l谷氨酸钠,1mm amp,1mm mgso4,0.5mm polyp的0.1mol/l的ph为8的磷酸盐反应液中;在25℃、200rpm的摇床中恒温振荡反应8h,每隔1-2h取一次样;12000rpm的转速和4℃的温度下离心取上清,获得含有γ-pga的反应液;采用ctab法测定γ-pga的产量,转化率如图6所示。可见,整个测定的反应时间范围内,随反应时间的延长,γ-pga产生量或谷氨酸转化率前4h先快速上升,接着趋于平缓,随后几乎不再变化,最终谷氨酸转化率达65.4%。该情况下混合菌产γ-pga能力优于一号重组菌的静息细胞和二号重组菌的静息细胞质量比为8:1~3:1的情况,说明重组pgsb和ppk2细胞比例会影响混合细胞产γ-pga水平,且重组ppk2的量在转化谷氨酸制备γ-pga过程占有主导地位。
106.实施例11:一号重组菌与二号重组菌的混合静息细胞制备γ-pga实例6
107.采用实施例1所述方法依次构建一号重组质粒和二号重组质粒,一号重组菌和二号重组菌;采用实施例2所述方法培养、诱导表达获得一号重组菌和二号重组菌的静息细胞。
108.用浓度为0.1mol/l、ph为8的磷酸盐缓冲液分别重悬一号重组菌的静息细胞和二号重组菌的静息细胞;将一号重组菌的静息细胞和二号重组菌的静息细胞按2:1的质量比加入到ph为8且含有30g/l谷氨酸钠,30mm amp,30mm mgso4,15mm polyp的0.1mol/l的磷酸盐反应液中;在25℃、200rpm的摇床中恒温振荡反应12h,每隔1-2h取一次样;12000rpm的转速和4℃的温度下离心取上清,获得含有γ-pga的反应液;采用ctab法测定γ-pga的产量。因反应4h和8h时均出现产物γ-pga生成量趋平现象,为验证反应趋平是底物耗尽引起的,反应6h时补加了15g/l的谷氨酸钠和10mm polyp,反应到10h时再次添加5g/l谷氨酸钠和5mm polyp。γ-pga产生量随时间情况如图7所示。可见,底物补加后,γ-pga产生量进一步升高。反应的前6h,30g/l底物谷氨酸钠被高效转化生成26.02g/l产物γ-pga,谷氨酸转化率为86.7%,转化速率4.34g/l/h;整个12h转化过程,50g/l谷氨酸钠转化生成44.25g/l产物γ-pga,谷氨酸的转化率达88.5%,转化速率为3.69g/l/h。
109.实施例12:采用基因编辑技术构建一号重组菌
110.本实施例采用crispr基因编辑技术实现pgsb基因敲入。下面详细阐述基因编辑的步骤。
111.1)根据目的基因pgsb序列的插入位置及周围的序列特点,设计并制备grna,将grna以及donor序列克隆至基因编辑载体donor质粒,并通过测序验证确保构建的载体中grna以及donor序列均与目标序列一致;
112.2)制备大肠杆菌bl21(de3)电转感受态,cas9质粒转化至bl21(de3)感受态中,挑单克隆制备bl21(de3)cas9电转感受态,donor质粒转化至bl21(de3)cas9电转感受态,加入阿拉伯糖诱导后涂板,进行基因编辑菌株筛选实验;
113.3)pcr扩增验证编辑后的bl21(de3)单克隆,pgsb基因敲入成功的条带大小
1193bp,未敲入成功无条带,琼脂糖凝胶电泳结果显示,成功筛选到pgsb基因敲入的单克隆petduet-1-pgsb-bl21(de3),即一号重组菌,置于50%甘油中保存。
114.实施例13:采用基因编辑技术构建二号重组菌
115.本实施例采用crisper基因编辑技术实现ppk2基因敲入。下面详细阐述基因编辑的步骤。
116.1)根据目的基因ppk2序列的插入位置及周围的序列特点,设计并制备grna,将grna以及donor序列克隆至基因编辑载体donor质粒,并通过测序验证确保构建的载体中grna以及donor序列均与目标序列一致;
117.2)制备大肠杆菌bl21(de3)电转感受态,cas9质粒转化至bl21(de3)感受态中,挑单克隆制备bl21(de3)cas9电转感受态,donor质粒转化至bl21(de3)cas9电转感受态,加入阿拉伯糖诱导后涂板,进行基因编辑菌株筛选实验;
118.3)pcr扩增验证编辑后的bl21(de3)单克隆,ppk2基因敲入成功的条带大小858bp,未敲入成功无条带,琼脂糖凝胶电泳结果显示,成功筛选到ppk2基因敲入的单克隆petduet-1-deipr-ppk2-bl21(de3),即二号重组菌,置于50%甘油中保存。
119.表1引物名称及序列
[0120][0121]
seq id no.1pgsb蛋白序列
[0122]
mwlliiacavilvigilekrrhqknidalpvrvningirgkstvtrlttgilieagyktvgkttgtdarmiywdtpeekpikrkpqgpnigeqkevmretverganaivsecmavnpdyqiifqeellqanigvivnvledhmdvmgptldeiaeaftatipynghlvitdseyteffkqkakerntkviiadnskitdeylrkfeymvfpdnaslalgvaqalgideetafkgmlnappdpgamrilplispsepghfvngfaandasstlniwkrvkeigyptddpiiimncradrvdrtqqfandvlpyieaseliligettepivkayeegkipadklhdleykstdeimellkkrmhnrviygvgnihgaaepliekiheykvkqlvs
[0123]
seq id no.2ppk2蛋白序列:
[0124]
mnskasqqlqvppgqkvrladystdtfegsaaldkeqvkqateqlqqrlselqeklyaegkqslliilqardgggkdstvsrvmgafnpngvhvanfkaptdlelqhdflwrihqqvpshgmiavfnrshyedvlvtrvhgliddaraqqnlehivnfekllsdagtrivkfylhlspeeqkarmedrlndpakhwkfnpsdlkdralwheytaayedalatsrsyapwyiipadrkwlrdyliseilvqtleemnpqfptahfeaayyliedipsr
[0125]
seq id no.3pgsb的核酸序列
[0126]
atgtggttactcattatagcctgtgctgtcatactggtcatcggaatattagaaaaacgacgacatcagaaaaacattgatgccctccctgttcgggtgaatattaacggcatccgcggaaaatcgactgtgacaaggctgacaac
cggaatattaatagaagccggttacaagactgttggaaaaacaacaggaacagatgcaagaatgatttactgggacacaccggaggaaaagccgattaaacggaaacctcaggggccgaatatcggagagcaaaaagaagtcatgagagaaacagtagaaagaggggctaacgcgattgtcagtgaatgcatggctgttaacccagattatcaaatcatctttcaggaagaacttctgcaggccaatatcggcgtcattgtgaatgttttagaagaccatatggatgtcatggggccgacgcttgatgaaattgcagaagcgtttaccgctacaattccttataatggccatcttgtcattacagatagtgaatataccgagttctttaaacaaaaagcaaaagaacgaaacacaaaagtcatcattgctgataactcaaaaattacagatgagtatttacgtaaatttgaatacatggtattccctgataacgcttctctggcgctgggtgtggctcaagcactcggcattgacgaagaaacagcatttaagggaatgctgaatgcgccgccagatccgggagcaatgagaattcttccgctgatcagtccgagcgagcctgggcactttgttaatgggtttgccgcaaacgacgcttcttctactttgaatatatggaaacgtgtaaaagaaatcggttacccgaccgatgatccgatcatcatcatgaactgccgcgcagaccgtgtcgatcggacacagcaattcgcaaatgacgtattgccttatattgaagcaagtgaactgatcttaatcggtgaaacaacagaaccgatcgtaaaagcctatgaagaaggcaaaattcctgcagacaaactgcatgatctagagtataagtcaacagatgaaattatggaattgttaaagaaaagaatgcacaaccgtgtcatatatggcgtcggcaatattcatggtgccgcagagcctttaattgaaaaaatccacgaatacaaggttaagcagctcgtaagc
[0127]
seq id no.4ppk2的核酸序列
[0128]
atgaacagcaaagcatctcaacaactgcaagttccgccgggccaaaaagtacgcctggcagactactccaccgacacctttgaaggctccgcagctctggataaggagcaggtgaaacaggcgacggaacagctgcaacaacgtctgtctgagctgcaagaaaaactgtacgcagaaggtaaacagtctctgctgattattctgcaagctcgtgatggcggtggtaaagattccactgtgagccgcgtgatgggcgcgttcaatccgaacggtgtgcacgtggcaaattttaaagcaccgaccgacctggaactgcaacacgactttctgtggcgtatccaccagcaggtgccgtctcacggtatgattgcggtgttcaatcgtagccactacgaagatgtgctggttacccgtgttcacggtctgattgacgacgcacgtgcgcagcagaacctggaacacattgttaacttcgaaaaactgctgagcgacgctggtactcgcattgtaaaattctatctgcacctgagcccagaggaacagaaagctcgtatggaggaccgtctgaacgacccggcgaaacactggaagttcaatccgtctgacctgaaagaccgtgcactgtggcacgaatataccgcagcttacgaagatgcactggcaacctctcgttcttacgccccgtggtacatcattccggcggaccgtaaatggctgcgcgactacctgattagcgaaatcctggttcagactctggaagaaatgaacccgcagtttccaaccgcgcatttcgaagctgcttactatctgattgaagacatcccgtcccgt
[0129]
seq id no.5乙酸激酶蛋白序列
[0130]
mkvlvlnagsssqksclydldsrgkkpnfvspiweatidwtlnlghtllkvksngqeystylsdhnrlesiktmlktmvegetkvlehlsdidvvghrvvhggtkysqatlinsevkatiekliplapnhnpahlegiesvenilgdipqvavfdtafhtniplyakiyplnhefykrgiqrygfhgisheyvsqrtseilqqplknlnlvtchlgngcsitavkngqsvnttmgftplegvmmgtrcgsidpaivihlmteygydgekinhilnkesglwgmseissdlrtilkaksennpkailaiemyifrlqeaiasmlpslgsldalvftagvgensafirekvcqglgflglkldleknsqslfneniatadsnskiliiptkedwaiasqcfqlmeskn
[0131]
seq id no.6肌酸激酶蛋白序列
[0132]
mllhkhltpelksrlerlttrngwtlrktiqsgldhgdsqmgvyagdsesyalfspllhpiirdhsghdlsghtsdfsldglpqgdldptgefilstrvrvgrnlaryafppaigardraaleaevvqvlsglrghlagkyhplaslseaerlelvhhhvlfqqsdrfldsagvnrdwprnrgifhsadmrfivwvgeedalriismqpgsglaqtylrlqtaleqfdgqldfaqdsrlgfltacptnlgtamrasvlirlphlsrrpdfrarcarlglavrglhgehseardgihdvsnatrlgvterdiyeqlrtgihalmemesaarkrghpkvapgn
[0133]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。