1.本发明属于微生物技术领域,更具体地,涉及一种锰氧化菌及其筛选方法和应用。
背景技术:
2.砷(as)是全球性污染物,过量的砷进入人体后,会破坏人体细胞的氧化还原能力,影响细胞的正常代谢,引起组织损害和机体障碍,严重者可直接引起中毒死亡。
3.砷在环境中以as
3
和as
5
两种形式存在,且as
3
的毒性远远高于 as
5
,其中:as
3
毒性约为as
5
毒性的60倍。此外,相关研究发现,与as
5
相比,as
3
具有更高的迁移率和更低的吸附率;其原因在于,当 ph在0-9.0之间时,as
3
的主要存在形式是h3aso3,表面不带电荷,因而不容易被带电物质吸附,其迁移率更高,而as
5
在ph>2.0的条件中,其主要存在形式有h2aso
4-、haso
42-和aso
43-,易与表面带正电荷物质相结合,从而降低其迁移率。
4.因此,将高毒性且易迁移的as
3
氧化为低毒性且迁移率低的as
5
是降低水体砷毒性的一个较优选择。
5.现有技术中,as
3
的氧化技术包括氧化剂氧化法、光催化氧化法和生物法。
6.其中,生物法由于具有成本低和无二次污染的优势,越来越受到人们的关注。锰氧化微生物是微生物氧化中的翘楚,通过锰氧化微生物氧化生成的生物锰氧化物电荷零点低,表面积大,负电荷高,有很高活性和很强的氧化吸附能力,其通常包裹在其他矿物表面,具有很强的反应活性。作为重要的天然吸附载体、氧化还原主体和化学反应的催化剂,生物锰氧化物对于无机污染物的生物有效性、生理毒性及在环境中的迁移转化和有机污染物的降解等方面起着决定性作用,在多种物质的生物地球化学循环中起着重要作用。通过高价生物锰氧化物可有效将as
3
氧化为as
5
,达到砷解毒的作用,且与化学锰氧化物对砷解毒作用相比,生物锰氧化物的氧化速度更快,效率更高,锰氧化物还原三价砷形成的mn
2
可被锰氧化菌继续反应形成生物锰氧化物,达到对砷的持续解毒作用。
7.但是,常见的锰氧化菌对锰氧化的效率较低,对砷的耐受性不强,达不到良好的对砷解毒效果。
8.因此,筛选一株对锰具有高氧化效率且对砷具有高耐受性的锰氧化菌是弥补当前不足,提高生物锰氧化物在砷解毒领域应用的必要措施。
9.鉴于此,特提出本发明。
技术实现要素:
10.鉴于此,本发明提供了一种锰氧化菌及其筛选方法和应用。
11.为实现上述目的,本发明的技术方案如下:
12.本发明提供了一种锰氧化菌,其属于摩根氏菌属(morganellamorganii),命名为摩根氏菌(morganella sp.)mnox-1,于2021年7月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22815。
13.具体地,该锰氧化菌为申请人从采集于湖南省长沙市洋湖湿地污泥中筛选和分离
得到,该菌现保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101;经鉴定,其16s rrna基因序列与 morganella morganii 16s rrna基因序列有99%的相似性。
14.本发明另一方面提供了上述锰氧化菌的筛选方法,包括:
15.s1、取污泥样本静置后的上清液,加入到含mnso4·
h2o和hepes 缓冲液的lb液体培养基中;
16.s2、恒温振荡培养5-9d后,通过lbb指示剂对培养基进行检验初筛。
17.进一步地,在上述技术方案中,所述锰氧化菌的筛选方法,还包括:
18.s3、将步骤s2中对lbb指示剂显蓝色的培养液稀释涂布分离于含mnso4·
h2o和hepes缓冲液的固体培养基中,恒温培养后,进一步通过lbb指示剂进行检验复筛,将对lbb指示剂显蓝色的进行分离和纯化,将得到的菌株与甘油按1∶1混匀后在-80℃下保藏。
19.具体地,在上述技术方案中,步骤s1中,lb液体培养基包括以下组分:
20.胰蛋白胨10g,酵母浸粉5g,氯化钠5g,蒸馏水1000ml,ph 为7,mnso4·
h2o 1mmol/l,hepes缓冲液20mmol/l。
21.具体地,在上述技术方案中,步骤s2中,lbb指示剂的配制方法如下:
22.称取0.04g lbb粉末,将其溶解于0.25ml的45mmol/l冰乙酸水溶液中,加入去离子水,定容至100ml,4℃避光保存。
23.在本发明的一个具体实施方式中,步骤s3中,含mnso4·
h2o和 hepes缓冲液的固体培养基的配置方法如下:
24.将胰蛋白胨10g、酵母浸粉5g、氯化钠5g和琼脂15g溶于1000 ml的蒸馏水中,调节ph为7,于灭菌锅121℃下灭菌20min,使用 0.22μm滤头过滤加入1mol/l mnso4·
h2o和1mol/l hepes缓冲液,使得mn
2
和hepes缓冲液的最终浓度分别为1mmol/l和20mmol/l,冷却至50℃后,于无菌操作台倒平板,固体平板冷凝后备用。
25.本发明又一方面还提供了含有上述锰氧化菌的菌剂。
26.本发明再一方面还提供了上述锰氧化菌或上述菌剂在制备氧化三价砷的生物锰氧化物中的应用。
27.本发明还一方面又提供了上述锰氧化菌或上述菌剂在氧化三价砷中的应用。
28.具体地,在上述氧化三价砷的应用中,所述锰氧化菌通过氧化mn
2
制得生物锰氧化物,通过生物锰氧化物将三价砷氧化为五价砷。
29.本发明与现有技术相比,具有以下优点:
30.(1)本发明所筛选得到的锰氧化菌是摩根氏菌属首次发现具有锰氧化能力的一株菌,且该菌的锰氧化能力较强,环境适应性好,具有极高的研究价值;
31.(2)本发明所提供的利用锰氧化菌氧化制备生物锰氧化物的方法具有操作简单和成本较低等优点,有利于其在砷解毒领域的应用。
附图说明
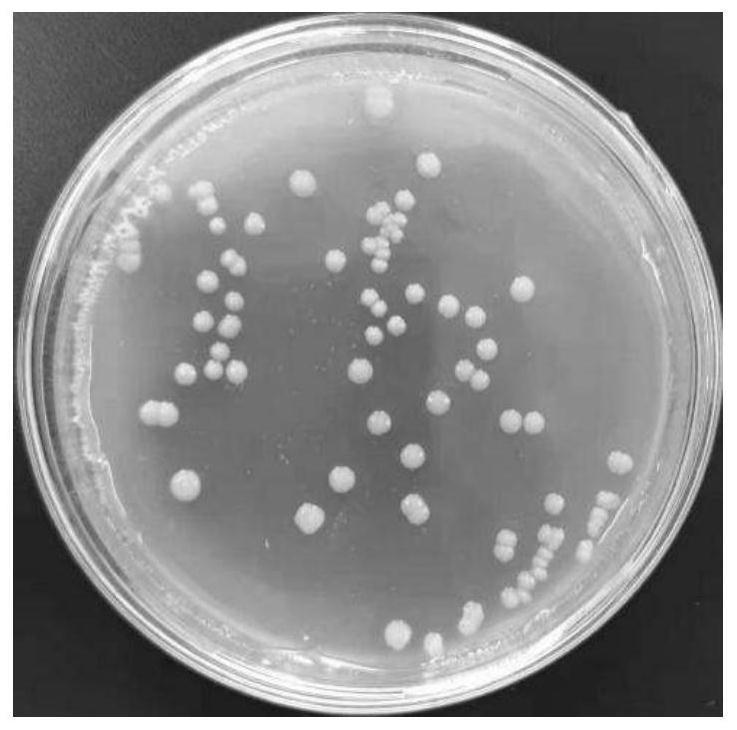
32.图1为本发明实施例中锰氧化菌的菌落形态图;
33.图2为本发明实施例中锰氧化菌的系统发育分析树;
34.图3为本发明实施例中锰氧化菌对1mmol/l锰氧化率图;
35.图4为本发明实施例中锰氧化菌在不同ph下的锰氧化率图;
36.图5为本发明实施例中锰氧化菌在不同ph下的锰氧化菌活性图;
37.图6为本发明实施例中锰氧化菌在不同二价锰含量下的锰氧化率图;
38.图7为本发明实施例中锰氧化菌在不同二价锰含量下的锰氧化菌活性图;
39.图8为本发明实施例中锰氧化菌产生的生物锰氧化物的sem照片;
40.图9为本发明实施例中锰氧化菌对100mg/las
3
氧化率图。
具体实施方式
41.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
42.应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
43.实施例中,如无特别说明,所用手段均为本领域常规的手段。
44.本文中所用的术语“包含”、“包括”或其任何其它变形,意在覆盖非排它性的包括。例如,包含所列要素的组合物、步骤、方法、制品或装置不必仅限于那些要素,而是可以包括未明确列出的其它要素或此种组合物、步骤、方法、制品或装置所固有的要素。
45.此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
46.若无特殊说明,本发明实施例中所用的原料均为市售产品。
47.一种锰氧化菌,于2021年7月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址:北京市朝阳区北辰西路1号院3 号,中国科学院微生物研究所,邮编100101,编号为cgmcc no.22815。
48.为了有助于进一步理解本发明,现结合优选实施例对本发明的技术方案进行详细说明。
49.实施例1锰氧化菌的筛选、分离与纯化
50.具体步骤如下:
51.(1)液体培养基的配制:
52.称取胰蛋白胨10g、酵母浸粉5g和氯化钠5g,加入到1000ml 蒸馏水中,调节ph为7,分装100ml于250ml锥形瓶,于灭菌锅121℃灭菌20min,使用0.22μm滤头过滤加入1mol/l的mnso4
·
h2o水溶液和1mol/l hepes缓冲液,并使得mn
2
和hepes缓冲液的最终浓度分别为1mmol/l和20mmol/l。
53.(2)固体培养基的配制:
54.称取胰蛋白胨10g、酵母浸粉5g、氯化钠5g和琼脂15g,加入到1000ml蒸馏水中,调节ph为7,于灭菌锅121℃灭菌20min,使用0.22μm滤头过滤加入1mol/l的mnso4
·
h2o水溶液和1mol/lhepes缓冲液,使得mn
2
和hepes缓冲液的最终浓度分别为1mmol/l 和20mmol/l,待培养基冷却至50℃时于无菌操作台倒平板,固体平板冷凝后备用。
55.(3)锰氧化菌的筛选与分离:
56.从湖南省长沙市洋湖湿地中采集污泥,静置后取上清液,按1%的接种量加入到步骤(1)中的液体培养基中,在30℃、150rpm的恒温摇床上震荡培养7天后,采用lbb指示剂定性检测是否产生锰氧化物,对lbb指示剂显示由无色变蓝色的培养液进行初步筛选。
57.其中,lbb指示剂的配制方法如下:称取0.04g lbb粉末,将其溶解于0.25ml的冰乙酸水溶液(45mmol/l),加入去离子水并定容至100ml,4℃避光保存。
58.(4)锰氧化菌的纯化
59.将步骤(3)中对lbb指示剂显蓝色的培养液稀释涂布分离于步骤(2)中的固体培养基中,置于30℃烘箱中恒温培养,观察菌落形态,采用lbb指示剂进行显色实验,对呈蓝色的菌落进行进一步划线分离和纯化,将纯化得到的菌株与甘油按1∶1混匀后保藏在-80℃的冰箱中。
60.实施例2锰氧化菌的形态特征和分子鉴定
61.形态特征:
62.如图1所示,结合扫描电镜结果,该菌株形状整体呈杆状,菌落形态为圆形,中心呈不透明乳白色,表面凸起湿润,边缘规则为棕色。
63.分子鉴定和系统发育进化树比对:
64.对分离纯化出来的锰氧化菌进行dna提取,采用magen公司生产出来的细菌dna提取试剂盒完成相关提取操作,之后进行pcr扩增,引物为细菌16s rdna通用引物(1492r
‑‘
ggttaccttgttacga ctt’,27f
‑‘
agagtttgatcmtggctcag’)。pcr产物的测序是由上海生物工程股份有限公司完成。将测序得到的16s rdna结果 (如seq id no:1所示)通过ncbi(美国国立生物技术信息中心) 的blast程序与已有16s rdna核酸序列进行相似性对比。采用mega4.0 软件进行系统发育进化树的分析与绘制,其系统发育进化树见图2。
65.序列结果分析显示,该锰氧化菌与morganella morganii相似性最高,鉴定其属于摩根氏菌属,并将其命名为mnox-1。
66.实施例3锰氧化菌mnox-1的锰氧化能力测定
67.(1)选取250ml锥形瓶,参照实施例1中步骤(1)的方式配制 100m1含锰液体培养基,即:称取胰蛋白胨10g、酵母浸粉5g和氯化钠5g,加入到1000ml蒸馏水中,调节ph为7,分装100ml于250ml 锥形瓶,于灭菌锅121℃灭菌20min,使用0.22μm滤头过滤加入1 mol/l的mnso4
·
h2o水溶液和1mol/l hepes缓冲液,并使得mn
2
和hepes缓冲液的最终浓度分别为1mmol/l和20mmol/l。
68.(2)按1%的接种量加入锰氧化菌于步骤(1)中的含锰液体培养基,将各锥形瓶放置于30℃,180rpm恒温摇床中振荡培养,每组3 个平行,1个空白对照;每隔24小时取样一次于10ml离心管,使用离心机8000rpm离心3min,吸取上清液,使用电感耦合等离子体发射光谱仪(icp-oes)测定培养液剩余mn
2
浓度,持续取样7天直至实验结束。
69.(3)锰氧化率的计算方法为:
70.锰氧化率=(初始锰含量-剩余锰含量)/初始锰含量*100%。
71.结果如图3所示,分析图3的结果可知,锰氧化菌对mn
2
氧化速度较快,1-2天时mn
2
被快速氧化,2-7天时mn
2
氧化逐渐趋于平稳,最大锰氧化率达到88.17%,具有极强的锰氧化能力。
72.实施例4不同ph、二价锰含量下的锰氧化能力测定
73.(1)不同ph条件下的锰氧化能力测定
74.参照实施例3中步骤(1)的方式配制含锰液体培养基,调节含锰液体培养基中的ph,使ph梯度分别为5、6、7、8和9,将100ml 含锰液体培养基加入到250ml锥形瓶中,将菌液
按1%的接种量接种到不同ph含锰液体培养基中,于180rpm,30℃的恒温摇床培养,每组3个平行,1个空白对照。
75.按照一定时间从不同培养基中取样,共取样7天,通过原子吸收光谱法测定过滤后离心管中的mn剩余量,通过紫外分光光度计测定 od600值,分别确定不同ph下锰氧化率及锰氧化菌活性。
76.如图4所示,锰氧化菌mnox-1在ph 5-9均有较好的锰氧化率,在72h左右均达到了80%左右的锰氧化率;其中,ph=5时锰氧化率略低,ph=6、7、8、9时的锰氧化率去除效果相似,表面该锰氧化菌氧化锰在中性偏碱环境氧化效率更好。
77.如图5所示,锰氧化菌活性在ph 5-9时活性相似,表明该菌适应性较广,酸性至碱性环境均能较好生长。
78.(2)不同二价锰含量下锰氧化能力测定
79.参照实施例3中步骤(1)的方式配制含锰液体培养基,调节含锰液体培养基中mn2 含量分别为1、5、10、15、20mmol/l,将100ml 含锰液体培养基加入到250ml锥形瓶中,将菌液按1%的接种量接种到不同二价锰含量液体培养基中,于180rpm,30℃的恒温摇床培养,每组3个平行,1个空白对照。
80.按照一定时间从不同培养基中取样,共取样7天,通过原子吸收光谱法测定过滤后离心管中的mn剩余量,通过紫外分光光度计测定 od600值,分别确定不同二价锰含量下锰氧化率及锰氧化菌活性。
81.如图6所示,锰氧化菌在mn
2
含量为1、5、10、15、20mmo/l 时锰氧化率差别很大,随着mn
2
含量增加,在5mmol/l时,锰氧化率达到最大,继续添加mn
2
含量,锰氧化率逐渐降低,在20mmol/l时,锰氧化率最低,仅为20%左右。
82.如图7所示,二价锰的含量变化对锰氧化菌活性有较大的影响,一定量的添加mn
2
对锰氧化菌的生长有一定促进作用,但是当mn
2
含量过多时,锰氧化菌生长则会受到明显抑制作用,如在mn
2
含量为 20mmol/l时,锰氧化菌生长明显较慢。
83.实施例5生物氧化锰的生成及对as
3
的氧化实验
84.(1)生物氧化锰的生成
85.参照实施例1中步骤(1)的方式配制100ml含锰液体培养基,即:称取胰蛋白胨10g、酵母浸粉5g和氯化钠5g,加入到1000ml蒸馏水中,调节ph为7,于灭菌锅121℃灭菌20min,使用0.22μm滤头过滤加入1mol/l的mnso4
·
h2o水溶液和1mol/l hepes缓冲液,并使得mn
2
和hepes缓冲液的最终浓度分别为1mmol/l和20mmol/l;按1%的接种量加入锰氧化菌于含锰液体培养基,于30℃,180rpm 恒温摇床中振荡培养7天,离心机8000rpm离心3min,弃去上清液,去离子水洗涤沉淀3次,所得沉淀即为生物锰氧化物。
86.(2)生物氧化锰的扫描电镜(sem)分析
87.生物氧化物是在含二价锰液体培养基中加入锰氧化菌形成,其扫描电镜图(sem)如图8所示,在10000倍的放大倍数下,扫描电镜显示生物氧化锰表面不规则,呈现条状或光滑晶石状,周围填充大量长条形锰氧化菌,这表明生物氧化锰是一种与锰氧化菌糅杂在一起的状态。
88.(3)生物锰氧化物对as
3
的氧化实验
89.参照实施例1中步骤(1)的方式配制100ml含锰液体培养基,即:称取胰蛋白胨10g、
酵母浸粉5g和氯化钠5g,加入到1000m1蒸馏水中,调节ph为7,于灭菌锅121℃灭菌20min,不同点在于,使用0.22μm滤头过滤加入1mol/l的mnso4
·
h2o水溶液、1mol/l hepes 缓冲液和as
3
溶液,并使得mn
2
、hepes缓冲液和as
3
的最终浓度分别为1mmol/l、20mmol/l和100mg/l;按1%的接种量加入锰氧化菌于上述含mn
2
、hepes缓冲液和as
3
的液体培养基,于30℃,180 rpm恒温摇床中振荡培养。
90.每隔24h进行取样,吸取1微升培养液稀释至10ml离心管,再吸取该稀释后10ml离心管中的1ml继续稀释至新的10ml离心管,共稀释1000倍,取样持续7天。
91.采用电感耦合等离子体质谱仪(icp-ms)对反应过程中as
3
/as
5
的含量进行测定。
92.如图9可以看出,本发明菌株产生的生物氧化锰对as
3
氧化较快,在初始反应3h后即可氧化50.98%的as
3
,并且随着时间的推移,as
3
逐渐被进一步氧化,并在7天后,对as
3
最终达到了74%左右的氧化效果。本发明菌株产生的锰氧化菌显示了对as
3
良好的氧化效果,可将as
3
氧化为毒性较小的as
5
,有利于在砷解毒领域应用。
93.综上所述,本发明筛选出了一株新型锰氧化菌,该锰氧化菌是摩根氏菌属中首次发现的具有锰氧化能力的细菌,且该菌锰氧化能力较强,对环境适应性较好,具有极高的研究价值;通过该菌生成的生物锰氧化物,可将as
3
氧化为as
5
,有利于应用于砷解毒领域,同时为生物锰氧化物可能存在的应用潜力提供理论依据。
94.应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。