dll3靶向抗体及其用途
相关申请的交叉引用
1.本技术要求2019年7月11日提交的美国临时专利申请号62/872,915的权益和优先权,将其全部内容通过引用并入本文。
技术领域
2.本发明技术总体上涉及特异性结合δ样蛋白3(dll3)的免疫球蛋白相关组合物(例如,抗体或其抗原结合片段)的制备以及所述免疫球蛋白相关组合物的用途。具体地,本发明技术涉及dll3结合抗体的制备及其在检测和治疗dll3相关癌症中的用途,所述癌症包括小细胞肺癌(sclc)、肺外神经内分泌癌和大细胞神经内分泌癌(lcnec)。政府支持声明
3.本发明是在由美国国立卫生研究院授予的ca213448下在美国政府支持下完成的。美国政府享有本发明的某些权利。
背景技术:
4.下文提供对本发明技术背景的说明仅仅是为了帮助理解本发明技术,并且不承认所述说明描述或构成针对本发明技术的现有技术。
5.肺神经内分泌肿瘤(lu-net)涵盖一个异质的肿瘤家族,分为四种组织学变体,即典型类癌(tc)、非典型类癌(ac)、大细胞神经内分泌癌(lcnec)和小细胞肺癌(sclc)。sclc和肺lcnec二者均是高级别和预后不良的肿瘤,其中在吸烟者中的发病率较高。与sclc相似,肺lcnec展现出生物学攻击行为。肺lcnec和sclc的存活曲线逐期重叠,并且此外存活率低于其他nsclc。即使在5年存活率范围为从27%至67%的患有潜在可切除i期肺癌的患者中,预后也很差。参见iyoda a.等人,j thorac cardiovasc surg.138:446
–
453(2009)。
技术实现要素:
6.在一个方面,本公开文本提供了一种抗体或其抗原结合片段,所述抗体或其抗原结合片段包含重链免疫球蛋白可变结构域(vh)和轻链免疫球蛋白可变结构域(v
l
),其中(a)所述vh包含选自以下的v
h-cdr1序列、v
h-cdr2序列和v
h-cdr3序列:(i)分别为seq id no:3、seq id no:4和seq id no:5;(ii)分别为seq id no:13、seq id no:14和seq id no:15;(iii)分别为seq id no:23、seq id no:24和seq id no:25;和(iv)分别为seq id no:33、seq id no:34和seq id no:35;和/或(b)所述v
l
包含选自以下的v
l-cdr1序列、v
l-cdr2序列和v
l-cdr3序列:(i)分别为seq id no:8、seq id no:9和seq id no:10;(ii)分别为seq id no:18、seq id no:19和seq id no:20;(iii)分别为seq id no:28、seq id no:29和seq id no:30;和(iv)分别为seq id no:38、seq id no:39和seq id no:40。在某些实施方案中,所述抗体或抗原结合片段包括以下特征中的一种或多种:(a)与seq id no:7、17、27或37中的任一个中存在的轻链免疫球蛋白可变结构域序列至少80%、至少85%、至少90%、至少95%或至少99%相同的轻链免疫球蛋白可变结构域序列;和/或(b)与seq id no:2、12、22或32
中的任一个中存在的重链免疫球蛋白可变结构域序列至少80%、至少85%、至少90%、至少95%或至少99%相同的重链免疫球蛋白可变结构域序列。
7.在另一个方面,本公开文本提供了包含重链免疫球蛋白可变结构域(vh)和轻链免疫球蛋白可变结构域(v
l
)的抗体或其抗原结合片段,其中:(a)所述vh包含选自以下的氨基酸序列:seq id no:2、seq id no:12、seq id no:22和seq id no:32;和/或(b)所述v
l
包含选自以下的氨基酸序列:seq id no:7、seq id no:17、seq id no:27和seq id no:37。在所述抗体或抗原结合片段的一些实施方案中,所述vh氨基酸序列和所述v
l
氨基酸序列选自:分别为seq id no:2和seq id no:7(7-i1-b);分别为seq id no:12和seq id no:17(2-c8-a);分别为seq id no:22和seq id no:27(10-o18-a);以及分别为seq id no:32和seq id no:37(6-g23-f)。
8.另外地或可替代地,在某些实施方案中,本发明技术的抗体或抗原结合片段与哺乳动物dll3多肽中存在的表位结合。所述表位可以是构象表位或非构象表位。另外地或可替代地,在一些实施方案中,所述哺乳动物dll3多肽包含选自以下的氨基酸序列:seq id no:50、seq id no:51、seq id no:52、seq id no:53和seq id no:54。在一些实施方案中,所述哺乳动物dll3多肽具有包含seq id no:50或seq id no:51的氨基酸残基27-492的氨基酸序列(例如,所述哺乳动物dll3多肽可以包含人dll3的细胞外结构域)。另外地或可替代地,在一些实施方案中,当所述抗体或抗原结合片段与细胞表面(例如,肿瘤细胞表面)上表达的dll3多肽结合时,所述抗体或抗原结合片段经历细胞内内化。
9.另外地或可替代地,在本文公开的任何实施方案中,所述抗体或抗原结合片段进一步包含选自以下的同种型的fc结构域:igg1、igg2、igg3、igg4、iga1、iga2、igm、igd和ige。另外地或可替代地,在本文公开的任何实施方案中,所述抗原结合片段选自fab、f(ab')2、fab'、scfv和fv。另外地或可替代地,在一些实施方案中,本发明技术的抗体或抗原结合片段是单克隆抗体、嵌合抗体、人源化抗体或双特异性抗体。
10.在一个方面,本公开文本提供了编码本文所述的任何抗体或抗原结合片段的重组核酸序列。在一些实施方案中,所述重组核酸序列选自:seq id no:1、6、11、16、21、26、31和36。
11.在另一个方面,本公开文本提供了包含本文公开的任何重组核酸序列的宿主细胞或载体。
12.在一个方面,本公开文本提供了组合物,所述组合物包含本发明技术的抗体或抗原结合片段和药学上可接受的载体,其中所述抗体或抗原结合片段任选地与选自以下的药剂缀合:同位素、染料、色原(chromagen)、造影剂、药物、毒素、细胞因子、酶、酶抑制剂、激素、激素拮抗剂、生长因子、放射性核素、金属、脂质体、纳米颗粒、rna、dna或其任何组合。
13.在一个方面,本公开文本提供了一种用于治疗有需要的受试者的dll3相关癌症的方法,所述方法包括向所述受试者施用治疗有效量的本发明技术的抗体或抗原结合片段,其中所述抗体或抗原结合片段与至少一种另外的治疗剂缀合。此类另外的治疗剂的例子包括但不限于同位素、药物、毒素、细胞因子、酶、酶抑制剂、激素、激素拮抗剂、生长因子、放射性核素、金属、脂质体、纳米颗粒、rna、dna或其任何组合。所述dll3相关癌症可以是小细胞肺癌、大细胞神经内分泌癌、肺神经内分泌癌、肺外神经内分泌癌或黑色素瘤。
14.在另一个方面,本公开文本提供了一种用于检测生物样品中dll3蛋白表达水平的
方法,所述方法包括使所述生物样品与本文所述的抗体或抗原结合片段接触,其中所述抗体或抗原结合片段与可检测标记缀合;以及检测所述生物样品中由所述可检测标记生成的信号。
15.本文还公开了用于检测和/或治疗dll3相关癌症的试剂盒,所述试剂盒包含至少一种本发明技术的免疫球蛋白相关组合物(例如,本文所述的任何抗体或抗原结合片段)或其功能性变体(例如,取代变体)以及使用说明书。在某些实施方案中,所述免疫球蛋白相关组合物与一种或多种可检测标记偶联。在一个实施方案中,所述一种或多种可检测标记包括放射性标记、荧光标记或发色标记。
16.另外地或可替代地,在一些实施方案中,所述试剂盒进一步包含与本文所述的抗dll3免疫球蛋白相关组合物特异性结合的二抗。在一些实施方案中,所述二抗与选自放射性标记、荧光标记或发色标记的至少一种可检测标记偶联。
附图说明
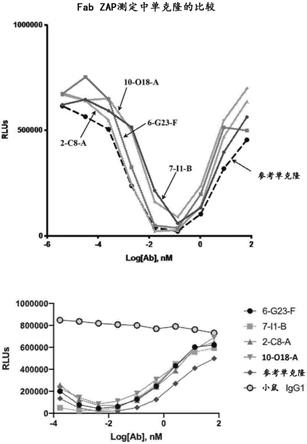
17.图1示出了进行fab zap测定(一种基于细胞毒性的内化测定)以测定通过指定抗体内化dll3的结果。将参考dll3单克隆抗体sc16用作阳性对照。参见wo2015127407。所有测试的抗dll3抗体均展现出与参考单克隆抗体可比较的杀伤活性。在较高浓度的抗dll3抗体下观察到钩状效应,因为游离的抗dll3与细胞结合的抗dll3竞争fab zap。
18.图2a-图2d示出了抗体7-i1-b(图2a)、6-g23-f(图2b)、10-o18-a(图2c)和2-c8-a(图2d)的结合曲线,如经由octet htx在25℃下使用pbs 0.1%bsa 0.02%tween 20作为结合缓冲液和10mm甘氨酸(ph 1.7)作为再生缓冲液测量的。将单克隆抗体(各5μg/ml)加载到抗小鼠fc传感器上,并且将加载的传感器浸入以200nm起始浓度采用7个连续1:3稀释度的重组人dll3蛋白(氨基酸ala27-ala479,目录号9749-dl,r&d systems)的指定稀释液中。对于每个dll3稀释液,示出了实际测量值和曲线拟合。
19.图2e示出了本文所述的四种单克隆抗体(6-g23-f、2-c8-a、7-i1-b和10-o18-a)的解离常数(kd)值,其是使用如图2a-图2d所示的结合曲线并且应用单价(1:1)结合模型计算的。
20.图3a示出了抗体7-i1-b的vh结构域的核苷酸序列和氨基酸序列,分别表示为seq id no:1和seq id no:2。v
h cdr1(seq id no:3)以粗体字体显示,v
h cdr2(seq id no:4)加下划线,并且v
h cdr3(seq id no:5)以斜体、下划线字体指示。
21.图3b示出了抗体7-i1-b的v
l
结构域的核苷酸序列和氨基酸序列,分别表示为seq id no:6和seq id no:7。v
l cdr1(seq id no:8)以粗体字显示,v
l cdr2(seq id no:9)加下划线,并且v
l cdr3(seq id no:10)以斜体、下划线字体指示。
22.图4a示出了抗体2-c8-a的vh结构域的核苷酸序列和氨基酸序列,分别表示为seq id no:11和seq id no:12。v
h cdr1(seq id no:13)以粗体字体显示,v
h cdr2(seq id no:14)加下划线,并且v
h cdr3(seq id no:15)以斜体、下划线字体指示。
23.图4b示出了抗体2-c8-a的v
l
结构域的核苷酸序列和氨基酸序列,分别表示为seq id no:16和seq id no:17。v
l cdr1(seq id no:18)以粗体字显示,v
l cdr2(seq id no:19)加下划线,并且v
l cdr3(seq id no:20)以斜体、下划线字体指示。
24.图5a示出了抗体10-o18-a的vh结构域的核苷酸序列和氨基酸序列,分别表示为
seq id no:21和seq id no:22。v
h cdr1(seq id no:23)以粗体字体显示,v
h cdr2(seq id no:24)加下划线,并且v
h cdr3(seq id no:25)以斜体、下划线字体指示。
25.图5b示出了抗体10-o18-a的v
l
结构域的核苷酸序列和氨基酸序列,分别表示为seq id no:26和seq id no:27。v
l cdr1(seq id no:28)以粗体字显示,v
l cdr2(seq id no:29)加下划线,并且v
l cdr3(seq id no:30)以斜体、下划线字体指示。
26.图6a示出了抗体6-g23-f的vh结构域的核苷酸序列和氨基酸序列,分别表示为seq id no:31和seq id no:32。v
h cdr1(seq id no:33)以粗体字体显示,v
h cdr2(seq id no:34)加下划线,并且v
h cdr3(seq id no:35)以斜体、下划线字体指示。
27.图6b示出了抗体6-g23-f的v
l
结构域的核苷酸序列和氨基酸序列,分别表示为seq id no:36和seq id no:37。v
l cdr1(seq id no:38)以粗体字显示,v
l cdr2(seq id no:39)加下划线,并且v
l cdr3(seq id no:40)以斜体、下划线字体指示。
28.图7显示了6-g23-f、10-o18-a和2-c8-a单克隆抗体(mab)选择性结合dll3,但是不结合dll1或dll4。7-i1-b mab结合dll3和dll4二者,但是不结合dll1。
29.图8a示出了智人(homo sapiens)δ样典型notch配体3(dll3)同种型1的核苷酸序列和氨基酸序列,分别表示为seq id no:55和seq id no:50。图8b示出了智人δ样典型notch配体3(dll3)同种型2的核苷酸序列和氨基酸序列,分别表示为seq id no:56和seq id no:51。
具体实施方式
30.应当理解,为了提供对本发明技术的实质性理解,在各个细节层次上描述了本发明技术的某些方面、模式、实施方案、变型和特征。
31.在实践本发明方法时,使用了分子生物学、蛋白质生物化学、细胞生物学、免疫学、微生物学和重组dna中的许多常规技术。参见例如,sambrook和russell编辑(2001)molecular cloning:a laboratory manual,第3版;丛书ausubel等人编辑(2007)current protocols in molecular biology;丛书methods in enzymology(academic press,inc.,n.y.);macpherson等人(1991)pcr 1:a practical approach(irl press at oxford university press);macpherson等人(1995)pcr 2:a practical approach;harlow和lane编辑(1999)antibodies,a laboratory manual;freshney(2005)culture of animal cells:a manual of basic technique,第5版;gait编辑(1984)oligonucleotide synthesis;美国专利号4,683,195;hames和higgins编辑(1984)nucleic acid hybridization;anderson(1999)nucleic acid hybridization;hames和higgins编辑(1984)transcription and translation;immobilized cells and enzymes(irl press(1986));perbal(1984)a practical guide to molecular cloning;miller和calos编辑(1987)gene transfer vectors for mammalian cells(cold spring harbor laboratory);makrides编辑(2003)gene transfer and expression in mammalian cells;mayer和walker编辑(1987)immunochemical methods in cell and molecular biology(academic press,伦敦);以及herzenberg等人编辑(1996)weir’s handbook of experimental immunology。检测和测量多肽基因表达产物水平(即基因翻译水平)的方法是本领域中熟知的,并且包括使用多肽检测方法,如抗体检测和量化技术。(还参见,
strachan和read,human molecular genetics,第二版(john wiley and sons,inc.,ny,1999))。
32.dll3在高级别肺神经内分泌肿瘤(包括sclc和lcnec)中选择性表达。在sclc和lcnec患者来源的异种移植肿瘤中观察到dll3的表达增加,并且在原发性肿瘤中也得到证实。参见saunders等人,sci translational medicine 7(302):302ra136(2015)。在肺外神经内分泌癌(包括前列腺神经内分泌癌)中也观察到dll3的表达增加(puca等人,sci transl med 11(484):pii:eaav0891(2019))。虽然dll3在此类肿瘤细胞表面表达,但是它在正常组织中不表达。本公开文本提供了免疫球蛋白相关组合物(例如,抗体或其抗原结合片段),其在与肿瘤细胞上的dll3结合时内化,并且因此可用于将毒性有效载荷递送至这些肿瘤细胞。本发明技术的免疫球蛋白相关组合物可用于检测或治疗有需要的受试者的dll3相关癌症的方法中。因此,本发明方法的各个方面涉及抗dll3抗体的制备、表征和操作。本发明技术的免疫球蛋白相关组合物可以单独使用或与用于治疗癌症的另外的治疗剂组合使用。在一些实施方案中,所述免疫球蛋白相关组合物是人源化抗体、嵌合抗体或双特异性抗体。定义
33.下文提供了如本说明书中使用的某些术语的定义。除非另外定义,否则本文使用的所有技术和科学技术语均通常具有与本发明技术所属的领域中的普通技术人员通常所理解的相同含义。
34.如在本说明书和所附权利要求中所用,单数形式“一种/一个”(“a”)、“一种/一个”(“an”)和“所述”(“the”)包括复数指示物,除非上下文另外明确规定。例如,对“一种/一个细胞”的提及包括两种/个或更多种/个细胞的组合等。通常,本文所用的命名和下文所述的细胞培养、分子遗传学、有机化学、分析化学和核酸化学和杂交中的实验室程序是本领域中熟知的和常用的那些。
35.如本文所用,关于数字的术语“约”通常视为包括落在所述数字任一方向(大于或小于)的1%、5%或10%范围内的数字,除非上下文另外说明或另外明显(这样的数字低于可能值的0%或超过可能值的100%的情况除外)。
36.如本文所用,向受试者“施用”药剂或药物包括向受试者引入或递送化合物以执行其预期功能的任何途径。施用可以通过任何合适的途径进行,所述合适的途径包括口服、鼻内、肠胃外(静脉内、肌肉内、腹膜内或皮下)、直肠、鞘内、瘤内或局部。施用包括自施用和由另一个人施用。
[0037]“佐剂”是指引起免疫系统刺激的一种或多种物质。在这种情况下,佐剂用于增强对一种或多种疫苗抗原或抗体的免疫应答。可以在疫苗的施用之前、与疫苗的施用组合或在疫苗的施用之后将佐剂施用至受试者。用作佐剂的化学化合物的例子包括铝化合物、油、嵌段聚合物、免疫刺激复合物、维生素和矿物质(例如,维生素e、维生素a、硒和维生素b12)、quil a(皂苷)、细菌和真菌细胞壁组分(例如,脂多糖、脂蛋白和糖蛋白)、激素、细胞因子和共刺激因子。
[0038]
如本文所用,术语“氨基酸”用于指含有至少一个氨基和至少一个羧基的任何有机分子。典型地,至少一个氨基在相对于羧基的α位。术语“氨基酸”包括天然存在的氨基酸和合成氨基酸以及以与天然存在的氨基酸相似的方式起作用的氨基酸类似物和氨基酸模拟
物。天然存在的氨基酸是由遗传密码编码的氨基酸,以及后来被修饰的那些氨基酸,例如羟脯氨酸、γ-羧基谷氨酸和o-磷酸丝氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构(即,α碳与氢、羧基、氨基和r基团结合)的化合物,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。此类类似物具有经修饰的r基团(例如正亮氨酸)或经修饰的肽骨架,但是保留与天然存在的氨基酸相同的基本化学结构。氨基酸模拟物是指具有与氨基酸的通用化学结构不同的结构,但是以与天然存在的氨基酸类似的方式起作用的化学化合物。氨基酸在本文中可以由其通常已知的三字母符号或由iupac-iub生化命名委员会推荐的单字母符号表示。
[0039]
如本文所用,术语“抗体”共同地指代免疫球蛋白或免疫球蛋白样分子,包括例如但不限于iga、igd、ige、igg和igm、其组合、以及在任何脊椎动物中例如在哺乳动物(如人、山羊、兔和小鼠)以及非哺乳动物物种中在免疫应答期间产生的类似分子(如鲨鱼免疫球蛋白)。如本文所用,“抗体”(包括完整免疫球蛋白)和“抗原结合片段”与目的分子(或一组高度类似的目的分子)特异性结合,而基本上排除与其他分子的结合(例如,对于目的分子的结合常数比对于生物样品中的其他分子的结合常数大至少103m-1
、大至少104m-1
或大至少105m-1
的抗体和抗体片段)。术语“抗体”还包括基因工程化形式如嵌合抗体(例如,人源化鼠抗体)、异源缀合抗体(如双特异性抗体)。还参见pierce catalog和handbook,1994-1995(pierce chemical co.,罗克福德,伊利诺伊州);kuby,j.,immunology,第3版,w.h.freeman&co.,new york,1997。
[0040]
更具体地,抗体是指特异性地识别并结合抗原表位的至少包含轻链免疫球蛋白可变区或重链免疫球蛋白可变区的多肽配体。抗体由重链和轻链构成,它们各自具有可变区,称为重链可变(vh)区和轻链可变(v
l
)区。vh区和v
l
区共同负责结合由抗体识别的抗原。通常,免疫球蛋白具有通过二硫键相互连接的重(h)链和轻(l)链。有两种类型的轻链,λ(lambda)和κ(kappa)。有五种主要的重链类别(或同种型):igm、igd、igg、iga和ige,它们决定了抗体分子的功能活性。每条重链和轻链均含有恒定区和可变区(所述区也称为“结构域”)。组合起来,重链可变区和轻链可变区特异性结合抗原。轻链可变区和重链可变区含有被三个高变区(也称为“互补决定区”或“cdr”)打断的“框架”区。已经定义了框架区和cdr的范围(参见kabat等人,sequences of proteins of immunological interest,u.s.department of health and human services,1991,将其通过引用特此并入)。kabat数据库目前在线上维护。不同轻链或重链的框架区的序列在物种内相对保守。抗体的框架区(即组成性轻链和重链的组合框架区)主要采用β-折叠构象,并且cdr形成连接β-折叠结构的环,并且在一些情况下所述环形成β-折叠结构的一部分。因此,框架区起到形成支架的作用,所述支架通过链间非共价相互作用使cdr以正确取向定位。
[0041]
cdr主要负责与抗原表位的结合。每条链的cdr通常称为cdr1、cdr2和cdr3,从n末端开始依次编号,并且通常还依据其中定位特定cdr的链来标识。因此,v
h cdr3位于发现它所在的抗体的重链的可变结构域中,而v
l cdr1是来自发现它所在的抗体的轻链的可变结构域的cdr1。结合dll3蛋白的抗体将具有特定的vh区和v
l
区序列,从而具有特定的cdr序列。具有不同特异性(即对于不同抗原的不同结合位点)的抗体具有不同的cdr。尽管不同的抗体之间cdr不同,但是cdr内仅有限数量的氨基酸位置直接参与抗原结合。cdr内的这些位置称为特异性决定残基(sdr)。如本文所用,“免疫球蛋白相关组合物”是指抗体(包括单克隆
抗体、多克隆抗体、人源化抗体、嵌合抗体、重组抗体、多特异性抗体、双特异性抗体等)以及抗体片段。抗体或其抗原结合片段与抗原特异性结合。
[0042]
如本文所用,术语“抗体相关多肽”意指包括单链抗体在内的抗原结合抗体片段,其可以单独包含一个或多个可变区或包含一个或多个可变区与以下多肽要素中的全部或部分的组合:抗体分子的铰链区、ch1、ch2和ch3结构域。所述技术中还包括一个或多个可变区和铰链区、ch1、ch2和ch3结构域的任何组合。可用于本方法中的抗体相关分子,例如是但不限于fab、fab'和f(ab')2、fd、单链fv(scfv)、单链抗体、二硫键连接的fv(sdfv)和包含v
l
或vh结构域的片段。例子包括:(i)fab片段,即由v
l
、vh、c
l
和ch1结构域组成的单价片段;(ii)f(ab')2片段,即包含由铰链区的二硫桥连接的两个fab片段的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的v
l
和vh结构域组成的fv片段;(v)dab片段(ward等人,nature 341:544-546,1989),其由vh结构域组成;和(vi)分离的互补决定区(cdr)。因此,“抗体片段”或“抗原结合片段”可以包含全长抗体的一部分,通常是其抗原结合区或可变区。抗体片段或抗原结合片段的例子包括fab、fab'、f(ab')2和fv片段;双抗体;线性抗体;单链抗体分子;以及由抗体片段形成的多特异性抗体。
[0043]
如本文所用,“双特异性抗体”或“bsab”是指可以同时与具有不同结构的两个靶标(例如,两个不同的靶抗原、同一靶抗原上的两个不同表位)结合的抗体。多种不同的双特异性抗体结构是本领域已知的。在一些实施方案中,双特异性抗体中的每个抗原结合部分都包括vh和/或v
l
区;在一些此类实施方案中,vh和/或v
l
区是在特定单克隆抗体中发现的那些。在一些实施方案中,双特异性抗体含有两个抗原结合部分,每个抗原结合部分包括来自不同单克隆抗体的vh和/或v
l
区。在一些实施方案中,双特异性抗体含有两个抗原结合部分,其中两个抗原结合部分中的一个包括具有vh和/或v
l
区的免疫球蛋白分子,所述vh和/或v
l
区含有来自第一单克隆抗体的cdr;并且另一个抗原结合部分包括具有vh和/或v
l
区的抗体片段(例如,fab、f(ab')、f(ab')2、fd、fv、dab、scfv等),所述vh和/或v
l
区含有来自第二单克隆抗体的cdr。
[0044]
如本文所用,术语“缀合的”是指通过本领域技术人员已知的任何方法使两个分子缔合。合适的缔合类型包括化学键和物理结合。化学键包括例如共价键和配位键。物理结合包括例如氢键、偶极相互作用、范德华力、静电相互作用、疏水性相互作用和芳环堆积。
[0045]
如本文所用,术语“双抗体”是指具有两个抗原结合位点的小抗体片段,所述片段包含在同一多肽链中与轻链可变结构域(v
l
)连接的重链可变结构域(vh)(v
h v
l
)。通过使用过短而不允许在同一链上的两个结构域之间配对的接头,迫使所述结构域与另一条链的互补结构域配对,并且产生两个抗原结合位点。双抗体更充分地描述在例如ep404,097;wo 93/11161;和hollinger等人,proc.natl.acad.sci.usa,90:6444-6448(1993)中。
[0046]
如本文所用,术语“单链抗体”或“单链fv(scfv)”是指fv片段的两个结构域v
l
和vh的抗体融合分子。单链抗体分子可以包括具有多个单独分子的聚合物,例如二聚体、三聚体或其他聚合物。此外,尽管fv片段的两个结构域v
l
和vh由分开的基因编码,但是它们可以使用重组方法通过合成的接头进行连接,从而将它们制成单个蛋白质链,在所述单个蛋白质链中v
l
和vh区配对形成单价分子(称为单链fv(scfv))。bird等人(1988)science 242:423-426和huston等人(1988)proc.natl.acad sci.usa 85:5879-5883。此类单链抗体可以通过重组技术或完整抗体的酶促切割或化学切割来制备。
[0047]
任何上述抗体片段是使用本领域技术人员已知的常规技术获得的,并且以与完整抗体相同的方式针对结合特异性和中和活性筛选所述片段。
[0048]
如本文所用,“抗原”是指抗体(或其抗原结合片段)可以选择性地结合的分子。靶抗原可以是蛋白质、碳水化合物、核酸、脂质、半抗原或其他天然存在或合成的化合物。在一些实施方案中,所述靶抗原可以是多肽(例如,包括dll3细胞外结构域的dll3多肽)。也可以将抗原施用至动物以在动物中产生免疫应答。
[0049]
术语“抗原结合片段”是指完整免疫球蛋白结构的片段,所述片段具有负责与抗原结合的多肽部分。可用于本发明技术中的抗原结合片段的例子包括scfv、(scfv)2、scfv-fc、fab、fab'和f(ab')2,但不限于此。
[0050]“结合亲和力”意指分子(例如,抗体)的单个结合位点与分子的结合配偶体(例如,抗原或抗原肽)之间的总非共价相互作用的强度。分子x对其配偶体y的亲和力通常可以由解离常数(kd)表示。亲和力可以通过本领域已知的标准方法(包括本文所述的那些)测量。低亲和力复合物含有通常倾向于容易从抗原解离的抗体,而高亲和力复合物含有通常倾向于更长时间地保持与抗原结合的抗体。
[0051]
如本文所用,术语“生物样品”意指源自活细胞的样品材料。生物样品可以包括从受试者分离的组织、细胞、细胞的蛋白质或膜提取物、和生物流体(例如,腹水或脑脊液(csf)),以及存在于受试者体内的组织、细胞和流体。本发明技术的生物样品包括但不限于取自以下的样品:乳腺组织、肾组织、子宫颈、子宫内膜、头或颈、胆囊、腮腺组织、前列腺、脑、脑下垂体、肾脏组织、肌肉、食道、胃、小肠、结肠、肝脏、脾脏、胰腺、甲状腺组织、心脏组织、肺组织、膀胱、脂肪组织、淋巴结组织、子宫、卵巢组织、肾上腺组织、睾丸组织、扁桃体、胸腺、血液、毛发、颊、皮肤、血清、血浆、csf、精子、前列腺液、精液、尿、粪便、汗液、唾液、痰、粘液、骨髓、淋巴和泪液。生物样品也可以从内脏的活检或从癌症获得。生物样品可以从受试者获得以进行诊断或研究;或者可以从未患病的个体获得,作为对照或用于基础研究。样品可以通过标准方法获得,所述标准方法包括例如静脉穿刺和手术活检。在某些实施方案中,所述生物样品是痰液样品或通过针吸活检或手术活检获得的组织样品。
[0052]
如本文所用,术语“cdr移植抗体”意指这样的抗体,在所述抗体中“受体”抗体的至少一个cdr被来自“供体”抗体的具有所需抗原特异性的cdr“移植物”替代。
[0053]
如本文所用,术语“嵌合抗体”意指这样的抗体,在所述抗体中使用重组dna技术将来自一个物种的单克隆抗体的fc恒定区(例如,小鼠fc恒定区)用来自另一物种的抗体的fc恒定区(例如,人fc恒定区)替代。一般参见,robinson等人,pct/us86/02269;akira等人,欧洲专利申请184,187;taniguchi,欧洲专利申请171,496;morrison等人,欧洲专利申请173,494;neuberger等人,wo 86/01533;cabilly等人美国专利号4,816,567;cabilly等人,欧洲专利申请0125,023;better等人,science 240:1041-1043,1988;liu等人,proc.natl.acad.sci.usa 84:3439-3443,1987;liu等人,j.immunol 139:3521-3526,1987;sun等人,proc.natl.acad.sci.usa 84:214-218,1987;nishimura等人,cancer res 47:999-1005,1987;wood等人,nature 314:446-449,1885;以及shaw等人,j.natl.cancer inst.80:1553-1559,1988。
[0054]
如本文所用,术语“共有fr”意指共有免疫球蛋白序列中的框架(fr)抗体区域。抗体的fr区不与抗原接触。
[0055]
如本文所用,“对照”是实验中出于比较目的使用的替代样品。对照可以是“阳性的”或“阴性的”。例如,在实验目的是确定治疗剂对特定类型疾病的治疗的功效的相关性的情况下,通常使用阳性对照(已知展现出所需治疗效果的化合物或组合物)和阴性对照(不接受治疗或接受安慰剂的受试者或样品)。
[0056]
如本文所用,术语“有效量”是指足以实现期望的治疗和/或预防效果的量,例如导致预防或减少本文所述疾病或病症或者与本文所述疾病或病症相关的一种或多种体征或症状的量。在治疗或预防应用的情况下,施用至受试者的组合物的量将根据组合物、疾病的程度、类型和严重程度以及根据个体的特征(如一般健康状况、年龄、性别、体重和药物耐受性)而变化。技术人员将能够根据这些和其他因素确定合适的剂量。所述组合物也可以与一种或多种另外的治疗化合物组合施用。在本文所述的方法中,可以将治疗组合物施用至具有本文所述疾病或病症的一种或多种体征或症状的受试者。如本文所用,组合物的“治疗有效量”指其中疾病或病症的生理作用得到改善或消除的组合物水平。可以将治疗有效量在一次或多次施用中施用。
[0057]“分离的”或“纯化的”多肽或肽基本上不含来自衍生药剂的细胞或组织来源的细胞物质或其他污染性多肽,或基本上不含化学合成时的化学前体或其他化学物质。例如,本发明技术的分离的抗dll3抗体或抗原结合片段将不含会干扰药剂的诊断或治疗用途的物质。此类干扰物质可能包括酶、激素和其他蛋白质和非蛋白质溶质。
[0058]
如本文所用,术语“表位”意指能够与抗体特异性地结合的蛋白质决定簇。表位通常由分子的化学活性表面基团(如氨基酸或糖侧链)组成并且通常具有特定的三维结构特征,以及特定的电荷特征。构象表位和非构象表位的差别在于:在变性溶剂的存在下,与构象表位而不是非构象表位的结合丧失。在一些实施方案中,dll3蛋白的“表位”是所述蛋白质中与本发明技术的抗dll3抗体特异性地结合的区域。在一些实施方案中,所述表位是构象表位或非构象表位。为了筛选与表位结合的抗dll3抗体,可以进行常规的交叉阻断测定,如描述于以下文献中的测定:antibodies,a laboratory manual,cold spring harbor laboratory,harlow和david lane编辑(1988)。此测定可用于确定抗dll3抗体是否与本发明技术的抗dll3抗体结合相同的位点或表位。可替代地或另外地,可以通过本领域已知的方法进行表位作图。例如,抗体序列可以如通过丙氨酸扫描被诱变,以鉴定接触残基。在不同的方法中,对应于dll3蛋白的不同区域的肽可以用于与多种测试抗体、或与一种测试抗体和具有经表征或已知表位的抗体的竞争测定中。
[0059]
如本文所用,“表达”包括以下中的一项或多项:基因转录为前体mrna;前体mrna的剪接和其他加工以产生成熟mrna;mrna稳定性;成熟mrna翻译成蛋白质(包括密码子使用和trna可用性);以及糖基化和/或翻译产物的其他修饰(如果适当的表达和功能需要)。
[0060]
如本文所用,术语“基因”意指含有用于rna产物的经调节的生物合成的所有信息的dna区段,包括启动子、外显子、内含子和控制表达的其他非翻译区。
[0061]
如本文所用,“同源性”或“同一性”或“相似性”是指两个肽之间或两个核酸分子之间的序列相似性。可以通过比较每个序列中的位置来确定同源性,所述序列可以出于比较目的被比对。当所比较序列中的位置被相同的碱基或氨基酸占据时,则所述分子在该位置是同源的。序列之间的同源性程度随所述序列共享的匹配或同源位置数而变。多核苷酸或多核苷酸区域(或多肽或多肽区域)与另一序列具有一定百分比(例如,至少60%、65%、
70%、75%、80%、85%、90%、95%、98%或99%)的“序列同一性”意味着,当比对时,在比较两个序列中,该百分比的碱基(或氨基酸)是相同的。可以使用本领域已知的软件程序确定此比对以及同源性或序列同一性百分比。在一些实施方案中,将默认参数用于比对。一种比对程序是blast,使用默认参数。具体而言,程序是blastn和blastp,使用以下默认参数:遗传密码=标准;过滤器=无;链=两条;截止值=60;期望值=10;矩阵=blosum62;描述=50个序列;排序方式=高得分(high score);数据库=非冗余,genbank embl ddbj pdb genbank cds翻译 swissprotein spupdate pir。这些程序的详细信息可以在国家生物技术信息中心(national center for biotechnology information)找到。生物学上等同的多核苷酸是具有指定同源性百分比并编码具有相同或相似生物活性的多肽的那些多核苷酸。如果两个序列彼此共享小于40%的同一性或小于25%的同一性,则将所述序列视为“无关的”或“非同源的”。
[0062]
如本文所用,非人(例如,鼠)抗体的“人源化”形式是嵌合抗体,其含有衍生自非人免疫球蛋白的最小序列。对于大部分,人源化抗体是人免疫球蛋白,其中受体的高变区残基被来自非人物种(如小鼠、大鼠、兔或非人灵长类动物)的具有所需的特异性、亲和力和能力的高变区残基(供体抗体)替代。在一些实施方案中,人免疫球蛋白的fv框架区(fr)残基被相应的非人残基替代。此外,人源化抗体可以包含在受体抗体或供体抗体中未发现的残基。进行这些修饰以进一步完善抗体性能如结合亲和力。通常,人源化抗体将包含至少一个、通常两个可变结构域(例如,fab、fab'、f(ab')2或fv)的基本上全部,其中全部或基本上全部的高变环对应于非人免疫球蛋白的那些高变环,并且全部或基本上全部的fr区是人免疫球蛋白共有fr序列的那些fr区,但所述fr区可以包括改善结合亲和力的一个或多个氨基酸取代。fr中这些氨基酸取代的数量通常在h链中不超过6个,并且在l链中不超过3个。所述人源化抗体任选地也可以包含免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白恒定区的至少一部分。关于进一步的细节,参见jones等人,nature 321:522-525(1986);riechmann等人,nature 332:323-327(1988);以及presta,curr.op.struct.biol.2:593-596(1992)。参见例如,ahmed和cheung,febs letters 588(2):288-297(2014);saxena和wu,frontiers in immunology 7:580(2016)。
[0063]
如本文所用,术语“高变区”是指抗体中负责抗原结合的氨基酸残基。高变区通常包含来自“互补决定区”或“cdr”的氨基酸残基(例如,v
l
中的残基24-34(l1)、50-56(l2)和89-97(l3)前后,以及vh中的31-35b(h1)、50-65(h2)和95-102(h3)前后(kabat等人,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.(1991))和/或来自“高变环”的那些残基(例如,v
l
中的残基26-32(l1)、50-52(l2)和91-96(l3),以及vh中的26-32(h1)、52a-55(h2)和96-101(h3)(chothia和lesk j.mol.biol.196:901-917(1987))。
[0064]
如本文所用,当在两个或更多个核酸或多肽序列的上下文中使用时,术语“相同”或“同一性”百分比是指相同的两个或更多个序列或子序列或者具有指定百分比的相同氨基酸残基或核苷酸(即,当在比较窗口或特定区域上比较和比对以求最大对应时,在指定区域上(例如,编码本文所述抗体的核苷酸序列或本文所述抗体的氨基酸序列)约60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性)的两个或更多个序列或子序列,如使用采用下文所述默认参数的blast或blast 2.0
序列比较算法或通过手动比对和视觉检查(例如ncbi网站)测量的。然后,此类序列被称为“基本上相同”。此术语也指或可以适用于测试序列的互补体。所述术语还包括具有缺失和/或添加的序列,以及具有取代的那些序列。在一些实施方案中,在长度为至少约25个氨基酸或核苷酸或长度为50-100个氨基酸或核苷酸的区域中存在同一性。
[0065]
如本文所用,术语“完整抗体”或“完整免疫球蛋白”意指具有通过二硫键相互连接的至少两个重(h)链多肽和两个轻(l)链多肽的抗体。每条重链由重链可变区(在本文中缩写为hcvr或vh)和重链恒定区构成。重链恒定区由三个结构域ch1、ch2和ch3构成。每条轻链由轻链可变区(在本文中缩写为lcvr或v
l
)和轻链恒定区构成。轻链恒定区由一个结构域c
l
构成。vh和v
l
区域可以进一步细分为具有高变性的区域,称为互补决定区(cdr),散布有更保守的区域,称为框架区(fr)。每个vh和v
l
由三个cdr和四个fr构成,按照以下顺序从氨基末端到羧基末端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,所述宿主组织或因子包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(clq)。
[0066]
如本文所用,术语“个体”、“患者”或“受试者”可以是单独生物体、脊椎动物、哺乳动物或人。在一些实施方案中,所述个体、患者或受试者是人。
[0067]
如本文所用,术语“单克隆抗体”是指从基本同质的抗体群体获得的抗体,即,除了可能少量存在的可能自然发生的突变之外,构成所述群体的单独抗体是相同的。例如,单克隆抗体可以是源自单一克隆(包括任何真核、原核或噬菌体克隆)而不是产生它的方法的抗体。单克隆抗体组合物对特定表位展示出单一结合特异性和亲和力。单克隆抗体针对单一抗原位点具有高度特异性。此外,与通常包括针对不同决定簇(表位)的不同抗体的常规(多克隆)抗体制剂相比,每种单克隆抗体是针对抗原上的单一决定簇。修饰语“单克隆的”指示抗体的特征为是从基本上同质的抗体群体获得的,并且不应解释为需要通过任何特定方法产生所述抗体。可以使用本领域已知的多种技术来制备单克隆抗体,所述多种技术包括例如但不限于杂交瘤、重组和噬菌体展示技术。例如,待根据本发明方法使用的单克隆抗体可以通过最初由kohler等人,nature 256:495(1975)描述的杂交瘤方法制备,或者可以通过重组dna方法(参见例如美国专利号4,816,567)制备。例如,“单克隆抗体”也可以使用clackson等人,nature 352:624-628(1991)和marks等人,j.mol.biol.222:581-597(1991)描述的技术从噬菌体抗体文库分离。
[0068]
如本文所用,术语“药学上可接受的载体”旨在包括与药物施用相容的任何和全部溶剂、分散介质、包衣、抗细菌化合物和抗真菌化合物、等渗化合物和吸收延迟化合物等。药学上可接受的载体及其配制品是本领域技术人员已知的,并且描述于例如remington's pharmaceutical sciences(第20版,a.gennaro,2000,lippincott编辑,williams&wilkins,philadelphia,pa.)中。
[0069]
如本文所用,术语“多克隆抗体”意指源自至少两(2)种不同的产抗体细胞系的抗体的制剂。此术语的使用包括至少两(2)种抗体的制剂,所述制剂含有与抗原的不同表位或区域特异性结合的抗体。
[0070]
如本文所用,术语“多核苷酸”或“核酸”意指任何rna或dna,其可以是未修饰的或修饰的rna或dna。多核苷酸包括但不限于单链和双链dna、作为单链和双链区域的混合物的
dna、单链和双链rna、作为单链和双链区域的混合物的rna以及包含dna和rna的杂交分子,所述dna和rna可以是单链的或更通常是双链的或者单链和双链区域的混合物。此外,多核苷酸是指包含rna或dna或者rna和dna两者的三链区域。术语多核苷酸还包括含有一个或多个修饰碱基的dna或rna,以及出于稳定性或其他原因对骨架进行修饰的dna或rna。
[0071]
如本文所用,术语“多肽”、“肽”和“蛋白质”在本文可互换使用,意指包含通过肽键或经修饰的肽键(即肽电子等排体)彼此连接的两个或更多个氨基酸的聚合物。多肽既是指通常称为肽、糖肽或寡聚物的短链,也是指通常称为蛋白质的较长链。多肽可以含有除了20种基因编码的氨基酸之外的氨基酸。多肽包括通过天然过程(如翻译后加工)或通过本领域熟知的化学修饰技术修饰的氨基酸序列。
[0072]
如本文所用,障碍或病症的“预防”(“prevention”或“preventing”)是指这样的化合物,在统计样品中,相对于未处理的对照样品,在处理的样品中减少所述障碍或病症的发生,或相对于未处理的对照样品,延迟所述障碍或病症的一种或多种症状的发作或降低所述障碍或病症的一种或多种症状的严重性。
[0073]
如本文所用,术语“重组”当关于例如细胞或核酸、蛋白质或载体使用时,指示所述细胞、核酸、蛋白质或载体已通过引入异源核酸或蛋白质或者改变天然核酸或蛋白质而被修饰,或指示所述材料源自经如此修饰的细胞。因此,例如,重组细胞表达在所述细胞的天然(非重组)形式内未发现的基因,或者表达原本异常表达、表达不足或完全不表达的天然基因。
[0074]
如本文所用,术语“分开”治疗使用是指通过不同途径同时或基本上同时施用至少两种活性成分。
[0075]
如本文所用,术语“顺序”治疗使用是指在不同时间施用至少两种活性成分,施用途径相同或不同。更具体地,顺序使用是指一种活性成分的整个施用在另外一种或多种活性成分的施用开始之前。因此,可以在施用另外一种或多种活性成分之前几分钟、几小时或几天内施用一种活性成分。在这种情况下,没有同时治疗。
[0076]
如本文所用,术语“同时”治疗使用是指通过相同途径并且同时或基本上同时施用至少两种活性成分。
[0077]
如本文所用,“特异性结合”是指识别并结合另一个分子(例如抗原)但基本上不识别并结合其他分子的分子(例如抗体或其抗原结合片段)。如本文所用,术语“特异性结合”、“特异性地结合”或“特异于”特定分子(例如,多肽或多肽上的表位)可以例如通过一种分子对于其所结合的分子具有约10-4
m、10-5
m、10-6
m、10-7
m、10-8
m、10-9
m、10-10
m、10-11
m或10-12
m的kd来展现。术语“特异性地结合”也可以指这样的结合,其中分子(例如,抗体或其抗原结合片段)与特定多肽(例如,dll3多肽)或特定多肽上的表位结合,而基本上不与任何其他多肽或多肽表位结合。
[0078]
如本文所用,术语“治疗剂”旨在意指当以有效量存在时对有需要的受试者产生所需治疗效果的化合物。
[0079]
如本文所用的“治疗”(“treating”或“treatment”)涵盖治疗受试者如人的本文所述疾病或障碍,并且包括:(i)抑制疾病或障碍,即阻止其发展;(ii)缓解疾病或障碍,即引起所述障碍的消退;(iii)减缓所述障碍的进展;和/或(iv)抑制、缓解或减缓所述疾病或障碍的一种或多种症状的进展。在一些实施方案中,治疗意指与疾病相关的症状例如得到缓
和、减少、治愈或处于缓解状态。
[0080]
还应理解,如本文所述的障碍的各种治疗方式旨在意指“基本上的”,其包括完全治疗但也不到完全治疗,并且其中实现了一些生物学或医学有关的结果。所述治疗可以是针对慢性疾病的连续延长治疗,或者是针对急性病症治疗的单次或几次施用。
[0081]
考虑了本文描述的抗dll3抗体的一种或多种氨基酸序列修饰。例如,可能希望改善抗体的结合亲和力和/或其他生物学特性。通过将适当的核苷酸变化引入抗体核酸中或通过肽合成来制备抗dll3抗体的氨基酸序列变体。此类修饰包括例如抗体氨基酸序列内的残基缺失和/或插入和/或取代。只要获得的抗体具有所需的特性,就可以进行缺失、插入和取代的任何组合以获得目的抗体。修饰还包括蛋白质糖基化模式的变化。进行取代诱变的最感兴趣的位点包括高变区,但是也考虑fr改变。“保守取代”显示在下表中。显示在下表中。
[0082]
一个类型的取代变体涉及取代亲本抗体的一个或多个高变区残基。用于生成此类取代变体的一种便利方法涉及使用噬菌体展示的亲和力成熟。特别地,使数个高变区位点(例如6-7个位点)突变,以在每个位点产生所有可能的氨基酸取代。将如此产生的抗体变体
id no:1-40)。下表还提供了本文公开的抗体的vh和v
l
的氨基酸序列以及cdr序列。
[0089]
在一个方面,本公开文本提供了一种抗体或其抗原结合片段,所述抗体或其抗原结合片段包含重链免疫球蛋白可变结构域(vh)和轻链免疫球蛋白可变结构域(v
l
),其中(a)所述vh包含选自以下的v
h-cdr1序列、v
h-cdr2序列和v
h-cdr3序列:(i)分别为seq id no:3、seq id no:4和seq id no:5;(ii)分别为seq id no:13、seq id no:14和seq id no:15;(iii)分别为seq id no:23、seq id no:24和seq id no:25;和(iv)分别为seq id no:33、seq id no:34和seq id no:35;和/或(b)所述v
l
包含选自以下的v
l-cdr1序列、v
l-cdr2序列和v
l-cdr3序列:(i)分别为seq id no:8、seq id no:9和seq id no:10;(ii)分别为seq id no:18、seq id no:19和seq id no:20;(iii)分别为seq id no:28、seq id no:29和seq id no:30;和(iv)分别为seq id no:38、seq id no:39和seq id no:40。在一些实施方案中,所述抗体进一步包含任何同种型的fc结构域,所述同种型例如但不限于igg(包括igg1、igg2、igg3和igg4)、iga(包括iga1和iga2)、igd、ige或igm和igy。恒定区序列的非限制性例子包括:
[0090]
人igd恒定区,uniprot:p01880(seq id no:41)
[0091]
aptkapdvfpiisgcrhpkdnspvvlaclitgyhptsvtvtwymgtqsqpqrtfpeiqrrdsyymtssqlstplqqwrqgeykcvvqhtaskskkeifrwpespkaqassvptaqpqaegslakattapattrntgrggeekkkekekeeqeeretktpecpshtqplgvylltpavqdlwlrdkatftcfvvgsdlkdahltwevagkvptggveegllerhsngsqsqhsrltlprslwnagtsvtctlnhpslppqrlmalrepaaqapvklslnllassdppeaaswllcevsgfsppnillmwledqrevntsgfaparpppqpgsttfwawsvlrvpappspqpatytcvvshedsrtllnasrslevsyvtdhgpmk
[0092]
人igg1恒定区,uniprot:p01857(seq id no:42)
[0093]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0094]
人igg2恒定区,uniprot:p01859(seq id no:43)
[0095]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkccvecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdisvewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0096]
人igg3恒定区,uniprot:p01860(seq id no:44)
[0097]
astkgpsvfplapcsrstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtytcnvnhkpsntkvdkrvelktplgdtthtcprcpepkscdtpppcprcpepkscdtpppcprcpepkscdtpppcprcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfkwyvdgvevhnaktkpreeqynstfrvvsvltvlhqdwlngkeykckvsnkalpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewessgqpennynttppmldsdgsfflyskltvdksrwqqgnifscsvmhealhnrftqkslslspgk
[0098]
人igm恒定区,uniprot:p01871(seq id no:45)
[0099]
gsasaptlfplvscenspsdtssvavgclaqdflpdsitlswkyknnsdisstrgfpsvlrggkyaatsqvllpskdvmqgtdehvvckvqhpngnkeknvplpviaelppkvsvfvpprdgffgnprksklicqatgfsprqiqvswlregkqvgsgvttdqvqaeakesgpttykvtstltikesdwlgqsmftcrvdhrgltfqqnassmcvpdqdtairvfaippsfasifltkstkltclvtdlttydsvtiswtrqngeavkthtniseshpnatfsavgeasiceddwnsgerftctvthtdlpsplkqtisrpkgvalhrpdvyllppareqlnlresatitclvtgfspadvfvqwmqrgqplspekyvtsapmpepqapgryfahsiltvseeewntgetytcvahealpnrvtertvdkstgkptlynvslvmsdtagtcy
[0100]
人igg4恒定区,uniprot:p01861(seq id no:46)
[0101]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcpscpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
[0102]
人iga1恒定区,uniprot:p01876(seq id no:47)
[0103]
asptspkvfplslcstqpdgnvviaclvqgffpqeplsvtwsesgqgvtarnfppsqdasgdlyttssqltlpatqclagksvtchvkhytnpsqdvtvpcpvpstpptpspstpptpspscchprlslhrpaledlllgseanltctltglrdasgvtftwtpssgksavqgpperdlcgcysvssvlpgcaepwnhgktftctaaypesktpltatlsksgntfrpevhllpppseelalnelvtltclargfspkdvlvrwlqgsqelprekyltwasrqepsqgtttfavtsilrvaaedwkkgdtfscmvghealplaftqktidrlagkpthvnvsvvmaevdgtcy
[0104]
人iga2恒定区,uniprot:p01877(seq id no:48)
[0105]
asptspkvfplsldstpqdgnvvvaclvqgffpqeplsvtwsesgqnvtarnfppsqdasgdlyttssqltlpatqcpdgksvtchvkhytnpsqdvtvpcpvpppppcchprlslhrpaledlllgseanltctltglrdasgatftwtpssgksavqgpperdlcgcysvssvlpgcaqpwnhgetftctaahpelktpltanitksgntfrpevhllpppseelalnelvtltclargfspkdvlvrwlqgsqelprekyltwasrqepsqgtttfavtsilrvaaedwkkgdtfscmvghealplaftqktidrmagkpthvnvsvvmaevdgtcy
[0106]
人igκ恒定区,uniprot:p01834(seq id no:49)
[0107]
tvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0108]
在一些实施方案中,本发明技术的免疫球蛋白相关组合物包含与seq id no:41-48至少80%、至少85%、至少90%、至少95%、至少99%或100%相同的重链恒定区。另外地或可替代地,在一些实施方案中,本发明技术的免疫球蛋白相关组合物包含与seq id no:49至少80%、至少85%、至少90%、至少95%、至少99%或100%相同的轻链恒定区。在一些实施方案中,本发明技术的免疫球蛋白相关组合物与dll3的细胞外结构域结合。在一些实施方案中,所述表位是构象表位。
[0109]
在另一个方面,本公开文本提供了一种分离的免疫球蛋白相关组合物(例如,抗体或其抗原结合片段),所述分离的免疫球蛋白相关组合物包含含有seq id no:2、seq id no:12、seq id no:22、seq id no:32或其具有一个或多个保守氨基酸取代的变体的重链免疫球蛋白可变结构域(vh)氨基酸序列。
[0110]
另外地或可替代地,在一些实施方案中,本发明技术的免疫球蛋白相关组合物包含含有seq id no:7、seq id no:17、seq id no:27、seq id no:37或其具有一个或多个保守氨基酸取代的变体的轻链免疫球蛋白可变结构域(v
l
)氨基酸序列。
[0111]
在一些实施方案中,本发明技术的免疫球蛋白相关组合物包含选自以下的重链免疫球蛋白可变结构域(vh)氨基酸序列和轻链免疫球蛋白可变结构域(v
l
)氨基酸序列:分别为seq id no:2和seq id no:7(7-i1-b);seq id no:12和seq id no:17(2-c8-a);seq id no:22和seq id no:27(10-o18-a);以及seq id no:32和seq id no:37(6-g23-f)。
[0112]
在免疫球蛋白相关组合物的上述实施方案中的任一个中,hc和lc免疫球蛋白可变结构域序列形成与dll3的细胞外结构域结合的抗原结合位点。在免疫球蛋白相关组合物的上述实施方案中的任一个中,hc和lc免疫球蛋白可变结构域序列形成与dll3结合的抗原结合位点并且促进所述免疫球蛋白相关组合物的内化。在一些实施方案中,所述表位是构象表位。
[0113]
在一些实施方案中,hc和lc免疫球蛋白可变结构域序列是同一多肽链的组分。在其他实施方案中,hc和lc免疫球蛋白可变结构域序列是不同多肽链的组分。在某些实施方案中,所述抗体是全长抗体。
[0114]
在一些实施方案中,本发明技术的免疫球蛋白相关组合物与至少一种dll3多肽特异性地结合。在一些实施方案中,本发明技术的免疫球蛋白相关组合物以约10-3
m、10-4
m、10-5
m、10-6
m、10-7
m、10-8
m、10-9
m、10-10
m、10-11
m或10-12
m的解离常数(kd)结合至少一种dll3多肽。在某些实施方案中,所述免疫球蛋白相关组合物是单克隆抗体、嵌合抗体、人源化抗体或双特异性抗体。在一些实施方案中,所述抗体包含人抗体框架区。
[0115]
在某些实施方案中,所述免疫球蛋白相关组合物包括以下特征中的一种或多种:(a)与seq id no:7、17、27或37中的任一个中存在的轻链免疫球蛋白可变结构域序列至少80%、至少85%、至少90%、至少95%或至少99%相同的轻链免疫球蛋白可变结构域序列;和/或(b)与seq id no:2、12、22或32中的任一个中存在的重链免疫球蛋白可变结构域序列至少80%、至少85%、至少90%、至少95%或至少99%相同的重链免疫球蛋白可变结构域序列。在另一个方面,本文提供的免疫球蛋白相关组合物中的一个或多个氨基酸残基被另一个氨基酸取代。取代可以是如本文所定义的“保守取代”。
[0116]
在某些实施方案中,所述免疫球蛋白相关组合物包含含有选自n297a和k322a的一个或多个氨基酸取代的igg1恒定区。另外地或可替代地,在一些实施方案中,所述免疫球蛋白相关组合物包含含有s228p突变的igg4恒定区。
[0117]
在一些方面,本文所述的抗dll3免疫球蛋白相关组合物含有结构修饰以促进快速结合和细胞吸收和/或缓慢释放。在一些方面,本发明技术的抗dll3免疫球蛋白相关组合物(例如,抗体)可以在ch2恒定重链区中含有缺失,以促进快速结合和细胞吸收和/或缓慢释放。在一些方面,fab片段用于促进快速结合和细胞吸收和/或缓慢释放。在一些方面,f(ab)'2片段用于促进快速结合和细胞吸收和/或缓慢释放。
[0118]
在一个方面,本发明技术提供了一种核酸序列,所述核酸序列编码本文所述的任何免疫球蛋白相关组合物。本文还公开了编码本文所述的抗体中的任一种的重组核酸序列。在一些实施方案中,所述核酸序列选自seq id no:1、6、11、16、21、26、31和36。
[0119]
在另一个方面,本发明技术提供了一种宿主细胞或表达载体,所述宿主细胞或表达载体表达编码本文所述的免疫球蛋白相关组合物中的任一种的任何核酸序列。
[0120]
本发明技术的免疫球蛋白相关组合物(例如,抗dll3抗体)可以是单特异性的、双特异性的、三特异性的或具有更大的多特异性。多特异性抗体可以对一种或多种dll3多肽的不同表位具有特异性,或者可以对一种或多种dll3多肽以及对异源组合物(如异源多肽或固体支持物材料)两者均具有特异性。参见例如wo 93/17715;wo92/08802;wo 91/00360;wo 92/05793;tutt等人,j.immunol.147:60-69(1991);美国专利号5,573,920;4,474,893;5,601,819;4,714,681;4,925,648;6,106,835;kostelny等人,j.immunol.148:1547-1553(1992)。在一些实施方案中,所述免疫球蛋白相关组合物是嵌合的。在某些实施方案中,所述免疫球蛋白相关组合物是人源化的。
[0121]
本发明技术的免疫球蛋白相关组合物可以进一步在n-末端或c-末端与异源多肽重组融合,或者与多肽或其他组合物化学缀合(包括共价和非共价缀合)。例如,本发明技术的免疫球蛋白相关组合物可以与可用作检测测定中的标记的分子和效应分子(如异源多肽、药物或毒素)重组融合或缀合。参见例如,wo 92/08495;wo 91/14438;wo 89/12624;美国专利号5,314,995;和ep 0 396 387。
[0122]
在本发明技术的免疫球蛋白相关组合物的上述实施方案中的任何一个中,所述抗体或抗原结合片段可以任选地与选自以下的药剂缀合:同位素、染料、色原、造影剂、药物、毒素、细胞因子、酶、酶抑制剂、激素、激素拮抗剂、生长因子、放射性核素、金属、脂质体、纳米颗粒、rna、dna或其任何组合。在一些实施方案中,本发明技术的抗体或抗原结合片段可以与药学上可接受的载体组合。对于化学键或物理结合,免疫球蛋白相关组合物上的官能团通常与药剂上的官能团缔合。可替代地,药剂上的官能团与免疫球蛋白相关组合物上的官能团缔合。
[0123]
药剂上的官能团和免疫球蛋白相关组合物上的官能团可以直接缔合。例如,药剂上的官能团(例如巯基)可以与免疫球蛋白相关组合物上的官能团(例如巯基)缔合以形成二硫键。可替代地,官能团可以通过交联剂(即,接头)缔合。交联剂的一些例子描述如下。交联剂可以附接至药剂或免疫球蛋白相关组合物。缀合物中的药剂或免疫球蛋白相关组合物的数量也受到对方上存在的官能团数量的限制。例如,与缀合物缔合的药剂的最大数量取决于免疫球蛋白相关组合物上存在的官能团的数量。可替代地,与药剂缔合的免疫球蛋白相关组合物的最大数量取决于药剂上存在的官能团的数量。
[0124]
在又另一个实施方案中,缀合物包含与一种药剂缔合的一种免疫球蛋白相关组合物。在一个实施方案中,缀合物包含与至少一种免疫球蛋白相关组合物化学键合(例如缀合)的至少一种药剂。可以通过本领域技术人员已知的任何方法将药剂与免疫球蛋白相关组合物化学键合。例如,药剂上的官能团可以直接附接至免疫球蛋白相关组合物上的官能团。合适的官能团的一些例子包括例如氨基、羧基、巯基、马来酰亚胺、异氰酸酯、异硫氰酸酯和羟基。
[0125]
也可以通过交联剂(如二醛、碳二亚胺、二马来酰亚胺等)将药剂与免疫球蛋白相
关组合物化学键合。交联剂可以例如从伊利诺伊州罗克福德的pierce biotechnology,inc.获得。pierce biotechnology,inc.网站可以提供帮助。另外的交联剂包括以下文献中描述的铂交联剂:荷兰阿姆斯特丹kreatech biotechnology,b.v.的美国专利号5,580,990;5,985,566;和6,133,038。
[0126]
可替代地,药剂和免疫球蛋白相关组合物上的官能团可以是相同的。同双官能交联剂通常用于交联相同的官能团。同双官能交联剂的例子包括egs(即乙二醇双[琥珀酰亚胺基琥珀酸酯])、dss(即二琥珀酰亚胺基辛二酸酯)、dma(即己二亚胺酸二甲酯.2hcl)、dtssp(即3,3'-二硫代双[磺基琥珀酰亚胺基丙酸酯])、dpdpb(即1,4-二-[3'-(2'-吡啶基二硫代)-丙酰胺基]丁烷)和bmh(即双马来酰亚胺己烷)。此类同双官能交联剂也可从pierce biotechnology,inc.获得。
[0127]
在其他情况下,从免疫球蛋白相关组合物切割药剂可能是有益的。上述pierce biotechnology,inc.的网站还可以为本领域技术人员在选择合适的交联剂方面提供帮助,所述交联剂可以通过例如细胞中的酶切割。由此,可以将药剂与免疫球蛋白相关组合物分离。可切割的接头的例子包括smpt(即4-琥珀酰亚胺基氧基羰基-甲基-a-[2-吡啶基二硫代]甲苯)、磺基-lc-spdp(即磺基琥珀酰亚胺基6-(3-[2-吡啶基二硫代]-丙酰胺基)己酸酯)、lc-spdp(即琥珀酰亚胺基6-(3-[2-吡啶基二硫代]-丙酰胺基)己酸酯)、磺基-lc-spdp(例如磺基琥珀酰亚胺基6-(3-[2-吡啶基二硫代]-丙酰胺基)己酸酯)、spdp(即n-琥珀酰亚胺基3-[2-吡啶基二硫代]-丙酰胺基己酸酯)和aedp(即3-[(2-氨基乙基)二硫代]丙酸hcl)。
[0128]
在另一个实施方案中,缀合物包含与至少一种与免疫球蛋白相关组合物物理结合的至少一种药剂。可以采用本领域技术人员已知的任何方法将药剂与免疫球蛋白相关组合物物理结合。例如,可以通过本领域技术人员已知的任何方法将免疫球蛋白相关组合物和药剂混合。混合的顺序并不重要。例如,可以通过本领域技术人员已知的任何方法将药剂与免疫球蛋白相关组合物物理混合。例如,可以将免疫球蛋白相关组合物和药剂放置在容器中,并且通过例如摇动容器进行搅拌,以混合免疫球蛋白相关组合物和药剂。
[0129]
免疫球蛋白相关组合物可以通过本领域技术人员已知的任何方法进行修饰。例如,如上所述,可以通过交联剂或官能团来修饰免疫球蛋白相关组合物。a.制备本发明技术的抗dll3抗体的方法
[0130]
概述。首先,选择靶多肽,可以产生针对所述靶多肽的本发明技术的抗体。例如,可以针对全长dll3蛋白或dll3蛋白的胞外结构域的一部分产生抗体。用于产生针对此类靶多肽的抗体的技术是本领域技术人员熟知的。此类技术的例子包括但不限于涉及展示文库、异种或人小鼠、杂交瘤等的技术。在本发明技术范围内的靶多肽包括能够引发免疫应答的源自含有胞外结构域的dll3蛋白的任何多肽。
[0131]
应当理解,针对dll3蛋白及其片段的重组工程化抗体和抗体片段(例如抗体相关多肽)适合于根据本公开文本使用。
[0132]
可以经受本文所述技术的抗dll3抗体包括单克隆抗体和多克隆抗体,以及抗体片段,如fab、fab'、f(ab')2、fd、scfv、双抗体、抗体轻链、抗体重链和/或抗体片段。已经描述了可用于高产量产生含抗体fv的多肽(例如fab
′
和f(ab
′
)2抗体片段)的方法。参见美国专利号5,648,237。
[0133]
通常,抗体是从起源物种获得的。更特别地,获得了对靶多肽抗原具有特异性的起源物种抗体的轻链、重链或两者的可变部分的核酸或氨基酸序列。起源物种是可用于产生本发明技术的抗体或抗体文库的任何物种,例如大鼠、小鼠、兔、鸡、猴、人等。
[0134]
噬菌体或噬菌粒展示技术是可用于衍生本发明技术抗体的技术。用于产生和克隆单克隆抗体的技术是本领域技术人员熟知的。编码本发明技术的抗体的序列的表达可以在大肠杆菌中进行。
[0135]
由于核酸编码序列的简并性,编码与天然存在的蛋白质的那些氨基酸序列基本相同的氨基酸序列的其他序列可用于本发明技术的实践中。这些序列包括但不限于包括编码上述多肽的全部或部分核酸序列在内的核酸序列,所述核酸序列通过编码序列内功能等同氨基酸残基的不同密码子的取代而发生改变,从而产生沉默变化。应当理解,根据本发明技术的免疫球蛋白的核苷酸序列容忍如通过标准方法计算的高达25%的序列同源性变异(“current methods in sequence comparison and analysis,”macromolecule sequencing and synthesis,selected methods and applications,第127-149页,1998,alan r.liss,inc.),只要这种变体形成识别dll3蛋白的有效抗体即可。例如,多肽序列内的一个或多个氨基酸残基可以被具有相似极性的另一个氨基酸取代,所述另一个氨基酸充当功能等同物,从而导致沉默改变。序列内氨基酸的取代基可以选自所述氨基酸所属的类别的其他成员。例如,非极性(疏水性)氨基酸包括丙氨酸、亮氨酸、异亮氨酸、缬氨酸、脯氨酸、苯丙氨酸、色氨酸和甲硫氨酸。极性中性氨基酸包括甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺和谷氨酰胺。带正电的(碱性)氨基酸包括精氨酸、赖氨酸和组氨酸。带负电的(酸性)氨基酸包括天冬氨酸和谷氨酸。在本发明技术范围内还包括蛋白质或其片段或衍生物,所述蛋白质或其片段或衍生物在翻译过程中或翻译后进行差异性修饰,例如通过糖基化、蛋白水解切割、与抗体分子或其他细胞配体的连接等来进行。另外,可以使编码免疫球蛋白的核酸序列在体外或体内突变,以产生和/或破坏序列的翻译、起始和/或终止,或者在编码区产生变异和/或形成新的限制性核酸内切酶位点或破坏先前存在的所述位点,以促进进一步的体外修饰。可以使用本领域中已知的任何诱变技术,包括但不限于体外定点诱变(j.biol.chem.253:6551,use of tab linkers(pharmacia))等。
[0136]
多克隆抗血清和免疫原的制备。产生本发明技术的抗体或抗体片段的方法通常包括用纯化的dll3蛋白或其片段或用表达dll3蛋白或其片段的细胞对受试者(通常是非人受试者,如小鼠或兔)进行免疫。合适的免疫原性制剂可以含有例如重组表达的dll3蛋白或化学合成的dll3肽。使用多克隆和单克隆抗体制备的标准技术,可以将dll3蛋白的细胞外结构域或其部分或片段用作免疫原以产生与dll3蛋白或其部分或片段结合的抗dll3抗体。
[0137]
全长dll3蛋白或其片段可作为片段用作免疫原。在一些实施方案中,dll3片段包含dll3的细胞外结构域,使得针对所述肽产生的抗体与dll3蛋白形成特异性免疫复合物。
[0138]
dll3的细胞外结构域的长度为466个氨基酸,跨越全长dll3蛋白的氨基酸27-492。在一些实施方案中,所述抗原性dll3肽包含至少5、8、10、15、20、30、40、50、60、70、80、90、100、150、200、250、300、350、400或450个氨基酸残基。取决于用途和根据本领域技术人员熟知的方法,有时需要较长的抗原肽而不是较短的抗原肽。给定表位的多聚体有时比单体更有效。
[0139]
如果需要的话,可以通过与载体蛋白(如钥孔戚血蓝蛋白(klh)或卵清蛋白(ova))
enzymol(1981)73:3-46)。使用标准方法筛选杂交瘤将产生具有不同特异性(即针对不同表位)和亲和力的单克隆抗体。具有所需特性(例如,dll3结合)的所选单克隆抗体可以如杂交瘤表达地使用,可以将其与分子(如聚乙二醇(peg))结合以改变其特性,或者可以将编码所述单克隆抗体的cdna以各种方式进行分离、测序和操纵。可以将合成的树型体(dendromeric)树添加到反应性氨基酸侧链例如赖氨酸,以增强dll3蛋白的免疫原性特性。另外,cpg-二核苷酸技术可用于增强dll3蛋白的免疫原性特性。其他操纵包括将促进抗体在储存过程中或在施用至受试者后的不稳定性的特定氨基酰基残基取代或缺失,以及亲和力成熟技术以改善dll3蛋白的抗体的亲和力。
[0144]
杂交瘤技术。在一些实施方案中,本发明技术的抗体是由杂交瘤产生的抗dll3单克隆抗体,所述杂交瘤包括获自转基因非人动物(例如转基因小鼠)的b细胞,所述转基因非人动物具有包含与永生化细胞融合的人重链转基因和轻链转基因的基因组。杂交瘤技术包括本领域已知的并且在以下文献中传授的那些:harlow等人,antibodies:a laboratory manual cold spring harbor laboratory,cold spring harbor,ny,349(1988);hammerling等人,monoclonal antibodies and t-cell hybridomas,563-681(1981)。用于产生杂交瘤和单克隆抗体的其他方法是本领域技术人员熟知的。
[0145]
噬菌体展示技术。如上所指出,可以通过应用重组dna技术和噬菌体展示技术来产生本发明技术的抗体。例如,可以使用本领域已知的各种噬菌体展示方法来制备抗dll3抗体。在噬菌体展示方法中,功能性抗体结构域展示在噬菌体颗粒的表面上,所述噬菌体颗粒携带编码所述功能性抗体结构域的多核苷酸序列。通过直接用抗原(通常是结合或捕获到固体表面或珠粒上的抗原)选择,从库或组合抗体文库(例如人或鼠)选择具有所需结合特性的噬菌体。这些方法中使用的噬菌体通常是丝状噬菌体,其包括具有fab、fv或二硫键稳定的fv抗体结构域的fd和m13,所述结构域与噬菌体基因iii或基因viii蛋白重组融合。此外,方法适合于fab表达文库的构建(参见例如huse等人,science246:1275-1281,1989),以快速有效地鉴定对dll3多肽具有所需特异性的单克隆fab片段,例如多肽或其衍生物、片段、类似物或同源物。可以用于制造本发明技术的抗体的噬菌体展示方法的其他例子包括以下文献中所披露的那些:huston等人,proc.natl.acad.sci u.s.a.,85:5879-5883,1988;chaudhary等人,proc.natl.acad.sci u.s.a.,87:1066-1070,1990;brinkman等人,j.immunol.methods 182:41-50,1995;ames等人,j.immunol.methods 184:177-186,1995;kettleborough等人,eur.j.immunol.24:952-958,1994;persic等人,gene 187:9-18,1997;burton等人,advances in immunology 57:191-280,1994;pct/gb91/01134;wo 90/02809;wo 91/10737;wo 92/01047;wo 92/18619;wo 93/11236;wo 95/15982;wo 95/20401;wo 96/06213;wo 92/01047(医学研究委员会等人);wo 97/08320(morphosys);wo 92/01047(cat/mrc);wo 91/17271(affymax)以及美国专利号5,698,426、5,223,409、5,403,484、5,580,717、5,427,908、5,750,753、5,821,047、5,571,698、5,427,908、5,516,637、5,780,225、5,658,727和5,733,743。lohning的美国专利号6,753,136已经描述了用于通过经由二硫键附接多肽而在噬菌体粒子表面上展示多肽的方法。如上述参考文献中所述,在噬菌体选择后,可以分离来自噬菌体的抗体编码区,并且将其用于产生完整抗体(包括人抗体)或任何其他所需的抗原结合片段,并在任何所需宿主(包括哺乳动物细胞、昆虫细胞、植物细胞、酵母和细菌)中表达。例如,重组产生fab、fab
′
he f(ab
′
)2片段的技术也可
以使用本领域已知的方法来利用,所述方法如以下文献中披露的那些:wo 92/22324;mullinax等人,biotechniques 12:864-869,1992;和sawai等人,ajri 34:26-34,1995;以及better等人,science 240:1041-1043,1988。
[0146]
通常,可以针对适当抗原选择克隆到展示载体中的杂合抗体或杂合抗体片段,以鉴定保持良好结合活性的变体,因为所述抗体或抗体片段将存在于噬菌体或噬菌粒颗粒的表面上。参见例如barbas iii等人,phage display,a laboratory manual(cold spring harbor laboratory press,cold spring harbor,纽约,2001)。然而,其他载体形式可用于此过程,如将抗体片段文库克隆到裂解性噬菌体载体(经修饰的t7或lambda zap系统)中进行选择和/或筛选。
[0147]
重组抗dll3抗体的表达。如上所述,可以通过应用重组dna技术来产生本发明技术的抗体。编码本发明技术的抗dll3抗体的重组多核苷酸构建体通常包括与抗dll3抗体链的编码序列可操作地连接的表达控制序列,所述表达控制序列包括天然缔合的或异源的启动子区域。因此,本发明技术的另一个方面包括含有编码本发明技术的抗dll3抗体的一种或多种核酸序列的载体。对于一种或多种本发明技术的多肽的重组表达,通过本领域中熟知和如下详述的重组dna技术将含有编码抗dll3抗体的核苷酸序列的全部或一部分的核酸插入合适的克隆载体或表达载体(即含有用于插入的多肽编码序列的转录和翻译的必要元件的载体)中。lerner等人的美国专利号6,291,160和6,680,192已经描述了用于产生多种载体群体的方法。
[0148]
一般而言,可用于重组dna技术中的表达载体通常呈质粒形式。在本公开文本中,“质粒”和“载体”可互换使用,因为质粒是最常用的载体形式。然而,本发明技术旨在包括在技术上不是质粒的、发挥同等功能的此类其他形式的表达载体,如病毒载体(例如,复制缺陷性逆转录病毒、腺病毒和腺相关病毒)。此类病毒载体允许感染受试者并且在该受试者中表达构建体。在一些实施方案中,表达控制序列是在能够转化或转染真核宿主细胞的载体中的真核启动子系统。一旦将载体掺入合适的宿主中,就将宿主维持在适合于高水平表达编码抗dll3抗体的核苷酸序列以及收集和纯化抗dll3抗体(例如交叉反应的抗dll3抗体)的条件下。总体上参见u.s.2002/0199213。这些表达载体通常可作为附加体或作为宿主染色体dna的组成部分在宿主生物中复制。通常,表达载体含有选择标记物,例如氨苄青霉素抗性或潮霉素抗性,以允许检测那些用所需dna序列转化的细胞。载体还可以编码可用于引导细胞外抗体片段的分泌的信号肽,例如果胶裂解酶。参见美国专利号5,576,195。
[0149]
本发明技术的重组表达载体包含编码具有dll3结合特性的蛋白质的核酸,所述重组表达载体呈适合于所述核酸在宿主细胞中表达的形式,这意味着所述重组表达载体包括根据用于表达的宿主细胞选择的一种或多种调节序列,所述一种或多种调节序列与待表达的核酸序列可操作地连接。在重组表达载体中,“可操作地连接”旨在意指,目的核苷酸序列以允许核苷酸序列表达(例如,在体外转录/翻译系统中或当将载体引入宿主细胞中时在宿主细胞中)的方式与一个或多个调节序列连接。术语“调节序列”旨在包括启动子、增强子和其他表达控制元件(例如,聚腺苷酸化信号)。此类调节序列描述于例如以下文献中:goeddel,gene expression technology:methods in enzymology 185,academic press,加利福尼亚州圣地亚哥(1990)。调节序列包括在许多类型的宿主细胞中引导核苷酸序列组成型表达的那些和仅在某些宿主细胞中引导核苷酸序列表达的那些(例如组织特异性调节
序列)。本领域技术人员将理解,表达载体的设计可以取决于如以下等因素:待转化的宿主细胞的选择、所需多肽的表达水平等。可用作重组多肽(例如抗dll3抗体)表达的启动子的典型调节序列包括例如但不限于3-磷酸甘油酸激酶和其他糖酵解酶的启动子。诱导型酵母启动子尤其包括来自以下的启动子:醇脱氢酶、异细胞色素c、以及负责麦芽糖和半乳糖利用的酶。在一个实施方案中,编码本发明技术的抗dll3抗体的多核苷酸与ara b启动子可操作地连接并且在宿主细胞中是可表达的。参见美国专利5,028,530。可以将本发明技术的表达载体引入宿主细胞中,从而产生由本文所述的核酸编码的多肽或肽,包括融合多肽(例如,抗dll3抗体等)。
[0150]
本发明技术的另一个方面涉及表达抗dll3抗体的宿主细胞,其含有编码一种或多种抗dll3抗体的核酸。本发明技术的重组表达载体可以被设计用于在原核或真核细胞中表达抗dll3抗体。例如,抗dll3抗体可以在细菌细胞(如大肠杆菌)、昆虫细胞(使用杆状病毒表达载体)、真菌细胞(例如酵母、酵母细胞)或哺乳动物细胞中表达。合适的宿主细胞进一步论述于以下文献中:goeddel,gene expression technology:methods in enzymology 185,academic press,加利福尼亚州圣地亚哥(1990)。可替代地,可以例如使用t7启动子调节序列和t7聚合酶在体外转录和翻译重组表达载体。先前已经描述了可用于经由表达随机产生的多核苷酸序列来制备并筛选具有预定特性的多肽(例如抗dll3抗体)的方法。参见美国专利号5,763,192;5,723,323;5,814,476;5,817,483;5,824,514;5,976,862;6,492,107;6,569,641。
[0151]
多肽在原核生物中的表达最常在大肠杆菌中用含有引导融合或非融合多肽表达的组成型或诱导型启动子的载体进行。融合载体将许多氨基酸添加至其中编码的多肽,通常添加至重组多肽的氨基末端。此类融合载体通常具有三个目的:(i)增加重组多肽的表达;(ii)增加重组多肽的溶解度;以及(iii)通过充当亲和纯化中的配体来帮助重组多肽的纯化。通常,在融合表达载体中,在融合部分和重组多肽的连接处引入蛋白水解切割位点,以使得在纯化融合多肽之后能够从融合部分分离重组多肽。此类酶及其同源识别序列包括因子xa、凝血酶和肠激酶。典型的融合表达载体包括pgex(pharmacia biotech inc;smith和johnson,1988.gene 67:31-40)、pmal(new england biolabs,贝弗利,马萨诸塞州)和prit5(pharmacia,皮斯卡塔韦,新泽西州),它们分别使谷胱甘肽s-转移酶(gst)、麦芽糖e结合多肽或多肽a与靶重组多肽融合。
[0152]
合适的诱导型非融合大肠杆菌表达载体的例子包括ptrc(amrann等人,(1988)gene 69:301-315)和pet 11d(studier等人,gene expression technology:methods in enzymology 185,academic press,加利福尼亚州圣地亚哥(1990)60-89)。pack等人的美国专利号6,294,353;6,692,935已经描述了用于经由多肽融合来靶向组装不同活性肽或蛋白质结构域以产生多功能多肽的方法。一种最大化大肠杆菌中的重组多肽(例如抗dll3抗体)表达的策略是在以蛋白水解方式切割重组多肽的能力受损的宿主细菌中表达所述多肽。参见例如gottesman,gene expression technology:methods in enzymology 185,academic press,加利福尼亚州圣地亚哥(1990)119-128。另一种策略是改变要插入表达载体中的核酸的核酸序列,使得每个氨基酸的各个密码子是表达宿主(例如大肠杆菌)中优先使用的密码子(参见例如wada等人,1992.nucl.acids res.20:2111-2118)。本发明技术的核酸序列的这种改变可以通过标准的dna合成技术来进行。
[0153]
在另一个实施方案中,抗dll3抗体表达载体是酵母表达载体。用于在酿酒酵母中表达的载体的例子包括pyepsec1(baldari等人,1987.embo j.6:229-234)、pmfa(kurjan and herskowitz,cell 30:933-943,1982)、pjry88(schultz等人,gene 54:113-123,1987)、pyes2(invitrogen corporation,圣加利福尼亚州地亚哥)和picz(invitrogen corp,加利福尼亚州圣地亚哥)。可替代地,可以使用杆状病毒表达载体在昆虫细胞中表达抗dll3抗体。可用于在培养的昆虫细胞(例如sf9细胞)中表达多肽(例如抗dll3抗体)的杆状病毒载体包括pac系列(smith等人,mol.cell.biol.3:2156-2165,1983)和pvl系列(lucklow和summers,1989.virology 170:31-39)。
[0154]
在又另一个实施方案中,使用哺乳动物表达载体在哺乳动物细胞中表达编码本发明技术的抗dll3抗体的核酸。哺乳动物表达载体的例子包括例如但不限于pcdm8(seed,nature 329:840,1987)和pmt2pc(kaufman等人,embo j.6:187-195,1987)。当用于哺乳动物细胞时,表达载体的控制功能通常由病毒调节元件提供。例如,常用的启动子源自多瘤病毒、腺病毒2、巨细胞病毒和猿猴病毒40。关于可用于表达本技术的抗dll3抗体的原核和真核细胞两者的其他合适的表达系统,参见例如sambrook等人,molecular cloning:a laboratory manual.第2版,cold spring harbor laboratory,cold spring harbor laboratory press,cold spring harbor,n.y.,1989的第16和17章。
[0155]
在另一个实施方案中,重组哺乳动物表达载体能够引导核酸在特定细胞类型中的表达(例如组织特异性调节元件)。组织特异性调节元件是本领域已知的。合适的组织特异性启动子的非限制性例子包括白蛋白启动子(肝脏特异性;pinkert等人,genes dev.1:268-277,1987)、淋巴特异性启动子(calame和eaton,adv.immunol.43:235-275,1988)、t细胞受体(winoto和baltimore,embo j.8:729-733,1989)和免疫球蛋白(banerji等人,1983.cell 33:729-740;queen和baltimore,cell 33:741-748,1983.)的启动子、神经元特异性启动子(例如,神经丝启动子;byrne和ruddle,proc.natl.acad.sci.usa 86:5473-5477,1989)、胰腺特异性启动子(edlund等人,1985.science 230:912-916),以及乳腺特异性启动子(例如,奶乳清启动子;美国专利号4,873,316和欧洲申请公开号264,166)。还涵盖发育调节的启动子,例如鼠hox启动子(kessel和gruss,science 249:374-379,1990)和甲胎蛋白启动子(campes和tilghman,genes dev.3:537-546,1989)。
[0156]
本发明方法的另一个方面涉及宿主细胞,其中已经引入了本发明技术的重组表达载体。术语“宿主细胞”和“重组宿主细胞”在本文中可互换使用。应当理解,此类术语不仅是指特定的受试者细胞,而且还指这种细胞的子代或潜在子代。因为在后代中由于突变或环境影响可能发生某些修饰,这种子代可能在事实上与亲代细胞不同,但是仍然包括在如在此使用的所述术语的范围内。
[0157]
宿主细胞可以是任何原核或真核细胞。例如,抗dll3抗体可以在细菌细胞(如大肠杆菌)、昆虫细胞、酵母或哺乳动物细胞中表达。哺乳动物细胞是适合于表达编码免疫球蛋白或其片段的核苷酸区段的宿主。参见winnacker,from genes to clones,(vch publishers,ny,1987)。在本领域中已经开发了许多能够分泌完整异源蛋白的合适的宿主细胞系,并且所述合适的宿主细胞系包括中国仓鼠卵巢(cho)细胞系、各种cos细胞系、hela细胞、l细胞和骨髓瘤细胞系。在一些实施方案中,所述细胞是非人的。这些细胞的表达载体可以包括表达控制序列,如复制起点、启动子、增强子,以及必要的处理信息位点,如核糖体
结合位点、rna剪接位点、聚腺苷酸化位点和转录终止子序列。queen等人,immunol.rev.89:49,1986。说明性表达控制序列是源自内源基因、巨细胞病毒、sv40、腺病毒、牛乳头瘤病毒等的启动子。co等人,j immunol.148:1149,1992。其他合适的宿主细胞为本领域技术人员所已知。
[0158]
可经由常规转化或转染技术将载体dna引入原核或真核细胞中。如本文所用,术语“转化”和“转染”旨在是指用于将外源核酸(例如,dna)引入宿主细胞中的各种本领域公认的技术,包括磷酸钙或氯化钙共沉淀、deae-葡聚糖介导的转染、脂质转染、电穿孔、基因枪或基于病毒的转染。用于转化哺乳动物细胞的其他方法包括使用聚凝胺、原生质体融合、脂质体、电穿孔和显微注射(通常参见sambrook等人,molecular cloning)。用于转化或转染宿主细胞的合适方法可以在以下文献中找到:sambrook等人(molecular cloning:a laboratory manual.第2版,cold spring harbor laboratory,cold spring harbor laboratory press,cold spring harbor,n.y.,1989)和其他实验室手册。取决于细胞宿主的类型,可以通过熟知的方法将含有目的dna区段的载体转移到宿主细胞中。
[0159]
对于哺乳动物细胞的稳定转染,已知根据所用的表达载体和转染技术,只有小部分细胞可以将外源dna整合到其基因组中。为了鉴定和选择这些整合体,通常将编码可选择标记物(例如,对抗生素的抗性)的基因与目的基因一起引入宿主细胞中。各种可选择标记物包括赋予对药物(如g418、潮霉素和甲氨蝶呤)的抗性的那些可选择标记物。可以将编码可选择标记物的核酸在与编码抗dll3抗体的载体相同的载体上引入宿主细胞中,或者可以在单独的载体上引入。可以通过药物选择来鉴定被引入的核酸稳定转染的细胞(例如,已掺入可选择标记基因的细胞将存活,而其他细胞死亡)。
[0160]
包括本发明技术的抗dll3抗体的宿主细胞(如培养中的原核或真核宿主细胞)可以用于产生(即表达)重组抗dll3抗体。在一个实施方案中,所述方法包括在合适的培养基中培养宿主细胞(已经向其中引入了编码抗dll3抗体的重组表达载体),从而产生抗dll3抗体。在另一个实施方案中,所述方法进一步包括从培养基或宿主细胞分离抗dll3抗体的步骤。一旦表达,就从培养基和宿主细胞纯化抗dll3抗体,例如抗dll3抗体或抗dll3抗体相关多肽的收集物。可以根据本领域的标准程序(包括hplc纯化、柱色谱、凝胶电泳等)纯化抗dll3抗体。在一个实施方案中,通过boss等人的美国专利号4,816,397的方法在宿主生物体中产生抗dll3抗体。通常,抗dll3抗体链连同信号序列被表达,并且因此被释放到培养基中。然而,如果抗dll3抗体链不是由宿主细胞自然分泌的,则可以通过用温和的洗涤剂处理来释放抗dll3抗体链。重组多肽的纯化是本领域熟知的,并且包括硫酸铵沉淀、亲和色谱纯化技术、柱色谱、离子交换纯化技术、凝胶电泳等(一般参见scopes,protein purification(springer-verlag,纽约,1982))。
[0161]
可将编码抗dll3抗体的多核苷酸例如抗dll3抗体的编码序列掺入转基因中,以供引入转基因动物的基因组中并随后在转基因动物的乳汁中表达。参见例如美国专利号5,741,957;5,304,489和5,849,992。合适的转基因包括与来自乳腺特异性基因(如酪蛋白或β-乳球蛋白)的启动子和增强子可操作连接的轻链和/或重链的编码序列。对于转基因动物的产生,可以将转基因显微注射到受精的卵母细胞中,或者可以将转基因掺入胚胎干细胞的基因组中,并将此类细胞的核转移到无核的卵母细胞中。
[0162]
单链抗体。在一个实施方案中,本发明技术的抗dll3抗体是单链抗dll3抗体。根据
本技术,技术可适用于产生对dll3蛋白具有特异性的单链抗体(参见例如美国专利号4,946,778)。可以用于产生本发明技术的单链fv和抗体的技术的例子包括描述于以下文献中的那些:美国专利号4,946,778和5,258,498;huston等人,methods in enzymology,203:46-88,1991;shu,l.等人,proc.natl.acad.sci.usa,90:7995-7999,1993;和skerra等人,science 240:1038-1040,1988。
[0163]
嵌合和人源化抗体。在一个实施方案中,本发明技术的抗dll3抗体是嵌合抗dll3抗体。在一个实施方案中,本发明技术的抗dll3抗体是人源化抗dll3抗体。在本发明技术的一个实施方案中,供体抗体和受体抗体是来自不同物种的单克隆抗体。例如,受体抗体是人抗体(以使其在人中的抗原性最小化),在这种情况下所得的cdr移植抗体称为“人源化”抗体。
[0164]
包含人和非人部分的重组抗dll3抗体(如嵌合单克隆抗体和人源化单克隆抗体)可以使用标准重组dna技术来制备,并且在本发明技术范围内。对于某些用途,包括本发明技术的抗dll3抗体的体内用途以及这些药剂在体外检测测定中的用途,可以使用嵌合或人源化抗dll3抗体。此类嵌合单克隆抗体和人源化单克隆抗体可以通过本领域已知的重组dna技术产生。此类有用的方法包括例如但不限于描述于以下文献中的方法:国际申请号pct/us86/02269;美国专利号5,225,539;欧洲专利号184187;欧洲专利号171496;欧洲专利号173494;pct国际公开号wo 86/01533;美国专利号4,816,567;5,225,539;欧洲专利号125023;better等人,1988.science 240:1041-1043;liu等人,1987.proc.natl.acad.sci.usa 84:3439-3443;liu等人,1987.j.immunol.139:3521-3526;sun等人,1987.proc.natl.acad.sci.usa 84:214-218;nishimura等人,1987.cancer res.47:999-1005;wood等人,1985.nature 314:446-449;shaw等人,1988.j.natl.cancer inst.80:1553-1559;morrison(1985)science 229:1202-1207;oi等人(1986)biotechniques 4:214;jones等人,1986.nature 321:552-525;verhoeyan等人,1988.science 239:1534;morrison,science 229:1202,1985;oi等人,biotechniques 4:214,1986;gillies等人,j.immunol.methods,125:191-202,1989;美国专利号5,807,715;和beidler等人,1988.j.immunol.141:4053-4060。例如,可以使用多种技术将抗体人源化,所述技术包括cdr移植(ep 0 239 400;wo 91/09967;美国专利号5,530,101;5,585,089;5,859,205;6,248,516;ep460167)、镶面或表面重修(ep 0 592 106;ep 0 519 596;padlan e.a.,molecular immunology,28:489-498,1991;studnicka等人,protein engineering 7:805-814,1994;roguska等人,pnas91:969-973,1994)和链改组(美国专利号5,565,332)。在一个实施方案中,用特异性选择的限制性内切酶消化编码鼠抗dll3单克隆抗体的cdna,以除去编码fc恒定区的序列,并取代编码人fc恒定区的cdna的等效部分(参见robinson等人,pct/us86/02269;akira等人,欧洲专利申请184,187;taniguchi,欧洲专利申请171,496;morrison等人,欧洲专利申请173,494;neuberger等人,wo 86/01533;cabilly等人美国专利号4,816,567;cabilly等人,欧洲专利申请125,023;better等人(1988)science 240:1041-1043;liu等人(1987)proc.natl.acad.sci.usa 84:3439-3443;liu等人(1987)j immunol 139:3521-3526;sun等人(1987)proc.natl.acad.sci.usa 84:214-218;nishimura等人(1987)cancer res 47:999-1005;wood等人(1985)nature 314:446-449;以及shaw等人(1988)j.natl.cancer inst.80:1553-1559;美国专利号6,180,370;美国专利
号6,300,064;6,696,248;6,706,484;6,828,422。
[0165]
在一个实施方案中,本发明技术提供人源化抗dll3抗体的构建,所述人源化抗dll3抗体不太可能诱导人抗小鼠抗体(以下称为“hama”)应答,同时仍然具有有效的抗体效应子功能。如本文所用,关于抗体的术语“人”和“人源化”涉及预期在人受试者中引发治疗上可耐受的弱免疫原性应答的任何抗体。在一个实施方案中,本发明技术提供人源化抗dll3抗体、重链和轻链免疫球蛋白。
[0166]
cdr抗体。在一些实施方案中,本发明技术的抗dll3抗体是抗dll3 cdr抗体。通常,用于产生抗dll3 cdr抗体的供体和受体抗体是来自不同物种的单克隆抗体;通常,受体抗体是人抗体(以使其在人中的抗原性最小化),在这种情况下所得的cdr移植抗体称为“人源化”抗体。移植物可以具有受体抗体的单个vh或v
l
内的单个cdr(或甚至单个cdr的一部分),或者可以具有vh和v
l
中的一个或两个内的多个cdr(或其部分)。通常,受体抗体的所有可变结构域中的所有三个cdr都将被相应的供体cdr替代,但只需要尽可能多的替代,以使所得的cdr移植抗体与dll3蛋白充分结合。用于产生cdr移植和人源化抗体的方法在以下文献中传授:queen等人的美国专利号5,585,089;美国专利号5,693,761;美国专利号5,693,762;和winter的u.s.5,225,539;和ep 0682040。可用于制备vh和v
l
多肽的方法在以下文献中传授:winter等人,美国专利号4,816,397;6,291,158;6,291,159;6,291,161;6,545,142;ep 0368684;ep0451216;和ep0120694。
[0167]
选择来自相同家族和/或相同家族成员的合适的框架区候选物后,重链和轻链可变区中的一个或两个是通过将来自起源物种的cdr移植到杂合框架区中而产生的。可以使用本领域技术人员已知的常规方法来完成关于以上任一方面的具有杂合可变链区的杂合抗体或杂合抗体片段的组装。例如,可以通过寡核苷酸合成和/或pcr来产生编码本文所述的杂合可变结构域(即,基于靶物种的框架和来自起源物种的cdr)的dna序列。也可以使用合适的限制酶从起源物种抗体分离编码cdr区的核酸,并通过用合适的连接酶连接而连接到靶物种框架中。可替代地,可以通过定点诱变来改变起源物种抗体的可变链的框架区。
[0168]
由于杂合体是从对应于每个框架区的多个候选物之间的选择构建的,因此存在适合于根据本文所述原理构建的许多序列组合。因此,可以组装杂合体的文库,其成员具有单独框架区的不同组合。此类文库可以是序列的电子数据库集合或杂合体的物理集合。
[0169]
此过程通常不会改变移植cdr侧翼的受体抗体的fr。然而,本领域技术人员有时可以通过替代给定fr的某些残基以使fr与供体抗体的相应fr更相似,来提高所得抗dll3 cdr移植抗体的抗原结合亲和力。合适的取代位置包括与cdr相邻的氨基酸残基,或能够与cdr相互作用的氨基酸残基(参见例如us 5,585,089,尤其是第12-16栏)。或者本领域技术人员可以从供体fr开始并对其进行修饰以使其与受体fr或人共有fr更相似。用于进行这些修饰的技术是本领域已知的。特别是如果所得的fr符合该位置的人共有fr或者与这种共有fr至少90%或更多相同,则与具有完全人fr的相同抗体相比,这样做可能不会显著增加所得经修饰的抗dll3 cdr移植抗体的抗原性。
[0170]
双特异性抗体(bsab)。双特异性抗体是可以同时与具有不同结构的两个靶标(例如,两个不同的靶抗原、同一靶抗原上的两个不同表位)结合的抗体。bsab可以例如通过组合识别相同或不同抗原的不同表位的重链和/或轻链来制备。在一些实施方案中,通过分子功能,双特异性结合剂在其两个结合臂中的一个结合臂(一个vh/vl对)上结合一个抗原(或
表位),并在其第二个臂(不同的vh/vl对)上结合不同的抗原(或表位)。依据此定义,双特异性结合剂具有两个不同的抗原结合臂(特异性和cdr序列两者均不同),并且对于其结合的每种抗原是单价的。
[0171]
本发明技术的双特异性抗体(bsab)和双特异性抗体片段(bsfab)具有与例如dll3特异性结合的至少一个臂和与第二靶抗原特异性结合的至少一个其他臂。在某些实施方案中,bsab能够与在细胞表面上表达dll3抗原的肿瘤细胞结合。
[0172]
使用分子工程化可以产生多种双特异性融合蛋白。例如,已经构建了利用完整的免疫球蛋白框架(例如igg)、单链可变片段(scfv)或其组合的bsab。在一些实施方案中,双特异性融合蛋白是二价的,其包含例如具有针对一种抗原的单一结合位点的scfv和具有针对第二抗原的单一结合位点的fab片段。在一些实施方案中,双特异性融合蛋白是二价的,其包含例如具有针对一种抗原的单一结合位点的scfv和具有针对第二抗原的单一结合位点的另一种scfv片段。在其他实施方案中,双特异性融合蛋白是四价的,其包含例如具有针对一种抗原的两个结合位点的免疫球蛋白(例如igg)和针对第二抗原的两个相同scfv。已经显示由两个串联的scfv单元构成的bsab是临床上成功的双特异性抗体形式。在一些实施方案中,bsab包含两个串联的单链可变片段(scfv),其被设计成使得结合肿瘤抗原(例如,dll3)的scfv与结合不同靶抗原的scfv连接。
[0173]
用于产生bsab的最新方法包括工程化重组单克隆抗体,其具有另外的半胱氨酸残基,使得它们比更常见的免疫球蛋白同种型更牢固地交联。参见例如fitzgerald等人,protein eng.10(10):1221-1225(1997)。另一种方法是工程化重组融合蛋白,其连接具有所需的双重特异性的两种或更多种不同的单链抗体或抗体片段区段。参见例如coloma等人,nature biotech.15:159-163(1997)。使用分子工程化可以产生多种双特异性融合蛋白。
[0174]
连接两种或更多种不同单链抗体或抗体片段的双特异性融合蛋白以类似的方式产生。重组方法可以用于产生多种融合蛋白。在一些特定的实施方案中,根据本发明技术的bsab包含含有重链和轻链的免疫球蛋白以及scfv。在一些特定的实施方案中,scfv与本文公开的任何dll3免疫球蛋白的重链的c末端连接。在一些特定的实施方案中,scfv与本文公开的任何dll3免疫球蛋白的轻链的c末端连接。在各个实施方案中,scfv经由接头序列与重链或轻链连接。通过pcr反应,将重链fd与scfv进行框内连接所必需的适当接头序列引入v
l
和v
κ
结构域中。然后将编码scfv的dna片段连接至含有编码ch1结构域的dna序列的分期(staging)载体中。切下所得的scfv-ch1构建体,并且将其连接至含有编码dll3抗体的vh区的dna序列的载体中。所得载体可用于转染适当的宿主细胞,如哺乳动物细胞,以表达双特异性融合蛋白。
[0175]
在一些实施方案中,接头长度为至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100个或更多个氨基酸。在一些实施方案中,接头的特征在于其倾向于不采用刚性三维结构,而是为多肽提供灵活性(例如,第一和/或第二抗原结合位点)。在一些实施方案中,基于赋予bsab的特定的特性,例如稳定性增加,在本文所述的bsab中采用接头。在一些实施方案中,本发明技术的bsab包含g4s接头。在一些特定的实施方案中,本发明技术的bsab包含(g4s)n接头,其中n为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或更多。
[0176]
fc修饰。在一些实施方案中,本发明技术的抗dll3抗体包含变体fc区,其中所述变体fc区包含相对于野生型fc区(或亲本fc区)的至少一个氨基酸修饰,使得所述分子对fc受体(例如fcγr)的亲和力发生了改变,条件是基于fc-fc受体相互作用的晶体学和结构分析(如sondermann等人,nature,406:267-273(2000)所披露的那些),所述变体fc区在与fc受体直接接触的位置没有取代。fc区内与fc受体(如fcγr)直接接触的位置的例子包括氨基酸234-239(铰链区)、氨基酸265-269(b/c环)、氨基酸297-299(c7e环)和氨基酸327-332(f/g)环。
[0177]
在一些实施方案中,本发明技术的抗dll3抗体对激活和/或抑制性受体具有改变的亲和力,其中变体fc区具有一个或多个氨基酸修饰,其中所述一个或多个氨基酸修饰是n297取代为丙氨酸或k322取代为丙氨酸。
[0178]
糖基化修饰。在一些实施方案中,本发明技术的抗dll3抗体具有fc区,所述fc区与亲本fc区相比含有变体糖基化。在一些实施方案中,变体糖基化包括岩藻糖的不存在;在一些实施方案中,变体糖基化是由于在gnt1缺陷性cho细胞中表达所致。
[0179]
在一些实施方案中,相对于与目的抗原(例如dll3)结合的适当参考抗体,本发明技术的抗体可以具有经修饰的糖基化位点,而不改变抗体的功能性,例如与抗原的结合活性。如本文所用,“糖基化位点”包括抗体中将与寡糖(即,含有连接在一起的两个或更多个单糖的碳水化合物)特异性和共价附接的任何特定氨基酸序列。
[0180]
寡糖侧链通常经由n连接或o连接与抗体的骨架连接。n-连接的糖基化是指寡糖部分与天冬酰胺残基的侧链附接。o连接的糖基化指寡糖部分附接至羟基氨基酸,例如丝氨酸、苏氨酸。例如,缺乏某些寡糖(包括岩藻糖)和末端n-乙酰葡糖胺的fc-糖型(hdll3-iggln)可以在特殊的cho细胞中产生,并展现出增强的adcc效应子功能。
[0181]
在一些实施方案中,通过添加或缺失糖基化位点来修饰本文公开的免疫球蛋白相关组合物的碳水化合物含量。修饰抗体的碳水化合物含量的方法是本领域中熟知的并且包括在本发明技术中,参见例如美国专利号6,218,149;ep 0359096b1;美国专利公开号us 2002/0028486;国际专利申请公开案wo 03/035835;美国专利公开号2003/0115614;美国专利号6,218,149;美国专利号6,472,511;上述专利都是通过引用以其整体并入本文。在一些实施方案中,通过缺失抗体的一个或多个内源性碳水化合物部分来修饰抗体(或其相关部分或组分)的碳水化合物含量。在一些特定的实施方案中,本发明技术包括通过将位置297的天冬酰胺修饰为丙氨酸来缺失抗体fc区的糖基化位点。
[0182]
工程化糖型可用于多种目的,包括但不限于增强或减弱效应子功能。工程化的糖型可以通过本领域技术人员已知的任何方法来产生,例如通过使用工程化的或变体表达毒株,通过与一种或多种酶(例如,n-乙酰氨基葡萄糖转移酶iii(gntiii))共表达,通过在各种生物体或来自各种生物体的细胞系中表达包含fc区的分子,或者通过在已经表达包含fc区的分子后修饰一种或多种碳水化合物。用于产生工程化糖型的方法是本领域已知的,并且包括但不限于描述于以下文献中的那些:umana等人,1999,nat.biotechnol.17:176-180;davies等人,2001,biotechnol.bioeng.74:288-294;shields等人,2002,j.biol.chem.277:26733-26740;shinkawa等人,2003,j.biol.chem.278:3466-3473;美国专利号6,602,684;美国专利申请序列号10/277,370;美国专利申请序列号10/113,929;国际专利申请公开wo 00/61739a1;wo 01/292246a1;wo 02/311140a1;wo 02/30954a1;
potillegent
tm
技术(biowa,inc.,普林斯顿,新泽西州);glycomab
tm
糖基化工程技术(glycart biotechnology ag,苏黎士,瑞士);这些文献各自通过引用以其整体并入本文。参见例如,国际专利申请公开wo 00/061739;美国专利申请公开号2003/0115614;okazaki等人,2004,jmb,336:1239-49。
[0183]
融合蛋白。在一个实施方案中,本发明技术的抗dll3抗体是融合蛋白。当与第二蛋白质融合时,本发明技术的抗dll3抗体可以用作抗原标签。可以与多肽融合的结构域的例子不仅包括异源信号序列,还包括其他异源功能区。融合不一定是直接的,而是可以通过接头序列进行。而且,本发明技术的融合蛋白也可以工程化以改善抗dll3抗体的特征。例如,可以将另外的氨基酸(特别是带电氨基酸)的区域添加至抗dll3抗体的n-末端以改善在从宿主细胞纯化或随后的处理和储存过程中的稳定性和持久性。另外,可以将肽部分添加到抗dll3抗体以促进纯化。可以在最终制备抗dll3抗体之前去除此类区域。添加肽部分以促进多肽的处理是本领域熟知的常规技术。可以将本发明技术的抗dll3抗体与标记序列(如促进融合多肽的纯化的肽)融合。在选择的实施方案中,标记氨基酸序列是六组氨酸肽,尤其如在pqe载体(qiagen,inc.,加利福尼亚州查茨沃斯(chatsworth))中提供的标签,许多所述六组氨酸肽是可商购的。如gentz等人,proc.natl.acad.sci.usa 86:821-824,1989中所述,例如,六组氨酸使得可便利地纯化融合蛋白。另一个可用于纯化的肽标签即“ha”标签对应于源自流感血凝素蛋白的表位。wilson等人,cell 37:767,1984。
[0184]
因此,任何这些上述融合蛋白可以使用本发明技术的多核苷酸或多肽进行工程化。另外,在一些实施方案中,本文所述的融合蛋白显示增加的体内半衰期。
[0185]
与单独的单体分泌的蛋白质或蛋白质片段相比,具有二硫键连接的二聚体结构(由于igg)的融合蛋白可以更高效地结合和中和其他分子。fountoulakis等人,j.biochem.270:3958-3964,1995。
[0186]
类似地,ep-a-o 464 533(加拿大对应案2045869)公开了融合蛋白,其包含免疫球蛋白分子恒定区的各个部分以及另一种人蛋白或其片段。在许多情况下,融合蛋白中的fc部分在治疗和诊断中是有益的,因此可以导致例如改善的药代动力学特性。参见ep-a 0232 262。可替代地,可能需要在表达、检测和纯化融合蛋白后缺失或修饰fc部分。例如,如果使用融合蛋白作为抗原用于免疫,则fc部分可能妨碍治疗和诊断。在药物发现中,例如人蛋白(如hil-5)已经与fc部分融合,以用于高通量筛选测定以鉴定hil-5的拮抗剂的目的。bennett等人,j.molecular recognition 8:52-58,1995;johanson等人,j.biol.chem.,270:9459-9471,1995。
[0187]
标记的抗dll3抗体。在一个实施方案中,本发明技术的抗dll3抗体与标记部分(即,可检测基团)偶联。与抗dll3抗体缀合的特定标记或可检测基团不是本发明技术的关键方面,只要它不显著干扰本发明技术的抗dll3抗体与dll3蛋白的特异性结合即可。可检测基团可以是具有可检测的物理或化学特性的任何材料。此类可检测的标记在免疫测定和成像领域已经得到了很好的发展。一般而言,可用于此类方法中的几乎任何标记都可以应用于本发明技术。因此,标记是可通过光谱、光化学、生物化学、免疫化学、电学、光学或化学手段检测的任何组合物。在本发明技术的实践中有用的标记包括磁珠(例如,dynabeads
tm
)、荧光染料(例如,异硫氰酸荧光素、德克萨斯红、罗丹明等)、放射性标记(例如,3h、
14
c、
35
s、
125
i、
121
i、
131
i、
112
in、
99m
tc)、其他成像剂如微泡(用于超声成像)、
18
f、
11
c、
15
o、
89
zr(用于正电
子发射断层摄影术)、
99m
tc、
111
in(用于单光子发射断层摄影术)、酶(例如辣根过氧化物酶、碱性磷酸酶和elisa中常用的其他酶)和量热标记如胶体金或有色玻璃或塑料(例如,聚苯乙烯、聚丙烯、乳胶等)珠粒。描述此类标记的用途的专利包括美国专利号3,817,837;3,850,752;3,939,350;3,996,345;4,277,437;4,275,149;和4,366,241,其每一个均通过引用以其整体并且出于所有目的并入本文。也参见handbook of fluorescent probes and research chemicals(第6版,molecular probes,inc.,eugene or.)。
[0188]
可以根据本领域熟知的方法将标记直接或间接地与测定的所需组分偶联。如上所述,可以使用多种标记,标记的选择取决于如以下的因素:所需的灵敏度、与化合物缀合的简便性、稳定性要求、可用的仪器以及处置规定。
[0189]
非放射性标记通常通过间接方式附接。通常,配体分子(例如生物素)与分子共价结合。然后配体与抗配体(例如,链霉亲和素)分子结合,所述抗配体分子是固有地可检测的或者与信号系统共价结合,所述信号系统如可检测的酶、荧光化合物或化学发光化合物。可使用许多配体和抗配体。在配体(例如生物素、甲状腺素和皮质醇)具有天然抗配体的情况下,所述配体可与标记的天然存在的抗配体结合使用。可替代地,任何半抗原或抗原化合物可与抗体例如抗dll3抗体组合使用。
[0190]
分子还可以与产生信号的化合物直接缀合,例如通过与酶或荧光团缀合。作为标记的目的酶将主要是水解酶,特别是磷酸酶、酯酶和糖苷酶,或者是氧化还原酶,特别是过氧化物酶。可用作标记部分的荧光化合物包括但不限于例如荧光素及其衍生物、罗丹明及其衍生物、丹磺酰基、伞形酮等。可用作标记部分的化学发光化合物包括但不限于例如荧光素和2,3-二氢酞嗪二酮,例如鲁米诺。关于可以使用的各种标记或信号产生系统的综述,参见美国专利号4,391,904。
[0191]
检测标记的手段是本领域技术人员熟知的。因此,例如,在标记是放射性标记的情况下,检测手段包括闪烁计数器或胶片,如在放射自显影中。在标记是荧光标记的情况下,它可以通过用适当波长的光激发荧光染料并检测产生的荧光来检测。荧光可以以目测形式、借助胶片、通过使用电子检测器如电荷耦合器件(ccd)或光电倍增管等来检测。类似地,酶标记可以通过提供酶的适当底物并检测所得反应产物来检测。最后,简单的比色标记可以通过观察与标记相关的颜色简单地检测。因此,在各种浸染棒法测定中,缀合金经常呈粉色,而各种缀合的珠粒呈现珠粒的颜色。
[0192]
一些测定形式不需要使用标记的组分。例如,凝集测定可用于检测靶抗体例如抗dll3抗体的存在。在这种情况下,通过包含靶抗体的样品将抗原包被的颗粒凝集。在这种形式中,不需要标记任何组分,并且通过简单的目测检查来检测靶抗体的存在。b.鉴定并且表征本发明技术的抗dll3抗体
[0193]
用于鉴定和/或筛选本发明技术的抗dll3抗体的方法。用于在针对dll3多肽的抗体中鉴定和筛选对dll3蛋白具有所需特异性的抗体(例如,与dll3的细胞外结构域结合的那些)的方法包括本领域中已知的任何免疫介导的技术。可以通过本领域普通技术人员熟知的各种方法在体外检测免疫应答的组分。例如,(1)细胞毒性t淋巴细胞可与放射性标记的靶细胞一起孵育,并通过放射性的释放来检测这些靶细胞的裂解;(2)可以将辅助t淋巴细胞与抗原和抗原呈递细胞一起孵育,并通过标准方法测量细胞因子的合成和分泌(windhagen a等人,immunity,2:373-80,1995);(3)可以将抗原呈递细胞与全蛋白抗原一
起孵育,并通过t淋巴细胞激活测定或生物物理学方法检测该抗原在mhc上的呈递(harding等人,proc.natl.acad.sci.,86:4230-4,1989);(4)可以将肥大细胞与试剂(交联其fc-ε受体)一起孵育并通过酶免疫测定来测量组胺释放(siraganian等人,tips,4:432-437,1983);(5)酶联免疫吸附测定(elisa)。
[0194]
类似地,也可以通过本领域普通技术人员熟知的各种方法来检测模型生物体(例如小鼠)或人受试者中免疫应答的产物。例如,(1)可以通过目前用于临床实验室中的标准方法例如elisa容易地检测响应于疫苗接种的抗体的产生;(2)可以通过刮伤皮肤表面并放置无菌容器以捕获刮痕部位上的迁移细胞来检测免疫细胞向炎症部位的迁移(peters等人,blood,72:1310-5,1988);(3)可以使用3h-胸苷测量外周血单核细胞(pbmc)响应于有丝分裂原或混合淋巴细胞反应的增殖;(4)可以通过将pbmc与标记的颗粒一起置于孔中来测量粒细胞、巨噬细胞和其他吞噬细胞在pbmc中的吞噬能力(peters等人,blood,72:1310-5,1988);和(5)可以通过用针对cd分子(如cd4和cd8)的抗体标记pbmc并测量表达这些标记物的pbmc的分数来测量免疫系统细胞的分化。
[0195]
在一个实施方案中,利用dll3肽在可复制的遗传包装的表面上的展示来选择本发明技术的抗dll3抗体。参见例如美国专利号5,514,548;5,837,500;5,871,907;5,885,793;5,969,108;6,225,447;6,291,650;6,492,160;ep 585 287;ep 605522;ep 616640;ep 1024191;ep 589 877;ep 774 511;ep 844 306。已经描述了可用于产生/选择丝状噬菌体颗粒的方法,所述丝状噬菌体颗粒含有编码具有所需特异性的结合分子的噬菌粒基因组。参见例如ep 774 511;us 5871907;us 5969108;us 6225447;us 6291650;us6492160。
[0196]
在一些实施方案中,利用dll3肽在酵母宿主细胞的表面上的展示来选择本发明技术的抗dll3抗体。可用于通过酵母表面展示分离scfv多肽的方法已经由kieke等人,protein eng.1997nov;10(11):1303-10描述。
[0197]
在一些实施方案中,使用核糖体展示选择本发明技术的抗dll3抗体。可用于使用核糖体展示来鉴定肽文库中配体的方法已经由mattheakis等人,proc.natl.acad.sci.usa 91:9022-26,1994;和hanes等人,proc.natl.acad.sci.usa 94:4937-42,1997描述。
[0198]
在某些实施方案中,使用dll3肽的trna展示来选择本发明技术的抗dll3抗体。可用于使用trna展示进行配体的体外选择的方法已经由merryman等人,chem.biol.,9:741-46,2002描述。
[0199]
在一个实施方案中,使用rna展示选择本发明技术的抗dll3抗体。可用于使用rna展示文库选择肽和蛋白质的方法已经由roberts等人proc.natl.acad.sci.usa,94:12297-302,1997;和nemoto等人,febs lett.,414:405-8,1997描述。可用于使用非天然rna展示文库选择肽和蛋白质的方法已经由frankel等人,curr.opin.struct.biol.,13:506-12,2003描述。
[0200]
在一些实施方案中,将本发明技术的抗dll3抗体在革兰氏阴性菌的周质中表达,并与标记的dll3蛋白混合。参见wo 02/34886。在表达对dll3蛋白具有亲和力的重组多肽的克隆中,与抗dll3抗体结合的标记的dll3蛋白的浓度增加,并且允许细胞从文库的其余部分分离,如在harvey等人,proc.natl.acad.sci.22:9193-98 2004和美国专利公开号2004/0058403中所述。
[0201]
在选择所需的抗dll3抗体之后,预期可以通过本领域技术人员已知的任何技术
(例如原核或真核细胞表达等)大量生产所述抗体。抗dll3抗体(它们是例如但不限于抗dll3杂合抗体或片段)可以通过以下方式来产生:使用常规技术构建编码抗体重链的表达载体,在所述抗体重链中保留起源物种抗体结合特异性所需的cdr和(如果需要)可变区框架的最小部分(如根据本文所述的技术工程化)源自起源物种抗体,并且抗体的其余部分源自可以如本文所述操纵的靶物种免疫球蛋白,从而产生用于表达杂合抗体重链的载体。
[0202]
dll3结合的测量。在一些实施方案中,dll3结合测定指一种测定形式,其中dll3蛋白和抗dll3抗体在适合于dll3蛋白与抗dll3抗体之间结合和评估dll3蛋白与抗dll3抗体之间的结合量的条件下混合。将结合量与合适的对照进行比较,所述对照可以是在不存在dll3蛋白的情况下的结合量、在存在非特异性免疫球蛋白组合物的情况下的结合量或二者。结合量可以通过任何合适的方法来评估。结合测定法包括例如elisa、放射免疫测定、临近闪烁测定、荧光能量转移测定、液相色谱、膜过滤测定等。用于直接测量与抗dll3抗体结合的dll3蛋白的生物物理学测定是例如核磁共振、荧光、荧光偏振、表面等离子体共振(biacore芯片)、生物层干涉法等。通过本领域已知的标准测定来测定特异性结合,所述标准测定是例如放射性配体结合测定、elisa、fret、免疫沉淀、spr、nmr(2d-nmr)、质谱法等。如果候选抗dll3抗体的特异性结合比在不存在候选抗dll3抗体的情况下观察到的结合高至少1%,则所述候选抗dll3抗体可用作抗本发明技术的抗dll3抗体。本发明技术的抗dll3抗体的用途
[0203]
概述。本发明技术的抗体可用于与dll3多肽的定位和/或定量有关(例如,用于测量适当的生理样品中dll3蛋白的水平、用于诊断方法、用于多肽成像等)的本领域已知的方法中。本发明技术的抗dll3抗体可用于通过标准技术(如亲和色谱法或免疫沉淀)来分离dll3多肽。本发明技术的抗dll3抗体可以促进天然免疫反应性dll3蛋白从生物样品例如哺乳动物血清或细胞的纯化,以及在宿主系统中表达的重组产生的免疫反应性dll3蛋白的纯化。此外,本发明技术的抗dll3抗体可用于检测免疫反应性dll3蛋白(例如,在血浆、细胞裂解液或细胞上清液中)以评价免疫反应性多肽的表达丰度和模式。本发明技术的抗dll3抗体可以作为临床测试程序的一部分在诊断上用于监测组织中的免疫反应性dll3蛋白水平,例如以确定给定治疗方案的功效。如上所述,可以通过将本发明技术的抗dll3抗体与可检测物质偶联(即物理连接)来促进检测。
[0204]
dll3蛋白的检测。用于检测生物样品中是否存在免疫反应性dll3蛋白的示例性方法涉及从测试受试者获得生物样品,并且使所述生物样品与本发明技术的能够检测免疫反应性dll3蛋白的抗dll3抗体接触,从而检测生物样品中免疫反应性dll3蛋白的存在。可以通过附接于抗体的可检测标记来完成检测。
[0205]
关于抗dll3抗体的术语“标记的”旨在涵盖通过将可检测物质与抗体偶联(即物理连接)来直接标记抗体,以及通过与直接标记的另一化合物(如二抗)的反应性来间接标记抗体。间接标记的例子包括使用荧光标记的二抗检测一抗以及用生物素对dna探针进行末端标记,使得可以用荧光标记的链霉亲和素对其进行检测。
[0206]
在一些实施方案中,将本文公开的抗dll3抗体与一个或多个可检测标记缀合。对于此类用途,抗dll3抗体可以通过发色剂、酶剂、放射性同位素剂、同位素剂、荧光剂、毒性剂、化学发光剂、核磁共振造影剂或其他标记的共价或非共价附接来可检测地标记。
[0207]
合适的发色标记的例子包括二氨基联苯胺和4-羟基偶氮-苯-2-甲酸。合适的酶标
记的例子包括苹果酸脱氢酶、葡萄球菌核酸酶、δ-5-类固醇异构酶、酵母醇脱氢酶、α-甘油磷酸脱氢酶、磷酸丙糖异构酶、过氧化物酶、碱性磷酸酶、天冬酰胺酶、葡萄糖氧化酶、β-半乳糖苷酶、核糖核酸酶、脲酶、过氧化氢酶、葡萄糖-6-磷酸脱氢酶、葡糖淀粉酶和乙酰胆碱酯酶。
[0208]
合适的放射性同位素标记的例子包括3h、
111
in、
125
i、
131
i、
32
p、
35
s、
14
c、
51
cr、
57
to、
58
co、
59
fe、
75
se、
152
eu、
90
y、
67
cu、
217
ci、
211
at、
212
pb、
47
sc、
109
pd等。
111
in是使用体内成像时的示例性同位素,因为它避免了
125
i或
131
i标记的dll3结合抗体被肝脏脱卤的问题。另外,这种同位素具有对于成像更有利的伽马发射能量(perkins等人,eur.j.nucl.med.70:296-301(1985);carasquillo等人,j.nucl.med.25:281-287(1987))。例如,与具有1-(对-异硫氰基苄基)-dpta的单克隆抗体偶联的
111
in在非肿瘤组织(特别是肝脏)中展现出很少的吸收,并增强了肿瘤定位的特异性(esteban等人,j.nucl.med.28:861-870(1987))。合适的非放射性同位素标记的例子包括
157
gd、
55
mn、
162
dy、
52
tr和
56
fe。
[0209]
合适的荧光标记的例子包括
152
eu标记、荧光素标记、异硫氰酸盐标记、罗丹明标记、藻红蛋白标记、藻蓝蛋白标记、别藻蓝蛋白标记、绿色荧光蛋白(gfp)标记、邻苯二甲醛标记和荧光胺标记。合适的毒素标记的例子包括白喉毒素、蓖麻毒素和霍乱毒素。
[0210]
化学发光标记的例子包括鲁米诺标记、异鲁米诺标记、芳香族吖啶酯(acridinium ester)标记、咪唑标记、吖啶盐(acridinium salt)标记、草酸酯标记、萤光素标记、萤光素酶标记和水母发光蛋白标记。核磁共振造影剂的例子包括重金属核,如gd、mn和铁。
[0211]
本发明技术的检测方法可以用于在体外以及体内检测生物样品中的免疫反应性dll3蛋白。用于检测免疫反应性dll3蛋白的体外技术包括酶联免疫吸附测定(elisa)、western印迹、免疫沉淀、放射免疫测定和免疫荧光。此外,用于检测免疫反应性dll3蛋白的体内技术包括将标记的抗dll3抗体引入受试者中。例如,可以用放射性标记物标记抗dll3抗体,所述放射性标记物在受试者中的存在和位置可以通过标准成像技术来检测。在一个实施方案中,生物样品含有来自测试受试者的dll3蛋白分子。
[0212]
免疫测定和成像。本发明技术的抗dll3抗体可用于使用基于抗体的技术测定生物样品(例如人血浆)中的免疫反应性dll3蛋白水平。例如,组织中的蛋白质表达可以用经典免疫组织学方法来研究。jalkanen,m.等人,j.cell.biol.101:976-985,1985;jalkanen,m.等人,j.cell.biol.105:3087-3096,1987。可用于检测蛋白质基因表达的其他基于抗体的方法包括免疫测定,如酶联免疫吸附测定(elisa)和放射免疫测定(ria)。合适的抗体测定标记是本领域已知的,并且包括酶标记(如葡萄糖氧化酶)和放射性同位素或其他放射性剂(如碘(
125
i、
121
i、
131
i)、碳(
14
c)、硫(
35
s)、氚(3h)、铟(
111
in)和锝(
99
mtc))和荧光标记(如荧光素、罗丹明和绿色荧光蛋白(gfp))以及生物素。
[0213]
除了测定生物样品中的免疫反应性dll3蛋白水平外,本发明技术的抗dll3抗体也可用于dll3的体内成像。可用于此方法的抗体包括可通过x射线照相术、nmr或esr检测的那些抗体。对于x射线照相术,合适的标记包括放射性同位素,如钡或铯,它们发射出可检测的辐射,但是对受试者没有明显的伤害。适用于nmr和esr的标记物包括具有可检测特征性自旋的那些标记,如氘,可以通过标记用于相关scfv克隆的营养素而将所述标记物掺入抗dll3抗体中。
[0214]
将已用适当的可检测成像部分(如放射性同位素(例如
131
i、
111
in、
99
mtc、
18
f、
89
zr)、
不透射线的物质或通过核磁共振可检测的材料)标记的本发明技术的抗dll3抗体引入(例如肠胃外、皮下或腹膜内)受试者中。在本领域中将理解,受试者的大小和所使用的成像系统将决定产生诊断图像所需的成像部分的量。在放射性同位素部分的情况下,对于人受试者,所注射的放射性的量通常在约5至20毫居里
99m
tc的范围内。然后,标记的抗dll3抗体将积聚在含有特定靶多肽的细胞位置。例如,本发明技术的经标记的抗dll3抗体将积聚在受试者体内已定位有dll3蛋白的细胞和组织中。
[0215]
因此,本发明技术提供了医学病症的诊断方法,所述方法涉及:(a)通过测量本发明技术的抗dll3抗体在个体的细胞或体液中的结合来测定免疫反应性dll3蛋白的表达;(b)将样品中存在的免疫反应性dll3蛋白的量与标准参照物进行比较,其中与标准品相比免疫反应性dll3蛋白水平的升高或降低指示医学病症。
[0216]
亲和纯化。本发明技术的抗dll3抗体可以用于从样品纯化免疫反应性dll3蛋白。在一些实施方案中,将抗体固定在固体支持物上。此类固体支持物的例子包括塑料(如聚碳酸酯)、复合碳水化合物(如琼脂糖(agarose)和琼脂糖(sepharose))、丙烯酸树脂以及如聚丙烯酰胺和乳胶珠粒。使抗体与此类固体支持物偶联的技术是本领域熟知的(weir等人,“handbook of experimental immunology”第4版,blackwell scientific publications,oxford,england,第10章(1986);jacoby等人,meth.enzym.34academic press,n.y.(1974))。
[0217]
将抗原与抗体-支持基质结合的最简单方法是将珠粒收集在柱子中,并使抗原溶液向下通过柱子。此方法的效率取决于固定化抗体与抗原之间的接触时间,可以通过使用低流速来延长所述接触时间。固定化抗体在抗原流过时捕获所述抗原。可替代地,可以通过以下方式使抗原与抗体支持基质接触:将抗原溶液与支持物(例如,珠粒)混合并旋转或摇动浆料,从而使抗原与固定化抗体之间实现最大接触。结合反应完成后,将浆料通入柱子中以收集珠粒。使用合适的洗涤缓冲液洗涤珠粒,然后洗脱纯的或基本上纯的抗原。
[0218]
可以将目的抗体或多肽与固体支持物(如珠粒)缀合。另外,如果需要的话,也可以通过任何合适的手段(包括本文公开的用于将多肽与支持物缀合的那些手段)将第一固体支持物如珠粒与第二固体支持物(其可以是第二珠粒或其他支持物)缀合。因此,本文公开的关于多肽与固体支持物的缀合的任何缀合方法和手段也可以用于将第一支持物与第二支持物缀合,其中第一和第二固体支持物可以相同或不同。
[0219]
用于将多肽与固体支持物缀合的合适的接头(其可以是交联剂)包括可以与支持物表面上存在的官能团或与多肽或两者反应的多种药剂。可用作交联剂的试剂包括同双官能试剂以及特别地异双官能试剂。有用的双官能交联剂包括但不限于n-siab、二马来酰亚胺、dtnb、n-sata、n-spdp、smcc和6-hynic。可以选择交联剂以提供多肽与固体支持物之间的可选择性切割的键。例如,可以使用光不稳定的交联剂如3-氨基-(2-硝基苯基)丙酸,作为从固体支持物切割多肽的手段。(brown等人,mol.divers,第4-12页(1995);rothschild等人,nucl.acids res.,24:351-66(1996);以及美国专利号5,643,722)。其他交联试剂是本领域熟知的。(参见例如wong(1991),同上;和hermanson(1996),同上)。
[0220]
可以通过在羧基官能化的珠粒与多肽的氨基末端之间形成的共价酰胺键,或者相反地通过在氨基官能化的珠粒与多肽的羧基末端之间形成的共价酰胺键,将抗体或多肽固定在固体支持物(如珠粒)上。另外,双官能的三苯甲基接头可以经由氨基树脂通过树脂上
的氨基或羧基附接于支持物,例如附接于树脂(如wang树脂)上的4-硝基苯基活性酯。使用双官能三苯甲基方法时,固体支持物可能需要使用挥发酸(如甲酸或三氟乙酸)进行处理,以确保多肽被切割并能够被去除。在这种情况下,多肽可以作为无珠粒的斑块沉积在固体支持物的孔底部或沉积在固体支持物的平坦表面上。添加基质溶液后,可以将多肽解吸到ms中。
[0221]
通过使用挥发酸或适当的基质溶液(例如含有3-hpa的基质溶液)从多肽切割氨基连接的三苯甲基,疏水性三苯甲基接头也可以用作酸不稳定的接头。还可以改变酸不稳定性。例如,可以将三苯甲基、单甲氧基三苯甲基、二甲氧基三苯甲基或三甲氧基三苯甲基改为多肽的适当的对位取代的或更加呈酸不稳定的三苯甲胺衍生物,即可以形成与所述多肽的三苯甲基醚键和三苯甲基胺键。因此,可以例如通过在酸性条件下破坏疏水引力或通过切割三苯甲基醚键或三苯甲胺键从疏水性接头去除多肽,所述酸性条件包括(如果需要)在典型的ms条件下,其中基质如3-hpa用作酸。
[0222]
正交可切割的接头也可用于将第一固体支持物(例如珠粒)与第二固体支持物结合,或可用于将目的多肽与固体支持物结合。使用此类接头,可以在不从支持物切割多肽的情况下从第二固体支持物选择性地切割第一固体支持物(例如珠粒);然后可以在稍后时间从珠粒切割多肽。例如,可以将可使用还原剂如dtt切割的二硫化物接头用于将珠粒与第二固体支持物结合,并且可以使用酸可切割的双官能三苯甲基将多肽固定至支持物。根据需要,可以首先切割多肽与固体支持物的连接,例如,保持第一与第二支持物之间的连接完整。三苯甲基接头可以提供共价或疏水性缀合,并且无论缀合的性质如何,三苯甲基在酸性条件下均易于切割。
[0223]
例如,珠粒可以通过连接基团与第二支持物结合,可以选择具有以下长度和化学性质的连接基团,所述长度和化学性质使得促进了珠粒与固体支持物的高密度结合或多肽与珠粒的高密度结合。这种连接基团可以具有例如“树状”结构,从而为固体支持物上的每个附接位点提供多个官能团。这种连接基团的例子包括聚赖氨酸、聚谷氨酸、五-赤藓糖醇(penta-erythrole)和三羟基氨基甲烷。
[0224]
非共价结合缔合。通过非共价相互作用,抗体或多肽可以与固体支持物缀合,或第一固体支持物也可以与第二固体支持物缀合。例如,由能够被磁化的铁磁材料制成的磁性珠粒可以被吸引至磁性固体支持物,并且可以通过移除磁场而从支持物释放。可替代地,固体支持物可以具有离子或疏水性部分,这可以允许离子或疏水性部分分别与多肽(例如含有附接的三苯甲基的多肽)或与具有疏水性特征的第二固体支持物相互作用。
[0225]
固体支持物也可以具有特异性结合对的成员,因此可以与含有互补结合部分的多肽或第二固体支持物缀合。例如,用抗生物素蛋白或用链霉亲和素包被的珠粒可以与其中掺入生物素部分的多肽结合,或者与用生物素或生物素衍生物(如亚氨基生物素)包被的第二固体支持物结合。
[0226]
应当认识到,本文公开的或本领域另外已知的任何结合成员都可以逆转。因此,分别地例如可以将生物素掺入多肽或固体支持物中,并且相反地,可以将抗生物素蛋白或其他生物素结合部分掺入支持物或多肽中。所考虑用于本文的其他特异性结合对包括但不限于激素及其受体、酶及其底物、核苷酸序列及其互补序列、抗体及其特异性相互作用的抗原,以及本领域技术人员已知的其他此类对。
a.本发明技术的抗dll3抗体的诊断用途
[0227]
概述。本发明技术的抗dll3抗体可用于诊断方法。因此,本发明技术提供了使用所述抗体诊断受试者中的dll3活性的方法。可以选择这样的本发明技术的抗dll3抗体,使得它们具有任何水平的表位结合特异性和对dll3蛋白的非常高的结合亲和力。一般而言,抗体的结合亲和力越高,就可以在免疫测定中执行更严格的洗涤条件以去除非特异性结合的材料而不去除靶多肽。因此,可用于诊断测定的本发明技术的抗dll3抗体通常具有约108m-1
、109m-1
、10
10
m-1
、10
11
m-1
或10
12
m-1
的结合亲和力。此外,期望用作诊断试剂的抗dll3抗体具有足够的动力学缔合速率,以在标准条件下在至少12h、至少五(5)h或至少一(1)小时内达到平衡。
[0228]
抗dll3抗体可用于在多种标准测定形式中检测免疫反应性dll3蛋白。此类形式包括免疫沉淀、蛋白质印迹、elisa、放射免疫测定和免疫测量测定。参见harlow和lane,antibodies,a laboratory manual(cold spring harbor publications,纽约,1988);美国专利号3,791,932;3,839,153;3,850,752;3,879,262;4,034,074;3,791,932;3,817,837;3,839,153;3,850,752;3,850,578;3,853,987;3,867,517;3,879,262;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074;和4,098,876。生物样品可以从受试者的任何组织或体液获得。在某些实施方案中,所述受试者处于癌症的早期阶段。在一个实施方案中,癌症的早期阶段是通过从受试者获得的样品中dll3蛋白的水平或表达方式来确定的。在某些实施方案中,样品选自尿、血液、血清、血浆、唾液、羊水、脑脊液(csf)和活检身体组织。
[0229]
免疫测量测定或夹心测定是本发明技术诊断方法的一种形式。参见美国专利号4,376,110、4,486,530、5,914,241和5,965,375。此类测定使用一种固定至固相的抗体(例如抗dll3抗体或抗dll3抗体群体)以及在溶液中的另一种抗dll3抗体或抗dll3抗体群体。通常,溶液抗dll3抗体或抗dll3抗体群体被标记。如果使用抗体群体,则所述群体可以含有针对靶多肽内不同表位特异性而结合的抗体。因此,相同的群体可以用于固相和溶液抗体二者。如果使用抗dll3单克隆抗体,则具有不同结合特异性的第一和第二dll3单克隆抗体用于固相和溶液相。可以使固相(也称为“捕获”)和溶液(也称为“检测”)抗体以任何顺序或同时与靶抗原接触。如果首先接触固相抗体,则所述测定称为正向测定。相反,如果首先接触溶液抗体,则所述测定称为反向测定。如果靶标同时与两种抗体接触,则所述测定称为同时测定。使dll3蛋白与抗dll3抗体接触后,将样品孵育一段时间,所述时间段通常从约10分钟到约24小时不等,并且通常为约1小时。然后执行洗涤步骤以去除样品中未与用作诊断试剂的抗dll3抗体特异性结合的组分。当固相抗体和溶液抗体在单独的步骤中结合时,可以在任一个或两个结合步骤之后进行洗涤。洗涤后,对结合进行定量,通常是通过经由标记的溶液抗体的结合而检测与固相连接的标记。通常对于给定的抗体对或抗体群体和给定的反应条件,从含有已知浓度的靶抗原的样品制作校准曲线。然后通过从校准曲线(即标准曲线)内插来读取正在测试的样品中免疫反应性dll3蛋白的浓度。可以从平衡时结合的标记溶液抗体的量或通过在达到平衡之前在一系列时间点对结合的标记溶液抗体的动力学测量来测量分析物。这种曲线的斜率是样品中dll3蛋白浓度的量度。
[0230]
用于上述方法的合适支持物包括例如硝酸纤维素膜、尼龙膜和衍生化尼龙膜,并且还包括颗粒,如琼脂糖、基于葡聚糖的凝胶、试纸条、微粒、微球、磁性颗粒、试管、微量滴
定孔、sephadex
tm
(amersham pharmacia biotech,新泽西州皮斯卡塔韦)等。固定化可以是通过吸收或通过共价附接来实现。任选地,抗dll3抗体可以与接头分子(如生物素)连接,以附接于表面结合的接头(如抗生物素蛋白)。
[0231]
在一些实施方案中,本公开文本提供了与诊断剂缀合的本发明技术的抗dll3抗体。诊断剂可以包含放射性或非放射性标记、造影剂(如用于磁共振成像、计算机断层摄影术或超声),并且放射性标记可以是γ、β、α、俄歇电子或正电子发射同位素。诊断剂是与抗体部分即抗体或抗体片段或亚片段缀合施用的分子,并且可用于通过定位含有抗原的细胞诊断或检测疾病。
[0232]
有用的诊断剂包括但不限于放射性同位素、染料(如采用生物素-链霉亲和素复合物)、造影剂、荧光化合物或分子以及磁共振成像(mri)的增强剂(例如顺磁性离子)。美国专利号6,331,175描述了mri技术和与mri增强剂缀合的抗体的制备,并且通过引用以其整体并入。在一些实施方案中,诊断剂选自放射性同位素、用于磁共振成像的增强剂和荧光化合物。为了使抗体组分负载放射性金属或顺磁性离子,可能需要使其与具有长尾部的试剂发生反应,所述长尾部附接有多种用于结合离子的螯合基团。这种尾部可以是聚合物,如聚赖氨酸、多糖或其他衍生化或可衍生的链,所述聚合物具有可与螯合基团结合的侧基,所述螯合基团是例如乙二胺四乙酸(edta)、二乙烯三胺五乙酸(dtpa)、卟啉、多胺、冠醚、双缩氨基硫脲、聚肟和已知可用于此目的的类似基团。螯合物可以使用标准化学方法与本发明技术的抗体偶联。螯合物通常通过如下基团与抗体连接,所述基团能够在免疫反应性损失最小并且聚集和/或内部交联最小的情况下与分子形成键。用于将螯合物与抗体缀合的其他方法和试剂公开于美国专利号4,824,659中。特别有用的金属-螯合物组合包括与诊断性同位素一起用于放射成像的2-苄基-dtpa及其一甲基和环己基类似物。在与非放射性金属(如锰、铁和钆)复合时,在与本发明技术的dll3抗体一起使用时,相同螯合物可用于mri。b.本发明技术的抗dll3抗体的治疗用途
[0233]
本发明技术的免疫球蛋白相关组合物(例如,抗体或其抗原结合片段)可用于治疗dll3相关癌症。这种治疗可以用于被鉴定为具有病理上高水平的dll3的患者(例如,通过本文所述的方法诊断的患者)或被诊断为已知与这种病理水平相关的疾病的患者。在一个方面,本公开文本提供了一种用于在有需要的受试者中治疗dll3相关癌症的方法,所述方法包括向所述受试者施用有效量的本发明技术的抗体(或其抗原结合片段)。可以通过本发明技术的抗体治疗的癌症的例子包括但不限于:小细胞肺癌(sclc)、大细胞神经内分泌癌(lcnec)、肺神经内分泌癌、肺外神经内分泌癌和黑色素瘤。
[0234]
本发明技术的免疫球蛋白相关组合物可以与可用于治疗dll3相关癌症的其他治疗剂结合使用。例如,本发明技术的抗体可以单独、与至少一种另外的治疗剂顺序或同时施用、或与至少一种另外的治疗剂缀合,其中所述至少一种另外的治疗剂选自海洋来源的化合物(例如,尾海兔素10、澳瑞他汀、他西多汀、尾海兔素15或其变体,单甲基澳瑞他汀e(mmae)、单甲基澳瑞他汀f(mmaf))(参见newman和cragg,mar drugs.2017年4月;15(4):99)、长春花药剂、抗雌激素药物、芳香酶抑制剂、卵巢抑制剂、vegf/vegfr抑制剂、parp抑制剂、抑制细胞生长的生物碱、细胞毒性抗生素、抗代谢药、内分泌/激素药剂、双磷酸盐疗法药剂和靶向生物疗法药剂(例如,描述于us 6306832、wo 2012007137、wo 2005000889、wo 2010096603等中的治疗性肽)、烷基化剂、烷基磺酸酯、鹅膏蕈碱、氮杂环丙烷类、乙烯亚胺
myers squibb oncology,新泽西州普林斯顿)、曲妥珠单抗(genentech)、替莫唑胺(4-甲基-5-氧代-2,3,4,6,8-戊氮杂双环[4.3.0]九-2,7,9-三烯-9-甲酰胺,cas号85622-93-1,schering plough)、他莫昔芬((z)-2-[4-(l,2-二苯基丁-l-烯基)苯氧基]-n,n-二甲基乙胺、二甲基乙胺、)和多柔比星另外的可商购或临床可获得用的抗癌剂包括硼替佐米(millennium pharm.)、索坦(su11248,pfizer)、来曲唑(novartis)、甲磺酸伊马替尼(novartis)、xl-518(mek抑制剂,exelixis,wo 2007/044515),arry-886(mek抑制剂,azd6244,array biopharma,astra zeneca)、sf-1126(pi3k抑制剂,semafore pharmaceuticals)、bez-235(pi3k抑制剂,novartis)、xl-147(pi3k抑制剂,exelixis)、ptk787/zk 222584(novartis)、氟维司群(astrazeneca)、甲酰四氢叶酸(亚叶酸)、雷帕霉素(西罗莫司,wyeth)、拉帕替尼(gsk572016,glaxo smith kline)、洛那法尼(saras ar
tm
,sch 66336,schering plough)、索拉非尼(bay43-9006,bayer labs)、吉非替尼(astrazeneca)、伊立替康(cpt-11,pfizer)、替比法尼(zarnestra
tm
,johnson&johnson)、abraxane
tm
(不含氢化蓖麻油)、白蛋白工程化的紫杉醇纳米颗粒配制品(american pharmaceutical partners,schaumberg,ii)、凡德他尼(rinn,zd6474,astrazeneca)、苯丁酸氮芥、ag1478、ag1571(su 5271;sugen)、西罗莫司(wyeth)、帕唑帕尼(glaxosmithkline)、环磷酰胺(telik)、噻替帕和环磷酰胺长春瑞滨卡培他滨(roche)、他莫昔芬(包括他莫昔芬柠檬酸盐、(托瑞米芬柠檬酸盐)(甲地孕酮乙酸盐)、(依西美坦;pfizer)、福美司坦、法屈唑、(伏罗唑)、和(阿那曲唑;astrazeneca);达拉非米(glaxosmithkline);达沙替尼(bristol-myers squibb);曲美替尼(glaxosmithkline);尼罗替尼(novartis),曲沙他滨(一种1,3-二氧戊环核苷胞嘧啶类似物);反义寡核苷酸、核酶,如vegf表达抑制剂和her2表达抑制剂;疫苗,ril-2;拓扑异构酶1抑制剂;rmrh;长春瑞滨和埃斯培拉霉素及以上任一种的药学上可接受的盐、酸或衍生物。
[0236]
本发明技术的组合物可以任选地以单次推注的形式施用至有需要的受试者。可替代地,给药方案可以包括在肿瘤出现后的不同时间多次施用。
[0237]
施用可以通过任何合适的途径进行,所述合适的途径包括口服、鼻内、肠胃外(静脉内、肌肉内、腹膜内或皮下)、直肠、颅内、瘤内、鞘内或局部。施用包括自施用和由另一个人施用。还应理解,如本文所述的医学病症的各种治疗方式旨在意指“基本上的”,其包括完全治疗但也不到完全治疗,并且其中实现了一些生物学或医学有关的结果。
[0238]
在一些实施方案中,本发明技术的抗体构成药物配制品,可以将所述药物配制品以一个或多个剂量施用至有需要的受试者。可以调整剂量方案以提供所需反应(例如,治疗反应)。
[0239]
通常,足以实现治疗效果的本发明技术的抗体组合物的有效量在每天每公斤体重
约0.000001mg至每天每公斤体重约10,000mg的范围内。通常,剂量范围为从约0.0001mg/千克体重/天至约100mg/千克体重/天。对于施用抗dll3抗体,剂量范围为每周、每两周或每三周0.0001至100mg/kg受试者体重,并且更通常为0.01至5mg/kg受试者体重。例如,剂量可以是每周、每两周或每三周1mg/kg体重或10mg/kg体重,或者在每周、每两周或每三周1-10mg/kg的范围内。在一个实施方案中,抗体的单次剂量范围为0.1-10,000微克/kg体重。在一个实施方案中,载体中的抗体浓度范围为每递送一毫升0.2至2000微克。示例性治疗方案使得需要每两周一次或每月一次或每3至6个月一次施用。可以在多个时机施用抗dll3抗体。单个剂量之间的间隔可以是每小时、每日、每周、每月或每年。如通过测量受试者中抗体的血液水平所指示,间隔也可以是不规则的。在一些方法中,调整剂量以在受试者中实现以下血清抗体浓度:约75μg/ml至约125μg/ml、100μg/ml至约150μg/ml、约125μg/ml至约175μg/ml或约150μg/ml至约200μg/ml。可替代地,抗dll3抗体可以作为持续释放配制品施用,在这种情况下需要不太频繁的施用。剂量和频率根据抗体在受试者中的半衰期而变化。施用的剂量和频率可以根据治疗是预防性的还是治疗性的而变化。在预防性应用中,在长时间段期间以相对不频繁的间隔施用相对低的剂量。在治疗性应用中,有时需要以相对短的间隔施用相对高的剂量,直到疾病的进展减少或终止为止,或直到受试者显示疾病症状的部分或完全改善为止。此后,可以向患者施用预防性方案。
[0240]
在另一个方面,本公开文本提供了用于在体内检测受试者中的肿瘤的方法,所述方法包括(a)向所述受试者施用有效量的本发明技术的抗体(或其抗原结合片段),其中所述抗体被配置为定位于表达dll3的肿瘤,并用放射性同位素标记;和(b)通过检测由所述抗体发射的高于参考值的放射性水平来检测所述受试者中肿瘤的存在。在一些实施方案中,参考值表示为注射剂量/克(%id/g)。参考值可通过如下方法来计算:测量存在于非肿瘤(正常)组织中的放射性水平,并且计算存在于非肿瘤(正常)组织中的平均放射性水平
±
标准差。在一些实施方案中,肿瘤与正常组织之间的放射性水平的比率为约2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、15:1、20:1、25:1、30:1、35:1、40:1、45:1、50:1、55:1、60:1、65:1、70:1、75:1、80:1、85:1、90:1、95:1或100:1。
[0241]
在一些实施方案中,所述受试者被诊断患有或怀疑患有癌症。可以使用正电子发射断层摄影术或单光子发射计算机断层摄影术检测由所述抗体发射的放射性水平。
[0242]
另外地或可替代地,在一些实施方案中,所述方法进一步包括向所述受试者施用有效量的免疫缀合物,所述免疫缀合物包含与放射性核素缀合的本发明技术的抗体。在一些实施方案中,所述放射性核素是发射α粒子的同位素、发射β粒子的同位素、俄歇(auger)发射体或其任何组合。发射β粒子的同位素的例子包括
86
y、
90
y、
89
sr、
165
dy、
186
re、
188
re、
177
lu和
67
cu。发射α粒子的同位素的例子包括
213
bi、
211
at、
225
ac、
152
dy、
212
bi、
223
ra、
219
rn、
215
po、
211
bi、
221
fr、
217
at和
255
fm。俄歇发射体的例子包括
111
in、
67
ga、
51
cr、
58
co、
99m
tc、
103m
rh、
195m
pt、
119
sb、
161
ho、
189m
os、
192
ir、
201
tl和
203
pb。在所述方法的一些实施方案中,正常组织中非特异性fcr依赖性结合被消除或减少(例如,经由fc区中的n297a突变,其导致去糖基化)。可以通过计算曲线下面积(auc)肿瘤:auc正常组织比率来确定这种免疫缀合物的治疗有效性。在一些实施方案中,所述免疫缀合物的auc肿瘤:auc正常组织比率为约2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、15:1、20:1、25:1、30:1、35:1、40:1、45:1、50:1、55:1、60:1、65:1、70:1、75:1、80:1、85:1、90:1、95:1或100:1。
[0243]
毒性。最佳地,本文描述的抗dll3抗体的有效量(例如剂量)将提供治疗益处,而不会引起对受试者的实质性毒性。本文所述的抗dll3抗体的毒性可以通过在细胞培养物或实验动物中的标准药学程序,例如通过测定ld
50
(对50%群体致死的剂量)或ld
100
(对100%群体致死的剂量)来确定。毒性与治疗效果之间的剂量比是治疗指数。从这些细胞培养测定和动物研究获得的数据可用于制定对人无毒的剂量范围。本文所述的抗dll3抗体的剂量在循环浓度的范围内,所述循环浓度包括具有很小或没有毒性的有效剂量。所述剂量可以根据所采用的剂型和所利用的施用途径在这个范围内变化。单独医师可以根据受试者的情况选择确切配方、施用途径和剂量。参见例如fingl等人,the pharmacological basis of therapeutics,第1章(1975)。
[0244]
药物组合物的配制品。根据本发明技术的方法,可以将抗dll3抗体掺入适合于施用的药物组合物中。药物组合物通常包含重组或基本上纯化的抗体和药学上可接受的载体,呈适合于施用至受试者的形式。药学上可接受的载体部分取决于所施用的特定组合物,以及取决于用于施用所述组合物的特定方法。因此,存在用于施用抗体组合物的药物组合物的多种合适配制品(参见例如,remington’s pharmaceutical sciences,mack publishing co.,easton,pa第18版,1990)。通常将药物组合物配制为无菌的、基本上等渗的并且完全符合美国食品和药物管理局的所有良好生产规范(gmp)规定。
[0245]
术语“药学上可接受的”、“生理上可耐受的”及其语法变体,当它们指组合物、载体、稀释剂和试剂时,可以互换使用,并表示所述材料能够被施用至受试者或施用至受试者上而不产生会禁止组合物的施用的程度的不希望的生理影响。例如,“药学上可接受的赋形剂”意指可用于制备通常是安全、无毒并且期望的药物组合物的赋形剂,并且包括对于兽用以及人药物用途可接受的赋形剂。此类赋形剂可以是固体、液体、半固体,或者在气溶胶组合物的情况下是气体。“药学上可接受的盐和酯”意指药学上可接受的并具有所需药理特性的盐和酯。此类盐包括可以在存在于组合物中的酸性质子能够与无机或有机碱反应的情况下形成的盐。合适的无机盐包括与碱金属例如钠和钾、镁、钙和铝形成的那些盐。合适的有机盐包括与有机碱形成的那些有机盐,所述有机碱如胺碱,例如乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、n-甲基葡糖胺等。此类盐还包括与无机酸(例如盐酸和氢溴酸)和有机酸(例如乙酸、柠檬酸、马来酸以及烷烃磺酸和芳烃磺酸如甲磺酸和苯磺酸)形成的酸加成盐。药学上可接受的酯包括由抗dll3抗体中存在的羧基、磺酰氧基和膦酸氧基形成的酯,例如c
1-6
烷基酯。当存在两个酸性基团时,药学上可接受的盐或酯可以是单酸单盐或酯或者二盐或酯;并且类似地,当存在多于两个酸性基团时,此类基团中的一些或全部可以被盐化或酯化。以此技术命名的抗dll3抗体可以按未盐化或未酯化形式存在,或以盐化和/或酯化形式存在,并且这种抗dll3抗体的命名旨在包括初始(未盐化和未酯化)化合物及其药学上可接受的盐和酯。另外,本发明技术的某些实施方案可以按多于一种立体异构体形式存在,并且这种抗dll3抗体的命名旨在包括所有单一的立体异构体以及此类立体异构体的所有混合物(无论是外消旋的还是其他形式)。本领域普通技术人员不难确定施用本发明技术的特定药物和组合物的适当时间安排、顺序和剂量。
[0246]
此类载体或稀释剂的例子包括但不限于水、盐水、林格氏溶液(ringer's solution)、右旋糖溶液和5%人血清白蛋白。也可使用脂质体和非水性媒介物,如固定油。此类介质和化合物用于药物活性物质的用途是本领域熟知的。除非任何常规介质或化合物
与抗dll3抗体不相容,否则考虑其在组合物中的使用。也可以将补充性活性化合物掺入组合物中。
[0247]
配制本发明技术的药物组合物以与其预期的施用途径相容。本发明技术的抗dll3抗体组合物可以通过肠胃外、局部、静脉内、口服、皮下、动脉内、皮内、透皮、直肠、颅内、鞘内、腹膜内、鼻内;或肌肉内途径,或者作为吸入剂施用。可以将抗dll3抗体任选地与在治疗各种dll3相关癌症方面至少部分有效的其他药物组合施用。
[0248]
用于肠胃外、皮内或皮下施用的溶液或悬浮液可包括以下组分:无菌稀释剂,如注射用水、盐水溶液、固定油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗细菌化合物,如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合化合物,如乙二胺四乙酸(edta);缓冲液(如醋酸盐、柠檬酸盐或磷酸盐),以及用于调节张力的化合物(如氯化钠或右旋糖)。可以用酸或碱(如盐酸或氢氧化钠)调节ph。可以将肠胃外制剂封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
[0249]
适合于可注射使用的药物组合物包括无菌水性溶液(在水溶性的情况下)或分散体以及用于临时制备无菌可注射溶液或分散液的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、cremophor el
tm
(basf,新泽西州帕西帕尼)或磷酸盐缓冲盐水(pbs)。在所有情况下,组合物必须是无菌的并且应当是易于注射的程度的流体。组合物在制造和储存条件下必须稳定,并且其保存必须可以抵抗如细菌和真菌的微生物的污染作用。载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)及其适宜混合物。例如,通过使用包衣如卵磷脂、通过在分散液的情况下维持所需的粒度、以及通过使用表面活性剂,可以维持适当的流动性。防止微生物的作用可以通过多种抗细菌和抗真菌化合物(例如,对羟基苯甲酸酯、三氯叔丁醇、苯酚、抗坏血酸、硫柳汞等)来实现。在许多情况下,希望在组合物中包含等渗化合物,例如糖、多元醇(如甘露糖醇、山梨糖醇)、氯化钠。可以通过在组合物中包含延迟吸收的化合物例如单硬脂酸铝和明胶来实现可注射组合物的延长吸收。
[0250]
无菌可注射溶液可以通过以下方式制备:将本发明技术的抗dll3抗体以所需量掺入视需要具有上文所列举成分中的一种或组合的适当溶剂中,之后过滤灭菌。通常,通过将所述抗dll3抗体掺入无菌媒介物中来制备分散液,所述无菌媒介物含有基础分散介质和来自以上列举的那些成分的所需其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,制备方法为真空干燥和冷冻干燥,所述真空干燥和冷冻干燥由先前无菌过滤的溶液产生活性成分和任何另外的所需成分的粉末。本发明技术的抗体可以以积存注射剂或植入制剂的形式施用,可以将所述形式以允许活性成分的持续或脉冲释放的方式配制。
[0251]
口服组合物通常包括惰性稀释剂或可食用载体。可以将它们封装于明胶胶囊中或压成片剂。出于口服治疗性施用的目的,可以将抗dll3抗体与赋形剂一起掺入,并且以片剂、锭剂或胶囊的形式使用。口服组合物也可以使用用作漱口剂的流体载体来制备,其中流体载体中的化合物经口施用并漱口并且被吐出或者被吞下。可以包括药学上相容的结合化合物和/或辅助材料作为组合物的一部分。片剂、丸剂、胶囊、锭剂等可含有任何以下成分或具有类似性质的化合物:粘合剂,如微晶纤维素、黄芪胶或明胶;赋形剂,如淀粉或乳糖,崩解性化合物,如藻酸、primogel或玉米淀粉;润滑剂,如硬脂酸镁或sterotes;助流剂,如二氧化硅胶体;甜味化合物,如蔗糖或糖精;或调味化合物,如薄荷、水杨酸甲酯或橙味剂。
[0252]
对于通过吸入施用,可以从加压容器或分配器(其含有合适的推进剂,例如气体(如二氧化碳))或者喷雾器以气溶胶喷雾剂形式递送抗dll3抗体。
[0253]
全身性施用也可以通过经粘膜或透皮方式进行。对于经粘膜或透皮施用,在配制品中使用适合于待渗透屏障的渗透剂。此类渗透剂通常是本领域已知的,并且包括(例如对于经粘膜施用)洗涤剂、胆汁盐、以及梭链孢酸衍生物。经粘膜施用可以通过使用鼻喷雾剂或栓剂来完成。对于透皮施用,将抗dll3抗体配制成如本领域通常已知的软膏、药膏、凝胶或乳膏。
[0254]
也可以将抗dll3抗体制备为呈栓剂(例如,与常规栓剂基质如可可脂和其他甘油酯一起)或保留灌肠剂的形式以供直肠递送的药物组合物。
[0255]
在一个实施方案中,抗dll3抗体是用防止抗dll3抗体从身体迅速清除的载体制备的,如控释配制品,包括植入物和微囊化递送系统。可以使用可生物降解的生物相容性聚合物,如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。用于制备此类配制品的方法对本领域技术人员而言将是清楚的。所述材料也可以从alza corporation和nova pharmaceuticals,inc.商购获得。脂质体悬浮液(包括用针对病毒抗原的单克隆抗体靶向感染细胞的脂质体)也可用作药学上可接受的载体。这些可以根据例如在美国专利号4,522,811中所述的本领域技术人员已知的方法来制备。c.试剂盒
[0256]
本发明技术提供用于检测和/或治疗dll3相关癌症的试剂盒,所述试剂盒包含至少一种本发明技术的免疫球蛋白相关组合物(例如,本文所述的任何抗体或抗原结合片段)或其功能性变体(例如,取代变体)。任选地,将本发明技术的试剂盒的上述组分包装在合适的容器中并进行标记以用于dll3相关癌症的诊断和/或治疗。上述组分可以作为水溶液(优选无菌溶液)或作为用于重构的冻干(优选无菌)配制品的形式储存在单元容器或多剂量容器(例如,密封的安瓿、小瓶、瓶子、注射器和试管)中。试剂盒可以进一步包含第二容器,所述第二容器容纳有适合于将药物组合物稀释至更大体积的稀释剂。合适的稀释剂包括但不限于药物组合物的药学上可接受的赋形剂和盐水溶液。此外,试剂盒可以包含用于稀释药物组合物的说明书和/或用于施用稀释的或未稀释的药物组合物的说明书。所述容器可以由多种材料(如玻璃或塑料)制成,并且可以具有无菌的进入口(例如,容器可以是静脉内溶液袋或带有可被皮下注射针刺穿的塞子的小瓶)。所述试剂盒还可以包含更多容器,所述容器含有药学上可接受的缓冲液,如磷酸盐缓冲盐水、林格氏溶液和右旋糖溶液。所述试剂盒还可以包括从商业和用户的角度来看合意的其他材料,包括用于一种或多种合适宿主的其他缓冲液、稀释剂、过滤器、针、注射器、培养基。试剂盒可以任选地包括通常包含在治疗或诊断产品的商业包装中的说明书,所述说明书含有关于例如关于使用此类治疗或诊断产品的适应症、用法、剂量、制造、施用、禁忌症和/或警告的信息。
[0257]
试剂盒可用于检测生物样品中免疫反应性dll3的存在,所述生物样品是例如任何体液,包括但不限于例如血清、血浆、淋巴液、囊液、尿、粪便、脑脊液、腹水或血液,并且包括体组织的活检样品。例如,试剂盒可以包含:能够结合生物样品中的dll3的本发明技术的一种或多种人源化、嵌合或双特异性抗dll3抗体(或其抗原结合片段);用于测定样品中dll3的量的器件;以及用于将样品中的免疫反应性dll3的量与标准品进行比较的器件。一种或多种抗dll3抗体可以经标记。试剂盒组分(例如试剂)可以被包装在合适的容器中。试剂盒
可以进一步包含用于使用所述试剂盒检测免疫反应性dll3的说明书。
[0258]
对于基于抗体的试剂盒,所述试剂盒可以包含,例如1)附接于固体支持物的第一抗体,例如本发明技术的人源化、嵌合或双特异性dll3抗体(或其抗原结合片段),所述第一抗体与dll3多肽结合;以及,任选地;2)第二种不同抗体,其与dll3多肽或所述第一抗体结合并与可检测标记缀合。
[0259]
试剂盒也可以包含例如缓冲剂、防腐剂或蛋白质稳定剂。所述试剂盒还可以包含检测所述可检测标记所需的其他组分,例如酶或底物。试剂盒还可以含有对照样品或一系列对照样品,可以对其进行测定并与测试样品进行比较。试剂盒的每个组分可以封装在单独的容器内,并且所有不同的容器可以与用于解释使用所述试剂盒进行测定的结果的说明书一起放在单个包装内。本发明技术的试剂盒可以在试剂盒容器上或试剂盒容器中含有书面产品。书面产品描述了如何使用试剂盒中含有的试剂,例如用于在体外或体内检测dll3多肽,或用于在有需要的受试者中治疗dll3相关癌症。在某些实施方案中,可以根据本发明技术的方法使用所述试剂。实施例
[0260]
通过以下实施例进一步说明本发明技术,不应将所述实施例视为以任何方式加以限制。以下实施例展示了本发明技术的说明性抗dll3抗体的制备、表征和用途。实施例1:单克隆抗体的产生
[0261]
将在稳定表达全长dll3的hek293t细胞中产生的对应于具有c末端6
×
his标签的氨基酸ala27-ala479的dll3(genbank登录号q9ny j7-1)的细胞外结构域(ecd)用作免疫原。根据标准免疫技术,在3周的时间段内将携带人免疫球蛋白库的ablexis alivamabκ小鼠(ablexis,加利福尼亚州圣地亚哥)用可溶性dll3-ecd或稳定细胞进行免疫。收获来自对dll3具有特异性的具有高血清滴度的小鼠的脾细胞和引流淋巴结细胞,并且使用电融合与小鼠骨髓瘤细胞融合以产生杂交瘤。然后筛选这些杂交瘤以通过elisa鉴定特异性结合可溶性dll3-ecd的抗体和通过流式细胞术稳定表达293细胞与亲本293细胞的全长dll3蛋白的抗体的存在。通过在流式细胞术中对293dll3转染子的染色强度排序以及如下所述进行4℃/37℃染色,选择用于进一步研究的杂交瘤。实施例2:用单克隆抗体6-g23-f、2-c8-a、7-i1-b和10-o18-a的4/37内化测定
[0262]
通过比较在4℃下和在37℃下的染色,比较四种单克隆抗体(6-g23-f、2-c8-a、7-i1-b和10-o18-a)内化dll3的能力。将参考单克隆抗体sc16(已知经由dll3内化并具有adc活性,并且先前在文献中报道过)用作内化的阳性对照。将指数生长的nci-h82细胞用胰蛋白酶/edta收获,在含有10%胎牛血清(fcs)的rpmi中洗涤一次,并且以2
×
107个细胞/ml重悬于补充有10%fcs的dmem中。将100μl(2
×
106个细胞)添加到u底96孔板中。将测试单克隆抗体(6-g23-f、2-c8-a、7-i1-b或10-o18-a)或参考单克隆抗体添加到单独的孔中,以在重复的板中得到10μg/ml的终浓度。将两个板均在4℃下保持30分钟,然后将两个板均用补充有10%fcs的冷rpmi洗涤2次,并且重悬于补充有10%fcs的rpmi中。将一个板在4℃下保持(对照板),将另一个板在37℃下在co2培养箱中孵育(实验板)。将实验板在37℃下在co2培养箱中孵育且将对照板在4℃下孵育4小时后,将细胞在4℃下用冷洗涤缓冲液(含有0.5%bsa的pbs)洗涤3次。然后将样品以在洗涤缓冲液中7μg/ml的终浓度重悬于冷洗涤缓冲液 r-藻红蛋白-affinipure f(ab')2片段山羊抗小鼠igg(jackson 115-116-071)中。在4℃下孵育
30分钟后,将细胞在冷洗涤缓冲液中洗涤三次,并且固定在pbs 0.5%多聚甲醛中,并且在48小时内通过流式细胞术分析。将通过对照板(其在4℃下与抗体一起孵育)获得的mfi除以从实验板(其在37℃下与抗体一起孵育)获得的相应mfi计算的平均荧光强度(mfi)比率作为内化的相对量度。高的值指示更大的内化。如下表所示,所有的单克隆抗体(6-g23-f、2-c8-a、7-i1-b和10-o18-a)都能够内化结合dll3,但是不能达到参考单克隆抗体的程度。克隆mfi比率6-g23-f1.672-c8-a1.767-i1-b1.6810-o18-a1.56参考单克隆抗体2.66小鼠igg11.28
[0263]
这些结果证明本发明技术的免疫球蛋白相关组合物经由与dll3结合而经历内化。因此,本文公开的免疫球蛋白相关组合物可用于将治疗剂递送至dll3阳性癌细胞。实施例3:单克隆抗体6-g23-f、2-c8-a、7-i1-b和10-o18-a的淬灭内化测定。
[0264]
为了关于内化对单克隆抗体进行排序,使用了淬灭内化测定。此方法反映了内化和进入内体/溶酶体途径。将山羊抗小鼠igg1 f(ab)(jackson immunoresearch115-007-185)用dy light dy650 nhs酯(thermofisher 02206)和licor irdye qc1 nhs酯(licor 929-7030)进行双重标记(所述双重标记抗体在本文称为“f(ab)dy650-qc1”)。此测定的原理如下:f(ab)dy650-qc1不发荧光,因为dy light dy650荧光被irdye qc1淬灭。然而,在内化后,f(ab)dy650-qc1经由内体/溶酶体途径降解,并且由此引起的irdye qc1释放使得可观察到dy light dy650的荧光。因此,将dy light dy650荧光信号用作经由溶酶体内化的量度。简言之,将指数生长的nci-h82细胞用胰蛋白酶/edta收获,在补充有10%fcs的生长培养基rpmi中洗涤一次,并且重悬于生长培养基中,并且每孔添加1.25x 106个细胞(80μl)。将浓度为200μg/ml的单克隆dll3抗体与200μg/ml的山羊抗小鼠igg1 dy650 qc1在室温下混合20分钟,并且将20μl的混合物添加到细胞中。在4℃下孵育30分钟后,将细胞用生长培养基洗涤两次,重悬于生长培养基中并且转移至37℃的co2培养箱中持续4小时以允许内化。然后将细胞用含有0.5%bsa的冰冷的pbs洗涤2次,并且通过流式细胞术进行分析,并且确定平均荧光强度。将对照参考单克隆的平均荧光强度设置为100%内化。如下表所示,所有四种单克隆抗体均展示出内化和进入内体/溶酶体途径。克隆dy light dy658荧光(对照参考单克隆抗体的%)6-g23-f(10μg/ml)76.57-i1-b(10μg/ml)70.12-c8-a(10μg/ml)62.910-o18-a(10μg/ml)62.2同种型对照20
[0265]
这些结果证明本发明技术的免疫球蛋白相关组合物经由与dll3结合经历内化,并且进入细胞的吞噬体/溶酶体区室。因此,本文公开的免疫球蛋白相关组合物可用于将治疗剂递送至dll3阳性癌细胞。
实施例4:抗dll3单克隆抗体组的fab zap测定。
[0266]
fab zap测定被用作测量内化的另一种方法。fab zap测定经由抗dll3单克隆抗体的内化来测量毒素向细胞的递送。fab zap测定使用皂草素毒素缀合的f(ab)抗小鼠重链和轻链来标记带有毒素的单克隆抗体。使用来自advanced targeting systems的试剂盒,根据fab zap测定方案表征抗dll3单克隆抗体组。简言之,将指数生长的nci-h82细胞用胰蛋白酶/edta收获,用补充有10%fcs的rmpi洗涤一次,并且在补充有10%fcs的100μl rpmi中在96孔白色固体板上以5000个细胞/孔铺板。第二天,以10μg/ml的起始浓度添加25μl的纯化的单克隆抗体(g23-f、2-c8-a、7-i1-b或10-o18-a)或参考单克隆单克隆抗体,并且进行连续三个倍数稀释。在25μl中添加皂苷缀合的f(ab)抗小鼠ig hl(fab zap)以得到4.4nm的终浓度。3-4天后,将相同体积的cell titre glow(promega g7571)添加到板上,将其在定轨摇床上摇动2分钟,并且在室温下再摇动10分钟后,使用读板器读取发光。所有单克隆抗体都被测试为完全滴定,以否定前带效应。如图1和下表所示,所有单克隆抗体都展现出与参考单克隆抗体可比较的细胞毒性活性。在这些单克隆抗体的其他实验中,小鼠igg1对照单克隆抗体没有展现出细胞毒性活性。因此,这些结果证明通过识别dll3而不是通过fcr来介导细胞毒性活性。
[0267]
这些结果证明本发明技术的免疫球蛋白相关组合物可以将治疗剂递送至在其细胞表面上表达dll3的肿瘤。因此,本文公开的免疫球蛋白相关组合物可用于将治疗剂递送至dll3阳性癌细胞。实施例5:抗dll3单克隆抗体组的表位分箱。
[0268]
在阵列表面等离子体共振(spr)测定平台(inc.,犹他州盐湖城)上使纯化的抗dll3单克隆抗体和参考单克隆抗体经受成对表位分箱,其中针对捕获组氨酸标记的dll3抗原(dll3-his)以及针对与组中的每一种其他抗体竞争结合dll3-his测试每种单克隆抗体。通过打印阵列方法通过标准胺偶联技术将抗体固定在hc200m芯片(配体)上。然后在每个循环中,在整个阵列中注射抗原,接着注射单个抗体(分析物)。在每个循环结束时,将表面再生以去除抗原和分析物,然后开始新的循环。如下表所示,鉴定三种不同的箱元,其中具有7-i1-b和2-c8-a的组映射为箱元2,而6-g23-f在箱元3中,并且10-o18-a在箱元1中。单克隆表位箱元10-o18-a17-i1-b22-c8-a26-g23-f3
[0269]
这些结果证明本发明技术的免疫球蛋白相关组合物结合dll3蛋白中存在的三种
不同表位。因此,本文公开的免疫球蛋白相关组合物可以彼此组合使用,以用于将多种治疗剂递送至表达dll3的肿瘤细胞。实施例6:亲和力测量。
[0270]
使用pbs 0.1%bsa 0.02%tween 20作为结合缓冲液和10mm甘氨酸(ph 1.7)作为再生缓冲液,在25℃下使用octet htx仪器通过生物层干涉法(bli)确定四种单克隆抗体(6-g23-f、2-c8-a、7-i1-b和10-o18-a)的结合亲和力。将四种纯化的单克隆抗体(各5μg/ml)加载到抗小鼠fc传感器上。将加载的传感器浸入以200nm起始浓度采用7个连续1:3稀释度的重组人dll3蛋白(氨基酸ala27-ala479,目录号9749-dl,r&d systems)的系列稀释液中。如图2a-图2d所示,结合是浓度依赖性的。使用单价(1:1)结合模型计算解离常数(kd)。如图2e所示,所有的单克隆抗体的亲和力都在亚纳摩尔范围内。图7显示了6-g23-f、10-o18-a和2-c8-a单克隆抗体(mab)选择性结合dll3,但是不结合dll1或dll4。7-i1-b mab结合dll3和dll4二者,但是不结合dll1。
[0271]
这些结果证明本发明技术的免疫球蛋白相关组合物以高亲和力特异性结合dll3。因此,本发明技术的免疫球蛋白相关组合物可用于检测生物样品中的dll3蛋白的方法中。实施例7:单克隆抗体与转染细胞和原代细胞的结合。
[0272]
通过流式细胞术测试四种单克隆抗体(6-g23-f、2-c8-a、7-i1-b和10-o18-a)与小鼠和食蟹猴dll3以及内源性人dll3结合的能力。为此,将hek293细胞用编码全长人、小鼠或食蟹猴dll3的质粒dna转染并且用于实验。简言之,将在facs缓冲液pbs 0.5%bsa中的106个转染的hek293细胞或nci-h82原代细胞添加到96孔u底板的孔中,并且以10μg/ml添加纯化的单克隆。在4℃下孵育30分钟后,将细胞在facs缓冲液中洗涤3次,并且与pe标记的f(ab)2抗小鼠igg h和l第2阶段一起孵育。在4℃下孵育另外的30分钟后,将细胞在facs缓冲液中洗涤三次,并且在流式细胞仪上进行分析。数据以单克隆的平均荧光强度除以第2阶段的背景染色的比率呈现。如下表所示,将所有的单克隆抗体都与食蟹猴dll3交叉反应,并且在nci h82细胞上检测到内源性dll3,但是只有6-g23-f和7-i1-b与小鼠dll3结合。
[0273]
这些结果证明本发明技术的免疫球蛋白相关组合物可用于检测生物样品中的dll3蛋白的方法中。实施例8:测序。
[0274]
通过race(快速扩增cdna末端)从7-i1-b、6-g23-f、2-c8-a和10-o18-a的相应杂交瘤中分离四种单克隆抗体的可变重链和可变轻链。使用rnaeasy试剂盒(qiagen)从裂解的杂交瘤分离rna。分离mrna用于cdna合成,并且使用race试剂盒生成pcr产物。然后将pcr产物克隆到topo载体中,进行pcr扩增,并且随后凝胶分离用于测序。重链可变结构域(vh)和轻链可变结构域(v
l
)的核苷酸和氨基酸序列显示在下表和图3a-图3d(7-i1-b)、图4a-图4d(2-c8-a)、图5a-图5d(10-o18-a)和图6a-图6d(6-g23-f)中。
实施例9:nci-h209异种移植物的处理。
[0275]
本研究将使用八周龄的雌性无胸腺裸小鼠。nci-h209肿瘤细胞将在含有10%胎牛血清(fcs)的rpmi中生长至对数中期。将细胞在组织培养瓶中在37℃下在5%co2和95%空气的气氛中的加湿培养箱中培养。在小鼠右侧腹皮下植入总体积0.2ml的在50%基质胶中的5
×
106个nci-h209肿瘤细胞。接种后八天,当肿瘤达到约150mm3的平均肿瘤体积时,将小鼠随机分组。将小鼠在第8、12和15天经由腹膜内注射人igg1(1或10mg/kg;n=5-15只小鼠)作为阴性对照或6-g23-f、2-c8-a、7-i1-b和10-o18-a的一种或多种抗体-药物缀合物(1或10mg/kg;n=5-15只小鼠)进行注射。将测量肿瘤生长。
[0276]
将使用文献中已知的方法制备6-g23-f、2-c8-a、7-i1-b和10-o18-a的抗体-药物缀合物。一些方法在本文的实施例3-4中公开。将一种或多种蛋白质毒素(例如,皂草素毒素、假单胞菌外毒素和白喉毒素)、放射性核素、蒽环霉素、微管抑制剂、有丝分裂抑制剂、dna损伤剂、核苷酸类似物、氨基酸类似物、维生素类似物与6-g23-f、2-c8-a、7-i1-b和10-o18-a缀合以分别生成6-g23-f-adc、2-c8-a-adc、7-i1-b-adc和10-o18-a-adc。本研究将使用八周龄的雌性无胸腺裸小鼠。nci-h209肿瘤细胞将在含有10%胎牛血清(fcs)的rpmi中生长至对数中期。将细胞在组织培养瓶中在37℃下在5%co2和95%空气的气氛中的加湿培养箱中培养。在小鼠右侧腹皮下植入总体积0.2ml的在50%基质胶中的5
×
106个nci-h209肿瘤细胞。接种后八天,当肿瘤达到约150mm3的平均肿瘤体积时,将小鼠随机分组。将小鼠在第8、12和15天经由腹膜内注射人igg1-adc(0.11或1mg/kg;n=5-15只小鼠)作为阴性对照或6-g23-f-adc、2-c8-a-adc、7-i1-b-adc或10-o18-a-adc中的一种或多种(0.1或1mg/kg;n=5-15只小鼠)进行注射。将测量肿瘤生长。
[0277]
这些结果将证明本发明技术的免疫球蛋白相关组合物可用于治疗患有dll3相关癌症(例如,小细胞肺癌、大细胞神经内分泌癌、肺神经内分泌癌、肺外神经内分泌癌、肺外神经内分泌癌或黑色素瘤)的受试者的方法中。等同物
[0278]
本发明技术并非受限于本技术中描述的具体实施方案,所述实施方案旨在作为本发明技术的单独方面的单一说明。如本领域技术人员将清楚的是,可以在不背离本发明技术的精神和范围的情况下,对本发明技术进行许多修改和改变。本领域技术人员根据前述描述将清楚,除了本文列举的方法和设备外,在本发明技术范围内的功能上等效的方法和设备。此类修改和改变旨在落入本发明技术的范围内。应理解,本发明技术并不限于具体方法、试剂、化合物、组合物或生物系统,它们当然可以改变。还应理解,本文所用的术语仅用于描述具体实施方案的目的,并不旨在是限制性的。
[0279]
另外,在本公开文本的特征或方面按马库什群组(markush group)来描述的情况下,本领域技术人员将认识到,本公开文本因此也按马库什群组的任何单独成员或成员亚组来描述。
[0280]
本领域技术人员将理解,出于任何和所有目的,特别是就提供书面描述而言,本文公开的所有范围还涵盖其任何和所有可能的子范围和子范围的组合。任何所列范围都可容易地识别为充分描述相同范围并且使得相同范围能分解为至少相等的二分之一、三分之一、四分之一、五分之一、十分之一等。作为非限制性例子,本文中论述的每个范围可容易地分解为下三分之一、中三分之一和上三分之一等。同样如本领域技术人员可理解,所有如“高达”、“至少”、“大于”、“小于”等言辞都包括所述数字并且涉及随后可分解为如上所述的子范围的范围。最后,如本领域技术人员可理解,范围包括每一个别成员。因此,例如,具有1-3个细胞的组是指具有1、2或3个细胞的组。类似地,具有1-5个细胞的组是指具有1、2、3、4或5个细胞的组等等。
[0281]
本文所提及或引用的所有专利、专利申请、临时申请和出版物都通过引用以其整体而并入,包括所有图形和表格,并入程度使其不会与本说明书的明确传授内容不一致。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。