1.本发明属于生物医药领域,涉及一种杜仲叶木脂素类化合物、制备方法及神经保护的应用。
背景技术:
2.帕金森(pd)是一种慢性神经退行性运动障碍疾病,主要由黑质中多巴胺能神经元的死亡引起,其特征是中枢和外周神经元的特定群体退化,包括黑质中多巴胺能神经元。pd中神经元死亡的潜在机制尚不完全清楚,目前的疗法主要针对症状而不是神经元丢失
1.。由于神经元死亡,无论其起因如何,通常都需要促凋亡基因激活。有研究结果表明dna损伤、氧化应激、缺氧、er应激和能量消耗均为引起pd神经元变性的原因
2.。大量的体内和外实验表明,ros过度产生会引起的氧化应激,可诱发神经退行性疾病
3.。在正常生理反应中,ros是由线粒体形成的,能够被被细胞本身的抗氧化防御清除。然而,当ros超过细胞防御的清除能力时,就会发生氧化应激,最终导致细胞凋亡,在神经退行性疾病的发病机制中起重要作用
4.。其中pi3k/akt信号通路的激活会抑制细胞凋亡,并促进神经生存
5.。目前治疗pd药物并不能够停止或延缓多巴胺能神经元变性,因此发掘抗氧化和抗凋亡作用的药物对于防治pd具有重要意义。
3.杜仲(eucommiaulmoides oliver)是我国孑遗植物,主要分布在我国的陕西、四川、河南,以及湖北等地,在我国具有悠久的用药史,在治疗腰膝酸软,强身健骨,保肝护肾方面具有药理活性
6.。研究发现杜仲的一些活性成分如:木脂素类、多酚类、黄酮类和环烯醚萜类化合物在降血压、降血脂,以及神经保护
[7-11]
方面具有很好的生物活性。
[0004]
利用h2o2诱导pc-12细胞建立氧化损伤细胞模型
[12]
,检测杜仲叶内分离得到的木脂素类化合物的神经细胞保护活性,实验结果证明双环氧木脂素化合物1,2和4具有较好的神经保护活性。以它们为研究对性,利用网络药物靶标技术探索它们的作用机制,借助western blot技术在蛋白水平上证实其神经保护活性,以期为从杜仲中筛选出神经保护活性的先导化合物提供科学依据。
[0005]
参考文献:
[0006]
[1]ryu ej,angelastro jm,greene la.2005.analysis of gene expression changes in a cellular model of parkinson disease.neurobiol dis,18(1):54-74.
[0007]
[2]malagelada c,jin zh,greene la.2008.rtp801 is induced in parkinson's disease and mediates neuron death by inhibiting akt phosphorylation/activation.j neurosci,28(53):14363-14371.
[0008]
[3]aliev g,priyadarshini m,reddy vp,grieg nh,kaminsky y,cacabelos r,ashraf gm,jabir nr,kamal ma,nikolenko vn,zamyatnin aa jr,benberin vv,bachurin so.2014.oxidative stress mediated mitochondrial and vascular lesions as markers in the pathogenesis of alzheimer disease.curr med chem,21(19):2208-2217.
[0009]
[4]underwood br,imarisio s,fleming a,rose c,krishna g,heard p,quick m,korolchuk vi,renna m,sarkar s,garc
í
a-arencibia m,o'kane cj,murphy mp,rubinsztein dc.2010.antioxidants can inhibit basal autophagy and enhance neurodegeneration in models of polyglutamine disease.hum mol genet,19(17):3413-3429.
[0010]
[5]pap m,cooper gm.1998.role of glycogen synthase kinase-3in the phosphatidylinositol 3-kinase/akt cell survival pathway.j biolchem,273(32):19929-19932.
[0011]
[6]he x,wang j,li m,hao d,yang y,zhang c,he r,tao r.2014.eucommiaulmoidesoliv.:ethnopharmacology,phytochemistry and pharmacology of an important traditional chinese medicine.j ethnopharmacol.151(1):78-92.
[0012]
[7]guo h,shi f,li m,liu q,yu b,hu l.neuroprotective effects of eucommiaulmoidesoliv.and its bioactive constituent work via ameliorating the ubiquitin-proteasome system.bmc complement altern med.2015;15:151.
[0013]
[8]fan s,yin q,li d,ma j,li l,chai s,guo h,yang z.anti-neuroinflammatory effects of eucommiaulmoidesoliv.in a parkinson's mouse model through the regulation of p38/jnk-fosl2 gene expression.j ethnopharmacol.2020;260:113016.
[0014]
[9]kwon sh,ma sx,hong si,kim sy,lee sy,jang cg.eucommiaulmoidesoliv.bark.attenuates 6-hydroxydopamine-induced neuronal cell death through inhibition of oxidative stress in sh-sy5y cells.j ethnopharmacol.2014;152(1):173-82.
[0015]
[10]li cp,qiu gz,liu b,chen jl,fu ht.neuroprotective effect of lignans extracted from eucommiaulmoidesoliv.on glaucoma-related neurodegeneration.neurol sci.2016;37(5):755-62.
[0016]
[11]huang q,tan jb,zeng xc,wang yq,zou zx,ouyang ds.lignans and phenolic constituents from eucommiaulmoides oliver.nat prod res.2021;35(20):3376-3383.
[0017]
[12]seo jy,ju sh,oh j,lee sk,kim js.2016.neuroprotective and cognition-enhancing effects of compound k isolated from red ginseng.j agric food chem,64(14):2855-2864.
技术实现要素:
[0018]
本发明从杜仲叶的乙醇提取物中分离得到12个木脂素类化合物,这些化合物对h2o2诱导的pc-12细胞具有有较强的神经保护活性,其中双环氧木脂素类化合物1-6活性佳,以活性最好的1、2和4为例,发现其通过调控pi3k/akt/gsk-3β/nrf2信号通路保护神经细胞免受氧化刺激。
[0019]
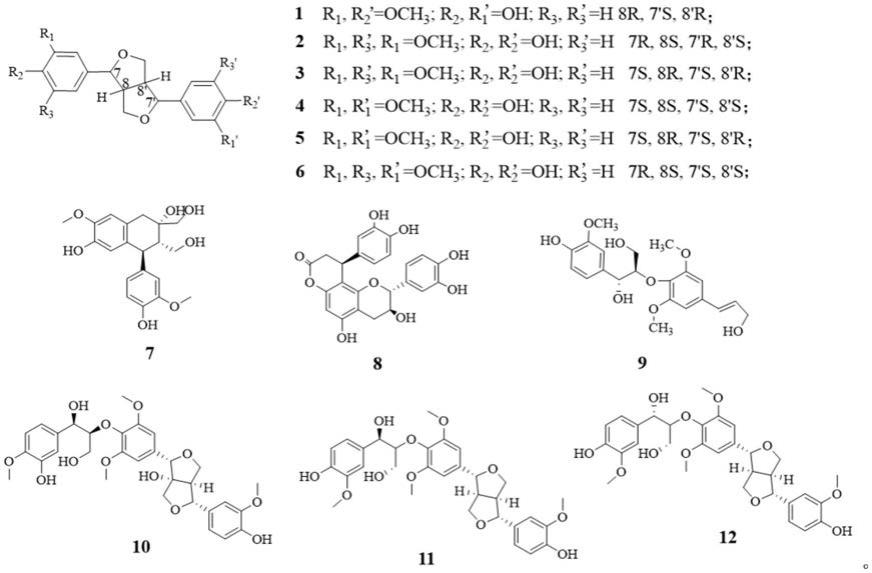
本发明的化合物结构式为:
1.0,meoh);
[0032]
本发明的化合物hedyotold(12)理化性质:c
31h36o11
;黄色粉末;[α]
20d 15.8(c 1.0,meoh);
[0033]
所述化合物均于杜仲叶乙醇提取物的乙酸乙酯相中分离得到。
[0034]
所述的杜仲叶于2017年采购与河南孟州,于室温内阴干后使用。
[0035]
可选的,杜仲叶的提取物用75%(v/v)的乙醇回流提取,再用等体积的乙酸乙酯萃取得到乙酸乙酯相浸膏;
[0036]
乙酸乙酯相浸膏通过硅胶柱层析用etoac-meoh(v/v,100:0
→
0:100)连续洗脱,将etoac提取物在硅胶柱中分离得到八个馏分(a~h)。
[0037]
fr d用chcl
3-meoh(v/v,50:1
→
10:1)梯度洗脱,得到4个片段(fr d-1~fr d-4),然后fr d-2通过凝胶柱sephadexlh-20(meoh)和反相rp-18柱meoh-h2o(v/v 20%
→
100%)。半制备型hplc(meoh-h2o,v/v 25%-100%)最终纯化得到化合物1(5mg)、2(8mg)、3(4mg)、4(12mg)、5(8mg)和6(9mg)。fr d-3经sephadex lh-20柱(chcl
3-meoh,v/v,1:1),然后通过半制备型hplc(meoh-h2o,v/v 50%)分离纯化得到化合物9(3.6mg)和10(4mg)。fr d-5经rp-18柱(meoh-h2o,v/v 10%
→
100%)分离得到三段(fr d-5-1~fr d-5-3),fr d 5-2进一步通过半制备型hplc(meoh-h2o,v/v 35%-100%)纯化得到化合物11(2.5mg)和12(3mg)。用ch2cl
2-meoh(v/v,50:1
→
1:1)梯度分离馏分e,得到九个馏分(fr e-1~fr e-9)。fr e-4通过sephadex lh-20柱纯化,然后进一步通过半制备型hplc(meoh-h2o,65%)分离,得到化合物7(6mg)。fr e-6用sephadex lh-20柱(meoh)分离,然后通过半制备型hplc(meoh-h2o,v/v,35:65)进一步纯化,得到化合物8(6mg)。
[0038]
本发明所述的木脂素类化合物用于制备神经保护药物的应用。本发明中,用h2o2诱导的pc-12细胞作为氧化应激下的神经细胞模型;所述的木脂素类化合物对pc-12细胞具有保护活性的最低浓度为6.25μm。
[0039]
一种治疗神经退行性疾病的药物,含有本发明所述的木脂素类化合物。
[0040]
本发明的木脂素类化合物作为神经保护小分子药物,在神经退行性疾病的防治方面具有开发应用潜力。
附图说明
[0041]
附图是用来提供对本公开的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本公开,但并不构成对本公开的限制。在附图中:
[0042]
图1为化合物1-6对h2o2诱导的pc-12细胞中细胞活力,ros和ldh的影响;(a)pc-12的细胞活力;化合物1-6对h2o2诱导的pc-12细胞中ldh(b)和ros(c)释放水平的影响;数据表示为三个独立实验的平均值
±
标准差。#p《0.05,##p《0.01,###p《0.001,与对照组相比;*p《0.05,**p《0.01,***p《0.001,与h2o2治疗组相比。
[0043]
图2为calcein-am(钙黄绿素)/pi(碘化丙啶)染色化合物1-6作用下h2o2诱导的pc-12细胞;calcein-am将活细胞染成绿色;pi将死细胞染成红色。
[0044]
图3为化合物1-6对h2o2诱导的pc-12细胞中gpx和sod酶活力的影响;数据表示为三个独立实验的平均值
±
标准差。#p《0.05,##p《0.01,###p《0.001,与对照组相比;*p《0.05,**p《0.01,***p《0.001,与h2o2治疗组相比。
[0045]
图4为化合物1,2和4对h2o2诱导的pc-12细胞中抗氧化蛋白ho-1、nqo-1和cat的影响;(a)ho-1,nqo-1和cat的蛋白表示水平;(b)ho-1蛋白定量的分析结果;(c)nqo-1蛋白定量的分析结果;(d)cat蛋白定量的分析结果。数据为平均值
±
标准差(n=3),#p《0.05,##p《0.01,###p《0.001,与对照组相比,*p《0.05,**p《0.01,***p《0.001与h2o2组相比;
[0046]
图5为化合物1,2和4对h2o2诱导的pc-12细胞核内外的nrf2的影响;(a)nrf2在细胞核和细胞质的蛋白表示水平;(b)细胞核中nrf2蛋白定量的分析结果;(c)细胞质中nrf2蛋白定量的分析结果。数据为平均值
±
标准差(n=3),#p《0.05,##p《0.01,###p《0.001,与对照组相比,*p《0.05,**p《0.01,***p《0.001与h2o2组相比。
[0047]
图6为化合物1,2和4对h2o2诱导的pc-12细胞中pi3k/akt/gsk-3β信号通路的影响;(a)pi3k,p-akt,akt,p-gsk 3β和gsk-3β的蛋白表示水平;(b)pi3k蛋白定量的分析结果;(c)p-akt/akt蛋白定量的分析结果;(d)p-gsk 3β/gsk-3β蛋白定量的分析结果。数据为平均值
±
标准差(n=3),#p《0.05,##p《0.01,###p《0.001,与对照组相比,*p《0.05,**p《0.01,***p《0.001与h2o2组相比。
[0048]
图7为ly294002存在时化合物1,2和4对h2o2诱导的pc-12细胞中ho-1、nqo-1、cat、pi3k和nrf2的影响;(a)ho-1,nqo-1,cat,nrf2和pi3k的蛋白表示水平;(b)ho-1蛋白定量的分析结果;(c)nqo-1蛋白定量的分析结果;(d)cat蛋白定量的分析结果;(e)nrf2蛋白定量的分析结果;(f)pi3k蛋白定量的分析结果。数据为平均值
±
标准差(n=3),#p《0.05,##p《0.01,###p《0.001,与对照组相比,*p《0.05,**p《0.01,***p《0.001与h2o2组相比,δp《0.05,δδp《0.01,δδδp《0.001与ly294002组相比。
[0049]
图8为化合物1的氢谱;
[0050]
图9为化合物1的碳谱;
[0051]
图10为化合物1的dept谱;
[0052]
图11为化合物1的hsqc谱;
[0053]
图12为化合物1的1h-1
h cosy谱;
[0054]
图13为化合物1的hmbc谱;
[0055]
图14为化合物1的noesy谱;
[0056]
图15为化合物1的hresims谱。
具体实施方式
[0057]
以下将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,以下所描述的实施例仅是本发明的一部分实施例,并非全部实施例,也并未对本发明做任何形式上的限制,凡是利用本实施例的技术方案,包括对本实施例做了简单的变化,均属于本发明保护的范围。
[0058]
本发明的十二个化合物( )-7-epi-pinoresinolmr1(1),( )-medioresinol(2),(-)-medioresinol(3),( )-diapinoresinol(4),(-)-pinoresinol(5),( )-de-4',4"-o-dimethylepimagnolin a(6),( )-cycloolivil(7),cinchonainib(8),threo-guaiacylglycerol-8-o-40-sinapyl alcohol ether(9),firmianols b(10),hedyotol c(11)和hedyotol d(12)是从杜仲叶乙醇浸提物中分离得到。该杜仲叶采集自中华人民共和国河南省孟州地区。
5-3)fr d 5-2进一步通过半制备型hplc(meoh-h2o,v/v 35%-100%)纯化得到化合物11(2.5mg)和12(3mg)。用ch2cl
2-meoh(v/v,50:1
→
1:1)梯度分离馏分e,得到九个馏分(fr e-1~fr e-9)。fr e-4通过sephadex lh-20纯化,然后进一步通过半制备型hplc(meoh-h2o,65%)分离,得到化合物7(6mg)。fr e-6用sephadex lh-20(meoh)分离,然后通过半制备型hplc(meoh-h2o,35:65)进一步纯化,得到化合物8(6mg)。
[0069]
1.2.化合物1的理化性质
[0070]
表1.化合物1的1h(500mhz)和
13
c(125mhz)核磁数据(dmso-d6)
[0071][0072][0073]
本发明的木脂素类化合物( )-7-epi-pinoresinol mr1理化性质为:
[0074]c20h22
o6,淡黄色不定型粉末。hr-esims(negative)m/z 357.1356[m-h]-(计算值c
20h21
o6,357.1338);1h-nmr谱和
13
c-nmr谱数据见表1,核磁和质谱见图8-15。
[0075]
1.3对h2o2诱导的pc-12细胞的神经保护活性
[0076]
利用大鼠肾上腺嗜铬细胞(pc-12)作为神经细胞模型,以h2o2作为氧化剂诱导神经细胞产生氧化应激,刺激细胞凋亡,实验中使用cck-8试剂确定细胞存活率,检测化合物在h2o2的氧化诱导下是否具有神经保护活性,阳性药选用橙皮素(hesperitin)。
[0077]
1.3.1细胞活力检测
[0078]
细胞活力是指以空白对照的吸光值为例归一化其它实验组的细胞吸光值计算其百分比即为细胞存活力。采用cck8对细胞进行染色测定其活力。将细胞按照1.5
×
105个/ml(100μl/孔)的密度接种到96孔板中,37℃ 5%co2的恒温培养箱中培养24小时。然后将h2o2按照浓度为:0,100,200,300,400和500μm分别加入培养基,于37℃5%co2的恒温培养箱中氧化刺激细胞12小时,加入10μl的cck-8在培养箱中避光培养3小时,读取450nm处的吸光度(od值),计算pc-12细胞的存活率,选择出最佳的h2o2浓度为400μm。将细胞按照1.5
×
105个/ml(100μl/孔)的密度接种到96孔板中,37℃ 5%co2的恒温培养箱中培养细胞24小时。设置空白对照组(dmso),阴性对照组(dmso),阳性对照组(25μm橙皮素),实验组(6.25,12.5和25μm化合物),分别预处理细胞6小时后,再加入400μm的h2o2刺激细胞12小时,最后加入cck-8,从重复上述操作,计算化合物作用下pc-12细胞的存活率。
[0079]
1.3.2乳酸脱氢酶(lactate dehydrogenase,ldh)抑制活性
[0080]
设置空白对照组(无pc-12细胞,仅含培养基),细胞对照组(pc12细胞,不用h2o2处理),阴性对照组(pc-12细胞,h2o2处理),阳性对照组(pc-12细胞 25μmhesperitin h2o2处理),样品处理组(pc-12细胞 25μm化合物 h2o2处理),按照上述分组,细胞以1.0
×
105个/ml的密度接种到96孔板中(150μl/孔),在37℃ 5%co2的恒温培养箱中培养24小时。用pbs液洗涤一次,换低血清培养液(含1%hs 0.5%fbs),阳性对照组和样品处理组中分别加入橙皮素和化合物,并做好标记,在37℃ 5%co2的恒温培养箱中培养6小时。然后,按照分组用400μm的h2o2氧化刺激细胞11小时,从细胞培养箱里取出细胞培养板,在阴性对照组中加入10μl试剂盒内提供的ldh释放试剂,轻柔吹的打各孔数次混匀液体。于细胞培养箱中避光孵育1小时后,分别取各孔的上清液120μl,加入到一新的96孔板相应孔中,加入检测液,并用锡箔纸包裹,室温下震荡30min,用酶标仪在490nm处测量吸光度(od值)。
[0081][0082]
1.3.3谷胱甘肽过氧化物酶(glutathione peroxidase,gpx)活力的检测
[0083]
将细胞按照2
×
105个/ml的密度接种到24孔板中(500μl/孔),在37℃ 5%co2的恒温培养箱中培养24小时。空白对照组(dmso),阴性对照组(dmso),阳性对照组(25μm橙皮素),实验组(25μm化合物),分别作用于细胞6小时后,用400μm的h2o2刺激细胞12小时,用pbs清洗后,每孔中加入15μl蛋白裂解液,将裂解液移入500μl离心管,用低温离心机在4℃,12000g条件下离心10min,保存上清液置于冰浴中,并检测上清液蛋白浓度。按照说明书配制工作液,在96孔板中,依次加入检测缓冲液、提取样品的稀释液和gpx检测工作液,加入完成后混匀,室温孵育15min,再向每孔加入10μl 30mm的过氧化物溶液,再次混匀。立即使用酶标仪检测340nm处的吸光度(od值),此时记录值为0分钟读值,温度设置为25℃,每隔1分钟自动/手动测定一次a340,连续记录25min,挑选出δa340/t(min)在0.01-0.2范围内的数
据计算gpx的酶活力。
[0084][0085]
v(ml)为反应体系,本次实验为0.1ml;vsample(ml)为反应体系中样品体积,本次实验为0.02ml;dil为样品稀释倍数;样品蛋白浓度利用bca蛋白检测试剂盒进行检测。
[0086]
1.3.4总超氧化物歧化酶(superoxide dismutase,sod)活性检测
[0087]
将细胞按照2
×
105个/ml的密度接种到24孔板中(500μl/孔),在37℃ 5%co2的恒温培养箱中培养24小时。空白对照组(dmso),阴性对照组(dmso),阳性对照组(25μm橙皮素),实验组(25μm化合物),分别作用于细胞6小时后,用400μm的h2o2诱导细胞12小时后,移除培养液,用4℃或冰浴预冷的pbs将细胞洗涤一遍,再加入20μl试剂盒内包含的sod样品制备液,反复吹打以细胞使其充分裂解,将裂解液移入150μl的离心管,4℃,12000g下离心10min,吸取上清液并检测上清液中蛋白浓度,冰浴中保存上清液,以便后续实验。设置空白对照组1(不含样品),空白对照2(不含样品,不加反应启动工作液)和实验组,按照每个反应160μl的体积配制适量的wst-8/酶工作液冰浴中保存,取96孔板,依次加入准备好的样品提取液、sod检测缓冲液、wst-8/酶工作液和反应启动液,在37℃恒温培养箱中,孵育30min,用酶标仪测量450nm处的吸光度(od值)。
[0088][0089]
1.3.5活性氧(reactive oxygen species,ros)检测
[0090]
将细胞按照2
×
105个/ml的密度接种到24孔板中(500μl/孔),在37℃ 5%co2的恒温培养箱中培养24小时。空白对照组(dmso),阴性对照组(dmso),阳性对照组(25μm橙皮素),实验组(25μm化合物),分别作用于细胞0.5小时后,用400μm的h2o2诱导细胞1小时。将试剂盒内自带的dcfh-da按照1:1000的比例用无血清培养液稀释,终浓度为10μm。去除细胞培养液,加入250μl dcfh-da稀释液。在恒温培养箱内孵育20min后,用无血清细胞培养液再洗涤细胞三次,将未进入细胞内的dcfh-da充分去除。利用荧光酶标仪设置激发波长为488nm,发射波长为525nm,检测刺激前后荧光的强弱。
[0091][0092]
表2木脂素类化合物对h2o2诱导的pc-12细胞中细胞活力、ros、ldh、gpx和sod的影响
[0093][0094]
*p《0.05;**p《0.01;***p《0.001表示与h2o2组相比。
[0095]
为了研究不同浓度的化合物1-6对pc-12细胞中氧化应激反应的影响,在h2o2处理的pc-12细胞中测定了细胞活力以及ldh和ros的水平。如图1a-c所示,与对照组(dmso)相比,h2o2处理组(p《0.001)的细胞活力显着降低,这表明在氧化应激下发生了细胞死亡。化合物1-6显着提高了细胞存活率(p《0.001)。与对照组(dmso)相比,h2o2治疗组的ldh和ros水平显着增加(p《0.001),但化合物1-6治疗组的ldh和ros水平降低(p《0.001)与h2o2治疗组相比。此外,calcein-am/pi染色的活细胞和死细胞进一步证明了化合物1-6的神经保护活性(图2)。
[0096]
在图3a-b中,sod和gpx的酶活性在h2o2处理组中最低;对照组的活动度最高。在氧化应激条件下,化合物1-6以剂量依赖性方式显着提高了sod和gpx的酶活性。其中,25μm的化合物1、2、4对sod和gpx的酶活性增强效果更好(p《0.001)。
[0097]
研究结果显示,化合物1,2和4在氧化应激下的神经保护活性最佳,将深入研究其作用机制。
[0098]
图1化合物1-6在h2o2诱导的pc-12细胞中的神经保护作用。
[0099]
(a)pc-12的细胞活力;化合物1-6对h2o2诱导的pc-12细胞中ldh(b)和ros(c)释放水平的影响;数据表示为三个独立实验的平均值
±
标准差。#p《0.05,##p《0.01,###p《0.001,与对照组相比;*p《0.05,**p《0.01,***p《0.001,与h2o2治疗组相比。
[0100]
图2化合物1-6降低了h2o2诱导的pc-12细胞的凋亡。
[0101]
calcein-am将活细胞染成绿色;pi将死细胞染成红色。
[0102]
图3化合物1-6在h2o2诱导的pc-12细胞中sod(a)和gpx(b)与的活力。
[0103]
数据表示为三个独立实验的平均值
±
标准差。#p《0.05,##p《0.01,###p《0.001,与对照组相比;*p《0.05,**p《0.01,***p《0.001,与h2o2治疗组相比。
[0104]
1.4化合物1,2和4对抗氧化蛋白(ho-1、nqo-1和cat)表达量的影响
[0105]
将细胞按照2
×
105个/ml的密度接种到9cm板中(10ml/皿),在37℃ 5%co2的恒温培养箱中培养24小时。对照组(dmso)、h2o2处理组(dmso)、阳性对照组(25μm橙皮素hesperitin)和化合物2-7处理组(6.25,12.5和25μm化合物)分别作用于细胞6小时后,用
x.2017.the triterpenoid cddo-imidazolide ameliorates mouse liver ischemia-reperfusion injury through activating the nrf2/ho-1pathway enhanced autophagy.cell death dis,8(8):e2983-e2990.
[0113]
1.6化合物1,2和4对pi3k/akt/gsk3β信号通路的影响
[0114]
pi3k/akt信号传导途径是一种关键的分子信号转导途径,涉及糖酵解、细胞周期和细胞凋亡的生化和病理过程,与多种疾病相关联。研究证明该通路对于调节衰老,以及许多神经退行性疾病期间的神经元存活和突触可塑性也很重要
[14]
。在pd的病理生理过程中,活化的pi3k/akt信号通路促进内皮存活,限制神经元损伤,进而阻断炎性神经元死亡。akt的激活可以增强gsk-3β的ser9磷酸化进而抑制gsk-3β,akt对gsk-3β的负调节在神经退行性疾病(如pd和ad)中的细胞周期进程和代谢中发挥关键作用
[15]
。
[0115]
如图6所示,pi3k,p-akt和p-gsk3β蛋白表达量随着化合物1,2和4浓度的升高呈浓度依赖性增加,akt和gsk-3β蛋白表达量在各实验组间无明显变化。蛋白定量分析结果表明,pi3k蛋白在空白对照组和阴性对照组之间无显著差异,与阴性对照组相比,25μm的化合物1,2和4作用下的pi3k蛋白表达量显著增强(p《0.001);p-akt/akt和p-gsk3β/gsk-3β在空白对照组和阴性对照组之间无显著差异,与阴性对照组相比,25μm的化合物2和4作用下的p-akt/akt明显增高(p《0.01),25μm的化合物1作用下的p-akt/akt显著增高(p《0.001);与阴性对照组相比,25μm的化合物1,2和4作用下的p-gsk3β/gsk-3β显著增强(p《0.001)。
[0116]
图6化合物1、2和4对h2o2诱导的pc-12细胞中pi3k/akt/gsk-3β信号通路的影响;(a)pi3k,p-akt,akt,p-gsk 3β和gsk-3β的蛋白表示水平;(b)pi3k蛋白定量的分析结果;(c)p-akt/akt蛋白定量的分析结果;(d)p-gsk 3β/gsk-3β蛋白定量的分析结果。数据为平均值
±
标准差(n=3),#p《0.05,##p《0.01,###p《0.001,与对照组相比,*p《0.05,**p《0.01,***p《0.001与h2o2组相比。
[0117]
[14]kitagishi y,nakanishia,oguray,matsuda s.2014.dietary regulation of pi3k/akt/gsk-3 beta pathway in alzheimer's disease.alzheimer's res ther,6(3):35-43.
[0118]
[15]yang l,wang h,liu l,xie a.2018.the role of insulin/igf-1/pi3k/akt/gsk3βsignaling in parkinson's disease dementia.front neurosci,12:73-79.
[0119]
1.7抑制剂ly294002的存在下化合物1,2和4对pi3k、nrf2、ho-1、nqo-1和cat表达量的影响
[0120]
研究证明,ly294002作为pi3k的特异性抑制剂
[16]
,显著降低了pi3k通路下游蛋白的表达量。ly294002作为pi3k抑制剂对纯化的pi3k蛋白的ic50为1.2μm,本次实验中使用蛋白提取物为蛋白混合物,设定ly294002的浓度为2μm。先用2μm的ly294002预处理pc-12细胞2h,再用25μm的化合物处理细胞6h,最后用h2o2诱导细胞12h,最后对提取的蛋白质进行western blot分析。
[0121]
如图7所示,与阴性对照组相比,加入抑制剂实验组(ly294002),ho-1(p《0.001),nqo-1(p《0.001),cat(p《0.01),nrf2(p《0.05)和pi3k(p《0.01)蛋白表达量明显降低。与抑制剂实验组相比,ly294002处理后25μm的化合物1实验组中ho-1(p《0.01),nqo-1(p《0.001),cat(p《0.01),nrf2(p《0.001)和pi3k(p《0.001)蛋白表达量显著增高;25μm的化合物2显著增加了ly294002预处理后h2o2诱导的pc-12细胞中ho-1(p《0.01),nqo-1(p《0.001),
cat(p《0.01),nrf2(p《0.05)和pi3k(p《0.001)蛋白表达量;ly294002处理后25μm的化合物4实验组中ho-1(p《0.001),nqo-1(p《0.001),cat(p《0.001),nrf2(p《0.05)和pi3k(p《0.001)蛋白表达量显著增高。因此,上述数据表明化合物1,2和4通过pi3k/akt/gsk-3β信号通路,诱导产生具有细胞保护作用的抗氧化酶,来发挥其神经细胞的保护活性。
[0122]
图7化合物1,2和4对ly294002作用后h2o2诱导的pc-12细胞中ho-1,nqo-1,cat,nrf2和pi3k的蛋白的影响;(a)ho-1,nqo-1,cat,nrf2和pi3k的蛋白表示水平;(b)ho-1蛋白定量的分析结果;(c)nqo-1蛋白定量的分析结果;(d)cat蛋白定量的分析结果;(e)nrf2蛋白定量的分析结果;(f)pi3k蛋白定量的分析结果。数据为平均值
±
标准差(n=3),#p《0.05,##p《0.01,###p《0.001,与对照组相比,*p《0.05,**p《0.01,***p《0.001与h2o2组相比,δp《0.05,δδp《0.01,δδδp《0.001与ly294002组相比。
[0123]
[16]li x,ma xy,feng yf,ma zs,wang j,ma tc,qi w,lei w,wang l.2015.osseointegration of chitosan coated porous titanium alloy implant by reactive oxygen species-mediated activation of the pi3k/akt pathway under diabetic conditions.biomaterials.36:44-54.
[0124]
综上所述,在神经退行性疾病的防治方面,木脂素类化合物可以作为有潜力的先导化合物进行开发。
[0125]
以上结合附图详细描述了本公开的优选实施方式,但是,本公开并不限于上述实施方式中的具体细节,在本公开的技术构思范围内,可以对本公开的技术方案进行多种简单变型,这些简单变型均属于本公开的保护范围。
[0126]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本公开对各种可能的组合方式不再另行说明。
[0127]
此外,本公开的各种不同的实施方式之间也可以进行任意组合,只要其不违背本公开的思想,其同样应当视为本公开所公开的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。