1.本发明属于免疫检测技术领域,具体地说,涉及肝癌特异性标志物醛酮还原酶1b10(akr1b10)、甲胎蛋白(afp)、甲胎蛋白异质体(afp-l3)和异常凝血酶原(dcp)联合测定试剂盒,可用于肝癌或高危人群的早期筛查、诊断、疗效判断、预后评估或复发监测。
背景技术:
2.原发性肝细胞肝癌(hepatocellular carcinoma,hcc)是临床上常见的恶性肿瘤之一,其主要发病诱因是由肝硬化、肝炎、酒精性和非酒精性脂肪肝导致,这类患者统称为肝癌高危人群。根据世界卫生组织统计,2020年肝癌全球有91万新发病例,83万死亡病例。肝癌早期症状不明显,一旦确诊,通常已发展为晚期,失去了最佳临床治疗期。目前临床对肝癌的诊断主要采用影像学检查和血清标志物检测,由于影像学检测灵敏度较低,且价格高昂,不适用于对高危人群大规模筛查。临床常用肝癌血清标志物包括甲胎蛋白、甲胎蛋白异质体和异常凝血酶原,虽然都具有一定的诊断价值,但是单一项目的诊断仍存在局限性,如果联合多种肿瘤标志物同时检测可大幅度的提升肝癌早期诊断的灵敏度和特异性,可极大的改善血清检测的漏检和错检现象。
3.甲胎蛋白(α-fetoprotein,αfp或afp)是一种相对分子质量约68kda的癌胚糖蛋白,由胎儿肝脏和卵黄囊合成。成人中,afp由肝细胞产生,其血清中含量极微,但当肝细胞发生癌变时,却又恢复了产生afp的功能,而且随着病情的恶化,afp在血清中的含量会急剧增加。检测血清afp水平对早期诊断原发性肝癌具有极高的临床价值,所以afp长期升高被视为原发性肝癌的特异性指标。然而并非所有肝癌患者的肝细胞都分泌afp,仍有30%~40%左右的患者afp呈阴性或低浓度,具有明显的局限性。
4.甲胎蛋白异质体是一种单链糖蛋白,含糖量约为4%,不同组织细胞中合成的afp糖链结构略有不同,这种糖链结构不同的afp统称为afp异质体。根据afp与扁豆凝集素(lca)不同的结合能力,可分为afp-l1、afp-l2和afp-l3。afp-l1主要表达于良性肝病中,不能与lca结合;afp-l2主要出现于孕妇中,与lca可有少量结合;afp-l3是肝癌细胞所特有的,与lca特异性结合。当afp-l3在总afp中的占比超过10%,提示肝癌的发生率大于95%。
5.异常凝血酶原(dcp)是维生素k缺乏或拮抗剂-ii诱导的蛋白质(protein induced by vitamin k absence or antagonist-ii,pivka-ii),可出现于维生素k缺乏或肝细胞肝癌(hcc)患者的血清中。研究表明,在hcc之外肝病患者的血清dcp水平轻度升高,但hcc患者的血清dcp水平却显著升高,在90%的hcc患者中都会出现dcp增高,均值高达900ug/l。
6.醛酮还原酶1b10(aldo-keto reductase 1b10,akr1b10)基因定位在染色体7q33,编码一个由316个氨基酸组成的蛋白,即akr1b10蛋白,分子量为36.02kda。akr1b10蛋白可由溶酶体介导的非经典分泌途径,从肿瘤细胞中分泌进入血液循环。其功能主要为保护细胞免于羧基毒性损伤;以及稳定乙酰辅酶a羧化酶α(accα)阻止accα降解,从而调节脂肪酸与脂质合成,促进肿瘤细胞的生长增殖和迁移。相关研究表明,akr1b10在人类原发性肝癌组织中高表达,是一种新型的肝癌血清标志物。
7.但上述各个肝癌血清标志物单独检测准确性和可靠性都存在或多或少的问题。
技术实现要素:
8.针对上述问题,本发明人开发了一种检测肝癌特异性标志物醛酮还原酶1b10(akr1b10)、甲胎蛋白(afp)、甲胎蛋白异质体(afp-l3)和异常凝血酶原(dcp)的联合测定试剂盒。该试剂盒可用于检测受试者血清、尿液、乳汁、肠液、大便或组织样本中的akr1b10、afp、afp-l3和dcp蛋白的浓度。采用本试剂盒,可同时检测四种肿瘤标志物的浓度,大幅度的提升肝癌早期诊断的灵敏度和特异性。在临床上可用于肝癌或高危人群的早期筛查、诊断、疗效判断、预后评估或复发监测。
9.具体而言,本发明涉及一种肝癌特异性标志物醛酮还原酶1b10(akr1b10)蛋白的测定试剂盒。醛酮还原酶1b10(akr1b10)、甲胎蛋白(afp)、甲胎蛋白异质体(afp-l3)和异常凝血酶原(dcp)联合测定试剂盒及其应用。
10.所述试剂盒,可用于肝癌或高危人群的早期筛查、诊断、疗效判断、预后评估或复发监测。
11.第一试剂,检测akr1b10所需的试剂组分;
12.第二试剂,检测afp所需的试剂组分;
13.第三试剂,分离afp-l3所需的试剂组分;
14.第四试剂,检测dcp所需的试剂组分。
15.以及分别容纳不同浓度akr1b10、afp和dcp抗原的校准品与质控品。
16.其中,
17.a)所述第一试剂包括:生物素标记的兔抗akr1b10多克隆抗体,吖啶酯标记的鼠抗akr1b10单克隆抗体和链酶亲和素磁珠。缓冲液为0.1m pbs(ph7.0
±
0.1),1%bsa,0.05%tween 20,0.05%proclin300。
18.b)所述第二试剂包括:生物素标记的鼠抗afp单克隆抗体,吖啶酯标记的鼠抗afp单克隆抗体和链酶亲和素磁珠。缓冲液为0.1m pbs(ph7.0
±
0.1),1%bsa,0.05%tween20,0.05%proclin300。
19.c)所述第三试剂包括:lca磁珠、清洗液和洗脱液。所述lca磁珠是用凝集素(lca)耦联nhs磁珠制备而成。缓冲液为0.1m pbs(ph7.0
±
0.1),1%bsa,0.05%tween 20,0.05%proclin300。所述清洗液由一定浓度的tris-hcl、pbs或nahco3制备而成,优选的清洗液的配制方法是:50mm tris
·
hcl(ph7.5
±
0.1);所述洗脱液由一定浓度的tris-hcl、pbs、蔗糖、葡聚糖或d-甘露糖苷制备而成,优选的洗脱液的配制方法是:0.2m pbs(ph7.0
±
0.1),5m d-甘露糖苷。
20.d)所述第四试剂包括:生物素标记的鼠抗dcp单克隆抗体,吖啶酯标记的鼠抗dcp单克隆抗体和链酶亲和素磁珠。缓冲液为0.1m pbs(ph7.0
±
0.1),1%bsa,0.05%tween20,0.05%proclin300。
21.优选地,所述试剂盒还包括:
22.所述不同浓度akr1b10、afp和dcp抗原的校准品与质控品,是将akr1b10、afp和dcp天然抗原(或重组抗原)稀释至指定浓度,缓冲液为0.1m pbs(ph7.0
±
0.1),1%bsa,0.05%tween 20,0.05%proclin300。包括:akr1b10校准品cal1 300pg/ml,cal2 6000pg/ml;
akr1b10质控品qc1 330pg/ml,qc2 1800pg/ml。afp校准品cal1 15ng/ml,cal2 180ng/ml;afp质控品qc1 10ng/ml,qc2 100ng/ml。dcp校准品cal1 200mau/ml,cal2 8000mau/ml;dcp质控品qc1 150mau/ml,qc2 4500mau/ml。
23.本发明的试剂盒中未详细描述的试剂组分(如一些必要的缓冲液)、试剂盒的外包装以及各试剂组分的独立包装容器等均可按照所属领域的常规操作进行,符合相关行业规定即可。
24.本发明试剂盒可用于检测的对象选自血清、尿液、乳汁、肠液、大便或组织样本。检测的用途为肝癌或高危人群的早期筛查、诊断、疗效判断、预后评估或复发监测。
25.本发明提供的肝癌四项联合测定试剂盒具有如下优势:
26.a)可同时测定akr1b10、afp、afp-l3和dcp四种蛋白的含量,极大的提高了肝癌早期诊断的灵敏度和特异性,还能大幅降低检测时间及成本,目前临床上暂无同类型产品;
27.b)以生物素标记捕获抗体,吖啶酯标记检测抗体,通过化学反应标记、分离纯化,极大的提高了检测灵敏度。同时,各组分试剂独立包装,避免了不同抗原或抗体之间产生交叉反应。
28.c)进一步地,本发明采用磁微粒化学发光分析法,使免疫反应更容易混匀和结合,且本底值低,有利于信号的检测,提高了试剂盒最终的灵敏度和特异性;
29.d)此外,本发明试剂盒稳定性良好,有效期可至一年以上。
附图说明
30.图1.本发明试剂盒检测正常人和高危人群血清中akr1b10、afp、afp-l3和dcp的含量。
31.图2.本发明试剂盒检测正常人和肝癌患者血清中akr1b10、afp、afp-l3和dcp的含量。
32.具体实施方法
33.本发明提供了一种肝癌四项联合测定试剂盒(磁微粒化学发光法),具体实施例仅用于更清楚的说明本发明,参照下列实施例进一步描述本发明。实施例仅用于解释而不以任何方式限制本发明。
34.实施例中所用到的部分试剂材料均可商购获得(鼠抗akr1b10单克隆抗体为本公司专利产品,专利号:zl 20141057977.0,授权公告号:cn 104650234 b),所用各仪器设备也是所属领域的现有设备,未注明具体条件的实验方法均为所属领域熟知的常规方法和条件。
35.实施例1.肝癌四项联合测定试剂盒的制备。
36.一、生物素标记抗体制备方法如下:
37.以生物素标记兔抗akr1b10多克隆抗体为例:
38.(1)将待标记的兔抗akr1b10多克隆抗体用脱盐柱置换成缓冲液为1x pbs溶液中。
39.(2)将步骤(1)中的抗体与10mm浓度的生物素混合,使用生物素和抗体的分子比为20:1,室温(18~25℃)轻轻振荡反应2小时。
40.(3)再将标记后的抗体溶液用脱盐柱置换成缓冲液为1x pbs溶液中,去除游离的生物素,-80℃保存,制备得到所需的生物素标记抗体。
41.其它生物素标记抗体的制备均可参照上述方法执行。
42.二、吖啶酯标记抗体制备方法如下:
43.以吖啶酯标记鼠抗akr1b10单克隆抗体为例:
44.(1)将待标记的鼠抗akr1b10单克隆抗体用脱盐柱置换成缓冲液为1x pbs溶液中。
45.(2)将步骤(1)中的抗体与浓度为1mg/ml浓度的吖啶酯混合,吖啶酯和抗体的分子比为5:1,室温(18~25℃)轻轻振荡反应30分钟。
46.(3)再将标记后的抗体溶液用脱盐柱置换成缓冲液为1x pbs溶液中,去除游离的吖啶酯,-80℃保存,制备得到所需的吖啶酯标记抗体。
47.其它吖啶酯标记抗体的制备均可参照上述方法执行。
48.三、lca磁珠制备方法如下:
49.凝集素(lca)与nhs磁珠均为商品化原料,可通过原辅材料供应商购买,将lca与nhs磁珠耦联制备得到lca磁珠。
50.(1)用磁力架将nhs磁珠分离,加入适量耦联缓冲液洗涤,去除残留溶液。
51.(2)取适量lca溶于耦联缓冲液中,配置成浓度为1mg/ml的lca溶液。
52.(3)将步骤(1)中处理好的nhs磁珠与lca溶液混合,nhs磁珠(g)与lca(mg)混合比例为1:1—1:5,室温混匀2小时。
53.(4)用0.1m pbs(ph7.0
±
0.1),1%bsa,0.05%tween 20,0.05%proclin300。反复清洗连接好的lca磁珠,去除未耦联的lca,得到的溶液即为lca磁珠。
54.四、校准品和质控品的配制方法如下:
55.以akr1b10校准品和质控品为例:
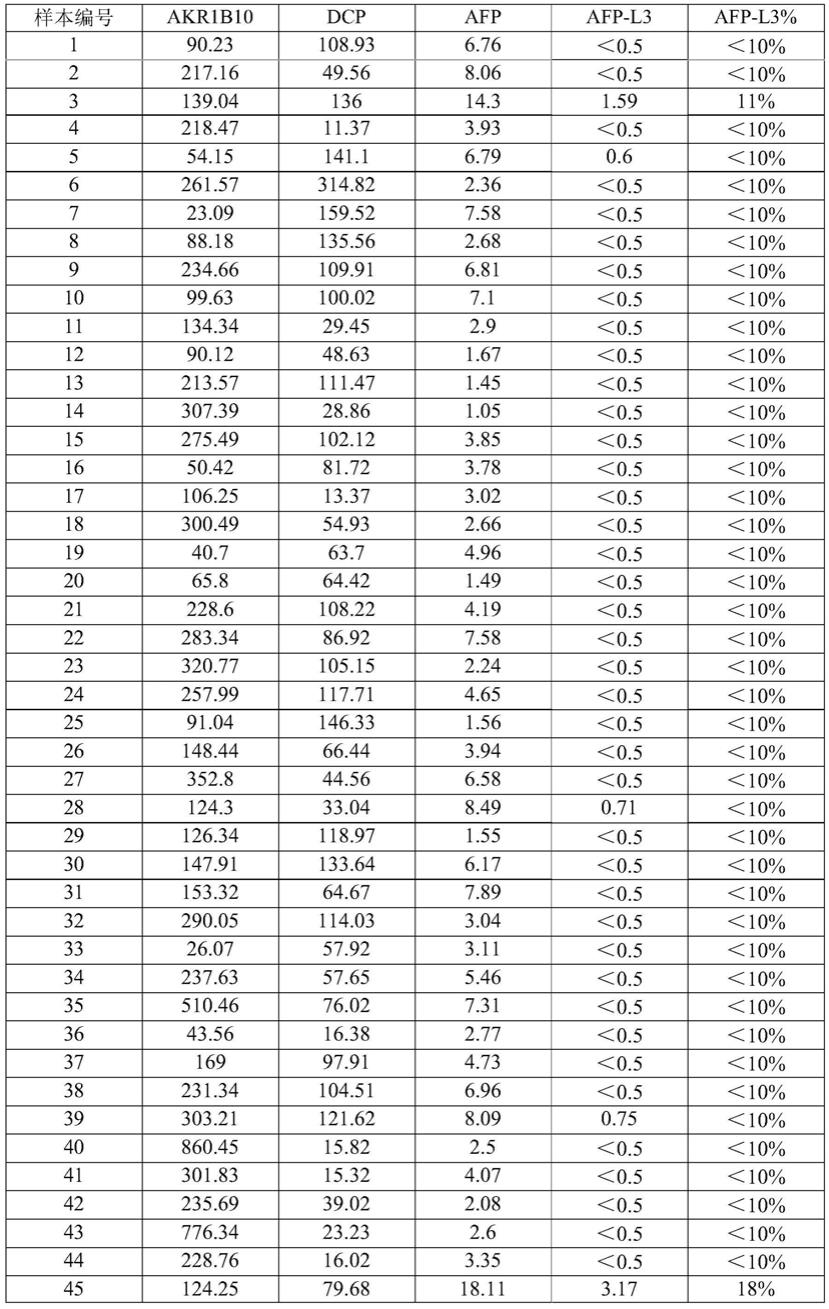
56.用0.1m pbs溶液溶解akr1b10抗原,配制akr1b10校准品,akr1b10校准品浓度分别为:cal1 300pg/ml,cal2 6000pg/ml;其中所述0.1m pbs溶液ph值为7.0
±
0.1,内含1%bsa、00.05%tween 20、0.05%proclin300。
57.用0.1m pbs溶液溶解akr1b10抗原,配制akr1b10质控品,akr1b10质控品浓度分别为:qc1 330pg/ml,qc2 1800pg/ml;其中所述0.1m pbs溶液ph值为7.0
±
0.1,内含1%bsa、00.05%tween 20、0.05%proclin300。
58.其它肿瘤标志物校准品和质控品的制备均可参照上述方法执行。
59.实施例2.肝癌四项联合测定试剂盒的检测步骤。
60.一、第一试剂、第二试剂和第四试剂检测步骤如下:
61.(1)每份样本分别加入适量体积到3个反应杯中,加入对应体积的akr1b10、afp和dcp校准品及质控品到加入反应杯中。
62.(2)将akr1b10、afp和dcp的生物素抗体和吖啶酯抗体分别加入对应的反应杯中,加入量分别为100ul。
63.(3)将反应杯置于37℃孵育10分钟,再分别加入30ul链酶亲和素磁珠到各反应杯中,37℃继续孵育20分钟。
64.(4)在磁力作用下吸附磁珠,吸去反应杯中液体,反复洗涤3次。
65.(5)在预激发液和激发液作用下,激发吖啶酯产生光子,光子强度与反应杯中待测物浓度呈正相关。
66.(6)根据akr1b10、afp和dcp校准品的浓度值和发光值,拟合曲线,分别计算
akr1b10、afp和dcp样本的浓度。
67.二、第三试剂检测步骤如下:
68.(1)分别取100ul样本到反应杯中,加入30ul lca磁珠。
69.(2)将反应杯置于37℃孵育10分钟,在磁力作用下吸附磁珠,吸去反应杯中液体,加入300ul清洗液反复洗涤3次。
70.(3)加入100ul洗脱液,37℃孵育2分钟,在磁力作用下吸附磁珠,吸取适量洗脱液转移至新的反应杯中。
71.(4)取第二试剂中的生物素抗体和吖啶酯抗体分别加入反应杯中,加入量分别为100ul。
72.(5)将反应杯置于37℃孵育10分钟,再分别加入30ul链酶亲和素磁珠到各反应杯中,37℃继续孵育20分钟。
73.(6)在磁力作用下吸附磁珠,吸去反应杯中液体,反复洗涤3次。
74.(7)在预激发液和激发液作用下,激发吖啶酯产生光子,光子强度与反应杯中待测物浓度呈正相关。
75.(8)根据afp校准品的浓度值和发光值,拟合曲线,计算afp-l3样本的浓度。
76.实施例3.肝癌四项联合测定试剂盒正常参考值。
77.采用与实施例2相同的检测方法,选取228例健康正常人样本,按照95%百分位确定正常参考值(p
95
=(228 1)
×
95%=217)。按照样本测定浓度排列顺序,在228例血清样本中,p95=217对应编号的akr1b10浓度为373.5pg/ml,dcp浓度为≤161.45mau/ml,afp浓度为8.7ng/ml,afp-l3%比值为≤10%,详细结果见表1,(afp-l3%为afp-l3和afp的浓度比值)。
78.表1. 228例健康正常人血清样本测定值
79.80.81.82.[0083][0084]
因此,确定akr1b10正常参考值≤350pg/ml,afp正常参考值≤8.7ng/ml,afp-l3/afp正常参考比值≤10%,dcp正常参考值≤40mau/ml(参见表2)。
[0085]
表2.肝癌四项正常参考值
[0086][0087][0088]
实施例4.肝癌四项联合测定试剂盒检测正常人和高危人群血清样本。
[0089]
采用与实施例2相同的检测方法,选取40例健康正常人和75例高危人群血清样本
进行检测,根据校准品的浓度值和发光值,拟合曲线,分别计算各受试者血清样本中akr1b10、afp、afp-l3和dcp的浓度,详细结果见表3。结果用graphpad 4.0统计学软件进行分析。akr1b10在健康正常人和高危人群中的浓度分别为208.7
±
15.76pg/ml和303.8
±
27.79pg/ml;afp的浓度分别为4.002
±
0.3133ng/ml和33.9
±
4.735ng/ml;afp-l3的浓度分别为3.189
±
0.3032ng/ml和4.458
±
1.191ng/ml;dcp的浓度分别为80.08
±
5.495mau/ml和178.3
±
19.99mau ml(参见图1)。
[0090]
表3. 75例高危人群血清样本测定值
[0091]
[0092][0093]
在高危人群中,单独分析akr1b10的阴性符合率77.33%(58/75),afp阴性符合率41.33%(31/75),afp-l3阴性符合率85.33%(64/75),dcp阴性符合率61.33%(46/75);联
合肝癌四项肿瘤标志物分析的总阴性符合率为96.00%(72/75)。该结果提示,在对肝癌高危人群的早期筛查中,肝癌四项联合检测相比较于单项分析,能大幅度提升高危人群的检测灵敏度,对于肝癌的早期筛查具有重要的指导意义(参见表4)。
[0094]
表4. 75例高危人群阴性符合率
[0095][0096]
实施例5.肝癌四项联合测定试剂盒检测正常人和肝癌患者血清样本。
[0097]
采用与实施例2相同的检测方法,选取40例健康正常人和68例肝癌患者血清样本进行检测,根据校准品的浓度值和发光值,拟合曲线,分别计算各受试者血清样本中akr1b10、afp、afp-l3和dcp的浓度,详细结果见表5。结果用graphpad 4.0统计学软件进行分析。akr1b10在健康正常人和肝癌患者中的浓度分别为208.7
±
15.76pg/ml和1319
±
180.1pg/ml;afp的浓度分别为4.002
±
0.3133ng/ml和265.8
±
48.46ng/ml;afp-l3的浓度分别为3.189
±
0.3032ng/ml和67.02
±
13.52ng/ml;dcp的浓度分别为80.08
±
5.495mau/ml和1981
±
379.3mau/ml(参见图2)。
[0098]
表5. 68例肝癌血清样本测定值
[0099]
[0100]
[0101][0102]
在肝癌患者中,单独分析akr1b10的阳性符合率73.53%(50/68),afp阳性符合率66.18%(45/68),afp-l3阳性符合率83.82%(57/68),dcp阳性符合率70.58%(48/68);联合肝癌四项肿瘤标志物分析的总阳性符合率为95.59%(65/68),显示出特别的优势。结果如表6所示。
[0103]
表6. 68例肝癌样本阳性符合率
[0104][0105]
由表6可知,在对肝癌确诊患者的诊断中,肝癌四项联合检测相比较于单项分析,可显著提升肝癌患者的阳性检出率。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。