降低主要不良心血管事件的组合物和方法
1.相关申请
2.本技术是中国专利申请201480072729.8号的分案申请。本技术要求于2013年12月6日提交的美国申请第61/913,216号;于2013年12月11日提交的美国申请第61/914,938号;于2014年4月25日提交的美国申请第61/984,580号,以及于2014年7月2日提交的美国申请第14/322,810号的优先权的权益,其各自在此通过引用整体并入。
3.发明背景
4.心血管疾病(“cvd”)(包括心脏病)是涉及心脏、血管(动脉、毛细血管和静脉)或二者的疾病种类。心血管疾病指影响心血管系统的任何疾病,主要是心脏病、脑和肾脏的脉管疾病以及外周动脉疾病。心血管疾病的原因是多种多样的,但是动脉粥样硬化和/或高血压是最常见的原因。
5.心血管疾病是全世界死亡的首位原因。根据who 2013年3月的实情报道(fact sheet)n 317的统计,在2008年,估计1730万人死于cvd,占所有全球死亡的30%。这些死亡中,估计730万人是由于冠心病,以及620万人是由于中风。死于cvd,主要死于心脏病和中风的人数,将在2030年增加达到2330万。预计cvd依然是死亡的单一主导原因。因此,存在发展新cvd治疗的需求。
6.主要不良心血管事件(“mace”)包括三项基本测量:非致命性心肌梗塞(“mi”)、非致命性中风以及心血管死亡。这些主要不良心血管事件代表严重的局部缺血事件,并且是心血管结果试验中广泛使用的终点。
7.鉴于前面所述,需要发展有效的治疗以降低mace风险增加的患者中的mace风险。
8.依据身体质量指数(bmi)定义肥胖。bmi被计算为体重(kg)/[身高(m)]2。根据美国疾病控制和预防中心(cdc)和世界卫生组织(who)的指导,对于超过20岁的成年人,将bmi按以下分类:低于18.5被认为是重量不足,18.5
–
24.9被认为是正常,25.0
–
29.9被认为是超重,以及30.0及以上被认为是肥胖(world health organization.physical status:the use and interpretation of anthropometry.geneva,switzerland:world health organization 1995.who technical report series)。
[0009]
在大多数抗肥胖药物的临床研究中,排除患有1型或2型糖尿病以及其它严重医学病况(如主要不良心血管事件(mace)的增加风险)的人。同样地,需要在这些处于风险的患者群体中发展有效的抗肥胖治疗。
[0010]
发明概述
[0011]
本文所公开的一些实施方案涉及用于降低主要不良心血管事件(mace)的风险的组合物、试剂盒、用途、系统和方法,所述组合物、试剂盒、用途、系统和方法包含纳曲酮(naltrexone)和安非他酮(bupropion)或者它们的药学可接受的盐。一个实施方案是治疗主要不良心血管事件(mace)的风险增加的对象的方法,其包括:鉴定mace的风险增加的对象;以及向所述对象施用有效降低所述风险增加的量的纳曲酮和安非他酮或它们的药学可接受的盐。
[0012]
一个实施方案是治疗对象的方法,其包括:鉴定患有不稳定心绞痛或处于患有不
稳定心绞痛风险的对象;以及通过向所述对象施用有效降低所述风险增加的有效量纳曲酮和安非他酮或它们的药学可接受的盐来降低心肌梗塞的风险或由于心血管事件死亡的风险。
[0013]
一个实施方案是治疗对象的方法,其包括:向对象开治疗进程的处方,包括在至少10天的时期内重复施用纳曲酮和安非他酮;以及建议对象或为对象提供这样的信息:用所述化合物进行治疗可以降低主要不良心血管事件的风险。
[0014]
一个实施方案是治疗对象的方法,其包括:鉴定处于一种或多种不良心血管事件风险的对象;根据方案重复地向对象施用纳曲酮和安非他酮,其中一种或多种不良心血管事件的风险被降低。
[0015]
一个实施方案是治疗对象的方法,其包括:鉴定相比相似年龄、种族或性别、但想要降低他们的mace风险的其它对象,还不知道其主要不良心血管事件(mace)的风险升高的对象;以及根据方案,向所述对象重复地施用纳曲酮和安非他酮,其中mace的风险被降低。
[0016]
一个实施方案是治疗对象的方法,其包括:鉴定接受至少一种心血管疾病或糖尿病的护理药物干预标准的对象,以及向所述对象施用有效量纳曲酮和安非他酮或它们的药学可接受的盐作为护理药物干预标准的辅助,以降低所述对象中mace的风险。
[0017]
一个实施方案是治疗对象的方法,其包括:鉴定接受抑郁症的护理药物干预标准的对象,以及向所述对象施用有效量纳曲酮和安非他酮或它们的药学可接受的盐作为护理药物干预标准的辅助,以及抗抑郁剂以降低所述对象中mace的风险。
[0018]
一个实施方案是提供药物的方法,其包括:向对象开多个个人剂量单位的纳曲酮和安非他酮或它们的药学可接受的盐的处方;并且建议所述对象:用所述化合物或其盐进行的治疗进程降低了主要不良心血管事件的风险。
[0019]
一个实施方案是提供药物的方法,其包括:向经销商、药房、护理提供者或患者提供容器,所述容器包含多个个人剂量单位的纳曲酮和安非他酮或它们的药学可接受的盐;以及向所述经销商、药房、护理提供者或患者提供这样的书面信息:用所述化合物或其盐进行的治疗进程可以降低主要不良心血管事件的风险。
[0020]
一个实施方案是用于销售化合物的方法,其包括:建议纳曲酮和安非他酮或它们的药学可接受的盐的潜在开药者:用所述化合物或其盐进行的疗程降低主要不良心血管事件的风险;以及向开药者开了所述化合物或其盐的处方的患者,供应用于销售的单位剂型的化合物或其盐。
[0021]
本公开的一些实施方案涉及用于预防或延迟主要不良心血管事件发生的方法,其包括:选择当前不是mace风险增加的对象进行治疗;以及向所述对象施用一定量的纳曲酮或其药学可接受的盐以及安非他酮或其药学可接受的盐。
[0022]
本公开的一些实施方案涉及在不良心血管后果的风险增加的对象或mace的风险增加的对象中,使用纳曲酮和安非他酮或它们的药学可接受的盐治疗超重或肥胖症的方法。在一些实施方案中,正通过本文所公开的方法治疗的对象(如,患者或患者群体)是超重或肥胖的,且不良心血管事件的风险增加。在一些实施方案中,所述对象在治疗时具有选自表8中所描述的亚群的一个或多个特征。在一些实施方案中,所述对象已经患有少于6年的2型糖尿病。在一些实施方案中,所述对象现时吸烟者,任选地,未患有2型糖尿病。在一些实施方案中,所述对象处于不良心血管后果的风险中,但未患有2型糖尿病。在一些实施方案
中,所述对象超过65岁。在一些实施方案中,所述对象是男性。在一些实施方案中,所述对象不是高加索人。在一些实施方案中,所述对象的bmi组别≥35kg/m2,且小于40kg/m2。在一些实施方案中,所述对象未患有2型糖尿病,或者未服用任何抗糖尿病药物,例如,胰岛素、二甲双胍或噻唑烷二酮类。在一些实施方案中,所述对象具有肾脏损害,特征是gfr≥90ml/min。在一些实施方案中,所述对象当前正在使用一种或多种β阻断剂。在一些实施方案中,所述对象当前正在使用一种或多种利尿剂。在一些实施方案中,所述对象未在使用一种或多种血管紧张肽ii受体阻断剂(arb)或血管紧张肽-转化酶抑制剂(acei)的伴随药物。在一些实施方案中,所述对象当前正在使用一种或多种钙通道阻断剂。在一些实施方案中,所述对象当前正在使用选自glp-1受体激动剂、dpp-4抑制剂或磺酰脲类的一种或多种药物。在一些实施方案中,所述对象当前正在使用一种或多种血清素再摄取抑制剂。在一些实施方案中,所述对象未患有抑郁症,或当前未使用任何抗抑郁症药物。
[0023]
在一些实施方案中,本文所描述的方法降低了不良心血管事件的风险。在一些实施方案中,本文所描述的方法降低mace的风险。在一些实施方案中,所述方法降低了不良心血管事件的预测严重性。在一些实施方案中,所述方法减少了不良心血管事件的预测死亡率。在一些实施方案中,所述方法增加了对象的预测预期寿命。在一些实施方案中,所述方法增加了不良心血管事件之间的预测时长。在一些实施方案中,所述方法增加了心血管干预在所述对象中的效力。在一些实施方案中,所述方法有利地调整了预测主要不良心血管事件的诊断指示物。在一些实施方案中,所述方法降低心血管疾病的发展。
[0024]
在一些实施方案中,所述对象患有ii型糖尿病(t2dm)。在一些实施方案中,所述对象患有既有的心血管疾病。在一些实施方案中,所述对象患有充血性心力衰竭。在一些实施方案中,所述对象有心血管疾病家族史。在一些实施方案中,所述对象是吸烟者。在一些实施方案中,所述对象具有患心血管疾病的遗传倾向。在一些实施方案中,所述对象患有或曾患有心律失常。在一些实施方案中,所述对象患有或曾患有心房纤维性颤动、心室纤维性颤动或快速性心律失常。在一些实施方案中,所述对象未患有窦性心动过速。在一些实施方案中,所述对象患有不稳定的心绞痛。在一些实施方案中,所述对象患有高血压。在一些实施方案中,所述对象是超重的。在一些实施方案中,所述对象是肥胖的。在一些实施方案中,所述对象曾患有中风。在一些实施方案中,所述对象患有动脉瘤。在一些实施方案中,所述对象的中风的风险增加。在一些实施方案中,所述对象具有升高的甘油三酯类、升高的ldl和/或低hdl。
[0025]
在一些实施方案中,所述对象不同时服用他汀类。在一些实施方案中,选择具有表5、表6和/或表8中所列特征的对象。在一些实施方案中,所述对象当前不是吸烟者。
[0026]
在一些实施方案中,所述不良心血管事件是心血管死亡、非致命性心肌梗塞、心律失常或非致命性中风。在一些实施方案中,主要不良心血管事件是心血管死亡。在一些实施方案中,心血管死亡包括由致命性心肌梗塞和致命性中风导致的死亡。在一些实施方案中,主要不良心血管事件是非致命性中风。在一些实施方案中,主要不良心血管事件是非致命性心肌梗塞。在一些实施方案中,主要不良心血管事件包括致命性和非致命性中风。在一些实施方案中,主要不良心血管事件包括心律失常。在一些实施方案中,主要不良心血管事件包括致命性和非致命性心肌梗塞。在一些实施方案中,主要不良心血管事件还包括从不稳定的心绞痛向心肌梗塞或死亡发展。
[0027]
在一些实施方案中,纳曲酮和安非他酮或它们的药学可接受的盐之一或两者以缓释制剂施用。
[0028]
在一些实施方案中,所述对象被治疗至少12周。在一些实施方案中,所述对象被治疗至少20周。在一些实施方案中,所述对象被治疗至少26周。在一些实施方案中,所述对象被治疗至少52周。在一些实施方案中,所述对象被治疗至少78周。在一些实施方案中,所述对象被治疗至少104周。
[0029]
在一些实施方案中,在治疗进程期间,所述对象的生命体征未改变10%或5%以上。在一些实施方案中,所述生命体征选自:血压、收缩压、舒张压和/或心率。
[0030]
本文所提供的一些实施方案包括正根据护理标准用既有药物治疗对象的方法,所述药物包括治疗糖尿病、血脂异常和高血压的药物。因此,本文所提供的实施方案包括,向处于mace风险且正根据护理标准用糖尿病药物、血脂异常药物或高血压药物进行治疗的对象,施用纳曲酮sr/安非他酮sr。本文所提供的实施方案还包括,向正服用糖尿病药物、血脂异常药物或高血压药物的对象,施用纳曲酮sr/安非他酮sr。在一些实施方案中,所述对象在同时服用用于控制一种或多种心血管病况或糖尿病的药物。在一些实施方案中,所述对象在同时服用用于控制一种或多种高血压、血脂异常或血糖病况的一种或多种药物。在一些实施方案中,所述对象在同时服用用于控制抑郁症的药物。在一些实施方案中,所述对象被施用纳曲酮和安非他酮或它们的药学可接受的盐,以及一种或多种其他药物化合物,其中所述组合选自表1-3中列出的组合。在一些实施方案中,所述方法还包括共同施用有效量的抗抑郁化合物。在一些实施方案中,所述抗抑郁化合物已被确定其药物安全性和疗效的政府机构批准用于抗抑郁剂用途。在一些实施方案中,所述方法还包括共同施用有效量的选自以下的抗抑郁化合物:选择性血清素再摄取抑制剂、血清素-去甲肾上腺素再摄取抑制剂、血清素拮抗剂和再摄取抑制剂、taar1激动剂、三环抗抑郁剂、四环抗抑郁剂或单胺氧化酶抑制剂。在一些实施方案中,所述方法还包括共同施用有效量的选择性血清素再摄取抑制剂。
[0031]
在一些实施方案中,对象的鉴定不依赖于一个或多个下述的患者特征:体重;腰围;性别;低于45年的年龄;血压;在鉴定之前有病历记载的心肌梗塞史》3个月;冠状动脉重建术史;颈动脉或外周动脉重建术史;伴随有缺血性改变的心绞痛;基于分级运动试验的ecg变化;阳性心脏成像研究;在鉴定之前2年内踝臂指数《0.9;或者在鉴定之前2年内冠动脉、颈动脉或下肢动脉有》50%的狭窄。
[0032]
在一些实施方案中,所述对象是非肥胖的。在一些实施方案中,所述对象是非超重的。在一些实施方案中,所述对象不是治疗期间的体重控制项目中的一部分。在一些实施方案中,在施用的过程期间,不监测对象的体重。在一些实施方案中,所述对象正参与治疗期间的体重控制项目。在一些实施方案中,在施用的过程期间,监测对象的体重。
[0033]
在一些实施方案中,所述对象在18岁至44岁之间。在一些实施方案中,所述对象大于44岁。在一些实施方案中,所述对象不是18岁至49岁的女性。在一些实施方案中,所述对象是18岁至49岁的女性。在一些实施方案中,所述对象的身体质量指数《27kg/m2。在一些实施方案中,所述对象身体质量指数至少27kg/m2。在一些实施方案中,所述对象是腰围《88cm的女性。在一些实施方案中,所述对象是腰围至少88cm的女性。在一些实施方案中,所述对象是腰围《102cm的男性。在一些实施方案中,所述对象是腰围至少102cm的男性。
[0034]
在一些实施方案中,所述对象患有2型糖尿病,或具有确认诊断的心血管疾病。在一些实施方案中,所述对象未患有2型糖尿病,或没有确认诊断的心血管疾病。在一些实施方案中,所述对象具有确认诊断的心血管疾病或心血管疾病的可能性高,并且其中所述对象具有以下的至少一种:在鉴定之前有病历记载的心肌梗塞史》3个月;冠状动脉重建术史;颈动脉或外周动脉重建术史;伴随有缺血性改变的心绞痛;基于分级运动试验的ecg变化;阳性心脏成像研究;在鉴定之前2年内踝臂指数《0.9;或者在治疗之前2年内冠动脉、颈动脉或下肢动脉有》50%狭窄。在一些实施方案中,所述对象具有确认诊断的心血管疾病或心血管疾病的可能性高,并且其中所述对象不具有以下的至少一种:在鉴定之前有病历记载的心肌梗塞史》3个月;冠状动脉重建术史;颈动脉或外周动脉重建术史;伴随有缺血性改变的心绞痛;基于分级运动试验的ecg变化;阳性心脏成像研究;在鉴定之前2年内踝臂指数《0.9;或者在治疗之前2年内冠动脉、颈动脉或下肢动脉有》50%狭窄。在一些实施方案中,所述对象患有2型糖尿病以及以下的仅仅一种:》145/95mm hg的高血压、需要药物疗法的血脂异常、之前12个月内有病历记载的低hdl或者当前是烟草使用者。
[0035]
在一些实施方案中,所述对象具有心房纤维性颤动史。在一些实施方案中,在用所述方法治疗之前,所述对象曾患有3个月内的心肌梗塞。在一些实施方案中,所述对象具有按照加拿大心血管协会分级方案的iii级或iv级心绞痛史。在一些实施方案中,所述对象具有脑血管疾病史。在一些实施方案中,所述对象具有中风史。在一些实施方案中,所述对象具有除窦性心动过速之外的心动过速史。在一些实施方案中,所述对象具有窦性心动过速史。在一些实施方案中,所述对象具有计划的减肥手术、心脏手术或冠状动脉血管成形术。
[0036]
在一些实施方案中,所述对象不具有癫痫史、颅骨创伤史或使所述对象易患癫痫的病况史。在一些实施方案中,所述对象具有癫痫史、颅骨创伤史或使所述对象易患癫痫的病况史。在一些实施方案中,所述对象具有躁狂症史、活动性精神病的当前诊断、活动性暴食症的当前诊断或神经性厌食症的当前诊断。在一些实施方案中,所述对象不具有躁狂症史、活动性精神病的当前诊断、活动性暴食症的当前诊断或神经性厌食症的当前诊断。
[0037]
在一些实施方案中,所述对象具有少于4年的预期寿命。在一些实施方案中,所述对象具有至少4年的预期寿命。
[0038]
在一些实施方案中,纳曲酮和安非他酮或它们的药学可接受的盐均是缓释形式。在一些实施方案中,如果血压增长到这样的值,则不指示对象停止纳曲酮和安非他酮,其中所述值是10mmhg或更高。在一些实施方案中,一天一次、两次、三次或四次施用纳曲酮和安非他酮。在一些实施方案中,纳曲酮或其药学可接受的盐以4-50mg的每日剂量施用。在一些实施方案中,安非他酮或其药学可接受的盐以50-400mg的每日剂量施用。
[0039]
在一些实施方案中,所述方法降低以下的至少一种:对象中的一种或多种主要不良心血管事件(mace)的风险、不良心血管事件的预测严重性、由于不良心血管事件导致的预测死亡率、以及它们的组合,其中所述风险、预测严重性或预测死亡率的降低是,相对于处于相同水平的mace风险、不良心血管事件的预测严重性、或由于不良心血管事件导致的预测死亡率但没有接受纳曲酮和安非他酮施用治疗的对象,至少或至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%或90%的降低。
[0040]
在一些实施方案中,所述方法有效地降低对象中心血管疾病的发展,并且其中所述心血管疾病发展的降低是,相对于处于相同水平的心血管疾病发展但没有接受纳曲酮和
安非他酮施用治疗的对象,至少或至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%或90%的降低。
[0041]
在一些实施方案中,所述方法有效地增加对象的预测预期寿命、或增加不良心血管事件下次发生之前的预测时长,并且其中所述增加是,相对于处于相同水平的mace风险但没有接受纳曲酮和安非他酮施用治疗的对象,至少或至少约1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、14个月、16个月、18个月、20个月或24个月的增加。
[0042]
在一些实施方案中,所述方法增加心血管干预在对象中的效力,其中所述增加是,相对于处于相同水平的mace风险并接受相同的心血管干预但不接受纳曲酮和安非他酮施用治疗的对象中的心血管干预的期望效力,至少或至少约至少或至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%或90%的增加。
[0043]
在一些实施方案中,所述方法有利地调整预测主要不良心血管事件的诊断指示物,其中所述有利调整是,相对于处于相同水平的mace风险但没有接受纳曲酮和安非他酮施用治疗的对象中的预测主要不良心血管事件的诊断指示物,至少或至少约至少或至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%或90%的有利调整。
[0044]
在一些实施方案中,在少于16周的治疗中、在16周的治疗之后、在少于20周的治疗中、在少于24周的治疗中、在少于28周的治疗或在少于52周的治疗中,实现风险的降低或后果的改善。
[0045]
在一些实施方案中,所述对象没有减重其体重的5%、4%、3%、2%、1%以上。在一些实施方案中,实现了mace风险的降低或后果的改善,并且所述对象没有减重其体重的5%、4%、3%、2%、1%以上。
[0046]
在一些实施方案中,对象的血压没有改变5%、4%、3%、2%、1%或0.5%以上。在一些实施方案中,对象的血压增加0.5%、1%、2%、3%、4%或5%。在一些实施方案中,所述血压是收缩压、舒张压或两者。在一些实施方案中,在2周、8周、16周、20周、24周、26周、28周、30周或52周的治疗之后,测量血压。在一些实施方案中,相对于预处理基线测量血压的变化。
[0047]
在一些实施方案中,所述方法可以增加选自以下的一个或多个事件的首次发生以前的时间:mace、四点扩展的mace(four-point expanded mace)、五点扩展的mace(five-point expanded mace)、cv死亡、非致命性mi、中风、致命性中风、非致命性中风、非致命性husa(由于不稳定的心绞痛导致住院)、冠状动脉重建术程序和/或全因死亡。
[0048]
在一些实施方案中,所述不良后果是选自以下的一个或多个事件:mace、四点扩展的mace、五点扩展的mace、cv死亡、非致命性mi、中风、致命性中风、非致命性中风、非致命性husa(由于不稳定的心绞痛导致的住院)、冠状动脉重建术程序和/或全因死亡。
[0049]
一个实施方案是在任意前述方法中使用的纳曲酮和安非他酮。一个实施方案是纳曲酮和安非他酮在降低主要不良心血管事件风险中的用途。一个实施方案是纳曲酮和安非他酮在制备用于降低主要不良心血管事件风险的药物中的用途。一个实施方案是纳曲酮和安非他酮在制备用于降低主要不良心血管事件风险的药物中的用途,其中所述化合物用于根据前述权利要求中任一项所述的方法使用。在一些实施方案中,纳曲酮和/或安非他酮或
它们的药学可接受的盐是缓释或延时释放的形式。
[0050]
作为非限制性实例,本技术提供了以下实施方案:
[0051]
1.治疗主要不良心血管事件(mace)的风险增加的对象的方法,其包括:
[0052]
选择mace的风险增加的对象进行治疗;以及
[0053]
向所述对象施用有效降低所述风险增加的量的纳曲酮或其药学可接受的盐以及安非他酮或其药学可接受的盐。
[0054]
2.如实施方案1所述的方法,其中所述对象在治疗时具有下述特征的一个或多个:ii型糖尿病;既有的心血管疾病或心血管疾病的可能性高;充血性心力衰竭;心血管疾病的家族史;现时吸烟者;具有患心血管疾病的遗传倾向;患有或曾患有心律失常;患有或曾患有心房纤维性颤动、心室纤维性颤动或快速性心律失常;未患有窦性心动过速;患有不稳定的心绞痛;患有高血压;曾患有中风或中风的风险增加;患有动脉瘤;或具有升高的甘油三酯类、升高的ldl和/或低hdl。
[0055]
3.如实施方案2所述的方法,其中所述对象患有2型糖尿病或确认诊断的心血管疾病。
[0056]
4.如实施方案2所述的方法,其中所述对象患有确认诊断的心血管疾病或心血管疾病的可能性高,并且其中所述对象具有以下的至少一种:在所述鉴定之前有病历记载的心肌梗塞史》3个月;冠状动脉重建术史;颈动脉或外周动脉重建术史;伴随有缺血性改变的心绞痛;基于分级运动试验的ecg变化;阳性心脏成像研究;在所述鉴定之前2年内踝臂指数《0.9;或者在治疗之前2年内冠动脉、颈动脉或下肢动脉有》50%的狭窄。
[0057]
5.如实施方案2所述的方法,其中所述对象患有2型糖尿病以及以下的不超过一种:》145/95mm hg的高血压、需要药物疗法的血脂异常、治疗之前12个月内有病历记载的低hdl或者是现时烟草使用者。
[0058]
6.如实施方案2所述的方法,其中所述对象具有心房纤维性颤动史。
[0059]
7.预防或延迟主要不良心血管事件发生的方法,其包括:
[0060]
选择当前不是mace风险增加的对象进行治疗;以及
[0061]
向所述对象施用一定量的纳曲酮或其药学可接受的盐以及安非他酮或其药学可接受的盐。
[0062]
8.如实施方案1至7中任一项所述的方法,其中所述对象是肥胖的或超重的。
[0063]
9.如实施方案1至7中任一项所述的方法,其中所述对象不是肥胖的或超重的。
[0064]
10.如实施方案1至9中任一项所述的方法,其中所述对象同时在服用用于控制选自以下的一种或多种病况的药物:心血管病况、糖尿病、高血压、血脂异常或血糖病况。
[0065]
11.如实施方案10所述的方法,其中所述药物选自表1或表2。
[0066]
12.如实施方案1至11中任一项所述的方法,其中所述对象同时在服用用于控制抑郁症的药物。
[0067]
13.如实施方案12所述的方法,其中所述药物是选自以下的抗抑郁化合物:选择性血清素再摄取抑制剂、血清素-去甲肾上腺素再摄取抑制剂、血清素拮抗剂和再摄取抑制剂、taar1激动剂、三环抗抑郁剂、四环抗抑郁剂或单胺氧化酶抑制剂。
[0068]
14.如实施方案12或13所述的方法,其中所述药物选自表3。
[0069]
15.如实施方案1至13中任一项所述的方法,其中所述对象没有在同时服用他汀
类。
[0070]
16.治疗对象的超重或肥胖症的方法,其包括:
[0071]
选择主要不良心血管事件的风险增加的超重或肥胖对象进行治疗;以及
[0072]
通过向所述对象施用一定量的纳曲酮或其药学可接受的盐以及安非他酮或其药学可接受的盐来治疗超重或肥胖症对象。
[0073]
17.如实施方案16所述的方法,其中所述对象在治疗时具有选自表8所描述的亚群的一个或多个特征,其中所述亚群的风险比的点估计选自:小于约0.85、小于约0.8、小于约0.75、小于约0.70、小于约0.65、小于约0.60、小于约0.55、小于约0.50、小于约0.45、小于约0.40、小于约0.35、小于约0.30、小于0.25、小于0.20、小于0.15或小于0.10。
[0074]
18.如实施方案16或17所述的方法,其中所述对象在治疗时具有选自以下的一个或多个特征:曾患有少于6年的2型糖尿病;现时吸烟者,任选地未患有2型糖尿病;处于不良心血管结果的风险但未患有2型糖尿病;超过65岁;男性;非高加索人;bmi组别≥35kg/m2且小于40kg/m2;未患有2型糖尿病或未服用选自以下的任何抗糖尿病药物:胰岛素、二甲双胍或噻唑烷二酮类;具有肾脏损伤,特征是gfr≥90ml/min;当前在使用一种或多种β阻断剂;当前在使用一种或多种利尿剂;当前未使用一种或多种血管紧张肽ii受体阻断剂(arb)或血管紧张肽-转化酶抑制剂(acei)的伴随药物;当前在使用一种或多种钙通道阻断剂;当前在使用选自glp-1受体激动剂、dpp-4抑制剂或磺酰脲类的一种或多种药物;当前在使用一种或多种血清素再摄取抑制剂;未患抑郁症;或当前未使用任何抗抑郁症的药物。
[0075]
19.如实施方案16或17所述的方法,其中所述对象曾患有少于6年的2型糖尿病。
[0076]
20.如实施方案16或17所述的方法,其中所述对象是现时吸烟者。
[0077]
21.如实施方案1至20中任一项所述的方法,其中所述施用降低所述对象中的主要不良心血管事件的风险。
[0078]
22.如实施方案1至20中任一项所述的方法,其中所述方法增加选自以下的一个或多个事件第一次发生以前的时间:mace、四点扩展的mace、五点扩展的mace、cv死亡、非致命性mi、中风、致命性中风、非致命性中风、非致命性husa(由于不稳定的心绞痛导致住院)、冠状动脉重建术程序和/或全因死亡。
[0079]
23.如实施方案1至21中任一项所述的方法,其中所述方法降低不良心血管事件的预测严重性或减少不良心血管事件的预测死亡率或降低心血管疾病的发展。
[0080]
24.如实施方案1至23中任一项所述的方法,其中所述方法增加所述对象的预测预期寿命、不良心血管事件之间的预测时长或心血管干预在所述对象中的效力。
[0081]
25.如实施方案1至24中任一项所述的方法,其中所述主要不良心血管事件是心血管死亡、非致命性心肌梗塞、心律失常或非致命性中风。
[0082]
26.如实施方案1至25中任一项所述的方法,其中所述主要不良心血管事件是心血管死亡。
[0083]
27.如实施方案26所述的方法,其中所述心血管死亡包括由致命性心肌梗塞和中风导致的死亡。
[0084]
28.如实施方案1至25中任一项所述的方法,其中所述主要不良心血管事件是非致命性中风。
[0085]
29.如实施方案1至25中任一项所述的方法,其中所述主要不良心血管事件是非致
命性心肌梗塞。
[0086]
30.如实施方案1至24中任一项所述的方法,其中所述主要不良心血管事件包括致命性中风和非致命性中风二者。
[0087]
31.如实施方案1至25中任一项所述的方法,其中所述主要不良心血管事件包括心律失常。
[0088]
32.如实施方案1至24中任一项所述的方法,其中所述主要不良心血管事件包括致命性心肌梗塞和非致命性心肌梗塞二者。
[0089]
33.如实施方案1至25中任一项所述的方法,其中所述主要不良心血管事件还包括从不稳定的心绞痛向心肌梗塞或死亡发展。
[0090]
34.如实施方案1至33中任一项所述的方法,其中所述施用导致减重所述对象体重的5%、4%、3%、2%或1%以上。
[0091]
35.如实施方案1至33中任一项所述的方法,其中实现mace风险的降低,并且所述对象没有减重其体重的5%、4%、3%、2%或1%以上。
[0092]
36.如实施方案1至35中任一项所述的方法,其中纳曲酮或其药学可接受的盐以及安非他酮或其药学可接受的盐之一或两者以缓释制剂施用。
[0093]
37.如实施方案1至36中任一项所述的方法,其中纳曲酮或其药学可接受的盐以4-50mg的每日剂量施用。
[0094]
38.如实施方案1至37中任一项所述的方法,其中安非他酮或其药学可接受的盐以50-400mg的每日剂量施用。
[0095]
39.如实施方案1至38中任一项所述的方法,其中所述量的纳曲酮和安非他酮的每日剂量是,32mg的缓释纳曲酮或其药学可接受的盐,以及360mg的缓释安非他酮或其药学可接受的盐。
[0096]
40.如实施方案39所述的方法,其中所述纳曲酮和安非他酮以单一口服剂型施用。
[0097]
41.如实施方案1至40中任一项所述的方法,其中将所述对象治疗至少12周、20周、26周或52周。
[0098]
42.如实施方案1至41中任一项所述的方法,其中所述对象的生命体征在治疗期间未改变10%或5%以上,其中所述生命体征选自:静息血压、收缩压、舒张压和/或心率。
[0099]
43.如实施方案1至41中任一项所述的方法,其中向所述对象施用:
[0100]
在治疗的第一周,每日约8mg的所述缓释纳曲酮或其药学可接受的盐,以及约90mg的所述缓释安非他酮或其药学可接受的盐;
[0101]
在治疗的第二周,每日约16mg的所述缓释纳曲酮或其药学可接受的盐,以及约180mg的所述缓释安非他酮或其药学可接受的盐;
[0102]
在治疗的第三周,每日约24mg的所述缓释纳曲酮或其药学可接受的盐,以及约270mg的所述缓释安非他酮或其药学可接受的盐;以及
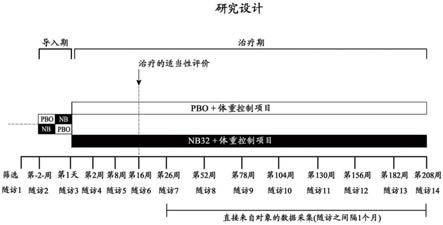
[0103]
在治疗的第四周和任意随后的治疗周,每日约32mg的所述缓释纳曲酮或其药学可接受的盐,以及约360mg的所述缓释安非他酮或其药学可接受的盐。
[0104]
44.如前述实施方案中任一项所述的方法,其中所述对象有过下述特征的一个或多个:(a)在用所述方法进行治疗之前3个月内的心肌梗塞;(b)按照加拿大心血管学会分级方案的iii级或iv级心绞痛史;(c)脑血管疾病史;(d)中风史;(e)除窦性心动过速之外的心
动过速史;(f)计划的减肥手术、心脏手术或冠状动脉血管成形术;(g)癫痫史、颅骨创伤史或使对象易患癫痫的病况史;(h)躁狂症史、活动性精神病的当前诊断、活动性暴食症的当前诊断或神经性厌食症的当前诊断;或者(i)预期寿命少于4年的病况。
[0105]
45.如前述实施方案中任一项所述的方法,其中一天一次、两次、三次或四次施用所述纳曲酮和安非他酮。
[0106]
46.纳曲酮和安非他酮在制备药物中的用途,其中所述药物根据前述实施方案中任一项所述的方法使用。
附图说明
[0107]
图1是实施例1和实施例2的研究设计的图示。
[0108]
图2示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)或安慰剂的患者,第一次主要不良心血管事件(mace)的时间。
[0109]
图3示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)和安慰剂的患者,相对于基线随时间的体重百分比变化。
[0110]
图4示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)或安慰剂的患者,第一次四点扩展的主要不良心血管事件(mace)的时间。
[0111]
图5示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)或安慰剂的患者,心血管死亡的时间。
[0112]
图6示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)或安慰剂的患者,第一次心肌梗塞的时间。
[0113]
图7示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)或安慰剂的患者,第一次中风的时间。
[0114]
图8示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)或安慰剂的患者,全因死亡的时间。
[0115]
图9示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)或安慰剂的患者,第一次五点扩展的主要不良心血管事件(mace)的时间。
[0116]
图10示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)或安慰剂的患者,相对于基线随时间的收缩压平均变化。
[0117]
图11示例了在一个实施方案中接受纳曲酮和安非他酮(nb32)或安慰剂的患者,相对于基线随时间的舒张压平均变化。
[0118]
发明详述
[0119]
orexigen therapeutics公司正在研发纳曲酮sr和安非他酮sr(或nb)的组合,用于超重和肥胖个体的减重和减重维持。为了探索用纳曲酮和安非他酮治疗的超重和肥胖对象中mace的风险,进行双盲、随机、安慰剂对照研究,其被设计来排除在不良cv后果风险增加的超重和肥胖对象中的过量心血管(cv)风险。在批准纳曲酮(contrave)之前,fda要求进行如实施例1中所描述的该研究,因为已知纳曲酮中的活性成分特别是安非他酮能增加血压。fda担心,血压的增加虽然对于普通群体是可接受的,但在超重/肥胖患者群体中将导致不良心血管后果的不可接受的增加。因此,用纳曲酮或安慰剂治疗处于较高风险的mace患者,以确定纳曲酮是否导致不良心血管后果的不可接受的增加。
[0120]
下文的实施例2总结了该临床研究的一些结果,其表明了用纳曲酮sr/安非他酮sr进行治疗降低了具有心血管风险因子的超重和肥胖对象中mace的发生。简单地说,相比于安慰剂,纳曲酮sr/安非他酮sr治疗组中经历mace事件的对象更少。
[0121]
例如,在患有心律失常的处于mace风险的超重/肥胖患者群体中,以及在特征是患有抑郁症的处于mace风险的超重/肥胖患者群体中,观察到有利结果,其中一些此类对象正在根据治疗抑郁症的护理标准接受抗抑郁剂药物,例如,选择性丝氨酸再摄取抑制剂(ssri)。还在根据护理标准用既有药物很好地治疗且处于mace风险的超重/肥胖患者群体中,观察到有利结果,已知其中一些既有药物降低mace的风险,所述药物包括治疗糖尿病、血脂异常和高血压的药物。
[0122]
对象
[0123]
术语“对象”指患有医学病况或在接受医学治疗的或为接受医学治疗的候选人的个体,优选人。对于人类对象,所述术语通常与术语“患者”同义使用。在一些实施方案中,正通过本文所公开的方法治疗的对象是超重或肥胖的,且主要不良心血管事件(mace)的风险增加。在一些实施方案中,mace是心血管死亡、非致命性心肌梗塞、非致命性中风。在一些实施方案中,mace的风险增加的超重或肥胖对象具有以下的一个或多个特征或患有以下的一种或多种:心血管疾病(cvd)史;当前确认诊断的cvd或cvd可能性高;1型糖尿病;2型糖尿病;血脂异常,例如,升高的甘油三酯类、升高的ldl或低hdl;高血压;过去或现时吸烟者;cvd的家族史;cvd的遗传倾向;不稳定的心绞痛;心律失常;心房纤维性颤动;充血性心力衰竭;以及中风。
[0124]
在一些实施方案中,mace的风险增加的对象的bmi≥27kg/m2,且≤50kg/m2。在一些实施方案中,mace的风险增加的对象是年龄至少50岁的男性,且腰围≥102cm。在一些实施方案中,mace的风险增加的对象是年龄至少45岁的女性,且腰围≥88cm。
[0125]
在一些实施方案中,不良心血管(cv)事件或mace的风险增加的超重或肥胖症对象,包括患有一种或多种下述病况的对象:
[0126]
(a)心血管疾病(cvd)(确认诊断的cvd或cvd的风险增加),任选地具有下述的至少一种:筛选或鉴定之前有病历记载的心肌梗塞史》3个月;冠状动脉重建术(如,冠状动脉旁路移植术、支架放置术、经皮经腔冠状动脉血管成形术或激光旋切术(atherectomy))史;颈动脉或外周动脉重建术(如,颈动脉内膜切除术、下肢动脉粥样硬化性疾病旋切术、腹部主动脉瘤修复术、股动脉或膕动脉旁路术)史;伴随有缺血性改变的心绞痛(静息ecg),基于分级运动试验的ecg变化(gxt)或阳性心脏成像研究;先前2年内踝臂指数《0.9(通过简单的切脉);以及先前2年内冠动脉、颈动脉或下肢动脉≥50%狭窄;和/或
[0127]
(b)2型糖尿病(t2dm),任选地具有下述的至少两种:高血压(在《145/95mm hg时,用或不用药物疗法控制);需要药物疗法的血脂异常;先前12个月内有病历记载的低hdl胆固醇(在女性中《50mg/dl,或在男性中《40mg/dl);以及现时吸烟者。
[0128]
在一些实施方案中,正被治疗的对象不具有(即,缺乏)一个或多个或全部下述特征:(a)治疗之前3个月内的心肌梗塞;(b)按照加拿大心血管协会分级方案的iii级或iv级心绞痛史;(c)脑血管疾病史;(d)中风史;(e)除窦性心动过速之外的心动过速史;(f)计划的减肥手术、心脏手术或冠状动脉血管成形术;(g)癫痫史、颅骨创伤史或使对象易患癫痫的病况史;(h)躁狂症史、活动性精神病的当前诊断、活动性暴食症的当前诊断、或神经性厌
食症的当前诊断;或者(i)使预期寿命小于4年的病况。
[0129]
在一些实施方案中,不良心血管后果的风险增加的对象被表征为:对象的不良心血管后果的可能性,在一些实施方案中,特别是mace的可能性,相比总群体或年龄和/或性别相配群体中的不良心血管后果或mace的可能性,更大至少或至少约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。
[0130]
在一些实施方案中,所述对象患有心律失常。例如所述对象的mace的风险增加,且患有心律失常。在一些实施方案中,心律失常是心房纤维性颤动、心室纤维性颤动或快速性心律失常。在一些实施方案中,心律失常不是窦性心动过速。在一些实施方案中,所述对象的特征是患有抑郁症。在一些实施方案中,抑郁症是慢性的且不严重,或者是最近发生的抑郁症。例如所述对象的特征是患有抑郁症,且mace的风险增加。在一些实施方案中,所述抑郁对象正在根据治疗抑郁症的护理标准接受抗抑郁剂,例如选择性丝氨酸再摄取抑制剂(ssri)。在一些实施方案中,所述对象正在根据护理标准用既有药物进行治疗,已知其中的一些降低mace的风险,所述药物包括治疗糖尿病、血脂异常和高血压的药物。例如所述对象可能mace的风险增加,且正接受治疗糖尿病、血脂异常或高血压的药物的护理标准。
[0131]
在一些实施方案中,选择具有表5、表6和/或表8中所列特征的对象或患者群体。在一些此类实施方案中,所述对象在治疗时具有表8中所描述亚群的一个或多个特征,在优选的实施方案中,亚群的点估计(point estimate)风险比选自:小于约0.85、小于约0.8、小于约0.75、小于约0.70或小于约0.65;更优选地,风险比选自:小于约0.60、小于约0.55、小于约0.50、小于约0.45、小于约0.40、小于约0.35、小于约0.30、小于0.25、小于0.20、小于0.15或小于0.10。在一些实施方案中,所述对象或患者群体具有下述特征的一个或多个:患有cv疾病;患有cv疾病而无t2dm;患有cv疾病与t2dm;患有t2dm;患有t2dm而无cv疾病;现时吸烟者;当前是非吸烟者;患有高血压;患有血脂异常;未患有高血压;未患有血脂异常;bmi《35kg/m2;bmi≥35kg/m2且《40kg/m2;bmi≥40kg/m2;当前正服用选自降压药的一种或多种药物(包括但不限于:β阻断剂、利尿剂、acei/arb、钙通道阻断剂);调脂药物(包括但不限于他汀类、非他汀类);抗糖尿病的药物(包括但不限于胰岛素、噻唑烷二酮类、二甲双胍、glp-1/ddp-iv、磺酰脲类);抗抑郁剂的药物(包括但不限于ssri、非ssri);t2dm时长《6年;t2dm时长≥6年。在一些实施方案中,所述对象或患者群体当前未服用他汀类。在一些实施方案中,所述对象或患者群体是现时吸烟者。在一些实施方案中,所述对象或患者群体具有《6年的t2dm。在一些实施方案中,所述对象或患者群体的bmi《40kg/m2。
[0132]
在一些此类实施方案中,所述对象是现时吸烟者,任选地未患有2型糖尿病。在一些此类实施方案中,所述对象曾患有少于6年的2型糖尿病。在一些此类实施方案中,所述对象当前在使用选自glp-1受体激动剂或dpp-4抑制剂的一种或多种药物。在一些此类实施方案中,所述对象的bmi组别≥35kg/m2且小于40kg/m2。在一些此类实施方案中,所述对象未在服用任何抗糖尿病药物。在一些此类实施方案中,所述对象是男性。在一些此类实施方案中,所述对象未使用二甲双胍。在一些此类实施方案中,所述对象超过65岁。在一些实施方案中,上述特征是除患者群体对象超重或肥胖,且优选不良心血管事件的风险增加或mace的风险增加之外的特征。
[0133]
在一些实施方案中,排除具有一个或多个下述特征的对象:当前未在服用任何调
脂药物、当前正在服用二甲双胍、hba1c组别小于7%、在治疗时曾患有6年或更多年的糖尿病,以及bmi》40kg/m2。
[0134]
方法
[0135]
本文所提供的实施方案包括,减少对象中不良心血管事件的预测可能性的方法,其中所述方法包括向对象(或对象群体)施用有效地减少所述对象(或对象群体)中不良心血管事件的预测可能性的量的纳曲酮和安非他酮或它们药学可接受的盐。本文所提供的实施方案还包括,治疗对象的超重或肥胖症的方法,其包括:选择超重或肥胖对象,优选地其不良心血管后果或事件(包括mace)的风险增加。如本文所提供,已发现,通过向对象或群体施用纳曲酮和安非他酮可以降低对象或群体中不良心血管事件的风险。这对已被鉴定为不良心血管事件的风险增加的对象尤其正确。然而,甚至未知的具有升高风险的较“正常”对象也可进行治疗,并接受降低mace的预测可能性的益处。
[0136]
注意到,当观察治疗的对象群体时,最容易观察到风险的降低或减少。因此,例如,通过比较治疗的群体与可比较的未治疗群体中实际的mace,可以观察到群体中mace的预测可能性或风险的减少。如本文所用,对于属于风险中或升高的风险类别的个体或对象的治疗,可以得到相同的结论,即便是其中n=1,不能证明严格的统计相关性的情况。然而,如果个体所属的任何对象群体的mace的可能性统计地减少,则该个体对象的mace的可能性被认为是减少的。本文提及的降低或减少对象中的mace的可能性,应被解释为包括个体对象的风险的减少和/或对象群体的风险的减少,除非上下文另有明确说明。
[0137]
本文所提供的一些实施方案包括,其中对象患有心律失常的方法。心律失常是其中心脏的电活动不规律或比正常快或慢的病况。在一些实施方案中,心律失常是心动过速(如,每分钟至少100次跳动);在一些实施方案中,心律失常是心动过缓(如,每分钟小于60次跳动)。在一些实施方案中,心律失常是不规律的心跳。在一些实施方案中,心律失常是纤维性颤动,如心房纤维性颤动或心室纤维性颤动。在一些实施方案中,心律失常不是窦性心动过速。在一些实施方案中,心律失常可导致心动停止或可使对象易于中风。下文的实施例2总结了临床研究的一些结果,其表明用纳曲酮sr/安非他酮sr进行治疗减少了具有心血管风险因子的超重和肥胖对象中的mace发生,其中这些对象中的一些患有心律失常。简单地说,相比患有心律失常的安慰剂组,患有心律失常的纳曲酮sr/安非他酮sr治疗组中经历mace事件的对象较少。本文所提供的实施方案包括,向处于mace风险的具有心律失常的对象施用纳曲酮和安非他酮。
[0138]
本文所提供的一些实施方案包括,其中对象的特点是患有抑郁症的方法。例如,所述对象可被诊断为患有临床抑郁症(重度抑郁症或抑郁症的其它形式),或者可具有与临床抑郁症一致的症状。在一些实施方案中,患有抑郁症的对象正在服用抗抑郁剂。在一些实施方案中,所述抗抑郁剂是选择性丝氨酸再摄取抑制剂(ssri),其根据治疗抑郁症的护理标准进行施用。所述抗抑郁剂可以是表3中所列的一种或多种化合物。下文的实施例2总结了临床研究的一些结果,其表明用纳曲酮sr/安非他酮sr进行治疗减少了具有心血管风险因子的超重和肥胖对象中的mace发生,其中这些对象中的一些患有抑郁症。简单地说,相比患有抑郁症的安慰剂组,患有抑郁症的纳曲酮sr/安非他酮sr治疗组中经历mace事件的对象较少。本文所提供的实施方案包括,向处于mace风险的患有抑郁症的对象施用纳曲酮和安非他酮。本文所提供的实施方案还包括,向正服用抗抑郁剂,优选ssri(如表3中所列的抗抑
郁剂)的对象施用纳曲酮和安非他酮(不管该对象是否患有抑郁症)。
[0139]
本文所提供的一些实施方案包括,其中所述对象正在根据护理标准用既有药物进行治疗的方法,已知其中的一些既有药物降低mace的风险或可能性,所述药物包括治疗糖尿病、血脂异常和高血压的药物。例如,所述对象正在用表1和表2中所列的糖尿病、血脂异常或高血压药物进行治疗。下文的实施例2总结了临床研究的一些结果,其表明用纳曲酮sr/安非他酮sr进行治疗减少了具有心血管风险因子的超重和肥胖对象中mace的发生,其中,这些对象中的一些正在根据护理标准用糖尿病药物、血脂异常药物或高血压药物进行治疗。简单地说,相比用相同药物治疗的安慰剂组,用此类药物治疗的纳曲酮sr/安非他酮sr治疗组中经历mace事件的对象较少。本文所提供的实施方案包括,向处于mace风险且正根据护理标准用糖尿病药物、血脂异常药物或高血压药物进行治疗的对象施用纳曲酮和安非他酮。本文所提供的实施方案还包括,向正服用糖尿病药物、血脂异常药物或高血压药物(如表1和表2中的药物)的对象施用纳曲酮和安非他酮。
[0140]
本文所提供的一些实施方案包括,用于预防或延迟主要不良心血管事件的发生的方法。
[0141]
在一些实施方案中,本文所提供的方法可以有效降低对象中的一个或多个主要不良心血管事件(mace)的风险、有效降低不良心血管事件的预测严重性、有效降低来自不良心血管事件的预测死亡率,以及它们的组合。风险、预测严重性或预测死亡率中的此类降低或减少可以是,相对于处于相同水平的mace风险、不良心血管事件的预测严重性或不良心血管事件的预测死亡率但没有根据本文所提供的方法接受纳曲酮和安非他酮施用治疗的对象,mace的风险、不良心血管事件的预测严重性或不良心血管事件的预测死亡率至少或至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%或90%的降低。
[0142]
在一些实施方案中,本文所提供的方法可以有效降低对象中的心血管疾病的发展。心血管疾病的发展的此类降低可以是,相对于处于相同水平的心血管疾病的发展但没有根据本文所提供的方法接受纳曲酮和安非他酮施用治疗的对象,心血管疾病的发展至少或至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%或90%的降低。
[0143]
在一些实施方案中,本文所提供的方法可以有效增加对象的预测预期寿命,或者增加不良心血管事件发生以前的预测时长。对象的预测预期寿命或不良心血管事件的发生以前的预测时长的此类增加可以是,相对于处于相同水平的mace风险但没有根据本文所提供的方法接受纳曲酮和安非他酮施用治疗的对象,增加了至少或至少约1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、14个月、16个月、18个月、20个月或24个月。
[0144]
在一些实施方案中,本文所提供的方法可以有效增加心血管干预在对象中的效力。心血管干预在对象中的效力的此类增加可以是,相对于心血管干预在处于相同水平的mace风险且接受相同的心血管干预但没有根据本文所提供的方法接受纳曲酮和安非他酮施用治疗的对象中的期望效力,增加了至少或至少约至少或至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%或90%。
[0145]
在一些实施方案中,本文所提供的方法可以有效地有利调整预测主要不良心血管
事件的诊断指示物。存在大量的此类诊断指示物,其包括,例如,血压、平板运动试验、肌钙蛋白试验、流体量、心输出量、射血分数、心肌症、心肌肥厚、ecg异常、外部氧依赖、利尿剂需求、心功能不全的住院、不稳定的血小板、心绞痛、心律失常、q-t间隔、升高的甘油三酯类、升高的ldl或低hdl等等。对象中预测主要不良心血管事件的诊断指示物的此类有利调整可以是,相对于处于相同水平的mace风险但没有根据本文所提供的方法接受纳曲酮和安非他酮施用治疗的对象中的预测主要不良心血管事件的诊断指示物,调整了至少或至少约至少或至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%或90%。
[0146]
在一些实施方案中,本文所提供的方法可导致对象的具体不良后果,例如mace(如心血管死亡、非致命性心肌梗塞或非致命性中风中的一种或多种)、四点扩展的mace、五点扩展的mace、cv死亡、非致命性mi、中风、致命性中风、非致命性中风、非致命性husa(由于不稳定的心绞痛导致的住院)、冠状动脉重建术程序和/或全因死亡的风险比(hr)(按照行业标准,比较治疗组中的风险与安慰剂组中的风险)小于:1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1,以及优选小于:1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.08、0.06、0.04、0.02或0.01。在任何公开的实施方案中,风险比可以是:1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0,更优选为0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.08、0.06、0.04、0.02或0.01,或通过前述值中的任意两个所限定的范围。
[0147]
在一些实施方案中,本文所提供的方法可以导致对象的具体不良后果的风险比(hr)为:0.01至0.1、0.1至1.9、0.2至1.8、0.3至1.7、0.4至1.6、0.5至1.5、0.6至1.4、0.7至1.3、0.8至1.2、0.9至1.1、0.1至1.0、0.2至1.1、0.3至1.2、0.4至1.3、0.5至1.4、0.6至1.5、0.7至1.6、0.8至1.7、0.9至1.8、或1.0至1.9。在一些实施方案中,hr是0.1至0.7。在一些实施方案中,hr是0.1至0.8。在一些实施方案中,hr是0.2至0.7。在一些实施方案中,hr是0.2至1.6。在一些实施方案中,hr是0.2至1.9。在一些实施方案中,hr是0.3至1.8。在一些实施方案中,hr是0.4至0.9。在一些实施方案中,hr是0.4至1.2。在一些实施方案中,hr是0.4至1.6。在一些实施方案中,hr是0.6至1.1.
[0148]
在任何公开的实施方案中,通过公开的方法所提供的一种或多种改善(如一种或多种mace的风险的降低、不良心血管事件的预测严重性的降低、不良心血管事件的预测死亡率的减少、对象中心血管疾病发展的减少、对象的预测预期寿命的增加或不良心血管事件的下一次发生以前的预测时长的增加、心血管干预在对象中的效力的增加或预测主要不良心血管事件的诊断指示物的有利调整),在纳曲酮和安非他酮的施用中止之后可以持续一段时间。在一些实施方案中,所述一段时间是或者是至少:1个月、2个月、3个月、4个月、5个月或6个月,或者0.5年、1年、2年、3年、4年或5年,或者1个月至6个月、1个月至1年、4个月至2年、或6个月至5年。
[0149]
在一些实施方案中,所述对象在治疗期间经历血压的变化。在一些实施方案中,在选自以下的治疗期测量对象的血压相对于基线水平的变化:2周、8周、16周、20周、24周、26周、30周或52周的治疗。在一些实施方案中,所述对象的血压、收缩压和/或舒张压,在一个或多个治疗期基本未变。在一些实施方案中,所述对象的血压、收缩压和/或舒张压,在一个或多个治疗期是减少的。在一些实施方案中,所述对象的血压、收缩压和/或舒张压,在一个或多个治疗期是增加的。在一些实施方案中,在一个或多个治疗期的血压,收缩压和/或舒
张压的增加或减少是或是约:1%、2%、3%、4%、5%、6%、7%、8%、9%或10%,或者通过前述值中的任意两个所限定的范围。在一些实施方案中,在一个或多个治疗期的血压、收缩压和/或舒张压的增加或减少是或是约:0.25mm hg、0.5mm hg、0.75mm hg、1mm hg、1.25mm hg、1.5mm hg、1.75mm hg、2mm hg、3mm hg、4mm hg、5mm hg、6mm hg、7mm hg、8mm hg、9mm hg、10mm hg、11mm hg、12mm hg、13mm hg、14mm hg或15mm hg,或者通过前述值中的任意两个所限定的范围。在一些实施方案中,相对于安慰剂治疗群体,在治疗的患者群体中血压的变化是血压的最小自乘平均值变化。在一些实施方案中,在一个或多个治疗期,所述对象经历血压的增加,同时经历由本公开的方法所提供的一种或多种改善(如一种或多种mace的风险的降低,不良心血管事件的预测严重性的降低,不良心血管事件的预测死亡率的减少,对象中的心血管疾病发展的减少,对象的预测预期寿命的增加或不良心血管事件的下次发生以前的预测时长的增加,心血管干预在对象中的效力的增加或预测主要不良心血管事件的诊断指示物的有利调整)。在一些实施方案中,血压的增加是舒张压的增加,其中所述增加是0.25至1.5mm hg。在一些实施方案中,在一个或多个治疗期,所述对象经历血压的增加,同时经历恶化,而不是由本公开的方法所提供的一种或多种改善。
[0150]
在一些实施方案中,在绝对期限或相对于没有接受纳曲酮和安非他酮的对照群体(如安慰剂对照),可以发生由本公开的方法所提供的一种或多种改善而所述对象没有减掉明显的重量。在一些实施方案中,当在绝对期限或相对于对照,可以发生由公开的方法所提供的一种或多种改善而所述对象没有减重或减重少于5%、4%、3%、2%或1%的体重。在一些实施方案中,在治疗16周、20周、24周或30周之后,和/或在所述对象减掉任何重量之前,可测量或评估一种或多种改善。在一些实施方案中,在绝对期限或相对于对照,所述对象减掉少于5%、4%、3%、2%或1%的体重之前,可测量或评估一种或多种改善。在一些实施方案中,mace的可能性的降低不依赖于减重。
[0151]
在一些实施方案中,由本公开的方法所提供的一种或多种改善(如一种或多种mace风险的降低、不良心血管事件的预测严重性的降低、不良心血管事件的预测死亡率的减少、对象中的心血管疾病发展的减少、对象的预测预期寿命的增加或不良心血管事件的下次发生以前的预测时长的增加、心血管干预在对象中的效力的增加或预测主要不良心血管事件的诊断指示物的有利调整)见于相比对照群体的治疗群体中,例如在接受纳曲酮和安非他酮的患者与接受安慰剂的患者之间比较。在一些实施方案中,在治疗12周、16周、18周、20周、22周、24周、26周、30周或52周,或者治疗仅12周、16周、18周、20周、22周、24周、26周、30周或52周的两个患者群体中可以观察到改善。
[0152]
在一些实施方案中,所述改善是以下的风险比的降低,或以下的第一次发生以前的时间的增加:mace、四点扩展的mace、五点扩展的mace、cv死亡、非致命性mi、中风、致命性中风、非致命性中风、非致命性husa(由于不稳定的心绞痛导致的住院)、冠状动脉重建术程序和/或全因死亡。在任何公开的实施方案中,以下的一种或多种第一次发生以前的时间是增加的:mace、四点扩展的mace、五点扩展的mace、cv死亡、非致命性mi、中风、致命性中风、非致命性中风、非致命性husa(由于不稳定的心绞痛导致的住院)、冠状动脉重建术程序和/或全因死亡。在一些实施方案中,所述时间增加或至少增加8周、10周、12周、14周、16周、18周、20周、30周、40周、50周,或由前述值中的任意两个所限定的范围。在一些实施方案中,所述时间增加或至少增加8周至50周、16周至30周、8周至14周或18周至50周。
[0153]
一些实施方案涉及告知受试对象本公开的组合物、试剂盒、用途、系统以及方法的益处和/或风险的方法,包括本文所鉴定的风险的降低或风险发生的延迟。可以通过以下告知对象:提供给他们或使他们获得连同开处方、接受或向所述对象施用药物的书面信息,包括提供给患者书面或电子材料,或者在如被监管当局所批准的药物标签中提供所述信息的全部或部分。可选地,所述告知步骤可以通过以下方式发生:告知护理人员或医学专业人员,包括医师或药剂师,其反过来将所述信息提供给患者。
[0154]
一些实施方案涉及鉴定针对对象或患者群体的本公开的方法或治疗的方法,和/或针对对象或患者群体开本公开的方法或治疗处方的方法。一些实施方案涉及针对本文所公开的一种或多种益处和/或风险监测对象或患者群体的方法。对象或患者群体包括本文所公开的任何对象或患者群体,包括表5、表6和表8中所鉴定的对象、患者群体和/或亚群。通过本文公开的方法所提供的益处和/或风险评估,包括但不限于本文所公开的各种图和表中所公开的那些。改善或风险的评估包括,比较治疗组之间的指定参数数值的任何常见方法—例如,死于心血管事件的对象数目。本文所公开的治疗组(安慰剂和纳曲酮/安非他酮)的任意测量参数,可以是益处或风险的基础。所述告知、开处方和监测或它们的组合,可以是除任何其它公开的实施方案之外的,例如但不限于,除公开的治疗方法实施方案之外的。
[0155]
施用
[0156]
在一些实施方案中,每天一次施用纳曲酮和/或安非他酮。在一些实施方案中,将纳曲酮和/或安非他酮分成两个或更多个剂量,优选相等的剂量,并且每天施用多于一次。在一些实施方案中,将纳曲酮和/或安非他酮分成不相等的剂量,并且每天施用多于一次。在一些实施方案中,将纳曲酮和安非他酮分成不同的剂量数,并且每天施用不同的次数。在一些实施方案中,将纳曲酮或安非他酮之一的剂量分开,而不将另一种的剂量分开。
[0157]
在一些实施方案中,每天一次、两次、三次、四次或更多次施用纳曲酮和安非他酮之一或两者。任一种或两种化合物可以每天施用少于一次,例如每2天、每3天、每4天、每5天、每6天、每7天、每8天、每9天、每10天、每11天、每12天、每13天或每14天一次,或者每1周或每2周施用一次,或者在前述值中任意两个所限定的范围施用一次。在一些实施方案中,每天施用次数是恒定的(如,每天一次)。在其它实施方案中,施用次数是可变的。施用次数可根据剂型的效力、观察到的副作用、期望滴定的期望剂量、外因(如,另一药物的更换)或已施用剂型的时长而变化。
[0158]
在一些实施方案中,纳曲酮每日剂量的范围可以是:约4mg至约50mg,或约4mg至约32mg,或约8mg至约32mg,或约8mg至约16mg。在一些实施方案中,纳曲酮的每日剂量是约4mg、约8mg、约12mg、约16mg、约32mg或约48mg,或者前述值中任意两个所限定的范围。具体剂量的选择可基于患者的重量。具体剂量的选择可基于另一共同施用化合物的特性、剂量和/或给药安排。然而,在一些实施方案中,使用这些范围之外的剂量可能是必需的。在一些实施方案中,每日剂量以单一口服剂型的形式施用。在一些实施方案中,纳曲酮的每日剂量是相同的,在一些实施方案中,每日剂量是不同的。
[0159]
在一些实施方案中,安非他酮每日剂量的范围可以是:约30mg至约500mg,或约30mg至约360mg,或约90mg至约360mg。在一些实施方案中,安非他酮的每日剂量是约30mg、约90mg、约180mg、约360mg或约450mg,或者前述值中任意两个所限定的范围。具体剂量的选
择可基于患者的重量。具体剂量的选择可基于另一共同施用化合物的特性、剂量和/或给药安排。然而,在一些实施方案中,使用这些范围之外的剂量可能是必需的。在一些实施方案中,每日剂量以单一口服剂型的形式施用。在一些实施方案中,安非他酮的每日剂量是相同的,在一些实施方案中,每日剂量是不同的。
[0160]
可将本文所描述的组合物分发、提供给自我施用的患者或者施用至个体。
[0161]
在一些实施方案中,以口服剂型的形式提供或施用该纳曲酮和/或安非他酮。在一些实施方案中,所述口服剂型是药丸、片剂、核心剂(core)、胶囊、囊片、散粉、溶液或悬液的形式。在一个优选的实施方案中,所述口服剂型是药丸、片剂或胶囊的形式。在一些实施方案中,组合的纳曲酮/安非他酮疗法以单一口服剂型的形式提供。在一些实施方案中,所述口服剂型是如美国专利申请第2008/0113026号中所描述的三层片剂形式,为所有目的将其通过引用整体并入本文,包括但不限于以下目的:描述三层片剂、制备和配制三层片剂的方法以及施用它们的方法。
[0162]
在一些实施方案中,在治疗期间,纳曲酮和安非他酮中至少一种以变化的频率施用。在这些实施方案的一些中,所述变化的频率包括在一段时间内减少的频率。例如,纳曲酮和安非他酮之一或两者最初可以每天施用多于一次,之后在以后的治疗中每天仅施用一次。在一些实施方案中,纳曲酮和安非他酮中至少一种的每日剂量是一致的,尽管施用频率变化。例如,在一些实施方案中,最初每天两次施用纳曲酮和安非他酮各两片,而在以后的治疗中每天一次施用纳曲酮和安非他酮各四片。可选地,在一些实施方案中,在以后的治疗中施用纳曲酮和安非他酮各一片或各两片,其中所述一片或两片具有与最初每天两次施用纳曲酮和安非他酮各两片等同的总每日剂量。在一些实施方案中,纳曲酮和安非他酮的剂量以逐步增加的方式施用。在一个实施方案中,在第一周,每日施用8mg纳曲酮和90mg安非他酮,在第二周,每日施用16mg纳曲酮和180mg安非他酮,在第三周,每日施用24mg纳曲酮和270mg安非他酮,以及其后每日施用32mg纳曲酮和360mg安非他酮。
[0163]
在一些实施方案中,纳曲酮或安非他酮中的至少一种是缓释或可控释放的制剂。例如,纳曲酮的缓释形式描述于美国专利申请第2007/0281021号,为所有目将其通过引用整体并入本文,包括但不限于以下目的:描述纳曲酮和安非他酮的缓释形式、将它们制备和配制为合适剂型的方法、以及施用它们的方法。在一些实施方案中,当纳曲酮和安非他酮之一或两者以可控释放或缓释(sr)制剂的形式每天施用少于一次时,所选择的剂量使患者接受与本文所描述的每日剂量大约相同的每日剂量。
[0164]
在一些实施方案中,纳曲酮不是隔绝形式的纳曲酮。例如,在一些实施方案中,纳曲酮是非隔绝、可控释放的制剂。在一些实施方案中,纳曲酮是非隔绝、缓释制剂。在优选的实施方案中,在施用的24小时内释放至少50%的纳曲酮。
[0165]
在一些实施方案中,分别地施用纳曲酮和安非他酮。在一些实施方案中,纳曲酮和安非他酮以包含纳曲酮和安非他酮的单一药物组合物的形式施用。在一些实施方案中,纳曲酮或安非他酮中至少一种与生理上可接受的载体、稀释剂或赋形剂或它们的组合一起施用。纳曲酮/安非他酮的组合、其制剂以及施用它们的方法的非限制性实例公开于美国专利第7,375,111号和第7,462,626号,为所有目的将其两者通过引用整体并入本文,包括但不限于以下目的:描述纳曲酮和安非他酮的组合、将它们制备和配制为合适剂型的方法以及施用它们的方法。本文提及的纳曲酮和纳曲酮/安非他酮组合的使用或施用,应被理解为包
括本文所公开或提及的所有施用模式,包括但不限于分开的施用、以单一剂型形式的施用、盐和/或代谢物形式的施用和/或以缓释形式的施用。本技术的化合物的制剂和施用的技术可见于《雷明顿药物科学》(remington’s pharmaceutical sciences)(mack publishing co.,easton,pa,第18版,1990),将其通过引用整体并入本文。
[0166]
在一些实施方案中,纳曲酮在安非他酮之前施用。在一些实施方案中,纳曲酮在安非他酮之后施用。在一些实施方案中,将纳曲酮和安非他酮共同施用。如本文所用,共同施用包括单一剂型或分开剂型的施用,将所述分开剂型同时或几乎同时施用。
[0167]
在一些实施方案中,将纳曲酮和安非他酮的施用持续或持续约1周、2周、3周、4周、6周、8周、10周、12周、16周、20周、24周、36周、48周或52周,或者前述值中任意两个所限定的范围。在一些实施方案中,持续纳曲酮和安非他酮的施用,直到使疾病、病症或病况的症状减少稳定或稳定约1周、2周、3周、4周、5周、6周或更多周,或者前述值中任意两个所限定的范围。在一些实施方案中,持续纳曲酮和安非他酮的施用,直到个体不再需要治疗。
[0168]
在一些实施方案中,“施用”药物包括个体获得且自己服用药物。例如,在一些实施方案中,个体从药房获得药物,并且根据本文所提供的方法自己施用药物。
[0169]
在一些实施方案中,本发明涉及试剂盒。所述试剂盒可以包含一种或多种含有纳曲酮、安非他酮、或纳曲酮和安非他酮的单位剂型。所述单位剂型可以是口服制剂。例如,所述单位剂型可以包括药丸、片剂或胶囊。所述试剂盒可以包含多个单位剂型。在一些实施方案中,所述单位剂型在容器中。在一些实施方案中,所述剂型是包含纳曲酮和安非他酮或它们的药学可接受的盐的单一口服剂型。
[0170]
本文所公开的方法、组合物和试剂盒可以包含信息。所述信息可以是被管理药物的制造、使用或销售的政府部门规定的形式,其公告反映了所述部门对用于人或兽医施用的药物形式的批准。此类信息,例如,可以是被美国食品药品管理局批准的用于处方药的标签,或者是被批准的产品插页。所述信息可以包括关于剂量和剂型的必要信息、施用安排和施用途径、不良事件、禁忌症、警告和注意事项、药物相互作用以及特殊群体的使用(参见,如,21c.f.r.
§
201.57,将其通过引用整体并入本文),以及在一些实施方案中,为了药物的销售,要求将所述信息显示在药物上或者与药物相关。还可制备在可兼容的药物载体中配制的包含缓释纳曲酮制剂的剂型,将其置于合适的容器中,并标记上用于治疗所指示的病况。在一些实施方案中,试剂盒用于处方药的销售,其需要政府部门(如美国食品药品管理局)的批准且受政府部门(如美国食品药品管理局)的规程限制。在一些实施方案中,为了向例如在美国的消费者销售试剂盒,所述试剂盒包含所述部门(如fda)要求的标签或产品插页。
[0171]
所述信息可以包括施用剂量约4mg、约8mg、约12mg、约16mg、约32mg或约48mg纳曲酮或其药学可接受的盐的单位剂型的指示。所述信息可包括施用剂量约30mg、约90mg、约180mg、约360mg或约450mg安非他酮或其药学可接受的盐的单位剂型的指示。这些指示可以以多种方式提供。所述信息可以包含何时施用单位剂型的指示。例如,所述信息可以包含相对于另一药物或食物的施用,何时施用所述单位剂型。在优选的实施方案中,所述信息指示个体与食物,优选膳食,一起服用纳曲酮或纳曲酮和安非他酮。
[0172]
一些实施方案包括这样的信息,优选这样的打印信息:与食物一起服用纳曲酮或其药学可接受的盐,相比于不与食物一起服用相同量的纳曲酮或其药学可接受的盐,导致
纳曲酮或其药学可接受的盐的生物利用率增加。一些实施方案包括这样的信息,优选这样的打印信息:与食物一起服用安非他酮或其药学可接受的盐,相比于不与食物一起服用相同量的安非他酮或其药学可接受的盐,导致安非他酮或其药学可接受的盐的生物利用率增加。一些实施方案包括这样的信息,优选这样的打印信息:与食物一起服用纳曲酮和安非他酮或它们的药学可接受的盐,相比于不与食物一起服用相同量的纳曲酮和安非他酮或它们的药学可接受的盐,导致纳曲酮和/或安非他酮或它们的药学可接受的盐的生物利用率增加。一些实施方案包括这样的信息,优选这样的打印信息:与食物一起服用纳曲酮和/或安非他酮或它们的药学可接受的盐,相比于不与食物一起服用相同量的纳曲酮和安非他酮或它们的药学可接受的盐,导致严重的药物相关不良事件更少或较少。在一些实施方案中,所述不良事件是胃肠事件。在一些实施方案中,为对象提供关于生物利用率、不良事件或施用方案指示的信息,为对象提供包含所述信息中所描述的药物剂型,以及根据所述信息施用的所述剂型。在一些实施方案中,所述对象是需要药物的患者。在一些实施方案中,施用所述药物,作为本文所描述的疾病的疗法。
[0173]
一些实施方案包括通过直接地或由医学专业人员提供信息,优选打印的或电子的信息,以告知对象用安非他酮和纳曲酮进行治疗可以降低mace或构成mace的任一种病况的风险或可能性或发生的指示。
[0174]
指示和/或信息可以以多种方式存在,包括在合适的媒介或基底上的打印信息(如,打印所述信息的一张或多张纸)、计算机可读媒介(如,已记录所述信息的磁盘、cd等)或可经由因特网获取的网址。可以将打印信息,例如提供在与药品相关的标签上、药品的容器上、与药品一起包装、或者除了药品之外单独地送给患者、或者以患者可独立地获得所述信息的方式(如,网站)提供。还可将打印信息提供给医学护理人员或涉及患者治疗或药物供给的其它医学专业人员。在一些实施方案中,向个人口述所述信息。
[0175]
一些实施方案包含适于商业销售的治疗包装。包装和分配器以及口服剂型的非限制性实例,公开于美国专利公开第2008/0110792号和第2008/0113026号,为所有目的将这两者通过引用整体并入本文,包括但不限于以下目的:描述纳曲酮和安非他酮的组合、将它们制备和配制为合适剂型的方法、包装和分配它们的方法以及施用它们的方法。
[0176]
所述信息可以与容器相关,例如,其被:写在与容纳本文所描述的剂型的瓶身粘贴固定的标签上(如,处方标签或单独的标签);包含在容器内部,作为书面包装插页,如在含有单位剂量包的盒子内部;被直接地应用至容器,如被打印在盒壁上;或者如通过系或捆扎被系上,如,作为指示卡,经由线、绳索或其它绳、系索或系绳型装置被固定至瓶颈上。所述信息可被直接地打印在单位剂量包装或吸塑包装或吸塑卡上。
[0177]
在一些实施方案中,本文所公开的方法、治疗和疗法包括,纳曲酮和安非他酮加上一种或多种其他药物化合物的施用。在一些实施方案中,向对象或患者群体施用选自表1、表2或表3之一的组合。
[0178]
表1.纳曲酮和安非他酮与抗高血压药物或调脂药物的组合
[0179]
[0180]
[0181]
[0182]
[0183][0184]
表2.纳曲酮和安非他酮与降糖和降胰岛素药物的组合
[0185]
[0186]
[0187][0188]
表3.纳曲酮和安非他酮与抗抑郁剂的组合
[0189] 抗抑郁剂药物 ssri纳曲酮/安非他酮ssri纳曲酮/安非他酮西酞普兰(citalopram)纳曲酮/安非他酮达泊西汀(dapoxetine)纳曲酮/安非他酮艾司西酞普兰(escitalopram)纳曲酮/安非他酮氟西汀(fluoxetine)纳曲酮/安非他酮氟伏沙明(fluvoxamine)纳曲酮/安非他酮吲达品(indalpine)纳曲酮/安非他酮帕罗西汀(paroxetine)纳曲酮/安非他酮舍曲林(sertraline)纳曲酮/安非他酮齐美利定(zimelidine) 其它抗抑郁剂纳曲酮/安非他酮血清素-去甲肾上腺素再摄取抑制剂纳曲酮/安非他酮三环抗抑郁剂纳曲酮/安非他酮单胺氧化酶抑制剂纳曲酮/安非他酮非ssri抗抑郁剂
[0190]
术语“安非他酮”在本文以通用的方式使用,指安非他酮的游离碱、药学可接受的安非他酮的盐(包括无水形式,如无水安非他酮)、安非他酮的代谢物(如,羟基安非他酮、苏式羟基安非他酮(threohydrobupropion)和赤式羟基安非他酮(erythrohydrobupropion))、安非他酮的同分异构体或它们的混合物。
[0191]
术语“纳曲酮”在本文以通用的方式使用,指纳曲酮的游离碱、药学可接受的纳曲酮的盐(包括水合物形式和无水形式,如,纳曲酮盐酸盐二水合物和无水纳曲酮盐酸盐)、纳曲酮的代谢物、纳曲酮的同分异构体或它们的混合物。
[0192]
如本文所用,术语“药学可接受的盐”指不会对施用它的生物体造成明显刺激,且不会消除所述化合物的生物活性和特性的化合物制剂。可通过常规实验获得药用盐。药学可接受的盐的非限制性实例包括安非他酮盐酸盐、radafaxine盐酸盐、纳曲酮盐酸盐以及6-β纳曲醇盐酸盐。
[0193]
在整个本公开中,当通过名称,例如安非他酮或纳曲酮提及具体化合物时,应理解,本公开的范围包括该命名化合物的药学可接受的盐、酯、酰胺或代谢物。例如,在本文的任何实施方案中,可以将纳曲酮的活性代谢物(如,6-β纳曲醇)与纳曲酮组合使用或代替纳曲酮使用。在本文所公开的任何实施方案中,可以将安非他酮的活性代谢物,包括s,s-羟基安非他酮(即,radafaxine)与安非他酮组合使用或代替安非他酮使用。
[0194]
如本文所用,术语“缓释”具有本领域技术人员所理解的普通含义,并且因此以非限制性实例的方式包括,在延长的时期内药物从剂型的可控释放。例如,在一些实施方案中,缓释剂型是具有这样的释放速率的剂型:其慢于可比较的速释形式的释放速率,如,不足速释剂型的释放速率的80%。
[0195]
适于用作参考标准的速释纳曲酮制剂是广泛可商购的速释纳曲酮制剂,如品牌的纳曲酮盐酸盐或其等同物。适于用作参考标准的速释安非他酮制剂是广泛可商购的速释安非他酮制剂,如品牌的安非他酮或其等同物。美国政府管控处方药可被标记的方式,并且因此本文提及的品牌的纳曲酮盐酸盐以及品牌的安非他酮对本领域技术人员而言具有熟知、固定且确切的含义。
[0196]
如本文所用,术语“口服剂型”具有本领域普通技术人员所理解的普通含义,并且因此以非限制性实例的方式包括,可施用于人的形式的药物制剂或多种药物制剂,包括药丸、片剂、核心剂、胶囊、囊片、散粉、溶液以及悬液。
[0197]
在本文所描述的任何实施方案中,可选地,可将治疗方法表述或保护为用途权利要求(如瑞士型(swiss-type)用途权利要求)或用于用途的组合物权利要求。例如,可选地,可以将用组合物降低mace的风险的方法变为组合物在制备用于降低mace风险的药物中的用途,或组合物在降低mace中的用途,或组合物自身用于降低mace。
[0198]
体重控制项目(program)
[0199]
在一些实施方案中,本文所提供的方法包括基于网络的和/或基于电话的体重控制项目。在一些实施方案中,将各个对象分配至对他们进行在线或电话咨询的卫生和健康专业人员。其他教育工具可以包括每周一次基于网络的信息、教育和激励资源,所述资源由定期呈现的视频课程补充。在一些实施方案中,所述项目的内容由以下组成:每周的电子邮件,所述电子邮件宣布本周的目标、提供积极性以及鼓励继续参与;与每周的主题匹配的每周目标(来自电子邮件),连同实现这些目标的详细解释和策略,将其放置在项目的对象页上;三张其它的每周内容,其被张贴至用户页(技巧和教育信息)以帮助对象达到他们的每周目标;被张贴至参与页的整个本周的激励信息;基于行为(即,缺席项目活动、没有成功记录)触发事件的电子邮件以发送至用户;为了未来获取,在项目网址上所提供的供参与者查看和归档的视频课程:前16周每周一次,接着的12周为两周一次,研究的剩余时间为每月一次,以及两次进修活动,所述进修活动包括试验的第三年和第四年期间每年的每周4次会议。视频课程集中于相关主题且由题材专家开发。
[0200]
本领域技术人员理解,在不脱离本发明的精神的情况下,可以做出许多不同的修饰。因此,应当清楚地理解,本文所公开的本发明的实施方案仅仅是示例性的,且不意图限制本发明的范围。为了本文所讨论的材料,将本文提到的任何参考文献通过引用整体并入。
实施例
[0201]
下文的实施例是非限制性的,并且仅代表本发明的不同方面。
[0202]
实施例1总结了临床研究的方案,表明用纳曲酮sr/安非他酮sr进行治疗不增加或者减少了主要不良心血管事件(mace)在具有心血管风险因子的超重和肥胖对象中的发生。
[0203]
实施例1
[0204]
多中心、随机、双盲、安慰剂对照研究,评估接受32mg纳曲酮sr/360mg安非他酮sr(“nb”或“nb32”)的具有心血管风险因子的超重和肥胖对象中主要不良心血管事件(mace)的发生。
[0205]
使大约9,880名对象入选双盲导入期,以鉴定不能很好地耐受低剂量nb治疗的对象,或显示预测缺乏依从性的其它特征的对象。在开始导入期时,将对象以1:1的比例随机分配至两种治疗顺序之一:1周的活性研究药物(每天1片片剂),随后1周的安慰剂(每天1片片剂);或者1周的安慰剂,随后1周的活性研究药物。随后将合格的对象随机用nb32或安慰剂以1:1的比例进行治疗。对于大多数对象,随机化治疗期的时间(或者早期中止研究药物的对象的对象随访期)预计在2-4年之间。
[0206]
对象的入选可以发生在两个阶段,大约6,850名对象入选以支持随机对象中足够事件的自然增长用于期中分析,随后大约3,030名对象入选以完成研究。来自两个入选阶段的随机对象中的事件支持最终分析。如果导入期期间的退出率大于预期的,则可以招募另外的对象。
[0207]
所述研究由三个时期组成(参见图1):
[0208]
1)筛选期(开始于第1次随访,在知情同意的情况下进行筛选):至多2周以验证合格性,然后是研究药物在导入期中的首次剂量。
[0209]
2)导入期(开始于第2次随访,第-2周):双盲、2周时间,在导入期期间,对象接受两个顺序之一的治疗:一天一次的活性研究药物(8mg纳曲酮sr/90mg安非他酮sr[nb32]),持续1周,随后一天一次的安慰剂,持续1周;或者1周的安慰剂,随后1周的活性研究药物。将对象随机分配至导入期的nb或安慰剂。
[0210]
3)治疗期(开始于第3次随访,第1天):双盲、随机期,在治疗期期间,完成了导入期且满足包含/排除标准的对象接受活性研究药物或安慰剂。治疗期在第3次随访时随机开始(第1天)。
[0211]
a)在第6次随访(第16周),评价相对于基线观察的减重和血压变化。目标减重是≥5%,在16周预期的最小减重是≥2%。如果有以下情形,则在16周,对象应当中止研究药物:
[0212]
他们没有减掉他们体重的至少2%,或者
[0213]
他们正经历≥10mm hg的血压(收缩或舒张压)的持续(如,在2次或更多次随访时)增加。如果研究者怀疑升高的血压测量可能是假的,则对象不应当中止,直到升高的测量在4周内被确认。
[0214]
b)所有对象参与如上文详述的全面的基于网络的体重控制项目。对象参与体重控制项目,贯穿研究程序的完成,不管他们是否正在服用研究药物。
[0215]
c)第7次随访(第26周)之后,随访之间隔月,使用基于因特网或电话的数据采集系统,要求对象回答与依从性和住院有关的特定问题(可能的mace或严重的不良事件[sae])。
[0216]
d)中止研究药物的所有随机对象,提早完成治疗结束的随访程序,并继续参与试验的剩余部分的研究,用于mace数据的采集。第7次随访(第26周)之后,随访之间隔月,要求对象在他们的排定随访时间来到研究场所,并完成基于网络或电话的数据采集,即使他们不再服用研究药物。
[0217]
对象必须满足所有下述纳入标准以适合于参与该研究。
[0218]
1.年龄≥50岁(女人)或年龄≥45岁(男人);
[0219]
2.身体质量指数(bmi)≥27kg/m2,且≤50kg/m2;
[0220]
3.腰围≥88cm(女人)或≥102cm(男人);
[0221]
4.不良心血管后果的风险增加:
[0222]
(a)心血管疾病(确认诊断的心血管疾病或心血管疾病的可能性高)与下述中的至少一种:筛选之前有病历记载的心肌梗塞史》3个月;冠状动脉重建术(即,冠动脉旁路移植术、支架放置术、经皮经腔冠状动脉血管成形术或激光旋切术)史;颈动脉或外周动脉重建术(即,颈动脉内膜切除术、下肢动脉粥样硬化性疾病旋切术、腹部主动脉瘤的修复、股动脉或膕动脉旁路术)史;伴随有缺血性改变的心绞痛(静息ecg),基于分级运动试验的ecg变化(gxt)或阳性心脏成像研究;之前2年内踝臂指数《0.9(通过简单的切脉);之前2年内冠动脉、颈动脉或下肢动脉有≥50%的狭窄;和/或
[0223]
(b)2型糖尿病与下述中的至少2种:高血压(《145/95mm hg时,用或不用药物疗法控制);需要药物疗法的血脂异常;之前12个月内有病历记载的低hdl胆固醇(在女人中《50mg/dl或在男人中《40mg/dl);现时吸烟者。
[0224]
具有下述特征的对象待被排除:筛选之前3个月内的心肌梗塞;按照加拿大心血管协会分级方案的iii级或iv级心绞痛;脑血管疾病(中风)的临床史;除窦性心动过速之外的快速性心律失常史;血压≥145/95mm hg,不考虑用抗高血压剂治疗;筛选之前3个月重量不稳定(如,》3%的增重或减重);计划的减肥手术、心脏手术或冠状动脉血管成形术;由估计的gfr《30ml/min限定的严重肾脏损伤;肝功能衰竭或者有病历记载的比正常上限(uln)大3倍的alt或ast的临床史;已知感染有hiv或者肝炎;长期使用类阿片或者类阿片的筛选呈阳性;筛选之前6个月内,近期药物或酒精滥用或依赖成瘾(除尼古丁的依赖性之外);癫痫史(包括热性惊厥)、颅骨创伤史或使所述对象易患癫痫的其它病况史;躁狂症史或活动性精神病、活动性暴食症或神经性厌食症的当前诊断(狂食症是不排除的);基于研究者的判断有自杀企图的风险;严重的抑郁病,包括抑郁症的最新发生或症状的急性恶化(不排除进行抑郁症慢性治疗的稳定对象);使期望的预期寿命少于4年的任何病况(如,充血性心力衰竭nyha 3级或4级);以前5年内有恶性肿瘤史,除了非黑素瘤皮肤癌或外科手术治愈的子宫颈癌之外;当前使用其它含安非他酮或纳曲酮的产品;对纳曲酮或安非他酮的过敏史或不耐受史;筛选之前14天内使用了单胺氧化酶抑制剂;筛选之前30天内使用了任何研究药物、装置或程序;孕妇或哺乳期妇女或者当前正想怀孕的女人,或者育龄期(包括一年内有过经期的绝经期妇女)且不愿意进行节育的女人;无能力始终使用宽带互联网;主办者或研究场所的雇佣或者与入选该研究中其他个体共同居住。
[0225]
将研究药物(nb和安慰剂)以药片的形式提供。每个活性药片含有8mg纳曲酮sr/90mg安非他酮sr(8/90)。所有药片,包括安慰剂,在外观上是完全相同的以维持盲法。如下文的表4所示,在治疗期的前4周中,发生剂量的逐步增加。可以将剂量与食物或不与食物一起服用。
[0226]
表4
[0227][0228]
实施例2
[0229]
实施例2总结了纳曲酮的心血管(cv)后果的临床研究结果,其表明,用32mg纳曲酮的缓释(sr)/360mg安非他酮sr(nb或nb32)进行治疗,不增加或者减少了具有心血管风险因子的超重和肥胖对象中主要不良心血管事件(mace)的发生。一般性研究患者的纳入标准描述于实施例1和下文的更多细节中。治疗期是不间断的,并且所报道的结果是期中结果。
[0230]
在第16周,评价相对于基线观察的减重和血压变化。如果对象没有减掉他们体重的至少2%,或者他们正经历≥10mm hg的血压(收缩或舒张压)的连续、持续增加,则在第16周对象待中止研究药物。
[0231]
研究药物将以双盲的形式被施用3至4年(2周的导入期,以及3至4年的治疗期)。在期中分析时,对于安慰剂组,暴露于研究药物的平均持续时间是26.84周,对于nb组,是30.47周。对于安慰剂组和nb组,研究药物的总对象年数分别是2289年和2602年。
[0232]
主要终点包括:从治疗期的随机化至第一次确诊mace(被定义为cv死亡,包括致命性mi和致命性中风)、非致命性mi和非致命性中风发生的时间。次要终点包括:从治疗期的随机化至第一次确诊四点扩展的mace(被定义为cv死亡,包括致命性mi、致命性中风和致命性husa)、非致命性mi、非致命性中风或非致命性husa发生的时间;从治疗期的随机化至确诊cv死亡(包括致命性mi、致命性中风)发生的时间;从治疗期的随机化至第一次确诊mi(非致命的或致命的)发生的时间;从治疗期的随机化至第一次确诊中风(非致命的或致命的)发生的时间;其它终点包括:从治疗期的随机化至第一次确诊由任何原因导致的死亡发生的时间;从治疗期的随机化至第一次确诊husa(非致命的或致命的)发生的时间;从治疗期的随机化至冠状动脉重建术程序的第一次发生的时间;至第52周基于基线的体重变化百分比;在第52周,基于基线实现≥10%减重的对象的比例;至第52周基于基线的血压变化。
[0233]
总之,为了符合条件,对13,192名对象进行筛选,使其中的10,504名入选导入期。随后使完成导入期的总共8910名对象随机进入治疗期,并接受至少一种剂量的治疗期研究药物(4450名接受安慰剂,以及4454名接受nb)。2013年11月6日的截止数据用于期中分析,1201名(安慰剂)对象和1708名(nb)对象继续用研究药物进行治疗。itt群体中的大多数对象(95.2%)继续有待关于mace的随访,然而4.8%的对象被归类为不能保持mace的随访,因为他们取消了他们的同意或者失访。重要地是,对被归类为不能保持mace的随访的所有对象,使用公开的记录进行生命状态的检查。在被归类为不能保持mace的随访的428名对象中,获得359名对象的生命状态,剩下的69名对象(0.8%的itt群体)在该期中分析时无生命状态(没有获得或待定)。对于nb,治疗期间中止研究药物的最常见原因是由于ae(安慰剂中7.4%,nb中26.7%);以及对于安慰剂,治疗期间中止研究药物的最常见原因是不能满足继
续第16周的治疗标准(安慰剂中40.7%,nb中14.2%)。中止研究药物的所有其它原因在治疗组之间是平衡的。
[0234]
人口统计特征和基线身体质量特征
[0235]
表5中显示itt群体中对象的人口统计特征和基线特征。对象中的大多数是女性(54.5%)、白种人(83.5%)且不是西班牙人或拉丁美洲人(93.5%)。平均年龄是61.0岁。平均基线体重(106.0kg)、bmi(37.3kg/m2)和腰围(119.5cm),与超重和肥胖的标准一致。
[0236]
对象中的大多数患有t2dm(85.2%),有cv疾病史的比例较小(cvd,32.1%)。治疗分配在主要的风险组内是平衡的,只患t2dm、只患cvd、或者患t2dm与cvd的整体分布,分别是67.8%、14.8%和17.3%。
[0237]
在患有t2dm的对象中,t2dm的中值持续时间是7.7年,有58.9%的对象报道≥6年的持续时间。平均基线hba1c是7.4%,以及52.7%的对象hba1c≥7%。在itt群体的所有对象中,78.7%的对象进行抗糖尿病药物的基线使用,其主要反映二甲双胍的使用(63.9%)。不要求患有t2dm的对象具有该研究包含的规定范围内的hba1c值,并且不存在对抗糖尿病药物的限制。
[0238]
患有基线高血压的对象,发生率是92.9%。抗高血压药物的基线使用是93.4%,其主要反映了血管紧张肽-转化酶抑制剂(acei)/血管紧张肽ii受体阻断剂(arb)的使用(78.0%)。类似地,91.8%的对象报导有基线血脂异常。88.4%的对象进行调脂药物的基线使用,其主要被归功于他汀类(hmg-coa还原酶抑制剂)的使用(80.4%)。在筛选时是现时吸烟者的对象发生率是9.2%,并且在治疗组之间是可比较的。cv相关的基线情况,包括实验室值和相关药物的使用,在治疗组之间是可比较的,并且指示,虽然对象呈现cv的风险增加,但还根据护理标准进行相关并存病的治疗。
[0239]
23.0%群体经历了基线抑郁症。在itt群体的所有对象之中,24.4%的对象进行抗抑郁剂药物的使用,其主要归因于ssri的使用(15.6%)。具有基线肾脏损伤(egfr《90ml/min)的对象发生率是26.9%。
[0240]
人口统计特征和基线特征在治疗组之间是平衡的。在cv风险组之中,人口统计学特征和基线特征的发生率和模式中没有意料之外的差别。
[0241]
表5.人口统计特征和基线特征:itt群体
[0242]
变量安慰剂(n=4450)nb(n=4455)总计(n=8905)年龄(岁)
ꢀꢀꢀ
n445044558905平均值(sd)60.9(7.38)61.1(7.27)61.0(7.33)中值61.061.061.0
[0243]
表5.人口统计特征和基线特征:itt群体
[0244][0245]
表5.人口统计特征和基线特征:itt群体
[0246][0247]
表5.人口统计特征和基线特征:itt群体
[0248][0249]
表5.人口统计特征和基线特征:itt群体
[0250]
变量安慰剂(n=4450)nb(n=4455)总计(n=8905)
n372736997426平均值(sd)9.5(7.64)9.5(7.42)9.5(7.53)中值7.67.87.7范围(最小值,最大值)0.0,50.50.0,69.00.0,69.0t2dm组别持续时间,n(%)
ꢀꢀꢀ
《6年1561(41.9%)1494(40.4%)3055(41.1%)≥6年2166(58.1%)2205(59.6%)4371(58.9%)hba1c(%)
ꢀꢀꢀ
n379937797578平均值(sd)7.5(1.57)7.4(1.47)7.4(1.52)中值7.17.07.0范围(最小值,最大值)4.1,16.04.5,15.34.1,16.0hba1c组别,n(%)
ꢀꢀꢀ
《7%1766(46.5%)1818(48.1%)3584(47.3%)≥7%2033(53.5%)1961(51.9%)3994(52.7%)抗糖尿病药物的使用,n(%)3518(79.1%)3493(78.4%)7011(78.7%)胰岛素1045(23.5%)1051(23.6%)2096(23.5%)噻唑烷二酮类353(7.9%)324(7.3%)677(7.6%)二甲双胍2866(64.4%)2822(63.3%)5688(63.9%)glp-1/dpp-iv912(20.5%)940(21.1%)1852(20.8%)磺酰脲类1174(26.4%)1226(27.5%)2400(27.0%)抑郁症,n(%)1009(22.7%)1039(23.3%)2048(23.0%)抗抑郁剂药物的使用,n(%)1072(24.1%)1100(24.7%)2172(24.4%)ssri671(15.1%)720(16.2%)1391(15.6%)egfr组别,n(%)
ꢀꢀꢀ
《90ml/min1174(26.4%)1220(27.4%)2394(26.9%)≥90ml/min3275(73.6%)3234(72.6%)6509(73.1%)
[0251]
缩写:acei=血管紧张肽-转化酶抑制剂;arb=血管紧张肽ii受体阻断剂;bmi=身体质量指数;cv=心血管;egfr=估计的肾小球滤过率;hscrp=高灵敏度的c反应蛋白;dpp-iv=二肽基肽酶iv;glp-1=胰高血糖素样肽1;hba1c=血红蛋白a1c;nb=纳曲酮sr 32mg/安非他酮sr 360mg;nr=正常范围;ssri=选择性血清素再摄取抑制剂;t2dm=2型糖尿病。
[0252]
病史
[0253]
为了有资格进入研究,对象应处于cv后果的风险增加状况下,其患有实施例1所述方案的纳入标准4中限定的cv疾病、t2dm或二者。基于所述方案的纳入标准4中陈述的要求,将itt群体的cv病史总结提供于表6中。为了被包含在cv疾病风险组“cv疾病”中,对象应具有下述中的至少一种:筛选之前有》3个月的mi史(13.3%);冠状动脉史、颈动脉史或外周动脉重建术史(分别是25.9%、0.9%和0.7%);伴随有缺血性改变的心绞痛,基于分级运动试验的ecg变化或阳性心脏成像研究(3.8%);之前2年的踝臂指数《0.9(0.6%);或者之前2年
内冠动脉、颈动脉或下肢动脉有≥50%狭窄(分别是3.6%、0.7%和0.2%)。
[0254]
为了被包含在cv疾病风险组“t2dm”中,对象应患有t2dm(85.2%)与下述中的至少两种:高血压史(92.9%)、需要药物疗法的血脂异常(91.8%)、之前12个月内有病历记载的低hdl(29.4%)或者现时吸烟者(9.2%)。
[0255]
cv病史在治疗组之间是平衡的。对于患有cv疾病、t2dm或两者的群体,各cv风险组的cv病史的发生率和模式是预期的。
[0256]
表6.心血管病史:itt群体
[0257][0258][0259]
缩写:ecg=心电图;hdl=高密度脂蛋白;nb=纳曲酮sr 32mg/安非他酮sr 360mg;t2dm=2型糖尿病。
[0260]
体重和血压的分析
[0261]
总之,nb相比安慰剂,平均减重始终大2%至3%(图3)。通过以下进一步证明了临床和统计学上有意义的减重:至第52周用nb(12.3%)相比安慰剂(3.3%),更高比例的对象实现了基于基线≥10%减重;比值比(or)4.13(p《0.0001)。该研究中观察到的减重,与之前
nb研究中患有t2dm对象的减重一致,但是绝对减重和安慰剂校正的减重小于之前nb研究中针对非糖尿病群体所观察到的。
[0262]
nb组相比安慰剂组,血压值在大多数时间点高大约0.5mm hg,在第8周达到高峰并具有大约1mm hg的治疗差异,该治疗差异至第16周被消退。
[0263]
安全性结果:
[0264]
生命体征
[0265]
收缩压基于基线持续增加的对象的比例,在nb组中稍微更高。≥160mm hg和≥180mm hg组别的具有持续收缩压的很少对象中,在nb组中对象的比例稍微更高,并且在第16周之前和之后观察到离群值(outlier)。nb组中相对小比例对象的舒张压具有基于基线持续的增加。在具有≥100mm hg持续的离群舒张压的很少对象中,在nb组中对象的比例稍微更高,治疗组之间有差异,第16周之后最明显。当通过基线血压组别评价时,治疗之间最大变化范围中不存在有意义的差别。
[0266]
在第16周之前(nb组稍微更高)以及第16周之后(安慰剂组稍微更高)观察到心率持续增加≥10bpm的轻微趋势,但是总的来说,结果在治疗之间是类似的。具有≥100bpm或≥110bpm心率离群值的对象的整体比例没有差别。当通过基线心率组别评价时,治疗之间最大变化范围中没有有意义的差别。
[0267]
研究后果的结果和单个对象数据的表格
[0268]
mace和其它后果测量的分析
[0269]
主要mace分析
[0270]
表7中显示itt群体第一次mace的发生率。处于风险的总对象年数,在治疗组之间是类似的。背景mace率是1.3%(安慰剂组),与具有1-1.5%的背景mace率的入选对象的预期目标一致。
[0271]
相比安慰剂(59,1.3%),用nb治疗的对象经历主要终点事件较少(35,0.8%);hr(95%ci)0.59(0.39-0.90)。nb组相比安慰剂,cv死亡和非致命性mi的单个mace组件的发生率更低,以及mace组件非致命性中风的发生率在组间是类似的。
[0272]
这些结果明显满足fda所述的预定要求,排除2.0的hr。而且,有利的点估计和小于1.0的95%ci上限指示,用nb导致的mace的风险相比于安慰剂没有升高。
[0273]
通过治疗导致的主要终点结果的分开很早发生,并且在整个评估期nb是有利的(图2)。
[0274]
表7.第一次mace的发生率:itt群体
[0275]
[0276][0277]
缩写:ci=置信区间;cv=心血管;hr=风险比;mace=主要不良心血管事件;mi=心肌梗塞;nb=纳曲酮sr 32mg/安非他酮sr 360mg。
[0278]
1基于用治疗作为因子的cox比例风险模型。
[0279]
2用于检验hr≥2的零假设相对单侧备择假设的p-值。
[0280]
主要mace子群的分析
[0281]
通过下述人口统计变量和基线特征来评价主要后果变量(至第一次mace的时间):cv风险组、年龄组别、性别、种族分组、种族划分、bmi组别、抽烟状态、hba1c组别、研究药物的类别、t2dm的持续时间组别以及肾脏损伤组别。进行这些分析以探索治疗效果的潜在变化。
[0282]
对于itt群体,表8中显示子群第一次mace的发生率的hr。对于pp群体,相对于子群的安慰剂,用nb导致的mace风险大体类似。
[0283]
表8.子群第一次mace的发生率:itt群体
[0284]
[0285][0286]
表8.子群第一次mace的发生率:itt群体(续)
[0287]
[0288][0289]
表8.子群第一次mace的发生率:itt群体(续)
[0290]
[0291]
[0292][0293]
缩写:acei=血管紧张肽-转化酶抑制剂;arb=血管紧张肽ii受体阻断剂;bmi=身体质量指数;ci=置信区间;cv=心血管;dpp-iv=二肽基肽酶iv;glp-1=胰高血糖素样肽1;hba1c=血红蛋白a1c;hr=风险比;n/a=不适用;nb=纳曲酮sr 32mg/安非他酮sr 360mg;t2dm=2型糖尿病。
[0294]
1基于cox比例风险模型;在来源表中总结了用来计算各子群的hr和95%ci的因子和协变量。
[0295]
2子群分析排除未患有cv疾病和t2dm的对象。
[0296]
3用于比较具有治疗*子群交叉项和无交叉项的模型的似然比检验。
[0297]
4子群分析排除未知状态的对象。
[0298]
次要mace测量
[0299]
四点扩展的mace、cv死亡、mi和中风的次要终点结果与主要终点一致;各自的hr《1.0且95%ci的上限《2.0。次要mace的测量更详细地描述于下述分段中。
[0300]
至第一次四点扩展的mace的时间
[0301]
四点扩展的mace包括cv死亡、非致命性mi、非致命性中风和非致命性husa的裁定后果。表9中显示itt群体第一次四点扩展的mace的发生率。对于itt和pp群体,hr(95%ci)分别是0.80(0.57,1.11)和1.02(0.66,1.58),表明在分析时已排除了四点扩展的mace的额外风险。对于两个群体的nb治疗组,husa(唯一未被包括在主要终点中的项)的发生率在数值上较高,但是不与冠状动脉重建术程序的增加相关。下文讨论了husa的第一次发生(其它
心血管终点和全因死亡终点)。对于itt群体,通过治疗导致四点扩展的mace终点结果的分开在第24周时发生,并且在评估期的剩余时间nb是有利的(图4)。在整个治疗期,患有四点扩展的mace的对象比例在pp群体的组间是类似的。
[0302]
表9.第一次四点扩展的mace的发生率
[0303][0304]
缩写:ci=置信区间;cv=心血管;hr=风险比;husa=由于不稳定的心绞痛导致的住院;mace=主要不良心血管事件;mi=心肌梗塞;nb=纳曲酮sr 32mg/安非他酮sr 360mg。
[0305]
1基于用治疗作为因子的cox比例风险模型。
[0306]
2用于检验hr≥2零假设相对单侧备择假设的p-值。
[0307]
至心血管死亡的时间
[0308]
cv死亡终点包括心脏性猝死、致命性mi、致命性中风以及其它致命性cv原因的裁定后果。表10中显示itt群体的cv死亡的发生率。对于itt和pp群体,hr(95%ci)分别是0.26(0.10,0.70)和0.56(0.16,1.94),表明在分析时已排除了cv死亡的额外风险。心脏性猝死和其它致命性cv的原因是所述终点的主要贡献者。对于itt和pp群体,通过治疗导致的cv死亡终点结果的分开在第20周时发生,并且在评估期的剩余时间nb是有利的(图5)。
[0309]
表10.心血管死亡的发生率
[0310][0311]
缩写:ci=置信区间;cv=心血管;hr=风险比;mi=心肌梗塞;nb=纳曲酮sr 32mg/安非他酮sr 360mg。
[0312]
1基于用治疗作为因子的cox比例风险模型。
[0313]
2用于检验hr≥2零假设相对单侧备择假设的p-值。
[0314]
至第一次心肌梗塞的时间
[0315]
mi终点包括致命性和非致命性mi的裁定后果。表11中显示itt群体第一次mi的发生率。对于itt和pp群体,hr(95%ci)分别是0.70(0.42,1.19)和0.83(0.40,1.71),表明在分析时已排除了mi的额外风险。在整个研究中,对于itt和pp群体,用nb导致mi的风险是有利的或与安慰剂类似(图6)。
[0316]
表11.第一次心肌梗塞的发生率
[0317][0318]
缩写:ci=置信区间;hr=风险比;mi=心肌梗塞;nb=纳曲酮sr 32mg/安非他酮sr 360mg。
[0319]
1基于用治疗作为因子的cox比例风险模型。
[0320]
2用于检验hr≥2零假设相对单侧备择假设的p-值。
[0321]
至第一次中风的时间
[0322]
中风终点包括致命性和非致命性中风的裁定后果。表12中显示itt群体第一次中
风的发生率。对于itt群体,hr(95%ci)是0.63(0.25,1.64),表明在对该群体进行分析时已排除了中风的额外风险。对于itt群体,通过治疗导致的中风终点结果的分开在第20周之后发生,并且在评估期的剩余时间nb是有利的(图7);在整个研究中,pp群体中患有中风的对象比例在治疗组之间大体类似。
[0323]
表12.第一次中风的发生率
[0324][0325]
缩写:ci=置信区间;hr=风险比;nb=纳曲酮sr 32mg/安非他酮sr 360mg。
[0326]
1基于用治疗作为因子的cox比例风险模型。
[0327]
2用于检验hr≥2零假设相对单侧备择假设的p-值。
[0328]
全因死亡终点和其它心血管终点
[0329]
表13中显示了itt群体的全因死亡终点和其它cv终点测量的概述。全因死亡的hr(95%ci)具有支持nb的点估计(0.45[0.22,0.96])。如所期望的,考虑到所述群体和研究设计,cv死亡是全因死亡终点的主要贡献者。对于itt群体,通过治疗导致的全因死亡终点结果的分开在第16周之后发生,并且在评估期的剩余时间nb是有利的(图8)。相比于安慰剂(23,0.5%),用nb治疗的经历husa终点事件的对象更多(29,0.7%);hr(95%ci)1.26(0.73,2.18)。对于itt群体,通过治疗导致的husa终点结果的分开很早发生,并且安慰剂是有利的。重要地,该观察不与冠状动脉重建术事件的增加相关(1.00的hr[95%ci][0.71,1.41])。在各治疗组中,65名(1.5%)对象经历冠状动脉重建术程序的终点事件。在整个研究中,对于itt群体,用nb导致的冠状动脉重建术事件的风险与安慰剂类似。
[0330]
第一次五点扩展的mace的hr(95%ci)具有支持nb的点估计(0.87[0.65,1.15])。五点扩展的mace包括cv死亡、非致命性mi、非致命性中风、非致命性husa以及冠状动脉重建术程序的裁定后果。对于两个治疗组,第一次冠状动脉重建术程序(唯一未被包括在四点扩展的mace中的项)的发生率是类似的(各为0.7%)。对于itt群体,通过治疗导致的五点扩展的mace终点结果的分开在第24周时发生,并且在评估期的剩余时间nb是有利的(图9)。还通过cv风险组、年龄组别、性别、种族分组、种族划分以及bmi组别,评价了itt群体的全因死亡终点和其它cv终点测量。
[0331]
表13.全因死亡终点和其它心血管终点的发生率
[0332][0333][0334]
缩写:ci=置信区间;cv=心血管;hr=风险比;nb=纳曲酮sr 32mg/安非他酮sr 360mg。
[0335]
1基于用治疗作为因子的cox比例风险模型。
[0336]
2用于检验hr≥2零假设相对单侧备择假设的p-值。
[0337]
基于基线的体重变化
[0338]
表14中提供了itt(用locf)和pp群体至第26周和第52周的基于基线的体重百分比变化的总结统计。对于itt(用locf)群体,遍及治疗组之中平均体重在基线是类似的(安慰剂中106.30kg;nb中105.65kg)。在第26周,基于基线的体重的ls平均百分比变化,相比安慰剂(0.00%;p《0.0001),nb在统计学上显著较大(-2.62%);ls平均治疗差异(nb减安慰剂)是-2.63%。在第52周,基于基线的体重的ls平均百分比变化,相比安慰剂(0.03%;p《0.0001),nb保持在统计学上显著较大(-2.74%);ls平均治疗差异是-2.78%。
[0339]
来自pp群体的基于基线的体重百分比变化的ls平均治疗差异结果,在第26周(-2.63%;p《0.0001)和第52周(-3.18%;p《0.0001),相比于安慰剂,nb在统计学上显著较大(表14)。
[0340]
表14.基于基线的体重的百分比变化:itt群体(用locf)
[0341]
[0342][0343]
缩写:ci=置信区间;locf=末次观测值结转法;ls=最小二乘法,nb=纳曲酮sr 32mg/安非他酮sr 360mg,sd=标准偏差;se=标准误差。
[0344]
1基于一般线性模型,用治疗、心血管风险组、种族分组(白种人、非白种人)和性别作为因子,以及基线的体重和年龄作为协变量。
[0345]
对于itt(用locf)和pp群体的各诊查子群,至第52周基于基线的体重的ls平均百分比变化,nb在统计学上显著优于安慰剂(p《0.05)。诊查子群包括:cv风险组、年龄组别、性别、种族分组、种族划分以及bmi组别。
[0346]
注意到,在期中分析的截止日期之前,只有44.8%的对象已完成第52周的随访。因此,对于接受药物的尚未到达第52周的对象,将截止日期时采集的末次观测值结转至第52周。图4中显示针对itt(用locf)随时间的基于基线的体重平均百分比变化。在第一次评估时间点(第2周),针对itt(用locf)群体的体重平均百分比变化,nb相比安慰剂显示基于基线的较大下降,并且在贯穿治疗的前16周继续与安慰剂分开。治疗组之间的体重平均百分比变化的差别,在第16周之后大体一致。总之,nb相比安慰剂,平均减重始终大2%至3%,没有体重反弹的迹象。
[0347]
由于减重不足(或血压的持续增加)而不能满足继续治疗标准的对象则中止治疗,其反映在相比itt群体,pp群体的两个治疗组在第16周之后增加的减重率。第16周继续治疗标准的应用,相比nb,对安慰剂具有更显著的影响,因为相比nb对象,在该时间点被撤出研究药物的安慰剂对象的比例更大,因此,缩小了治疗组之间的减重差异。
[0348]
收缩压的变化
[0349]
图10中显示通过对itt(用locf)群体的随访,基于基线的收缩压的平均变化。注意到,在期中分析的截止日期之前,只有44.8%的对象已完成第52周的随访。因此,对于接受药物的尚未到达第52周的对象,将截止日期前采集的末次观测值结转至第52周。在各时间点,相比于nb,用安慰剂导致的血压变化稍微更有利。在安慰剂组中,平均收缩压在第2周下降至基线以下,然后直至第52周稳定地增加。在nb组中,收缩压值在大多数时间点比安慰剂高大约0.5mm hg,其在第8周时达到高峰并具有大约1mm hg的治疗差异,该治疗差异至第16周被消退。
[0350]
由于血压的持续增加(或减重不足)而不能满足继续治疗标准的对象则中止治疗,其反映在相比itt群体(用locf),pp群体的两个治疗组在第16周之后收缩压急剧下降。此外,按照pp群体的定义且根据安非他酮的拟交感神经作用,nb组中的所有对象在各时间点下进行治疗,其贡献了在第16周之后与itt群体(用locf)相比的治疗差异量级。
[0351]
舒张压的变化
[0352]
图11中显示通过对itt(用locf)群体随访,基于基线的舒张压的平均变化。注意到,在期中分析的截止日期之前,只有44.8%的对象已完成第52周的随访。因此,对于接受药物的尚未到达第52周的对象,将截止日期时采集的末次观测值结转至第52周。在各时间点,相比于nb,用安慰剂导致的血压变化更有利。在安慰剂组中,在各时间点,平均舒张压在基于基线的1mm hg内,直到第52周。在nb组中,舒张压值在大多数时间点比安慰剂高大约0.5mm hg,其在第8周到达高峰并具有大约1mm hg的治疗差异,该治疗差异至第16周被消退。
[0353]
由于血压的持续增加(或减重不足)而不能满足继续治疗标准的对象则中止治疗,其反映在相比于itt群体(用locf),pp群体的两个治疗组在第16周之后舒张压急剧减少。此外,按照pp群体的定义且根据安非他酮的拟交感神经作用,nb组中的所有对象在各时间点
下进行治疗,其贡献了在第16周之后与itt群体(用locf)相比的治疗差异量级。
[0354]
总之,在nb-cvot中,相对于安慰剂,用nb治疗的舒张压微弱相对增加,与3期项目中观察到的一致。
[0355]
结论:
[0356]
总之,在该期中分析时,风险比(hr)的有利点估计和小于1.0的95%ci的上限表明,用nb治疗的超重和肥胖对象中的mace风险,相比于接受安慰剂的对象中的mace风险没有增加。值得注意的是,在用治疗糖尿病、血脂异常和高血压的药物根据护理标准很好地治疗的群体中,观察到这些有利结果。在该研究中观察到主要mace的点估计(hr[95%ci]:0.59[0.39,0.90]),这显示用nb进行治疗降低了mace的风险,而不是如fda所预料的增加mace的风险。尽管用nb治疗导致血压微弱的相对增加(其还在更早的试验中观察到),但是在期中分析时mace终点的结果明显表明,没有与nb的轻微拟交感神经作用相关的危害。
[0357]
虽然接受nb的全部患者群体具有降低的mace的风险比(hr),但是一些nb患者亚群由于在这些患者组中mace风险的变化而使人们对其特别感兴趣。例如,抽烟状态和t2dm的持续时间。相比于非吸烟者(hr[95%ci]:0.69[0.44,1.07])和患有6年或更多年t2dm的患者(hr[95%ci]:0.93(0.53,1.64]),现时吸烟者(hr[95%ci]:0.10[0.01,0.77])和患有小于6年t2dm的患者(hr[95%ci]:0.24[0.08,0.70])显示了更大的mace风险的降低。基于这些结果,相比于不良心血管事件风险增加的超重或肥胖患者的一般群体,现时吸烟者或患有小于6年t2dm的不良心血管事件风险增加的超重或肥胖患者,通过降低他们的mace风险将得益于nb的治疗。
[0358]
此外,当前使用glp-1受体激动剂或dpp-4抑制剂的患者,相比未服用这些药物的患者,表现出mace风险的良好降低(hr=0.33[0.11,1.02])。当前未服用抗糖尿病药物或二甲双胍的患者,也表现出mace风险的良好降低(分别是hr=0.37、0.44)。bmi≥35kg/m2且《40kg/m2的患者、男性患者、超过65岁的患者,也表现出mace风险降低的改善,相比于0.59的总hr,其hr分别是0.35、0.43和0.46。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
