细胞因子前药和双前药
1.相关申请的交叉引用
2.本技术要求于2019年9月28日提交的美国临时申请第62/907,615号的优先权,所述美国临时申请的内容以全文引用的方式并入本文中。
3.序列表
4.本技术含有已经以ascii格式电子提交的序列表,并且特此以全文引用的方式并入。创建于2020年9月23日的所述ascii副本命名为025471_wo007_sl.txt并且大小为282,851字节。
背景技术:
5.白介素12(il-12)在免疫中起着重要作用(watford等人,《细胞因子与生长因子综述(cytokine growth factor rev.)》(2003)14(5):361-8)。其刺激干扰素γ释放并激活t细胞和自然杀伤(nk)细胞(del vecchio,《临床癌症研究(clin cancer res.)》(2007)13(16):4677-85)。il-12由两个亚基,即p40和p35组成。il-12受体由两个亚基,即il-12受体β1(il-12rβ1)和β2(il-12rβ2)组成。il-12rβ1的缺乏会损害il-12信号通路,并可能导致细菌感染甚至自身免疫,如干燥综合征(syndrome)(sogkas等人,《免疫学前沿(front immunol.)》(2017)8:885)。il-12先前已被探索为治疗癌症的潜在疗法(colombo和trinchieri,《细胞因子与生长因子综述》(2002)13(2):155-68;del vecchio,同上;lasek等人,《癌症免疫学与免疫疗法(cancer immunol immunother.)》(2014)63(5):419-35)。若干项关于il-12疗法的临床试验示出,由于其治疗指数狭窄,疗效有限(lasek等人,同上)。
6.il-2,即另一种重要的细胞因子,在淋巴细胞生成、存活和体内平衡中起着核心作用。所述il-2具有133个氨基酸并由四个反平行、两亲性α螺旋组成,所述螺旋形成对其功能不可或缺的四级结构(smith,《科学(science)》(1988)240:1169-76;bazan,《科学》(1992)257:410-13)。
7.il-2通过与il-2受体(il-2r)结合来发挥作用,所述il-2r由至多三个单独的亚基组成。α(cd25)、β(cd122)和γ(cd132)亚基的缔合产生三聚体、高亲和力il-2r。由β和γ亚基组成的二聚体il-2r被称为中间亲和力il-2r。α亚基形成单体低亲和力il-2r。尽管二聚体中间亲和力il-2受体结合il-2的亲和力是三聚体高亲和力受体的大约1/100,但二聚体和三聚体il-2r变体两者能够在il-2结合时传输信号(minami等人,《免疫学年度综述(annu rev immunol)》(1993)11:245-68)。因此,α亚基不是il-2信号转导所必需的,但赋予与il-2r的高亲和力结合,而β和γ亚基对信号转导至关重要(krieg等人,《美国国家科学院院刊(proc natl acad sci.)》(2010)107:11906-11)。三聚体il-2r由cd4
foxp3
调节性t(treg)细胞表达。三聚体il-2r也在常规激活的t细胞上瞬时诱导,而在静息状态下,这些细胞仅表达二聚体il-2r。treg细胞在体内持续表达最高水平的cd25(fontenot等人,《自然免疫学(nature immunol.)》(2005)6:1142-51)。
8.已制备il-2的突变蛋白以减少il-2的副作用。参见例如美国专利6,955,807和9,428,567以及ep2639241b1。还公开了高亲和力三聚体il-2r亲和力降低的聚乙二醇化il-2
(us20140328791)。此外,il-2突变蛋白已与抗体融合,如pd-l1抗体(例如,wo 2017/220989)和cea抗体(例如,klein等人,《肿瘤免疫学(oncoimmunology)》(2017)6(3):e1277306;美国专利9,206,260)。cea抗体从原始小鼠cea抗体pr1a3(美国专利8,642,742)成熟。虽然抗体可能将il-2突变蛋白靶向到肿瘤位点,但在肿瘤位点处的抗体-il-2的融合的量可能仅是施用剂量的一小部分,大部分施用剂量仍在循环中。循环的il-2将与定位于免疫器官(例如,淋巴结和脾脏)中的免疫细胞上的所谓“pk沉降”(如il-2r)结合。因此,即使抗体具有肿瘤靶向特异性,但可给药的il-2的总量仍然有限。
9.il-15是与il-2结构类似的细胞因子。il-15在病毒感染后由单核吞噬细胞和其它免疫细胞分泌。il-15诱导nk和其它免疫细胞的增殖,并参与杀死病毒感染的细胞和癌细胞。与il-2一样,il-15与kd为约1nm的il-2rβ/γ复合物,即中间亲和力受体结合(giri等人,《欧洲分子生物学学会杂志(embo j.)》(1994)13:2822-30)。il-15以更高的亲和力(kd~0.05nm)与il-15受体(il-15r)α结合。il-15rα可以与il-2rβ/γ复合物缔合以形成il-15特异性、功能性高亲和力受体(αβγ)(minami等人,《免疫学年度综述》(1993)11:245-67;giri等人,《白细胞生物学杂志(j leukoc biol.)》(1995)5745:763-6;以及lehours等人,《欧洲细胞因子网络(eur cytokine netw.)》(2000)11:207-15)。il-15rα的胞外区含有sushi结构域,这是蛋白质-蛋白质相互作用中的常见基序。已经示出,具有前65个氨基酸的il-15rαn端片段具有部分活性,而具有前85个氨基酸的片段具有完全功能(wei等人,《免疫学杂志(j immunol.)》(2001)167(1):277-82)。
10.不幸的是,当前细胞因子药物候选物的副作用很显著,从而限制了此类药物的剂量。此外,这些药物候选物对t、nk和其它免疫细胞的激活不是位点特异性的。另外,细胞因子突变蛋白似乎也存在“pk沉降”,即使在突变蛋白对细胞因子受体的亲和力已显著降低时。在基于细胞因子的蛋白质治疗药物的生产中也有许多困难。
11.因此,需要开发经改进的基于细胞因子的癌症治疗药物,所述基于细胞因子的癌症治疗药物对肿瘤位点更具选择性,避免pk沉降并且在提高功效的同时具有更少的严重副作用。
技术实现要素:
12.本公开提供一种il-12前药或(“前药”),其包括il-12细胞因子部分、掩蔽部分(m)、二聚体载体部分(c)和至少一个肽接头,其中所述il-12细胞因子部分包括il-12p40亚基(p40)和il-12p35亚基(p35),所述掩蔽部分与所述il-12细胞因子部分结合并抑制所述il-12细胞因子部分的生物活性,并且所述掩蔽部分任选地通过肽接头与所述二聚体载体部分的一条多肽链融合,并且所述il-12细胞因子部分任选地通过肽接头与所述载体部分的另一条多肽链融合,或者所述p40亚基任选地通过肽接头与所述载体部分的一条多肽链融合,所述p35亚基任选地通过肽接头与所述载体部分的另一条多肽链融合,并且所述掩蔽部分任选地通过肽接头与所述p40亚基或所述p35亚基的c端融合。
13.在特定实施例中,所述il-12亚基p40与seq id no:5的氨基酸序列具有至少95%的同源性。在特定实施例中,所述il-12亚基p35与seq id no:6的氨基酸序列具有至少95%的同源性。
14.在一些实施例中,至少一个肽接头是可切割的肽接头。在其它实施例中,至少一个
肽接头是不可切割的肽接头。
15.在一些实施例中,所述掩蔽部分是第一掩蔽部分(mm1),所述mm1任选地通过可切割的肽接头与所述载体部分或与所述il-12p40或p35亚基融合。在特定实施例中,所述第一掩蔽部分(mm1)与il-12p40亚基结合并减少或抑制il-12与il-12受体β1(il-12rβ1)结合。在一些实施例中,所述掩蔽部分选自il-12受体β1的胞外结构域(il-12rβ1ecd)或其片段、从肽库筛选中发现的p40结合肽以及与p40结合的抗体的单链抗体(scfv)或fab结构域。在其它实施例中,所述掩蔽部分是与p40结合的抗体的scfv或fab结构域。在特定实施例中,所述掩蔽部分包括与p40结合的scfv,其中所述scfv包括与seq id no:7-11和12具有至少99%同源性的氨基酸序列。
16.在一些实施例中,所述前药进一步包括第二掩蔽部分(mm2),所述mm2任选地通过可切割的肽接头与所述载体部分或与所述il-12p40或p35亚基融合。在特定实施例中,所述第二掩蔽部分(mm2)与p35和/或p40结合并抑制il-12与il-12受体β2(il-12rβ2)结合。在一些实施例中,所述第二掩蔽部分选自il-12受体β2的胞外结构域(il-12rβ2ecd)或其片段、从肽库筛选中发现的p35或p40结合肽以及与p35或p40结合并减少或抑制il-12与il-12rβ2结合的抗体的单链抗体或fab结构域。在特定实施例中,所述第二掩蔽部分包括il-12受体β2(il-12rβ2)的胞外结构域(ecd)或其片段,其中所述il-12rβ2ecd或其片段包括与seq id no:17、18或19至少95%同源性的氨基酸序列。
17.在一些实施例中,所述第二掩蔽部分包括与p40结合并减少或抑制il-12与il-12rβ2结合的抗体的单链抗体(scfv)或fab结构域;其中所述fab的scfv包括与源自以下的相同的轻链cdr和重链cdr:il-12抗体pma204、抗体1、抗体50、抗体68、抗体80或抗体136。
18.在一些实施例中,所述载体是与在癌细胞表面上表达的靶标结合的抗体或抗原结合部分。在特定实施例中,所述抗体或抗原结合部分与选自以下的抗原结合:5t4、claudin 18.2、egfr、egfr iii型、gpc3、trop-2、间皮素、psma、cmet、dll-3和bcma。
19.在一些实施例中,所述载体部分选自fc结构域和抗体。在特定实施例中,所述载体部分包括fc结构域,所述fc结构域包括第一多肽链和第二多肽链,并且其中所述前药的所述多肽链包括选自以下对中的一对的分子式(从n端到c端):
20.a.f1-pl1-a-pl2-b,f2-cl1-mm2-cl2-mm1;以及
21.b.f1-pl1-b-pl2-a、f2-cl1-mm1-cl2-mm2;
22.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1和pl2是肽接头;cl1和cl2是可切割的肽接头;mm1是第一掩蔽部分,所述第一掩蔽部分与p40结合并减少或抑制il-12与il-12rβ1结合;mm2是第二掩蔽部分,所述第二掩蔽部分与p35和/或p40结合并减少或抑制il-12与il-12rβ2结合;a是il-12p35亚基;并且b是il-12p40亚基。
23.在特定实施例中,所述载体部分包括fc结构域,所述fc结构域包括第一多肽链和第二多肽链,其中所述前药的所述多肽链包括选自以下对中的一对的分子式(从n端到c端):
24.a.f1-pl1-a-pl2-b,f2-pl3-mm2-cl-mm1;以及
25.b.f1-pl1-b-pl2-a、f2-pl3-mm1-cl-mm2;
26.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1、pl2和pl3是肽接头;cl是可切割的肽接头;mm1是第一掩蔽部分,所述第一掩蔽部分与p40结合并
减少或抑制il-12与il-12rβ1结合;mm2是第二掩蔽部分,所述第二掩蔽部分与p35和/或p40结合并减少或抑制il-12与il-12rβ2结合;a是il-12p35亚基;并且b是il-12p40亚基。
27.在特定实施例中,所述载体部分包括fc结构域,所述fc结构域包括第一多肽链和第二多肽链,其中所述前药的所述多肽链包括选自以下对中的一对的分子式(从n端到c端):
28.a.f1-pl1-a-cl1-mm2,f2-pl2-b-cl2-mm1;以及
29.b.f1-pl1-a-cl1-mm1、f2-pl2-b-cl2-mm2;
30.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1和pl2是肽接头;cl1和cl2是可切割的肽接头;mm1是第一掩蔽部分,所述第一掩蔽部分与p40结合并减少或抑制il-12与il-12rβ1结合;mm2是第二掩蔽部分,所述第二掩蔽部分与p35和/或p40结合并减少或抑制il-12与il-12rβ2结合;a是il-12p35亚基;并且b是il-12p40亚基。
31.在特定实施例中,所述载体部分包括fc结构域,所述fc结构域包括第一多肽链和第二多肽链,其中所述多肽链包括选自以下对中的一对的分子式(从n端到c端):
32.a.f1-pl1-a-cl-mm2,f2-pl2-b-pl3-mm1;以及
33.b.f1-pl1-a-pl2-mm1、f2-pl3-b-cl-mm2;
34.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1、pl2和pl3是肽接头;cl是可切割的肽接头;mm1是第一掩蔽部分,所述第一掩蔽部分与p40结合并减少或抑制il-12与il-12rβ1结合;mm2是第二掩蔽部分,所述第二掩蔽部分与p35和/或p40结合并减少或抑制il-12与il-12rβ2结合;a是il-12p35亚基;并且b是il-12p40亚基。
35.在特定实施例中,所述载体部分包括fc结构域,所述fc结构域包括第一多肽链和第二多肽链,其中所述多肽链包括选自以下对中的一对的分子式(从n端到c端):
36.a.f1-pl1-a-pl2-b,f2-cl-m;以及
37.b.f1-pl1-b-pl2-a、f2-cl-m;
38.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1和pl2是肽接头;cl是可切割的肽接头;m是与p40亚基结合并抑制il-12生物活性的掩蔽部分;a是il-12p35亚基;并且b是il-12p40亚基。
39.在特定实施例中,所述载体部分包括fc结构域,所述fc结构域包括第一多肽链和第二多肽链,其中所述多肽链包括选自以下对中的一对的分子式(从n端到c端):
40.a.f1-pl1-a-pl2-m,f2-pl3-b;以及
41.b.f1-pl1-b-pl2-a、f2-pl3-m;
42.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1、pl2和pl3是肽接头;m是与p40亚基结合并抑制il-12生物活性的掩蔽部分;a是il-12p35亚基;并且b是il-12p40亚基。
43.在特定实施例中,所述载体部分包括fc结构域,所述fc结构域包括第一多肽链和第二多肽链,其中所述多肽链包括选自以下对中的一对的分子式(从n端到c端):
44.a.f1-pl1-m,f2-pl2-a-ss-b;以及
45.b.f1-cl、f2-pl1-a-ss-b;
46.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1和pl2是肽接头;m是与p40亚基结合并抑制il-12生物活性的掩蔽部分;a是il-12p35亚基;并且b
是il-12p40亚基;并且ss是二硫键。
47.在一些实施例中,所述不可切割的肽接头包括选自seq id no:29-33的氨基酸序列;并且其中所述可切割的肽接头包括选自seq id no:34-54的氨基酸序列。
48.在一些实施例中,所述前药包括两条多肽链,其中所述第一多肽链包括与seq id no:20至少99%同源性的氨基酸序列;并且其中所述第二多肽链包括任一与选自seq id no:21-28的氨基酸序列至少99%同源性的氨基酸序列。
49.在一些实施例中,所述前药包括两条多肽链,其中所述第一多肽链包括与seq id no:55至少99%同源性的氨基酸序列;并且其中所述第二多肽链包括任一与选自seq id no:56-59的氨基酸序列至少99%同源性的氨基酸序列。
50.在一些实施例中,所述前药包括两条多肽链,其中所述第一多肽链包括与seq id no:60至少99%同源性的氨基酸序列;并且所述第二多肽链包括任一与选自seq id no:61-64的氨基酸序列至少99%同源性的氨基酸序列。
51.在一些实施例中,所述前药包括两条多肽链,其中所述第一多肽链包括与seq id no:65至少99%同源性的氨基酸序列;并且所述第二多肽链包括任一与选自seq id no:66-73的氨基酸序列至少99%同源性的氨基酸序列。
52.在一些实施例中,所述前药包括两条多肽链,其中所述第一多肽链包括与seq id no:20至少99%同源性的氨基酸序列;并且所述第二多肽链包括任一与选自seq id no:76-79的氨基酸序列至少99%同源性的氨基酸序列。
53.在一些实施例中,本公开提供了一种药物组合物,其包括本发明的前药以及药学上可接受的赋形剂。
54.在一些方面,本公开提供了对本发明的前药进行编码的一种多核苷酸、包括所述多核苷酸的表达载体以及包括所述表达载体的宿主细胞(例如,哺乳动物宿主细胞,如cho、ns0细胞和293t细胞)。在一些实施例中,敲除本文所述的宿主细胞中对upa、mmp-2、mmp-9和/或蛋白裂解酶进行编码的一个或多个基因。本公开还提供了制备本发明的前药的方法,所述方法包括在允许表达前药的条件下培养所述宿主细胞以及分离(也纯化)所述前药。
55.本公开还提供了一种治疗有需要的患者的癌症或传染病或刺激所述患者的免疫系统的方法,所述方法包括向所述患者施用治疗有效量的所述前药或本公开的所述药物组合物。本公开还提供了一种治疗癌症的方法,所述方法包括向癌症患者施用本公开的所述前药或药物组合物与第二药物组合物的组合,其中所述第二药物组合物包括选自以下的活性成分:除il-12或其融合分子之外的细胞因子、抗pd-1的抗体、抗pd-l1的抗体、抗ctla-4的抗体、抗cd47的抗体、pd-1抗体-il-2融合分子、pd-1-il-7融合分子、pd-1抗体-il-15融合分子和pd-1-il-21融合分子。所述患者可能患有例如病毒感染(例如,hiv、hbv、hcv或hpv感染)或选自由以下组成的组的癌症:脑癌、乳腺癌、肺癌、胰腺癌、食道癌、甲状腺髓样癌、卵巢癌、子宫癌、前列腺癌、睾丸癌、结直肠癌和胃癌。
56.本文还提供了前药在治疗癌症或传染病或刺激所述免疫系统的中的应用;il-12前药在制备用于治疗癌症或传染病或刺激所述免疫系统的药物中的应用;以及包括本发明的il-12前药的一个或多个剂量单位的制品(例如,试剂盒)。
附图说明
57.图1a和1b示出了包括以下的il-12前药的结构的图示:il-12p40亚基(p40)、il-12p35亚基(p35)、第一掩蔽部分(mm1;图示结构中的白色图形)、第二掩蔽部分(mm2;图示结构中的黑色图形)、载体(c)和两个可切割的肽接头。图1a示出了il-12亚基p35与fc结构域中的一条多肽的c端融合,而il-12亚基p40通过不可切割的肽接头与p35的c端融合。第二掩蔽部分通过可切割的接头与fc结构域另一多肽的c端融合,并且第一掩蔽部分通过可切割的肽接头与所述第二掩蔽部分的c端融合。图1b示出了il-12亚基p40与fc结构域中的一条多肽的c端融合,而il-12亚基p35通过不可切割的肽接头与p40的c端融合。第一掩蔽部分通过可切割的接头与fc结构域另一多肽的c端融合,并且第二掩蔽部分通过可切割的肽接头与所述第一掩蔽部分的c端融合。
58.图2a和2b示出了包括以下的il-12前药的结构的图示:il-12p40亚基(p40)、il-12p35亚基(p35)、第一掩蔽部分(mm1;图示结构中的白色图形、第二掩蔽部分(mm2;图示结构中的黑色图形)、载体(c)和一个可切割的肽接头。图2a示出了il-12亚基p35与fc结构域中的一条多肽的c端融合,而il-12亚基p40通过不可切割的肽接头与p35的c端融合。第二掩蔽部分通过不可切割的接头与fc结构域另一多肽的c端融合,并且第一掩蔽部分通过可切割的肽接头与所述第二掩蔽部分的c端融合。图2b示出了il-12亚基p40与fc结构域中的一条多肽的c端融合,而il-12亚基p35通过不可切割的肽接头与p40的c端融合。第一掩蔽部分通过不可切割的接头与fc结构域另一多肽的c端融合,并且所述第二掩蔽部分通过可切割的肽接头与所述第一掩蔽部分的c端融合。
59.图3a和3b示出了包括以下的il-12前药的结构的图示:il-12p40亚基(p40)、il-12p35亚基(p35)、第一掩蔽部分(mm1;图示结构中的白色图形)、第二掩蔽部分(mm2;图示结构中的黑色图形)、载体(c)和两个可切割的肽接头。图3a示出了il-12亚基p35通过不可切割的肽接头与fc结构域中的一条多肽的c端融合,而il-12亚基p40通过不可切割的肽接头与fc结构域另一多肽的c端融合。第二掩蔽部分通过可切割的接头与p35的c端融合,而第一掩蔽部分通过可切割的肽接头与p40的c端融合。图3b示出了il-12亚基p35通过不可切割的肽接头与fc结构域中的一条多肽的c端融合,而il-12亚基p40通过不可切割的肽接头与fc结构域另一多肽的c端融合。第二掩蔽部分通过可切割的接头与p40的c端融合,而第一掩蔽部分通过可切割的肽接头与p35的c端融合。
60.图4a和4b示出了包括以下的il-12前药的结构的图示:il-12p40亚基(p40)、il-12p35亚基(p35)、第一掩蔽部分(mm1;图示结构中的白色图形)、第二掩蔽部分(mm2;图示结构中的黑色图形)、载体(c)和一个可切割的肽接头。图4a示出了il-12亚基p35通过不可切割的肽接头与fc结构域中的一条多肽的c端融合,而il-12亚基p40通过不可切割的肽接头与fc结构域另一多肽的c端融合。第二掩蔽部分通过可切割的接头与p35的c端融合,并且第一掩蔽部分通过不可切割的肽接头与p40的c端融合。图4b示出了il-12亚基p35通过不可切割的肽接头与fc结构域中的一条多肽的c端融合,而il-12亚基p40通过不可切割的肽接头与fc结构域另一多肽的c端融合。第二掩蔽部分通过可切割的接头与p40的c端融合,并且第一掩蔽部分通过不可切割的肽接头与p35的c端融合。
61.图5a和5b示出了包括以下的il-12前药的结构的图示:il-12p40亚基(p40)、il-12p35亚基(p35)、掩蔽部分(mm)和一个可切割的肽接头。图5a示出了il-12亚基p35通过不
可切割的肽接头与fc结构域中的一条多肽的c端融合,而il-12亚基p40通过不可切割的肽接头与p35的c端融合。此外,掩蔽部分通过可切割的接头与fc第二条多肽的c端融合。图5b示出了il-12亚基p40通过不可切割的肽接头与fc结构域中的一条多肽的c端融合,而il-12亚基p35通过不可切割的肽接头与p40的c端融合。此外,掩蔽部分通过可切割的接头与fc第二条多肽的c端融合。
62.图6a和6b示出了包括以下的il-12前药的结构的图示:il-12p40亚基(p40)、il-12p35亚基(p35)、掩蔽部分(mm)、载体(c)并且无可切割的肽接头。图6a示出了il-12亚基p35通过不可切割的肽接头与fc结构域中的一条多肽的c端融合,而il-12亚基p40通过不可切割的肽接头与fc结构域另一多肽的c端融合。此外,掩蔽部分通过不可切割的接头与p35的c端融合。图6b示出了il-12亚基p40通过不可切割的肽接头与fc结构域中的一条多肽的c端融合,而il-12亚基p35通过不可切割的肽接头与p40的c端融合。此外,所述掩蔽部分通过不可切割的接头与fc第二条多肽的c端融合。
63.图7a和7b示出了包括三条多肽链的il-12前药的结构的图示,所述前药包括il-12p40亚基(p40)、il-12p35亚基(p35)、掩蔽部分(mm)和载体(c)。图7a示出了il-12亚基p35任选地通过不可切割的接头与fc结构域中的一条多肽的c端融合,掩蔽部分任选地通过不可切割的接头与fc结构域另一多肽的c端融合。p40是第三多肽链,所述第三多肽链通过二硫键与p35亚基连接。图7b示出了il-12亚基p35任选地通过不可切割的肽接头与fc结构域中的一条多肽的c端融合,掩蔽部分通过不可切割的肽接头与fc结构域另一多肽的c端融合。p40是第三多肽链,所述第三多肽链通过二硫键与p35亚基连接。
64.图8a和8b示出了sds-page分析。图8a示出了结构如在图5b中展示的和序列如在表2中示出的il-12前药jr3.105.2、jr3.105.3、jr3.105.4和jr3.105.5的蛋白a亲和层析法池样品的sds-page分析。样品分别在还原和非还原条件下进行操作。尽管可以观察到部分前药被激活,但样品的纯度合理。图8b示出了前药jr3.105.5样品在以蛋白酶处理前药在激活之前和之后的sds-page分析。数据示出,大多数前药样品被激活。
65.图9示出了在蛋白酶处理之前和之后il-12前药样品的基于细胞的活性分析。用蛋白酶处理的前药标记为jr3.105.2-clv、jr3.105.3-clv、jr3.105.4-clv和jr3.105.5-clv。在用蛋白酶处理的前药jr3.105.5可观察到显著的活性。
66.图10示出了在基于细胞的测定中检测的il-12前药样品的ec
50
值,如在图9中示出的。前药jr3.105.5的ec
50
值在激活前为大约0.9nm,并且激活后为大约0.05nm。
具体实施方式
67.如在本文中和所附权利要求书中所使用的,单数形式“一个或一种(a)”、“或(or)”和“所述(the)”包含复数指代物,除非上下文另有明确指明。本文中提及“约”值或参数包括(及描述)针对所述值或参数本身的变化。例如,提及“约x”的描述包含对“x”的描述。此外,在任何数字系列之前使用“约”包含“约”所述系列中列举的每个数字。例如,提及“约x、y或z”的描述旨在描述“约x、约y或约z”。
68.术语“抗原结合部分”是指与抗原特异性地结合的多肽或一组相互作用的多肽,并且包含但不限于抗体(例如,单克隆抗体、多克隆抗体、多特异性抗体、双特异性抗体(dual specific or bispecific antibody)、抗独特型抗体或双功能杂合抗体)或其抗原结合片
段(例如,fab、fab'、f(ab')2、fv、二硫键连接的fv、scfv、单结构域抗体(dab)或双功能抗体)、单链抗体和含有fc的多肽,如免疫粘附素。在一些实施例中,抗体可以属于任何重链同种型(例如,igg、iga、igm、ige或igd)或亚型(例如,igg1、igg2、igg3或igg4)。在一些实施例中,抗体可以属于任何轻链同种型(例如,κ或λ)。抗体可以是人、非人(例如,来自小鼠、大鼠、兔、山羊或另一个非人动物)、嵌合(例如,具有非人可变区和人恒定区)或人源化(例如,具有非人cdr和人框架和恒定区)。在一些实施例中,抗体是源性抗体。
69.术语“细胞因子激动剂多肽”或“细胞因子部分”是指野生型细胞因子或其类似物。野生型细胞因子的类似物具有与野生型细胞因子相同的生物学特异性(例如,与相同的受体结合并激活相同的靶细胞),即使类似物的活性水平可能不同于野生型细胞因子的活性水平。类似物可以是例如野生型细胞因子的突变蛋白(即突变多肽),并且可以包括相对于野生型细胞因子的至少一个突变、至少两个突变、至少三个突变、至少四个突变、至少五个突变、至少六个突变、至少七个突变、至少八个突变、至少九个突变或至少十个突变。
70.术语“细胞因子掩蔽剂(mask)”或“掩蔽部分”是指与细胞因子结合由此抑制细胞因子与其在靶细胞表面上的受体结合和/或在被罩结合时发挥其生物学功能的部分(例如,多肽)。细胞因子掩蔽剂的实例包含但不限于源自与细胞因子接触的细胞因子的天然受体的胞外结构域的多肽。
71.术语“有效量”或“治疗有效量”是指足以治疗具体病症、病状或疾病,如改善、缓和、减轻和/或延缓其症状中的一种或多种症状的化合物或组合物的量。
72.术语“功能类似物”是指具有与参考分子相同的生物学特异性(例如,与相同配体结合)和/或活性(例如,激活或抑制靶细胞)的分子。
73.关于两个多肽序列的术语“融合(fused)”或“融合(fusion)”是指两个多肽序列通过主链肽键接合。两个多肽可以直接融合或通过一个或多个氨基酸长的肽接头融合。融合多肽可以通过重组技术从含有两个融合配偶体的相应编码序列的编码序列制备,在其间具有或不具有肽接头的编码序列。在一些实施例中,融合涵盖化学缀合。
74.术语“药学上可接受的赋形剂”当用于指组合物中的成分时意指所述赋形剂适合施用于治疗受试者,所述受试者包含人类受试者,而不会对受试者产生过度有害的副作用并且不影响活性药物成分(api)的生物活性。
75.术语“受试者”是指哺乳动物,并且包含但不限于人、宠物(例如,犬科动物或猫科动物)、农场动物(例如,牛或马)、啮齿动物或灵长类动物。
76.如本文所使用的,“治疗(treatment)”或“治疗(treating)”是用于获得有益或期望的临床结果的方法。有益或期望的临床结果包含但不限于以下中的一项或多项:缓解由疾病引起的一种或多种症状、减轻疾病程度、改善疾病状态、稳定疾病(例如,预防或延缓疾病的恶化或进展)、预防或延缓疾病的传播(例如,转移)、预防或延缓疾病的复发、提供疾病的部分或全部缓解、减少治疗疾病所需的一种或多种其它药物的剂量、提高患者的生活质量和/或延长存活期。本公开的方法涵盖这些治疗方面中的任何一个或多个方面。
77.应理解,本文所描述的各个实施例中的一个、一些或所有特性可以组合以形成本发明的其它实施例。本文中使用的章节标题仅出于组织目的,而不应被解释为对下面所描述的主题进行限制。
78.i.il-12前药
79.本公开提供了在体内代谢成为活性il-12治疗药物的il-12前药。il-12前药具有更少的副作用、更好的体内pk特性(例如,更长的半衰期)和更好的靶向特异性,并且与现有技术的il-12治疗药物相比更有效。本发明的il-12前药包括il-12激动剂多肽、至少一个掩蔽部分(m)、载体(c)以及一个或多个将所述掩蔽部分与所述激动剂多肽或所述载体连接的可切割的或不可切割的肽接头。在一些实施例中,il-12前药包括il-12激动剂多肽、第一掩蔽部分(mm1)、第二掩蔽部分(mm2)、载体(c)以及一个或多个将所述掩蔽部分与所述激动剂多肽或所述载体连接的可切割的或不可切割的肽接头。
80.il-12包括亚基p40和p35。亚基p40包括如seq id no:5所示的氨基酸,并且p35包括如seq id no:6所示的氨基酸序列。在一些实施例中,il-12类似物包括具有与seq id no:5至少90%同源性的氨基酸的亚基p40。在其它实施例中,il-12类似物包括具有与seq id no:6至少90%同源性的氨基酸序列的亚基p35。
81.在一些实施例中,il-12前药包括至少一个掩蔽部分。所述掩蔽部分可以通过肽接头与细胞因子部分或载体部分连接。在一些实施例中,肽接头是可切割的肽接头。在一些实施例中,可切割肽接头包括一个或多个可切割的部分,所述一个或多个可切割的部分是通常在肿瘤位点处发现的蛋白酶的底物。当掩蔽剂与细胞因子部分结合时,掩蔽剂会抑制细胞因子部分的生物功能。在具体实施例中,掩蔽剂抑制il-12或其类似物的生物活性。前药可以在患者的靶位点(例如,在肿瘤部位或周围环境)通过切割接头和随后从前药中释放细胞因子掩蔽剂而被激活,从而暴露先前经掩蔽的细胞因子部分并允许所述细胞因子部分与靶细胞上的其受体结合并在靶细胞上发挥其生物功能。
82.在一些实施例中,il-12前药的载体是在靶位点(例如,肿瘤表面)处结合抗原的抗原结合部分。在一些实施例中,本发明的il-12前药被代谢以在载体靶向的靶位点处在体内变得有活性。在另外的实施例中,前药中的载体是靶向肿瘤抗原的抗体,使得il-12前药被递送到患者的肿瘤部位,并且通过切割将细胞因子掩蔽剂与载体或细胞因子部分连接的接头而局部代谢(例如,在肿瘤微环境内部或附近),从而使细胞因子部分可与靶细胞上的其受体相互作用并局部刺激靶免疫细胞。
83.在一些实施例中,载体选自白蛋白、fc片段、聚乙二醇(peg)或其抗体或抗原结合片段。
84.a.il-12前药的掩蔽部分
85.在一些实施例中,il-12掩蔽部分(m、mm1或mm2)来自il-12受体β1亚基胞外结构域或其片段、il-12受体β2亚基胞外结构域或其片段以及对p40或p35具有特异性的scfv或fab。在一些实施例中,掩蔽部分抑制il-12或其类似物的生物活性。在一些实施例中,掩蔽部分包括scfv,其中所述scfv具有与seq id no:7-11和12至少99%同源性的氨基酸序列。在一些实施例中,掩蔽部分是il-12受体胞外结构域(ecd)或其功能类似物,其中所述il-12受体是il-12受体β1。在一些实施例中,掩蔽部分是il-12受体胞外结构域(ecd)、其功能类似物或其片段,其中所述il-12受体是il-12受体β1。在一些实施例中,il-12受体β1具有与seq id no:137至少95%同源性的氨基酸序列。在一些实施例中,前药包括两个掩蔽部分mm1和mm2;其中所述掩蔽部分中的至少一个掩蔽部分包括scfv或fab,其与p40或p35结合并减少或抑制il-12与il-12rβ1或il-12rβ2结合。在一些实施例中,scfv或fab包括与il-12抗体布雷奴单抗(briakinumab)或乌司奴单抗(ustekinumab)相同的轻链cdr和重链cdr。在一
些实施例中,scfv或fab包括与选自以下的il-12抗体相同的轻链cdr和重链cdr:pma204、抗体1、抗体50、抗体68、抗体80和抗体136(参见美国专利第8,563,697号)。
86.在一些实施例中,掩蔽部分(mm1和mm2)均为scfv或fab;其中所述第一掩蔽部分与p40结合并减少或抑制il-12与il-12rβ1结合,并且所述第二掩蔽部分与p40或p35结合,并减少或抑制il-12与il-12rβ2结合。在一些实施例中,第一掩蔽部分包括与il-12抗体布雷奴单抗或乌司奴单抗相同的轻链cdr和重链cdr。在一些实施例中,第二掩蔽部分包括与选自以下的il-12抗体相同的轻链cdr和重链cdr:pma204、抗体1、抗体50、抗体68、抗体80和抗体136(参见美国专利第8,563,697号)。
87.b.前药的载体部分
88.本发明的前药的载体部分可以是抗原结合部分,或者不是抗原结合的部分。载体部分可以改善细胞因子激动剂多肽的pk特性,如血清半衰期,并且还可以将细胞因子激动剂多肽靶向身体中的靶位点,如肿瘤位点。
89.1.非抗原结合载体部分
90.非抗原结合载体部分可以用于本发明的前药。例如,可以使用抗体fc结构域(例如,人igg1、igg2、igg3或igg
4 fc)、聚合物(例如,peg)、白蛋白(例如,人白蛋白)或其片段或纳米颗粒。
91.前药的载体部分可以包括白蛋白(例如,人血清白蛋白)或其片段。在一些实施例中,白蛋白或白蛋白片段与人血清白蛋白或其片段约85%或更多、约90%或更多、约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多、约99.5%或更多、或约99.8%或更多相同。
92.在一些实施例中,载体部分包括长度为以下的白蛋白片段(例如,人血清白蛋白片段):约10个氨基酸或更多个氨基酸、20个氨基酸或更多个氨基酸、30个氨基酸或更多个氨基酸、40个氨基酸或更多个氨基酸、50个氨基酸或更多个氨基酸、60个氨基酸或更多个氨基酸、70个氨基酸或更多个氨基酸、80个氨基酸或更多个氨基酸、90个氨基酸或更多个氨基酸、100个氨基酸或更多个氨基酸、120个氨基酸或更多个氨基酸、140个氨基酸或更多个氨基酸、160个氨基酸或更多个氨基酸、180个氨基酸或更多个氨基酸、200个氨基酸或更多个氨基酸、250个氨基酸或更多个氨基酸、300个氨基酸或更多个氨基酸、350个氨基酸或更多个氨基酸、400个氨基酸或更多个氨基酸、450个氨基酸或更多个氨基酸、500个氨基酸或更多个氨基酸或550个氨基酸或更多个氨基酸。在一些实施例中,白蛋白片段的长度介于约10个氨基酸与约584个氨基酸之间(如长度介于约10个氨基酸与约20个氨基酸之间、介于约20个氨基酸与约40个氨基酸之间、介于约40个氨基酸与约80个氨基酸之间、介于约80个氨基酸与约160个氨基酸之间、介于约160个氨基酸与约250个氨基酸之间、介于约250个氨基酸与约350个氨基酸之间、介于约350个氨基酸与约450个氨基酸或介于约450个氨基酸与约550个氨基酸之间)。在一些实施例中,白蛋白片段包含sudlow i结构域或其片段,或sudlow ii结构域或其片段。
93.在一些实施例中,载体是抗体fc片段。fc是具有两个n端和两个c端的二聚体分子。在一些实施例中,细胞因子部分可以与二聚体fc片段中的一个fc多肽融合,并且掩蔽部分可以与第二fc多肽融合。在优选的实施例中,细胞因子部分和掩蔽部分两者与二聚体fc片段的每条多肽链的c端融合。在一些实施例中,细胞因子部分和掩蔽部分两者与二聚体fc片
段的每条多肽链的n端融合。在任一情况下,掩蔽部分中的至少一个通过可切割的肽接头直接地或间接地与fc多肽融合。
94.在一些实施例中,载体部分是包括第一多肽链和第二多肽链(即,两个不同的重链)的fc结构域,其中前药的多肽链包括选自以下对中的一对的分子式(从n端到c端):
95.a.f1-pl1-a-pl2-b、f2-cl1-mm2-cl2-mm1(图1a);以及
96.b.f1-pl1-b-pl2-a、f2-cl1-mm1-cl2-mm2(图1b);
97.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1和pl2是肽接头;cl1和cl2是可切割的肽接头;mm1是第一掩蔽部分,所述第一掩蔽部分与p40结合并减少或抑制il-12与il-12rβ1结合;mm2是第二掩蔽部分,所述第二掩蔽部分与p35和/或p40结合并减少或抑制il-12与il-12rβ2结合;a是il-12p35亚基;并且b是il-12p40亚基。
98.在一些实施例中,载体部分是包括第一多肽链和第二多肽链(即,两个不同的重链)的fc结构域,其中前药的多肽链包括选自以下对中的一对的分子式(从n端到c端):
99.a.f1-pl1-a-pl2-b、f2-pl3-mm2-cl-mm1(图2a);以及
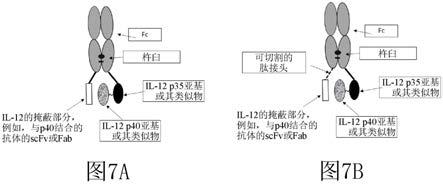
100.b.f1-pl1-b-pl2-a、f2-pl3-mm1-cl-mm2(图2b);
101.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1、pl2和pl3是肽接头;cl是可切割的肽接头;mm1是第一掩蔽部分,所述第一掩蔽部分与p40结合并减少或抑制il-12与il-12rβ1结合;mm2是第二掩蔽部分,所述第二掩蔽部分与p35和/或p40结合并减少或抑制il-12与il-12rβ2结合;a是il-12p35亚基;并且b是il-12p40亚基。
102.在一些实施例中,载体部分是包括第一多肽链和第二多肽链(即,两个不同的重链)的fc结构域,其中前药的多肽链包括选自以下对中的一对的分子式(从n端到c端):
103.a.f1-pl1-a-cl1-mm2、f2-pl2-b-cl2-mm1(图3a);以及
104.b.f1-pl1-a-cl1-mm1、f2-pl2-b-cl2-mm2(图3b);
105.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1和pl2是肽接头;cl1和cl2是可切割的肽接头;mm1是第一掩蔽部分,所述第一掩蔽部分与p40结合并减少或抑制il-12与il-12rβ1结合;mm2是第二掩蔽部分,所述第二掩蔽部分与p35和/或p40结合并减少或抑制il-12与il-12rβ2结合;a是il-12p35亚基;并且b是il-12p40亚基。
106.在一些实施例中,载体部分是包括第一多肽链和第二多肽链(即,两个不同的重链)的fc结构域,其中前药的多肽链包括选自以下对中的一对的分子式(从n端到c端):
107.a.f1-pl1-a-cl-mm2、f2-pl2-b-pl3-mm1(图4a);以及
108.b.f1-pl1-a-pl2-mm1、f2-pl3-b-cl-mm2(图4b);
109.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1、pl2和pl3是肽接头;cl是可切割的肽接头;mm1是第一掩蔽部分,所述第一掩蔽部分与p40结合并减少或抑制il-12与il-12rβ1结合;mm2是第二掩蔽部分,所述第二掩蔽部分与p35和/或p40结合并减少或抑制il-12与il-12rβ2结合;a是il-12p35亚基;并且b是il-12p40亚基。
110.在一些实施例中,载体部分是包括第一多肽链和第二多肽链(即,两个不同的重链)的fc结构域,其中前药的多肽链包括选自以下对中的一对的分子式(从n端到c端):
111.a.f1-pl1-a-pl2-b、f2-cl-m(图5a);以及
112.b.f1-pl1-b-pl2-a、f2-cl-m(图5b);
113.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1和pl2
是肽接头;cl是可切割的肽接头;m是与p40结合并减少或抑制il-12与il-12rβ1结合的掩蔽部分;a是il-12p35亚基;并且b是il-12p40亚基。
114.在一些实施例中,载体部分是包括第一多肽链和第二多肽链(即,两个不同的重链)的fc结构域,其中前药的多肽链包括选自以下对中的一对的分子式(从n端到c端):
115.a.f1-pl1-a-pl2-m、f2-pl3-b(图6a);以及
116.b.f1-pl1-b-pl2-a、f2-pl3-m(图6b);
117.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1、pl2和pl3是肽接头;m是与p40结合并减少或抑制il-12与il-12rβ1结合的掩蔽部分;a是il-12p35亚基;并且b是il-12p40亚基。
118.在一些实施例中,载体部分是包括第一多肽链和第二多肽链(即,两个不同的重链)的fc结构域,其中前药的多肽链包括选自以下对中的一对的分子式(从n端到c端):
119.a.f1-pl1-m、f2-pl2-a-ss-b(图7a);以及
120.b.f1-cl-m、f2-pl1-a-ss-b(图7b);
121.其中f1和f2是形成异二聚体的所述载体部分(例如,fc结构域)的亚基;pl1和pl2是肽接头;m是与p40结合并减少或抑制il-12与il-12rβ1结合的掩蔽部分;cl是可切割的肽接头;a是il-12p35亚基;并且b是il-12p40亚基;并且ss是二硫键。
122.2.抗原结合载体部分
123.载体部分可以是抗体或其抗原结合片段,或免疫粘附素。在一些实施例中,抗原结合部分是具有以下的全长抗体:两条重链和两条轻链、fab片段、fab'片段、f(ab')2片段、fv片段、二硫键连接的fv片段、单结构域抗体、纳米抗体或单链可变片段(scfv)。在一些实施例中,抗原结合部分是双特异性抗原结合部分并且可以与两种不同的抗原或同一抗原上的两种不同的表位结合。抗原结合部分可以为细胞因子激动剂多肽提供另外的和潜在协同的治疗功效。在一些实施例中,抗原结合部分包括全长抗体重链或全长抗体轻链。在一些实施例中,抗原结合部分包含抗体重链片段或抗体轻链片段。
124.在一些实施例中,细胞因子部分与抗体的重链之一的c端融合,并且所述细胞因子的掩蔽剂通过肽接头(任选地可切割的接头)与抗体的另一重链的c端融合,其中两条重链任选地含有允许两条不同重链特异性配对的突变。
125.形成fc融合多肽或双特异性抗体的异二聚体的策略是众所周知的(例如参见spies等人,《分子免疫学(mol imm.)》(2015)67(2)(a):95-106)。例如,前药中的两条重链多肽可以通过“杵臼”突变形成稳定的异二聚体。进行“杵臼”突变以促进形成抗体重链的异二聚体,并且所述突变通常用于制备双特异性抗体(参见例如美国专利8,642,745)。例如,抗体的fc结构域可以包括“杵链”的ch3结构域中的t366w突变以及“臼链”的ch3结构域中的t366s、l368a和/或y407v突变。还可以使用ch3结构域之间的另外的链间二硫键,例如通过将y349c突变引入到“杵链”的ch3结构域中并且将e356c或s354c突变引入到“臼链”的ch3结构域中(参见例如merchant等人,《自然生物技术(nature biotech)》。(1998)16:677-81)。在其它实施例中,抗体部分可以包括两个ch3结构域之一中的y349c和/或t366w突变以及另一个ch3结构域中的e356c、t366s、l368a和/或y407v突变。在某些实施例中,抗体部分可以包括两个ch3结构域之一中的y349c和/或t366w突变以及另一个ch3结构域中的s354c(或e356c)、t366s、l368a和/或y407v突变,其中另外的y349c突变位于一个ch3结构域中并且另
外的e356c或s354c突变位于另一个ch3结构域中,从而形成链间二硫键(始终根据kabat的eu指数编号;kabat等人,《具有免疫学意义的蛋白质序列(sequences of proteins of immunological interest)》,第5版,马里兰州贝塞斯达国立卫生研究院公共卫生署(public health service,national institutes of health,bethesda,md.)(1991))。可以可替代地或另外地使用其它杵臼技术,如在ep1870459a1中所述的杵臼技术。因此,抗体部分的杵臼突变的另一个实例是具有在“杵链”的ch3结构域中的r409d/k370e突变以及在“臼链”的ch3结构域中的d399k/e357k突变(eu编号)。
126.在一些实施例中,前药中的抗体部分包括其fc结构域中的l234a和l235a(“lala”)突变。lala突变消除了补体结合和固定以及fcγ依赖性adcc(参见例如hezareh等人,《病毒学杂志(j.virol.)》(2001)75(24):12161-8)。在另外的实施例中,抗体部分中除了杵臼突变之外,还存在lala突变。
127.在一些实施例中,抗体部分包括fc结构域中的m252y/s254t/t256e(“yte”)突变。yte突变允许同时调节血清半衰期、组织分布和igg1的活性(参见dall'acqua等人,《生物化学杂志(j biol chem.)》(2006)281:23514-24;以及robbie等人,《抗微生物制剂与化疗(antimicrob agents chemother.)》(2013)57(12):6147-53)。在另外的实施例中,除了杵臼突变之外,yte突变存在于抗体部分中。在特定实施例中,抗体部分具有yte、lala和杵臼突变或其任何组合。
128.在一些实施例中,抗体与pd-l1结合。在一些实施例中,抗体与cea结合。在一些实施例中,抗体与肿瘤细胞上的抗原结合,例如5t4、fap、trop-2、pd-l1、her-2、egfr、claudin 18.2、dll-3、gcp3和cea。抗体可能具有或可能不具有抗体依赖性细胞毒性(adcc)活性。抗体也可以进一步与细胞毒性药物缀合。在一些实施例中,抗体与免疫细胞表面上的靶标结合,并具有激活所述免疫细胞并增强其抗癌活性的能力,例如pd-1抗体、lag3抗体、tigit抗体、tgf-β抗体和ctla4抗体。
129.抗原结合部分可以结合细胞表面上的抗原,如癌细胞。在一些实施例中,抗原结合部分是双特异性抗原结合部分,可以与两种不同的抗原或同一抗原上的两种不同的表位结合。在一些实施例中,抗原结合部分可以与以下结合:鸟苷酸环化酶c(gcc)、糖类抗原19-9(ca19-9)、糖蛋白a33(gpa33)、粘蛋白1(muc1)、癌胚抗原(cea)、胰岛素样生长因子1受体(igf1-r)、人表皮生长因子受体2(her2)、人表皮生长因子受体3(her3)、δ样蛋白3(dll3)、δ样蛋白4(dll4)、表皮生长因子受体(egfr)、磷脂酰肌醇聚糖-3(gpc3)、c-met、血管内皮生长因子受体1(vegfr1)1、血管内皮生长因子受体2(vegfr2)、粘连蛋白-4、liv-1、糖蛋白nmb(gpnmb)、前列腺特异性膜抗原(psma)、trop-2、碳酸酐酶ix(ca9)、内皮素b受体(etbr)、tf抗原(thomsen-friedenrech antigen,tf)、钠依赖性磷酸转运蛋白2b(napi2b)、前列腺六跨膜上皮抗原1(steap1)、叶酸受体α(fr-α)、slit和ntrk样蛋白6(slitrk6)、碳酸酐酶vi(ca6)、外核苷酸焦磷酸酶/磷酸二酯酶家族成员3(enpp3)、间皮素、滋养层糖蛋白(tpbg)、cd19、cd20、cd22、cd33、cd40、cd56、cd66e、cd70、cd74、cd79b、cd98、cd123、cd138、cd352、程序性死亡配体1(pd-l1)、claudin 18.2、claudin 6、psma或fapα。在一些实施例中,抗原结合部分与dll3的表皮生长因子(egf)样结构域结合。在一些实施例中,抗原结合部分与dll3的delta/serrate/lag2(dsl)样结构域结合。在一些实施例中,抗原结合部分与位于gpc3的第374个氨基酸之后的表位结合。在一些实施例中,抗原结合部分与gpc3的硫酸肝素聚糖结
合。在一些实施例中,抗原结合部分与claudin 18.2结合而不与claudin 18.1结合。在一些实施例中,抗原结合部分以比claudin18.2弱至少10倍的结合亲和力与claudin18.1结合。
130.抗原结合部分可以结合细胞表面上的抗原,如免疫细胞,例如t细胞、nk细胞和巨噬细胞。在一些实施例中,抗原结合部分是双特异性抗原结合部分,可以与两种不同的抗原或同一抗原上的两种不同的表位结合。在一些实施例中,抗原结合部分与以下结合:pd-1、lag-3、tim-3、ctla-4或tgf-β。
131.在一些实施例中,抗原结合部分(载体部分)包含本领域已知的抗体或其片段,所述抗体或其片段与pd-1结合并破坏pd-1与其配体(pd-l1)之间的相互作用以刺激抗肿瘤免疫应答。在一些实施例中,抗体或其抗原结合部分与pd-1特异性结合。例如,靶向pd-1并且可以在本发明中发现使用的抗体包含但不限于纳武利尤单抗(bms-936558,百时美施贵宝公司)、帕博利珠单抗(mk03475或mk-3475,默克公司)、人源化抗pd-1抗体js001(上海君士公司)、单克隆抗pd-1抗体tsr-042(tesaro公司)、匹地利珠单抗(pidilizumab)(抗pd-1mab ct-011,麦迪韦逊医疗公司)、抗pd-1单克隆抗体bgb-a317(百济神州公司)和/或抗pd-1抗体shr-1210(上海恒瑞公司)、人单克隆抗体regn2810(再生元制药公司)、人单克隆抗体mdx-1106(百时美施贵宝公司)和/或人源化抗pd-1igg4抗体pdr001(诺华公司)。在一些实施例中,pd-1抗体来自克隆:rmp1-14(大鼠igg)—bioxcell目录号bp0146。其它合适的抗pd-1抗体包含在美国专利第8,008,449中公开的那些抗体。在一些实施例中,抗体或其抗原结合部分与pd-l1特异性结合并抑制其与pd-1的相互作用,从而增加免疫活性。与pd-l1结合并破坏pd-1与pd-l1之间的相互作用并刺激抗肿瘤免疫应答的本领域已知的任何抗体均适用于本文公开的组合治疗方法。例如,靶向pd-l1的抗体包含bms-936559(百时美施贵宝公司)和mpdl3280a(基因技术;目前正在进行人体试验)。靶向pd-l1的其它合适的抗体公开于美国专利第7,943,743号中。普通技术人员将理解,任何与pd-1或pd-l1结合、破坏pd-1/pd-l1相互作用并刺激抗肿瘤免疫应答的抗体均适用于本文公开的组合治疗方法。
132.在一些实施例中,其中所述载体是抗人pd-l1的抗体,所述抗体选自askb1296、阿维鲁单抗(avelumab)、阿特珠单抗(atezolizumab)和德瓦鲁单抗(durvalumab)。
133.示例性抗原结合部分包含曲妥珠单抗(trastuzumab)、利妥昔单抗(rituximab)、本妥昔单抗(brentuximab)、西妥昔单抗(cetuximab)、帕尼单抗(panitumumab)、gc33(或其人源化版本)、抗egfr抗体mab806(或其人源化版本)、抗fapα抗体西罗珠单抗(sibrotuzumab)(bibh1)及其片段。在一些实施例中,抗原结合部分与以下具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同源性:曲妥珠单抗、利妥昔单抗、本妥昔单抗、西妥昔单抗或帕尼单抗、gc33(或其人源化版本)、抗egfr抗体mab806(或其人源化版本)、西罗珠单抗(bibh1)或其片段。在一些实施例中,抗原结合部分具有与以下的抗体重链具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同源性的抗体重链:曲妥珠单抗、利妥昔单抗、本妥昔单抗、西妥昔单抗、帕尼单抗、gc33(或其人源化版本)、抗egfr抗体mab806(或其人源化版本)、西罗珠单抗(bibh1)或其片段。在一些实施例中,抗原结合部分具有与以下的抗体轻链具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同源性的抗体轻链:曲妥珠单抗、利妥昔单抗、本妥昔单抗、西妥昔单抗、帕尼单抗、gc33(或其人源化版本)、抗egfr抗体mab806(或其人源化版本)、西罗珠单抗(bibh1)或其片段。
134.在一些实施例中,抗原结合部分包括以下的六个互补决定区(cdr):曲妥珠单抗、利妥昔单抗、本妥昔单抗、西妥昔单抗、帕尼单抗、gc33、抗egfr抗体mab806或西罗珠单抗(bibh1)。许多cdr描绘是本领域公知的并涵盖在本文中。本领域技术人员可以基于重链或轻链可变区的序列容易地确定给定描绘的cdr。“kabat”互补决定区(cdr)基于序列可变性,并且是最常用的(kabat等人,《具有免疫学意义的蛋白质序列(sequences of proteins of immunological interest)》,第5版,马里兰州贝塞斯达国立卫生研究院公共卫生署(public health service,national institutes of health,bethesda,md.)(1991))。“chothia”cdr是指结构环的位置(chothia和lesk,《分子生物学杂志(j.mol.biol.)》(1987)196:901-917)。“abm”cdr表示kabat cdr与chothia结构环之间的折衷并且通过牛津分子公司(oxford molecular)的abm抗体建模软件使用。“contact”cdr是基于对可用的复杂晶体结构的分析。参考常见的抗体编号方案,来自这些cdr中的每一个的残基在下表1中注明。除非本文另有规定,否则抗体的氨基酸编号是指在kabat等人,同上中所述的kabat编号方案,包含在参考kabat、chothia、abm或contact方案进行cdr描绘的情况。使用此编号系统,实际线性氨基酸序列可以含有较少或另外的氨基酸,所述氨基酸对应于可变结构域的框架区(fr)或cdr的缩短或到其中的插入。例如,重链可变结构域可以包含在h2的残基52之后的单个氨基酸插入物(根据kabat的残基52a)和在重链fr残基82之后的插入残基(例如,根据kabat的残基82a、82b和82c等)。通过将抗体序列的同源区与“标准”kabat编号序列比对,可以确定给定抗体的kabat残基编号。
135.表1:根据各种方案的cdr描绘
[0136][0137]
在一些实施例中,cdr是“扩展cdr”,并且涵盖根据不同方案开始或终止的区域。例如,扩展cdr可以如下所示:l24-l36、l26-l34或l26-l36(vl-cdr1);l46-l52、l46—l56或l50-l55(vl-cdr2);l91-l97(vl-cdr3);h47-h55、h47-h65、h50-h55、h53-h58或h53-h65(vh-cdr2);和/或h93-h102(vh-cdr3)。
[0138]
在一些实施例中,本公开的il-12前药包括包含抗原结合部分的载体;其中所述抗原结合部分与trop-2结合。在一些实施例中,il-12前药用于治疗患有实体瘤的患者。在一些实施例中,前药用于治疗三阴性乳腺癌、尿路上皮癌、小细胞肺癌、胰腺癌、肝门部胆管癌、宫颈癌和胃癌。
[0139]
在一些实施例中,il-12前药包括包含抗原结合部分的载体;其中所述抗原结合部分与5t4结合。在一些实施例中,il-12前药用于治疗患有实体瘤的患者。在一些实施例中,前药用于治疗三阴性乳腺癌、小细胞肺癌、非小细胞肺癌、胰腺癌、卵巢癌和胃癌。
[0140]
在一些实施例中,il-12前药包括包含抗原结合部分的载体;其中所述抗原结合部
分与claudin 18.2结合。在一些实施例中,il-12前药用于治疗患有胰腺癌和胃癌的患者。
[0141]
在一些实施例中,il-12前药包括包含抗原结合部分的载体;其中所述抗原结合部分与egfr iii型结合。在一些实施例中,il-12前药用于治疗患有胶质母细胞瘤和结肠癌的患者。
[0142]
在一些实施例中,il-12前体药物与免疫检查点阻断剂(如pd-1抗体或其pd-1抗体片段)组合使用。
[0143]
c.前药的接头部分
[0144]
il-12激动剂多肽可以在具有或不具有肽接头的情况下与载体部分融合。肽接头可以是不可切割的。在一些实施例中,肽接头选自seq id no:29-33。
[0145]
il-12掩蔽剂可以通过不可切割的接头或可切割的接头与细胞因子部分、与载体或与另一个掩蔽剂融合。可切割的接头可以包含一个或多个(例如,两个或三个)可切割的部分(cm)。每个cm可以是选自以下的酶或蛋白酶的底物:豆荚蛋白、纤溶酶、tmprss-3/4、mmp2、mmp9、mt1-mmp、组织蛋白酶、胱天蛋白酶、人中性粒细胞弹性蛋白酶、β分泌酶、upa和psa。可切割的接头的实例包含但不限于包括选自seq id no:34-54的氨基酸序列的那些氨基酸序列。
[0146]
d.具有另外的效应多肽的il-12前药
[0147]
1.il-2激动剂多肽
[0148]
在一些实施例中,本公开的il-12前药进一步包括另一种细胞因子或效应子部分。在一些实施例中,第二细胞因子部分包括il-2激动剂多肽。
[0149]
在一些实施例中,前药中的il-2激动剂多肽包括与seq id no:1具有至少85%、至少90%、至少95%或100%同源性的氨基酸序列。在一些实施例中,il-2激动剂多肽含有导致高亲和力三聚体il-2受体的亲和力显著降低的突变。所述高亲和力三聚体il-2受体包括α、β和γil-2受体亚基。任选地,il-2激动剂多肽进一步包括导致显著降低与中等亲和力il-2受体的结合亲和力的突变,所述中等亲和力il-2受体包括il-2受体β和γ亚基。在一些实施例中,il-2激动剂多肽包括根据具有seq id no:1的氨基酸序列的人il-2的编号在残基r38、f42、f44、y45、e62、e68、l72和a73处的一个或多个突变。在一些实施例中,il-2激动剂多肽进一步包括根据具有seq id no:1的氨基酸序列的人il-2的编号在残基d20、n88、n90和q126处的一个或多个突变。残基t3和/或c125处的另外的突变任选地包含在内。
[0150]
在一些实施例中,il-2前药的il-2激动剂多肽包括残基f42n/f44t、a73t和/或n90t处的突变;其中所述突变是根据具有seq id no:1的氨基酸序列的人il-2的编号指代的。
[0151]
在一些实施例中,il-2前药的il-2激动剂多肽包括选自以下组合中的一个组合的突变:
[0152]
t3a、r38a、f42i、y45n、e62l、e68v、c125s;
[0153]
t3a、r38k、f42k、y45r、e62l、e68v、c125s;
[0154]
t3a、r38a、f42a、y45a、e62a、c125s;
[0155]
t3a、r38s、f42a、y45a、e62a、c125s;或
[0156]
r38s、f42a、y45a、e62a;并且
[0157]
其中所述突变是根据具有seq id no:1的氨基酸序列的人il-2的编号指代的。
[0158]
在一些实施例中,与野生型il-2相比,il-2激动剂多肽的结合亲和力是包括α、β和γ亚基的高亲和力三聚体il-2受体的结合亲和力的至多1/30;其中所述多肽包括r38、f42、y45、e62、e68和l72处的一个或多个突变;其中所述突变是根据具有seq id no:1的氨基酸序列的人il-2的编号指代的。在一些实施例中,il-2的激动剂多肽进一步包括根据具有seq id no:1的氨基酸序列的人il-2的编号在残基a3、d20、n88、c125和/或q126处的一个或多个突变。
[0159]
在一些实施例中,il-2激动剂肽包括选自seq id no:74和75的氨基酸序列。
[0160]
2.il-15激动剂多肽
[0161]
在一些实施例中,本公开的il-12前药进一步包括另一种细胞因子或效应子部分。在一些实施例中,第二细胞因子部分包括il-15激动剂多肽。在一些实施例中,il-15激动剂多肽可以任选地包括il-15受体α亚基的sushi结构域。
[0162]
在一些实施例中,il-15部分是包括人il-15的选自以下的位置处的至少1个、2个、3个、4个或5个突变的il-15突变蛋白:n1、n4、i6、s7、d8、k10、k11、e46、d61、t62、e64、n65、i68、l69、n72、v63、l66、i67、a70、n71、q108、n112。示例性il-15突变蛋白是具有选自以下的一个或多个突变的il-15突变蛋白:n1a、n1d、n4a、n4d、i6t、s7a、d8a、dat、d8e、d8n、k10a、k10d、k11a、k11d、d61a、d61n、t62l、t62a、e64a、e64l、e64k、e64q、n65a、n65l、n65d、l66d、l66e、i 67d、i67e、i68s、i68e、l69s、l69e、n72a、n72d、v63e、v63d、l66e、l66d、i67e、i67d、q108e和n112a。在一些实施例中,il-15部分包括选自以下的位置处的突变:e46、v49、l45、s51和l52。除非另有说明,本文所述的il-15和il-15突变蛋白中的所有残基编号均与seq id no:4中的编号一致。在其它实施例中,il-15部分包括与seq id no:4具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同源性的氨基酸序列。
[0163]
在特定实施例中,il-15突变蛋白含有选自以下的突变:n1d/d61n、n1d/e64q、n4d/d61n、n4d/e64q、d8n/d61n、d8n/e64q、d30n/e64q/n65d、d61n/e64q、e64q/q108e、n1d/n4d/d8n、d61n/e64q/n65d、n1d/d61n/e64q、n1d/d61n/e64q/q108e和n4d/d61n/e64q/q108e。
[0164]
在一些实施例中,本发明的il-15前药包括il-15rαsushi结构域。sushi结构域任选地通过接头(例如,不可切割的或可切割的肽接头)直接与载体或与il-15细胞因子部分融合。掩蔽部分可以通过可切割的或不可切割的肽接头与sushi结构域或与载体融合。在特定实施例中,sushi结构域与载体融合,并且细胞因子部分通过肽接头与sushi结构域融合。
[0165]
3.il-2/il-15掩蔽部分
[0166]
在一些实施例中,本文公开的另外的细胞因子部分的掩蔽部分包括il-2受体β亚基的可溶性胞外结构域的肽、单体或二聚体、il-2受体β和γ亚基融合蛋白或复合物的可溶性胞外结构域、或与il-2或il-15结合并干扰il-2、il-2突变蛋白或il-15与二聚体il-2受体结合的抗体。在一些实施例中,il-2掩蔽部分还抑制或降低il-2或il-15的生物活性。在一些实施例中,il-2掩蔽部分是通过筛选从肽库中鉴定的肽。在一些实施例中,il-2掩蔽部分是阻断il-2或il-2突变体与il-2受体结合的抗体或其片段。在一些实施例中,il-2掩蔽部分是scfv、fab或单链fab,所述单链fab具有与选自杂交瘤克隆4e12b2d10、4e12b2和4e12的抗体相同的cdr结构域序列。
[0167]
ii.il-12前药的实例
[0168]
在一些实施例中,il-12前药包括抗体或fc结构域以及il-12激动剂多肽;其中所
述il-12激动剂多肽任选地通过肽接头与抗体的一条重链或fc结构域的fc多肽链的c端融合;其中所述il-12掩蔽部分通过可切割的肽接头与第二重链或fc多肽链的c端融合。在图1a、图1b、图2a、图2b、图3a、图3b、图4a、图4b、图5a、图5b、图6a、图6b、图7a和图7b中展示了前药的实例。所有前药均示出具有细胞因子组分p35和p40以及位于fc结构域的c端上的掩蔽部分。在一些实施例中,细胞因子组分p35和p40以及掩蔽部分位于fc结构域的n端。此外,前药可以包括il-12和il-2激动剂多肽两者或il-12和il-15激动剂多肽两者。
[0169]
举例来说,il-12前药包括两条多肽链,其中所述第一多肽链包括与seq id no:20具有至少99%同源性的氨基酸序列;并且所述第二多肽链包括与选自seq id no:21-28的氨基酸序列具有至少99%同源性的氨基酸序列。
[0170]
通过另一个实例的方式,il-12前药包括两条多肽链,其中所述第一多肽链包括与seq id no:55具有至少99%同源性的氨基酸序列;并且所述第二多肽链包括与选自seq id no:56-59的氨基酸序列具有至少99%同源性的氨基酸序列。
[0171]
通过另一个实例的方式,il-12前药包括两条多肽链,其中所述第一多肽链包括与seq id no:60具有至少99%同源性的氨基酸序列;并且所述第二多肽链包括与选自seq id no:61-64的氨基酸序列具有至少99%同源性的氨基酸序列。
[0172]
通过另一个实例的方式,il-12前药包括两条多肽链,其中所述第一多肽链包括与seq id no:65具有至少99%同源性的氨基酸序列;并且所述第二多肽链包括与选自seq id no:66-73的氨基酸序列具有至少99%同源性的氨基酸序列。
[0173]
通过另一个实例的方式,il-12前药包括两条多肽链,其中所述第一多肽链包括与seq id no:20具有至少99%同源性的氨基酸序列;并且所述第二多肽链包括与选自seq id no:76-79的氨基酸序列具有至少99%同源性的氨基酸序列。
[0174]
在一些实施例中,在进一步包括第二细胞因子或效应子部分的前药中,所述第二细胞因子部分是il-2激动剂多肽,如具有选自seq id no:74和75的氨基酸序列的il-2激动剂多肽。举例来说,如在图1a-7b中所展示,所述第二细胞因子可以与fc结构域多肽中的一个的n端融合,而il-12激动剂多肽以及掩蔽部分与fc结构域的c端融合。在一些实施例中,il-12前药可以进一步包括一个或多个结合并抑制第二细胞因子的生物活性的掩蔽部分。
[0175]
iii.药物组合物
[0176]
前药的药物组合物以冻干制剂或水溶液的形式通过将本公开的前药、或具有期望纯度的抗体融合分子或抗体融合分子药物缀合物与一种或多种任选的药学上可接受的载体混合来制备(参见osol,a.编著.《雷明顿药物科学(remington's pharmaceutical sciences)》第16版(1980))。药学上可接受的载剂通常在所采用的剂量和浓度下对受体无毒并且包含但不限于:缓冲液,如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包含抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;氯化六烃季铵;苯扎氯铵;苄索氯铵;酚醇、丁醇或苯甲醇;烷基对羟苯甲酸酯,如甲基或丙基对羟苯甲酸酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;以及间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其它碳水化合物,包含葡萄糖、甘露糖或糊精;螯合剂,如edta;糖,如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐反离子,如钠;金属络合物(例如,zn-蛋白络合物);和/或非离子表面活性剂,如聚乙二醇(peg)。
[0177]
缓冲液用于将ph控制在优化治疗效果的范围内,尤其是在稳定性取决于ph的情况下。缓冲液优选地以范围为约50mm到约250mm的浓度存在。与本发明一起使用的合适缓冲液包含有机酸和无机酸及其盐,如柠檬酸盐、磷酸盐、琥珀酸盐、酒石酸盐、富马酸盐、葡糖酸盐、草酸盐、乳酸盐、乙酸盐。此外,缓冲液可以包括组氨酸和三甲胺盐,如tris。
[0178]
添加防腐剂以减缓微生物生长,并且通常以0.2%-1.0%(w/v)的范围存在。与本发明一起使用的合适的防腐剂包含:十八烷基二甲基苄基氯化铵;氯化六烃季铵;苄烷铵卤化物(例如氯化物、溴化物、碘化物)、苄索氯铵;硫柳汞、苯酚、丁醇或苯甲醇;烷基对羟苯甲酸酯,如甲基或丙基对羟苯甲酸酯;邻苯二酚;间苯二酚;环己醇、3-戊醇和间甲酚。
[0179]
张力剂,有时称为“稳定剂”,的存在用以调节或维持组合物中液体的张力。当与如蛋白质和抗体等大的带电的生物分子一起使用时,张力剂通常被称为“稳定剂”,因为其可以与氨基酸侧链的带电的基团相互作用,由此降低分子间和分子内相互作用的可能性。考虑到其它成分的相对量,张力剂可以以介于0.1重量%到25重量%之间或更优选地介于1重量%到5重量%之间的任何量存在。优选的张力剂包含多元糖醇,优选地三元或更高的糖醇,如甘油、赤藓糖醇、阿拉伯糖醇、木糖醇、山梨糖醇和甘露糖醇。
[0180]
存在非离子表面活性剂或去污剂(也称为“润湿剂”)以帮助溶解治疗剂并保护治疗性蛋白免受搅动诱导的聚集,这也允许调配物暴露于剪切表面应力而不会造成活性治疗性蛋白或抗体的变性。非离子表面活性剂存在的范围为约0.05mg/ml到约1.0mg/ml,优选地约0.07mg/ml到约0.2mg/ml。
[0181]
适合的非离子表面活性剂包含聚山梨酸酯(20、40、60、65、80等)、泊洛沙姆(184、188等)、多元醇、聚氧乙烯脱水山梨糖醇单醚(-20、-80等)、聚桂醇400、聚氧乙烯40硬脂酸酯、聚氧乙烯氢化蓖麻油10、50和60、单硬脂酸甘油酯、蔗糖脂肪酸酯、甲基纤维素和羧甲基纤维素。可以使用的阴离子去污剂包含月桂基硫酸钠、十六烷磺基琥珀酸钠和二辛基磺酸钠。阳离子去污剂包含苯扎氯铵或苄索氯铵。
[0182]
药物载体、赋形剂或稀释剂的选择可以根据预期施用途径和标准药物实践进行选择。药物组合物可以包括作为载体、赋形剂或稀释剂或除载体、赋形剂或稀释剂之外的任何合适的粘结剂、润滑剂、悬浮剂、涂层剂或增溶剂。
[0183]
根据不同的递送系统,可能有不同的组合物/调配物要求。举例来说,本发明中有用的药物组合物可以调配成使用微型泵或通过粘膜途径施用,例如作为用于吸入或可摄取溶液的鼻喷雾剂或气溶胶,或通过可注射的形式调配组合物以用于肠胃外递送,通过例如静脉内途径、肌肉内途径或皮下途径。可替代地,所述调配物可以设计为通过多种途径施用。在一些实施例中,所述调配物直接在一个或多个肿瘤中施用。
[0184]
在一些实施例中,抗体或蛋白质调配物是冻干制剂。在另一个实施例中,抗体或蛋白质调配物是水性制剂。
[0185]
在一些实施例中,药物组合物是组合药物组合物,所述组合药物组合物包括本公开的il-12前药、药学上可接受的赋形剂以及选自以下的第二活性成分:除il-12或其融合分子之外的细胞因子、抗pd-1的抗体、抗pd-l1的抗体、抗ctla-4的抗体、抗cd47的抗体、pd-1抗体-il-15融合分子、pd-1-il-2融合分子和pd-1-il-21融合分子。
[0186]
iv.治疗方法
[0187]
当前公开的前药可以用于治疗疾病,这取决于抗原结合结构域所结合的抗原。在一些实施例中,本文公开的前药用于治疗癌症。在一些实施例中,前药用于治疗感染,例如当药物分子是抗菌剂或抗病毒剂时。
[0188]
在一些实施例中,一种治疗受试者的疾病(如癌症、病毒感染或细菌感染)的方法包括向受试者施用有效量的当前公开的前药。
[0189]
在一些实施例中,癌症是实体瘤。在一些实施例中,癌症是血癌。可以治疗的示例性癌症包含但不限于白血病、淋巴瘤、肾癌、膀胱癌、泌尿道癌、宫颈癌、脑癌、头颈癌、皮肤癌、子宫癌、睾丸癌、食道癌、肝癌、结直肠癌、胃癌、鳞状细胞癌、前列腺癌、胰腺癌、肺癌、胆管癌、乳腺癌和卵巢癌。
[0190]
在一些实施例中,当前公开的前药用于治疗细菌感染,如败血症。在一些实施例中,引起细菌感染的细菌是耐药细菌。在一些实施例中,抗原结合部分与细菌抗原结合。
[0191]
在一些实施例中,前药用于治疗病毒感染。在一些实施例中,引起病毒感染的病毒是丙型肝炎(hcv)、乙型肝炎(hbv)、人免疫缺陷病毒(hiv)、人乳头状瘤病毒(hpv)。在一些实施例中,抗原结合部分与病毒抗原结合。
[0192]
通常,本发明的药物组合物的施用剂量和途径是根据标准药学实践根据受试者的体型和病状测定的。在一些实施例中,药物组合物通过任何途径施用于受试者,包含口服施用、经皮施用、通过吸入施用、静脉内施用、动脉内施用、肌肉内施用、直接应用到伤口部位、应用到外科手术部位、腹膜内施用、通过栓剂施用、皮下施用、皮内施用、经皮施用、通过雾化施用、胸膜内施用、心室内施用、关节内施用、眼内施用或脊柱内施用。在一些实施例中,将组合物静脉内施用于受试者。
[0193]
在一些实施例中,以单剂量或重复剂量向需要的受试者施用前药。在一些实施例中,所述剂量每天一次、每天两次、每天三次、或每天四次或更多次向受试者给予。在一些实施例中,一周内给予约1个或更多个(例如,约2个、3个、4个、5个、6个或7个或更多个)剂量。在一些实施例中,与药物缀合的抗体融合分子每周施用一次、每2周施用一次、每3周施用一次、每4周施用一次、3周中的两周每周施用一次或4周中的3周每周施用一次。在一些实施例中,在几天、几周、几个月或几年的过程中给予多剂量。在一些实施例中,一个疗程为约1个剂量或更多个剂量(如约2个剂量、3个剂量、4个剂量、5个剂量、7个剂量、10个剂量、15个剂量或20个剂量或更多个剂量)。
[0194]
在一些实施例中,il-12前药与第二药物组合物组合施用于受试者,其中所述第二药物组合物包括选自以下的活性成分:除il-12或其融合分子之外的细胞因子、抗pd-1的抗体、抗pd-l1的抗体、抗ctla-4的抗体、抗cd47的抗体、pd-1抗体-il-2融合分子、pd-1-il-7融合分子、pd-1抗体-il-15融合分子和pd-1-il-21融合分子。
[0195]
v.制备前药的方法
[0196]
当前公开的前药可以使用重组dna方法产生。对所述前药的多肽或融合多肽进行编码的核酸分子可以被分离并插入到一个或多个载体中以进一步克隆和/或在宿主细胞中表达。此类核酸分子可以使用常规方法容易地分离和测序。用于克隆或表达融合多肽载体的合适宿主细胞包含原核细胞或真核细胞。示例性宿主细胞包含中国仓鼠卵巢(cho)细胞或人胚胎肾细胞(例如,hek293)。
[0197]
表达宿主细胞表达抗体融合分子。在表达期之后,可以裂解宿主细胞,并且可以纯
化前药或抗体融合分子。示例性纯化方法包含液相色谱法,如离子交换色谱法、亲和色谱法(如蛋白a亲和层析法)或尺寸排阻色谱法。
[0198]
应当理解,尽管本说明书的各方面通过参考具体实施例来突出显示,但是本领域技术人员将容易理解,这些所公开的实施例仅说明本文公开的主题的原理。因此,应当理解,所公开的主题不旨在限于特定的化合物、组合物、制品或方法,除非明确说明。此外,本领域的普通技术人员将认识到,在不背离本说明书的精神的情况下,可以根据本文的教导进行某些改变、修改、置换、变更、添加、减去以及其子组合。
[0199]
除非本文另外定义,否则结合本公开使用的科学和技术术语应具有本领域的普通技术人员通常理解的含义。下文描述了示例性方法和材料,但是与本文所述的那些方法和材料类似或等同的方法和材料也可以用于本公开的实践或测试。在发生冲突的情况下,应以本说明书(包含定义)为准。通常,本文所述的与细胞和组织培养、分子生物学、免疫学、微生物学、遗传学、分析化学、合成有机化学、药用和药物化学以及蛋白质和核酸化学和杂交结合使用的术语表和技术是本领域众所周知和常用的术语表和技术。如本领域通常实现的或如本文所描述的来根据制造商的说明执行酶促反应和纯化技术。此外,除非上下文另外要求,否则单数术语应包含复数含义并且复数术语应包含单数含义。贯穿本说明书和实施例,词语“具有(have)”“包括(comprise)”或如“具有(has)”、“具有(having)”“包括(comprises)”或“包括(comprising)”等变体应当被理解为暗示包含所陈述整数或整数组,但不排除任何其它整数或整数组。应当理解,本文所述的本发明的方面和变体包含“由方面和变体组成”和/或“基本上由方面和变体组成”。本文提及的所有出版物和其它参考文献以全文引用的方式并入。尽管本文引用了许多文件,但此引用并不构成承认这些文件中的任何文件形成本领域公知常识的一部分。
[0200]
vi.示例性实施例
[0201]
下文描述了本公开的非限制性示例性实施例。
[0202]
1.一种il-12前药,其包括il-12p40亚基(p40)、il-12p35亚基(p35)、第一掩蔽部分(mm)、第二掩蔽部分、载体(c)和至少一个可切割的肽接头;其中:
[0203]
a.所述il-12亚基p40具有与seq id no:5至少95%同源性的氨基酸序列;
[0204]
b.所述il-12亚基p35具有与seq id no:6至少95%同源性的氨基酸序列;
[0205]
c.所述第一掩蔽部分包括与p40结合的结合部分,并且所述第二掩蔽部分包括与p35结合的结合部分;并且
[0206]
d.所述载体选自白蛋白或白蛋白片段、fc结构域和抗体。
[0207]
2.根据实施例1所述的前药,其中所述第一掩蔽部分选自il-12受体β1的胞外结构域(il-12rβ1ecd)或其片段、从肽库筛选中发现的p40结合肽以及与p40结合的抗体的单链fv或fab结构域。
[0208]
3.根据实施例1或2所述的前药,其中所述第二掩蔽部分选自il-12受体β2的胞外结构域(il-12rβ2ecd)或其片段、从肽库筛选中发现的p35或p40结合肽,以及与p35结合的抗体的scfv或fab结构域。
[0209]
4.根据实施例1到3中任一项所述的前药,其中所述第一掩蔽部分包括il-12受体β1(il-12rβ1)的胞外结构域(ecd)或其片段,其中所述il-12rβ1ecd包括与seq id no:13具有至少95%同源性的氨基酸序列。
[0210]
5.根据实施例1到3中任一项所述的前药,其中所述第一掩蔽部分包括il-12rβ1ecd的片段,其中所述片段包括与seq id no:14、15或16具有至少95%同源性的氨基酸序列。
[0211]
6.根据实施例1到3中任一项所述的前药,其中所述第二掩蔽部分包括il-12受体β2(il-12rβ2)的胞外结构域(ecd)或其片段,其中所述il-12rβ2ecd包括与seq id no:17具有至少95%同源性的氨基酸序列。
[0212]
7.根据实施例1到3中任一项所述的前药,其中所述第二掩蔽部分包括il-12rβ2ecd的片段,其中所述片段包括与seq id no:18或19具有至少95%同源性的氨基酸序列。
[0213]
8.根据实施例1到3中任一项所述的前药,其中所述第一掩蔽部分包括与p40结合的scfv,其中所述scfv包括任一与选自seq id no:7-11和12具有至少99%同源性的氨基酸序列。
[0214]
9.根据实施例1到3中任一项所述的前药,其中所述第一掩蔽部分选自以下:il-12rβ1ecd或其片段,所述il-12rβ1ecd或其片段包括选自seq id no:13-16的氨基酸序列;或具有选自seq id no:7-12的氨基酸序列的scfv;并且其中所述第二掩蔽部分包括il-12rβ2ecd或其片段,所述il-12rβ2ecd或其片段包括选自seq id no:17-19的氨基酸序列。
[0215]
10.根据实施例1到3中任一项所述的前药,其中所述第一掩蔽部分选自以下:il-12rβ1ecd或其片段,所述il-12rβ1ecd或其片段包括选自seq id no:13-16的氨基酸序列;或具有选自seq id no:7-12的氨基酸序列的scfv;并且其中所述第二掩蔽部分包括与p35结合的scfv。
[0216]
11.根据实施例1到10中任一项所述的前药,其中所述载体是可与在免疫细胞或癌细胞的表面上表达的靶标结合的抗体。
[0217]
12.根据实施例1到10中任一项所述的前药,其中其进一步包括另一细胞因子或效应子部分。
[0218]
13.根据实施例12所述的前药,其中所述细胞因子部分包括il-2激动剂多肽,所述il-2激动剂多肽包括选自seq id no:74和75的氨基酸序列。
[0219]
14.根据实施例1到10中任一项所述的前药,其中所述载体包括fc结构域,所述fc结构域包括第一多肽链f1和第二多肽链f2,其中所述f1和f2形成异二聚体;其中所述p40或其类似物任选地通过不可切割的肽接头与f1的c端融合,所述p35或其类似物通过不可切割的肽接头与p40的c端融合;并且其中所述第一掩蔽部分通过可切割的或不可切割的肽接头与f2的c端融合,并且所述第二掩蔽部分通过可切割的肽接头与所述第一掩蔽部分的c端融合。
[0220]
15.根据实施例1到10中任一项所述的前药,其中所述载体包括fc结构域,所述fc结构域包括第一多肽链f1和第二多肽链f2,其中所述f1和f2形成异二聚体;其中所述p40任选地通过不可切割的肽接头与f1的c端融合,并且所述第一掩蔽部分通过可切割的或不可切割的肽接头与p40的c端融合;并且其中所述p35与f2的c端融合,并且所述第二掩蔽部分通过可切割的肽接头与p35的c端融合。
[0221]
16.根据实施例1到10中任一项所述的前药,其中所述载体包括fc结构域,所述fc结构域包括第一多肽链f1和第二多肽链f2,其中所述f1和f2形成异二聚体;其中所述p35任选地通过不可切割的肽接头与f1的c端融合,并且所述第一掩蔽部分通过可切割的或不可
切割的肽接头与p35的c端融合;并且其中所述p40与f2的c端融合,并且所述第二掩蔽部分通过可切割的肽接头与p40的c端融合。
[0222]
17.根据实施例1到16中任一项所述的前药,其中所述不可切割的肽接头包括选自seq id no:29-33的氨基酸序列;其中所述可切割的肽接头包括选自seq id no:34-54的氨基酸序列。
[0223]
18.根据实施例1所述的前药,其包括两条多肽链,其中所述第一多肽链包括与选自seq id no:20具有至少99%同源性的氨基酸序列;并且所述第二多肽链包括任一与选自seq id no:21-28具有至少99%同源性的氨基酸序列。
[0224]
19.根据实施例1所述的前药,其包括两条多肽链,其中所述第一多肽链包括与seq id no:55至少99%同源性的氨基酸序列;并且所述第二多肽链包括任一与选自seq id no:56-59具有至少99%同源性的氨基酸序列。
[0225]
20.根据实施例1所述的前药,其包括两条多肽链,其中所述第一多肽链包括任一与选自seq id no:60具有至少99%相同的氨基酸序列;并且所述第二多肽链包括任一与选自seq id no:61-64具有至少99%同源性的氨基酸序列。
[0226]
21.根据实施例1所述的前药,其包括两条多肽链,其中所述第一多肽链包括与seq id no:65具有至少99%同源性的氨基酸序列;并且所述第二多肽链包括任一与选自seq id no:66-73具有至少99%同源性的氨基酸序列。
[0227]
22.一种药物组合物,其包括根据实施例1到21中任一项所述的前药以及药学上可接受的赋形剂。
[0228]
23.一种多核苷酸,其编码实施例1到22中任一项所述的前药。
[0229]
24.一种表达载体,其包括实施例23所述的多核苷酸。
[0230]
25.一种宿主细胞,其包括实施例24所述的载体。
[0231]
26.根据实施例25所述的宿主细胞,其中所述宿主细胞中编码upa、mmp-2、mmp-9和/或蛋白裂解酶的基因被敲除。
[0232]
27.一种制备根据实施例1到21中任一项所述的前药的方法,所述方法包括在允许表达所述抗原结合分子的条件下培养根据实施例25或26所述的宿主细胞以及分离所述抗原结合分子。
[0233]
28.一种治疗有需要的患者的癌症或传染病或刺激所述患者的免疫系统的方法,所述方法包括施用根据实施例22所述的药物组合物。
[0234]
29.一种前药在根据实施例28所述的方法中治疗癌症或传染病或刺激所述免疫系统中的应用。
[0235]
30.根据实施例28所述的方法,其中所述癌症选自由以下组成的组:乳腺癌、肺癌、胰腺癌、食道癌、甲状腺髓样癌、卵巢癌、子宫癌、前列腺癌、睾丸癌、结直肠癌和胃癌。
[0236]
31.一种治疗患有癌症的患者的方法,所述方法包括将根据实施例22所述的药物组合物直接施用于肿瘤中。
[0237]
为了更好地理解本发明,阐述以下实例。这些实例仅出于说明目的并且不应被解释为以任何方式限制本发明的范围。
[0238]
实例
[0239]
实例1:使用hek293细胞瞬时转染il-12前药
[0240]
使用pei(聚乙烯亚胺)以大约2.5μg/ml将表达质粒共转染到大约4
×
106个细胞/ml的自由式hek293细胞中。对于基于fc的il-12前药,fc-il-12融合多肽与fc掩蔽部分融合多肽的比率为1:2。转染后6天,以9,000rpm离心持续45分钟,随后进行0.22μm过滤,采集细胞培养物。表达了许多il-12前药。表2中列出了序列号。
[0241]
表2.样品的序列信息。
[0242]
前药或对照品名称fc-il-12融合多肽的序列号fc掩蔽部分融合多肽的序列号jr3.105.2seq id no:20seq id no:76jr3.105.3seq id no:20seq id no:77jr3.105.4seq id no:20seq id no:78jr3.105.5seq id no:20seq id no:79
[0243]
实例2:基于fc的il-12前药的纯化
[0244]
基于fc的il-12前药的蛋白质的纯化通过使用蛋白a亲和层析进行。简而言之,将瞬时表达细胞培养物的上清液装载到蛋白a柱上,在施加样品之前,用ph为7.8的25mm tris-hcl、30mm nacl(缓冲液a)平衡所述蛋白a柱。用5柱体积的缓冲液a洗涤柱,并用ph为3.6的50mm乙酸洗脱结合蛋白。使用1m tris碱将经洗脱的蛋白质的ph调节至大约5.2。如下所述,通过sds-page进行分析样品。
[0245]
实例3:sds-page分析
[0246]
将10μl的10-20μg的经纯化的蛋白样品与具有或不具有还原试剂的bolt
tm lds样品缓冲液(诺威克公司(novex))混合。将样品在70℃下加热持续3分钟,并且然后将其加载到nupage
tm 4-12%的bistris凝胶(invitrogen
tm
)中。将凝胶在nupage
tm mops sds运行缓冲液(invitrogen
tm
)中以200伏特运行持续40分钟,并且然后用考马斯染色。通过sds-page分析对前药的经纯化的样品进行分析,如在图8a中示出的。也通过sds-page分析对用蛋白酶mmp-2处理(见下文)的jr3.105.5(结构如在图5b中所展示的)样品进行分析,如在图8b中示出的。数据表明,前药的掩蔽部分通过蛋白酶消化被大量去除,并且经激活的分子以预期的分子量迁移。此外,蛋白a柱池样品似乎还含有il-12前药的经激活版本(图8b)。
[0247]
实例4:蛋白水解处理
[0248]
蛋白酶、人mmp2、人mmp9、小鼠mmp2和小鼠mmp9购自r&d系统公司(r&d systems)。通过将10μg-50μg的前药与1μg的人mmp2、人mmp9、小鼠mmp2或小鼠mmp9在含有2mm cacl2和10μm zncl2的hbs缓冲液(20mm hepes,150mm nacl2,ph 7.4)中在37℃下温育持续12小时进行蛋白酶消化。通过sds-page(图8b)和基于细胞的活性测定(见下文)分析消化前后的前药jr3.105.5。
[0249]
实例5:基于细胞的il-12报告基因测定
[0250]
使用分泌型碱性磷酸酶报告基因细胞系(hek blue il-12,invivogen目录号hkb-il12)测定激活前后il-12前药的生物活性。通过将人il-12受体和信号转导通路的基因稳定引入到hek 293细胞中产生hek-蓝il-12细胞系。所述细胞还表达stat4诱导分泌型碱性磷酸酶(seap)报告基因。将测试制品在96孔平底细胞培养板中的100μl/孔的培养基中稀释,随后在100μl中以50,000个细胞/孔添加hek-蓝il-12细胞。将培养物在37℃下温育过夜。将20μl的培养上清液转移到elisa板,并且添加180μl quanti-blue(invivogen,目录号rep-qb1)。将elisa板在37℃下温育持续1小时,并用酶标仪测量od
630
。数据示出于图9和图
10中。结果示出,基于ec
50
值,jr3.105.5的活性大约是jr3.105.5clv(activated)的18倍(图10)。如在图8b中示出,il-12前药jr3.105.5样品可能含有少量的前药激活版本。因此,jr3.105.5的掩蔽部分的掩蔽效率可能比图9和10中示出的掩蔽效率要强。
[0251]
与其它样品相比,此il-12前药jr3.105.5的激活也最高。il-12前药全部具有相同的fc-il-12链(seq id no:20,表2)。然而,jr3.105.5的掩蔽部分在其vl和vh之间具有最长的接头,包括(g4s)4,如seq id no:80所示的。
[0252]
实例6:使用小鼠肿瘤模型的体内功效研究
[0253]
在小鼠模型中测试了本发明的il-12-fc前药的体内抗肿瘤效应。向nod scidγ(nsg)小鼠的右胁腹皮内植入3
×
106个pp-65表达性mcf-7细胞。肿瘤建立后,向小鼠腹膜内植入1.5
×
106个人pbmc。然后每周两次、每周或两周一次用il-12前药处理小鼠。每隔一天测量一次肿瘤体积和体重。在研究结束时处死小鼠,并分析血液样品、血清样品和组织(包含肝和肺的肿瘤和主要器官)的pk、安全性、细胞因子释放和前药激活。
[0254]
提供上述非限制性实例仅用于说明目的,以便促进对所公开主题的更完整理解。这些实例不应被解释为限制本说明书中描述的任何实施例,包含与抗体、药物组合物或用于治疗癌症、神经退行性病变或传染病的方法和用途有关的实施例。
[0255]
序列表
[0256]
seq id no:1-人il-2:
[0257][0258]
seq id no:2-人il-2受体β亚基胞外结构域(https://www.uniprot.org/uniprot/p14784)
[0259][0260]
seq id no:3-il-15受体α亚基sushi结构域
[0261]
itcpppmsve hadiwvksys lysreryicn sgfkrkagts sltecvlnka tnvahwttps lkcirdpalv hqrpapp
[0262]
seq id no 4-人il15
[0263][0264]
seq id no:5-人il-12p40亚基
[0265][0266]
seq id no:6-人il-12p35亚基
[0267][0268]
seq id no:7-与il-12结合的scfv
[0269][0270]
seq id no:8-与il-12结合的scfv
[0271][0272]
seq id no:9-与il-12结合的scfv
[0273][0274]
seq id no:10-与il-12结合的scfv
[0275][0276]
seq id no:11-与il-12结合的scfv
[0277][0278]
seq id no:12-与il-12结合的scfv
[0279][0280]
seq id no:13-il-12受体β1胞外结构域(il-12rβ1ecd)
[0281][0282]
seq id no:14-il-12rβ1 ecd d1-d5
[0283][0284]
seq id no:15-il-12rβ1 ecd d1-d2
[0285][0286]
seq id no:16-il-12rβ1 ecd d1-d3
[0287][0288]
seq id no:17-il-12rβ2 ecd d1-d6
[0289][0290]
seq id no:18-il-12rβ2ecd d1-d2
[0291][0292]
seq id no:19-il-12rβ2ecd d1-d3
[0293][0294]
seq id no:20-具有杵突变的fc-il-12(p40-p35)
[0295][0296]
seq id no:21-具有臼突变的fc-il-12rβ1-d1d2/il-12rβ2-d1d2
[0297][0298]
其中n1=1、2、3或4,并且n2=1、2、3或4。
[0299]
seq id no:22-具有臼突变的fc il-12rβ1-d1d2d3/il-12rβ2-d1d2d3
[0300][0301]
n1=1、2、3或4,并且n2=1、2、3或4。
[0302]
seq id no:23-具有臼突变的fc-il-12rβ1-d1d2/il-12rβ2-d1d2
[0303][0304]
其中n1=1、2、3或4,并且n2=1、2、3或4。
[0305]
seq id no:24-具有臼突变的fc il-12rβ1-d1d2d3/il-12rβ2-d1d2d3
[0306][0307]
;n1=1、2、3或4,并且n2=1、2、3或4。
[0308]
seq id no:25-具有臼突变的fc scfv/il-12rβ2-d1d2d3
[0309][0310]
;n1=1、2、3或4,并且n2=1、2、3或4。
[0311]
seq id no:26-具有臼突变的fc scfv/il-12rβ2-d1d2d3
[0312][0313]
;n1=1、2、3或4,并且n2=1、2、3或4。
[0314]
seq id no:27-具有臼突变的fc scfv/il-12rβ2-d1d2d3
[0315][0316]
;n1=1、2、3或4,并且n2=1、2、3或4。
[0317]
seq id no:28-具有臼突变的fc scfv/il-12rβ2-d1d2d3
[0318][0319]
;n1=1、2、3或4,并且n2=1、2、3或4。
[0320]
seq id no:29-33肽接头
[0321]
ggggs(seq id no:29)
[0322]
ggggsggggs(seq id no:30)
[0323]
ggggsggggs ggggs(seq id no:31)
[0324]
ggggsggggx ggggsggggs(seq id no:32),x=a或n
[0325]
(ggggsggggx
1 ggggx2ggggs)n(seq id no:33),x1=s、a或n,x2=a或n,并且n=1、2或3。
[0326]
seq id no:34-可切割的肽接头
[0327]
ggslsgrsdn hggggs
[0328]
seq id no:35-可切割的肽接头
[0329]
ggslsgrsdn hgs
[0330]
seq id no:36-可切割的接头
[0331]
ggggsggggs ggggsissgl lssggsggsl sgrsdnhggg gs
[0332]
seq id no:37-43-mmp-2/mmp-9可切割的肽接头
[0333]
gplgvr(seq id no:37)
[0334]
plgmwsr(seq id no:38)
[0335]
plglwar(seq id no:39)
[0336]
pqgiagqr(seq id no:40)
[0337]
plglag(seq id no:41)
[0338]
lalgpr(seq id no:42)
[0339]
ggplgmlsqs(seq id no:43)
[0340]
seq id no:44-52-尿激酶纤溶酶原激活剂(upa)可切割的肽接头
[0341]
ggggrrggs(seq id no:44)
[0342]
tgrgpswv(seq id no:45)
[0343]
sargpsrw(seq id no:46)
[0344]
targpsfk(seq id no:47)
[0345]
targpsw(seq id no:48)
[0346]
ggwhtgrn(seq id no:49)
[0347]
htgrsgal(seq id no:50)
[0348]
pltgrsgg(seq id no:51)
[0349]
ltgrsga(seq id no:52)
[0350]
seq id no:53-蛋白裂解酶可切割的肽接头
[0351]
rqarvvng(seq id no:53)
[0352]
seq id no:54-蛋白裂解酶-mmp2/9双可切割的肽接头
[0353]
vhmplgflgp rqarvvng(seq id no:54)
[0354]
seq id no:55-具有臼突变的fc-il-12p35-接头-il-12rβ2片段
[0355]
;n1=1、2、3或4,并且n2=1、2、3或4。
[0356]
seq id no:56-具有杵突变的fc-il-12p40-不可切割的接头-il-12rβ1片段
[0357]
seq id no:57-具有杵突变的fc-il-12p40-可切割的接头-il-12rβ1片段
[0358]
seq id no:58-具有杵突变的fc-il-12p40-可切割的接头-scfv
[0359][0360]
seq id no:59-具有杵突变的fc-il-12p40-可切割的接头-scfv
[0361][0362]
seq id no:60-具有臼突变的fc-il-12p40-接头-il-12rβ2片段
[0363]
n1=1、2、3或4,并且n2=1、2、3或4。
[0364]
seq id no:61-具有杵突变的fc-il-12p35-不可切割的接头-il-12rβ1片段
[0365]
seq id no:62-具有杵突变的fc-il-12p35-可切割的接头-il-12rβ1片段
[0366]
seq id no:63-具有杵突变的fc-il-12p35-可切割的接头-scfv
[0367][0368]
seq id no:64-具有杵突变的fc-il-12p35-可切割的接头-scfv
[0369][0370]
seq id no:65-具有杵突变的fc-il-12(p35-p40)
[0371][0372]
其中n1=2、3、4或5;并且其中n2=2、3、4或5。
[0373]
seq id no:66-具有臼突变的fc-il-12rβ2-d1d2/il-12rβ1-d1d2
[0374][0375]
其中n1=1、2、3或4,并且n2=1、2、3或4。
[0376]
seq id no:67-具有臼突变的fc il-12rβ2-d1d2d3/il-12rβ1-d1d2d3
[0377][0378]
n1=1、2、3或4,并且n2=1、2、3或4。
[0379]
seq id no:68-具有臼突变的fc-il-12rβ2-d1d2/il-12rβ1-d1d2
[0380][0381]
其中n1=1、2、3或4,并且n2=1、2、3或4。
[0382]
seq id no:69-具有臼突变的fc il-12rβ2-d1d2d3/il-12rβ1-d1d2d3
[0383][0384]
n1=1、2、3或4,并且n2=1、2、3或4。
[0385]
seq id no:70-具有臼突变的fc il-12rβ2-d1d2d3/scfv
[0386][0387]
n1=1、2、3或4,并且n2=1、2、3或4。
[0388]
seq id no:71-具有臼突变的fc il-12rβ2-dld2d3/scfv
[0389][0390]
;n1=1、2、3或4,并且n2=1、2、3或4。
[0391]
seq id no:72-具有臼突变的fc il-12rβ2-d1d2d3 scfv
[0392][0393]
n1=1、2、3或4,并且n2=1、2、3或4。
[0394]
seq id no:73-具有臼突变的fc il-12rβ2-d2d2d3/scfv
[0395][0396]
n1=1、2、3或4,并且n2=1、2、3或4。
[0397]
seq id no:74-il-2激动剂多肽
[0398]
apx
aa3
ssstkkt qlqlehlll x
aa20 lqmilnginn yknpkltrml tx
aa42
kfx
aa45
mpkka telkhlqcle eelkpleevl nx
aa72
x
aa73
qsknfhl rprdlisx
aa88
ix
aa90 vivlelkgse ttfmceyade tativeflnr witfx
aa125
x
aa126
siis tlt
[0399]
其中x
aa3
是n或a;其中x
aa125
是c或s;其中x
aa20
选自d、h、k、l、m、n、q、r、s、v和y;其中x
aa42
选自a、g、s、t、q、e、n、d、r和k;其中x
aa45
选自a、g、s、t、q、e、n、d、r和k;其中x
aa72
选自a、g、s、t、q、e、n、d、r和k;其中x
aa73
是a;其中x
aa88
选自n、a、e、f、h、k、l、m、s、t、v、w和y;其中x
aa90
是n或t;并且其中x
aa126
选自a、d、f、g、h、i、k、l、p、s、t、w和y;并且其中x
aa20
、x
aa88
、x
aa90
和x
aa126
中的至少一个是突变的。
[0400]
seq id no:75-il-2激动剂多肽
[0401]
apx
aa3
ssstkkt qlqlehlll x
aa20 lqmilnginn yknpkltx
aa38
ml tx
aa42
kfx
aa45
mpkka telkhlqcle ex
aa62
lkplex
aa68
vl nlx
aa73
qsknfhl rprdlisx
aa88
ix
aa90 vivlelkgse ttfmceyade tativeflnr witfx
aa125
x
aa126
siis tlt
[0402]
其中x
aa3
是n或a;其中x
aa125
是c或s;其中x
aa20
选自d、h、k、l、m、n、q、r、s、v和y;其中x
aa38
选自a、k和s;其中x
aa42
选自a、g、i、s、t、q、e、n、d、r和k;其中x
aa45
选自a、g、s、t、q、e、n、d、r和k;其中x
aa62
选自e、l、a和i;其中x
aa68
是e或v;其中x
aa73
是a或t;其中x
aa88
选自n、a、e、f、h、k、l、m、s、t、v、w和y;其中x
aa90
是n或t;并且其中x
aa126
选自a、d、f、g、h、i、k、l、p、s、t、w和y;并且其中xaa20、x
aa88
、x
aa90
和x
aa126
中的至少一个是突变的。
[0403]
seq id no:76-可与il-12-vh-vl-2接头结合的scfv
[0404][0405]
seq id no:77-可与il-12-vh-vl-3接头结合的scfv
[0406][0407]
seq id no:78可-与il-12-vl-vh-3接头结合的scfv
[0408]
[0409]
seq id no:79-可与il-12-vl-vh-4接头结合的scfv
[0410][0411]
seq id no:80-g4s4接头
[0412]
ggggsggggs ggggsggggs
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。