1.本发明涉及医用材料领域,特别涉及一种载药纳米纤维、基于该载药纳米纤维的医用埋线材料,及其制备方法和作为针灸穴位用可缓释腺苷a1受体激动剂的复合型埋线材料在镇痛治疗中的应用。
背景技术:
2.日间手术是未来主要的手术形式。与其它手术类似,术后疼痛是手术后最常见的症状之一。术后急性疼痛发生率为91.8%,其中约86%手术患者经历了中度、重度或极重度的疼痛。日间手术后疼痛的处理与住院手术后疼痛的治疗有明显不同。日间手术患者术后24小时内出院回家,如果以阿片类药物为主镇痛,出现呼吸抑制、瘙痒、恶心呕吐、尿潴留等,会带来生命危险和再入院;以非甾体类抗炎药(nsaids)为主,会出现镇痛强度不够等问题。随着日间手术的日益普及,传统的术后镇痛措施已不能完全满足日间手术患者术后镇痛需求,迫切需要寻找新的镇痛药物和镇痛方法。
3.针刺镇痛疗效确切且安全。但传统的针灸治疗方法如手针、电针等疗效维持时间短,后效应欠佳,至少需每日进行一次针刺,很难用于术后24小时内已出院回家的日间手术病人。人们尝试用穴位埋线来解决这个问题,穴位埋线虽具有长效刺激效应,但缺乏手针/电针样的间歇性强刺激。有研究表明针灸加穴位埋线/穴位注射具有协同增效作用,能更好地缓解术后疼痛,但这种联合针灸的方法同样具有手针/电针镇痛需每日进行一次针刺的问题。因此,探寻针刺镇痛起效的关键物质,通过调控穴位类针刺样镇痛物质的释放以更简便地实现优效和长效化镇痛是针刺作用原理研究和针灸临床实践中的共性关键问题。
4.研究表明,腺苷是针刺镇痛起效的关键物质,且主要通过腺苷a1受体发挥镇痛效应,这为棘手的疼痛治疗及针刺镇痛研究提供了新的方向。并且外周或中枢给予腺苷a1受体激动剂(腺苷、cpa和ccpa等)均可产生较好的镇痛效果。但全身性给予腺苷a1受体激动剂具有一定的心血管副作用。
5.因此,亟需研发一种针灸穴位用的可缓释腺苷a1受体激动剂的复合型埋线材料,模拟针刺加穴位埋线的复合镇痛效应,以发挥协同增效作用,增强腺苷a1受体和穴位的镇痛效应,实现较为长时的穴位刺激,从而实现优效和长效化镇痛,解决日间手术病人出院回家后镇痛有效性和安全性难题。
技术实现要素:
6.本发明的首要目的在于:提供针灸穴位用可缓释腺苷a1受体激动剂的埋线材料,能够缓慢释放腺苷a1受体激动剂,从而达到长效治疗的目的。
7.本发明的另一个目的在于:提供制备所述埋线材料的方法,能够获得多层同轴结构的纳米纤维,可有效提高埋线材料的载药量,同时使埋线材料具有优良的药物缓释性。
8.本发明的再一个目的在于:提供所述的埋线材料在镇痛治疗中的应用。
9.本发明的上述目的通过以下技术方案实现:
10.首先,提供一种载药纳米纤维,具有多层同轴结构,所述的多层同轴结构由外到内至少包括壳层、中间层和芯层;所述的中间层和芯层均为载药层,每个载药层的材料均为腺苷a1受体激动剂和可生物降解材料的混合物;所述的壳层的材料为可生物降解材料。
11.本发明优选的载药纳米纤维中,所述的中间层和芯层中腺苷a1受体激动剂所占重量比为8.5%-57%;优选21.5%-57%;最优选57%。
12.本发明的载药纳米纤维中,所述的腺苷a1受体激动剂可以是非选择性腺苷a1受体激动剂或选择性腺苷a1受体激动剂。所述的非选择性腺苷a1受体激动剂可以选自腺苷或5-n-乙基羧基酰胺腺苷(neca);所述的选择性腺苷a1受体激动剂可以选自以下任意一种或两种以上的组合物或其衍生物:2-氯腺苷、2-氯-n(6)-环戊基腺苷(ccpa)、n6-环戊基腺苷(cpa)、n6-环己基腺苷(cha)、替卡地松(tecadenoson,cvt-510)、安斯泰来的dti-009、neladenoson bialanate、卡帕诺生、gw493838、gr79236、n-环己基-2'-o-甲基腺苷(sdz wag994)、2-氯腺嘌呤核苷、n-双环[2.2.1]hept-2-yl-5
′‑
氯-5
′‑
脱氧腺苷、甲基-2-氯-n6-环戊基腺苷(2-meccpa)、n6-(r)-苯基异丙基腺苷(r-pia)、(2s)-n6-[2-endo-norbornyl]腺苷、cvt-3619(gs-9667)、amp579或2-氯-n-[(r)-[(2-苯并噻唑)硫]-2-丙基]腺苷(nnc 21-0136)。本发明优选的所述载药纳米纤维中,所述的腺苷a1受体激动剂为腺苷。
[0013]
本发明的载药纳米纤维中,所述的可生物降解材料可以是现有的多种可生物降解的高分子材料,具体可以选自:聚乳酸(pla)、聚氨酯(pu)、聚己内酯(pcl)、聚β-羟基丁酸脂(phb)、壳聚糖(cs)或丝素蛋白(sf)中的任意一种或多种的组合物。本发明优选的所述载药纳米纤维中,所述的可生物降解材料优选聚乳酸(pla)。
[0014]
本发明优选的所述载药纳米纤维中,所述的多层同轴结构是通过多层同轴静电纺丝的方法制备形成的。
[0015]
本发明最优选的一种实施方式中,所述的载药纳米纤维具有三层同轴结构,所述的三层同轴结构由外到内分别是壳层、中间层和芯层;所述的中间层和芯层均为载药层,每个所述载药层的材料均为腺苷和聚乳酸的混合物;所述的壳层材料为聚乳酸。
[0016]
基于所述的载药纳米纤维,本发明进一步提供一种可缓释腺苷a1受体激动剂的医用埋线材料,它是由无数条本发明所述的载药纳米纤维构成的毫米级线状材料。
[0017]
所述的埋线的直径为0.1-0.5mm;优选0.4mm。
[0018]
所述的埋线的长短为0.1-5cm;优选0.5-2cm。
[0019]
此外,本发明还提供制备所述的载药纳米纤维的方法,包括:将溶有可生物降解材料的溶液和溶有腺苷a1受体激动剂的溶液按预定比例混合得到载药层电纺液;以单独的溶有可生物降解材料的溶液为壳层电纺液;采用多层同轴静电纺丝设备,将所述壳层电纺液推入纺丝喷头最外层,同时将所述的载药层电纺液分别推入纺丝喷头其他各层,通过多层同轴静电纺丝制备得到具有多层同轴结构的载药纳米纤维。
[0020]
本发明所述的制备载药纳米纤维的方法中,所述的多层同轴静电纺丝设备是喷丝头或纺丝喷头至少包括三层的同轴静电纺丝设备,具体讲,是指喷丝头或纺丝喷头由至少三个不同直径的管状套件依次套接在一起组成的同轴静电纺丝设备。使用时,将所述的壳层电纺液通过推注设备注入所述喷丝头或纺丝喷头最外层的管状套件内,同时将所述的载药层电纺液分别通过不同的推注设喷丝头或纺丝喷头其他管状套件内,由此在喷丝头或纺
丝喷头出口处会喷出至少三层的多层同轴结构纳米纤维。
[0021]
本发明所述的制备所述载药纳米纤维的方法中,所述的可生物降解材料选自:聚乳酸(pla)、聚氨酯(pu)、聚己内酯(pcl)、聚β-羟基丁酸脂(phb)、壳聚糖(cs)或丝素蛋白(sf)中的任意一种或多种的组合物;优选聚乳酸(pla)。
[0022]
本发明所述的制备所述载药纳米纤维的方法中,所述的腺苷a1受体激动剂可以是非选择性腺苷a1受体激动剂或选择性腺苷a1受体激动剂。所述的非选择性腺苷a1受体激动剂可以选自腺苷或5-n-乙基羧基酰胺腺苷(neca);所述的选择性腺苷a1受体激动剂可以选自以下任意一种或两种以上的组合物或其衍生物:2-氯腺苷、2-氯-n(6)-环戊基腺苷(ccpa)、n6-环戊基腺苷(cpa)、n6-环己基腺苷(cha)、替卡地松(tecadenoson,cvt-510)、安斯泰来的dti-009、neladenoson bialanate、卡帕诺生、gw493838、gr79236、n-cyclohexyl-2
′‑
o-methyladenosine(sdz wag994)、2-氯腺嘌呤核苷、n-双环[2.2.1]hept-2-yl-5
′‑
氯-5
′‑
脱氧腺苷、甲基-2-氯-n6-环戊基腺苷(2-meccpa)、n6-(r)-苯基异丙基腺苷(r-pia)、(2s)-n6-[2-endo-norbornyl]腺苷、cvt-3619(gs-9667)、amp579或2-氯-n-[(r)-[(2-苯并噻唑)硫]-2-丙基]腺苷(nnc 21-0136)。本发明优选的制备所述载药纳米纤维的方法中,所述的腺苷a1受体激动剂为腺苷。
[0023]
本发明所述的制备载药纳米纤维的方法中,所述的溶有可生物降解材料的溶液是将所述的可生物降解材料溶于有机溶剂得到的溶液,可用于溶解所述可生物降解材料的有机溶剂可以选自丙酮、二氯甲烷、三氯甲烷或四氢呋喃中的任意一种;优选丙酮。所述的溶有腺苷a1受体激动剂的溶液是将所述的腺苷a1受体激动剂溶于溶剂得到的溶液,可用于溶解所述腺苷a1受体激动剂的溶剂可以选自二甲基亚砜(dmso)、蒸馏水、生理盐水或甲醇中的任意一种;优选二甲基亚砜(dmso)。
[0024]
本发明优选的制备所述载药纳米纤维的方法中,所述的壳层电纺液中可生物降解材料的质量分数为8%-12%,最佳为10%。
[0025]
本发明优选的制备所述载药纳米纤维的方法中,所述的载药层电纺液中可生物降解材料的质量分数为4.6%-10.5%,优选为7.2%;所述的载药层电纺液中腺苷a1受体激动剂的质量分数为0.3%-10.1%,优选为5.5%。
[0026]
本发明优选的实施方案中,制备所述载药纳米纤维的方法具体包括以下步骤:
[0027]
1)制备溶有可生物降解材料的溶液:将可生物降解高分子材料溶解于丙酮、二氯甲烷、三氯甲烷或四氢呋喃中得到所述的溶有可生物降解材料的溶液,记作溶液a,优选将聚乳酸溶于丙酮中,在70℃下搅拌均匀,得到溶有聚乳酸的丙酮溶液;
[0028]
2)制备溶有腺苷a1受体激动剂的溶液:将腺苷a1受体激动剂溶解于二甲基亚砜(dmso)、蒸馏水、生理盐水或甲醇中,得到溶有腺苷a1受体激动剂的溶液,记作溶液b;优选将腺苷溶于二甲基亚砜(dmso)中,室温下搅拌均匀,得到溶有腺苷的二甲基亚砜溶液;
[0029]
3)将1)所得的溶液a与2)所得的溶液b混合,得到载药层电纺液;
[0030]
4)使用多层同轴静电纺丝设备进行静电纺丝,将1)得到的溶液a注入所述多层同轴静电纺丝设备的喷丝头的最外层,同时将3)得到的载药层电纺液分别注入所述多层同轴静电纺丝设备的喷丝头的其他层,通过同轴静电纺丝,并由接收装置承接,得到多层同轴的载药纳米纤维。
[0031]
发明人经实验发现,本发明所述的制备载药纳米纤维的方法中,当溶液a中可生物
降解材料的浓度过高时,会导致溶液粘度过高,纺丝针头易堵塞,无法顺利纺丝,而过低时会使得纺丝液粘度不够,无法形成连续的纳米纤维。当溶液b中腺苷a1受体激动剂的浓度过高时,在步骤3)的混合过程中,溶液b的溶质会受到溶液组成变化的影响而出现析出现象,不仅影响静电纺丝流畅性,也会明显对纳米纤维成品的载药量产生不利影响;而过低时也会使得载药量降低,导致缓释效果差。因此,为了获得均匀的纺丝纤维,延长缓释效果,需要对所述溶液a中可生物降解材料的浓度和溶液b中腺苷a1受体激动剂的浓度进行合理的控制。
[0032]
本发明进一步优选的方案中,按重量百分比计,控制步骤1)所述的溶液a中可生物降解高分子材料的浓度在8%-12%,最优选为10%。
[0033]
本发明进一步优选的方案中,控制步骤2)所述的溶液b的腺苷a1受体激动剂的浓度在26.7-347.4mg/ml,最优选为267.2-347.4mg/ml。
[0034]
本发明进一步优选的方案中,控制步骤3)所述的溶液a与溶液b混合的体积比为7:3-9:1,最优选的体积为8:2。
[0035]
本发明进一步优选的方案中,控制步骤4)所述的喷丝头的各层的溶液注入速度为1.1mm/min,静电纺丝电压为8kv,喷丝头出口与接收装置之间的距离为15cm。
[0036]
本发明还提供制备所述医用埋线材料的方法,包括:将本发明所述的载药纳米纤维无序叠加形成载药纳米纤维膜,然后再将所述的载药纳米纤维膜卷积形成预设规格的毫米级线状材料。
[0037]
本发明还提供所述载药纳米纤维或所述医用埋线材料在制备用于镇痛的医用材料中的应用。
[0038]
所述的用于镇痛的医用材料优选是针灸穴位用的递送腺苷a1受体激动剂的埋线。
[0039]
本发明还提供一种用于缓解个体急性或慢性疼痛的长效镇痛方法,是在个体外周局部通过埋线方式模拟针刺刺激,具体是将本发明所述的可缓释腺苷a1受体激动剂的医用埋线材料在个体外周局部以常规方式施用,利用所述的医用埋线材料在个体外周局部持续缓慢释放腺苷a1受体激动剂,激活局部的腺苷a1受体,从而达到长期的类针刺样镇痛效果。
[0040]
本发明所述的长效镇痛方法中,所述的个体可以是人类个体,也可以是哺乳动物个体,优选人类个体或大鼠个体。
[0041]
本发明优选的所述长效镇痛方法中,所述的机体外周局部是体表的各个穴位,即脏腑经络之气输注出入的特殊部位,既是疾病的反应点,又是针灸临床的刺激点。
[0042]
本发明所述的长效镇痛方法中,所述的埋线材料的施用可以利用一次性埋线针、皮下注射口递送系统或导管等器械完成。
[0043]
本发明所述的长效镇痛方法中,所述的持续缓慢释放腺苷a1受体激动剂,优选是所述的医用埋线材料在个体外周局部提供不少于12小时的腺苷a1受体激动剂的持续释放,更优选提供不少于24小时的持续释放,进一步优选提供不少于36小时的持续释放,更进一步优选提供不少于48小时的持续释放,再进一步优选提供不少于60小时、不少于72小时、不少于84小时、不少于96小时、不少于108小时、不少于120小时、不少于132小时、不少于144小时、不少于156小时或不少于168小时的腺苷a1受体激动剂药物的持续释放。
[0044]
与现有技术相比,本发明的有益效果是:
[0045]
(1)本发明提供了一种治疗急慢性疼痛的方法。通过激活穴位局部的腺苷a1受体
达到类针刺样镇痛效果。
[0046]
(2)首次在针灸埋线材料应用药物缓释技术,将有效提高埋线疗效,拓展其市场应用。
[0047]
(3)本发明采用同轴静电纺丝技术,制备了具有多层同轴结构的纳米纤维,芯层和中层均混合有腺苷受体激动剂,提高了负载药物含量,最外的可生物降解壳层将腺苷受体激动剂包埋其中,在生理环境中起到了一定的阻碍作用,有利于延长药物释放时间。
[0048]
(4)本发明的制备方法简单,条件温和,采用的生物降解材料具有优异的生物相容性和可纺性能,具有很好的应用前景。
[0049]
(5)本发明中腺苷受体激动剂用量可灵活调控,可针对不同状态患者进行个性化定制不同缓释效果的穴位埋线。
附图说明
[0050]
图1为实施例1至实施例2所制得的三层同轴载药纳米纤维的结构示意图。
[0051]
图2为实施例1至实施例2所制得的埋线材料的光学显微镜图像。
[0052]
图3为实施例1至实施例2中使用的三层同轴静电纺丝装置的结构示意图。
[0053]
图4a是不同浓度腺苷溶液的吸收曲线;图4b是腺苷标准溶液的吸收曲线。
[0054]
图5a是实施例1制备的样品1在不同时间后的吸收曲线;图5b是实施例1制备的样品1的腺苷缓释曲线。
[0055]
图6a是实施例2制备的样品2在不同时间后的吸收曲线;图6b是实施例2制备的样品2的腺苷缓释曲线。
[0056]
图7a是对比例1制备的对比样品1在不同时间后的吸收曲线;图7b是对比例1制得的对比样品1的腺苷缓释曲线。
[0057]
图8a是对比例2制备的对比样品2在不同时间后的吸收曲线;图8b是对比例2制备的对比样品2的腺苷缓释曲线。
[0058]
图9是不同的载药纤维的体外释放缓释曲线汇总图。
[0059]
图10是测试例2动物模型足三里埋入不同埋线后的镇痛效果。
[0060]
图11是测试例2动物模型足三里埋入三轴腺苷缓释线后的镇痛效果。
具体实施方式
[0061]
本发明提供采用同轴静电纺丝技术制备的具有至少三层同轴结构的载药纳米纤维,所述的至少三层可以是三层、四层、五层或更多层;及基于该载药纳米纤维进一步制备的埋线材料。所述的载药纳米纤维中,除最外层壳层外的其他层(芯层和所有中间层)均由生物降解材料与腺苷a1受体激动剂的混合溶液经过同轴静电纺丝得到,壳层是由生物降解材料溶解于有机溶剂形成的纺丝液经过同轴静电纺丝得到。将这种至少三层的同轴结构载药纳米纤维无序堆叠成膜后再卷积可制医用成穴位埋线材料。
[0062]
以下通过列举具体实施方式和实施例的的方式对上述技术方案做出进一步解释。
[0063]
在本发明的一种具体实施方式中,希望制备一种针灸穴位用可缓释腺苷a1受体激动剂的复合型埋线材料,所述的复合型埋线材料由大量的三层同轴载药纳米纤维构成。所述的三层同轴载药纳米纤维从外到内依次包括壳层、中间层和芯层,其中壳层为生物降解
材料,优选聚乳酸(pla);中间层和芯层均为腺苷a1受体激动剂和生物降解材料的混合物,所述的腺苷a1受体激动剂优选腺苷。
[0064]
制备该具体实施方式中的三层同轴载药纳米纤维的一种优选的方法,包括以下步骤:
[0065]
(1)聚乳酸溶液制备:将聚乳酸(pla)溶解于丙酮中,70℃下搅拌均匀;
[0066]
(2)腺苷溶液制备:将腺苷溶于二甲基亚砜(dmso)中,室温下搅拌均匀;
[0067]
(3)芯层和中间层纺丝液制备:将聚乳酸溶液与腺苷溶液以一定比例混合,室温下搅拌均匀,得到芯层及中间层纺丝液;
[0068]
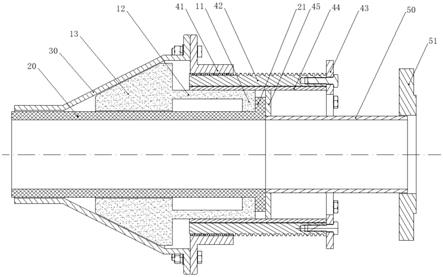
(4)将步骤(1)得到的聚乳酸溶液和步骤(3)得到的芯层及中间层纺丝液用于三层同轴静电纺丝。所述的三层同轴静电纺丝使用结构如图3所示的三层同轴静电纺丝设备。如图3所示,该设备包括推注装置、喷丝头20(纺丝针头)、电控装置30和纺丝接收装置40;其中喷丝头20由三个内径不同的套管套接形成,相邻两个套管之间存在间隙;推注装置包括第一注射器11、第二注射器12和第三注射器13,分别与内径从小到大的三个套管连通;所述的电控装置30用于控制所述喷丝头20的电压;所述的纺丝接收装置40用于承接出自喷丝头20的载药纳米纤维50。
[0069]
进行所述三层同轴静电纺丝时,将步骤(3)中得到的纺丝液加入图3中的第一注射器11和第二注射器12中,将步骤(1)中的聚乳酸溶液加入第三注射器13中,三个注射器以相同的推进速度将相应纺丝液注入喷丝头20,三层纺丝液经过三层同轴的喷丝头进行静电纺丝,得到三层同轴的载药纳米纤维,所述的载药纳米纤维50被纺丝接收装置40承接后成膜;
[0070]
(5)将步骤(4)中的纳米纤维膜卷成线状,制得埋线材料。
[0071]
优选地,步骤(1)中,聚乳酸溶液的质量分数为8%-12%,最佳为10%。
[0072]
优选地,步骤(2)中,腺苷溶液的浓度为26.7-347.4mg/ml,最佳为267.2-347.4mg/ml。
[0073]
优选地,步骤(3)中,聚乳酸溶液与腺苷溶液的体积比为7:3-9:1,最佳为8:2。
[0074]
优选地,步骤(4)中,静电纺丝的注射器推进速度为1.1mm/min,静电纺丝电压为8kv,针头与接受装置之间的距离为15cm。
[0075]
本实施方式获得的埋线材料可以使用标准方法和装置,例如,一次性使用埋线针、皮下注射口递送系统、导管等来完成穴位局部的施用。
[0076]
实施例1:三层同轴载药纳米纤维及埋线材料的制备
[0077]
1.1聚乳酸(pla)纯化:
[0078]
将30g的pla粒料加入180ml的二氯甲烷中,搅拌使其完全溶解后再加入1080ml的乙醇与其形成混合溶液。室温下(25
±
3℃)将溶液进行真空抽滤后倒入培养皿中,并在30℃下干燥,得到提纯后的pla。
[0079]
1.2溶液配制:
[0080]
将0.1g的经1.1纯化的聚乳酸加入0.9g的丙酮溶剂中,并于70℃下搅拌12h,制得质量分数为10%的均匀的聚乳酸-丙酮溶液(pla溶液)。称取267.2mg的腺苷加入到1ml二甲基亚砜(dmso)中,室温下搅拌30min,制备浓度为1m的均一溶液,记为腺苷溶液a。
[0081]
1.3三层同轴纤维及埋线材料的制备:
[0082]
将800μl步骤1.2制备的pla溶液和200μl步骤1.2制备的腺苷溶液a的混合液作为
芯层纺丝液,以1ml步骤1.2制备的pla溶液作为外层纺丝液,分别连接同轴针头,并在室温下进行静电纺丝。电压为8kv,针尖和收集器之间的距离为15cm。纺丝结束后将样品于室温下干燥,得到载药纳米纤维膜。组成载药纳米纤维膜的三层同轴载药纳米纤维,其大体结构如图1所示,由外向内依次包括壳层1、中间层2和芯层3,其中芯层3和中间层2均为载药层。
[0083]
然后将纤维膜卷积,得到直径约0.4mm的埋线材料,记为样品1。埋线材料外观的光学显微镜图像可参见图2。
[0084]
实施例2.三层同轴载药纳米纤维及埋线材料的制备
[0085]
取与实施例1相同的聚乳酸-丙酮溶液(pla溶液),称取347.4mg的腺苷溶解于1ml dmso中,制备浓度为1.3m的均一溶液,记为腺苷溶液b。
[0086]
将800μl pla溶液与200μl腺苷溶液b均匀混合作为芯层和中间层纺丝液,其他步骤与实施例1中步骤1.3制备方法一致,得到载药纳米纤维膜。组成载药纳米纤维膜的三层同轴载药纳米纤维,其大体结构如图1所示,由外向内依次包括壳层1、中间层2和芯层3,其中芯层3和中间层2均为载药层。
[0087]
然后将纤维膜卷积,得到直径约0.4mm的埋线材料,记为样品2。埋线材料外观的光学显微镜图像可参见图2。
[0088]
对比例1.双层同轴载药纳米纤维及埋线材料的制备:
[0089]
取与实施例1相同的聚乳酸-丙酮溶液(pla溶液)和腺苷溶液a,将800μl pla溶液和200μl腺苷溶液a的混合液作为芯层纺丝液,单纯以1ml的pla溶液作为外层纺丝液,分别连接同轴针头,并在室温下进行双层同轴静电纺丝。电压为8kv,针尖和收集器之间的距离为15cm。纺丝结束后将样品于室温下干燥,得到双层同轴载药纳米纤维构成的载药纳米纤维膜,双层同轴载药纳米纤维中包括芯层和外层,其中芯层为载药层。
[0090]
然后将上述双层同轴纳米纤维构成的纤维膜卷积,得到直径约0.4mm的埋线材料,记为对比样品1。
[0091]
对比例2.双层同轴载药纳米纤维及埋线材料的制备:
[0092]
取与实施例2相同的聚乳酸-丙酮溶液(pla溶液)和腺苷溶液b,参考上述对比例1的方法,将800μl pla溶液与200μl腺苷溶液b均匀混合作为芯层纺丝液,其他步骤与对比例1的方法一致,得到对比样品2。
[0093]
测试例1:药物体外释放实验
[0094]
1.1标准溶液曲线的绘制
[0095]
以生理盐水为溶剂,分别配制浓度为10、20、30、40、50、60μm的腺苷标准溶液,利用紫外-可见分光光度计在腺苷的最大吸收波长260nm处分别测定各标准溶液的吸收光谱。以腺苷标准溶液的浓度为横坐标,吸收强度为纵坐标绘制标准溶液曲线,其中,拟合函数由origin软件计算,r2代表线性度,越接近于1表示线性度越好。
[0096]
1.2载药纤维的体外释放实验
[0097]
室温下(25
±
3℃),分别取5mm的实施例1、2、对比例1、2制备的埋线材料样品1、样品2、对比样品1和对比样品2置于10ml生理盐水中,在第0、0.5、1、2、4、6、9、12、24、36、48、60、72、96、120、168小时后取出2ml溶液,并再加入相同体积的生理盐水,保持体积恒定。用紫外-可见分光光度计测定吸收光谱,并根据腺苷的标准溶液曲线计算药物释放量。
[0098]
数据分析:
[0099]
如图4a所示,随着腺苷溶液浓度的增加,其在波长260nm处的吸收强度逐渐增加。图4b以腺苷溶液浓度为横坐标,吸收强度为纵坐标绘制了标准溶液曲线,并通过origin软件进行了线性函数拟合,得到线性函数y=0.01639x 0.0025。式中,y代表溶液在260nm波长处的吸收强度,x代表腺苷溶液浓度。拟合后的函数线性度r2=0.999,接近于1,这说明拟合函数的线性度良好,为腺苷体外释放的测试提供了定量分析的基础。
[0100]
图5a为本发明样品1在不同时间后的吸收曲线。根据图4a的吸收强度,通过腺苷标准溶液的拟合函数计算出腺苷释放质量后,再经过公式(ei为特定时间点的累积释放量,ve为每次取样的体积(2ml),ci和cn为该时间点溶液中药物的浓度(c0设为0),v0为溶液总体积(10ml))即可计算出腺苷在不同时间点的累积释放量。通过计算绘制出缓释曲线图5b,并总结出表2。说明随着时间的增加,样品1溶液在260nm处的吸收强度逐渐增大,在24h时达到最大,且在72h时仍可维持一定强度。说明样品1置于生理盐水后,其负载的腺苷药物会在24h内缓慢释放。在24h时腺苷释放浓度达到最高值,之后的吸收强度逐渐降低,表明释放速率逐渐降低,但仍可在72h时维持10μm以上的腺苷浓度,结合图5b和表2可知,24h后,其累积释放质量基本比较稳定。
[0101]
表2样品1在不同时间的腺苷释放量
[0102][0103]
图6a为本发明样品2在不同时间后的吸收曲线。48h前,随着时间增加,溶液的吸收强度逐渐增大,说明样品2置于生理盐水后,其负载的腺苷药物会在48h内缓慢释放。之后,吸收强度又逐渐降低,表明释放速率降低。通过计算绘制出缓释曲线图6b,并总结出表3,说明随着时间的增加,样品2溶液在260nm处的吸收强度逐渐增大,在48h时达到最大,且在72h时仍可维持一定强度。72h后,样品2腺苷的累积释放量基本稳定。
[0104]
表3样品2在不同时间的腺苷释放量
[0105][0106]
图7a为对比样品1在不同时间后的吸收曲线。在36h内,随着时间增加,溶液在260nm处的吸收强度逐渐增大,在36h时达到最大。之后,吸收强度又逐渐降低,说明释放速率在36h后大幅度降低。可见对比样品1置于生理盐水后,其负载的腺苷药物会在36h内缓慢释放。这是由于外层pla的存在使得内层的腺苷与生理盐水的接触面积大大减小,当pla外层溶蚀致孔后,内层的腺苷才可以通过表层孔道扩散释放于生理盐水中。36h后,内层的腺苷含量已经大大降低,因此释放速率大大降低,腺苷的释放与测试后新加入生理盐水导致的稀释达到平衡,累积释放量基本不再变化。通过计算绘制出缓释曲线图7b,并总结出表4:
[0107]
表4对比样品1在不同时间的腺苷释放量
[0108]
[0109]
图8a为对比样品2在不同时间后的吸收曲线。随着时间增加,溶液在260nm处的吸收强度逐渐增大,说明其内部的腺苷不断缓慢释放。通过计算绘制出缓释曲线图8b,并总结出表5,结合图8b和表5可知,在6天后,其累积释放质量仍未达到峰值。
[0110]
表5对比样品2在不同时间的腺苷释放量
[0111][0112]
此外,我们将上述所有样品的缓释曲线总结为图9,基于同样的制备方法,相对于样品1,样品2的腺苷添加量更多,但其总释放量更少;相对于对比样品1,对比样品2的腺苷添加量更多,但其总释放量更少。这可能是因为当腺苷的溶解量过高时,在与pla-丙酮溶液混合的过程中,腺苷溶质会受到溶液组成变化的影响出现析出现象,导致载药量的减少。此外,从图中还可以明显观察到三层结构(本发明的样品1和2)分别比相同载药量的双层结构(对比样品1和对比样品2)纤维的药物累积释放量更大。这是因为在三层结构中,内层和中层均负载了腺苷激动剂。
[0113]
动物实验镇痛效果
[0114]
1.1实验动物
[0115]
spf级雄性sprague-dawley(sd)大鼠,体重180
±
30g,从上海西普尔-必凯实验动物有限公司获取,所有实验动物的相关操作流程均符合国家卫生协会实验室动物护理和使用指南的规定,并通过上海同济生物医药技术有限公司动物伦理委员会批准后开始实验。
[0116]
1.2主要仪器及试剂
[0117]
表1主要仪器及试剂
[0118][0119]
1.3.足三里单次埋入腺苷缓释线镇痛效应研究
[0120]
动物模型:6-8周150g-200g sd大鼠,cfa炎性痛模型。
[0121]
实验分组:将sd大鼠编号后,依照随机数字表法随机分为7组:样品1组、样品2组、对比样品1组、对比样品2组、pla线组、胶原蛋白线组、假穴位埋线组,每组6只大鼠,
[0122]
干预方法:左侧足底打完全弗氏佐剂24h后成模。即造模24h后在左侧足三里
(st36)单次分别埋入样品1、样品2、对比样品1和对比样品2四种埋线材料、pla线或胶原蛋白线,共埋1次,埋入线体的直径约0.4mm,长度约0.5cm。假穴位埋线组只用穴位埋线针刺一下,不埋线。
[0123]
观察指标:机械痛。造模前1天测基础痛阈,造模后连续观察12天。
[0124]
实验结果:
[0125]
①
本发明埋线材料镇痛效应中腺苷溶液的最佳浓度为267.2mg/ml,最佳层次为三层,即样品1(图10)。
[0126]
②
单次埋入本发明样品1后的镇痛效果优于常规胶原蛋白线,pla线的镇痛效果和常规胶原蛋白线无统计学差异(图11)。
[0127]
③
单次埋入本发明样品1后的镇痛效果可以维持4天(d2-d5),注射后第5天(d6)镇痛效果开始逐步下降(图11)。
[0128]
④
目前采用最佳腺苷浓度267.2mg/ml配制的电纺液对应的最佳镇痛效果与造模前大鼠机械痛阈相比,可恢复91.53%(62.82/68.63)。与常规胶原蛋白线相比,可增效48.69%((62.82-42.25)/42.25))(图11)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。