具有改善酒精性肝病的瑞士乳杆菌zjuids12及其应用
技术领域
1.本发明涉及食品微生物技术领域,具体涉及具有改善酒精性肝损伤的瑞士乳杆菌zjuids12及应用。
背景技术:
2.目前研究报道,酒精是大多数工业化国家慢性肝病的常见致病因素,肝脏是代谢酒精的主要器官,因此长期以来肝脏一直被认为是酒精损害的主要靶器官。而因此酒精性肝病(alcoholic liver disease,ald)已经逐渐成为全球广泛流行的慢性肝病。在ald疾病进程初期,脂质会在乙醇的诱导下进入肝细胞中并逐渐积累,形成脂肪肝,此时若仍持续摄入酒精,则可能进一步发展为肝纤维化甚至肝硬化。目前,ald已成为全球备受关注的公共卫生问题,然而迄今为止尚无安全有效治疗ald的临床用药。如何有效防治ald是临床医学迫切需要解决的问题。
3.瑞士乳杆菌(lactobacillus helveticus)是一种重要的工业微生物发酵剂,主要用于发酵制作各种奶酪,它最早是从西方奶酪中分离出来的。瑞士乳杆菌具有极强的蛋白水解活性,其发酵乳制品中多肽含量较高,因此具有潜在的产生生物活性肽的能力。除了对于奶酪制作工艺的重要性,越来越多的科学证据表明瑞士乳杆菌菌株具有促进健康的特性。
4.201910558554.6公开了一种能够缓解酒精性肝损伤的瑞士乳杆菌及应用,属于微生物的技术领域,分类名称为瑞士乳杆菌(lactobacillus helveticus)l551,保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.15604,保藏日期为2018年4月11日。该瑞士乳杆菌l551具有耐酸性,对酒精造成的血清alt和ast增多有抑制作用;对酒精造成的肝脏mda增多有抑制作用,并恢复肝脏gsh和sod活性;对酒精造成的血清内毒素增多有抑制作用;对酒精造成的肝脏细胞炎性因子升高有抑制作用;减轻肝脏脂肪泡,减轻炎症细胞浸润。该瑞士乳杆菌l551可以有效缓解酒精造成的肝脏损伤。
技术实现要素:
5.本发明要解决的技术问题是提供一种具有改善酒精性肝病的瑞士乳杆菌(lactobacillus helveticus)zjuids12及其应用。
6.为解决上述技术问题,本发明提供一种瑞士乳杆菌(lactobacillus helveticus)zjuids12,其保藏号为cgmcc no.23997。
7.作为本发明的瑞士乳杆菌(lactobacillus helveticus)zjuids12的改进:其16s rdna全序列为seq id no:1所示。
8.本发明还同时提供了上述瑞士乳杆菌(lactobacillus helveticus)zjuids12在制备保护肝损伤的产品中的应用。
9.作为本发明应用的改进:所述保护肝损伤的产品中,包含瑞士乳杆菌(lactobacillus helveticus)zjuids12的菌粉制剂,及灭活后的菌体、内容物和发酵液产
品。
10.本发明的菌株zjuids12,保藏名称为瑞士乳杆菌lactobacillus helveticus,保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,保藏地址:北京市朝阳区北辰西路1号院3号,保藏编号:cgmcc no.23997,保藏时间2021年11月29日。
11.本发明从蒙古族传统发酵食品酸奶油中筛选出一株瑞士乳杆菌(lactobacillus helveticus)zjuids12,通过细菌形态学、生理学和培养特征,结合16s rdna测序等对该菌株进行了鉴定。
12.本发明所提供的瑞士乳杆菌zjuids12(lactobacillus helveticus zjuids12)的具有较强的保护肝损伤的能力、体内外抗氧化能力、恢复肠道屏障,改善肠道菌群功效。
13.与现有的瑞士乳杆菌相比,本发明的瑞士乳杆菌zjuids12(lactobacillus helveticus zjuids12)具有如下优势:本发明利用体内动物实验证明,本发明的菌株在体内也具有较强的改善酒精性肝病的效果,较强的抗氧化能力、抑制幽门螺旋杆菌能力;此外本发明的菌株不仅本身活菌有显著效果,其菌体本身也有显著的改善酒精性肝病的效果。本发明的瑞士乳杆菌(lactobacillus helveticus)zjuids12还具有体外抗氧化性能、粘附性能(表面疏水性)、耐胆盐性、抗生素敏感性、抗致病菌性,且,本发明的灭活菌体有缓解酒精性肝病功效。
附图说明
14.下面结合附图对本发明的具体实施方式作进一步详细说明。
15.图1为图1为zjuids12的菌落形态图。
16.图2为zjuids12革兰氏染色的菌体形态图。
17.图3为zjuids12的16s rdna的电泳鉴定图;
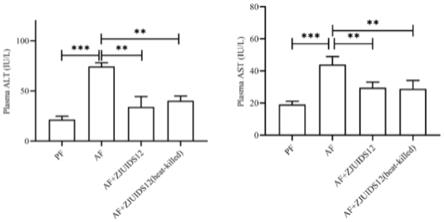
18.图4为zjuids12对小鼠血浆中谷丙转氨酶和谷草转氨酶(alt和ast)的影响。
19.图5为zjuids12对小鼠血浆中游离脂肪酸(ffa)的影响。。
20.图6为zjuids12对小鼠肝脏中甘油三酯的影响。
21.图7为zjuids12对小鼠肝脏中丙二醛(mda),总超氧化物歧化酶(t-sod)和过氧化氢酶(cat)的影响。
22.图8为zjuids12对小鼠肝脏中脂肪酸合成基因(srebp1c和fas)的影响。
23.图9为zjuids12对小鼠肠道中紧密连接蛋白基因(zo-1和claudin-1)的影响。
24.图10为zjuids12对小鼠粪便中短链脂肪酸(乙酸,丙酸和丁酸)的影响。
25.图11为本发明zjuids12对小鼠结肠内容物中益生菌的影响。
26.图12为本发明zjuids12灭活菌体对小鼠血浆中谷丙转氨酶和谷草转氨酶(alt和ast)的影响。
27.注:图4-12中,pf为对照组,af为酒精处理组,af zjuids12组为酒精和zjuids12同时处理组,af zjuids(heat-killed)为酒精和zjuids12灭活菌体处理组。
具体实施方式
28.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
29.实施例1、瑞士乳杆菌zjuids12的筛选及鉴定:
30.1.瑞士乳杆菌zjuids12的筛选
31.1.1 样品来源
32.本发明所使用的菌株分离自内蒙古地区蒙古族牧民自制的酸奶油产品,样品共采集20份。
33.1.2 菌株的分离纯化
34.取大约5g新鲜样品用无菌管收集,立即送至实验室进行菌株分离。取1g样品放入9ml的mrs肉汤培养基中,涡旋混匀后于37℃下富集培养48h;然后在超净台中吸取富集液1ml,用无菌生理盐水进行十倍梯度稀释,选取10-6
、10-7
、10-8
三个稀释梯度,每个梯度取菌液100μl涂于mrs琼脂培养基上,于37℃培养48h。培养结束后,从琼脂培养基中选择生长有50-150个单菌落的平板,挑取典型菌落,在mrs琼脂平板上多次划线纯化,直至整个平板上的菌落形态一致,挑取单菌落到mrs肉汤培养基增菌培养。得到的菌株均在含40%甘油的mrs肉汤培养基中于-80℃冷冻保存。
35.2.瑞士乳杆菌zjuids12的鉴定
36.2.1 菌落特征
37.将分离纯化所得的瑞士乳杆菌zjuids12在mrs琼脂培养基培养48h后,直径在0.3-1.5mm之间,表面光滑,边缘不规则有轻微毛边形状,有很强烈的酸乳味道,见图1。
38.2.2 显微镜下形态:
39.瑞士乳杆菌zjuids12菌落涂片:革兰氏染色呈阳性,不产芽孢,圆端直杆菌,单个、成对或短链状,见图2。
40.2.3 16s rdna鉴定
41.用ezup柱式细菌基因组dna抽提试剂盒提取目标菌株基因组dna,将提取的乳酸菌基因组dna作为pcr扩增的模板,采用细菌通用引物27f和1492r进行16s rdna的pcr实验,pcr反应扩增结束后,取pcr产物进行琼脂糖凝胶检测拍照,扩增片段长度为1.2kbp左右,见图3。将pcr产物送至华大基因有限公司进行测序,结果如seq id no.1所示,在ncbi网站上进行blast序列比对,结果显示该序列与瑞士乳杆菌的鉴定的16s rdna序列同源性超过99%。
42.将菌株zjuids12的序列比对结果和生理生化结果相结合,确定筛选的乳酸菌zjuids12为瑞士乳杆菌zjuids12(lactobacillus helveticus zjuids12)。
43.本发明的菌株zjuids12,保藏名称为瑞士乳杆菌lactobacillus helveticus,保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,保藏地址:北京市朝阳区北辰西路1号院3号,保藏编号:cgmcc no.23997,保藏时间2021年11月29日。
44.本发明中:
45.1、zjuids12菌液的制备方法为:将于甘油管中保存的菌株zjuids12先在mrs琼脂平板上划线活化2~3次,然后挑取单菌落在mrs液体培养基中于37℃扩大培养18~24h,菌液的浓度达到109~10
10
cfu/ml左右,作为菌悬液(为活菌液)。实际使用时,可利用生理盐水调节菌液至所需浓度,例如调节至5
×
109cfu/ml。
46.2、将上述zjuids12的菌悬液于121℃高温高压灭活30min,作为灭活zjuids12菌液。
47.实施例2、瑞士乳杆菌zjuids12改善酒精性肝病:
48.1、实验动物:c57bl/6雄性小鼠24只,购自上海斯莱克实验动物中心,公司许可证编号:scxk(沪)2017-0005,饲养于浙江中医药大学实验动物中心,spf环境中。
49.试剂:lieber-decarli酒精液体模型饲料(产品代码tp-4030b,南通特洛菲饲料科技有限公司);lieber-decarli对照液体饲料(产品代码tp-4030d,南通特洛菲饲料科技有限公司);胆碱,维生素(南通特洛菲饲料科技有限公司)。无水乙醇(cas-no:64-17-5,lichrosolv),alt试剂盒(货号:c009-2南京建成生物工程研究所),ast试剂盒(货号:c010-2南京建成生物工程研究所)游离脂肪酸试剂盒(货号:a042-2-1南京建成生物工程研究所),组织甘油三酯试剂盒(货号:e1013北京普利莱基因技术有限公司),丙二醛测定试剂盒(货号:a003-1南京建成生物工程研究所),总超氧化物歧化酶测定试剂盒(货号:a001-1南京建成生物工程研究所),过氧化氢酶检测试剂盒(货号:a001-1,南京建成生物工程研究所)
50.2、方法:
51.2.1 实验动物饲养
52.c57bl/6小鼠于spf级别动物实验室进行适应喂养一周后,对8周龄的c57bl/6小鼠随机分为3组,每组8只,分别为对照液体饲料组 生理盐水组(pf组),酒精液体饲料组 生理盐水组(af组),酒精液体饲料 瑞士乳杆菌zjuids12组(af zjuids12组)。
53.pf组用lieber-decarli对照液体饲料喂养4周,期间根据af组lieber-decarli酒精液体模型饲料摄入量调整pf组对照液体饲料的体积,并且每日每只灌胃1次0.2ml生理盐水;af和af zjuids12组第1-3天给予lieber-decarli对照液体饲料,第4-5天给予5.5%热量比酒精液体饲料,第6-7天给予11%热量比酒精液体饲料,第二周给予22%热量比酒精液体饲料,第三周27%热量比酒精液体饲料,第四周32%热量比酒精液体饲料,从第一天开始af组每日每只灌胃1次0.2ml生理盐水,af zjuids12组每日每只灌胃1次0.2ml zjuids12菌液(0.2ml菌液中含109cfu的zjuids12,溶剂为生理盐水)。
54.小鼠所食用的液体饲料每日更换为新配置饲料,每周记录小鼠的体重,检测变化,饲喂结束后,小鼠使用1%戊巴比妥腹腔注射进行麻醉,下腔静脉取血测定alt,ast和ffa,取小鼠肝脏和回肠部分组织进行相关指标测定。
55.3、饲料配方
56.(1)pf组小鼠所使用对照液体饲料配制方法:
57.表1:对照组小鼠所食用液体饲料配方(1l)
[0058][0059]
加水600ml左右,搅拌完全溶解后,加水定容至1l。
[0060]
注:饲料主料购自南通特罗菲,主要包含酪蛋白,l-胱氨酸,dl-蛋氨酸,玉米油,橄榄油,红花油,纤维素,矿物质,维生素,酒石酸胆碱,黄原胶,tbhq。
[0061]
(2)不同酒精浓度液体饲料的配制:以配制1l液体为例,
[0062]
表2:实验组小鼠所食用液体饲料配方(1l)
[0063][0064][0065]
加水600ml左右,搅拌完全溶解后,加水定容至1l。
[0066]
4.指标测定
[0067]
参照南京建成或北京普利莱试剂盒说明书等,具体如下:
[0068]
4.1 血浆alt检测
[0069]
取小鼠血浆样本直接取样测定,基质液提前在37℃预热,测定孔加入20μl基质液与5μl的待测样本,混匀,对照孔加入20μl基质液,37℃孵育30min。分别在测定孔与对照孔加入20μl的2,4-二硝基苯肼液,并在对照孔加入5μl的待测样本,混匀,37℃孵育20min。在每孔加入200μl的0.4mol/l氢氧化钠液,混匀,室温放置15min,510nm波长,酶标仪测各孔od值,查标准曲线,求得相应的alt/gpt活力单位。
[0070]
4.2 血浆ast检测
[0071]
取小鼠血浆样本直接取样测定,基质液提前在37℃预热,测定孔加入20μl基质液与5μl的待测样本,混匀,对照孔加入20μl基质液,37℃孵育30min。分别在测定孔与对照孔加入20μl的2,4-二硝基苯肼液,并在对照孔加入5μl的待测样本,混匀,37℃孵育20min。在每孔加入200μl的0.4mol/l氢氧化钠液,混匀,室温放置15min,510nm波长,酶标仪测各孔od值,查标准曲线,求得相应的ast/gpt活力单位。
[0072]
4.3 血浆ffa检测
[0073]
在空白孔中加入4μl的双蒸水,在校准孔加入4μl的标准品,在样本孔加入4μl的样品。在这三个孔中加入200μl的试剂一。混匀,37℃孵育5min,读取吸光度值a1,分别在这三个孔中加入50μl的试剂二,混匀,37℃孵育5min,读取吸光度值a2,计算a2-a1的值,采用两点校准计算。
[0074]
4.4 肝脏tg的检测
[0075]
精准称取肝脏100mg,以1mg肝脏加20μl裂解液的比例加入裂解液。用全自动样品快速研磨仪破碎组织,而后静置10min,取适量上清液转移到1.5ml离心管中,进行以下步骤,余下的裂解液可用bca法进行蛋白定量。上清液70℃金属浴加热10min。室温2000rpm离心5min,取上层清液用于tg测定。取10μl上清于96孔板中,并将4mm甘油标准品倍比稀释为1000、500、250、125、62.5、31.25、15.625、7.8125μmol/l并各取10μl稀释液于96孔板中,按北京普利莱液体tg试剂盒说明书所述配制工作液。将190μl工作液加入样本中,在37℃下孵育15min,采用550nm工作波长测定od值。
[0076]
4.5 丙二醛(mda)检测
[0077]
准确称取肝组织重量,按照重量(g):体积(ml)=1:9的比例加入9倍体积生理盐水,剪碎组织,冰水浴制备匀浆,3000转/分钟,离心10min取上清即10%匀浆上清液待测。在空白管中加入0.1ml的无水乙醇,在标准管中加入0.1ml的10nmol/ml标准品,在测定管、对照管加入0.1ml的测试样品,分别在这四管中加入0.1ml的试剂一,混匀,在这四管中加入3ml的试剂二应用液,在空白管,标准管,测定管中加入1ml的试剂三应用液,在对照管中加入1ml的50%冰醋酸。混匀,95℃孵育40min,取出后冷却,然后3500~4000r/min离心10min取上清,532nm处,测定od值。根据计算公式计算各组之间mda含量。
[0078]
4.6 超氧化物歧化酶(t-sod)的检测
[0079]
取10%肝匀浆上清液待测。在两管中加入1ml的试剂一应用液,在测定管中加入0.05ml的样品,在对照管中加入0.05ml的蒸馏水,分别在两管中加入0.1ml的试剂二、试剂三、试剂四应用液,用旋涡混匀器充分混匀,37℃孵育40min,分别在这两管中加入2ml的显色剂。混匀,室温放置10min,于波长550nm处,测定od值。
[0080]
4.7 过氧化氢酶(cat)的检测
[0081]
取部分10%肝匀浆用生理盐水按1:9稀释制备成1%肝匀浆,同时用bca试剂盒测定该匀浆蛋白浓度,每次测定前先配制底物溶液,使其吸光度在0.5~0.55之间,并将底物溶液预温至25℃备用。取1cm光径石英比色皿,紫外240nm,双蒸水调零备用。取经过前处理的样本0.02ml加入比色皿底部,将已经预温至25℃,od在0.5~0.55之间的底物溶液3ml直接用5ml的大移液枪快速冲入比色皿中,240nm处立即测定吸光度,记下od1值,比色皿不要取出,1min时立即再测一次吸光度,记下od2值。根据计算公式计算各组之间cat活力。
[0082]
4.8 实时定量荧光pcr(real-time pcr)
[0083]
(1)从-80℃的冰箱中取出组织于冰盒中,用电子天平称取0.02g左右的组织于ep管中,同时预冷4℃离心机;
[0084]
(2)向装有组织块的ep管加入1ml的trizol以及3颗钢珠,用研磨机研磨,取出液体,倒出钢珠,室温反应10min;
[0085]
(3)向ep管中加入200μl的氯仿,剧烈震荡混匀30s,置于冰上静置5-10min;
[0086]
(4)静置后将离心管置于4℃离心机内,12000rpm,离心15min;
[0087]
(5)吸取离心样品的水相(上清液)于新的1.5ml离心管内
[0088]
(6)加入与离心抽取的溶液等体积的异丙醇溶液,并轻轻颠倒混匀,于-20℃静置20min;
[0089]
(7)将-20℃中的样本取出12000rpm,4℃离心15min;
[0090]
(8)离心完成后弃去上清即得白色(或无色透明)沉淀,沿离心管内壁加入预冷的使用depc水配制的75%乙醇100-300μl,洗涤2-3次;
[0091]
(9)弃去液体后室温风干约15min,向离心管内加入预冷depc水20-50μl,溶解底部风干后的沉淀(rna),置于-20℃冰箱保存待用。
[0092]
(10)使用超微量紫外分光光度计测量rna浓度,记录结果并计算每组上样量。
[0093]
(11)如表1所示,加入逆转录试剂盒中相应的反应溶液进行预混,并加样进行逆转录,震荡离心后置入pcr仪器,按照逆转录试剂盒中设置相应的pcr反应条件。将逆转录仪器逆转录后的cdna样品置于-20℃冰箱保存备用。
[0094]
(13)使用0.2ml荧光定量pcr八连管,加入反应物,以cdna为模板,通过使用荧光定量pcr扩增仪对实验目的基因进行扩增,进行荧光定量pcr测定。
[0095]
(14)将混合的反应物进行振荡混匀,离心后将八连管置入qrt-pcr反应仪中。设置pcr反应程序:预变性:94℃,5min;变性:94℃,30s,60℃,30s,72℃,30s,40个循环;延伸:72℃,5min,4℃保存。pcr仪器的热盖温度设置为105℃。
[0096]
(15)根据通过2
–
δδct法计算目的基因的表达变化。
[0097]
4.9 短链脂肪酸测定
[0098]
用无菌钳挤压分段结肠切片,取出内容物,保存于-80℃低温保存管中。。用超纯水将结肠内容物稀释五倍并涡旋3分钟。接下来,将悬浮液静置5分钟,然后在4℃,5000
×
g离心20分钟。一毫升的上层清液与20μl色谱级磷酸混合,将混合物通过0.45μm膜过滤器注入色谱瓶进行气相色谱分析。气相色谱仪由aoc-20s自动采样器和配备有火焰离子化检测器的gc-2010组成。以氮气为载气,流速为3ml/min。在气相色谱上安装一个sh稳定蜡高极性柱,样品进样量为0.2μl,分流注射比为50,注射温度为200℃。乙酸乙酯作为空白溶剂注入每个样品之间,以消除任何记忆影响。初始柱温度设定在80℃,并保持1分钟,然后以8℃/min的速度升到170℃,然后,立即以20℃/min的速度升至220℃,保持4分钟。总时间为18.75分钟。最后,scfas计算的内容根据scfa标准曲线,用外标法标定。
[0099]
4.10 16s rrna基因测序
[0100]
收集的结肠内容物样本送往杭州明科生物公司进行总dna分离和16s rrna高通量测序技术。16srrna在v3-v4区扩增。使用qia快速pcr纯化试剂盒纯化扩增子,通过illumina novaseq平台进行测序,通过uparse对原始序列进行质量控制。操作分类单元(otu)是通过使用qiime将序列绑定到序列相似性大于97%的簇中来构建的。
[0101]
5、实验结果:
[0102]
图4的结果可以看出zjuids12可以显著降低酒精摄入所引起的alt和ast升高。alt,即谷丙转氨酶,谷丙转氨酶主要存在于肝细胞浆内,细胞内浓度高于血清中1000-3000倍,只要有1%的肝细胞被破坏,就可以使血清酶增高一倍。因此,谷丙转氨酶被世界卫生组织推荐为肝功能损害最敏感的检测指标。alt降低即意味着肝损伤降低。ast,即谷草转氨酶,也称天门冬氨酸氨基转移酶。ast主要分布在肝细胞的线粒体中,也是肝细胞受损敏感的指标之一。
[0103]
图5的结果表明zjuids12可以显著降低酒精摄入所引起的ffa升高。游离脂肪酸(ffa)是甘油三酯分解成的物质。正常情况下血浆中含量极少,游离脂肪酸的升高会改变粘膜的通透性,导致粘膜受损,且肝脏过多的摄入游离脂肪酸,超过了肝脏线粒体对脂肪酸的氧化,会促使甘油三酯增加,加剧形成脂肪肝
[0104]
图6结果表明zjuids12可以显著降低酒精摄入所引起的肝脏tg的升高,酒精组(af)小鼠肝脏中甘油三酯的含量相对于对照组(pf)明显增多,而af zjuids12组其肝脏中甘油三酯的含量相对于af组显著降低,所以判断zjuids12能有效的减少小鼠肝脏中甘油三酯的含量。
[0105]
图7结果表明zjuids12具有较强的抗氧化能力,正常情况下,生物体中天然的抗氧化剂防御系统中的抗氧化酶可以与饮食或者药物中的抗氧化剂协同作用,清除过氧化物。其中最重要的抗氧化酶包括超氧化物歧化酶(sod)和过氧化氢酶(cat)。sod负责将超氧阴
离子歧化为过氧化氢,而cat则可以减少过氧化氢,从而阻止高毒性羟基自由基的产生。另一方面检测脂质过氧化产物mda的水平以间接判断细胞受自由基攻击的严重程度。
[0106]
图8结果表明zjuids12具有抑制肝脏甘油三酯从头合成的能力,srebp-1c是调控肝脏脂肪酸和甘油三酯合成有关基因的主要转录因子,与肝细胞内甘油三酯的过度蓄积产生脂肪毒性的发生密切相关,fas是srebp-1c的靶基因,srebp-1c和fas在af组中显著表达升高,而zjuids12干预能显著抑制其基因的表达,表明zjuids12具有抑制甘油三酯从头合成的能力。
[0107]
图9结果表明zjuids12具有改善肠粘膜屏障的能力,紧密连接是肠上皮细胞间的主要连接方式,对维持肠道黏膜上皮机械屏障和通透性起着重要作用。紧密连接蛋白是构成肠道黏膜屏障、决定肠壁通透性的重要蛋白质分子,对紧密连接的组成和功能发挥有很大影响。其中,zo-1、claudin 1是构成细胞间紧密连接的重要因子,zjuids12干预显著恢复酒精诱导的zo-1、claudin 1的基因表达降低的情况。
[0108]
图10结果表明zjuids12具有促进肠道短链脂肪酸合成的能力,scfa是肠道微生物发酵产生主要的代谢物。scfa作为其代谢最终产物,维持肠道需氧环境中的氧化还原当量。scfa是具有1-6个碳原子的饱和脂肪酸,最丰富的scfa(~95%)为乙酸(c2)、丙酸(c3)和丁酸(c4)。zjuids12干预显著增加肠道中的乙酸,丙酸,丁酸的含量。
[0109]
图11结果表明zjuids12具有改善肠道菌群的功能,图中显示zjuids12处理后肠道中的乳杆菌(lactobacillaceae)显著高于酒精处理组,和对照组相近。说明zjuids12能够调节肠道菌群平衡,改善肠道健康。
[0110]
实施例3、灭活瑞士乳杆菌zjuids12菌体改善酒精性肝病:
[0111]
1、实验动物:c57bl/6雄性小鼠32只,购自上海斯莱克实验动物中心,公司许可证编号:scxk(沪)2017-0005,饲养于浙江中医药大学实验动物中心,spf环境中。
[0112]
试剂:lieber-decarli酒精液体模型饲料(产品代码tp-4030b,南通特洛菲饲料科技有限公司);lieber-decarli对照液体饲料(产品代码tp-4030bc,南通特洛菲饲料科技有限公司);胆碱,维生素(南通特洛菲饲料科技有限公司)。无水乙醇(cas-no:64-17-5,lichrosolv),alt试剂盒(货号:c009-2南京建成生物工程研究所),ast试剂盒(货号:c010-2南京建成生物工程研究所)游离脂肪酸试剂盒(货号:a042-2-1南京建成生物工程研究所)。
[0113]
2、方法:
[0114]
2.1 实验分组
[0115]
实验共分成4组:1)pf组:生理盐水组;2)af组:酒精液体饲料组;3)af zjuids12组:酒精液体饲料 瑞士乳杆菌zjuids12菌液,菌液为含109cfu/ml的zjuids12活菌;4)af zjuids12灭活组:酒精液体饲料 灭活的zjuids12菌液,灭活处理为含109cfu/ml的zjuids12菌液在121℃下处理30min。
[0116]
2.2 实验动物饲养(参照实施例2)
[0117]
c57bl/6小鼠于spf级别动物实验室进行适应喂养一周后,对8周龄的c57bl/6小鼠随机分为4组,每组8只,分别为对照液体饲料组 生理盐水组(pf组),酒精液体饲料组 生理盐水组(af组),酒精液体饲料 瑞士乳杆菌zjuids12组(af zjuids12组),酒精液体饲料 瑞士乳杆菌zjuids12灭活组(af zjuids12灭活组)。每只小鼠每天灌胃1次0.2ml生理盐水(pf
组),或者0.2ml zjuids12菌液(zjuids12组),或者0.2ml灭活zjuids12菌液(zjuids12灭活组)。
[0118]
3、动物实验的方法和检测指标参照实施例2。
[0119]
实验结果:
[0120]
图12结果表明zjuids12其本身菌体就具有改善酒精性肝病的能力,灭活的瑞士乳杆菌zjuids12其本身仍能降低血浆中alt和ast水平,表明其菌体本身具有改善酒精性肝病的功效。因此,灭活的瑞士乳杆菌zjuids12可以作为后生元用于改善酒精性肝病。
[0121]
需要说明的是:瑞士乳杆菌l551的菌液进行灭活(于121℃高温高压灭活30min),作为灭活l551菌液,参照本发明的上述方法进行实验;
[0122]
l551灭活组的结果为:alt和ast结果接近与酒精处理组,表明l551灭活后没有显著缓解脂肪肝功效。
[0123]
而本发明的zjuids12灭活组的结果为:zjuids12活菌组和灭活组的alt和ast结果相近,显著低于酒精处理组(见图12)。
[0124]
因此,可得知,本发明的菌株即使灭活后也有良好的缓解脂肪肝功效,显著优于l551。
[0125]
实施例4、瑞士乳杆菌zjuids12的抗氧化能力的确认
[0126]
1、总抗氧化能力(frap法)
[0127]
总抗氧化能力的测定方法按照giuberti等的方法略作修改。向酶标板中加入150μl tptz工作液(0.3m醋酸-醋酸钠缓冲液、20mm氯化铁溶液、10mm tptz缓冲液,以v:v:v=10:1:1混合,现用现配)和20μl的样品,振荡混匀,37℃反应10min,测定溶液在593nm处的吸光度。将样品测得的吸光度代入硫酸亚铁标准曲线,样品抗氧化能力以硫酸亚铁当量表示(μmol feso4/ml样品)。每个样品重复3次,求平均值。
[0128]
硫酸亚铁标准曲线:配制不同质量浓度(0μm、50μm、100μm、200μm、400μm、600μm、800μm)的硫酸亚铁溶液,将不同摩尔浓度的硫酸亚铁溶液、10mm tptz缓冲液、0.3m醋酸盐缓冲液以v:v:v=1:1:10混合,取170μl混合液加入酶标板,37℃反应10min,测定溶液在593nm处的吸光度。以吸光度为纵坐标,硫酸亚铁质量浓度为横坐标绘制标准曲线并进行测定。
[0129]
2、还原能力
[0130]
还原能力的测定参考lin等的方法并略做一些修改。取1ml样品于离心管中,加入0.2m,ph 6.6的pbs缓冲溶液及1%(w/v)铁氰化钾溶液各1ml,混匀。50℃水浴20min,冰浴冷却。再加入10%三氯乙酸1ml,6000r/min离心5min,取上清液1ml,加入0.1%(w/v)三氯化铁1ml、蒸馏水1ml,混匀,静置反应10min,于700nm处测定吸光度。用pbs缓冲液或mrs肉汤培养基代替样品为空白组。每个样品重复3次,求平均值。
[0131]
还原能力(%)=[(as-ab)/ab]*100
[0132]
式中:as——样品组吸光度;
[0133]
ab——空白组吸光度;
[0134]
3、dpph自由基清除能力
[0135]
dpph自由基清除能力的测定方法参考shimada等的方法并略作一些修改。配制vc标准溶液1000mg/ml,稀释成不同浓度梯度(0-30μg/ml)。向酶标板中加入100μl待测样品
(或vc标准溶液)和100μl 0.2mm dpph乙醇溶液(无水乙醇配制,4℃避光保存,现配现用),摇匀后于室温下避光30min,测定溶液在517nm处的吸光度;用100μl无水乙醇代替100μldpph乙醇溶液为空白组;用100μl pbs缓冲液(0.2m,ph6.6的pbs或mrs肉汤培养基)代替100μl待测样品为对照组,并以100μl pbs缓冲液(或mrs肉汤培养基)和无水乙醇混
[0136]
合液空白调零。每个样品重复3次,求平均值。
[0137]
dpph自由基清除能力(%)=[1-(as-ab)/ac]*100
[0138]
式中:as——样品组吸光度;ab——空白组吸光度;ac——对照组吸光度。
[0139]
所得结果如下表3所述:
[0140]
表3、瑞士乳杆菌zjuids12的抗氧化活力
[0141][0142]
*代表差异显著,p《0.05;**代表差异显著,p《0.01。
[0143]
如表3所示,本发明筛得的瑞士乳杆菌zjuids12发酵上清液的总抗氧化能力、还原能力以及dpph自由基均显著高于标准菌株atcc53103。从而说明瑞士乳杆菌zjuids12发酵上清液和菌悬液具有高效的抗氧化能力。
[0144]
实施例5、瑞士乳杆菌zjuids12的抑制幽门螺旋杆菌能力的确认
[0145]
1、幽门螺旋杆菌atcc43504的培养
[0146]
取100μl幽门螺旋杆菌涂布于哥伦比亚血琼脂培养基进行活化培养,培养条件为微需氧环境中(7%氧气、10%二氧化碳、83%氮气),37℃,培养72~96h。在固体培养基中活化一代后挑取单菌落继续划线传代三代,挑取纯化培养后的单菌落接入幽门螺旋杆菌液体培养基中,液体培养条件与固体培养条件相同。液体培养后的混合液于8000rpm,15min,4℃条件下离心,分别收集上清液和幽门螺旋杆菌菌体沉淀。菌体沉淀用干净的幽门螺旋杆菌液体培养基洗涤两次并重悬,使活菌数达到107cfu/ml。
[0147]
2、试验菌株的培养
[0148]
将分离出的纯化菌体zjuids12从-80℃冰箱取出,放置室温中解冻,挑取少量甘油管中菌液于mrs固体培养基上活化,24h后挑取mrs固体培养基上的乳酸菌单菌落再划线传代3次。将最后一次活化的单菌落接于mrs液体培养基中,37℃静置培养24h后取出,8000rpm,15min,4℃离心,分别收集上清液和沉淀。上清液采用0.22μm的过滤器除菌,菌体沉淀用无菌pbs洗涤两次并重悬,使活菌数达到108cfu/ml。
[0149]
3、菌株对幽门螺旋杆菌的生长抑制实验
[0150]
采用琼脂扩散法来测量本试验所筛选的菌株对幽门螺旋杆菌的抑菌活性。制备哥伦比亚血琼脂培养基,并于培养基冷却至55℃左右时倒入事先放置无菌牛津杯的培养皿中,每皿定量加入15ml培养基,待培养基冷却后轻轻用灭菌镊子拔掉牛津杯。
[0151]
取100μl幽门螺旋杆菌的菌悬液均匀涂布于不含抗生素的哥伦比亚血琼脂平板
上,每孔加入待测液体100μl。将接好发酵液的平板置于37℃、微需氧环境下培养72~96h,培养结束后,用游标卡尺测量抑菌圈直径。
[0152]
4、菌株抑制尿素酶活性的测定
[0153]
取40μl幽门螺旋杆菌菌悬液分别与10μl试验菌株的发酵上清液/乳酸菌菌悬液混匀,空白对照使用10μl的无菌幽门螺旋杆菌液体培养基。吸取50μl混合液加入至干净无菌的96孔板中,37℃、微需氧环境培养48h。将培养好的混合液体取出,每个孔内加入150μl的尿素酶试剂,观察颜色变化并测定其od550的数值。
[0154]
尿素酶指示剂配方为:0.9%nacl,20mmol/l尿素,14μg/ml苯酚红,用hcl调至ph为6.8。
[0155]
瑞士乳杆菌的幽门螺旋杆菌抑制率和尿素酶活性如下表4所示:表4中结果显示zjuids12菌体及发酵上清具有良好的幽门螺旋杆菌抑制率,和抑制尿素酶活性。
[0156]
表4、菌株的胆盐水解酶测定结果
[0157][0158][0159]
注:阴性对照为等普通的瑞士乳杆菌;阳性对照为0.05mg/ml的甲硝唑溶液;-为未测量组;同一列中的平均值标有*表示差异显著(*p《0.05;**p《0.01)。
[0160]
实施例6、瑞士乳杆菌zjuids12的胆盐水解酶活力的确认
[0161]
1、瑞士乳杆菌zjuids12产胆盐水解酶定性测定
[0162]
在新鲜配制的mrs琼脂培养基中添加0.3%(m/v,即,3g/1000ml)脱氧牛磺胆酸钠、0.2%(m/v)巯基乙酸钠、0.37g/l cacl2,将其完全溶解。于121℃灭菌15min,倾倒入无菌平板中,待凝固后把无菌滤纸片均匀放入平板中,在滤纸片上滴加10μl瑞士乳杆菌zjuids12菌悬液(约108cfu/ml),以滴加10μl的无菌磷酸盐缓冲液为空白对照。将平板于厌氧罐(oxoid)中37℃厌氧培养72h。若滤纸片周围有白色沉淀物则认为有胆盐水解酶活性。
[0163]
说明:将实施例2所得的zjuids04菌体利用pbs缓冲液(0.2m,ph 7.0)进行重悬,从而获得zjuids04菌悬液(约108cfu/ml)。
[0164]
2.瑞士乳杆菌zjuids12胆盐水解酶活力的定量测定
[0165]
瑞士乳杆菌zjuids12瑞士乳杆菌zjuids12菌体和菌悬液的制备参考实例2,取0.1ml瑞士乳杆菌zjuids12的菌体破碎上清溶液,向其中加入1.8ml 0.1mol/l的pbs缓冲溶液(0.2m,ph 7.0)和0.1ml的6mmol/l牛磺胆酸钠。这些混合物在37℃培养30min,之后加入0.5ml 15%的三氯乙酸终止酶促反应。将其进行离心,取0.5ml上清液加入1ml的茚三酮显色液。将其旋涡震荡混匀,煮沸35min。冷却后测定其在570nm处的吸光度值。一个胆盐水解
酶活力单位定义为每分钟从底物释放1μmol牛磺酸所需要的酶的量。
[0166]
以鼠李糖乳杆菌(lactobacillus rhamnosus)atcc53103作为阳性对照,进行上述胆盐水解酶活力的测定。蛋白质浓度的测定采用牛血清蛋白作为标准品,所有实验重复3次。
[0167]
表5为两株菌的胆盐水解酶活性定量测定结果。从表5中可以看出,这两株菌的胆盐水解酶活力均在1.0u/mg以上,实验结果表明,瑞士乳杆菌zjuids12具有较高的胆盐水解酶活力。
[0168]
表5、菌株的胆盐水解酶测定结果
[0169][0170][0171]
注: 表示产生沉淀圈,-表示不产生沉淀圈。
[0172]
胆盐水解酶可将体内结合型胆盐水解为游离型胆盐,而游离型胆盐不参与肝肠循环,随粪便排出体外,因而胆盐水解酶活性是降低体内血糖的关键因素。本发明所提供的瑞士乳杆菌zjuids12具有较强的胆盐水解酶活力。
[0173]
实施例7、瑞士乳杆菌zjuids12的耐酸性及耐胆盐性的确认
[0174]
1.耐酸实验
[0175]
挑取瑞士乳杆菌zjuids12单菌落在mrs液体培养基中37℃扩大培养18h,将扩大后菌悬液以1%的量接种到mrs液体培养基,37℃培养18h后。将培养液于4℃经8000r/min离心5min收集菌体,用pbs缓冲液(ph 6.8,0.1mol/l)洗涤2次后。菌体悬浮于已事先调节ph为3.0的mrs液体培养基中,将初始活菌数校正至大约108cfu/ml,37℃培养3h。采用倾注平板法对0h和3h样品中的活菌进行计数,倾注后的平板于37℃培养48h,测定其存活率,存活率计算公式如下:
[0176][0177]
上式中,n0为测试菌株0h的活菌数(cfu/ml);n
t
为测试菌株3h的活菌数(cfu/ml)。
[0178]
2.耐胆盐实验
[0179]
将活化扩大后的瑞士乳杆菌zjuids12菌悬液以1%的量接种到mrs液体培养基中,于37℃培养18h后,漩涡混匀,将初始活菌数校正至大约109cfu/ml。以10%的量接种到含0.3%(m/v)牛胆盐的mrs液体培养基(对照为不含牛胆盐的mrs液体培养基),于37℃培养3h。然后采用倾注平板法对样品中的活菌数进行计数。倾注后的平板于37℃培养48h。菌株的胆盐耐受能力以3h时每毫升含胆盐培养基中活菌数与不含胆盐培养基中活菌数的差值的对数来表示(log cfu/ml)。
[0180]
以鼠李糖乳杆菌(lactobacillus acidophilus)atcc53103作为对照,进行上述耐酸、耐胆盐性能测定。
[0181]
如表6所示,瑞士乳杆菌zjuids12的耐酸耐胆盐性能明显优于对照菌株atcc53103。其在ph为3.0的mrs培养基中的存活率高达101.51%。在含有0.3%的牛胆盐的
环境中活菌数仍达到4*106cfu/ml以上,说明其具有较好的胆盐耐受性。实验证明,瑞士乳杆菌zjuids12具备较高的胃肠道生存能力。
[0182]
表6、菌株对酸和胆盐耐受性结果
[0183][0184]
益生菌必须能够耐受胃肠道中胃酸和胆汁等一系列不良环境而活着才能发挥其益生作用。本发明提供的瑞士乳杆菌zjuids12在ph 3.0的条件下能够生长增殖,其能顺利通过胃中的酸性环境到达小肠。同时,瑞士乳杆菌zjuids12能耐受胆盐,其能在肠道内存活,进而能有效地改善肠道菌群进而发挥降血糖作用。
[0185]
实施例8、瑞士乳杆菌zjuids12疏水能力的确认
[0186]
1.疏水性的测量
[0187]
用干净的pbs缓冲液(0.1mol/l,ph 6.8)洗涤乳酸菌体沉淀两次,重悬使od
610
的吸光度约为0.5左右,得乳酸菌悬液;培养基菌悬液制备同上。
[0188]
取2ml乳酸菌悬液和2ml二甲苯彻底混合,37℃水浴充分震荡5min后,并于0h、2h后分别测量水相的od
610
吸光值。
[0189][0190]
a0=0h的吸光值,a
t
=th的吸光值。
[0191]
所得结果如下表7所示。
[0192]
表7、不同菌株的表面疏水性(%)
[0193]
菌株疏水性瑞士乳杆菌zjuids1225.87
±
0.51%鼠李糖乳杆菌atcc5310312.31
±
1.15%
[0194]
2.结果分析
[0195]
经测量,瑞士乳杆菌zjuids12的疏水性在25.87%,显著高于对照标准菌株。表明该菌株具有较强的粘附能力,可粘附到人的肠道,改善肠道菌群的健康。
[0196]
实施例9、瑞士乳杆菌zjuids12的抗生素感受性的确认
[0197]
将培养18h的浓度约为107cfu/ml瑞士乳杆菌zjuids12菌悬液按1%的量加入冷却至45℃左右的灭过菌的mrs琼脂培养基中,充分混合,定量加入15ml/皿。待凝固后,用镊子取药敏纸片放于培养基上。将培养皿正面朝上放于37℃培养箱中培养24h。以无抗生素的纸片为空白对照。测量抑菌圈直径。每个重复三次。
[0198]
瑞士乳杆菌zjuids12对抗生素感受性抑菌圈直径如表8所示。参考clsi(2017)药敏试验标准可得,瑞士乳杆菌zjuids12对青霉素g、氨苄青霉素、头孢唑林、丁胺卡那、庆大霉素、红霉素、复方新诺明和氯霉素呈现敏感性。对于环丙沙星、氟哌酸呈现中介。实验结果表明,瑞士乳杆菌zjuids12对常见的抗生素敏感。
[0199]
表8、瑞士乳杆菌zjuids12对抗生素敏感性结果
[0200][0201]
注:s,敏感;i,中介;r,耐药
[0202]
随着抗生素在临床治疗的广泛应用,乳酸菌的耐药性也越来越严重,长期摄入耐药性的乳酸菌会给临床治疗带来很大的困难。本发明所提供的瑞士乳杆菌zjuids12对常见的抗生素敏感,不会对人体健康造成危害。
[0203]
实施例10、瑞士乳杆菌zjuids12的病原菌抑制能力的确认
[0204]
采用国际通用琼脂扩散法测定乳酸菌抗菌活性。将10ml lb琼脂培养基倒入无菌培养皿中,冷却后做为下层培养基。将培养18h菌浓度约为107cfu/ml指示菌菌悬液按1%的量加入冷却至45℃左右的灭过菌的lb琼脂培养基中,充分混合,定量加入10ml/皿。在上面摆放灭过菌的的牛津杯。待上层培养基冷凝后,轻轻拔掉牛津杯。定量以100μl/孔加入瑞士乳杆菌zjuids12发酵上清液样品,并且以pbs缓冲液(0.1mol/l,ph 6.8)作为对照。挑选出小孔周围有明显抑菌圈的菌株,测量抑菌圈直径,每个重复三次。
[0205]
如表9所示,瑞士乳杆菌zjuids12的代谢产物对金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌以及单增李斯特等致病菌均有一定的抑制作用,并优于atcc53103的抑菌效果。可见这株菌的代谢产物具有抑菌特性。
[0206]
表9、菌株对病原菌抑制能力的结果
[0207][0208]
金黄色葡萄球菌是人类化脓感染中最常见的病原菌,一些大肠杆菌可引起严重腹泻和败血症,一些沙门氏菌种也会引起人类食物中毒。乳酸菌代谢产生的细菌素、有机酸、
过氧化氢等抑菌物质均能单独或共同地抑制这些致病菌的生长。本发明所提供的瑞士乳杆菌zjuids12的代谢产物对这三种致病菌具有一定的拮抗作用,这对其维持肠道微生态平衡发挥重要作用,并起到健康促进效果。
[0209]
实施例11、利用瑞士乳杆菌zjuids12制备功能性发酵酸奶1.酸奶的加工工艺流程:
[0210]
原料
→
预热
→
均质
→
调配
→
杀菌
→
冷却
→
制备接种
→
发酵
→
后熟
→
冷藏
[0211]
2.操作要点
[0212]
(1)原料:2l全脂uht灭菌乳或鲜牛乳;
[0213]
(2)预热:放入容器中加热至63℃,
[0214]
(3)均质:倒入均质机中均质,压力为15-25mpa),混合液倒入铁罐中,同时加入100g白糖,于90℃水浴环境杀菌10min,。
[0215]
(4)调配:牛乳中加入配料,并溶解
[0216]
(5)杀菌:加糖牛乳在90℃水浴里杀菌10min,
[0217]
(6)冷却:杀菌后的牛乳,冷却至40-50℃备用,
[0218]
(7)制备发酵剂:瑞士乳杆菌zjuids12菌种在无菌环境下,接种于装有灭菌脱脂乳(12%,w/v)的试管中,于37℃条件下培养20小时。每次传代接种量为2-4%(v/v),传代2~3次以恢复活力,放置于4℃冰箱中保存。
[0219]
(8)接种、发酵:在无菌条件下,接入活化好的瑞士乳杆菌zjuids12,接种量为2-4%(v/v)。在42℃条件下恒温发酵6-10h。
[0220]
(9)后熟:发酵结束后,放入4℃冰箱中后熟12-24h。
[0221]
(10)灌装、冷藏:后熟完成后,灌装到250ml的灭菌玻璃瓶中,送至冷库冷藏。
[0222]
实施例12、利用瑞士乳杆菌zjuids12制备功能性发酵果蔬汁
[0223]
1.发酵果蔬汁的加工工艺流程
[0224]
原料
→
清洗
→
闪蒸
→
打浆
→
调配
→
均质
→
灭菌
→
冷却
→
接种
→
密闭发酵
→
后熟
→
灌装
→
冷藏
[0225]
2.操作要点
[0226]
(1)原料:选取新鲜的南瓜和火龙果。
[0227]
(2)清洗切块:清洗、去皮(南瓜去瓤)、切成小块。
[0228]
(3)闪蒸:采用闪蒸的方法灭酶,0.5~1min,121℃处理,迅速排气。
[0229]
(4)打浆:按照南瓜∶水(重量比)=1∶1的比例,将南瓜和水适量的逐渐放入胶体磨中研磨,进行粗磨和细磨各一次。将火龙果用打浆机打浆至果肉均匀无块状。
[0230]
(5)调配、均质:按南瓜汁15%,火龙果汁30%,再用蔗糖调节可溶性固形物含量至10
°
brix,加入0.2%的稳定剂cmc混合均匀,采用两段均质法,先低压(15mpa),后高压(25mpa),使瓜肉颗粒直径粒径为2~3μm。
[0231]
(6)灭菌、冷却:调配好的复合果蔬汁在100℃下保温10min,冷却至40℃左右。
[0232]
(7)接种、发酵:在无菌条件下,接入活化好的瑞士乳杆菌zjuids12,初始菌数控制在107cfu/ml。在37℃条件下恒温发酵24h。
[0233]
(8)后熟:发酵结束后,放入4℃冰箱中3h。
[0234]
(9)灌装、冷藏:后熟完成后,灌装到250ml的灭菌玻璃瓶中,送至冷库冷藏。
[0235]
实施例13、利用瑞士乳杆菌zjuids12制备菌粉
[0236]
1.瑞士乳杆菌zjuids12菌泥的制备
[0237]
挑取瑞士乳杆菌zjuids12单菌落接种于50ml mrs液体培养基中,放置37℃培养箱中培养18h。再次按5%的接种量于250ml mrs液体培养基中活化,放置37℃培养箱中培养24h。最后将活化好的瑞士乳杆菌zjuids12以5%接种量于10l发酵罐中进行高密度厌氧培养,于37℃、ph 6.8的条件下培养18h。之后在8000r/min、4℃条件下离心15min,弃去上清液,收集菌体沉淀,用无菌磷酸盐缓冲液(ph 7.0)漂洗菌体2次。即可得到瑞士乳杆菌zjuids12菌泥。
[0238]
2.保护剂的制备
[0239]
冻干保护剂含有15%的脱脂乳粉,5%的海藻糖,3%的谷氨酸钠,1%的甘油,0.5%的半胱氨酸盐酸盐。水作为溶剂。于110℃灭菌备用。
[0240]
3.瑞士乳杆菌zjuids12菌粉的制备
[0241]
将上述制备的瑞士乳杆菌zjuids12菌体沉淀按1:5的比例与保护剂溶液充分混匀。于-40℃条件下预冻5h,使其均匀冻结在容器内壁上,然后进行真空冷冻干燥,干燥18~20h后,即可得到瑞士乳杆菌zjuids12菌粉。用生理盐水复水后,洗涤两次,测得瑞士乳杆菌zjuids12菌粉中活菌数约为1.0
×
10
11
~1
×
10
12
cfu/g。
[0242]
实施例14、利用瑞士乳杆菌zjuids12制备宠物益生菌奶粉
[0243]
1.瑞士乳杆菌zjuids12菌粉的制备
[0244]
参照实施例13制备瑞士乳杆菌zjuids12菌粉冻干菌粉,菌粉中活菌数约为1.0
×
10
11
~1
×
10
12
cfu/g。
[0245]
2.宠物配方粉的制备
[0246]
原料初选:奶粉、鱼粉、骨粉、谷物、植物油,添加剂:维生素、微量元素、功能因子、其他;
[0247]
自动配料:按照配方将得到的物料原料投入物料仓;
[0248]
粉碎:将称量好的物料通过粉碎机粉碎;
[0249]
混合:粉碎的物料再添加植物油和微量元素,加入到混合机混合均匀;
[0250]
膨化:混合好的物料通过膨化机制成颗粒物料
[0251]
烘干:混合好的物料通过烘干机烘干,温度控制在65-70度
[0252]
分级筛选:将物流通过分级筛,颗粒控制在2.5-5毫米
[0253]
3.宠物益生菌配方粉的制备
[0254]
将1制备的菌粉和2制备的宠物饲料按照1:100的比例混合均匀,最终产品中的出厂的活菌在108cfu/g以上。产品灌装后,入库保存销售。
[0255]
实施例15、利用瑞士乳杆菌zjuids12制备后生元
[0256]
1.瑞士乳杆菌zjuids12菌泥的制备
[0257]
挑取瑞士乳杆菌zjuids12单菌落接种于50ml mrs液体培养基中,放置37℃培养箱中培养18h。再次按5%的接种量于250ml mrs液体培养基中活化,放置37℃培养箱中培养24h。最后将活化好的瑞士乳杆菌zjuids12以5%接种量于10l发酵罐中进行高密度厌氧培养,于37℃、ph 6.8的条件下培养18h。之后在8000r/min、4℃条件下离心15min,弃去上清液,收集菌体沉淀,用无菌磷酸盐缓冲液(ph 7.0)漂洗菌体2次。即可得到瑞士乳杆菌
zjuids12菌泥。
[0258]
2.瑞士乳杆菌zjuids12后生元的制备
[0259]
收集到的瑞士乳杆菌zjuids12菌泥、菌体或者发酵液,采用高温灭菌121℃高温高压灭活15min后收集灭活菌泥、菌体或者发酵液,真空包装或者无菌灌装后直接使用或者添加到其他产品中应用。
[0260]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
