1.本发明涉及免疫检测技术领域,特别涉及用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法。
背景技术:
2.呼吸道感染包括鼻、咽、喉、气管、支气管及肺部的感染性炎症,以喉为界分为上呼吸道感染和下呼吸道感染。大多数呼吸道感染都是上呼吸道感染,据统计90%以上都是由病毒引起,少数为细菌。下呼吸道感染由病毒、细菌、支原体、衣原体等微生物引起,临床主要表现为急性气管/支气管炎、慢性肺炎、支气管扩张等,其治疗时必须明确引起感染的病原体以选择有效的治疗方案。而一种病原体可引起多种临床症状,同一临床表现可由多种病原体引起,不是所有的临床症状都能准确的判断,据统计,呼吸道感染者中,存在部分复合感染的比例约20%,单一的病毒或者细菌等病原体的检测已不能辅助临床更准确的判断。
3.目前常用实验室病原体的检测方法主要有电镜法、分离培养法、抗原的测定、特异性抗体检测和分子生物学法。其中电镜检测病毒颗粒可在一定程度上鉴别病原体,但该检查方法需较长的时间,但阳性率不高、时间较长,不适合临床快速诊断。分离培养法检测时间较长,标本内所含病毒数量少时会出现假阴性,且有较高的要求,如取材、环境、操作技术等,在临床上并未普及。抗原的测定能够明确感染证据,快速检测,但是其敏感性低;而特异性抗体的检测虽然特异及敏感性高,但是对于感染早期检测有窗口期,不能及时辅助诊断;分子生物学的方法虽然敏感性高,检测快速,但对实验环境要求高,不易推广。
技术实现要素:
4.为了解决现有技术中存在的上述问题和缺陷的至少一个方面,本发明提供了一种用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法。所述技术方案如下:
5.本发明的一个目的是提供了一种用于多病原体联检的直接免疫荧光检测试剂盒的制备方法。
6.本发明的另一目的是提供了一种用于多病原体联检的试剂盒。
7.本发明的还一目的是提供了一种多病原体的联检方法。
8.根据本发明的一个方面,提供了一种用于多病原体联检的直接免疫荧光检测试剂盒的制备方法,制备方法包括以下步骤:
9.提供用于多病原体联检的病原体对照玻片和空白玻片;
10.提供样本稀释液;
11.提供用于清洗载有样本的病原体对照玻片的浓缩洗涤液;
12.提供荧光素结合物;和
13.提供荧光抗体稀释液;
14.其中,所述荧光抗体稀释液的组成成分包括:0.1%~0.5%的磷酸氢二钠、 0.01%~0.05%的磷酸二氢钠、0.5%~1.5%的氯化钠、0.01%~0.05%的氯化钾、2%~8%的双糖、10%~30%的甘油、0.05%~0.3%的酪蛋白钠盐、5%~20%的牛血清、 0.01%~0.1%吐温20、0.01%~0.1%的tritonx-100、0.005%~0.03%的伊文思蓝、 0.01%~0.05%的庆大霉素、0.05%~0.5%的4-氨基安替比林和0.005%~0.03%的 pc-300。
15.具体地,所述0.1%~0.5%的磷酸氢二钠为0.2%~0.4%的十二水磷酸氢二钠,所述0.01%~0.05%的磷酸二氢钠为0.02%~0.04%的二水磷酸二氢钠,所述2%~8%的双糖为4%~7%的蔗糖。
16.优选地,所述荧光素结合物为通过荧光素标记的单克隆抗体,
17.在检测抗原时,将所述荧光抗体稀释液稀释所述荧光素结合物,使所述荧光抗体稀释液中含有所述荧光素结合物的浓度为10~200μg/ml。
18.具体地,所述病原体对照玻片通过以下方法制备得到,所述方法包括以下步骤:
19.步骤s1将多种病原体分别进行细胞传代培养;
20.步骤s2将多种病原体中的至少两种传代细胞分别制成细胞悬液;
21.步骤s3将制成的细胞悬液分别施加于同一载玻片上的不同载玻孔中,待所述不同载玻片孔中的细胞悬液中的细胞均吸附后,在相同的条件下固定所述不同载玻片孔中的细胞;
22.所述多种病原体包括从呼吸系统感染病原体和生殖系统感染病原体中的任意一种病原体及其它们的组合,
23.在步骤s3中,所述相同的条件为在相同的温度条件下使用无水乙醇固定相同的时间,之后在湿度小于50%的同一湿度环境下干燥相同的时间形成所述病原体对照玻片。
24.优选地,所述相同的温度条件为环境温度选自范围23℃~27℃之间的同一温度,所述固定相同的时间是固定时间选自范围30min~3h之间的同一时间,所述干燥相同的时间是干燥时间选自范围30min~3h之间的同一时间。
25.更加优选地,所述相同的温度条件是25℃,所述固定相同的时间是1h,所述干燥相同的时间是2h,所述无水乙醇为-20℃无水乙醇,
26.所述湿度小于50%的同一湿度是选自范围10%~20%之间的同一湿度,
27.在步骤s2中,细胞悬液的制备包括细菌悬液的制备和感染非细菌的细胞悬液的制备。
28.具体地,所述细菌悬液的制备包括以下步骤:
29.将传代培养的细菌细胞放入无菌生理盐水中制成细菌悬液;
30.感染非细菌的细胞悬液的制备包括以下步骤:
31.步骤s21将多种病原体中的至少两种传代细胞分别用浓度范围在0.1%~0.5%之间的胰酶消化分离,待所述至少两种传代细胞脱离培养器皿的底时停止消化分离并吸出所述胰酶;
32.步骤s22将消化分离后的至少两种传代细胞分别置于湿度≥90%且温度 37℃、co2浓度为5%的co2培养箱中吸附1h~3h;
33.步骤s23将吸附后的至少两种传代细胞的补充浓度范围在5%~20%的胎牛血清
培养基,之后继续在湿度≥90%且温度37℃、co2浓度为5%的co2培养箱中感染细胞24h~96h,直至至少两种传代细胞中所有的病原体细胞均发生病变;
34.步骤s24将发生病变的至少两种传代细胞分别用浓度范围在0.1%~0.5%之间的胰酶消化分离,待所述至少两种感染的病原体细胞脱离培养器皿的底部时加入浓度范围在1%~5%之间的胎牛血清培养基停止消化,形成细胞悬液。
35.具体地,所述感染非细菌的细胞悬液的制备包括以下步骤:
36.将所述多种病原体的细胞分别加入多种病原体中对应的病原体传代细胞中感染预定时间;
37.将多种病原体中的至少两种转染的病原体细胞分别进行细胞消化分离以确保细胞活力,将消化分离后的至少两种转染的病原体细胞继续培养至细胞发生病变,之后将发生病变的至少两种转染的病原体细胞制成细胞悬液;
38.其中,多种病原体的原代细胞不包括细菌细胞,
39.原代细胞与传代细胞的数量比例范围在1:2~1:1之间,感染预定时间的范围为24h~72h。
40.根据本发明的另一方面,提供了一种用于多病原体联检的试剂盒,其中,
41.所述试剂盒为根据上述任一项所述的用于多病原体联检的直接免疫荧光试剂盒的制备方法制得。
42.根据本发明的还一方面,提供了一种多病原体的联检方法,所述联检方法包括以下步骤:
43.提供试剂盒,所述试剂盒为上述的试剂盒;
44.配置所述试剂盒中的浓缩洗涤液并预处理样本;
45.将预处理后的样本分别加入至病原体对照玻片上的不同载玻片孔中,之后放入湿盒并在温度范围在4℃~37℃之间的环境中温育20min~12h;
46.将所述试剂盒中的所述荧光抗体稀释液稀释标记后的单克隆抗体;
47.使用配置后的浓缩洗涤液清洗温育后的病原体对照玻片,之后在清洗后的病原体对照玻片的不同载玻片孔中加入含有单克隆抗体的荧光抗体稀释液,然后将病原体对照玻片放入湿盒并在温度范围在4℃~37℃之间的环境中温育 20min~12h,获得能够判读结果的病原体对照玻片,
48.所述能够判读结果的病原体对照玻片中阳性结果为第一颜色,阴性结果为第二颜色,所述第一颜色与第二颜色为不同的两种颜色。
49.根据本发明的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法具有以下优点中的至少一个:
50.(1)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法中的荧光抗体稀释液组成成分具有广谱性和良好的兼容性,不会因为检测抗原的不同而需要调整,且同一荧光抗体稀释液可满足所有抗原基片的检测;
51.(2)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法采用直接免疫荧光法,可以减少间接法中二抗非特异性反应,而提高其特异性;
52.(3)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法中的试剂盒具有良好的特异性,结果判定无需加封闭剂,缩短操作时间;
53.(4)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法能够在同一反应条件下,将含两种或两种以上的病原体如病毒、细菌、支原体等不同种类的病原微生物固定于同一病原体对照玻片上,使得在联检过程中能够同步完成多种疑似病原体鉴别诊断,一次性操作即可获得多个结果;
54.(5)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法中的病原体对照玻片制备过程中无生化提纯步骤,且能够通过荧光双色显影进行结果判读,避免了非特异荧光的干扰;
55.(6)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法中的病原体对照玻片制备中,细胞无需使用封闭剂包被即可使抗原吸附至载玻片上,同时还能保证在不同种类的病原体之间不会发生交叉反应,并且大大缩短了制备病原体对照玻片的时间。
附图说明
56.本发明的这些和/或其他方面和优点从下面结合附图对优选实施例的描述中将变得明显和容易理解,其中:
57.图1是根据本发明的一个实施例的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法的流程图;
58.图2是图1所示的用于多病原体联检的病原体对照玻片的制备方法流程图;
59.图3是使用图1所示的制备方法制得的试验盒进行多病原体的联检方法的流程图。
具体实施方式
60.下面通过实施例,并结合附图,对本发明的技术方案作进一步具体的说明。在说明书中,相同或相似的附图标号指示相同或相似的部件。下述参照附图对本发明实施方式的说明旨在对本发明的总体发明构思进行解释,而不应当理解为对本发明的一种限制。
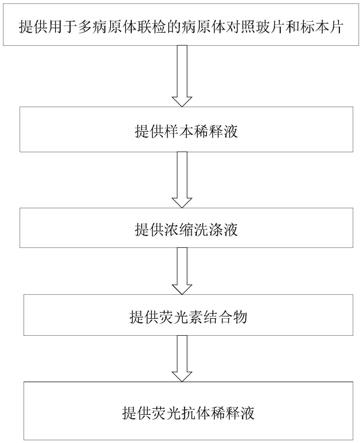
61.参见图1,其示出了根据本发明的一个实施例的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法,所述制备方法包括以下步骤:
62.提供用于多病原体联检的病原体对照玻片;
63.提供用于多病原体联检的标本片;
64.提供样本稀释液;
65.提供用于清洗载有样本的病原体对照玻片的浓缩洗涤液;
66.提供荧光素结合物;
67.提供有效量的单克隆抗体;和
68.提供荧光抗体稀释液;
69.其中,所述荧光抗体稀释液的组成成分包括:0.1%~0.5%的磷酸氢二钠、 0.01%~0.05%的磷酸二氢钠、0.5%~1.5%的氯化钠、0.01%~0.05%的氯化钾、2%~
8%的双糖、10%~30%的甘油、0.05%~0.3%的酪蛋白钠盐、5%~20%的牛血清、 0.01%~0.1%吐温20、0.01%~0.1%的tritonx-100、0.005%~0.03%的伊文思蓝、 0.01%~0.05%的庆大霉素和0.005%~0.03%的pc-300。
70.在一个示例中,所述荧光素结合物为通过荧光素标记的单克隆抗体,在检测抗原时,将所述荧光抗体稀释液稀释所述荧光素结合物,使所述荧光抗体稀释液中含有有效量的所述荧光素结合物,该有效量的荧光素结合物的浓度为 10~200μg/ml,例如20μg/ml、40μg/ml、80μg/ml、100μg/ml、130μg/ml、150μg/ml、 170μg/ml等等。
71.在一个示例中,所述0.1%~0.5%的磷酸氢二钠为0.2%~0.4%的十二水磷酸氢二钠,所述0.01%~0.05%的磷酸二氢钠为0.02%~0.04%的二水磷酸二氢钠,所述 2%~8%的双糖为用于保护抗原抗体活性的4%~7%的蔗糖,酪蛋白钠盐为用于保护抗体活性及封闭非特异的casein-na。
72.在一个示例中,抗原检测荧光抗体稀释液组成成分由0.3%~0.38%的十二水磷酸氢二钠、0.022%~0.03%的二水磷酸二氢钠、0.7%~0.98%氯化钠、 0.015%~0.025%的氯化钾、4.5%~6%的蔗糖、15%~25%的甘油、0.08%~0.25%的casein-na、8%~15%的牛血清、0.03%~0.08%的吐温20(即tween-20)、0.02%~0.07%的tritonx-100、0.007%~0.02%的伊文思蓝、0.07%~0.3%的4-氨基安替比林、 0.01%~0.035%的8万的庆大霉素和0.007%~0.02%的pc300组成。
73.在一个示例中,荧光素结合物为通过荧光素标记的单克隆抗体,所述吸附剂为igg单克隆抗体。所述荧光素包括异硫氰荧光素(fitc)和藻红蛋白(pe),浓缩洗涤液为磷酸盐缓冲液。优选地,所述荧光素结合物为通过fitc标记的抗人igm单克隆抗体,所述吸附剂为鼠人igg单克隆抗体。本示例是一种说明性示例,本领域技术人员可以采用其它具有相同作用的荧光素、荧光素结合物、吸附剂、浓缩洗涤液替代对应的试剂,本示例不应当理解为对本发明的一种限制。
74.在一个示例中,在检测抗原时,将所述荧光抗体稀释液稀释所述荧光素结合物,使所述荧光抗体稀释液中含有所述荧光素结合物的浓度为10~200μg/ml。本领域技术人员可以明白,根据标记fitc抗体的效价不同,被标记后的单克隆抗体(即荧光素结合物)浓度将有所不同,但只需要将其控制在10~200μg/ml 的范围中即可。
75.在一个示例中,样本稀释液为磷酸盐缓冲液(pbs),包括10mm磷酸二氢钠-磷酸氢二钠系统,其中含0.9%nacl且ph值为7.2,冲洗细胞,并加入了 0.5%的triton以增加细胞通透性。
76.在一个示例中,用于多病原体联检的试剂盒的制备方法还包括提供阳性对照和阴性对照,阴性对照可以选择为10%的正常人体血清,阳性对照为同一载玻片上的所有载玻片孔中的病原体。
77.在一个示例中,病原体对照玻片是将不同种类的病原体阳性细胞在同一反应条件下固定而成,其包括含有阳性对照细胞的点样孔(即载玻片孔)和含有阴性对照细胞的点样孔(即载玻片孔)。
78.在一个示例中,标本片为病原体空白玻片,其是通过预处理后的空白无污染的玻片。
79.如图2所示,试剂盒中所使用的病原体对照玻片通过以下方法制备,具体方法包括
以下步骤:
80.步骤s1将多种病原体分别进行细胞传代培养;
81.步骤s2将多种病原体中的至少两种传代细胞分别制成细胞悬液;
82.步骤s3将制成的细胞悬液分别施加于同一载玻片上的不同载玻片孔中,待所述不同载玻片孔中的细胞悬液中的细胞均吸附后,在相同的条件下固定所述不同载玻片孔中的细胞(即在不同的载玻片孔中固定有不同种类的抗原)。
83.在一个示例中,所述多种病原体包括从呼吸系统感染病原体和生殖系统感染病原体中选择的任意一种病原体中的至少两种病原微生物。所述病原微生物包括病毒、细菌、支原体、衣原体、真菌、螺旋体和立克次体。例如,呼吸系统感染病原体中的至少两种病原微生物包括肺炎支原体、肺炎衣原体、甲型流感病毒、乙型流感病毒、呼吸道合胞疱疹病毒、嗜肺军团菌等等中的两种或两种以上的任意组合。也就是说,在同一生理功能系统(例如在同一呼吸系统,或者在同一生殖系统)中,病毒、细菌、衣原体、支原体等等中的两种或两种以上的任意组合。
84.在一个示例中,所述多种病原体也可以包括从呼吸系统感染病原体和生殖系统感染病原体中选择的任意一种病原体中的具体的某一类病原微生物下的具体分类之间的任意组合。例如呼吸系统感染病毒下的具体分类中的两种及其以上的任意组合,生殖系统感染细菌下的具体分类中的两种及其以上的任意组合。
85.在一个示例中,在步骤s3中,所述相同的条件为在相同的温度条件下使用无水乙醇固定相同的时间,之后在湿度小于50%的同一湿度环境下干燥相同的时间形成所述病原体对照玻片。优选地,所述相同的温度条件为选自温度范围
ꢀ‑
30℃~-10℃之间的同一温度,更加优选地温度范围为-25℃~-15℃之间,例如
ꢀ‑
25℃、-22℃、-20℃、-17℃或-15℃,特别优选地相同的温度条件可以为-20℃。换句话说,当环境温度设置在23℃~27℃之间,湿度保持在10%~20%之间(优选地湿度为15%),通过选择-20℃无水乙醇在相同的时间下固定(例如固定1 小时)不同载玻片孔中的细胞进行,使得在不同病原体对照玻片中的细胞彼此之间不发生交叉反应,因此无需使用封闭剂进行细胞包被。同时在整个病原体对照玻片制备过程中本发明均采用的无生化提纯步骤,就能使得抗原接近于真实三维构象。
86.在一个示例中,所述固定相同的时间是固定时间选自范围30分钟(min)~3 小时(h)之间的同一时间,更加优选地时间范围为50min~1.5h,特别优选地固定相同的时间是1h。
87.在一个示例中,细胞悬液还可以通过冷丙酮在通风橱中固定,保持通风橱中的温度在20~30℃,例如25℃,湿度为10%~30%,例如15%、20%,固定时间为10~20min。当然本领域技术人员可以明白,细胞悬液还可以用1%的叠氮化钠和稳定水溶解缓冲甘油固定。由于上述细胞固定剂(即细胞封闭剂)对细胞有特异性影响,因此本发明优选为-20℃预冷的无水乙醇固定。
88.在一个示例中,优选所述干燥相同的时间是干燥时间选自范围30min~3h之间的同一时间。更加优选地干燥时间选自范围1h~2.5h之间的同一时间。特别优选地干燥相同的时间是1.5h、2h。在湿度小于50%的同一湿度是湿度是选自范围20%~40%之间的同一湿度,例如可以在湿度为20%、25%、30%、35%、40%中任一湿度环境中培养,优选地为多种病原体中所有的病原体均选择湿度为 20%~30%(例如28%或29%)的环境中培养。
89.在一个示例中,载玻片上设置有至少3个载玻片孔,所述至少3个载玻片孔中包括一个空白对照孔和固定有至少两种抗原的至少两个载玻片孔。
90.在一个示例中,在步骤s1中,细胞传代培养包括细菌细胞的传代培养和非细菌细胞的传代培养,所述非细菌细胞为不包括细菌细胞在内的其它病原体细胞,所述细菌细胞的传代培养包括以下步骤:
91.将高压灭菌后的培养基待凝固后接种细菌菌种,之后置于湿度小于50%且温度为37℃的浓度为5%的co2培养箱中培养36h~48h长成菌膜形成细菌传代细胞;
92.所述非细菌细胞的传代培养包括以下步骤:
93.步骤s11将多种病原体的原代细胞分别放入不同的培养器皿中,之后分别加入浓度范围在10%~15%之间的胎牛血清培养基,再置于湿度≥90%且温度为 37℃的浓度为5%的co2培养箱中培养第一预定时间进行复苏;
94.步骤s12将复苏的多种病原体用浓度范围在0.1%~0.5%之间的胰酶消化分离,待多种病原体的细胞脱离培养器皿的底部(例如培养瓶底部),呈现立体状时停止消化并吸出所述胰酶,并计数,之后置于湿度≥90%且温度为37℃的浓度为5%的co2培养箱中培养第二预定时间,当培养器皿中的细胞密度达到 80%-90%时,去除该培养器皿汇总的培养基,停止该培养器皿中的病原体的细胞传代培养。
95.在一个示例中,培养器皿包括培养瓶和培养皿,本领域技术人员可以根据需要进行相应的选择。
96.在一个示例中,在步骤s11中的胎牛血清的浓度可以选择为10%、15%或 20%,优选地选择浓度为10%的胎牛血清。
97.在一个示例中,在步骤s11中,所述第一预定时间的范围为24h~48h,优选地,培养48h复苏所述多种病原体的原代细胞。
98.在一个示例中,在步骤s12中,胰酶的浓度优选为0.15%、0.2%、0.25%、 0.3%,更加优选地选择浓度为0.25%的胰酶消化分离所述多种病原体细胞。
99.在一个示例中,在步骤s11和s12中,培养箱中的湿度≥90%,优选地培养箱中的湿度可以自范围95%-98%之间选择,例如95%、97%、98%。
100.在一个示例中,在步骤s12中,所述第二预定时间小于所述第一预定时间,所述第二预定时间的范围为10h~48h,优选地选择12h、15h、20h、24h、30h、 35h培养,更加优选地选择培养24h。
101.在一个示例中,细菌细胞传代培养还可以通过以下方法实现,具体包括以下步骤:将不同种类的病原体对应的专用培养基粉溶解,在120℃~130℃的温度下高压灭菌10min~20min,之后待培养基凝固,接种一定量的与专用培养基对应的病原体,例如接种lp菌种。湿度小于50%且温度为37℃的浓度为5%的co2培养箱中培养第一预定时间进行复苏;湿度小于50%且温度为37℃的浓度为5%的co2培养箱中培养24h~48h,待长出例如菌膜停止传代培养。
102.在一个示例中,在培养箱中的湿度≥90%,优选地培养箱中的湿度可以自范围95%-98%之间选择,例如95%、97%、98%。
103.在步骤s2中,细胞悬液的制备包括细菌悬液的制备和感染非细菌的细胞悬液的制备。所述细菌细胞悬液的制备包括以下步骤:将传代培养的细菌细胞放入无菌生理盐水中
制成细菌悬液。
104.感染非细菌的细胞悬液的制备包括以下步骤:
105.步骤s21将多种病原体中的至少两种传代细胞(例如在步骤s12中培养获得的传代细胞)分别用浓度范围在0.1%~0.5%之间,优选浓度为0.25%的胰酶消化分离,待所述至少两种传代细胞脱离培养器皿的底部(例如培养瓶底部),呈现立体状时停止消化分离并吸出所述胰酶;
106.步骤s22将消化分离后的至少两种传代细胞分别置于湿度≥90%,优选为湿度为96%且温度37℃的浓度为5%的co2培养箱中吸附1h~3h,优选吸附2h;
107.步骤s23将吸附后的至少两种传代细胞的补充浓度范围在5%~20%,优选浓度为10%的胎牛血清培养基,之后继续在湿度≥90%,优选为湿度为96%且温度37℃的浓度为5%的co2培养箱中感染细胞24h~48h,需根据不同的病原体细胞设定不同的感染时间(例如coxb细胞感染时间为24h),直至至少两种传代细胞中所有的病原体细胞均发生病变;
108.步骤s24将发生病变的至少两种传代细胞分别用浓度范围在0.1%~0.5%之间,优选浓度为0.25%的胰酶消化分离,待所述至少两种传代细胞脱离培养器皿的底部(例如培养瓶底部),呈现立体状时加入浓度范围在1%~5%之间的胎牛血清培养基(优选地选择2%的胎牛血清培养基)停止消化形成细胞悬液。
109.在一个示例中,在步骤s22和s23中,在培养箱中的湿度≥90%,优选地培养箱中的湿度可以自范围95%-98%之间选择,例如95%、97%、98%。
110.在一个示例中,在步骤s2中,感染非细菌的细胞悬液的制备还可以采用以下方法制成,具体包括以下步骤:
111.将所述多种病原体的原代细胞分别加入多种病原体中对应的病原体传代细胞(即在步骤s12中培养获得的传代细胞)中感染预定时间;
112.将多种病原体中的至少两种转染的病原体细胞分别进行细胞消化分离以确保细胞活力,将消化分离后的至少两种转染的病原体细胞继续培养至细胞发生病变,之后将发生病变的至少两种转染的病原体细胞制成细胞悬液。
113.其中,多种病原体的原代细胞不包括细菌细胞,即包括例如病毒、支原体、衣原体等等。
114.原代细胞与传代细胞的数量比例范围在1:2~1:1之间,优选地为1:2,即将多种病原体的传代细胞一半数量的原代细胞加入到与该原代细胞类型相同的传代细胞中接毒感染,感染的时间的范围为24h~72h,优选地为24h、48h和72h,根据病原体细胞种类的不同,选择不同的接毒感染时间。
115.参见图3,其示出了使用上述试剂盒对多病原体进行联检的方法,联检方法包括以下步骤:
116.步骤s100提供试剂盒,所述试剂盒为前述的试剂盒;
117.步骤s200配置所述试剂盒中的浓缩洗涤液并预处理样本;
118.步骤s300将预处理后的样本分别加入至病原体对照玻片上的不同载玻片孔中,之后放入湿盒并在温度范围在4℃~37℃之间的环境中温育20min~12h;
119.步骤s400将所述试剂盒中的荧光素结合物标记所述单克隆抗体,之后将所述荧光抗体稀释液稀释标记后的单克隆抗体;
120.步骤s500使用配置后的浓缩洗涤液清洗温育后的病原体对照玻片,之后在清洗后的病原体对照玻片的不同载玻片孔中加入含有单克隆抗体的荧光抗体稀释液,然后将病原体对照玻片放入湿盒并在温度范围在4℃~37℃之间的环境中温育20min~12h,获得能够判读结果的病原体对照玻片,
121.所述能够判读结果的病原体对照玻片中阳性结果为第一颜色,阴性结果为第二颜色,所述第一颜色与第二颜色为不同的两种颜色。
122.在一个示例中,所述能够判读结果的病原体对照玻片中阳性结果为第一颜色,阴性结果为第二颜色,所述第一颜色与第二颜色为不同的两种颜色。优选地,第一颜色为红色,第二颜色为绿色。
123.在一个示例中,在步骤s300中,例如温度选择4℃时,温育8h~12h;当温度选择37℃时,温育1h;当选择室温时,可以温育2h。
124.在步骤s200中,所述预处理样本包括以下步骤:
125.步骤s201将样本与所述样本等体积的所述试剂盒中的吸附剂混匀,之后在预定的转速下离心预定时间;
126.步骤s202将吸附后的样本按照预定比例加入至所述试剂盒中的样本稀释液中混匀。
127.在一个示例中,在步骤s201中,预定转速为200~700rpm,离心预定时间为3~7min,优选为5min。
128.在一个示例中,在步骤s202中,预定比例为吸附后的样本与样本稀释液的体积比范围为1:5~1:3之间,优选为1:4。
129.在一个示例中,在步骤s200中,配置所述试剂盒中的浓缩洗涤液为将所述试剂盒中的浓缩洗涤液稀释30~50倍,优选为40倍。
130.实施例1
131.1.制备用于呼吸系统感染联检的病原体对照玻片的方法包括以下步骤:
132.(1)细胞传代培养:
133.方法一病原体感染细胞培养:将待固定的鼻咽上皮细胞加入10%胎牛血清的dmem培养基,之后置于温度为37℃、湿度为90%、co2浓度为5%的co2培养箱中培养48小时复苏;然后用0.25%胰酶消化分离,吸出胰酶并计数600 万/t75,再次置于温度为37℃、湿度为90%的5%co2培养箱中培养24小时进行传代培养。
134.方法二嗜肺军团菌lp细胞培养:lp专用培养基粉末溶解后,在温度为121℃下进行高压灭菌15min,冷却后倒入平皿,使每皿约15ml培养基,待培养基凝固后,接种50ul lp菌种,置于温度为37℃、湿度为90%的5%co2培养箱中培养24-48小时,长出菌膜后停止传代培养。
135.(2)病原体感染细胞:
136.计数传代的细胞弃掉培养基,将多种病原体加入鼻咽上皮细胞中,置于温度为37℃、湿度为90%的5%co2培养箱中吸附2小时后,补充培养基至16ml,继续培养至细胞发生病变。
137.(3)细胞悬液制备:
138.方法一病原体感染的细胞病变后,用0.25%胰酶消化,加入2%胎牛血清的 dmem
培养基36ml,制成细胞悬液。
139.方法二嗜肺军团菌lp菌悬液制备:将lp菌膜刮下,放入无菌生理盐水中,吹打均匀,制成菌悬液。
140.(4)病原体固定:
141.方法一将上述病原体感染细胞悬液分别滴加于载玻片孔中,待细胞吸附后,去掉培养基,在环境温度为25℃、湿度为18%的条件下,用-20℃无水乙醇固定 1小时,晾干。
142.方法二嗜肺军团菌lp细胞悬液滴加载玻片孔,晾干即可。
143.2.用于呼吸系统感染中多病原体的联检方法中预处理样本包括以下步骤:
144.(1)将标本在涡旋混匀器上轻微混匀3下,时间控制在30s左右,浑浊后把标本移至1.5ml的ep管中,用400~600r/min的转速离心5min,去除上清液,留沉淀,加入适量的样本稀释液(例如磷酸缓冲液)约300μl),移液枪吹打使其成为细胞悬液。之后在标本片的每孔中加入15μl预处理过的细胞悬液血清。
145.(2)在病原体对照玻片的每孔中加入25μl预处理过的细胞悬液血清,同时将25μl不稀释的阳性对照和15μl不稀释的阴性对照分别加入两个不同的细胞基本孔中,放在干燥箱里干燥固定细胞1h,或室温风干,用-20℃冰箱无水乙醇固定1h。
146.(3)配置荧光抗体稀释液:将蔗糖50g、磷酸氢二钠3.63g,磷酸二氢钠 0.24g,氯化钠9g,氯化钾0.2g,酪蛋白钠盐0.5g,加蒸馏水至600ml,高压灭菌,冷却后加入无菌的胎牛血清200ml,甘油100ml,吐温-20 0.5ml,tritonx-100 0.5ml,伊文思蓝0.01g和庆大霉素0.2ml、pc300 1ml后定容至1000ml以制成荧光抗体稀释液,且其中8万的庆大霉素最终浓度为50μg/ml。
147.3.用于呼吸系统感染中多病原体的联检方法中其结果的判读方法如下:
148.终点结果确定方法:将实施例2中无水乙醇固定后的病原体对照玻片在洗液中重复洗3次,自然晾干。用荧光抗体稀释液将荧光抗体结合物内,稀释500 倍,使荧光抗体稀释液中含有荧光抗体结合物的浓度为10μg/ml,获得稀释后的荧光单克隆抗体。
149.在一个示例中,荧光抗体结合物为将20mg单克隆抗体标记fitc,透析后重悬在4ml的荧光抗体保护剂内。在一个示例中,荧光抗体保护剂为抗体偶联 fitc后的保护剂,即母液的保护剂,一般为在pbs中加入50%的甘油和10mg/ml 的bsa中获得。
150.之后,在晾干后的病原体对照玻片的每孔中加入例如15μl、20μl、25μl的稀释后的荧光单克隆抗体,之后在湿盒中37℃温育30分钟后,pbs冲洗3次,风干,即可用荧光显微镜(推荐滤光片波长为470-495nm)下观察结果。
151.结果判读具体为:
152.(1)空白对照:无绿色荧光,细胞呈现红色。
153.(2)阳性对照:rsv、adv、ifva、ifvb及piv1、2、3的细胞核、细胞浆或胞膜出现苹果绿荧光。
154.(3)阴性对照:rsv、adv、ifva、ifvb及piv1、2、3可观察到无荧光,且rsv、adv、ifva、ifvb及piv1、2、3细胞呈现红色。
155.实施例2
156.生殖系统感染常见为沙眼衣原体、解脲脲原体感染。
157.1.制备用于生殖系统感染联检的病原体对照玻片通过以下制备方法获得:
158.(1)细胞传代培养:
159.病原体感染细胞培养:将待固定的hacat细胞,用10%胎牛血清的dmem 培养基,置于温度为37℃、湿度为95%的5%co2培养箱中培养48小时复苏;待培养皿中的细胞长成致密单层细胞后,用0.25%胰酶消化后,计数600万/t75,再次置于温度为37℃、湿度为95%的5%co2培养箱中培养24小时进行传代培养。
160.(2)病原体感染细胞:
161.将临床标本在-80℃下反复冻融3次,使细胞碎裂释放沙眼衣原体,在 3000r/min的转速下离心5分钟,之后取上清制备菌株液,吸去含有致密单层 hacat细胞的营养液。细胞孔内加新鲜的生长培养液,然后向孔中加入临床菌株液0.1ml。之后在32℃、3000r/min的转速下离心1h,静置,在37℃、湿度为 95%的5%co2培养箱中孵育2h,加入含1μg/ml放线菌酮的衣原体感染液,再在37℃、湿度为95%的5%co2的培养箱中孵育48~72h,直至细胞发生病变。
162.(3)细胞悬液制备:
163.终止培养,将细胞培养瓶中的生长液吸出,用pbs溶液洗细胞3次。加入 1ml 0.25%胰酶溶液,细胞面呈毛玻璃样,弃消化液,加入2%胎牛血清的dmem 培养基36ml,用吸管吹打,使细胞脱壁制成细胞悬液。
164.(4)病原体固定:
165.将上述病原体感染细胞悬液30μl分别滴加于载玻片孔中,在温度20℃的条件下,湿度<20%,例如17%的环境中干燥2h(或自然风干或吹干后)。用-20℃预冷无水乙醇固定1h。
166.2.在对生殖系统感染进行联检中其预处理样本的方法如下:
167.(1)将标本在涡旋混匀器上轻微混匀3下,时间控制在30s左右,浑浊后把标本移至1.5ml的ep管中,在400~600r/min的转速下离心5min,去除上清液,留沉淀,加入适量的样本稀释液(例如磷酸缓冲液)约300μl,移液枪吹打使其成为细胞悬液。
168.(2)配置荧光抗体稀释液:将蔗糖50g、磷酸氢二钠3.63g,磷酸二氢钠 0.24g,氯化钠9g,氯化钾0.2g,酪蛋白钠盐0.5g,加蒸馏水至600ml,高压灭菌,冷却后加入无菌的胎牛血清200ml,甘油100ml,吐温-20 0.5ml,tritonx-100 0.5ml,伊文思蓝0.01g和庆大霉素0.2ml、pc300 1ml后定容至1000ml以制成荧光抗体稀释液,且其中8万的庆大霉素最终浓度为50μg/ml。
169.(3)将上述病原体感染细胞悬液30μl分别滴加于载玻片孔中,在温度20℃,湿度<20%,例如17%的环境下,干燥2h(或自然风干或吹干后)。放入湿盒中,用-20℃预冷无水乙醇固定60min。
170.3.联检后的结果的判读方法如下:
171.终点结果确定方法:将实施例3中无水乙醇固定后的病原体对照玻片在洗涤液中重复洗3次,自然晾干。用荧光抗体稀释液将荧光抗体结合物稀释50倍,使荧光抗体稀释液中含有荧光抗体结合物的浓度为100μg/ml,获得稀释后的荧光单克隆抗体。
172.在一个示例中,荧光抗体结合物为将20mg单克隆抗体标记fitc,透析后重悬在4ml的荧光抗体保护剂内。在一个示例中,荧光抗体保护剂为抗体偶联 fitc后的保护剂,即母液的保护剂,一般为在pbs中加入50%的甘油和10mg/ml 的bsa中获得。
173.之后,病原体对照玻片每孔中加入15μl的稀释后的荧光单克隆抗体,之后在湿盒中37℃温育30分钟后,pbs冲洗3次,风干,即可用荧光显微镜(推荐滤光片波长为470-495nm)下观察结果。
174.双色系统结果判读具体方法:
175.(1)空白对照:第0孔无绿色荧光,细胞呈现红色。
176.(2)阳性对照:沙眼衣原体的细胞核、细胞浆或胞膜出现苹果绿荧光;
177.(3)阴性对照:沙眼衣原体的细胞呈现红色。
178.根据本发明的制备用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法具有以下优点中的至少一个:
179.(1)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法中的荧光抗体稀释液组成成分具有广谱性和良好的兼容性,不会因为检测抗原的不同而需要调整,且同一荧光抗体稀释液可满足所有抗原基片的检测;
180.(2)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法采用直接免疫荧光法,可以减少间接法中二抗非特异性反应,而提高其特异性;
181.(3)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法中的试剂盒具有良好的特异性,结果判定无需加封闭剂,缩短操作时间;
182.(4)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法能够在同一反应条件下,将含两种或两种以上的病原体如病毒、细菌、支原体等不同种类的病原微生物固定于同一病原体对照玻片上,使得在联检过程中能够同步完成多种疑似病原体鉴别诊断,一次性操作即可获得多个结果;
183.(5)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法中的病原体对照玻片制备过程中无生化提纯步骤,且能够通过荧光双色显影进行结果判读,避免了非特异荧光的干扰;
184.(6)本发明提供的用于多病原体联检的直接免疫荧光检测试剂盒的制备方法、用于多病原体联检的试剂盒及多病原体的联检方法中的病原体对照玻片制备中,细胞无需使用封闭剂包被即可使抗原吸附至载玻片上,同时还能保证在不同种类的病原体之间不会发生交叉反应,并且大大缩短了制备病原体对照玻片的时间。
185.虽然本总体发明构思的一些实施例已被显示和说明,本领域普通技术人员将理解,在不背离本总体发明构思的原则和精神的情况下,可对这些实施例做出改变,本发明的范围以权利要求和它们的等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
