一种人源ace2多肽阻滞剂及其设计与合成方法与应用
技术领域
1.本技术涉及一种人源ace2多肽阻滞剂及其设计与合成方法与应用,属于抑制病毒药物多肽技术领域。
背景技术:
2.新冠病毒sars-cov-2突刺(spike)糖蛋白通过结合人体内细胞人血管紧张素转化酶2(ace2)受体识别并吸附在宿主细胞的表面,然后通过宿主细胞膜穿入易感细胞,并在细胞内复制重组生成子代病毒,易感细胞释放子代病毒,从而完成病毒在人体内的快速繁殖进而引起各种感染,新型冠状病毒sars-cov-2隐匿性和传染性很强,既可引起无症状感染,也可引起病毒性肺炎、严重呼吸综合征、肾衰竭及死亡。
3.大体来说,抗新冠病毒的药物可以归纳为两大类,一是阻止病毒和宿主细胞结合,二是阻止新病毒在宿主细胞内的产生。如果要阻止病毒和宿主细胞结合,那么作用的靶位就是s蛋白(突刺糖蛋白)或者ace2。短时间获得s蛋白抗体是比较困难的也更加复杂,通过设计结构更加简单的小分子多肽与s蛋白竞争性结合是一种比较简单易行的方法。多肽抑制剂结合到ace2关键位点阻滞了s蛋白的进一步入侵从而缓解了病毒的进一步感染。
技术实现要素:
4.根据本技术的一个方面,提供一种人源ace2多肽阻滞剂,所述人源ace2多肽阻滞剂能够竞争性结合ace2,从而降低冠状病毒s蛋白与ace2的特异性结合,具有良好的作为抑制冠状病毒药物的应用前景。
5.一种人源ace2多肽阻滞剂,所述人源ace2多肽阻滞剂的氨基酸序列包括脯氨酸和色氨酸。
6.可选地,所述人源ace2多肽阻滞剂的氨基酸序列选自trptrp pro protrptrp、trptrp pro protrptrp、trptrp pro proprotrptrp、trp pro ala proproprotrptrp和trp protrp pro proprotrptrp中的至少一种,
7.或选自trptrp pro protrptrp、trptrp pro protrptrp、trptrp pro proprotrptrp、trp pro ala proproprotrptrp和trp protrp pro proprotrptrp经过取代、缺失和/或增加一个或多个氨基酸而不影响其生物活性的氨基酸序列中的至少一种。
8.可选地,所述人源ace2多肽阻滞剂中的氨基酸为d-氨基酸和/或l-氨基酸。
9.可选地,所述多肽的氨基酸序列选自下列中的至少一种:
10.trptrp pro protrptrp,其中第2位的trp、第4位的pro、第5位的trp和第6位的trp为d-氨基酸,第1位的trp、第3位的pro为l-氨基酸;
11.trptrp pro protrptrp,其中第2位的trp、第3位的pro、第4位的pro、第5位的trp、第6位的trp为d-氨基酸,第1位的trp为l-氨基酸;
12.trptrp pro proprotrptrp,其中第2位的trp、第3位的pro、第5位的pro、第6位的trp、第7位的trp为d-氨基酸,第1位的trp、第4位的pro为l-氨基酸;
13.trp pro ala proproprotrptrp,其中第1位的trp、第2位的pro、第三位的ala、第4位的pro、第6位的pro、第7位的trp、第8位的trp为d-氨基酸,第5位的pro为l-氨基酸;
14.trp protrp pro proprotrptrp,其中第1位的trp、第2位的pro、第3位的trp、第4位的pro、第6位的pro、第7位的trp、第8位的trp为d-氨基酸,第5位的pro为l-氨基酸。
15.可选地,所述人源ace2多肽阻滞剂具有稳定的空间结构。
16.常规多肽具有柔线性结构,可以自由旋转,本技术序列中加入了脯氨酸用于改变键角,使多肽以折叠或刚性结构存在,最终人源ace2多肽阻滞剂刚性好,结构稳定,不易旋转。
17.可选地,所述人源ace2多肽阻滞剂可与ace2特异性结合。
18.可选地,所述人源ace2多肽阻滞剂在血浆中37℃孵育8h降解率小于60%。
19.可选地,所述人源ace2多肽阻滞剂在血浆中37℃孵育8h降解率为40%~50%。
20.根据本技术的另一个方面,提供一种人源ace2多肽阻滞剂的合成方法,所述合成方法合成具有上述任意一项所述的序列的人源ace2多肽阻滞剂。
21.根据本技术的另一个方面,提供一种人源ace2多肽阻滞剂的设计方法,所述设计方法包括以下步骤:通过计算机辅助设计人源ace2多肽阻滞剂的序列,将设计所得的人源ace2多肽阻滞剂与ace2进行虚拟对接分析,优化人源ace2多肽阻滞剂序列结构,评分确定最终序列,获得所述人源ace2多肽阻滞剂。
22.可选地,所述通过计算机辅助设计人源ace2多肽阻滞剂的序列具体为:根据先导化合物设计先导多肽。
23.可选地,所述先导化合物为(z)-3,3'-(2-(((3,5-二(1h-吲哚-3-基)-1h-吡咯-2-基)亚甲基)-2h-吡咯-3,5-二基)二(1h-吲哚)。
24.可选地,所述将设计所得的人源ace2多肽阻滞剂与ace2进行虚拟对接分析具体为:确定设计所得的人源ace2多肽阻滞剂与ace2之间的氨基酸残基之间的相互作用力类型,并确定ace2的高亲和区域。
25.可选地,所述ace2的高亲和区域位于ace2序列第348~401位氨基酸。
26.可选地,所述优化人源ace2多肽阻滞剂序列结构具体为:根据对接分析结果,调整人源ace2多肽阻滞剂序列结构使人源ace2多肽阻滞剂上的氨基酸残基延伸到所述高亲和区域。
27.可选地,所述评分确定最终序列具体为:通过对优化后的序列进行评分,获得人源ace2多肽阻滞剂序列。
28.可选地,所述评分确定最终序列具体为:通过对优化后的序列进行评分,选取结合力小于-7的人源ace2多肽阻滞剂。
29.根据本技术的另一个方面,提供一种上述任意一项所述的人源ace2多肽阻滞剂、上述任意一项所述的合成方法合成的人源ace2多肽阻滞剂、上述任意一项所述的设计方法设计得到的人源ace2多肽阻滞剂中的至少一种在作为抑制冠状病毒药物中的应用。
30.可选地,所述冠状病毒包括新型冠状病毒。
31.所述新型冠状病毒为sars-cov-2。
32.根据本技术的另一个方面,提供一种抑制冠状病毒药物,所述抑制冠状病毒药物包括上述任意一项所述的人源ace2多肽阻滞剂、根据上述任意一项所述的合成方法合成的
人源ace2多肽阻滞剂、上述任意一项所述的设计方法设计得到的人源ace2多肽阻滞剂中的至少一种。
33.可选地,所述冠状病毒包括新型冠状病毒。
34.所述新型冠状病毒为sars-cov-2。
35.作为一种实施方式,本技术设计了一类序列组成不同多肽化合物,随后利用分子对接软件将其与ace2上的特定位点进行分子对接,通过对分子对接结果评价逐步改善化合物序列及空间结构,最终获得了具有生物活性的分子结构。本技术基于分子对接结果合成了相关的对应多肽,并在血液稳定性实验中发现待测多肽具有长的衰减周期,进一步利用试剂盒测试了设计化合物对ace2的结合能力证明了其具备与新冠病毒s蛋白竞争结合ace2的能力,为新冠病毒多肽拮抗剂的研发奠定了基础。
36.为实现上述目的,本发明采用的技术方案如下:
37.一种基于ace2位点的人源ace2多肽阻滞剂的设计及其在新型冠状病毒中的应用,所述的人源ace2多肽阻滞剂为以下五个序列wwppww、wwppww、wwpppww、wpapppww和wpwpppww,其中小写代表d-氨基酸大写代表l-氨基酸
38.所述人源ace2多肽阻滞剂具备特定的空间结构和序列信息,其特征是,所述的多肽核心结构由脯氨酸与色氨酸组成,且可以更换氨基酸的l/d-构型,可在已有序列基础上增减氨基酸残基
39.所述人源ace2多肽阻滞剂在正常人类血液中可长时间稳定存在且不易降解,具体地,孵化时间分别为0h、0.083h、0.5h、1h、2h、4h、8h、24h、48h。
40.所述人源ace2多肽阻滞剂能够竞争性结合ace2降低新型冠状病毒s蛋白与ace2的特异性结合,具体地,测试多肽浓度分别为50μm和100μm。
41.作为一种实施方式,本技术提供一种与ace2特异性结合从而抑制新型冠状病毒sars-cov-2的s蛋白的人源ace2多肽阻滞剂;
42.可选地,所述人源ace2多肽阻滞剂的氨基酸可以为l/d构型。
43.可选地,所述的人源ace2多肽阻滞剂具备特定的空间结构和序列,在保证核心结构前提下可以增添/删减氨基酸残基;
44.可选地,所述人源ace2多肽阻滞剂的序列核心由脯氨酸与色氨酸交错组成。
45.可选地,所述的人源ace2多肽阻滞剂在正常人类血液中可长时间稳定存在且不易降解;
46.具体地,孵化时间分别为0h、0.083h、0.5h、1h、2h、4h、8h、24h、48h。
47.可选地,所述的人源ace2多肽阻滞剂能够竞争性结合ace2从而抑制新型冠状病毒s蛋白与ace2的特异性结合;
48.具体地,测试人源ace2多肽阻滞剂浓度分别为50μm和100μm。
49.作为一种实施方式,本技术提供一种基于ace2的多肽拮抗剂的设计方法及其在抑制新型冠状病毒sars-cov-2中的应用。利用分子对接软件,将设计多肽与血管紧张素转化酶2(ace2)在特定的抑制性位点进行分子对接,对结果进行综合分析,筛选出具有抑制ace2活性的多肽。筛选得到的多肽经检测发现半衰期明显提升,增强了设计多肽的可用性,随后利用试剂盒测试了设计化合物ace2的结合能力证明了其具备与新冠病毒s蛋白竞争结合ace2的能力,为新冠病毒多肽拮抗剂的研发奠定了基础,可作为新冠病毒抑制的潜在药物。
50.本发明通过计算机辅助实现了多肽/类肽的从头设计,使得我们对蛋白质与多肽之间的相互作用有了更加深刻的认识并且指导了新药的开发和设计,这不仅降低了人工和研发周期,还大大节省了经济成本。
51.本发明设计的人源ace2多肽阻滞剂能够与靶向蛋白结合,通过对人源ace2多肽阻滞剂结构优化简化了化合物合成步骤,有利于活性成分的低成本高通量的产出。
52.人源ace2多肽阻滞剂具有稳定的结构,血浆稳定性实验证明了人源ace2多肽阻滞剂可以在复杂循环系统的体液中稳定长时间存在,这对人源ace2多肽阻滞剂的摄入和制剂提供了更多的可能。
53.借助计算机设计的人源ace2多肽阻滞剂能够与s蛋白竞争性结合ace2,说明其具备开发药物的前景。
54.本技术能产生的有益效果包括:
55.(1)本技术所提供的人源ace2多肽阻滞剂能够竞争性结合ace2,从而降低冠状病毒s蛋白与ace2的特异性结合,为冠状病毒多肽拮抗剂的研发奠定了基础,具有良好的作为抑制冠状病毒药物的应用前景。
56.(2)本技术所提供的人源ace2多肽阻滞剂具有稳定的结构,具有较长的半衰期,在正常人类血液中可长时间稳定存在且不易降解,增强了其可用性。
57.(3)本技术所提供的人源ace2多肽阻滞剂的设计方法,通过计算机辅助实现了多肽/类肽的从头设计,对多肽结构优化简化了化合物合成步骤,有利于活性成分的低成本高通量的产出。不仅降低了人工和研发周期,还大大节省了经济成本。
附图说明
58.图1为人源ace2多肽阻滞剂p1与ace2的空间相互作用分析;
59.图2为人源ace2多肽阻滞剂p1与ace2的氨基酸残基相互作用分析;
60.图3为ace2关键空间结构分析;
61.图4为人源ace2多肽阻滞剂p1~p5血浆稳定性分析结果;
62.图5、图6为人源ace2多肽阻滞剂p1~p5对s蛋白的竞争性抑制分析结果。
63.图7为先导化合物(z)-3,3'-(2-(((3,5-二(1h-吲哚-3-基)-1h-吡咯-2-基)亚甲基)-2h-吡咯-3,5-二基)二(1h-吲哚)的结构式。
具体实施方式
64.下面结合实施例详述本技术,但本技术并不局限于这些实施例。
65.在本技术中,pro和p代表脯氨酸;trp和w代表色氨酸,ala和a代表丙氨酸。
66.实施例1:人源ace2多肽阻滞剂与ace2的虚拟对接分析
67.计算机辅助实现了多肽的从头设计包括以下步骤:
68.根据先导化合物(z)-3,3'-(2-(((3,5-二(1h-吲哚-3-基)-1h-吡咯-2-基)亚甲基)-2h-吡咯-3,5-二基)二(1h-吲哚)(结构如图7所示)设计导多肽p1的序列,并对其进行结构分析与优化。
69.多肽与蛋白之间的相互作用力主要包括有范德华力、疏水性作用、氢键结合作用力及静电相互作用等几种形式。因此为了解通过虚拟对接得到的结果,评价多肽与蛋白之
间的相互作用情况,我们选择先导多肽p1与目标蛋白(ace2)为参照,其相互作用力分析如下(见图1):
70.依据先导化合物p1的组成,我们详细分析了多肽p1与ace2之间氨基酸残基之间的相互作用力,确定了疏水作用是两者之间的最主要作用力,其次为氢键作用力,另外我们确定了p1对ace2的高亲和区域,在这些区域内两者更容易发生相互作用且作用力更强(见图2)。分析结果表明arg-514、glu-398、glu-402等具有羟基、羰基和氨基等易形成氢键结构,这些结构容易与多肽中肽键及r基团发生相互作用形成较强的结合力,同样也存在phe-40、phe-390和tyr-385这类高疏水性结构,这类结构容易与烷基和苯基发生作用。
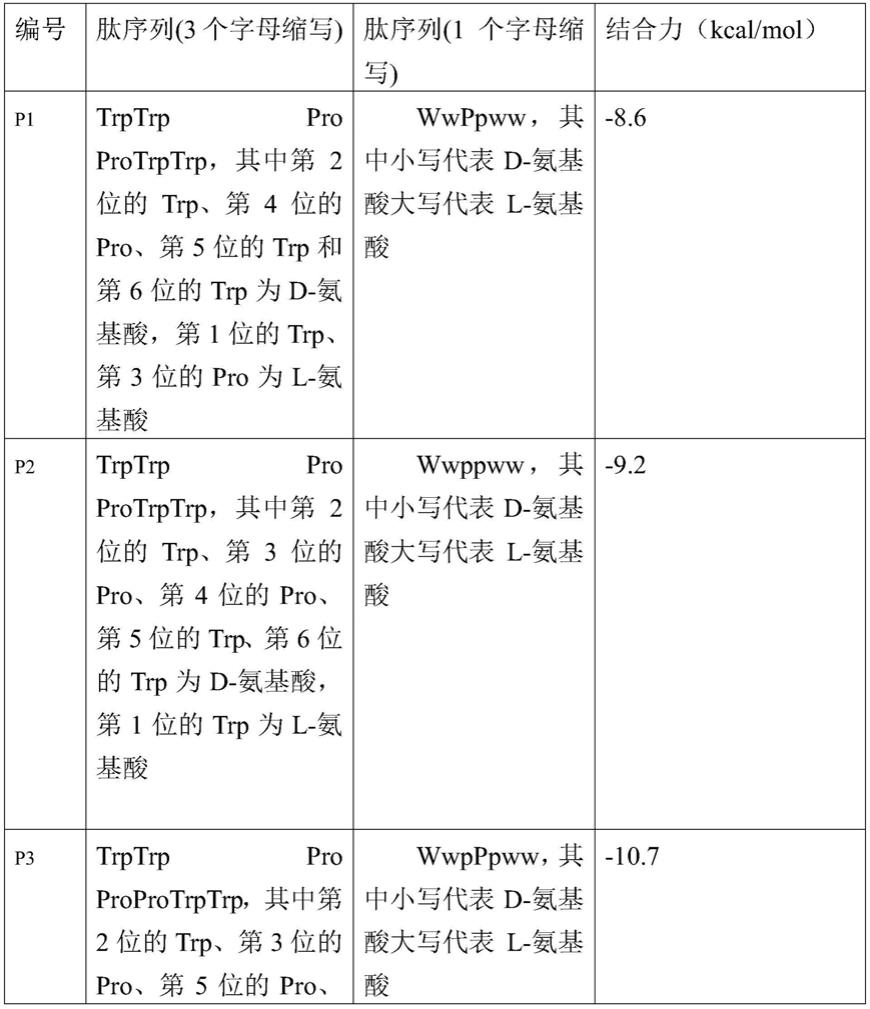
71.根据多肽p1对接结果,我们修改序列结构使多肽上的氨基酸残基延伸到更容易生成相互作用的部位,我们综合这些残基之间相互作用到空间结构(见图3),确定了整个ace2中最亲和多肽的空腔并在空腔中调整序列最终得到了几条具备类似能力的多肽段,为了确定最佳结构并能继续优化,我们以分子对接打分结果为评价标准评价设计结构好坏。最终确定多肽序列及评分结果如下表1,这一些列多肽主要由脯氨酸和色氨酸组成整体结构骨架,分子对接结构也具有较好的得分,符合局部氨基酸残基作用最优化和空腔最优化。
72.表1设计多肽序列及分子对接评分
73.[0074][0075]
实施例2:多肽的血浆稳定性分析
[0076]
(1)多肽与血浆共孵育
[0077]
将5个多肽(p1~p5)分别配制成浓度为100μm的混合溶液,取40μl该溶液加入到1.5ml ep管中,再加入360μl人血浆混匀,使血浆中多肽终浓度为10um,在37℃下分别孵育0h、0.083h、0.5h、1h、2h、4h、8h、24h、48h。采用盐析辅助均向液液萃取法对血浆样品进行预处理,得到待分析样品。
[0078]
(2)hplc-ms分析
[0079]
所用仪器为uplc-q-tof液质联用仪(agilent);
[0080]
高效液相色谱条件:流动相a为体积分数为0.1%的甲酸溶液;流动相b为乙腈(含体积分数为0.1%的甲酸);色谱柱为:infinitylabporoshell120ec-c18(50mm
×
2.1mm,2.7μm);流速为0.35ml/min,柱温为50℃,进样量为10μl;洗脱梯度为0~2min:5%-10%b;2~
7min:10%-98%b;7~9.5min:98%-100%b;9.6~12min:5%b。
[0081]
质谱条件为:电喷雾电离源,正离子模式,采集范围为100-1200m/z,毛细管电压为3500v;干燥器温度为350℃;碎裂电压为150v。
[0082]
(3)实验结果
[0083]
以时间为横坐标,将0h浓度设为100%,以各时间点浓度与0h浓度百分比为纵坐标做图,如图4所示,5个多肽在血浆中可稳定存在(p1和p2的曲线重叠),37℃孵育8h仅降解40%-50%。
[0084]
实施例3:多肽与s蛋白对ace2的竞争性结合分析(多肽与ace2蛋白经过共孵育)
[0085]
采用covid-19spike-ace2binding检测试剂盒进行检测:
[0086]
(1)多肽与ace2蛋白的混合液制备并共孵育
[0087]
分别用稀释液将多肽p1~p5配置成50μm和100μm两个浓度的溶液,分别取100μl上述溶液加入10μl 10
×
的ace2工作液,涡旋,37℃孵育1小时,进行下一步操作;
[0088]
用100ul稀释液加10μl 10
×
的ace2工作液作为阴性对照。
[0089]
(2)酶联免疫法检测ace2蛋白与s蛋白的结合率
[0090]
96孔板包被了sars-cov-2s1蛋白结合域,加入(1)中所述多肽与ace2的混合溶液100μl,孵育2.5小时,用洗涤液洗掉未结合的ace2蛋白;加入100μl一抗,即能够与s1蛋白-ace2蛋白复合物结合的山羊源抗ace2抗体,孵育1小时,用洗涤液清洗;加入100μl二抗,即hrp标记的抗“山羊-lgg”,用洗涤液清洗;加入100μl显色剂tbm,孵育30分钟;加入终止液终止反应,在450nm下测定吸光度,吸光度与s1蛋白-ace2蛋白复合物的量成正比。
[0091]
(3)实验结果
[0092]
如图5所示,多肽与ace2蛋白孵育1小时,p1、p2、p3的100μm组能够抑制s1蛋白与ace2蛋白的结合,抑制率分别为30.3%、11.1%和9.5%。表明,p1~p5可以通过竞争性与ace2结合从而抑制新冠病毒s蛋白与ace2的结合,具有作为新冠病毒s蛋白的竞争性抑制剂的应用前景。
[0093]
实施例4:多肽与s蛋白对ace2的竞争性结合分析(多肽与ace2蛋白未经共孵育)
[0094]
采用covid-19spike-ace2binding检测试剂盒进行检测:
[0095]
(1)多肽与ace2蛋白的混合液制备
[0096]
分别用稀释液将多肽p1~p5配置成50μm和100μm两个浓度的溶液,取100μl上述溶液加入10μl 10
×
的ace2工作液,涡旋后直接进行下一步操作;
[0097]
用100ul稀释液加10μl 10
×
的ace2工作液作为阴性对照。
[0098]
(2)酶联免疫法检测ace2蛋白与s蛋白的结合率
[0099]
96孔板包被了sars-cov-2s1蛋白结合域,加入(1)中所述多肽与ace2的混合溶液100μl,孵育2.5小时,用洗涤液洗掉未结合的ace2蛋白;加入100μl一抗,即能够与s1蛋白-ace2蛋白复合物结合的山羊源抗ace2抗体,孵育1小时,用洗涤液清洗;加入100μl二抗,即hrp标记的抗“山羊-lgg”,用洗涤液清洗;加入100μl显色剂tbm,孵育30分钟;加入终止液终止反应,在450nm下测定吸光度,吸光度与s1蛋白-ace2蛋白复合物的量成正比。
[0100]
(3)实验结果
[0101]
如图6所示,未孵育时,p1的100μm组显示出抑制作用,抑制率为20.8%。表明,p1具
有很强的通过竞争性与ace2结合从而抑制新冠病毒s蛋白与ace2的结合的能力,具有很好的作为新冠病毒s蛋白的竞争性抑制剂的应用前景。
[0102]
以上所述,仅是本技术的几个实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。