具有除草剂抗性的hppd突变型蛋白及其应用
技术领域
1.本发明属于植物蛋白和植物抗除草剂领域,涉及具有除草剂抗性的hppd突变型基因、蛋白及其应用;具体而言,本发明涉及水稻的对羟基苯丙酮酸双加氧酶(hppd)突变基因及其编码的突变hppd蛋白,该突变蛋白能赋予植物尤其水稻抗对羟基苯丙酮酸双加氧酶抑制剂类除草剂的特性。本发明公开了该突变蛋白的核苷酸序列和氨基酸序列,以及它们在植物抗除草剂领域中的应用。
背景技术:
2.农田杂草与作物竞争生存空间、光照、水分和养分等资源,并可能成为病虫害的中间寄主,严重干扰作物生长,引起减产。传统的人工拔草费工费时,效率低;机械除草通常不彻底,过度以及不合理地翻耕还容易造成土壤侵蚀、养分流失、能源过度消耗、温室气体排放等问题。喷施除草剂除草简便易行、效果好、效率高,逐渐成为了农田防控杂草最经济有效的手段。然而,单一作用靶标的除草剂多年连续使用,使多种杂草产生了严重的抗药性,成为恶性杂草。此外,如磺酰脲类等除草剂在土壤中残效期长,对下茬作物影响较大,也可能随水渗透,造成污染环境。
3.20世纪90年代对羟基苯丙酮酸双加氧酶(4-hydroxyphenylpyruvate dioxygenase,hppd)首次被确定为除草剂作用靶标,此后一系列hppd抑制剂类除草剂相继被开发出来,包括异噁唑类、二酮腈类、三酮类、吡唑盐类等。hppd是质体琨和生育酚合成途径中的关键酶。质体琨是类胡萝卜素合成途经中的关键酶八氢蕃茄红素脱氢酶(phytoene desaturase)反应的电子受体,也是光合系统ii的电子受体。质体琨和生育酚都是重要的抗氧化物质,能够清除植物组织中的活性氧自由基。抑制hppd的活性,将造成质体琨和生育酚的缺乏,影响类胡萝卜素的合成和光合作用,从而导致植物白化死亡。hppd抑制剂类除草剂可以作为als抑制剂类、酰胺类、合成激素类等除草剂的轮换药剂和复配药剂,防治农田恶性杂草。hppd抑制剂类除草剂一般具有高效低毒、不易产生抗性、环境兼容性好、对后茬作物安全等优点。
4.植物抗除草剂主要依靠靶标抗性和非靶标抗性两种机制。靶标抗性是指除草剂的靶标基因或其编码蛋白发生变化,导致植物能够抵抗或耐受一定浓度的除草剂。最常见的靶标抗性的形式是除草剂靶标基因的编码序列发生改变,导致靶标蛋白的某个或某些氨基酸发生突变,使得除草剂不能结合靶标蛋白,而该蛋白的正常生理功能却不受影响。例如,将玉米hppd酶的编码基因与对hppd抑制剂类除草剂具有抗性或耐受性的细菌的hppd编码基因进行基因改组(dna family shuffling),获得具有18个点突变的突变型玉米hppd基因,在大豆中过量表达该突变型玉米hppd蛋白,使大豆产生了对多种三酮类除草剂的抗性(siehl et al,2014)。dna shuffling的方法造成多个位点的突变,可能改变了hppd的整体构象;又如,将多种植物的hppd蛋白序列与对hppd抑制剂类除草剂具有抗性或耐受性的细菌的hppd蛋白进行序列比对,进而对植物hppd编码基因进行单点和多点突变,将突变的植物hppd蛋白转入相应的植物中,能够赋予转基因植物对于hppd抑制剂类除草的抗性或耐受
性;另有研究报道,直接将荧光假单胞杆菌(pseudomonas fluorescens)的hppd基因转入到大豆和烟草的叶绿体中也能够提高植物对于硝磺草酮的抗性(dufourmantel et al.,2009)。此外,除草剂的靶标蛋白序列没有改变,但是提高植物体内除草剂的靶标基因的拷贝数或表达水平,产生过量的野生型hppd蛋白,也能使植物耐受一定水平的hppd抑制剂类除草剂。
5.非靶标抗性是指靶标蛋白序列、基因拷贝数和表达水平没有改变,而由于植物对除草剂的吸收少,转移慢;或者进入体内的除草剂被降解、修饰或钝化,使除草剂不能抑制靶标蛋白的活性。目前,对hppd抑制剂类除草剂非靶标抗性的研究主要集中在玉米和杂草中。一类目前应用较广的hppd抑制剂类除草剂硝磺草酮主要是应用于玉米田的除草剂,玉米对于硝磺草酮具有耐受性,苗前苗后均可承受一定浓度的硝磺草酮,而玉米的正常生长不受显著性的影响。已有研究报道相比于对硝磺草酮敏感的植物,玉米对硝磺草酮的吸收相对较慢,代谢相对较快(mitchell et al.,2001)。另有研究鉴定到对了硝磺草酮不敏感的杂草糙果苋群体(hausman et al.,2011;ma et al.,2013),和敏感群体相比,抗性群体的硝磺草酮吸收速率与敏感群体没有明显差异,甚至略高于敏感群体,然而半降解时间(dt50)显著短于敏感群体,除草剂处理离体叶片结合高效液相色谱鉴定结果表明,在喷施硝磺草酮24小时之后,抗性群体中的硝磺草酮的含量显著低于敏感群体(ma et al.,2013)。在糙果苋中施加马拉硫磷或四环唑(tetcyclacis)之后,硝磺草酮不敏感的群体对硝磺草酮的敏感性变高,说明硝磺草酮不敏感的糙果苋可能对除草剂的代谢能力更强(ma et al.,2013)。
6.为创制除草剂抗性或耐受性作物品种,转基因技术已经广泛采用。然而,转基因作物品种的安全性在全球范围内仍存在较大争议,各国对于转基因作物的商品化也持有不同的态度。目前,受到政策影响和转基因作物登记成本的限制,转基因抗除草剂的应用和推广具有较大阻力。新近发展起来的以crispr系统为代表的基因编辑技术有望改善上述困境。通过crispr/cas9、crispr/cpf1等系统介导的基因定点突变及同源重组可以对植物内源除草剂靶标基因进行改造,从而赋予植物对于除草剂的抗性或耐受性。目前报道的成功实例都集中在乙酰乳酸合成酶(als)抑制剂类、乙酰辅酶a羧化酶(accase)抑制剂类和草甘膦等除草剂的抗性和耐受性植物的创制方面。考虑到hppd抑制剂类除草剂的巨大应用前景,以及非转基因hppd抑制剂类除草剂抗性和耐受性植物种质的缺乏,需要科学家不断研究提高作物对这一类除草剂抗性和耐受性的方法。水稻是全球最重要的粮食作物,而其野生型品种对于绝大多数的hppd抑制剂类除草剂敏感。
7.此前,尚未有文献报道对水稻内源hppd编码基因进行单点或多点突变能够同时赋予水稻多种hppd抑制剂类除草剂的抗性。
技术实现要素:
8.发明目的:本发明所要解决的技术问题是提供一种可以赋予植物对除草剂抗性的突变型蛋白。进一步地,本发明所要解决的技术问题是提供一种可以赋予植物抗(耐)对羟基苯丙酮酸双加氧酶抑制剂类除草剂特性的水稻hppd突变型蛋白。
9.本发明还要解决的技术问题是提供一种可以赋予植物抗除草剂特性的突变型基因。进一步地,本发明所要解决的技术问题是提供一种可以赋予植物抗(耐)对羟基苯丙酮
酸双加氧酶抑制剂类除草剂特性的水稻hppd突变型基因。
10.本发明还要解决的技术问题是提供了一种表达盒、重组载体或细胞。
11.本发明还要解决的技术问题是提供了水稻hppd突变型蛋白、所述的核酸或基因,所述的表达盒、重组载体或细胞在植物抗除草剂方面的应用。
12.本发明还要解决的技术问题是提供了一种获得具有除草剂抗性的植物细胞、植物组织、植物部分或植物的方法。
13.本发明还要解决的技术问题是提供了一种鉴定植物的方法。
14.本发明还要解决的技术问题是提供了一种控制杂草的方法。
15.本发明最后要解决的技术问题是提供了一种用于保护植物免受由除草剂引起的损伤的方法。
16.技术方案:为了解决上述技术问题,本发明提供了一种水稻hppd突变型蛋白,所述水稻hppd突变型蛋白的氨基酸序列存在以下任意一种或多种突变:其对应于野生型水稻hppd的氨基酸序列的第29、52、54、68、92、99、117、120、132、133、146、156、206、216、237、238、244、266、270、273、277、282、295、297、310、313、315、316、325、333、336、338、344、345、346、349、357、388、392、404、406、408、415和423位氨基酸发生突变;其中,第277位由脯氨酸突变为缬氨酸,第336由脯氨酸突变为丝氨酸,第338位由天冬氨酸突变为赖氨酸或异亮氨酸或苏氨酸,第346位由精氨酸突变为亮氨酸,第392位由甲硫氨酸突变为异亮氨酸,第415位由甘氨酸突变为丙氨酸或天冬酰胺或丝氨酸。
17.其中,所述水稻hppd突变型蛋白的氨基酸序列对应于野生型水稻hppd的氨基酸序列具有选自下述的一种或多种突变形式:v29a、v52i、l54f、f68s、l92i、p99l、t117i、s120a、f132s、a133t、r146l、a156v、e206q、e206v、y216c、y237n、i238t、f244l、v266a、n270d、t273s、p277v、v282e、l295q、h297r、s310c、s310v、s310a、s310g、s310t、v313m、v313i、v313l、g315a、g315s、g315r、t316k、a325d、a333p、p336s、n338k、n338i、n338t、r344k、r345l、r345q、r346l、d349g、n357s、f388l、m392i、s404g、s404l、s404t、q406r、y408h、g415a、g415n、g415s和e423g。
18.其中,所述的水稻hppd突变型蛋白,其包括:
19.(a)其氨基酸序列选自seq id no:4、seq id no:6、seq id no:8、seq id no:10、seq id no:12、seq id no:14、seq id no:16、seq id no:18、seq id no:20、seq id no:22、seq id no:24、seq id no:26、seq id no:28、seq id no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38、seq id no:40、seq id no:42、seq id no:44、seq id no:46、seq id no:48、seq id no:50、seq id no:52、seq id no:54、seq id no:56、seq id no:58、seq id no:60、seq id no:62、seq id no:64、seq id no:66、seq id no:68、seq id no:70、seq id no:72、seq id no:74、seq id no:76、seq id no:78、seq id no:80、seq id no:82、seq id no:84、seq id no:86、seq id no:88、seq id no:90、seq id no:92、seq id no:94、seq id no:96、seq id no:98、seq id no:100、seq id no:102、seq id no:104、seq id no:106、seq id no:108、seq id no:110、seq id no:112、seq id no:114、seq id no:116、seq id no:118、seq id no:120或seq id no:122中的任意一个;或
20.(b)在(a)中的氨基酸序列经过取代和/或缺失和/或添加一个或多个氨基酸,且具有对羟基苯丙酮酸双加氧酶活性的由(a)衍生的蛋白质。
no:45、seq id no:47、seq id no:49、seq id no:51、seq id no:53、seq id no:55、seq id no:57、seq id no:59、seq id no:61、seq id no:63、seq id no:65、seq id no:67、seq id no:69、seq id no:71、seq id no:73、seq id no:75、seq id no:77、seq id no:79、seq id no:81、seq id no:83、seq id no:85、seq id no:87、seq id no:89、seq id no:91、seq id no:93、seq id no:95、seq id no:97、seq id no:99、seq id no:101、seq id no:103、seq id no:105、seq id no:107、seq id no:109、seq id no:111、seq id no:113、seq id no:115、seq id no:117、seq id no:119、seq id no:121、seq id no:123、seq id no:125、seq id no:127、seq id no:129、seq id no:131、seq id no:133、seq id no:135、seq id no:137、seq id no:139、seq id no:141、seq id no:143、seq id no:145、seq id no:147、seq id no:149、seq id no:151、seq id no:153、seq id no:155、seq id no:157、seq id no:159、seq id no:161、seq id no:163、seq id no:165、seq id no:167、seq id no:169、seq id no:171、seq id no:173、seq id no:175、seq id no:177、seq id no:179、seq id no:181、seq id no:183、seq id no:185、seq id no:187、seq id no:189、seq id no:191、seq id no:193、seq id no:195、seq id no:197、seq id no:199、seq id no:201、seq id no:203、seq id no:205、seq id no:207、seq id no:209、seq id no:211、seq id no:213、seq id no:215、seq id no:217、seq id no:219、seq id no:221、seq id no:223、seq id no:225、seq id no:227、seq id no:229、seq id no:231、seq id no:233、seq id no:235、seq id no:237、seq id no:239、seq id no:241、seq id no:243、seq id no:245、seq id no:247、seq id no:249、seq id no:251或seq id no:253所示的核苷酸序列或其互补序列中的任意一个。
27.具体地,本发明的内容还包括水稻hppd突变型基因的核苷酸序列存在下列任意一种或几种突变:其对应于野生型水稻hppd的氨基酸序列的第86位核苷酸由t突变为c,第154位核苷酸由g突变为a,第160位核苷酸由c突变为t,第203位核苷酸由t突变为c,第274位核苷酸由c突变为a,第297位核苷酸由c突变为g,第350位核苷酸由c突变为t,第358位核苷酸由t突变为g,第395位核苷酸由t突变为c,第397位核苷酸由g突变为a,第437位核苷酸由g突变为t,第467位核苷酸由c突变为t,第616位核苷酸由g突变为c,第617位核苷酸由a突变为t,第647位核苷酸由a突变为g,第709位核苷酸由t突变为a,第713位核苷酸由t突变为c,第730位核苷酸由t突变为c,第797位核苷酸由t突变为c,第808位核苷酸由a突变为g,第817位核苷酸由a突变为t,第829位核苷酸由c突变为g,第830位核苷酸由c突变为t,第831位核苷酸由g突变为t,第845位核苷酸由t突变为a,第884位核苷酸由t突变为a,第890位核苷酸由a突变为g,第928位核苷酸由a突变为t或g,第929位核苷酸由g突变为t或c,第930位核苷酸由c突变为t,第937位核苷酸由g突变为a或c,第939位核苷酸由g突变为t,第943位核苷酸由g突变为a或t,第944位核苷酸由g突变为c,第945位核苷酸由g突变为t,第947位核苷酸由c突变为a,第974位核苷酸由c突变为a,第997位核苷酸由g突变为c,第1006位核苷酸由c突变为a,第1007位核苷酸由c突变为g,第1008位核苷酸由g突变为t,第1013位核苷酸由a突变为t或c,第1014位核苷酸由c突变为a,第1030位核苷酸由c突变为a,第1031位核苷酸由g突变为a,第1034位核苷酸由g突变为a或t,第1037位核苷酸由g突变为t,第1046位核苷酸由a突变为g,第1070位核苷酸由a突变为g,第1164位核苷酸由t突变为a,第1176位核苷酸由g突变为a,第1210位核苷酸由a突变为g或c,第1211位核苷酸由g突变为c或t,第1216位核苷酸由c突
变为a,第1217位核苷酸由a突变为g,第1222位核苷酸由t突变为c,第1243位核苷酸由g突变为a或t,第1244位核苷酸由g突变为c或a,第1245位核苷酸由g突变为c,第1268位核苷酸由a突变为g。
28.本发明内容还包括一种表达盒、重组载体或细胞,其含有所述的核酸或基因。
29.本发明中适用的载体包括可从商业渠道获得的质粒,包括但不限于:pbr322、pkk223-3、gem1pd10、psix174bluescript ii ks、pnh8a、pnh16a、pnh18a、pnh46a、ptrc99a、pdr540、prit5、pkk232-8、pcm7、psv2cat、pog44、pxt1、psg、psvk3、pbpv、pmsg和psvl等。
30.本发明内容还包括所述的水稻hppd突变型蛋白、所述的核酸或基因,所述的表达盒、重组载体或细胞在植物抗除草剂方面的应用。
31.其中,所述除草剂为hppd抑制剂类除草剂,包括三酮类、吡唑酮类以及异噁唑酮类,作为优选,所述除草剂为硝磺草酮、苯唑草酮、异噁唑草酮、环磺酮中的一种或多种。
32.本发明内容还包括一种获得具有除草剂抗性的植物细胞、植物组织、植物部分或植物的方法,包括如下步骤:
33.1)使植物包含所述的核酸或基因;或
34.2)使植物表达所述的水稻hppd突变型蛋白;
35.3)通过突变的方法,获得包含所述的核酸或基因,或所述的突变型水稻hppd蛋白或其生物活性片段;或
36.(4)对植物细胞、植物组织、植物部分或植物的内源hppd基因进行基因编辑,以实现在其中表达任一项所述的突变型水稻hppd蛋白。
37.其中,所述突变的方法包括定向突变的方法,具体为通过基因定点突变、易错pcr、基因编辑(包括crispr、talen、锌指酶等介导的方法)等。
38.其中,所述的方法,其包括易错pcr、基因编辑(包括crispr、talen、锌指酶等介导的方法)、转基因、杂交、回交或无性繁殖步骤。
39.本发明内容还包括一种鉴定植物的方法,其中所述植物是包含所述的核酸或基因的植物、表达任一所述的蛋白的植物或由任一所述的方法获得的植物,包括以下步骤:
40.1)测定所述植物是否包含所述的核酸或基因;或
41.2)测定所述植物是否表达所述的蛋白。
42.本发明内容还包括一种控制杂草的方法,包括:对种植作物的大田施用有效剂量的除草剂,所述作物包含所述的核酸或基因或所述的表达盒、重组载体或细胞,所述除草剂包括三酮类、吡唑酮类以及异噁唑酮类,作为优选,所述除草剂为硝磺草酮、苯唑草酮、异噁唑草酮、环磺酮中的一种或多种。
43.本发明内容还包括一种用于保护植物免受由除草剂引起的损伤的方法,包括:对种植作物的大田施用有效剂量的除草剂,所述作物包含所述的核酸或基因或将所述的表达盒、重组载体导入植物,导入后的植物产生除草剂抗性蛋白,所述除草剂包括三酮类、吡唑酮类以及异噁唑酮类,作为优选,所述除草剂为硝磺草酮、苯唑草酮、异噁唑草酮、环磺酮中的一种或多种。
44.本发明中所述植物为粮食作物、经济作物,包括水稻、小麦、油菜等。
45.有益效果:相对于现有技术,本发明具备以下优点:
46.1)本发明利用改良的易错pcr技术,对野生型水稻的hppd编码基因进行大规模随
机突变,筛选到了多个在大肠杆菌中能提高大肠杆菌对hppd抑制剂类除草剂抗的新的突变型基因,结合转基因技术,确定了部分突变位点能够提高水稻对硝磺草酮、异噁唑草酮、苯唑草酮和环磺酮的抗性。本发明扩大了抗hppd抑制类除草剂的水稻hppd基因的突变位点范围,为培育抗hppd抑制剂类除草剂的水稻品种提供了更为灵活和多样的选择;同时,本发明鉴定到的突变型水稻hppd基因的转基因植物能够耐受一定浓度的硝磺草酮、异噁唑草酮、苯唑草酮,扩展了在水稻中可选的hppd抑制剂类除草剂的范围。结合基因编辑技术的优势,鉴定到赋予植物对于hppd抑制剂类除草剂抗性或耐受性的新型突变型水稻hppd蛋白就显现出了重大的意义。
47.2)利用市售的易错pcr试剂盒不能对水稻hppd基因有效地进行随机突变。本发明通过大量的前期实验,优化易错pcr组分和反应条件,最终将突变率较为精准地控制在1~2个碱基的范围内,该方法可能为其他基因的定点突变提供技术借鉴。通过优化的易错pcr结合饱和突变的方法对水稻野生型hppd蛋白进行了系统性的突变并在大肠杆菌中进行抗性或耐受性检测,获得了一系列耐受hppd抑制剂类除草剂的新的突变型蛋白。此外,本发明使用多种hppd抑制剂类除草剂对表达突变型hppd基因的转基因水稻进行抗性鉴定,发现部分转基因株系能够耐受硝磺草酮、苯唑草酮、异噁唑草酮、环磺酮等四种除草剂,扩大了水稻可选hppd抑制剂类除草剂的种类,这对于培育hppd抑制剂类除草剂的抗性或耐受性植物具有十分广泛的应用前景。
48.3)本发明获得的单点突变或多点突变的突变型蛋白,在大肠杆菌中能够耐受最高300μm的硝磺草酮、1000μm的苯唑草酮、800μm的异噁唑草酮等hppd抑制剂类除草剂。本发明含有单点或多点突变的转基因水稻能够耐受最高12g a.i./亩的硝磺草酮、3g a.i./亩的苯唑草酮、12g a.i./亩的异噁唑草酮和3g a.i./亩的环磺酮等四种hppd抑制剂类除草剂。
附图说明
49.图1、易错pcr预实验琼脂糖凝胶电泳结果。
50.图2、显示了在0~20μm的硝磺草酮的筛选浓度下,表达了野生型(wt)或部分耐受性较好的单点突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对硝磺草酮的抗性或耐受性越高。绝大多数突变型hppd在10μm硝磺草酮的条件下,仍有明显深于野生型hppd的显色。其中,含有v52i、l54f、t117i、s120a、f132s、y216c、y237n、l295q、h297r、s310a、s310c、s310v、v313i、g315s、g315r、t316k、a333p、p336s、r344k、r345q、r346l、m392i、d349g、f388l和e423g的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对硝磺草酮的耐受性最佳。
51.图3、显示了在0~40μm的硝磺草酮的筛选浓度下,表达了野生型(wt)或双点组合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对硝磺草酮的抗性或耐受性越高。其中,含有y216c/r345q、p336s/r346l、s310c/g415a、l295q/s310c、l54f/r345q、s120a/s310c、f68s/s310c、s310c/m392i、s310c/r345q和s310c/v313i的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对硝磺草酮的耐受性最佳。
52.图4、显示了在0~100μm的硝磺草酮的筛选浓度下,表达了野生型(wt)、三点组合
突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对硝磺草酮的抗性或耐受性越高。其中,含有y216c/r345q/p336s、y216c/r345q/r346l、l92i/s310c/v313i和p336s/r345q/r346l的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对硝磺草酮的耐受性最佳。
53.图5、显示了在0~250μm的硝磺草酮的筛选条件下,表达了野生型(wt)、四点组合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对硝磺草酮的抗性或耐受性越高。其中,含有y216c/r345q/p336s/r346l、v52i/y216c/p336s/r345q和y216c/p277v/s310c/r345q的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对硝磺草酮的耐受性最佳。
54.图6、显示了在0~500μm的硝磺草酮的筛选条件下,表达了野生型(wt)、五点组合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对硝磺草酮的抗性或耐受性越高。所示3种组合的y216c/s310c/p336s/r345q/r346l、v29a/y216c/s310c/p336s/r345q和v52i/y216c/s310c/p336s/r345q在大肠杆菌中均能耐受至少300μm的硝磺草酮。
55.图7、显示了在0~120μm的苯唑草酮的筛选条件下,表达了野生型(wt)或单点突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对苯唑草酮的抗性或耐受性越高。绝大多数突变型hppd在60μm苯唑草酮的条件下,仍有明显深于野生型hppd的显色。其中,含有v52i、f68s、f132s、y216c、h297r、s310c、s310v、v313i、r345q、m392i、f388l、s404g和q406r的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对苯唑草酮的耐受性最佳。
56.图8、显示了在0~120μm的苯唑草酮的筛选条件下,表达了野生型(wt)或双点组合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对苯唑草酮的抗性或耐受性越高。其中,含有r345q/r346l、y216c/r345q、p336s/r346l、v29a/r346l、s310c/g415a、s310c/g415n、l295q/r345q、f68s/s310c、v266a/s310c、v266a/r345q和s310c/v313i的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对苯唑草酮的耐受性最佳。
57.图9、显示了在0~250μm的苯唑草酮的筛选条件下,表达了野生型(wt)、三点组合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对苯唑草酮的抗性或耐受性越高。其中,含有y216c/p336s/r345q、y216c/r345q/r346l、v29a/y216c/r345q、l92i/s310c/v313i、p336s/r345q/r346l、l54f/l295q/s310c、l92i/l295q/r345q/和l54f/p336s/r346l的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对苯唑草酮的耐受性最佳。
58.图10、显示了在0~500μm的苯唑草酮的筛选条件下,表达了野生型(wt)、四点组合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对苯唑草酮的抗性或耐受性越高。其中,含有y216c/p336s/r345q/r346l、v52i/y216c/p336s/r345q、s310c/p336s/r345q/r346l、v29a/l295q/s310c/g415a和v52i/l295q/s310c/g415a的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对苯唑草酮的耐受性最佳。
59.图11、显示了在0~1000μm的苯唑草酮的筛选条件下,表达了野生型(wt)、五点组
合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对苯唑草酮的抗性或耐受性越高。其中,组合y216c/s310c/p336s/r345q/r346l的耐受性最好,在1000μm苯唑草酮的筛选条件能够显色,v52i/y216c/s310c/p336s/r345q耐受性较好,在800μm苯唑草酮的筛选条件能够显色,v29a/y216c/s310c/p336s/r345q能够耐受在600μm苯唑草酮。
60.图12、显示了在0~5μm的环磺酮的筛选条件下,表达了野生型(wt)、单点组合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对苯唑草酮的抗性或耐受性越高。绝大多数突变型hppd在2μm环磺酮的条件下,仍有明显深于野生型hppd的显色。其中,含有f68s、y216c、v266a、h297r、v313i、p336s、r345q、r346l、m392i的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对环磺酮的耐受性最佳。
61.图13、显示了在0~160μm的异噁唑草酮的筛选条件下,表达了野生型(wt)、单点组合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对异噁唑草酮的抗性或耐受性越高。绝大多数突变型hppd在100μm异噁唑草酮的条件下,仍有明显深于野生型hppd的显色。其中,含有v52i、68s、p99l、f132s、y216c、h297r、v313i、s310v、p336s、r345q、r346l和m392i的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对异噁唑草酮的耐受性最佳。
62.图14、显示了在0~1000μm的异噁唑草酮的筛选条件下,表达了野生型(wt)、五点组合突变型水稻hppd基因的大肠杆菌在含培养液的48孔板中的显色反应。在含有相同浓度除草剂的培养条件下,颜色越深表示相应的突变型hppd蛋白对苯唑草酮的抗性或耐受性越高。其中,组合y216c/s310c/p336s/r345q/r346l和v29a/y216c/s310c/p336s/r345q的耐受性最好,在800μm异噁唑草酮的筛选条件能够显色,v52i/y216c/s310c/p336s/r345q能够耐受在600μm异噁唑草酮。
63.图15、显示了用于水稻转化的水稻野生型或突变型的hppd转基因表达载体的构建图。zmpubi:玉米ubi基因启动子;oshppd:野生型或或突变型水稻hppd基因;6
×
his tag:串联6次的组氨酸标签;nos ter:nos终止子;p35s:花椰菜花叶病毒35s启动子;hygr:潮霉素抗性基因;35s ter:35s终止子;lb:t-dna左边界,rb:t-dna右边界。
64.图16、野生型和突变型hppd转基因水稻对硝磺草酮的耐受性情况。其中,含有v266a、s310c、v313i和r345q突变形式的hppd转基因植株能够耐受6g a.i./亩的硝磺草酮。y216c/r345q、p336s/r346l、l295q/s310c、f68s/s310c、s310c/r345q、s310c/g415a、s310c/v313i、y216c/p336s/r345q、y216c/r345q/r346l,l92i/s310c/v313i,y216c/s310c/p336s/r345q/r346l、v29a/y216c/s310c/p336s/r345q和v52i/y216c/s310c/p336s/r345q能够耐受12g a.i./亩的硝磺草酮。
65.图17、野生型和突变型hppd转基因水稻对苯唑草酮的耐受性情况。其中,含有f68s、f132s、v313i、s310c、r345q和m392i突变形式的hppd转基因植株能够耐受对苯唑草酮(1.5g a.i./亩)具有不同程度的耐受性。y216c/r345q、p336s/r346l、s310c/g415a、s310c/v313i、f68s/s310c、l295q/r345q,y216c/r345q/r346l,l92i/s310c/v313i,y216c/p336s/r345q、y216c/s310c/p336s/r345q/r346l、v29a/y216c/s310c/p336s/r345q和v52i/y216c/s310c/p336s/r345q能够耐受3g a.i./亩浓度的苯唑草酮。
66.图18、野生型和突变型hppd转基因水稻对异噁唑草酮的耐受性情况。其中,含有f68s、f132s、v313i、s310c和p336s突变形式的hppd转基因植株对异噁唑草酮(6g a.i./亩)具有不同程度的耐受性。y216c/r345q、p336s/r346l、l295q/s310c、f68s/s310c、s310c/r345q、s310c/m392i、y216c/p336s/r345q、y216c/r345q/r346l、l92i/s310c/v313i、y216c/s310c/p336s/r345q/r346l、v29a/y216c/s310c/p336s/r345q和v52i/y216c/s310c/p336s/r345q能够耐受12ga.i./亩浓度的异噁唑草酮。
67.图19、野生型和突变型hppd转基因水稻对环璜酮的耐受性情况。其中,含有f68s、v266a、s310c、r345q和m392i突变形式的hppd转基因植株能够耐受1.5g a.i./亩浓度的环璜酮。y216c/r345q、l295q/s310c、l295q/r345q、s310c/m345q、s310c/m392i、y216c/s310c/p336s/r345q/r346l、v29a/y216c/s310c/p336s/r345q和v52i/y216c/s310c/p336s/r345q能够耐受3g a.i./亩浓度的环璜酮。
具体实施方式
68.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
69.实施例1、水稻hppd(oshppd)基因的克隆
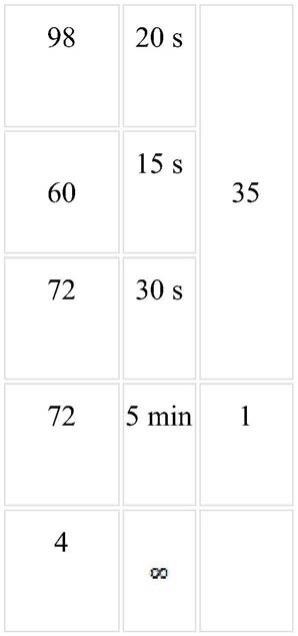
70.根据水稻(oryza sativa japonica)hppd基因(基因id:loc_os02g07160)的编码区序列以及pet-28a载体的序列设计并合成引物(金斯瑞,中国):28a-oshppd-f:tgggtcgcggatccgaattcatgcctcccactcccacc和28a-oshppd-r:tggtggtggtggtgctcgagctaggatccttgaactgtaggggc。利用这对引物,以水稻品种日本晴的cdna为模板,用phanta max高保真dna聚合酶(p505-d1,诺唯赞,中国)扩增水稻hppd基因。反应体系为:pcr扩增条件如下:
[0071][0072]
用1%的琼脂糖凝胶对pcr产物进行电泳,在紫外灯下切下含有大约1.4kb的目标条带的琼脂糖胶条,按照dna纯化试剂盒(axygen,usa)的说明书步骤,对目标条带进行纯化;利用微量分光光度计(nanodrop)测定纯化产物浓度为31ng/μl。pet-28a载体为本实验室保存,浓度为124ng/μl。
[0073]
将1.4kb的pcr产物和pet-28a载体分别用限制性内切酶ecor i和xho i(takara,japan)进行双酶切,反应体系和反应条件为:pcr产物或pet-28a载体,30μl;10
×
h缓冲液,5μl;ecor i(15u/μl),1μl;xho i(10u/μl),1μl;ddh2o,13μl;37℃,2h。按照dna纯化试剂盒(axygen,usa)的说明书步骤,回收约1.4kb的hppd基因片段和5.4kb的pet-28a载体片段,得到含有相同黏性末端的hppd基因片段和线性化载体片段,利用微量分光光度计(nanodrop)测得hppd片段纯化产物浓度为20ng/μl,pet-28a载体纯化产物浓度为35ng/μl。用t4 dna连
接酶(takara,japan)将上述2个纯化后的片段连接在一起,反应体系和反应条件:5
×
t4 dna连接酶缓冲液,2μl;hppd片段,2μl;pet-28a载体片段,2μl;t4 dna连接酶(350u/μl),1μl;ddh2o,3μl;22℃,1h。将连接产物全部转入100μl 缓慢融化的dh5α感受态细胞(擎科,中国)中,轻轻吹吸混匀,冰上静置30min,42℃水浴45s,冰上静置2min,加入500μl不含抗生素的液体lb培养基,37℃220rpm恢复培养1h,涂布于含有50μg/ml卡那霉素的固体lb培养基平板上,置于37℃温箱倒置培养12h,用121℃高压灭菌后的牙签挑取单克隆菌落,用载体和基因特异性引物(正向引物pet28a-sf:taatacgactcactatagg,反向引物oshppd-cr:ctaggatccttgaactgtaggggc)进行菌落pcr鉴定阳性克隆,pcr反应体系和反应条件为:
[0074][0075][0076]
菌落pcr反应共挑取8个克隆,其中7个可以扩增出约为500bp的目标条带,作为阳性克隆。选取扩增条带较亮的2号和5号克隆,分别接种于含有50μg/ml卡那霉素的液体lb培养基中,37℃振荡培养12h,利用质粒小量提取试剂盒(康为世纪,中国)提取质粒得到pet28a-oshppd-2和pet28a-oshppd-5,利用微量分光光度计(nanodrop)测定质粒浓度pet28a-oshppd-2为345ng/μl,pet28a-oshppd-5浓度为288ng/μl。利用引物pet28a-sf:taatacgactcactatagg和pet28a-sr:gctagttattgctcagcgg对质粒进行sanger测序验证(擎科,中国),2个质粒测序结果一致,故采用浓度较高的pet28a-oshppd-2进行后续实验。
[0077]
实施例2、利用易错pcr对水稻hppd基因(oshppd)进行随机突变
[0078]
野生型水稻hppd基因(seq id no:1所示)的gc含量为70.8%,氨基酸序列如seq id no:2所示,本发明首先尝试利用可调型易错pcr试剂盒(天恩泽,cat#:101005-100,中国),以稀释后的pet28a-oshppd-2质粒为模板进行易错pcr,未能得到扩增条带。为此,本发明尝试不同的pcr试剂和反应条件,对易错pcr体系进行优化。由于水稻hppd基因gc含量很高,本发明用专门适用于高gc含量基因扩增的2
×
gc i buffer(takara,cat#:9154)作为pcr缓冲液,使用扩增能力强的taq dna聚合酶(5u/μl)(takara,cat#:r500a)进行易错pcr,并对扩增体系中的datp,dttp,dctp,dgtp(表1),mncl2和mgcl2使用量进行优化,测试扩增效率和突变率。不同dntp的使用浓度组合见表1:
[0079]
表1易错体系中dntp使用浓度预实验
[0080][0081]
表中第一行的编号,对应下面电泳中的泳道2-21;dntp浓度的单位为mm。
[0082]
琼脂糖凝胶电泳结果表明,当任何一种dntp浓度为0时,都不能扩增任何条带。而dntp浓度为0.07~0.8mm,即正常扩增浓度的0.35~4倍时,能够扩出目的条带。mncl2浓度
在0.2mm以下时,能够扩增出目的产物;而在0.2mm以上时,随着mncl2浓度的增加,hppd基因目的条带逐渐变弱;在mncl2浓度为0.4mm以上时,检测不到扩增条带。mgcl2的浓度不影响扩增产物量。实验结果见图1。
[0083]
随后对不同反应条件下的hppd易错pcr扩增产物进行切胶纯化,并克隆到pclone007 simple载体(擎科,中国)中,反应体系为:hppd纯化片段,2μl;pclone007simple载体,1μl;10
×
topo混合液,1μl;ddh2o,6μl。将连接产物全部转入50μl缓慢融化的dh5α感受态细胞(擎科,中国)中,轻轻吹吸混匀,冰上静置30min,42℃水浴45s,冰上静置2min,加入500μl不含抗生素的液体lb培养基,37℃220rpm恢复培养1h,涂布于含有50μg/ml卡那霉素的固体lb培养基平板上,置于37℃温箱倒置培养12h,用121℃高压灭菌后的牙签挑取单克隆菌落,用载体和基因特异性引物(正向引物pet28a-sf,反向引物oshppd-cr)进行菌落pcr鉴定阳性克隆。挑取20个单克隆进行sanger测序,结果表明当dntp浓度为0.4mm时,mnci2的添加量为0.2mm时,mgci2的添加量为2.5mm时,突变率为1~2bp/克隆。本发明采用上述pcr体系,以100倍稀释后的pet28a-oshppd-2质粒为模板,进行易错pcr。
[0084]
本发明共进行了4次独立的易错pcr扩增,每次额外添加1种特定的dntp,使该种dntp终浓度为0.4mm,其他3种dntp终浓度保持在0.2mm。
[0085]
易错pcr反应体系:
[0086]2×
gc i pcr buffer(mgci
2 plus)15μldatp或dttp或dctp或dgtp(2.5mm)2.4μl10
×
易错pcr专用dntp(2.5mm each)2.4μl易错pcr专用mncl2(10mm)0.6μl100倍稀释的pet28a-oshppd-2质粒0.5μl10μm扩增正向引物(28a-oshppd-f)1μl10μm扩增反向引物(28a-oshppd-r)1μlrtaq dna聚合酶0.5μlddh2o6.6μl
[0087]
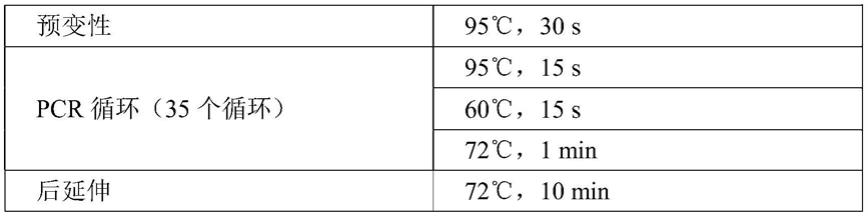
易错pcr反应程序:
[0088][0089]
实施例3、基于显色反应的hppd抗性突变体的筛选
[0090]
大肠杆菌中的酪氨酸氨基转移酶可以催化酪氨酸生成对羟苯基丙酮酸(4-hpp),后者被hppd催化生成尿黑酸(hga),再经自氧化作用生成棕色色素。hppd抑制剂可以抑制hppd的催化反应,从而抑制棕色色素的产生。因此,可以根据棕色色素颜色的深浅来初步判断hppd活性的强弱或者受抑制程度。
[0091]
为了摸索稳定的显色反应条件,本研究首先测试了野生型水稻hppd在大肠杆菌中能够耐受硝磺草酮的临界浓度。首先取1μl pet28a-oshppd-2质粒,加入到50μl缓慢融化的bl21-gold(de3)感受态细胞(优宝生物,中国)中,轻轻吹吸混匀,冰上静置30min,42℃水浴
热激45s,冰上静置2min,37℃恢复培养1h,涂布于含有50μg/ml卡那霉素的固体lb培养基平板上,37℃倒置培养12h。用灭过菌的牙签挑取单克隆,在一个新的含有50μg/ml卡那霉素的固体lb培养基平板上划线保存菌种,同时利用引物进行菌落pcr(正向引物pet28a-sf:taatacgactcactatagg,反向引物oshppd-cr:ctaggatccttgaactgtaggggc),筛选阳性克隆。挑取阳性单菌落,分别接种于含有0μm、1μm、2μm、5μm、10μm、15μm、20μm、30μm、40μm、50μm和100μm共11种浓度的硝磺草酮、1g/l酪氨酸底物和iptg诱导剂的液体lb培养基中,37℃,150rpm振荡培养24h;iptg的浓度设置0.01mm、0.02mm、0.05mm、0.1mm、0.2mm、0.5mm和1mm共7个浓度。结果表明,在iptg为0.02mm时,0mm硝磺草酮对应的孔显色程度最深,且2μm硝磺草酮浓度对应的孔完全没有显色,1μm硝磺草酮对应的孔有极微弱的显色。后在0.02mm的iptg的条件下,重复显色实验3次,均得到与第1次预实验相同的结果,说明该条件较稳定,可用于后续显色反应,即0.02mm的iptg诱导剂,2μm硝磺草酮作为野生型水稻hppd不能显色的临界浓度。
[0092]
本研究共进行4次独立的易错pcr扩增反应(datp,dttp,dctp,dgtp4种独立易错pcr),将所有易错pcr扩增产物分别连入pet-28a载体后得到突变对应的pet28a-mhppd质粒,转化bl21-gold(de3)感受态细胞,总共挑取约201300个单克隆,在24孔板中进行显色反应。具体实验过程如下:
[0093]
对于每次独立的易错pcr反应,取100μl产物用限制性内切酶ecor i和xho i(takara,japan)分2管进行双酶切,反应体系和反应条件为:易错pcr产物,50μl;10
×
h缓冲液,8μl;ecor i,1μl;xho i,1μl;ddh2o,20μl;37℃,2h。按照dna纯化试剂盒(axygen,usa)的说明书步骤,回收约1.4kb的易错pcr后的hppd片段,利用微量分光光度计(nanodrop)测得hppd片段纯化产物的浓度。所测4次独立的易错pcr纯化产物浓度分别为27ng/μl、25ng/μl、32ng/μl和30ng/μl。将纯化后的hppd易错pcr产物分别与此前纯化的pet-28a载体进行连接,反应体系和反应条件为:5
×
t4 dna连接酶缓冲液,2μl;hppd片段,2μl;pet-28a载体片段,2μl;t4 dna连接酶,1μl;ddh2o,3μl;22℃,1h。对于每次易错pcr片段的连接产物,同时进行5管连接反应。对于每管连接产物,分别将产物全部加入100μl缓慢融化的bl21-gold(de3)感受态细胞(本实验室制备,适用于电击转化)中,用移液器枪头轻柔吹吸混匀,吸出感受态细胞与质粒的混合物全部转入-20℃预冷的电击杯中(bio-rad,usa),将电击杯插入电击转化仪(eppendorf,germany)的孔槽中,取出电击杯,加入500μl不含抗生素的液体lb培养基轻轻吹打混匀,吸出菌液转入1.5ml离心管中,37℃,200rpm振荡,恢复培养1h;分别涂布于4个含有50μg/ml卡那霉素的固体lb培养基平板上,37℃倒置培养12h,用高压灭菌的牙签尽可能地挑取所有单克隆菌落,接种到含有2μm硝磺草酮和1g/l酪氨酸底物的lb液体培养基的24孔板中,28℃,150rpm振荡培养24h。然后根据它们在酪氨酸代谢过程中产生棕色色素的颜色深浅来评价突变型hppd活性的强弱。
[0094]
在含有2μm硝磺草酮的条件下,共鉴定到1017个有不同程度显色的克隆,蘸取显色的孔中的菌液,接种到含有50μg/ml卡那霉素的液体lb培养基中,37℃,220rpm振荡培养12h后,提取质粒pet28a-mhppd,利用引物pet28a-sf:taatacgactcactatagg和pet28a-sr:gctagttattgctcagcgg对质粒pet28a-mhppd进行sanger测序验证,将测序结果利用vector nti软件与野生型水稻hppd基因进行比对,共鉴定到60种不同氨基酸变化的单点突变和2种不同的双点突变形式,包括:v29a、v52i、l54f、f68s、l92i、p99l、t117i、s120a、f132s、
a133t、r146l、a156v、e206q、e206v、y216c、y237n、i238t、f244l、v266a、n270d、t273s、p277v、v282e、l295q、h297r、s310c、s310v、s310a、s310g、s310t、v313m、v313i、v313l、g315a、g315s、g315r、t316k、a325d、a333p、p336s、n338k、n338i、n338t、r344k、r345l、r345q、r346l、d349g、n357s、f388l、m392i、s404g、s404l、s404t、q406r、y408h、g415a、g415n、g415s、e423g、r345q/r346l和s310c/v313i。
[0095]
进一步,根据所有单点和双点的突变形式,利用定点突变试剂盒,分别设计60对特异的突变引物:“mhppd-突变形式-f”和“mhppd-突变形式-r”(序列见定点突变引物列表参见表2),以pet28a-oshppd-2质粒为模板,进行pcr扩增,构建含有相应的突变型hppd基因的pet28a载体,转入bl21-gold(de3)感受态细胞,在2μm硝磺草酮的浓度下,对大规模筛选结果进行验证。确认上述62种突变型hppd确实能够在2μm硝磺草酮的浓度下显色。对于利用2μm硝磺草酮筛选到的能够显色的单点和双点突变型hppd蛋白,利用上述同样的显色方法,进一步提高硝磺草酮的浓度,检测鉴定到的突变型hppd蛋白是否能在大肠杆菌中耐受更高浓度的硝磺草酮。进一步设置5μm、10μm、15μm和20μm共4种浓度,同时设置0μm和2μm作为对照。显色结果表明,v52i、f68s、l92i、t117i、f132s、y216c、h297r、s310v、s310a、s310c、s310t、v313i、p336s、r345q、r346l、m392i、v29a、l54f、s120a、y237n、i238t、v266a、l295q、g315r、g315s、t316k、a333p、r344k、d349g、f388l和e423g共31个突变(图2),s310c/v313i和r345q/r346l共2种双点突变(图3),显色效果最为明显。
[0096]
表2定点突变引物序列
[0097]
[0098]
[0099]
[0100][0101]
在硝磺草酮筛选鉴定结果的基础上,本发明还检测了上述60种单点突变型hppd对其他种类的hppd抑制剂类除草剂的耐受性,包括苯唑草酮、环磺酮和异噁唑草酮。利用上述同样的显色方法,首先对野生型水稻hppd能够耐受苯唑草酮、环磺酮和异噁唑草酮的临界浓度进行测定和梯度实验。结果表明,苯唑草酮、环磺酮和异噁唑草酮的临界浓度分别为40μm、1μm和80μm,梯度实验结果表明,上述60种单点突变性hppd对这3种除草剂均有不同程度的耐受性(图7、12、13)。其中v52i、f68s、l92i、t117i、f132s、y216c、h297r、s310v、s310a、s310c、s310t、v313i、p336s、r345q、r346l、m392i对这4种除草剂均有一定程度的耐受性,而
其他位点对不同除草剂的耐受性具有差异。如l54f、s120a、y237n、i238t、l295q、a333p、r344k、d349g和e423g仅对硝磺草酮具有一定的耐受性;s404g、q406r和y408h对硝磺草酮和苯唑草酮具有耐受性;s310g、g415a、g415n、v29a、v266a、g315s和t316k对硝磺草酮和环磺酮具有耐受性;a133t、a156v和v282e对硝磺草酮和异噁唑草酮具有耐受性。p99l对硝磺草酮、苯唑草酮和异噁唑草酮具有耐受性;e206q、e206v和g415s对硝磺草酮、异噁唑草酮和环磺酮具有耐受性;f388l对硝磺草酮、苯唑草酮和环璜酮具有耐受性。
[0102]
实施例4、利用定点突变pcr对单点hppd基因突变进行组合
[0103]
考虑到多点突变有可能提高突变型hppd蛋白对hppd抑制剂类除草剂的抗性,本发明在单点突变的基础上,采用定点突变pcr的方法将第一轮显色筛选中有显色的60个单点突变进行叠加,旨在筛选耐受性强于单点突变的双点突变型hppd,故本轮筛选采用5μm硝磺草酮为起点。
[0104]
具体地,首先以含有单点突变的水稻hppd基因的对应的pet28a-mhppd为模板(验证显色结果时构建的60个载体,质粒浓度均在200ng/μl到350ng/μl之间),质粒100倍稀释后,等体积混合,作为定点突变的模板,引物采用实施例3中的60对引物分别扩增;用phanta高保真dna聚合酶(p505-d1,诺唯赞,中国)进行扩增。pcr反应体系:2
×
phanta max缓冲液,25μl;dntp mix(10mm each),1μl;10μm定点突变正向引物,2μl;10μm定点突变反向引物,2μl;phanta max super-fidelity dna聚合酶(1u/ul),1μl;100倍稀释的pet28a-mhppd混合质粒模板,2μl;ddh2o,17μl。
[0105]
pcr反应条件为:
[0106][0107]
取20μl扩增产物用限制性内切酶dpn i(10u/μl,takara,japan)消化,以除去甲基化的质粒模板,反应体系和条件:点突变扩增产物,20μl;10
×
t缓冲液,4μl;dpn i,1μl;ddh2o,15μl;37℃,6h;70℃,15min。将热失活后的酶切产物,加入100μl缓慢融化的bl21-gold(de3)感受态细胞中,轻轻吹吸混匀,冰上静置30min,42℃水浴热激45s,冰上静置2min,加入500μl不含抗生素的液体lb培养基,37℃恢复培养1h,分别涂布于5个含有50μg/ml卡那霉素的固体lb培养基平板上,37℃倒置培养12h,用高压灭菌的牙签尽可能地挑取所有单克隆菌落,接种到含有5μm硝磺草酮的lb液体培养基的24孔板中,28℃,150rpm振荡培养24h。然后根据它们在酪氨酸代谢过程中产生棕色色素的颜色深浅来评价突变型hppd活性的强弱。同实施例3中所述过程类似的,蘸取显色的孔中的菌液,接种到含有50μg/ml卡那霉素的液体lb培养基中,37℃,220rpm振荡培养12h后,提取质粒,利用引物pet28a-sf:taatacgactcactatagg和pet28a-sr:gctagttattgctcagcgg对得到的质粒进行sanger测序验证,将测序结果利用vector nti软件与野生型水稻hppd基因进行比对。本轮筛选共挑取约26000个单克隆,在24孔板中进行显色反应,筛选条件同实施例3中所述。共得到19个新的能够耐受5μm硝磺草酮的双点突变型hppd,包括:y216c/r345q、p336s/r346l、v29a/r346l、
l295q/s310v、v29a/s310c、s310c/g415a、s310c/g415n、l295q/r345q、l295q/s310c、l54f/r345q、l54f/r346l、s120a/s310c、f68s/s310c、v266a/s310c、v266a/r345q、s310c/m392i、s310c/r345q、t273s/s310c、l92i/m392i,连同易错pcr筛选到的2种双点突变r345q/r346l、s310c/v313i,本发明共鉴定到21种对5μm硝磺草酮的有耐受性的双点突变型hppd(图3、8)。本次测序后得到的双点突变的质粒,继续用于更高浓度除草剂耐受性的鉴定和后续更多点突变型hppd的筛选的模板。
[0108]
具体地,首先分别取1μl得到的双点突变的质粒,分别加入25μl缓慢融化的bl21-gold(de3)感受态细胞中,轻轻吹吸混匀,冰上静置30min,42℃水浴热激45s,冰上静置2min,加入500μl不含抗生素的液体lb培养基,37℃恢复培养1h,分别涂布于含有50μg/ml卡那霉素的固体lb培养基平板上,37℃倒置培养12h。利用引物pet28a-sf和oshppd-cr对进行菌落pcr(pet28a-sf:taatacgactcactatagg,oshppd-cr:ctaggatccttgaactgtaggggc),每个载体检测8个单克隆。对于每个单独的质粒转化事件,分别挑取3个单克隆,接种到含有更高浓度硝磺草酮的液体lb培养基中,本轮筛选设置10μm、20μm、30μm和40μm共4种浓度,同时设置0μm和5μm作为对照。显色结果表明,被测的21种双点突变形式,包括:r345q/r346l、y216c/r345q、p336s/r346l、v29a/r346l、l295q/s310v、v29a/s310c、s310c/g415a、s310c/g415n、l295q/r345q、l295q/s310c、l54f/r345q、l54f/r346l、s120a/s310c、f68s/s310c、v266a/s310c、v266a/r345q、s310c/m392i、s310c/r345q、t273s/s310c、l92i/m392i和s310c/v313i在一定程度耐受5μm或5μm以上的硝磺草酮。其中,含有y216c/r345q、p336s/r346l、s310c/g415a、l295q/s310c、l54f/r345q、s120a/s310c、f68s/s310c、s310c/m392i、s310c/r345q和s310c/v313i的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对硝磺草酮的耐受性最佳。利用与上述同样的突变和筛选策略,本发明对于突变位点进一步叠加,即以所有在5μm的硝磺草酮浓度下能够显色的双点突变型hppd载体作为模板,用60对引物分别扩增筛选耐受性更好的三点突变型hppd,以此类推,直至五点突变型hppd。三点突变型共筛选约25000个单克隆,四点突变共筛选约18000个单克隆,五点突变共筛选约9500个单克隆。本发明采用逐轮升高的起始硝磺草酮筛选浓度来筛选耐受性更好的突变型水稻hppd,即三点突变的起始硝磺草酮筛选浓度为20μm,四点突变为50μm,五点突变为100μm。利用起始筛选浓度得到新的突变型hppd之后,进一步设置更高的硝磺草酮浓度梯度,鉴定突变型hppd耐受硝磺草酮的上限。本研究共筛选到28个能够至少耐受20μm硝磺草酮的三点突变型hppd,包括:y216c/p277v/r345q、y216c/p336s/r345q、y216c/r345q/r346l、v29a/y216c/r345q、y216c/r345q/g415a、y216c/r345q/e423g、l92i/s310c/v313i、v52i/y216c/r345q、y216c/r345q/f388l、p336s/r345q/r346l、l295q/s310c/g415a、l54f/l295q/s310c、s120a/l295q/s310c、l295q/s310c/f388l、l54f/l295q/r345q、l92i/l295q/r345q、l295q/s310c/r345q、l54f/s310c/g415a、l92i/s310c/g415a、v266a/s310c/g415a、s310c/v313i/g415a、l54f/p336s/r346l、l92i/p336s/r346l、s310c/p336s/r346l、v29a/s310c/v313i、l54f/s310c/v313i、i238t/s310c/v313i、l54f/y216c/r345q;14个能够至少耐受50μm硝磺草酮的四点突变型hppd,包括:v29a/y216c/p336s/r345q、y216c/p336s/r345q/r346l、v52i/y216c/p336s/r345q、y216c/p336s/r345q/e423g、y216c/s310c/r345q/g415a、l54f/y216c/s310c/r345q、y216c/p277v/s310c/r345q、v52i/y216c/s310c/r345q、y216c/s310c/r345q/f388l、s310c/p336s/r345q/r346l、v29a/l295q/s310c/g415a、v52i/l295q/s310c/
g415a、l54f/l295q/s310c/g415a、l295q/s310c/m392i/g415a;3个能够至少耐受300μm硝磺草酮的五点突变型hppd,包括:y216c/s310c/p336s/r345q/r346l、v29a/y216c/s310c/p336s/r345q和v52i/y216c/s310c/p336s/r345q(图4-6)。
[0109]
在本发明鉴定到的四点突变型hppd中,14个能够至少耐受50μm硝磺草酮的四点突变型hppd,与单独的三点突变型hppd最高能够耐受20μm硝磺草酮,以及其他单点突变型hppd最高能够耐受10μm硝磺草酮相比,该14个四点突变型hppd的效果远远优于三点突变型和单点突变型耐受能力之和;同时,五点突变型y216c/s310c/p336s/r345q/r346l和v29a/y216c/s310c/p336s/r345q能够耐受300μm的硝磺草酮,其中,四点突变型y216c/p336s/r345q/r346l和v29a/y216c/p336s/r345q能够耐受150μm的硝磺草酮,而单点突变型s310c仅能耐受10μm硝磺草酮,因此,该五点突变型y216c/s310c/p336s/r345q/r346l和v29a/y216c/s310c/p336s/r345q效果远远优于两者之和。
[0110]
利用苯唑草酮对上述双点及多点组合进行抗性验证。双点突变利用40μm、60μm、80μm、100μm和120μm等5个浓度进行显色,结果表明r345q/r346l、y216c/r345q、p336s/r346l、v29a/r346l、s310c/g415a、s310c/g415n、l295q/r345q、f68s/s310c、v266a/s310c、v266a/r345q和s310c/v313i的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对苯唑草酮的耐受性最佳。三点突变利用50μm、100μm、150μm、200μm和250μm等5个浓度进行显色,结果表明y216c/p336s/r345q、y216c/r345q/r346l、v29a/y216c/r345q、l92i/s310c/v313i、p336s/r345q/r346l、l54f/l295q/s310c、l92i/l295q/r345q/和l54f/p336s/r346l的耐受性最佳;四点突变利用100μm、200μm、300μm、400μm和500μm等5个浓度进行显色结果表明y216c/p336s/r345q/r346l、v52i/y216c/p336s/r345q、s310c/p336s/r345q/r346l、v29a/l295q/s310c/g415a和v52i/l295q/s310c/g415a的突变型hppd对应的孔显色最深,表明其在大肠杆菌中对苯唑草酮的耐受性最佳;五点突变利用200μm、400μm、600μm、800μm和1000μm等5个浓度进行显色。同时设置0μm作为对照。结果表明组合y216c/s310c/p336s/r345q/r346l和v52i/y216c/s310c/p336s/r345q耐受性较好(图8-11)。另外,利用异噁唑草酮对上述五点组合进行抗性验证,结果表明组合y216c/s310c/p336s/r345q/r346l和v29a/y216c/s310c/p336s/r345q的耐受性最好,在800μm异噁唑草酮的筛选条件能够显色,v52i/y216c/s310c/p336s/r345q能够耐受在600μm异噁唑草酮(图14)。
[0111]
实施例5、hppd蛋白的表达与纯化
[0112]
将100ng的水稻野生型hppd基因表达载体质粒pet28a-hppd-2和相应的单点或双点或多点的水稻突变型hppd表达载体质粒pet-mhppd分别加入到100μl经过缓慢融化的大肠杆菌菌株bl21-gold(de3)的感受态细胞中(诺唯赞,中国),冰上放置30min,42℃水浴60s,冰上放置2min,加入500μl不含抗生素的液体lb培养基,37℃振荡恢复培养1h,取将100μl恢复培养产物,均匀涂布于含有50μg/ml卡那霉素的固体lb培养基平板上,置于37℃温箱倒置培养12h,挑取8个单克隆菌落,利用引物pet-sf和oshppd-cr进行菌落pcr(正向引物pet28a-sf:taatacgactcactatagg,反向引物oshppd-cr:ctaggatccttgaactgtaggggc),正确的扩增产物大小约为1.4kb,随后利用1%的琼脂糖凝胶电泳对pcr产物进行检测,如果检测到特异的扩增条带,其相对应的单菌落即为含有目标质粒的阳性转化子。用灭菌的牙签挑取1个验证正确的单菌落,转接至盛有3ml含有50μg/ml卡那霉素的液体lb培养基的试管中,置于37℃摇床,180rpm水平振荡培养5h,转接1ml菌液至盛有100ml含有50μg/ml卡那霉
素的液体lb培养基的锥形瓶中,置于37℃摇床,180rpm水平振荡培养至od
600
在0.4-0.6之间,加入25μl 1m iptg,转移至16℃摇床,180rpm水平振荡诱导15h,8000rpm离心2min收集菌体,用4℃预冷的10mm ph7.4的pbs缓冲液洗涤菌体2次,用10ml 10mm ph7.4的pbs缓冲液重悬菌体,冰上超声破碎10min,超声条件为:功率15%,超声1s,间隔2s,超声10min;超声破碎后12000rpm离心30min,去除沉淀,上清液即为粗酶液。利用co
2
层析柱(ge,usa)按照说明书纯化对粗酶液进行纯化,用含有10mm咪唑的缓冲液冲洗层析柱去除杂质,用含有500mm咪唑的洗脱缓冲液洗脱,得到目的蛋白。
[0113]
sds-page检测纯化后蛋白的纯度。利用8%的变性聚丙烯酰胺凝胶(金斯瑞,中国)对纯化后的蛋白进行电泳,电泳条件为120v恒压120min。电泳结束后,取下凝胶,置于干净的玻璃培养皿中,蒸馏水清洗一次,用0.05%的考马斯亮蓝染液(50%v/v甲醇,10%v/v冰乙酸,0.05%m/v考马斯亮蓝r-250)染色4h,用脱色液(30%v/v甲醇,10%v/v冰乙酸)脱色大约6h(其间换两次新的脱色液),染色和脱色过程均在室温下在水平摇床60rpm缓慢振荡。如果检测到大小正确的单一条带,则表示蛋白纯化效果较好,继续进行后续实验。
[0114]
将纯化后的蛋白放入透析袋(源叶,中国)于4℃条件下进行透析,透析液为10mm pbs(ph7.4)缓冲液,透析10~12h,期间更换两次透析液。透析后的蛋白利用bca蛋白定量试剂盒(生工,中国)进行浓度测定。对应的突变型hppd蛋白的浓度为:wt 138.5ng/μl;v52i 237.8ng/μl;f68s 148.2ng/μl;l92i 176.0ng/μl;t117i 215.9ng/μl;f132s 157.0ng/μl;y216c 170.4ng/μl;v266a 180.7ng/μl;l295q 163.5ng/μl;h297r 265.0ng/μl;s310a 251.3ng/μl;s310c 243.7ng/μl;s310v 263.5ng/μl;s310t188.7ng/μl;v313i 296.8ng/μl;p336s 195.0ng/μl;r345q 168.4ng/μl;g415a 244.2ng/μl;r346l 332.7ng/μl;m392i 140.4ng/μl;y216c/r345q 112.8ng/μl;p336s/r346l220.5ng/μl;l295q/s310c 151.8ng/μl;l295q/r345q 233.5ng/μl;s310c/g415a 233.0ng/μl;s310c/r345q 378.9ng/μl;f68s/s310c 212.6ng/μl;s310c/v313i 235.8ng/μl;s310c/m392i 198.2ng/μl;l92i/m392i 285.1ng/μl;y216c/p336s/r345q 352.6ng/μl;y216c/r345q/r346l 284.9ng/μl;l295q/s310c/r345q 192.5ng/μl;s310c/v313i/g415a 255.3ng/μl;l92i/s310c/v313i 182.3ng/μl;y216c/p336s/r345q/r346l 167.9ng/μl;v52i/y216c/p336s/r345q 295.2ng/μl;v52i/l295q/s310c/g415a 302.7ng/μl;l295q/s310c/m392i/g415a 285.2ng/μl;y216c/s310c/p336s/r345q/r346l 266.3ng/μl;v52i/y216c/s310c/p336s/r345q 234.6ng/μl。
[0115]
实施例6、hppd酶活性及酶动力学参数的测定
[0116]
1)设定对羟基苯丙酮酸(4-hpp)的底物浓度为5.0~100μm(分别包括5、10、20、40、60、80、100μm),配制1ml的标准酶促反应体系:1mm抗坏血酸、10μm fe
2
、10mm pbs(ph7.4)、适量的hppd蛋白,30℃下反应1min后用10%(v/v)tfa终止反应,控制底物转化率不超过10%。利用高效液相色谱(hplc)检测产物尿黑酸(homogentisic acid,hga)的生成量,利用origin pro 8.0软件非线性拟合michaelis menten方程,并计算酶动力学参数。
[0117]
2)hppd抑制剂类除草剂对hppd蛋白抑制能力ic50的测定
[0118]
先将不同浓度的硝磺草酮、苯唑草酮、异噁唑草酮(0、2、4、6、10μm),环磺酮(0、0.2、0.4、0.5、0.8μm)、分别与hppd蛋白在30℃条件下预孵育30min以达到平衡,然后添加到同步骤1)的酶促反应体系中,于30℃条件下再反应10min后用10%(v/v)的tfa终止酶反应。通过hplc检测产物hga生成的结果,计算相对于抑制剂浓度为0μm时其他抑制剂浓度下的相
对酶活。最终hppd的半抑制浓度(ic50)值通过以下方程式进行非线性回归拟合来计算:
[0119]
y=100/[1 10^(x-lgic50)]
[0120]
其中y是不同抑制剂浓度下的相对酶活,x是抑制剂浓度值的对数。
[0121]
酶反应结束后,加入等体积的色谱甲醇终止反应,用0.22μm有机系滤膜过滤后进行高效液相分析,检测产物hga的产生情况。高效液相色谱仪的型号为alliance e2695(waters,usa),使用的色谱柱为zorbax sb-aq 5μ4.6
×
250mm(aglient,usa)反相色谱柱。进样量为20μl,高效液相的分析条件为:先5%~50%甲醇水(buffer a为含0.1%甲酸的水,buffer b为甲醇)梯度10min,然后5%甲醇水等度5min;流速为1ml/min;柱温为30℃。hga的检测波长为292nm。
[0122]
以上的酶活检测相关数据参见表3。
[0123]
表3
[0124]
[0125][0126][0127]
从以上酶动力学相关参数测定结果可以看出,相对于野生型(wt),绝大多数突变
型hppd的相对与hppd抑制剂类除草剂的ic50值均有明显的提高。尽管有的突变型hppd的酶催化活性可能受到一定的影响,但是ic50的提高仍然可以赋予突变型hppd对相应hppd抑制剂类除草剂的耐受性,这从大肠杆菌的显色实验的结果和突变型hppd的转基因水稻对不同种类hppd抑制剂类除草剂的耐受性提高两个方面可以看出来。
[0128]
具体地,其中,超过50%的单点突变型hppd的ic50至少比野生型hppd高出10%。尤其地,s310c和r345q单点突变型hppd相对于硝磺草酮的ic50增幅最大,超过20%;f68s和s310c单点突变型hppd相对于苯唑草酮的ic50增幅最大,超过30%;r345q和r346l单点突变型hppd相对于异噁唑草酮的ic50增幅最大,超过20%;野生型水稻hppd对环磺酮非常敏感,绝大多数单点突变型hppd相对于环磺酮对ic50均有不同程度的提高。
[0129]
双点突变型hppd相对于不同hppd抑制剂类除草剂的ic50的增幅明显高于单点突变型hppd。其中,s310c/r345q相对于硝磺草酮的ic50增幅最大,达到了野生型的1.8倍;l295q/r345q相对于苯唑草酮和环磺酮的ic50增幅最大,分别达到了野生型的2.94倍和5.5倍;p336s/r346l相对于异噁唑草酮的ic50增幅最大,分别达到了野生型的1.67倍。三点突变型hppd相对于不同hppd抑制剂类除草剂的ic50的增幅与双点突变型hppd相仿,也明显高于单点突变型。
[0130]
四点和五点突变型hppd相对于不同hppd抑制剂类除草剂的ic50的增幅更为明显。其中,y216c/r345q/p336s/r346l相对于硝磺草酮和苯唑草酮的ic50分别达到野生型的2.5倍和3.8倍,y216c/r345q/p336s/r346l/s310c的五点突变型hppd的ic50提高幅度更大,分别达到野生型的2.8倍和4.6倍。而对于环磺酮和异噁唑草酮的,四点和五点突变型hppd相比于双点和三点突变,ic50的增幅并不明显。
[0131]
综上可以看出,对于不同种类的hppd抑制剂类除草剂,不同突变形式的hppd的耐受性有所差异。总的来说,随着突变位点数目的累加,突变型hppd对hppd抑制剂类除草剂的ic50值逐步增加,反映出相应突变型hppd对除草剂对耐受性逐步增强。其中,对于环磺酮和异噁唑草酮四点和五点突变的耐受性明显好于单点、双点和三点突变;对于环磺酮和异噁唑草酮,双点和三点突变的耐受性明显好于单点突变,但进一步增加突变位点数目对耐受性增加对作用不大。上述结果为后续转基因实验和应用提供了有价值的参考。
[0132]
此外,值得注意的是含有m392i的单点突变和双点突变型hppd除了ic50值有所增大,本底酶催化速率也明显高于野生型,约为野生型的2倍,说明m392i这种突变形式即使在与野生型hppd相当的表达水平下也有较好的应用潜力,特别适合利用基因编辑等技术对hppd基因进行原位改造。
[0133]
实施例7、突变型hppd基因的水稻表达载体的构建和农杆菌转化
[0134]
根据水稻hppd基因的编码区序列,设计两端添加酶切位点的基因特异性引物,hppd-1:gttacttctgcactaggtaccatgcctcccactcccacc和hppd-2:cttagaattcccggggatccctaggatccttgaactgtaggggc,综合单点到五点显色结果,选则8种单点突变型hppd(f68s、f132s、v266a、s310c、v313i、p336s、r345q和m392i),9种双点突变型hppd(y216c/r345q、p336s/r346l、l295q/s310c、f68s/s310c、s310c/r345q、s310c/g415a、s310c/v313i、l295q/r345q、s310c/m392i)、3种三点突变型hppd(y216c/p336s/r345q、y216c/r345q/r346l、l92i/s310c/v313i)和3种五点突变型hppd(y216c/s310c/p336s/r345q/r346l、v29a/y216c/s310c/p336s/r345q和v52i/y216c/s310c/p336s/r345q),以含有相应突变的
pet28a-mhppd载体为模板,扩增含有相应突变型hppd基因编码区dna序列,1%琼脂糖凝胶电泳后,利用前述试剂盒切胶纯化,用限制性内切酶bamh i和kpn i进行双酶切;,通过同源重组试剂盒(诺唯赞,中国),将hppd片段连入pcambia1390-zmpubi载体(zmpubi,玉米ubiquitin 1基因启动子)(图15),利用引物pubi-sf和oshppd-cr(pubi-sf:gccctgccttcatacgct和oshppd-cr:ctaggatccttgaactgtaggggc)对单克隆菌落进行菌落pcr,每个转化质粒挑取8个单克隆进行菌落pcr检测,从中挑取1个阳性克隆,利用质粒小量提取试剂盒提取质粒,并利用引物pubi-sf和nost-sr(pubi-sf:gccctgccttcatacgct,nost-sr:tgccaaatgtttgaacgatc)进行sanger测序,并利用vector nit软件与野生型水稻hppd基因序列进行比对,验证hppd基因突变位点以及与启动子接头的正确性,构建获得对应突变位点的突变型水稻hppd基因的表达载体pc1390-pubi-mhppd,利用微量分光光度计测定测序正确的质粒的浓度,测定结果分别为pc1390-ubi-mhppd-f68s,313ng/μl;pc1390-ubi-mhppd-f132s,225ng/μl;pc1390-ubi-mhppd-v266a,374ng/μl;pc1390-ubi-mhppd-s310c,295ng/μl;pc1390-ubi-mhppd-v313i,303ng/μl;pc1390-ubi-mhppd-p336s,280ng/μl;pc1390-ubi-mhppd-r345q,357ng/μl;pc1390-ubi-mhppd-m392i,257ng/μl;pc1390-ubi-mhppd-y216c/r345q,378ng/μl;pc1390-ubi-mhppd-p336s/r346l,296ng/μl;pc1390-ubi-mhppd-l295q/s310c,295ng/μl;pc1390-ubi-mhppd-f68s/s310c,340ng/μl;pc1390-ubi-mhppd-s310c/r345q,288ng/μl;pc1390-ubi-mhppd-s310c/g415a,346ng/μl;pc1390-ubi-mhppd-s310c/v313i,246ng/μl;pc1390-ubi-mhppd-l295q/r345q,298ng/μl;pc1390-ubi-mhppd-s310c/m392i,269ng/μl;pc1390-ubi-mhppd-y216c/p336s/r345q,215ng/μl、pc1390-ubi-mhppd-y216c/r345q/r346l,266ng/μl、pc1390-ubi-mhppd-l92i/s310c/v313i,224ng/μl、pc1390-ubi-mhppd-y216c/s310c/p336s/r345q/r346l,227ng/μl;pc1390-ubi-mhppd-v29a/y216c/s310c/p336s/r345q,309ng/μl;pc1390-ubi-mhppd-v52i/y216c/s310c/p336s/r345q,482ng/μl。
[0135]
利用热激法将1μl上述的水稻hppd基因表达载体质粒分别加入到100μl经过缓慢融化的农杆菌菌株eha105的感受态细胞中(唯地生物,中国),液氮冻5min,42℃水浴5min,冰上放置5min,加入500μl lb液体培养基,28℃振荡恢复培养3h,取将100μl恢复培养产物,均匀涂布于含有50μg/ml利福平和50μg/ml卡那霉素的固体lb培养基平板上,置于28℃温箱倒置培养36h,挑取单克隆菌落,利用引物pubi-sf和oshppd-cr进行菌落pcr。对于每个质粒的转化产物,鉴定8个农杆菌单克隆,如果能够扩增出1.4kb的特异性条带,即为含有目标质粒的阳性菌落。为了防止个别单菌落侵染活性较低,每个质粒的农杆菌挑取3个单克隆进行农杆菌介导的水稻遗传转化。
[0136]
实施例8、农杆菌介导的水稻遗传转化及转基因阳性植物的鉴定
[0137]
1)愈伤组织的获得:选择饱满健康的水稻品种日本晴种子去壳;在70%的乙醇中表面消毒1min,其间不断摇动;再用含有1滴吐温-20的3%的次氯酸钠消毒30分钟,其间在摇床上摇动;用灭菌的蒸馏水洗5次,每次约2min,期间不断摇动;然后用镊子将洗过的种子夹出,置于铺有5层无菌的滤纸得培养皿中,将种子均匀铺展在滤纸上,再在其上覆盖5层滤纸,使种子干燥;将15颗种子放置在愈伤诱导固体培养基(n6盐,4g;肌醇,0.1g;脯氨酸,2.8g;水解酪蛋白,0.3g;蔗糖,30g;2g/ml 2,4-d,1ml;植物凝胶,4g;加无离子水至1l;高压灭菌)上,使胚乳埋到培养基内,胚露出培养基表面,使盾片恰好与培养基接触;将培养皿置
mhppd-f132s;pc1390-ubi-mhppd-v266a;pc1390-ubi-mhppd-s310c;pc1390-ubi-mhppd-v313i;pc1390-ubi-mhppd-p336s;pc1390-ubi-mhppd-r345q;pc1390-ubi-mhppd-m392i;pc1390-ubi-mhppd-y216c/r345q;pc1390-ubi-mhppd-p336s/r346l;pc1390-ubi-mhppd-l295q/s310c;pc1390-ubi-mhppd-f68s/s310c;pc1390-ubi-mhppd-s310c/r345q;pc1390-ubi-mhppd-s310c/g415a;pc1390-ubi-mhppd-s310c/v313i;pc1390-ubi-mhppd-l295q/r345q;pc1390-ubi-mhppd-s310c/m392i;pc1390-ubi-mhppd-y216c/p336s/r345q;pc1390-ubi-mhppd-y216c/r345q/r346l;pc1390-ubi-mhppd-l92i/s310c/v313i;pc1390-ubi-mhppd-y216c/s310c/p336s/r345q/r346l;pc1390-ubi-mhppd-v29a/y216c/s310c/p336s/r345q;pc1390-ubi-mhppd-v52i/y216c/s310c/p336s/r345q)的后代,每种选取10~15个转基因阳性单株的后代,种植在土种,待小苗长到3叶期时提取每个单株的作为模版,用引物pubi-sf和oshppd-cr进行pcr扩增(pubi-sf:gccctgccttcatacgct和oshppd-cr:ctaggatccttgaactgtaggggc),根据1:3(不含目的条带的植株:含有目的条带的植株)的孟德尔分离比,选出含有单拷贝插入的转基因株系,保留下来继续种植至4-5叶期,用1倍硝磺草酮(6g a.i./亩作为1倍)、1倍苯唑草酮(1.5ga.i./亩作为1倍)、1倍异噁唑草酮(6g a.i./亩作为1倍)和1倍环璜酮(1.5g a.i./亩作为1倍)处理单点突变型hppd基因的转基因植株。2倍硝磺草酮、苯唑草酮、异噁唑草酮以及环璜酮处理多点突变型hppd基因的转基因植株。使用气压式喷雾器(gardena,germany)对转基因阳性植物进行叶面喷施处理,使液滴均匀分布与叶片表面,以转化受体品种作为对照;于28℃培养室,在长日照条件下,继续培养2周后,观察相应植株的生长状况,选取3个有代表性的独立株系的单株拍照记录(图16~19)。其中,野生型对照植株或不再长出新叶,或长出的新叶完全白化,大部分老叶干枯,植株生长缓慢;对相应hppd抑制剂类除草剂具有耐受性的转基因植株,能够长出新叶,且新叶仍然保持绿色,植株也能一定程度地继续生长;所用的除草剂硝磺草酮(胜邦绿野,中国)、苯唑草酮(basf,germany)、环璜酮、异噁唑草酮(本实验室自行配制)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。