抗-il-23p19抗体制剂
1.相关申请的交叉引用
2.本技术主张2019年9月9日申请的美国临时申请no.62/897,930的优先权,其全部内容并入本文中。
技术领域
3.本发明大体上关于包含结合人类il-23的p19亚基的诸如瑞沙珠单抗(risankizumab)的抗-il-23p19抗体的制剂。更具体言之,公开包含高浓度抗-il-23p19抗体瑞沙珠单抗的药物制剂以及用于治疗各种疾病及病症的相关产品及用途。本文公开包含150mg/ml抗体瑞沙珠单抗的稳定的液体药物制剂。
背景技术:
4.人类il-23由与il-12的共同亚基(p40)及独特p19亚基构成。尽管共享p40亚基,il-23及il-12的作用完全不同。il-12经由促进th1细胞分化、增殖及活化而对th1反应至关重要。与之相对,il-23支持称为th17细胞的cd4
t辅助细胞组的发育及维护,这是因为所述细胞具产生il-17及相关细胞因子的能力。il-23参与慢性自体免疫发炎且il-23活性调节提供针对自体免疫疾病的有效疗法。
5.其中il-23发挥主要作用的自体免疫疾病中的一种是牛皮癣,牛皮癣是慢性免疫介导的炎性疾病,其特征在于过度表达促发炎介体的角质细胞及皮肤浸润性t淋巴球的过度增殖。该疾病是慢性疼痛性免疫介导的炎性皮肤病且具有具备触发易感个体的恶化,因此使治疗具挑战性的变化因素的终身缓解性及复发性过程。牛皮癣的不受控发炎可能会造成常伴共生病症,包括心血管(cv)疾病(包括高血压及经增加的心肌梗塞、中风及cv死亡风险)、肥胖症、2型糖尿病、关节炎及慢性肾病。牛皮癣亦伴随有包括抑郁症、焦虑及自杀倾向的严重精神共生病症以及药物滥用。
6.il-23的高效且特定的抑制剂是抗体瑞沙珠单抗。瑞沙珠单抗是针对il-23的p19亚基的人类化免疫球蛋白g1(igg1)单克隆抗体。瑞沙珠单抗与il-23p19的结合抑制il-23诱导且维持t辅助(th)17型细胞、先天性淋巴细胞、γδt细胞及自然杀手(nk)细胞的作用,所述细胞造成组织发炎、破坏及异常组织修复。瑞沙珠单抗尤其有效地治疗自体免疫及炎性疾病,详言之牛皮癣。临床研究揭露瑞沙珠单抗在斑块型牛皮癣治疗中的极佳安全性及功效。经批准用于治疗牛皮癣的建议剂量为150mg,在第0、4周及其后每12周以两次75mg注射皮下施用。
7.较大药剂体积的注射要求呈现挑战,尤其在药物依从性及持久性比例明显地低于患急性病况患者的患慢性病况患者中如此。皮下施用途径对于需要家庭(自我)药疗的治疗性适应症,例如对于诸如牛皮癣的慢性疾病而言是优选的。然而,皮下施用途径受注射体积限制,此可归因于组织背压及注射疼痛。此种情况亦视所注射制剂而定。通过皮下注射施用的诸如瑞沙珠单抗的大部分药物常以体积不超过1ml的单位剂量使用。因此,对于诸如大于2ml的较高体积,通常使用多次注射,但此方法可能会增加损耗速率或降低患者依从性。
8.因此,为允许在单次注射的情况下施用高剂量的诸如瑞沙珠单抗的抗体,需要具有经增加的抗体浓度的药物制剂。然而,增加抗体制剂中的抗体浓度可能会造成稳定性问题,例如导致高分子量物种(hmws)形成的聚集及黏度增加。因此,提供适用于诸如皮下注射的非经肠施用的稳定高浓度液体抗体制剂是一个巨大的挑战。
技术实现要素:
9.本发明提供包含150mg/ml如本文所定义的抗体的液体抗体制剂。抗体为瑞沙珠单抗或包含与瑞沙珠单抗相同的重链及轻链序列的抗体。本领域中未描述或不可获得具有此类高抗体浓度的该抗体制剂,且本发明通过提供该高浓度抗体制剂而对本领域作出重要贡献。尽管抗体浓度高,本发明制剂是稳定的且适用于治疗用途。如实施例中所展现,本发明的包含150mg/ml抗体瑞沙珠单抗的制剂提供有利稳定性特征且充分适用于皮下施用。其可提供长期稳定性。有利地,150mg剂量的抗体可在单次1ml注射的情况下施用。
10.根据本发明的第一方面,提供包含150mg/ml抗-il-23p19抗体的液体药物制剂,其中抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列。
11.根据此第一方面的第一次方面,该液体药物制剂包含
12.a)150mg/ml抗-il-23p19抗体,其中该抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列;
13.b)多元醇;及
14.c)表面活性剂。
15.此制剂可另外包含d)缓冲剂。此外,本发明提供包含150mg/ml抗体的不含缓冲剂的制剂。如本文所公开,根据第一次方面的液体药物制剂是稳定的。
16.根据此第一方面的第二次方面,提供包含以下的稳定的液体药物制剂:
17.a)150mg/ml抗-il-23p19抗体,其中该抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列;
18.b)张力调节剂;及
19.c)表面活性剂,
20.其中该制剂的ph为5.5-5.9且该制剂具等张性。
21.此制剂可另外包含d)缓冲剂。
22.根据第一方面的150mg/ml抗体制剂的第一次方面及第二次方面的制剂亦可以经冻干形式提供。
23.在相关方面中,提供含有本发明制剂的密封容器。
24.在相关方面中,本发明涉及用于治疗性治疗人类个体的本发明制剂或含有本发明制剂的容器。待治疗的疾病可选自牛皮癣及炎性肠病。在另外的实施方案中,待治疗的疾病可选自牛皮癣性关节炎及克罗恩氏病(crohn's disease)。
25.本技术案的其他对象、特点、优势及方面对于本领域技术人员而言将根据以下描述及所附权利要求书而变得显而易见。然而,应理解,虽然以下描述、所附权利要求书及特定实施例指示本技术案的优选实施方案,但其仅作为说明给出。
information,第29卷,第2期,2015),且这样的抗体在本文中称为瑞沙珠单抗。有利地,本发明提供经批准用于治疗牛皮癣的抗体瑞沙珠单抗的稳定高浓度液体药物制剂。本文所提供的整个公开内容经特定地导入且应用于所公开制剂中所包含的抗体瑞沙珠单抗。瑞沙珠单抗可在各种宿主细胞中以重组方式产生且适用于重组抗体产生的细胞是本领域中已知的。
46.在一个实施方案中,抗体在哺乳动物细胞中以重组方式产生。合适哺乳动物细胞是本领域中已知的且包含啮齿动物以及人类细胞株。在一个实施方案中,抗体已在仓鼠细胞中以重组方式产生。在一个实施方案中,抗体已在cho细胞中以重组方式产生。
47.组分b)
48.根据第一方面的150mg/ml制剂的第一次方面的制剂包含作为组分b)的多元醇。可用作药物制剂中的赋形剂的合适多元醇为本领域中已知的且描述于本文中。
49.根据第一方面的150mg/ml制剂的第二次方面的制剂包含作为组分b)的张力调节剂。张力调节剂是适合于调节制剂张力的试剂。可用于调节药物制剂张力的张力调节剂是本领域中已知的且包括诸如盐及此外诸如糖及糖醇的多元醇的化合物。因此,用作根据第二次方面的150mg/ml稳定制剂中的组分b)的张力调节剂可为多元醇,如同用作根据第一次方面的150mg/ml制剂中的组分b)一般。根据一个实施方案,因此,根据第二次方面的稳定的液体制剂中所包含的张力调节剂为多元醇,任选为糖和/或糖醇。
50.如本文所使用的术语“多元醇”是指具有多个羟基的物质,且包括糖(还原性糖及非还原性糖)及糖醇。多元醇可包含至少三个、至少四个或至少五个羟基。在某些实施方案中,多元醇的分子量≤600da(例如,在120da至400da范围内)。“还原性糖”是含有自由醛或酮基且可还原金属离子或与蛋白质中的赖氨酸及其他氨基共价反应的糖。“非还原性糖”是缺乏自由醛或酮基且不经诸如斐林氏溶液(fehling's solution)或本氏溶液(benedict's solution)的温和氧化剂氧化的糖。适用于药物制剂中的还原性糖及非还原性糖的实施例为技术人员所已知。非还原性糖包括例如蔗糖及海藻糖。如本文所公开,海藻糖的使用是特别有用的。适用于药物制剂中的糖醇的实施例为技术人员所已知且包括例如甘露醇及山梨醇。多元醇可用作制剂中的张力剂。
51.多元醇可起作用且可用作张力调节剂以便调节张力。例如糖的某些多元醇亦可充当稳定剂,由此支持所提供的制剂的稳定性。
52.如本文所公开,多元醇可选自糖及糖醇。此外,如实施例中亦展现,两种或更多种不同多元醇的组合可用作组分b)。如实施例中所示,糖及糖醇以及其组合可有利地用于150mg/ml本发明制剂中。根据一个实施方案,多元醇选自海藻糖、蔗糖、山梨醇、甘露醇及其组合。根据一个实施方案,制剂仅包含作为组分b)的选自糖和/或糖醇的多元醇。根据一个实施方案,制剂仅包含作为组分b)的单一多元醇。
53.在特定实施方案中,多元醇为糖。多元醇可选自海藻糖及蔗糖。如实施例中所示,制剂可包含作为多元醇的海藻糖且海藻糖的使用是有利的。海藻糖可单独或与例如另一糖或糖醇的另一多元醇组合使用。根据特定实施方案,制剂仅包含作为单一多元醇的诸如海藻糖的单一糖。使用单一多元醇作为赋形剂例如以调节张力可是有利的。
54.根据一个实施方案,多元醇为糖醇。糖醇可选自山梨醇及甘露醇。在实施方案中,制剂包含作为多元醇的甘露醇。在另外实施方案中,制剂包含山梨醇。如本文所公开,甘露醇及山梨醇可用作单一多元醇或可与彼此组合或与诸如糖或其他糖醇的不同多元醇组合
使用。
55.山梨醇可用于提供本发明的稳定制剂。在某些实施方案中,提供不含山梨醇的制剂。不含山梨醇的制剂对于具有遗传性果糖不耐受性的患者而言是有利的。在一特定实施方案中,因此,液体药物制剂不包含山梨醇。在某些实施方案中,制剂不包含糖醇。
56.如实施例中所展现,甘露醇和/或海藻糖可用作本发明制剂中的多元醇以便调节所需渗透重量摩尔浓度。然而,150mg/ml制剂内的甘露醇的量受甘露醇溶解度及可在调配步骤期间添加的储备溶液的量限制。因此,在实施方案中,甘露醇与诸如高度可溶海藻糖的糖组合使用。发现海藻糖对于本文所公开的抗体制剂而言是有利的,这是因为其溶解度足以达成具有一种赋形剂的等张性制剂。因此,在某些实施方案中,海藻糖用作多元醇且海藻糖可为用于调节等张性的制剂中的唯一多元醇。
57.多元醇可用于调节渗透重量摩尔浓度。在实施方案中,制剂的渗透重量摩尔浓度在200mosm/kg至400mosm/kg范围内,诸如在225mosm/kg至375mosm/kg范围内。在实施方案中,渗透重量摩尔浓度在250mosm/kg至350mosm/kg,诸如275mosm/kg至330mosm/kg或290mosm/kg至320mosm/kg范围内。制剂可具等张性,其中“等张性”意指所关注的制剂具有与人类血液基本上相同的渗透压。渗透重量摩尔浓度可例如使用蒸气压或冰冷冻型渗透压计进行测量。
58.制剂中的多元醇浓度可为至少80mm或至少95mm。在实施方案中,制剂中的多元醇浓度为至少115mm、至少125mm、至少135mm、至少140mm、至少150mm或至少160mm。在实施方案中,制剂中的多元醇浓度为≤500mm、≤450mm或≤400mm。如本文所公开,两种或更多种多元醇亦可用作赋形剂b)。如本文所公开,在一个核心实施方案中,多元醇为以该浓度使用的糖。在一个实施方案中,糖为海藻糖。用作根据第二次方面的制剂中的组分b)的张力调节剂同样如此。如本文所公开,张力调节剂可为多元醇。
59.根据第一方面,详言之其第一次方面及第二次方面的制剂中的多元醇浓度可在95mm至400mm,诸如95mm至300mm或95mm至250mm范围内。制剂中的多元醇的例示性浓度范围包括但不限于125mm至250mm及125mm至225mm。在一个实施方案中,制剂中的多元醇浓度在125mm至225mm范围内。在一个实施方案中,多元醇浓度在145mm至225mm范围内。如本文所公开,在一个核心实施方案中,多元醇为以如本文所描述的此类浓度使用的糖。在一个实施方案中,糖为海藻糖。
60.根据一个实施方案,多元醇为糖,且其中糖浓度在125mm至250mm、150mm至250mm、150mm至200mm范围内或在160mm至200mm范围内。在另一实施方案中,糖浓度在170mm至200mm范围内。浓度可为185mm。在一个实施方案中,该糖为海藻糖。因此,本文亦公开包含150mg/ml抗体及185mm作为多元醇的海藻糖的液体药物制剂。海藻糖可例如以二水合海藻糖形式添加。
61.c)表面活性剂
62.根据第一方面的液体制剂进一步包含表面活性剂。如实施例中所展现,在150mg/ml制剂中并入表面活性剂是有利的。在根据第一方面的150mg/ml制剂的第一次方面及第二次方面的制剂中包含作为组分c)的表面活性剂。
63.根据一个实施方案,表面活性剂为非离子表面活性剂。适用于药物制剂的非离子表面活性剂是本领域中已知的且亦描述于本文中。至少一种表面活性剂可为聚山梨醇酯
(例如,聚山梨醇酯20)或泊洛沙姆(poloxamer)(例如,泊洛沙姆188)。亦可使用表面活性剂组合。在一个核心实施方案中,表面活性剂为聚山梨醇酯。非离子表面活性剂可选自聚山梨醇酯20和/或聚山梨醇酯80。亦可使用组合。在一个实施方案中,表面活性剂为聚山梨醇酯20。在一个实施方案中,本发明制剂包含单一表面活性剂,诸如单一非离子表面活性剂,例如单一聚山梨醇酯。
64.在一个实施方案中,制剂中的表面活性剂浓度为至少0.05mg/ml。浓度可为至少0.075mg/ml。如实施例中所展现,甚至低量的表面活性剂亦提供效益。在实施方案中,制剂中的表面活性剂浓度为至少0.1mg/ml、至少0.125mg/ml、至少0.15mg/ml、至少0.175mg/ml或至少0.185mg/ml。在实施方案中,制剂中的表面活性剂浓度为≤1mg/ml,任选≤0.75mg/ml或≤0.5mg/ml。在实施方案中,制剂中的表面活性剂浓度为≤0.4mg/ml、≤0.3mg/ml或≤0.25mg/ml。如本文所公开,表面活性剂可为非离子表面活性剂。如本文所公开,在核心实施方案中,表面活性剂为聚山梨醇酯,该聚山梨醇酯任选选自聚山梨醇酯20和/或聚山梨醇酯80。在实施方案中,表面活性剂为聚山梨醇酯20。聚山梨醇酯20可有利地以如实施例中所展现的如本文所公开的所述浓度使用。
65.制剂中的表面活性剂浓度可在0.05mg/ml至0.75mg/ml范围内。制剂中的表面活性剂的例示性浓度范围包括但不限于0.05mg/ml至0.5mg/ml、0.075mg/ml至0.4mg/ml或0.075mg/ml至0.3mg/ml。在实施方案中,制剂中的表面活性剂浓度在0.05mg/ml至0.5mg/ml、0.075mg/ml至0.3mg/ml或0.1mg/ml至0.3mg/ml范围内。制剂中的表面活性剂浓度可为0.2mg/ml。如本文所公开,表面活性剂可为非离子表面活性剂。在核心实施方案中,表面活性剂为聚山梨醇酯,该聚山梨醇酯任选选自聚山梨醇酯20和/或聚山梨醇酯80。在实施方案中,表面活性剂为可有利地以如实施例中所展现的所述浓度范围使用的聚山梨醇酯20。
66.在特定实施方案中,本发明制剂包含0.2mg/ml作为表面活性剂的聚山梨醇酯20。此制剂可包含作为组分b)的糖,其中糖浓度在95mm至250mm、125mm至250mm或145mm至225mm范围内。所包含的糖可为海藻糖。
67.ph
68.在核心实施方案中为水性制剂的液体药物制剂的ph可在ph 5.0至7.5,诸如ph 5.0至7.0范围内。
69.液体药物制剂的ph可为≤6.8,诸如≤6.7、≤6.6、≤6.5、≤6.4、≤6.3或≤6.2。在实施方案中,液体药物制剂的ph为≤6.1,诸如≤6.0或≤5.9。在实施方案中,液体药物制剂的ph为≥5.2,诸如≥5.3、≥5.4或≥5.5。ph≥5.2的液体药物制剂的例示性ph范围包括但不限于5.2至6.8,诸如5.2至6.7、5.2至6.6、5.2至6.5、5.2至6.4、5.2至6.3及5.2至6.2。ph≥5.3的液体药物制剂的例示性ph范围包括但不限于5.3至6.8,诸如5.3至6.7、5.3至6.6、5.3至6.5、5.3至6.4、5.3至6.3及5.3至6.2。ph≥5.4的液体药物制剂的例示性ph范围包括但不限于5.4至6.8,诸如5.4至6.7、5.4至6.6、5.4至6.5、5.4至6.4、5.4至6.3及5.4至6.2。ph≥5.5的液体药物制剂的例示性ph范围包括但不限于5.5至6.8,诸如5.5至6.7、5.5至6.6、5.5至6.5、5.5至6.4、5.5至6.3及5.5至6.2。ph≥5.6的液体药物制剂的例示性ph范围包括但不限于5.6至6.8,诸如5.6至6.7、5.6至6.6、5.6至6.5、5.6至6.4、5.6至6.3及5.6至6.2。在另外实施方案中,制剂的ph在5.6至6.0或5.6至5.9范围内。
70.根据一个实施方案,液体药物制剂的ph在5.2至6.5范围内。根据一个实施方案,液
体药物制剂的ph在5.2至6.2范围内。如自实施例可见,在稳定性及物理应力研究期间,较低ph值显示较少聚集。
71.根据一个实施方案,液体药物制剂的ph在5.5至6.5范围内。在一个实施方案中,液体药物制剂的ph在5.5至6.2范围内。
72.根据一个实施方案,ph为5.5至5.9。在一个实施方案中,ph为5.6至5.8。150mg/ml具有该ph的瑞沙珠单抗制剂在实施例中经受测试且显示有利特征。
73.在另一实施方案中,液体药物制剂的ph为5.7。
74.在另一实施方案中,液体药物制剂的ph为6.2。
75.如本文所公开,根据第二次方面的稳定的液体药物制剂的ph为5.5至5.9。其可在5.5至5.8范围内。在实施方案中,根据第二次方面的150mg/ml稳定制剂的ph为5.7。
76.d)缓冲剂
77.根据第一方面的150mg/ml抗体制剂可以不含缓冲剂的制剂形式或以含缓冲剂的制剂形式提供。根据本文所公开的一个核心实施方案,药物制剂包含d)缓冲剂。与不含缓冲剂的制剂相比,包含缓冲剂的制剂在实验中显示较少滑移力增加(最大值及平均值)。因此,缓冲剂可用作根据第一方面的150mg/ml瑞沙珠单抗制剂的第一次方面及第二次方面的制剂中的组分d)。
78.缓冲剂可用于维持液体药物制剂的溶液ph。适用于药物制剂的缓冲剂是本领域中已知的且描述于本文中。缓冲剂可是有机缓冲剂。根据一个实施方案,缓冲剂在25℃下的pka在液体药物制剂的最终ph的1.5或1ph单位内。在某些实施方案中,缓冲剂在25℃下的pka在4.2至7.2或4.5至7ph范围内。缓冲剂可包含缓冲剂组合。在一个实施方案中,单一缓冲剂用作制剂中的组分d)。
79.制剂可包含作为缓冲剂d)的羧酸缓冲剂。
80.根据一个实施方案,缓冲剂选自乙酸盐缓冲剂及丁二酸盐缓冲剂。如实施例中所展现,包含所述缓冲剂的制剂提供对于特此提供的高浓度抗体制剂而言有利的稳定性特点。在另外实施方案中,缓冲剂为组氨酸缓冲剂。
81.在一个实施方案中,缓冲剂为乙酸盐缓冲剂。乙酸盐缓冲剂可包含乙酸钠及乙酸。其他乙酸盐亦可用于乙酸盐缓冲剂中。
82.另外可使用的缓冲剂包括但不限于柠檬酸盐、谷氨酸盐、甘氨酸、乳酸盐、顺丁烯二酸盐、磷酸盐或酒石酸盐缓冲剂。
83.缓冲剂盐的存在可支持所包含的抗体的稳定性,根据本发明,该抗体为瑞沙珠单抗。
84.根据一个实施方案,制剂中所包含的缓冲剂d)不是丁二酸盐缓冲剂。在某些实施方案中,制剂不含丁二酸盐缓冲剂。在某些实施方案中,使用为例如由乙酸盐(例如,乙酸钠)及乙酸提供的乙酸盐缓冲剂的单一缓冲剂。
85.缓冲剂在使用时以足以在储存条件下维持制剂的所选ph达产品存放期的量包括在内。
86.本文所公开的液体药物制剂可包含至少1mm缓冲剂、至少2mm缓冲剂、至少3mm缓冲剂。缓冲剂浓度可为至少4mm、至少4.5mm或至少5mm。在实施方案中,缓冲剂浓度为100mm或更低,诸如75mm或更低或50mm或更低。在实施方案中,制剂中的缓冲剂浓度为80mm或更低,
诸如75mm或更低、70mm或更低、60mm或更低或50mm或更低。在另外实施方案中,缓冲剂浓度为45mm或更低,诸如40mm或更低、35mm或更低、30mm或更低或25mm或更低。在另外实施方案中,缓冲剂浓度为20mm或更低或15mm或更低。所包含的缓冲剂的例示性浓度范围包括但不限于3mm至100mm,诸如4mm至75mm、4mm至60mm及4mm至50mm。另外例示性缓冲剂浓度范围包括但不限于4mm至45mm,诸如5mm至40mm、5mm至35mm及5mm至30mm。再另外例示性缓冲剂浓度范围包括但不限于5mm至25mm,诸如5mm至20mm及5mm至15mm。在一个特定实施方案中,缓冲剂浓度在7mm至12mm范围内。合适缓冲剂公开于本文中。在一个实施方案中,制剂包含呈如所描述的该浓度的乙酸盐缓冲剂。
87.在实施方案中,缓冲剂浓度为20mm或更低或15mm或更低。在另外实施方案中,缓冲剂浓度在4mm至50mm范围内。制剂的缓冲剂浓度可在5mm至25mm或5mm至20mm范围内。缓冲剂浓度亦可在5mm至15mm或7mm至12mm范围内。在实施方案中,缓冲剂浓度为10mm。
88.在某些实施方案中,制剂包含单一缓冲剂。在特定实施方案中,单一缓冲剂为乙酸盐缓冲剂。
89.包含150mg/ml抗体的含缓冲剂的制剂的特定实施方案
90.根据一个实施方案,液体药物制剂包含
91.a)150mg/ml该抗体;
92.b)糖;
93.c)非离子表面活性剂;及
94.d)缓冲剂;
95.任选其中制剂的ph在ph 5.2至ph 6.5范围内,例如在5.2至6.2或5.5至6.2范围内。
96.赋形剂b)至d)的合适浓度及实施方案描述于上文中。在一个实施方案中,糖浓度在145mm至225mm范围内和/或非离子表面活性剂浓度在0.05mg/ml至0.5mg/ml或0.075mg/ml至0.3mg/ml范围内。糖可为海藻糖且非离子表面活性剂可为诸如聚山梨醇酯20的聚山梨醇酯。ph可为5.7。在另一实施方案中,ph为6.2。
97.根据一个实施方案,液体药物制剂包含
98.a)150mg/ml该抗体;
99.b)海藻糖;
100.c)聚山梨醇酯;及
101.d)缓冲剂;
102.任选其中制剂的ph在ph 5.2至ph 6.5范围内,例如在5.2至6.2或5.5至6.2范围内。
103.赋形剂b)至d)的合适浓度及实施方案描述于上文中。在一个实施方案中,海藻糖浓度在145mm至225mm范围内和/或聚山梨醇酯浓度在0.05mg/ml至0.5mg/ml或0.075mg/ml至0.3mg/ml范围内。ph可为5.7。在另一实施方案中,ph为6.2。
104.这些液体药物制剂中所包含的缓冲剂可为乙酸盐或丁二酸盐,任选其中缓冲剂浓度在5mm至25mm范围内。聚山梨醇酯可为聚山梨醇酯20。
105.根据一个实施方案,液体药物制剂包含
106.a)150mg/ml该抗体;
107.b)170mm至200mm海藻糖;
108.c)0.1mg/ml至0.3mg/ml聚山梨醇酯,任选为聚山梨醇酯20;及
109.d)缓冲剂,任选其中该缓冲剂为乙酸盐缓冲剂。
110.此制剂的ph可在ph 5.2至ph 6.5范围内,例如在5.2至6.2或5.5至6.2范围内。
111.根据一个实施方案,液体药物制剂包含
112.a)150mg/ml该抗体;
113.b)185mm海藻糖;
114.c)0.2mg/ml聚山梨醇酯20;及
115.d)10mm乙酸盐缓冲剂;
116.其中该ph为5.7。
117.此液体制剂可为水性制剂且在一个实施方案中不包含任何其他添加剂。
118.包含150mg/ml抗体的不含缓冲剂的制剂的特定实施方案
119.如本文所公开,亦提供不含缓冲剂的液体药物制剂,详言之水性制剂。根据一个实施方案,液体药物制剂包含
120.a)150mg/ml该抗体;
121.b)多元醇,任选其中该多元醇为糖或糖醇;及
122.c)非离子表面活性剂,任选为聚山梨醇酯;
123.d)不包含缓冲剂。
124.如上文所指出,本发明亦提供不含缓冲剂的制剂且不添加作为赋形剂的缓冲剂。150mg/ml具有如seq id no:1及seq id no:2中所示的轻链及重链序列的抗体具有高缓冲容量。如实施例中亦显示,可基于本文所提供的公开内容提供储存稳定性不含缓冲剂的制剂。
125.在实施方案中,不含缓冲剂的制剂的ph在ph 5.2至ph 6.5范围内。ph可在5.2至6.2或5.5至6.2范围内。在一个实施方案中,ph为5.7。在另一实施方案中,ph为6.2。
126.在实施方案中,不含缓冲剂的制剂包含80mm至250mm多元醇。诸如糖及糖醇的合适多元醇详细公开于上文中且参考本发明。在一个实施方案中,糖为海藻糖。
127.根据一个实施方案,不含缓冲剂的制剂中的非离子表面活性剂浓度在0.05mg/ml至0.5mg/ml、0.075mg/ml至0.4mg/ml或0.1mg/ml至0.3mg/ml范围内。根据一个实施方案,非离子表面活性剂为聚山梨醇酯。其可选自聚山梨醇酯20及聚山梨醇酯80且为一个实施方案聚山梨醇酯20。
128.另外任选选用的组分
129.在一个实施方案中,本发明的液体药物制剂包含作为另一添加剂的氨基酸。可作为赋形剂添加至药物制剂中的合适氨基酸实施方案为本领域中已知的且亦公开于实施例中。
130.在一个实施方案中,制剂包含具有带电侧链,任选具有带正电侧链的氨基酸。该氨基酸的实施例为l-精氨酸。
131.根据一个实施方案,制剂包含氨基酸,其中氨基酸以盐,任选以盐酸(hcl)盐形式存在于制剂中。
132.根据一个实施方案,制剂包含甲硫氨酸。根据一个实施方案,制剂包含氨基酸l-脯
氨酸。
133.根据一个实施方案,150mg/ml本发明制剂不包含精氨酸。发现含有精氨酸的制剂在冷冻/解冻应力研究期间显示略微地升高的粒子计数以及较高浊度值,即使浊度不随时间推移而增加。发现黏度较高。聚集物的量与包含150mg/ml抗体、但不包含精氨酸的其他制剂相比略微地较低。
134.根据一个实施方案,本发明制剂不包含作为赋形剂的具有带正电侧链的氨基酸。根据一个实施方案,本发明制剂不包含作为赋形剂的具有带电侧链的氨基酸。根据一个实施方案,本发明制剂不包含作为赋形剂的甲硫氨酸。根据一个实施方案,本发明制剂不包含作为添加剂的氨基酸。
135.本领域中已知的其他赋形剂可用于制剂中,只要其不对稳定性有不利影响即可。
136.然而,在某些实施方案中,本发明制剂中不包含额外赋形剂。特别有利的是抗体瑞沙珠单抗的储存稳定性制剂可具备基本上由以下组成或由以下组成的制剂:a)该抗体(150mg/ml);b)组分;c)表面活性剂;及任选选用的d)缓冲剂。如本文所公开,有利地,制剂可包含仅单一多元醇、单一表面活性剂及(若存在)单一缓冲剂。由此,提供用于150mg/ml抗体瑞沙珠单抗制剂的非复合、但仍具储存稳定性的制剂。
137.稳定性特征
138.如本文所公开,有利地,提供稳定的包含150mg/ml抗体的液体药物制剂。提供该稳定高浓度抗体瑞沙珠单抗制剂对于治疗性用途而言是特别有利的。
139.在实施方案中,稳定抗体制剂为其中抗体在储存时基本上保持其物理稳定性和/或生物活性的制剂。用于测量蛋白质稳定性的各种分析技术可在本领域中获得且公开于本文中。稳定性可在所选温度下历经所选时间段进行测量。
140.不同的本发明的包含150mg/ml抗体的液体药物制剂的稳定性特征在实施例中加以测试且显示有利稳定性特征。
141.在实施方案中,本发明的稳定的液体药物制剂在冷冻温度(2-8℃)下不显示显著变化达至少3个月,诸如6个月或1年或甚至长达2年或更长时间。稳定的液体制剂包括在包括25℃及40℃的温度下展现所需特点达包括1个月、3个月、6个月、12个月和/或24个月的时段的稳定的液体制剂。
142.若在目视检查颜色和/或清晰性时或如通过uv光散射、粒径排阻色谱法(sec)和/或动态光散射所测量时,抗体不显示显著的聚集、沉淀和/或变性增加,则抗体特别地保持其在药物制剂中的物理稳定性。蛋白质构形变化可通过确定蛋白质三级结构的荧光光谱法及通过确定蛋白质二级结构的ftir光谱法来评估。
143.若抗体在给定时间的生物活性在制备药物制剂时所展现的生物活性的预定范围内,则抗体特别地保持其在药物制剂中的生物活性。抗体的生物活性可例如通过抗原结合检定来测定。
144.聚集物的不同之处可在于起源、尺寸及类型。可能影响生物产品的功效或安全性的聚集物受到特别关注,例如可增强免疫反应且可能造成不利临床效应的聚集物。亦称为高分子量物种(hmws)的高分子量聚集物可能受到特别关注。聚集亦可能潜在地影响治疗蛋白的皮下生物可用性及药物动力学。有利地,本发明提供其中高分子量物种量低,在经延长储存时间内亦如此的制剂。如通过储存之后经减少的聚集物量和/或经降低的聚集物形成
速率所展现,本发明特别地提供经稳定(或稳定)水性药物制剂。如本文所描述,所述制剂的稳定性通过储存之后在变化时间段内及在变化温度下经减少的hmws量和/或经降低的hmws形成速率示出。一般而言,较高稳定性制剂与相对于较低储存温度而言在较高储存温度下的较低hmws量、较低hmws形成速率和/或较高抗体主峰相关。如本文所使用的术语“高分子量物种”或“hmws”是指制剂抗体的高阶聚集物以及制剂抗体的低阶聚集物。低阶聚集物包括例如二聚体物种。聚集物量及形成速率可通过包括实施例中所公开的技术的各种技术来测量或监测。
145.如本文所使用的术语“低分子量物种”或“lmws”特别地指小于单体的抗体片段,包括但不限于自由轻链、自由重链、包含一个轻链及一个重链的分子、缺失一或两个轻链的抗体分子及通过裂解一或多个多肽链获得的抗体片段(诸如蛋白水解片段)或其他以酶方式或以化学方式降解的抗体分子。
146.在某些实施方案中,本文所公开的制剂中的抗体在储存期间基本上维持呈单体形式。在特定实施方案中,制剂可满足以下稳定性特征中的一或多个:
147.在某些实施方案中,在5℃下储存36个月之后,如通过up-sec所测量,至少94%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过3%或超过2.5%。在某些实施方案中,在5℃下储存36个月之后,如通过up-sec所测量,至少95%或至少96%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过2%或超过1.5%。在某些实施方案中,在5℃下储存24个月之后,如通过up-sec所测量,至少94%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过3%或超过2.5%。在某些实施方案中,在5℃下储存24个月之后,如通过up-sec所测量,至少95%或至少96%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过2%或超过1.5%或超过1%。在某些实施方案中,在5℃下储存9个月之后,如通过up-sec所测量,至少96%或至少96.5%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过1.5%或超过1%。在某些实施方案中,在5℃下储存3个月之后,如通过up-sec所测量,至少96%或至少97%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过1%或超过0.7%或超过0.5%。在某些实施方案中,在25℃下储存12个月之后,如通过up-sec所测量,至少90%或至少92%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过7%或超过6%或超过5%。在某些实施方案中,在25℃下储存3个月之后,如通过up-sec所测量,至少95%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过3%或超过2%。在某些实施方案中,在25℃下储存1个月之后,如通过up-sec所测量,至少96%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过2%或超过1%。在某些实施方案中,在40℃下储存3个月之后,如通过up-sec所测量,至少87%或至少88%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过10%或超过9%或超过8%。在某些实施方案中,在40℃下储存1个月之后,如通过up-sec所测量,至少93%或至少94%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过5%或超过4%。在某些实施方案中,在25℃下摇动21天之后,如通过up-sec所测量,至少95%或至少96%的抗体以单体形式存在,和/或抗体的相对单体含量不减少超过2%或超过1%。相对单体含量的减少为针对所指示储存时间及温度加以计算且特别地通过比较所指示储存开始时与结束时的相对单体含量来确定。在特定实施方案中,如实施例中所描述执行测量。
148.在某些实施方案中,本文所公开的制剂中的抗体在储存期间不形成大量hmws。特
别是,制剂满足以下稳定性特征中的一或多个:
149.在某些实施方案中,在5℃下储存36个月之后,如通过up-sec所测量,少于4%或少于3%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过2%或超过1.5%。在某些实施方案中,在5℃下储存24个月之后,如通过up-sec所测量,少于4%或少于3%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过2%或超过1.5%或超过1%。在某些实施方案中,在5℃下储存9个月之后,如通过up-sec所测量,少于4%或少于3%或少于2.5%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过1%或超过0.8%或超过0.6%。在某些实施方案中,在5℃下储存3个月之后,如通过up-sec所测量,少于4%或少于3%或少于2.5%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过1%或超过0.8%或超过0.6%。在某些实施方案中,在25℃下储存12个月之后,如通过up-sec所测量,少于5%或少于4%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过3%或超过2.5%或超过2%。在某些实施方案中,在25℃下储存3个月之后,如通过up-sec所测量,少于4%或少于3.5%或少于3.2%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过2%或超过1.5%。在某些实施方案中,在25℃下储存1个月之后,如通过up-sec所测量,少于4%或少于3.5%或少于3%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过1.5%或超过1%。在某些实施方案中,在40℃下储存3个月之后,如通过up-sec所测量,少于6.5%或少于6%或少于5.5%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过5%或超过4%。在某些实施方案中,在40℃下储存1个月之后,如通过up-sec所测量,少于5%或少于4.5%或少于4%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过2.5%或超过2%。在某些实施方案中,在25℃下摇动21天之后,如通过up-sec所测量,少于3%或少于2%的抗体以hmws形式存在,和/或抗体的相对hmws含量不增加超过2%或超过1.5%或超过1%。相对hmws含量的增加为针对所指示储存时间及温度加以计算且特别地通过比较所指示储存开始时与结束时的相对hmws含量来确定。在特定实施方案中,如实施例中所描述执行测量。
150.在另外实施方案中,本文所公开的制剂中的抗体在储存期间不形成大量lmws。在特定实施方案中,制剂可满足以下稳定性特征中的一或多个:
151.在某些实施方案中,在5℃下储存36个月之后,如通过up-sec所测量,少于2%或少于1.5%的抗体以lmws形式存在,和/或抗体的相对lmws含量不增加超过1.5%或超过1.5%或超过0.5%。在某些实施方案中,在5℃下储存24个月之后,如通过up-sec所测量,少于2%或少于1.5%的抗体以lmws形式存在,和/或抗体的相对lmws含量不增加超过1.5%或超过1.5%或超过0.5%。在某些实施方案中,在5℃下储存9个月之后,如通过up-sec所测量,少于2%或少于1.5%的抗体以lmws形式存在,和/或抗体的相对lmws含量不增加超过1.5%或超过1.5%或超过0.5%。在某些实施方案中,在5℃下储存3个月之后,如通过up-sec所测量,少于2%或少于1.5%或少于1%的抗体以lmws形式存在,和/或抗体的相对lmws含量不增加超过1%或超过0.5%或超过0.25%。在某些实施方案中,在25℃下储存12个月之后,如通过up-sec所测量,少于6%或少于5%或少于4.5%的抗体以lmws形式存在,和/或抗体的相对lmws含量不增加超过5%或超过4%或超过3%。在某些实施方案中,在25℃下储存3个月之后,如通过up-sec所测量,少于3%或少于2%或少于1.8%的抗体以lmws形式存在,和/或抗体的相对lmws含量不增加超过2%或超过1.5%或超过1%。在某些实施方案中,在25℃
下储存1个月之后,如通过up-sec所测量,少于2%或少于1.5%或少于1.2%的抗体以lmws形式存在,和/或抗体的相对lmws含量不增加超过1%或超过0.6%或超过0.4%。在某些实施方案中,在40℃下储存3个月之后,如通过up-sec所测量,少于8%或少于7%或少于6%的抗体以lmws形式存在,和/或抗体的相对lmws含量不增加超过8%或超过7%或超过6%。在某些实施方案中,在40℃下储存1个月之后,如通过up-sec所测量,少于4%或少于3.5%或少于3%的抗体以lmws形式存在,和/或抗体的相对lmws含量不增加超过3%或超过2.5%或超过2.2%。相对lmws含量的增加为针对所指示储存时间及温度加以计算且特别地通过比较所指示储存开始时与结束时的相对lmws含量来确定。在特定实施方案中,如实施例中所描述执行测量。
152.在某些实施方案中,特别是,如实施例中所描述,呈单体、hmws和/或lmws形式的抗体的相对量为使用up-sec来测定。举例而言,使用诸如waters(milford,ma,usa)的acquity uplc系统的包含粒径排阻色谱(sec)柱的超效液相色谱(uplc)系统。由sec柱进行的蛋白质洗脱可通过在280nm下的uv吸收来检测,且相对量测定可通过计算各洗脱峰的曲线下面积(auc)来进行。峰可根据对应于不同物种的分子尺寸的不同物种洗脱时间来分配给不同物种。为测量制剂中的抗体的相对单体含量、相对hmws含量和/或相对lmws含量,特别地使单体、hmws及lmws抗体彼此分离,这是在其存在于制剂中的情况下如此。特别是,相对含量或量指示为值百分比且单体、hmws及lmws抗体的总和为100%。
153.在某些实施方案中,本文所公开的制剂的浊度或乳白光在储存期间不显著地增加。在特定实施方案中,制剂可满足以下稳定性特征中的一或多个:
154.在某些实施方案中,在5℃下储存至少36个月之后,制剂具有12fnu(福尔马肼浊度测定单位(formazin nephelometry unit))或更少或10fnu或更少的乳白光,和/或乳白光不增加超过5fnu或超过3fnu。在某些实施方案中,在5℃下储存至少3、6、9、12、18或24个月之后,制剂具有12fnu(福尔马肼浊度测定单位)或更少或10fnu或更少的乳白光,和/或乳白光不增加超过5fnu或超过3fnu。在某些实施方案中,在25℃下储存至少1、3、6、9或12个月之后,制剂具有12fnu或更少或10fnu或更少的乳白光,和/或乳白光不增加超过7fnu或超过5fnu。在某些实施方案中,在40℃下储存至少1或3个月之后,制剂具有12fnu或更少或10fnu或更少的乳白光,和/或乳白光不增加超过5fnu或超过3fnu。在某些实施方案中,在25℃下摇动21天之后,制剂具有12fnu或更少或10fnu或更少的乳白光,和/或制剂的乳白光不增加超过3fnu或超过2fnu。乳白光的增加为针对所指示储存时间及温度加以计算且特别地通过比较所指示储存开始时与结束时的乳白光来确定。在特定实施方案中,如实施例中所描述执行测量。
155.在某些实施方案中,乳白光或浊度为根据药典或根据行业标准iso 7027来测量。在某些实施方案中,特别是,如实施例中所描述,制剂的乳白光或浊度为使用诸如hach-lange gmbh(germany)的hach lange乳白光计的浊度计来测定。乳白光可在不同波长下,包括在400-600nm下进行测量。在实施方案中,上文所指示的fna值为在400-600nm下进行测量。较高fnu值指示较高乳白光及浊度。
156.在某些实施方案中,本文所公开的制剂中的抗体在储存期间不形成额外大量酸性或碱性变异体。在特定实施方案中,制剂可满足以下稳定性特征中的一或多个:
157.在某些实施方案中,在5℃下储存36个月之后,如通过离子交换色谱法(iec)所测
定,至少55%、至少60%或至少65%的抗体以主峰变异体形式存在,和/或抗体的相对主峰变异体含量不减少超过8%或超过7%或超过5%。在某些实施方案中,在5℃下储存24个月之后,如通过离子交换色谱法(iec)所测定,至少55%、至少60%或至少65%的抗体以主峰变异体形式存在,和/或抗体的相对主峰变异体含量不减少超过8%或超过7%或超过5%。在某些实施方案中,在5℃下储存6个月之后,如通过离子交换色谱法(iec)所测定,至少60%或至少65%的抗体以主峰变异体形式存在,和/或抗体的相对主峰变异体含量不减少超过5%或超过4%。在某些实施方案中,在5℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,至少60%或至少65%的抗体以主峰变异体形式存在,和/或抗体的相对主峰变异体含量不减少超过4%或超过3%或超过2%。在某些实施方案中,在25℃下储存12个月之后,如通过离子交换色谱法(iec)所测定,至少35%或至少40%或至少45%的抗体以主峰变异体形式存在,和/或抗体的相对主峰变异体含量不减少超过35%或超过30%或超过25%。在某些实施方案中,在25℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,至少55%或至少60%的抗体以主峰变异体形式存在,和/或抗体的相对主峰变异体含量不减少超过15%或超过10%。在某些实施方案中,在25℃下储存1个月之后,如通过离子交换色谱法(iec)所测定,至少60%或至少65%的抗体以主峰变异体形式存在,和/或抗体的相对主峰变异体含量不减少超过10%或超过5%。在某些实施方案中,在5℃下储存36个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于28%的抗体以酸性峰群变异体形式存在,和/或抗体的相对酸性峰群变异体含量不增加超过4%或超过3%或超过2%。在某些实施方案中,在5℃下储存24个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于28%的抗体以酸性峰群变异体形式存在,和/或抗体的相对酸性峰群变异体含量不增加超过4%或超过3%或超过2%。在某些实施方案中,在5℃下储存6个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于28%的抗体以酸性峰群变异体形式存在,和/或抗体的相对酸性峰群变异体含量不增加超过4%或超过3%或超过2%。在某些实施方案中,在5℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于28%的抗体以酸性峰群变异体形式存在,和/或抗体的相对酸性峰群变异体含量不增加超过3%或超过2%或超过1%。在某些实施方案中,在25℃下储存12个月之后,如通过离子交换色谱法(iec)所测定,少于50%、少于45%或少于40%的抗体以酸性峰群变异体形式存在,和/或抗体的相对酸性峰群变异体含量不增加超过30%或超过25%或超过20%。在某些实施方案中,在25℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,少于40%或少于35%或少于30%的抗体以酸性峰群变异体形式存在,和/或抗体的相对酸性峰群变异体含量不增加超过10%或超过8%或超过6%。在某些实施方案中,在25℃下储存1个月之后,如通过离子交换色谱法(iec)所测定,少于35%或少于30%或少于28%的抗体以酸性峰群变异体形式存在,和/或抗体的相对酸性峰群变异体含量不增加超过4%或超过3%。在某些实施方案中,在5℃下储存36个月之后,如通过离子交换色谱法(iec)所测定,少于20%、少于17%、少于15%或少于13%的抗体以碱性峰群变异体形式存在,和/或抗体的相对碱性峰群变异体含量不增加超过10%或超过8%或超过6%。在某些实施方案中,在5℃下储存24个月之后,如通过离子交换色谱法(iec)所测定,少于20%、少于17%、少于15%或少于13%的抗体以碱性峰群变异体形式存在,和/或抗体的相对碱性峰群变异体含量不增加超过10%或超过8%或超过6%。在某些实施方案中,在5℃下储存6个月之后,如通过离子交换色谱法(iec)
所测定,少于15%或少于10%的抗体以碱性峰群变异体形式存在,和/或抗体的相对碱性峰群变异体含量不增加超过4%或超过3%或超过2%。在某些实施方案中,在5℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,少于15%或少于10%的抗体以碱性峰群变异体形式存在,和/或抗体的相对碱性峰群变异体含量不增加超过3%或超过2%。在某些实施方案中,在25℃下储存12个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于25%或少于22%的抗体以碱性峰群变异体形式存在,和/或抗体的相对碱性峰群变异体含量不增加超过25%或超过20%或超过15%。在某些实施方案中,在25℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,少于20%或少于15%或少于12%的抗体以碱性峰群变异体形式存在,和/或抗体的相对碱性峰群变异体含量不增加超过9%或超过7%或超过5%。在某些实施方案中,在25℃下储存1个月之后,如通过离子交换色谱法(iec)所测定,少于15%或少于10%或少于9%的抗体以碱性峰群变异体形式存在,和/或抗体的相对碱性峰群变异体含量不增加超过3%或超过2%。相对主峰变异体含量的减少及相对酸性及碱性峰群变异体含量的增加为针对所指示储存时间及温度加以计算且特别地通过比较所指示储存开始时与结束时的相对各别峰变异体含量来确定。在特定实施方案中,如实施例中所描述执行测量。
158.在某些实施方案中,特别是,如实施例中所描述,为主峰变异体、酸性峰变异体和/或碱性峰变异体的抗体的相对量为使用离子交换色谱法(iec)来测定。特别是,使用弱阳离子交换色谱法(wcx)。举例而言,使用诸如waters(milford,ma,usa)的alliance hplc系统的包含wcx柱的高效液相色谱(hplc)系统。由wcx柱进行的蛋白质洗脱可通过在280nm下的uv吸收来检测,且相对量测定可通过计算各洗脱峰或各组洗脱峰的曲线下面积(auc)来进行。峰可根据对应于抗体物种的表面电荷的抗体物种洗脱条件来分配给不同物种。主峰为未经降解的抗体的iec色谱图中的最大峰。对于稳定性分析,测量可在制备制剂(t0)之后且随后在所指示储存条件下的所指示储存时间之后执行。酸性峰群(apg)包括主峰之前的全部峰。这些峰包括酸性高于天然抗体主峰变异体和/或在色谱条件下在其表面上具有更多负电荷的抗体变异体。碱性峰群包括主峰之后的全部峰。这些峰包括酸性高于天然抗体主峰变异体和/或在色谱条件下在其表面上具有更多正电荷的抗体变异体。对于测量制剂中的抗体的主峰变异体、酸性峰群变异体和/或碱性峰群变异体的相对量,特别地使主峰与酸性峰群及碱性峰群分离,这是在其存在于制剂中的情况下如此。特别是,相对含量或量指示为值百分比且主峰变异体、酸性峰群变异体及碱性峰群变异体的总和为100%。
159.在某些实施方案中,本文所公开的制剂中的抗体在储存期间基本上维持其与人类il-23的特异性结合活性。在特定实施方案中,制剂满足以下稳定性特征中的一或多个:
160.在某些实施方案中,在5℃下储存36个月之后,相较于参考抗体而言测量至少95%或至少97%的与il-23的特异性结合活性,其中参考抗体尚未储存。在某些实施方案中,在5℃下储存4、6、9、12、18或24个月之后,相较于参考抗体而言测量至少95%或至少97%的与il-23的特异性结合活性,其中参考抗体尚未储存。在某些实施方案中,在25℃下储存2、3、4、6、9、12或18个月之后,相较于参考抗体而言测量至少93%或至少96%的与il-23的特异性结合活性,其中参考抗体尚未储存。在某些实施方案中,在40℃下储存3、4或6个月之后,相较于参考抗体而言测量至少90%或至少95%的与il-23的特异性结合活性,其中参考抗体尚未储存。在特定实施方案中,如实施例中所描述执行测量。
161.在某些实施方案中,特别是,如实施例中所描述,制剂中的抗体与人类il-23的特异性结合活性为使用表面等离子共振测量,例如使用诸如ge healthcare life science(united kingdom)的biacore t200的biacore仪器来测定。
162.根据第一方面的液体药物制剂的另外特征
163.在有利实施方案中,本发明的液体药物制剂为水性制剂。在一个实施方案中,全部本文所公开的液体制剂皆为水性制剂。除非特定情形另外指示,否则以下描述应用于根据第一方面的150mg/ml制剂,且因此亦应用于如本文所公开的根据第一次方面及第二次方面的制剂。
164.根据一个实施方案,所测量的根据第一方面的液体药物制剂在20℃下的动态黏度为≤30mpas(mpa
·
s),诸如≤25mpas或≤20mpas。在实施方案中,所测量的制剂在20℃下的动态黏度为≤18mpas,诸如≤16mpas、≤15mpas、≤14mpas、≤13mpas或≤12mpas。在特定实施方案中,如实施例中亦显示,动态黏度为使得制剂适用于皮下施用的动态黏度。动态黏度可如实施例中所描述进行测定。
165.根据一个实施方案,本发明制剂的电导率在0.8至5ms/cm范围内。在实施方案中,电导率范围为1至2ms/cm或1.2至1.8ms/cm。在实施方案中,制剂的特征在于在至少12个月的储存时间内在25℃下的电导率变化为≤1ms/cm,诸如≤0.75ms/cm、≤0.5ms/cm或≤0.3ms/cm。
166.本发明的液体制剂为药物制剂。药物制剂特别地指呈使得准许活性成分(此处为包含如seq id no:1中所示的轻链及如seq id no:2中所示的重链的抗体)有效的形式且不含有对施用有制剂的个体具有毒性的额外组分的组合物。
167.本文所公开的根据第一方面的制剂有利地适用于非经肠递送。非经肠施用包括例如皮下、肌内、皮内、髓内注射以及鞘内、直接脑或心室内、静脉内、腹膜内及玻璃体内施用。药物可以诸如腹膜内、非经肠、动脉内或静脉内注射的各种常规方式施用。在一个实施方案中,所公开的制剂为可注射制剂。在实施方案中,本文所公开的制剂适用于皮下、静脉内或肌内施用。有利地,所公开的制剂适用于皮下注射。本文所公开的150mg/ml制剂是特别地有利的,这是因为达成使制剂特别地适用于皮下施用的总体特征。高浓度允许施用小体积制剂,同时仍达成高抗体剂量(此处例如对于150mg剂量的1ml)。此外,本发明制剂显示良好可注射性。此外,如实施例中所公开,其具有有利黏度及渗透重量摩尔浓度特征且达成良好滑移力(最大值及平均值),在储存时亦如此。在实施方案中,本发明的液体药物制剂对希望施用部位具等张性。举例而言,若制剂意欲用于非经肠施用,则其可对血液具等张性(其为约300mosm/kg渗透重量摩尔浓度)。合适渗透重量摩尔浓度范围在其他地方得以描述。
168.液体抗体制剂可通过作为纯化过程最后一个步骤的采用呈液体形式(例如在水性药物制剂中)的药物物质且将其缓冲更换且制备成所需缓冲剂来制造。可使于最终缓冲剂中的药物物质浓缩至所需浓度或稀释更浓缩形式的抗体以达成150mg/ml浓度。制剂浓缩可通过任何合适方法来进行。在一个方面中,浓缩过程可包括超过滤。
169.在一个核心实施方案中,根据第一方面的液体药物制剂不是通过复原经冻干制剂制备的制剂。在此核心实施方案中,在制备液体药物制剂期间不存在冻干步骤。诸如组分b)及表面活性剂c)的赋形剂可添加至药物物质中,该药物物质可使用适当缓冲剂稀释至150mg/ml的最终蛋白质浓度。待用于体内施用的药物制剂通常是无菌的。在某些实施方案
中,此种情况可通过过滤通过无菌过滤膜来实现。因此,最终调配的药物物质可经过滤(例如,使用0.22μm过滤器)且可填充至最终容器(例如,玻璃小瓶或注射器)中。在此实施方案中,将所制备的液体制剂直接施用至患者以使得不存在冻干或复原步骤。所述液体药物制剂公开于本文中且亦在实施例中得以制造及分析。
170.经冻干及复原药物制剂
171.根据一个实施方案,根据第一方面的液体药物制剂由经冻干药物制剂通过复原来制备。在实施方案中,因此,本文所描述的液体药物组合物为经复原制剂。此种情况应用于根据第一方面的150mg/ml抗体制剂的第一次方面及第二次方面的液体制剂。
172.术语“冻干”或“经冻干”特别地指首先冷冻待干燥的材料且随后通过在真空环境中进行升华来去除冰或冷冻溶剂的过程。所述技术是本领域中众所周知的且因此未在本文中加以详细描述。冻干前制剂中可包括赋形剂以增强经冻干产品在储存时的稳定性。经冻干制剂可包含低温保护剂,该低温保护剂一般包括向蛋白质提供稳定性以抵抗冷冻诱发的应力的试剂。其亦可在初次及二次干燥以及长期产品储存期间提供保护。实施例包括诸如蔗糖及海藻糖的糖及诸如聚山梨醇酯的表面活性剂。经冻干制剂亦可包括冻干保护剂,该冻干保护剂包括在干燥或去水过程(初次及二次干燥循环)期间向蛋白质提供稳定性的试剂。此举有助于维持蛋白质构形,在冻干循环期间最小化蛋白质降解,且改善长期产品稳定性。实施例包括多元醇,诸如糖,例如蔗糖及海藻糖。所公开的根据第一方面的液体药物制剂包含取得低温保护剂和/或冻干保护剂资格的赋形剂。因此,经冻干制剂可由所述制剂制备。在一实施方案中,抗体瑞沙珠单抗经调配为用于静脉内施用的供复原及利用的经冻干散剂。
[0173]“经复原”制剂为通过将经冻干药物抗体制剂溶解于稀释剂中以使得抗体分散于经复原制剂中来制备的制剂。经复原制剂适用于施用且可任选适用于皮下施用。
[0174]
经冻干药物制剂预计在复原之前以所需浓度,此处为150mg/ml抗体制备。
[0175]
根据一个实施方案,提供抗-il-23p19抗体的经冻干制剂,其中抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列。根据一个实施方案,抗体瑞沙珠单抗的经冻干制剂为就例如冻干前溶液的用于制造经冻干制剂的溶液而言加以定义。此经冻干制剂为通过以下来制造:冻干根据第一方面的150mg/ml液体抗体制剂,诸如如下文实施方案1至86中任一项中所定义的根据第一方面的液体药物制剂。如本文所公开,在一个实施方案中,液体制剂为水性制剂。该水性制剂可用于制备经冻干药物制剂。
[0176]
在又其他实施方案中,抗体瑞沙珠单抗的经冻干制剂定义为由经冻干制剂生成的经复原溶液。根据一个实施方案,因此提供抗-il-23p19抗体的经冻干制剂,其中抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列,该经冻干制剂为在复原根据第一方面,详言之其第一次方面及第二次方面的150mg/ml液体抗体制剂时提供。根据实施方案,经冻干制剂为在复原如下文实施方案1至86或104至119中任一项中所定义的液体药物制剂时提供。此瑞沙珠单抗制剂可为水性制剂。
[0177]
亦提供包含以下的经冻干制剂:
[0178]
a)抗-il-23p19抗体,其中抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列,抗体的量在复原时提供150mg/ml的抗体浓度;
[0179]
b)多元醇;
[0180]
c)表面活性剂;及
[0181]
d)任选选用的缓冲剂。
[0182]
在一个实施方案中,经冻干药物制剂包含150mg抗体。抗体为瑞沙珠单抗。
[0183]
亦提供包含以下的经冻干制剂:
[0184]
a)抗-il-23p19抗体,其中抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列,抗体的量在复原时提供150mg/ml的抗体浓度;
[0185]
b)张力调节剂;
[0186]
c)表面活性剂;及
[0187]
d)任选选用的缓冲剂。
[0188]
在一个实施方案中,经冻干药物制剂包含150mg抗体。抗体为瑞沙珠单抗。
[0189]
用于药物制剂的诸如合适多元醇的所包含组分已结合液体药物制剂公开于上文中,这里提到的上述公开也适用于此。合适多元醇包括亦可组合使用的糖及糖醇。多元醇可具有如根据第一方面的液体药物制剂的下文实施方案6至13中任一项中所定义的特征中的一或多个。在一个实施方案中,多元醇为糖,该糖任选选自海藻糖及蔗糖。在一个实施方案中,糖为海藻糖。
[0190]
合适表面活性剂已结合液体药物制剂公开于上文中且其称为此处亦适用的上文公开内容。表面活性剂可具有如根据第一方面的液体药物制剂的下文实施方案22至25中任一项中所定义的特征中的一或多个。在一个实施方案中,表面活性剂为聚山梨醇酯,该聚山梨醇酯任选选自聚山梨醇酯20及聚山梨醇酯80。在一个实施方案中,聚山梨醇酯为聚山梨醇酯20。
[0191]
在一个实施方案中,经冻干制剂包含缓冲剂。适合于制备经冻干制剂的缓冲剂是本领域中已知的,且合适缓冲剂亦结合根据第一方面的液体药物制剂公开于上文中且其称为上文公开内容。
[0192]
根据一个实施方案,经冻干制剂的特征在于制剂在复原时具有如本文针对根据第一方面的液体药物制剂公开的ph。合适ph值公开于上文中且其称为此处亦适用的各别公开内容。在复原时,ph可如150mg/ml液体药物制剂的下文实施方案31至36中任一项中所定义。此外,在复原时,ph可如针对根据第二次方面的制剂所定义。在复原时,ph可为5.5至5.9,例如5.6至5.8。
[0193]
本发明的经冻干瑞沙珠单抗制剂在施用之前经复原。在一些情况下,可能需要在容器中冻干瑞沙珠单抗制剂,在该容器中进行抗体复原以避免转移步骤。
[0194]
容器及用途
[0195]
根据本发明的另一方面,提供含有根据本发明的第一方面的液体药物制剂或经冻干药物制剂的密封容器。容器可为小瓶或预填充注射器。在实施方案中,容器含有2ml或更少,任选1.5ml或更少或1ml或更少液体药物制剂。该容器可包含根据第一方面的150mg/ml抗体制剂的第一次方面或第二次方面的有利稳定的液体药物制剂。
[0196]
在核心实施方案中,诸如注射器的容器包含150mg单次剂量的抗体。如本文所公开,抗体为瑞沙珠单抗。
[0197]
在一个实施方案中,配备有针的注射器中包含根据本发明的第一方面的液体药物制剂。在特定实施方案中,针适用于皮下施用。针可为27号规脊髓薄壁针或适用于皮下使用
的其他针。
[0198]
根据一个实施方案,配备有针的预填充注射器的平均滑移力为20n或更小。在实施方案中,平均滑移力在5至20n或5至15n范围内。在实施方案中,预填充注射器的松动力(break loose force)为3至12n、优选3至9n。
[0199]
在某些实施方案中,配备有针且包含根据第一方面的液体药物制剂的注射器在储存期间基本上维持使制剂自注射器推出所需的最大和/或平均滑移力。在某些实施方案中,在5℃下储存36个月之后,预填充有液体制剂的注射器的最大滑移力为14n或更低、12n或更低或10n或更低,和/或最大滑移力不增加超过5n或超过4n或超过3n。在某些实施方案中,在5℃下储存24个月之后,预填充有液体制剂的注射器的最大滑移力为14n或更低、12n或更低、10n或更低或8n或更低,和/或最大滑移力不增加超过3n或超过2n或超过1.5n。在某些实施方案中,在5℃下储存9个月之后,最大滑移力为9n或更低或8n或更低,和/或最大滑移力不增加超过2n或超过1.5n或超过1n。在某些实施方案中,在5℃下储存3个月之后,最大滑移力为8n或更低或7.5n或更低,和/或最大滑移力不增加超过1.5n或超过1n。在某些实施方案中,在25℃下储存3个月之后,最大滑移力为10n或更低或8n或更低,和/或最大滑移力不增加超过3n或超过2n或超过1.5n。在某些实施方案中,在25℃下储存1个月之后,配备有针的预填充注射器的最大滑移力为8n或更低或7.5n或更低,和/或最大滑移力不增加超过1.5n或超过1n。在某些实施方案中,在40℃下储存1个月之后,最大滑移力为16n或更低或13n或更低,和/或最大滑移力不增加超过10n或超过8n或超过6n。
[0200]
在某些实施方案中,在5℃下储存36个月之后,预填充有根据第一方面的液体制剂且配备有针的注射器的平均滑移力为14n或更低、12n或更低、10n或更低或9n或更低,和/或平均滑移力不增加超过5n或超过4n或超过3n。在某些实施方案中,在5℃下储存24个月之后,预填充有根据第一方面的液体制剂且配备有针的注射器的平均滑移力为14n或更低、12n或更低、10n或更低或8n或更低,和/或平均滑移力不增加超过3n或超过2n或超过1.5n。在某些实施方案中,在5℃下储存9个月之后,配备有针的预填充注射器的平均滑移力为9n或更低或7.5n或更低,和/或平均滑移力不增加超过2n或超过1.5n或超过1n。在某些实施方案中,在5℃下储存3个月之后,平均滑移力为8n或更低或7n或更低,和/或平均滑移力不增加超过1.5n或超过1n或不超过0.5n。在某些实施方案中,在25℃下储存12个月之后,平均滑移力为15n或更低或13n或更低,和/或平均滑移力不增加超过9n或超过8n或超过7n。在某些实施方案中,在25℃下储存3个月之后,平均滑移力为9n或更低或8n或更低,和/或平均滑移力不增加超过3n或超过2n或超过1.5n。在某些实施方案中,在25℃下储存1个月之后,平均滑移力为8n或更低或7n或更低,和/或平均滑移力不增加超过1.5n或超过1n或不超过0.5n。在某些实施方案中,在40℃下储存3个月之后,平均滑移力为18n或更低或15n或更低,和/或平均滑移力不增加超过12n或超过10n或超过9n。在某些实施方案中,在40℃下储存1个月之后,平均滑移力为13n或更低或10n或更低,和/或平均滑移力不增加超过7n或超过5n或超过3n。
[0201]
最大或平均滑移力的增加为针对所指示储存时间及温度加以计算且特别地通过比较所指示储存开始时与结束时的最大或平均滑移力来确定。在特定实施方案中,如实施例中所描述执行测量。
[0202]
制剂的最大滑移力是指使制剂自注射器推出所需的最大机械力。制剂的平均滑移
力是指使制剂自注射器推出所需的平均机械力。在一些实施方案中,滑移力为根据诸如iso 7886、iso 11040及iso 11499的行业规范来测定。在某些实施方案中,特别是,如实施例中所描述,制剂的最大及平均滑移力是使用诸如zwick(germany)的zwick 2.5ts/n的拉伸及压缩测试机器来测定的。测量可使用诸如becton dickinson(usa)的neopak 1ml注射器,详言之如实施例中所使用的配备有针的注射器的具有27号规x1/2英寸针的1ml注射器来执行。测量可使用诸如约380mm/min,详言之379.2mm/min的约300至500mm/min的速度,例如持续5秒来执行。
[0203]
本发明的另一方面涉及用于治疗性治疗人类个体的根据第一方面的液体药物制剂或经冻干药物制剂或根据本文所公开的另一方面的容器。待治疗的疾病为可经抗-il-23p19抗体治疗的疾病且所述疾病是本领域中已知的。疾病可选自由以下组成的群:炎性疾病、自体免疫疾病、呼吸道疾病、代谢失调及癌症。在实施方案中,疾病为慢性疾病。待治疗的疾病可选自牛皮癣及炎性肠病。在另外实施方案中,待治疗的疾病可选自牛皮癣性关节炎及克罗恩氏病。出于本文所论述的原因,向患者施用150mg/ml高浓度的本发明的液体药物制剂以进行治疗是有利的。
[0204]
150mg/ml制剂的另外实施方案
[0205]
在以下内容中,公开根据第一方面的150mg/ml抗体制剂的另外特定经考虑实施方案:
[0206]
1.一种液体药物制剂,其包含
[0207]
a)150mg/ml抗-il-23p19抗体,其中该抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列;
[0208]
b)多元醇;及
[0209]
c)表面活性剂。
[0210]
2.如实施方案1的制剂,其包含
[0211]
d)缓冲剂。
[0212]
3.如实施方案1或2的制剂,其中该抗体为瑞沙珠单抗。
[0213]
4.如实施方案1至3中任一项的制剂,其中该抗体已在哺乳动物细胞中以重组方式产生。
[0214]
5.如实施方案4的制剂,其中该抗体已在cho细胞中以重组方式产生。
[0215]
6.如实施方案1至5中一或多项的制剂,其中该多元醇选自糖、糖醇及其组合。
[0216]
7.如实施方案6的制剂,其中该多元醇选自海藻糖、蔗糖、山梨醇、甘露醇及其组合。
[0217]
8.如实施方案6的制剂,其中该多元醇为糖,该糖任选选自海藻糖及蔗糖。
[0218]
9.如实施方案6的制剂,其包含作为多元醇的海藻糖。
[0219]
10.如实施方案6的制剂,其中该多元醇选自山梨醇及甘露醇。
[0220]
11.如实施方案6的制剂,其包含作为多元醇的甘露醇。
[0221]
12.如实施方案1至11中任一项的制剂,其中该液体药物制剂不包含山梨醇。
[0222]
13.如实施方案1至9中一或多项的制剂,其中该制剂不包含糖醇。
[0223]
14.如实施方案1至13中一或多项的制剂,其具有以下特征中的一或多个:
[0224]
(i)该制剂中的该多元醇的浓度为至少95mm;
[0225]
(ii)该制剂中的该多元醇的浓度为至少125mm;
[0226]
(iii)该制剂中的该多元醇的浓度为至少150mm;
[0227]
(iv)该制剂中的该多元醇的浓度为≤500mm、≤450mm或≤400mm;
[0228]
(v)该制剂中的该多元醇的浓度为≤350mm、≤300mm或≤275mm;和/或
[0229]
(vi)该制剂中的该多元醇的浓度处于95mm至450mm或125mm至400mm范围内;
[0230]
任选其中该多元醇为糖和/或糖醇。
[0231]
15.如实施方案1至13中一或多项的制剂,其中该制剂中的该多元醇的浓度在95mm至250mm范围内,任选其中该多元醇为糖。
[0232]
16.如实施方案1至13中一或多项的制剂,其中该制剂中的该多元醇的浓度在125mm至225mm范围内,任选其中该多元醇为诸如海藻糖的糖。
[0233]
17.如实施方案1至13中一或多项的制剂,其中该多元醇的浓度在145mm至225mm范围内,任选其中该多元醇为诸如海藻糖的糖。
[0234]
18.如实施方案1至13中一或多项的制剂,其中该多元醇为糖且其中该糖的浓度在150mm至200mm范围内,任选其中该糖为海藻糖。
[0235]
19.如实施方案1至13中一或多项的制剂,其中该多元醇为糖且其中该糖的浓度在160mm至200mm范围内,任选其中该糖为海藻糖。
[0236]
20.如实施方案1至13中一或多项的制剂,其中该多元醇为糖且其中该糖的浓度在170mm至200mm范围内,任选其中该糖为海藻糖。
[0237]
21.如实施方案1至13中一或多项的制剂,其包含185mm作为多元醇的海藻糖。
[0238]
22.如实施方案1至21中一或多项的制剂,其中该表面活性剂为非离子表面活性剂。
[0239]
23.如实施方案22的制剂,其中该表面活性剂为聚山梨醇酯。
[0240]
24.如实施方案22或23的制剂,其中该非离子表面活性剂选自聚山梨醇酯20和/或聚山梨醇酯80。
[0241]
25.如实施方案1至24中一或多项的制剂,其中该表面活性剂为聚山梨醇酯20。
[0242]
26.如实施方案1至25中一或多项,详言之实施方案23至25中任一项的制剂,其中该制剂中的该表面活性剂的浓度为至少0.05mg/ml,任选至少0.075mg/ml。
[0243]
27.如实施方案1或26中一或多项,详言之实施方案23至25中任一项的制剂,其中该制剂中的该表面活性剂的该浓度在0.05mg/ml至0.75mg/ml范围内。
[0244]
28.如实施方案1或27中一或多项,详言之实施方案23至25中任一项的制剂,其中该制剂中的该表面活性剂的该浓度在0.05mg/ml至0.5mg/ml或0.075mg/ml至0.3mg/ml范围内。
[0245]
29.如实施方案25的制剂,其中该制剂包含0.2mg/ml作为表面活性剂的聚山梨醇酯20。
[0246]
30.如实施方案29的制剂,其中该多元醇为糖且其中该糖的浓度在145mm至225mm范围内,任选其中该糖为海藻糖。
[0247]
31.如实施方案1至30中一或多项的制剂,其中该液体药物制剂的ph在ph 5.0至7.5或ph 5.0至7.0范围内。
[0248]
32.如实施方案1至30中一或多项的制剂,其中该液体药物制剂的ph在5.2至6.5或
5.2至6.2范围内。
[0249]
33.如实施方案1至30中一或多项的制剂,其中该液体药物制剂的ph在5.5至6.5或5.5至6.2范围内。
[0250]
34.如实施方案1至30中一或多项的制剂,其中该液体药物制剂的ph在5.5至5.9范围内。
[0251]
35.如实施方案1至30中一或多项的制剂,其中该液体药物制剂的ph在5.6至5.8范围内。
[0252]
36.如实施方案1至30中一或多项的制剂,其中该液体药物制剂的ph为5.7或6.2。
[0253]
37.如实施方案2至36中一或多项的制剂,其中该缓冲剂在25℃下的pka在该液体药物制剂的最终ph的1.5或一ph单位内,任选其中该缓冲剂在25℃下的pka在4.2至7.2ph或4.5至7ph范围内。
[0254]
38.如实施方案2至37中一或多项的制剂,其中该缓冲剂是有机缓冲剂,该有机缓冲剂任选选自乙酸盐缓冲剂及丁二酸盐缓冲剂。
[0255]
39.如实施方案38的制剂,其中该缓冲剂为乙酸盐缓冲剂,任选其中该乙酸盐缓冲剂包含乙酸钠及乙酸。
[0256]
40.如实施方案2至37中一或多项的制剂,其中该缓冲剂为组氨酸缓冲剂,或其中该制剂满足以下特征中的至少一个:
[0257]
(i)其包含羧酸缓冲剂;(ii)其不包含丁二酸盐缓冲剂。
[0258]
41.如实施方案2至40中一或多项的制剂,其包含至少1mm、至少2mm或至少3mm缓冲剂,任选包含至少4mm、至少4.5mm或至少5mm缓冲剂。
[0259]
42.如实施方案2至41中一或多项的制剂,其中该缓冲剂浓度为100mm或更低、75mm或更低或50mm或更低。
[0260]
43.如实施方案2至41中一或多项的制剂,其中该缓冲剂浓度为20mm或更低或15mm或更低。
[0261]
44.如实施方案2至41中一或多项的制剂,其中该缓冲剂浓度在4mm至50mm范围内。
[0262]
45.如实施方案2至41中一或多项的制剂,其中该缓冲剂浓度在5mm至25mm或5mm至20mm范围内。
[0263]
46.如实施方案2至41中一或多项的制剂,其中该缓冲剂浓度在5mm至15mm或7mm至12mm范围内。
[0264]
47.如实施方案2至41中一或多项的制剂,其中该缓冲剂浓度为10mm。
[0265]
48.如实施方案2至47中一或多项的制剂,其中该制剂包含单一缓冲剂,任选为乙酸盐缓冲剂。
[0266]
49.如技术方案1或3至36中任一项的制剂,其中该制剂不包含缓冲剂。
[0267]
50.如实施方案1至49中一或多项的制剂,其中该制剂为水性制剂。
[0268]
51.如实施方案2至48或50中任一项的制剂,其包含
[0269]
a)150mg/ml该抗体;
[0270]
b)糖,任选其中该糖的浓度在95mm至250mm或145mm至225mm范围内;
[0271]
c)非离子表面活性剂,任选其中该非离子表面活性剂的浓度在0.05mg/ml至0.5mg/ml或0.075mg/ml至0.3mg/ml范围内;及
[0272]
d)缓冲剂。
[0273]
52.如实施方案2至48或50至51中任一项的制剂,其包含
[0274]
a)150mg/ml该抗体;
[0275]
b)海藻糖,任选其中海藻糖的浓度在95mm至250mm或145mm至225mm范围内;
[0276]
c)聚山梨醇酯,任选其中该聚山梨醇酯的浓度在0.05mg/ml至0.5mg/ml或0.075mg/ml至0.3mg/ml范围内;及
[0277]
d)缓冲剂。
[0278]
53.如实施方案51或52的制剂,其中该缓冲剂为乙酸盐缓冲剂或丁二酸盐缓冲剂,任选其中该缓冲剂浓度在5mm至25mm范围内。
[0279]
54.如实施方案52或53的制剂,其中该聚山梨醇酯为聚山梨醇酯20。
[0280]
55.如实施方案51至54中任一项的制剂,其中该制剂的该ph在ph 5.2至ph 6.5范围内,任选其中该ph在5.2至6.2或5.5至6.2范围内或为5.7。
[0281]
56.如实施方案2至48或50至55中任一项的制剂,其包含
[0282]
a)150mg/ml该抗体;
[0283]
b)170mm至约200mm海藻糖;
[0284]
c)0.1mg/ml至0.3mg/ml聚山梨醇酯,任选为聚山梨醇酯20;及
[0285]
d)缓冲剂,任选其中该缓冲剂为乙酸盐缓冲剂。
[0286]
57.如实施方案1、3至36或49至50中一或多项的液体药物制剂,其包含
[0287]
a)150mg/ml该抗体;
[0288]
b)多元醇,任选其中该多元醇为糖或糖醇;及
[0289]
c)非离子表面活性剂,任选为聚山梨醇酯;
[0290]
d)不包含缓冲剂。
[0291]
58.如实施方案57的制剂,其中该制剂的该ph在ph 5.2至ph 6.5范围内,任选其中该ph在5.2至6.2或5.5至6.2范围内。
[0292]
59.如实施方案58的制剂,其中该ph为5.7。
[0293]
60.如实施方案57至59中任一项的制剂,其包含80mm至250mm多元醇,任选其中该多元醇为海藻糖。
[0294]
61.如实施方案57至60中任一项的制剂,其中该非离子表面活性剂的浓度在0.05mg/ml至0.5mg/ml、0.075mg/ml至0.4mg/ml或0.1mg/ml至0.3mg/ml范围内。
[0295]
62.如实施方案61的制剂,其中该非离子表面活性剂为聚山梨醇酯,任选为聚山梨醇酯20。
[0296]
63.如实施方案1至62中一或多项的制剂,其进一步包含作为添加剂的氨基酸。
[0297]
64.如实施方案63的制剂,其中该氨基酸具有带电侧链,任选具有带正电侧链,该氨基酸诸如为l-精氨酸。
[0298]
65.如实施方案63或64的制剂,其中该氨基酸以盐,任选以盐酸(hcl)盐形式存在于该制剂中。
[0299]
66.如实施方案63的制剂,其中该氨基酸为甲硫氨酸。
[0300]
67.如实施方案63的制剂,其中该氨基酸为l-脯氨酸。
[0301]
68.如实施方案1至67中一或多项的制剂,其中该制剂具有以下特征中的一或多
个:
[0302]
(i)其不包含精氨酸;
[0303]
(ii)其不包含具有带正电侧链的氨基酸;
[0304]
(iii)其不包含具有带电侧链的氨基酸;
[0305]
(iv)其不包含甲硫氨酸;和/或
[0306]
(v)其不包含作为添加剂的氨基酸。
[0307]
69.如实施方案2至68中任一项的液体药物制剂,其包含
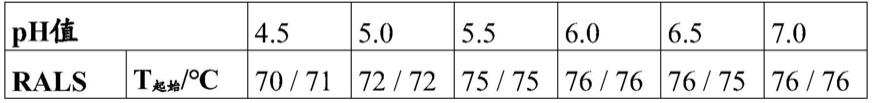
[0308]
a)150mg/ml该抗体;
[0309]
b)185mm海藻糖;
[0310]
c)0.2mg/ml聚山梨醇酯20;及
[0311]
d)10mm乙酸盐缓冲剂;
[0312]
其中该ph在5.2至6.2范围内且任选为5.7。
[0313]
70.如实施方案1至69中任一项的制剂,其中该制剂是稳定的。
[0314]
71.如实施方案70的制剂,其满足以下稳定性特征中的一或多个:
[0315]
(i)在5℃下储存36个月之后,如通过up-sec所测量,至少94%、至少95%或至少96%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过3%、超过2.5%、超过2%或超过1.5%;
[0316]
(ii)在5℃下储存24个月之后,如通过up-sec所测量,至少94%、至少95%或至少96%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过3%、超过2.5%、超过2%、超过1.5%或超过1%;
[0317]
(iii)在5℃下储存9个月之后,如通过up-sec所测量,至少96%或至少96.5%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过1.5%或超过1%;
[0318]
(iv)在5℃下储存3个月之后,如通过up-sec所测量,至少96%或至少97%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过1%或超过0.7%或超过0.5%;
[0319]
(v)在25℃下储存12个月之后,如通过up-sec所测量,至少90%或至少92%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过7%或超过6%或超过5%;
[0320]
(vi)在25℃下储存3个月之后,如通过up-sec所测量,至少95%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过3%或超过2%;
[0321]
(vii)在25℃下储存1个月之后,如通过up-sec所测量,至少96%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过2%或超过1%;
[0322]
(viii)在40℃下储存3个月之后,如通过up-sec所测量,至少87%或至少88%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过10%或超过9%或超过8%;和/或
[0323]
(ix)在40℃下储存1个月之后,如通过up-sec所测量,至少93%或至少94%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过5%或超过4%。
[0324]
72.如实施方案70或71的制剂,其满足以下稳定性特征中的一或多个:
[0325]
(i)在5℃下储存至少36个月之后,该制剂具有12fnu(福尔马肼浊度测定单位)或更少或10fnu或更少的乳白光,和/或该乳白光不增加超过5fnu或超过3fnu;
[0326]
(ii)在5℃下储存至少3、6、9、12、18或24个月之后,该制剂具有12fnu(福尔马肼浊度测定单位)或更少或10fnu或更少的乳白光,和/或该乳白光不增加超过5fnu或超过3fnu;
[0327]
(iii)在25℃下储存至少1、3、6、9或12个月之后,该制剂具有12fnu或更少或10fnu或更少的乳白光,和/或该乳白光不增加超过7fnu或超过5fnu;
[0328]
(iv)在40℃下储存至少1或3个月之后,该制剂具有12fnu或更少或10fnu或更少的乳白光,和/或该乳白光不增加超过5fnu或超过3fnu;和/或(v)在25℃下摇动21天之后,该制剂具有12fnu或更少或10fnu或更少的乳白光,和/或该制剂的该乳白光不增加超过3fnu或超过2fnu。
[0329]
73.如实施方案70至72中任一项的制剂,其满足以下稳定性特征中的一或多个:
[0330]
(i)在25℃下摇动21天之后,如通过up-sec所测量,至少95%或至少96%的该抗体以单体形式存在,和/或该抗体的相对单体含量不减少超过2%或超过1%;和/或
[0331]
(ii)在25℃下摇动21天之后,如通过up-sec所测量,少于3%或少于2%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmw含量不增加超过2%或超过1.5%或超过1%。
[0332]
74.如实施方案70至73中任一项的制剂,其满足以下稳定性特征中的一或多个:
[0333]
(i)在5℃下储存36个月之后,如通过up-sec所测量,少于4%或少于3%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmws含量不增加超过2%或超过1.5%;
[0334]
(ii)在5℃下储存24个月之后,如通过up-sec所测量,少于4%或少于3%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmw含量不增加超过2%或超过1.5%或超过1%;
[0335]
(iii)在5℃下储存9个月之后,如通过up-sec所测量,少于4%或少于3%或少于2.5%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmw含量不增加超过1%或超过0.8%或超过0.6%;
[0336]
(iv)在5℃下储存3个月之后,如通过up-sec所测量,少于4%或少于3%或少于2.5%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmw含量不增加超过1%或超过0.8%或超过0.6%;
[0337]
(v)在40℃下储存3个月之后,如通过up-sec所测量,少于6.5%或少于6%或少于5.5%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmw含量不增加超过5%或超过4%;和/或
[0338]
(vi)在40℃下储存1个月之后,如通过up-sec所测量,少于5%或少于4.5%或少于4%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmw含量不增加超过2.5%或超过2%。
[0339]
75.如实施方案70至74中任一项的制剂,其满足以下稳定性特征中的一或多个:
[0340]
(i)在25℃下储存12个月之后,如通过up-sec所测量,少于5%或少于4%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmw含量不增加超过3%或超过2.5%或超过2%;
[0341]
(ii)在25℃下储存3个月之后,如通过up-sec所测量,少于4%或少于3.5%或少于3.2%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmw含量不增加超过
2%或超过1.5%;和/或
[0342]
(iii)在25℃下储存1个月之后,如通过up-sec所测量,少于4%或少于3.5%或少于3%的该抗体以高分子量(hmw)物种形式存在,和/或该抗体的相对hmw含量不增加超过1.5%或超过1%。
[0343]
76.如实施方案70至75中任一项的制剂,其满足以下稳定性特征中的一或多个:
[0344]
(i)在5℃下储存36个月之后,如通过up-sec所测量,少于2%或少于1.5%的该抗体以低分子量(lmw)物种形式存在,和/或该抗体的相对lmws含量不增加超过1.5%或超过1.5%或超过0.5%;
[0345]
(ii)在5℃下储存24个月之后,如通过up-sec所测量,少于2%或少于1.5%的该抗体以低分子量(lmw)物种形式存在,和/或该抗体的相对lmw含量不增加超过1.5%或超过1.5%或超过0.5%;
[0346]
(iii)在5℃下储存9个月之后,如通过up-sec所测量,少于2%或少于1.5%的该抗体以低分子量(lmw)物种形式存在,和/或该抗体的相对lmw含量不增加超过1.5%或超过1.5%或超过0.5%;
[0347]
(iv)在5℃下储存3个月之后,如通过up-sec所测量,少于2%或少于1.5%或少于1%的该抗体以低分子量(lmw)物种形式存在,和/或该抗体的相对lmw含量不增加超过1%或超过0.5%或超过0.25%;
[0348]
(v)在40℃下储存3个月之后,如通过up-sec所测量,少于8%或少于7%或少于6%的该抗体以低分子量(lmw)物种形式存在,和/或该抗体的相对lmw含量不增加超过8%或超过7%或超过6%;和/或
[0349]
(vi)在40℃下储存1个月之后,如通过up-sec所测量,少于4%或少于3.5%或少于3%的该抗体以低分子量(lmw)物种形式存在,和/或该抗体的相对lmw含量不增加超过3%或超过2.5%或超过2.2%。
[0350]
77.如实施方案70至76中任一项的制剂,其满足以下稳定性特征中的一或多个:
[0351]
(i)在25℃下储存12个月之后,如通过up-sec所测量,少于6%或少于5%或少于4.5%的该抗体以低分子量(lmw)物种形式存在,和/或该抗体的相对lmw含量不增加超过5%或超过4%或超过3%;
[0352]
(ii)在25℃下储存3个月之后,如通过up-sec所测量,少于3%或少于2%或少于1.8%的该抗体以低分子量(lmw)物种形式存在,和/或该抗体的相对lmw含量不增加超过2%或超过1.5%或超过1%;和/或
[0353]
(iii)在25℃下储存1个月之后,如通过up-sec所测量,少于2%或少于1.5%或少于1.2%的该抗体以低分子量(lmw)物种形式存在,和/或该抗体的相对lmw含量不增加超过1%或超过0.6%或超过0.4%。
[0354]
78.如实施方案70至77中任一项的制剂,其满足以下稳定性特征中的一或多个:
[0355]
(i)在5℃下储存36个月之后,如通过离子交换色谱法(iec)所测定,至少55%、至少60%或至少65%的该抗体以主峰变异体形式存在,和/或该抗体的相对主峰变异体含量不减少超过8%或超过7%或超过5%;
[0356]
(ii)在5℃下储存24个月之后,如通过离子交换色谱法(iec)所测定,至少55%、至少60%或至少65%的该抗体以主峰变异体形式存在,和/或该抗体的相对主峰变异体含量
不减少超过8%或超过7%或超过5%;
[0357]
(iii)在5℃下储存6个月之后,如通过离子交换色谱法(iec)所测定,至少60%或至少65%的该抗体以主峰变异体形式存在,和/或该抗体的相对主峰变异体含量不减少超过5%或超过4%;
[0358]
(iv)在5℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,至少60%或至少65%的该抗体以主峰变异体形式存在,和/或该抗体的相对主峰变异体含量不减少超过4%或超过3%或超过2%;
[0359]
(v)在25℃下储存12个月之后,如通过离子交换色谱法(iec)所测定,至少35%或至少40%或至少45%的该抗体以主峰变异体形式存在,和/或该抗体的相对主峰变异体含量不减少超过35%或超过30%或超过25%;
[0360]
(vi)在25℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,至少55%或至少60%的该抗体以主峰变异体形式存在,和/或该抗体的相对主峰变异体含量不减少超过15%或超过10%;和/或
[0361]
(vii)在25℃下储存1个月之后,如通过离子交换色谱法(iec)所测定,至少60%或至少65%的该抗体以主峰变异体形式存在,和/或该抗体的相对主峰变异体含量不减少超过10%或超过5%。
[0362]
79.如实施方案70至78中任一项的制剂,其满足以下稳定性特征中的一或多个:
[0363]
(i)在5℃下储存36个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于28%的该抗体以酸性峰群变异体形式存在,和/或该抗体的相对酸性峰群变异体含量不增加超过4%或超过3%或超过2%;
[0364]
(ii)在5℃下储存24个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于28%的该抗体以酸性峰群变异体形式存在,和/或该抗体的相对酸性峰群变异体含量不增加超过4%或超过3%或超过2%;
[0365]
(iii)在5℃下储存6个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于28%的该抗体以酸性峰群变异体形式存在,和/或该抗体的相对酸性峰群变异体含量不增加超过4%或超过3%或超过2%;
[0366]
(iv)在5℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于28%的该抗体以酸性峰群变异体形式存在,和/或该抗体的相对酸性峰群变异体含量不增加超过3%或超过2%或超过1%;
[0367]
(v)在25℃下储存12个月之后,如通过离子交换色谱法(iec)所测定,少于50%、少于45%或少于40%的该抗体以酸性峰群变异体形式存在,和/或该抗体的相对酸性峰群变异体含量不增加超过30%或超过25%或超过20%;
[0368]
(vi)在25℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,少于40%或少于35%或少于30%的该抗体以酸性峰群变异体形式存在,和/或该抗体的相对酸性峰群变异体含量不增加超过10%或超过8%或超过6%;和/或(vii)在25℃下储存1个月之后,如通过离子交换色谱法(iec)所测定,少于35%或少于30%或少于28%的该抗体以酸性峰群变异体形式存在,和/或该抗体的相对酸性峰群变异体含量不增加超过4%或超过3%。
[0369]
80.如实施方案70至79中任一项的制剂,其满足以下稳定性特征中的一或多个:
[0370]
(i)在5℃下储存36个月之后,如通过离子交换色谱法(iec)所测定,少于20%、少
于17%、少于15%或少于13%的该抗体以碱性峰群变异体形式存在,和/或该抗体的相对碱性峰群变异体含量不增加超过10%或超过8%或超过6%;
[0371]
(ii)在5℃下储存24个月之后,如通过离子交换色谱法(iec)所测定,少于20%、少于17%、少于15%或少于13%的该抗体以碱性峰群变异体形式存在,和/或该抗体的相对碱性峰群变异体含量不增加超过10%或超过8%或超过6%;
[0372]
(iii)在5℃下储存6个月之后,如通过离子交换色谱法(iec)所测定,少于15%或少于10%的该抗体以碱性峰群变异体形式存在,和/或该抗体的相对碱性峰群变异体含量不增加超过4%或超过3%或超过2%;
[0373]
(iv)在5℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,少于15%或少于10%的该抗体以碱性峰群变异体形式存在,和/或该抗体的相对碱性峰群变异体含量不增加超过3%或超过2%;
[0374]
(v)在25℃下储存12个月之后,如通过离子交换色谱法(iec)所测定,少于30%或少于25%或少于22%的该抗体以碱性峰群变异体形式存在,和/或该抗体的相对碱性峰群变异体含量不增加超过25%或超过20%或超过15%;
[0375]
(vi)在25℃下储存3个月之后,如通过离子交换色谱法(iec)所测定,少于20%或少于15%或少于12%的该抗体以碱性峰群变异体形式存在,和/或该抗体的相对碱性峰群变异体含量不增加超过9%或超过7%或超过5%;和/或
[0376]
(vii)在25℃下储存1个月之后,如通过离子交换色谱法(iec)所测定,少于15%或少于10%或少于9%的该抗体以碱性峰群变异体形式存在,和/或该抗体的相对碱性峰群变异体含量不增加超过3%或超过2%。
[0377]
81.如实施方案70至80中任一项的制剂,其满足以下稳定性特征中的一或多个:
[0378]
(i)在5℃储存36个月之后,测得相较于参考抗体至少95%或至少97%与il-23的特异性结合活性,其中该参考抗体尚未储存;
[0379]
(ii)在5℃储存4、6、9、12、18或24个月之后,测得相较于参考抗体至少95%或至少97%与il-23的特异性结合活性,其中该参考抗体尚未储存;
[0380]
(iii)在25℃储存2、3、4、6、9、12或18个月之后,测得相较于参考抗体至少93%或至少96%与il-23的特异性结合活性,其中该参考抗体尚未储存;和/或
[0381]
(iv)在40℃储存3、4或6个月之后,测得相较于参考抗体至少90%或至少95%与il-23的特异性结合活性,其中该参考抗体尚未储存。
[0382]
82.如实施方案1至81中一或多项的制剂,其中在20℃所测量的动态黏度为≤30mpas(mpa
·
s)、≤25mpas或≤20mpas。
[0383]
83.如实施方案1至82中一或多项的制剂,其中该制剂的电导率在0.8至5ms/cm范围内,任选在1至2ms/cm或1.2至1.8ms/cm范围内。
[0384]
84.如实施方案1至83中一或多项的制剂,其中该制剂的渗透重量摩尔浓度在225mosm/kg至375mosm/kg,诸如250mosm/kg至350mosm/kg、275mosm/kg至330mosm/kg或290mosm/kg至320mosm/kg范围内。
[0385]
85.如实施方案1至84中一或多项的制剂,其中该制剂为可注射制剂。
[0386]
86.如实施方案85的制剂,其中该制剂适用于皮下注射。
[0387]
87.如实施方案1至86中一或多项的制剂,其中该制剂在施用之前不经且尚未经复
原步骤。
[0388]
88.如实施方案1至86中任一项的制剂,其为由冻干制剂复原制备。
[0389]
89.一种抗-il-23p19抗体的冻干制剂,其中该抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列,该冻干制剂为通过冻干如实施方案1至69中任一项的液体制剂制造,任选其中该液体制剂为水溶液。
[0390]
90.一种抗-il-23p19抗体的冻干制剂,其中该抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列,该冻干制剂在复原时提供如实施方案1至69或82至86中任一项的液体制剂。
[0391]
91.一种经冻干制剂,其包含
[0392]
a)抗-il-23p19抗体,其中抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列,抗体的量在复原时提供150mg/ml的抗体浓度;
[0393]
b)多元醇;
[0394]
c)表面活性剂;及
[0395]
d)任选选用的缓冲剂。
[0396]
92.如实施方案91的经冻干制剂,其中该抗体为瑞沙珠单抗。
[0397]
93.如实施方案91或92的经冻干制剂,其中该多元醇具有如实施方案6至13中任一项的特征中的一或多个,任选其中该多元醇为糖,该糖任选选自海藻糖及蔗糖。
[0398]
94.如实施方案91至93中任一项的经冻干制剂,其中该表面活性剂具有如实施方案22至25中任一项的特征中的一或多个,任选其中该表面活性剂为聚山梨醇酯。
[0399]
95.如实施方案91至94中任一项的经冻干制剂,其包含d)缓冲剂,其中该缓冲剂具有如实施方案37至40中任一项的特征中的一或多个。
[0400]
96.如实施方案91至95中任一项的经冻干制剂,其中该制剂在复原时具有如实施方案31至36中任一项的ph。
[0401]
97.一种密封容器,任选为小瓶或预填充注射器,其含有如实施方案1至87中任一项的液体药物制剂。
[0402]
98.一种容器,任选为密封小瓶,其含有如实施方案88至96中任一项的经冻干制剂。
[0403]
99.如实施方案97的产品,其中该容器含有2ml或更少该液体制剂,任选含有1.5ml或更少或1ml或更少该液体制剂。
[0404]
100.如实施方案97至99中任一项的产品,其包含150mg单次剂量的抗体。
[0405]
101.如实施方案1至96中任一项的制剂或如实施方案97至100中任一项的产品,其用于治疗性治疗人类个体。
[0406]
102.如实施方案1至96中任一项的制剂或如实施方案97至100中任一项的产品,其用于治疗选自牛皮癣及炎性肠病的疾病。
[0407]
103.如实施方案1至96中任一项的制剂或如实施方案97至100中任一项的产品,其用于治疗选自牛皮癣性关节炎及克罗恩氏病的疾病。
[0408]
104.一种稳定的液体药物制剂,其包含
[0409]
a)150mg/ml抗-il-23p19抗体,其中该抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列;
[0410]
b)张力调节剂;及
[0411]
c)表面活性剂,
[0412]
其中该制剂的ph为5.5-5.9且该制剂具等张性。
[0413]
105.如实施方案104的稳定制剂,其中该抗体为瑞沙珠单抗。
[0414]
106.如实施方案104或105的稳定制剂,其中张力调节剂为多元醇。
[0415]
107.如实施方案104至106中任一项的稳定制剂,其中该张力调节剂为如上文实施方案6至11中任一项的多元醇。
[0416]
108.如实施方案104至107中任一项的稳定制剂,其中该张力调节剂的浓度具有如针对上文实施方案14至21中任一项中的多元醇所定义的特征中的一或多个,任选其中该张力调节剂为如其中所定义的多元醇,任选为糖和/或糖醇,该糖任选选自海藻糖及蔗糖。
[0417]
109.如实施方案104至108中任一项的稳定制剂,其中该表面活性剂具有如上文实施方案22至25中任一项的特征中的一或多个,任选其中该表面活性剂为聚山梨醇酯,该聚山梨醇酯任选选自聚山梨醇酯20及聚山梨醇酯80。
[0418]
110.如实施方案104至109中任一项的稳定制剂,其中该制剂中的该表面活性剂的浓度如上文实施方案26至30中任一项中所定义。
[0419]
111.如实施方案104至110中任一项的稳定制剂,其中该制剂的ph在5.6至5.8范围内,任选其中该制剂的该ph为5.7。
[0420]
112.如实施方案104至111中任一项的稳定制剂,其包含d)缓冲剂,任选其中该缓冲剂具有如实施方案37至40及48中任一项的特征中的一或多个。
[0421]
113.如实施方案112的稳定制剂,其中该缓冲剂具有如实施方案41至47中任一项的浓度。
[0422]
114.如实施方案104至113中任一项的稳定制剂,其中该制剂为水性制剂。
[0423]
115.如实施方案104至114中任一项的稳定制剂,其满足如实施方案71至81中任一项的稳定性特征中的一或多个。
[0424]
116.如实施方案104至111或114至115中任一项的稳定制剂,其中该制剂不含缓冲剂。
[0425]
117.如实施方案104至116中任一项的稳定制剂,其中该制剂的渗透重量摩尔浓度为290-320mosm/kg。
[0426]
118.如实施方案104至117中任一项的稳定制剂,其具有以下特征中的至少一个或至少两个:
[0427]
(i)该表面活性剂为非离子表面活性剂;
[0428]
(ii)该表面活性剂为聚山梨醇酯,该聚山梨醇酯任选选自聚山梨醇酯20及聚山梨醇酯80;
[0429]
(iii)其中该制剂中的该表面活性剂的浓度在0.05mg/ml至0.5mg/ml范围内,任选在0.075mg/ml至0.4mg/ml或0.1mg/ml至0.3mg/ml范围内;和/或
[0430]
(iv)其具有如实施方案12、13或63至68的特征中的任一个。
[0431]
119.如实施方案104至118中任一项的稳定制剂,其为通过由经冻干制剂进行复原来制备。
[0432]
120.一种抗-il-23p19抗体的经冻干制剂,其中该抗体包含根据seq id no:1的轻
链氨基酸序列及根据seq id no:2的重链氨基酸序列,该经冻干制剂为通过冻干如实施方案104至118中任一项的液体制剂来制造,任选其中该稳定的液体制剂为水溶液。
[0433]
121.一种抗-il-23p19抗体的经冻干制剂,其中该抗体包含根据seq id no:1的轻链氨基酸序列及根据seq id no:2的重链氨基酸序列,该经冻干制剂为在复原如实施方案104至118中任一项的稳定的液体制剂时提供。
[0434]
数值范围包括界定该范围的数值。本文所提供的标题并非对本发明的各种方面或实施方案的限制,所述方面或实施方案可参看本说明书整体来读取。
[0435]
除非上下文另外清楚地指示,否则如本说明书中所使用的单数形式“一(a/an)”及“该/所述”包括复数个提及物。术语“包括”、“具有”、“包含”及其变化形式以同义使用且解释为非限制性的。在整个本说明书中,除非另外描述,否则在将组合物描述为包含组分或材料的情况下,经考虑组合物亦可在实施方案中基本上由所叙述组分或材料的任何组合组成或由所叙述组分或材料的任何组合组成。本文说明性地公开的技术适当地可在不存在本文未具体公开的任何元素的情况下实践。
[0436]
实施例
[0437]
以下实施例仅出于说明的目的且不解释为以任何方式限制本发明。
[0438]
i.物质及方法
[0439]
1.制备起始物质
[0440]
必要时,在uf/df过程之前,将在cho细胞中产生且经纯化的瑞沙珠单抗起始物质调节至ph 5.9。最后,浓缩溶液且使用经浓缩起始物质以制备根据后续实施例的制剂。
[0441]
2.注射器
[0442]
基本上通过使用becton dickinson(usa)的具有橡胶塞的neopak注射器来执行制剂于注射器中的储存。使用所述注射器来测量松动力以及最大及平均滑移力。在实施方案中,使用becton dickinson(usa)的具有27号规1/2英寸针及橡胶塞的1ml neopak注射器。
[0443]
ii.实施例1:表征起始物质
[0444]
1.ph对抗体的影响
[0445]
对于10mm乙酸盐、10mm柠檬酸盐、10mm磷酸盐、115mm nacl的缓冲剂混合物中的在不同ph值下的瑞沙珠单抗执行rals(直角光散射)测量。结果示于表1中。
[0446]
表1:针对不同ph值的rals测量结果。
[0447][0448]
结果显示当ph增大时展开起点升高直至达到平线区为止。在高于5.0至7的ph时测量到指示高稳定性的最高起始温度。因此,ph不应过于酸性(<5)。
[0449]
2.测定起始物质的缓冲容量
[0450]
尤其测定抗体起始物质的缓冲容量以便促进后续稳定性研究的制剂溶液的ph调节且以避免蛋白质损伤。在以下浓度下执行用以测定抗体缓冲容量的滴定:150mg/ml;100mg/ml;50mg/ml(两次)及20mg/ml。
[0451]
根据表2在烧杯中进行稀释。
[0452]
表2:用于测定起始物质的缓冲容量的稀释流程。
[0453][0454]
在稀释之后,使用体积滴管将5ml各别溶液转移至10r玻璃小瓶中且进行滴定。选择0.2m naoh溶液以进行滴定(250rpm的搅拌速度)。对于各抗体浓度,执行滴定且计算所添加naoh的量。使用excel计算如表3中所示的斜率及斜率的倒数值。
[0455]
表3:斜率及对应倒数值的计算结果。
[0456][0457][0458]
通过绘制浓度对斜率的倒数值图式来获得浓度相依缓冲容量水平。因此,获得斜率为0.0505且y轴截距为-0.2007的直线。结果及下文实施例显示,瑞沙珠单抗自身具有相当大缓冲容量,允许制备150mg/ml不包含任何另外/额外缓冲物质的本发明的不含缓冲剂的制剂。
[0459]
iii.实施例2:分析不同ph值及缓冲物质
[0460]
1.比较具有不同ph值的乙酸盐与丁二酸盐缓冲系统以评估150mg/ml制剂的稳定性
[0461]
1.1.制备制剂
[0462]
制备且分析表4中所示的制剂:
[0463]
表4:所分析制剂的组成。
[0464][0465]
0.02%ps20对应于0.2mg/ml ps20。
[0466]
在18个月时段内(0、3、6、8、12及18个月)采集样品。储存条件为:5℃及25℃/相对湿度60%。将各制剂填充至neopak注射器中。层流内的填充设定成1.1ml的体积。用塞子封闭注射器且在储存之前视觉上分析粒子。之后,在各别温度下在注射器-托盘中悬挂式储存注射器。并行地将缓冲溶液储存为对照。在制备制剂之后,对各溶液进行无菌过滤且将所制备的制剂储存于注射器(becton dickinson(usa)的neopak注射器)中。
[0467]
1.2.分析
[0468]
为分析样品,尤其执行高压粒径排阻色谱法(hp-sec)及超效粒径排阻色谱法(up-sec)且测量在860nm下的浊度(亦称为乳白光)。通过测量释放/注射制剂所需的机械力来分析储存于注射器(neopak)中的制剂的可注射性。在379.2毫米/分钟的速度的情况下执行压力测试(5秒)。在20℃下使用具有c35/1转子的haake rheostress 600测量制剂黏度。执行双重测量。
[0469]
下文描述所用分析方法的另外细节。
[0470]
1.3.结果
[0471]
1.3.1.测量单体含量
[0472]
通过hp-sec及up-sec分析样品以测定单体含量。
[0473]
hp-sec分析
[0474]
通过在25℃及5℃的储存温度下的hp-sec分析获得的结果示于表5中:
[0475]
表5:在注射器中不同温度下的18个月储存内以%为单位的hp-sec单体分析结果。
[0476][0477][0478]
在25℃下在18个月的储存时间内单体含量在91%-94%之间。在此实施例中,对于所测试的f1,测量到-5%的最强降低;对于所测试的制剂4及5,测量到-3%的最低降低。在5℃下在18个月的储存时间内单体含量在93%-96%之间。对于f1,测量到-2.4%的最强降低;对于制剂4及5,测量到-0.9%及-1.1%的最低降低。
[0479]
up-sec分析
[0480]
up-sec分析结果类似于hp-sec分析结果且因此确认这些结果。
[0481]
表5a:在注射器中不同温度下的18个月储存内以%为单位的up-sec单体分析结果。
[0482][0483]
在25℃下在18个月的储存时间内单体含量(up-sec)在88%-91%之间。对于f1,测量到-6.4%的最强降低;对于制剂4及5,测量到-5.1%及-5.4%的最低降低。在5℃下在18个月的储存时间内单体含量(up-sec)在93%-95%之间。对于f1,测量到-2.2%的最强降
低;对于制剂4及5,测量到-1%的最低降低。
[0484]
结果与讨论
[0485]
鉴于单体含量,全部所测试制剂皆总体上稳定,显示这些制剂在长达18个月的长储存时间内在5℃及25℃下稳定。
[0486]
1.3.2.测量hmw含量
[0487]
通过hp-sec及up-sec分析样品以测定hmw含量。
[0488]
hp-sec分析
[0489]
通过在25℃及5℃的储存温度下的hp-sec分析获得的结果示于表6中:
[0490]
表6:在注射器中18个月内不同储存温度下的以%为单位的hp-sec hmw含量结果。
[0491][0492]
在25℃下在18个月的储存时间内hmw物种增加2%-4%。对于f1,测量到 3.6%的最强增加;对于制剂4及5,测量到 1.6%及 2.0%的最低增加。在5℃下在18个月的储存时间内hmw物种增加1%-2%。对于f1,测量到 2.2%的最强增加;对于制剂4及5,测量到 0.8%及 1.0%的最低增加。
[0493]
up-sec分析
[0494]
up-sec分析结果类似于hp-sec分析结果且因此确认这些结果。
[0495]
表6a:在注射器中18个月内不同储存温度下的以%为单位的up-sec hmw含量结果。
[0496][0497]
在25℃下在18个月的储存时间内hmw增加2%-3.5%。对于f1,测量到 3.5%的最强增加;对于制剂4及5,测量到 1.8%及 2.2%的最低增加。在5℃下在18个月的储存时间内hmw增加0.7%-1.9%。对于f1,测量到 1.9%的最强增加;对于制剂4及5,测量到 0.7%及 0.8%的最低增加。
[0498]
结果与讨论
[0499]
鉴于hmw含量,全部所测试制剂皆总体上稳定,显示本发明的各种制剂在长达18个月的长储存时间内在5℃及25℃下稳定。
[0500]
1.3.3.浊度测量
[0501]
表7:在注射器中18个月内不同储存温度下的以fnu为单位的在860nm下的浊度结果。
[0502][0503]
[0504]
测量在860nm的波长下的浊度,显示在25℃下18个月的储存时间期间1至3福尔马肼浊度测定单位(fnu)的增加。制剂1具有3fnu的最强增加且制剂2具有1fnu的最小增加。含有l-精氨酸的制剂4自开始起具有最高浊度。
[0505]
测量在860nm的波长下的浊度,显示在5℃下18个月的储存时间期间0-1fnu的增加。
[0506]
结果与讨论
[0507]
浊度测量显示在18个月内于冰箱中的储存不导致相对浊度变化。含有l-精氨酸的制剂4具有最高浊度,使得不含精氨酸的制剂更有利。
[0508]
1.3.4.电导率测量
[0509]
测量制剂电导率。
[0510]
表8:在25℃下的储存温度下持续长达18个月的以ms/cm为单位的电导率测量结果。
[0511][0512]
结果与讨论
[0513]
在18个月的储存时间内及5℃及25℃的温度下全部5种制剂的电导率保持恒定。f1、f2、f3及f5的电导率值在1至2ms/cm之间,而含有l-精氨酸的制剂f4具有仅低于4ms/cm的相对高电导率。
[0514]
1.4.另外分析及结果
[0515]
另外,对所测试的五种制剂执行另外分析(储存时间及温度如上文所描述),其中结果如下。
[0516]
·
在18个月的储存时间内及在所测试的不同储存温度下ph值保持基本上恒定。因此,所测量ph值在5.7-6.3范围内。
[0517]
·
在18个月的储存时间内及在所测试的不同储存温度下渗透重量摩尔浓度保持基本上恒定。所测试值范围为296-333mosm/kg。
[0518]
·
在18个月的储存时间内及在所测试的不同储存温度下在20℃下的动态黏度保持基本上恒定。动态黏度在10-14mpas范围内。
[0519]
·
在18个月的储存时间内及在所测试的不同储存温度下蛋白质浓度保持基本上恒定。蛋白质浓度的小偏差归因于分析变化,导致范围为148-159mg/ml。
[0520]
·
在18个月的储存时间内及在所测试的不同储存温度下hp-sec片段含量保持基本上恒定。片段含量在0.2%-1.4%范围内。在18个月的储存时间内及在所测试的不同储存温度下up-sec lmw含量保持基本上恒定。详言之,在18个月内,对于25℃,测量到3%的低增加,且对于5℃,测量到0.1%-0.3%的低增加。lmw含量在1.0%-4.5%范围内。
[0521]
·
在5℃下在18个月的储存时间内弱阳离子交换(wcx)主峰、酸性峰群(apg)及碱性峰群(bpg)含量保持恒定。在制剂之间未观测到关于主峰、apg及bpg的差异。
[0522]
·
在25℃下在12个月的储存时间内或在5℃下在8个月的储存时间内疏水相互作用色谱(hic)主峰含量保持基本上恒定。在储存时间内及储存温度下后峰增加约2%-3%。前峰在25℃下在12个月内略微地增加5%-7%且在5℃下在8个月内不增加。在制剂之间未观测到关于主峰、后峰及前峰的差异。
[0523]
·
在18个月的储存时间内及在所测试的不同储存温度下特异性结合活性保持基本上恒定,其中对于25℃及5℃持续18个月,分别仅3%及1%-2%的最小降低。特异性结合活性在96%-101%范围内。
[0524]
·
未观测到可见粒子。
[0525]
1.5.结果概述
[0526]
在25℃及5℃下在18个月储存时间内全部5种制剂皆是稳定的。然而,制剂4包含额外助剂。制剂3是稳定的且不具有额外助剂,与含精氨酸的制剂f4形成对比。在约5.7的ph下观测到较少聚集物形成。
[0527]
2.在冷冻/解冻实验中比较具有不同ph值的乙酸盐与丁二酸盐缓冲系统
[0528]
分析150mg/ml制剂的冷冻及解冻是否对瑞沙珠单抗的产品质量具有影响。因此,将3种制剂填充在对于初始值而言体积为10ml或14ml的小型袋中,接着在-40℃下冷冻。此外,将一个袋储存于2℃-8℃下。两种条件(-40℃及2℃-8℃)的储存时间均为3周。
[0529]
通过受控冷冻方法执行冷冻。之后,将袋转移至-40℃冰箱中且保持冷冻达所指示储存时间。
[0530]
2.1.制备制剂
[0531]
各冷冻/解冻循环包含在冻干器中在-40℃下进行冷冻,且随后转移至-40℃冰箱中,且在冻干器中以20℃/min的最大解冻速率进行解冻直至3周之后的室温为止。所测试制剂示于表9中。
[0532]
表9:制剂的组成。
[0533][0534]
将起始物质储存于冰箱中2℃-8℃下直至使用为止。使用冻干器以0.5℃/min的受控冷冻速率冷冻样品体积为10ml的袋(“小型flexboy袋”)直至达到-40℃的温度为止。
[0535]
2.2.分析
[0536]
在分析之前使用冻干器以受控方式直接解冻样品。为测量蛋白质稳定性,执行hp-sec分析且测量结合活性。测量在860nm下及在400-600nm下的浊度。下文描述所用分析方法的另外细节。
[0537]
2.3.结果
[0538]
2.3.1.测量单体及hmw含量
[0539]
执行hp-sec及up-sec分析以测定制剂稳定性,显示单体及hmw含量。获得以下结果:
[0540]
表10:3周储存(在-40℃下及在2℃-8℃下冷冻)之后以%为单位的hp-sec单体含量及初始值结果。
[0541][0542][0543]
up-sec测量确认hp-sec测量结果。
[0544]
表10a:3周储存(在-40℃下及在2℃-8℃下冷冻)之后以%为单位的up-sec单体含量及初始值结果。
[0545][0546]
含量缺失达到100%的剩余抗体以hmw物种形式存在。
[0547]
结果与讨论
[0548]
总体而言,hp-sec分析结果展现全部制剂的稳定性,显示制剂允许冷冻/解冻循环。关于较高单体含量及较少hmw物种,一些制剂显示更优选结果。
[0549]
2.3.2.测量结合活性
[0550]
利用表面等离子共振(biacore)测量来测量针对rhil-23的结合活性。全部制剂中的结合活性总体上相同,证实制剂的可应用性。特别是,结合活性测量为在95%至110%之间的范围内且特异性结合活性为约100%。冷冻状态或在2℃-8℃下的3周储存不改变结合活性。
[0551]
2.3.3.测量黏度
[0552]
蛋白质制剂的另一重要参数为黏度,该黏度优选不过高以便允许注射制剂(例如,在不过度使用力的情况下穿过针)。因此,测量了动态黏度。
[0553]
f1、f2及f3的动态黏度极为类似,在8.7至10mpas范围内。
[0554]
2.4.另外分析及结果
[0555]
另外,对所测试的三种制剂执行另外分析,其中结果如下。
[0556]
·
在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,不可目视粒子含量(≥25μm、≥10μm、≥5μm)保持基本上恒定。全部三种制剂的经计数粒子总和基本上相同。
[0557]
·
在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,渗透重量摩尔浓度保持基本上恒定。150mg/ml制剂的所测试值范围为299-321mosm/kg。
[0558]
·
在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,在860nm及400-600nm下的浊度保持基本上恒定。所测试值范围为在860nm下的2-7fnu及在400-600nm下的4-13fnu。
[0559]
·
在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,ph值保持基本上恒定。因此,所测量ph值在5.7-6.2范围内。
[0560]
·
在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,电导率保持基本上恒定。因此,所测量电导率在1.3-2.5ms范围内。
[0561]
·
在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,蛋白质浓度保持基本上恒定。蛋白质浓度的小偏差归因于分析变化,导致针对150mg/ml的初始蛋白质含量的范围为149-157mg/ml。
[0562]
·
在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,疏水相互作用色谱(hic)主峰含量保持基本上恒定。hic主峰值范围为97.1%-97.7%。在3周内在5℃下或在-40℃下,
包括冷冻/解冻循环,后峰及前峰保持基本上恒定。
[0563]
·
在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,弱阳离子交换(wcx)色谱主峰含量保持基本上恒定。wcx主峰值范围为72.5%-73.8%。在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,酸性峰群(apg)及碱性峰群(bpg)保持基本上恒定。在制剂之间未观测到关于主峰、apg及bpg的差异。
[0564]
·
在3周内在5℃下或在-40℃下,包括冷冻/解冻循环,毛细管凝胶电泳(cge)分析显示基本上恒定的值。未经降低的主峰含量范围为96.7%-97.6%。
[0565]
2.5.结果概述
[0566]
本实施例的结果展现不同150mg/ml制剂中所提供的瑞沙珠单抗在冷冻/解冻循环内的稳定性。在-40℃下储存时间为3周或在2℃-8℃下储存时间为3周的单一冷冻/解冻循环对瑞沙珠单抗的产品质量不具有影响。因此,150mg/ml制剂为合适浓缩物。与其他ph值相比,ph 5.7的表现似乎略微地更优。
[0567]
3.比较具有不同ph值的乙酸盐与丁二酸盐缓冲系统
[0568]
特别地合适的ph在5.2至6.2,诸如5.5至6.2或约5.7范围内。通过sec所测量,较高ph可能会导致蛋白质聚集增多。较低ph可能会导致化学降解。在先前研究中,使用山梨醇以调节张力。在本实施例中,使用海藻糖及甘露醇代替山梨醇以调节张力。选择七种不含山梨醇的制剂且在以下三种条件下对其进行测试:(i)5℃达18个月,不监测r.h.;(ii)25℃/60%r.h.达18个月;及(iii)40℃/75%r.h.达6个月。
[0569]
制剂1-7的组成描绘于下表11中。
[0570]
表11:所分析制剂的组成。
[0571][0572]
制剂及制剂缓冲剂经无菌过滤(过滤器类型0.22μm)且在层流下以1.04ml填充体
积填充在注射器(neopak)中。通过混合起始物质与包含辅助剂(赋形剂、缓冲剂等)的浓缩物溶液来制备制剂。将经填充注射器水平地储存在2℃-8℃下的使用纸板盒避光的rondo托盘中。使用以下装填材料:
[0573]
neopak注射器(具有27号规1/2英寸针的1ml注射器)
[0574]
橡胶塞
[0575]
rondo托盘
[0576]
3.1.分析
[0577]
为分析样品,执行hp-sec及up-sec且测量浊度(亦称为乳白光)。使用以下设备以进行分析:
[0578]-uplc、upsec:uplc 29/31 waters acquity,waters,ma
[0579]-hplc、wcx/sec:hplc 82/83/107waters alliace,waters,ma
[0580]-根据mfi的粒子计数/尺寸:微流成像(micro flow imagine),5200 bot a/b(roboter),protein simple,ger
[0581]-渗透压计:osmomat 3000 gonotec gmbh,ger
[0582]-ph计:sevengo,mettler toledo,ger
[0583]-浊度亮度计:2100an浊度计,hach-lange gmbh,ger
[0584]-根据solo vpe的蛋白质浓度:solo vpe,c.technologies,inc.,nj
[0585]-biacore:biacore t200,ge healthcare life science,uk
[0586]-拉伸及压缩测试机器:zwick 2.5ts/n 21159574 zwick,germany
[0587]
下文描述所用分析方法的另外细节。
[0588]
3.2.结果
[0589]
3.2.1.测量单体含量
[0590]
使用up-sec及hp-sec以测定单体含量损失。单体含量是应力诱导的储存期间蛋白质稳定性及质量的关键质量属性。下表显示up-sec测量结果。
[0591]
表12:通过up-sec测量的储存于5℃、25℃及40℃下的七种制剂的单体含量[%]。
[0592][0593]
hp-sec确认up-sec结果。与up-sec相比,hp-sec不生成额外信息。
[0594]
结果与讨论
[0595]
全部所分析制剂在所测试条件下皆是稳定的。
[0596]
3.2.2.测量hmw含量
[0597]
使用up-sec及hp-sec以测定hmw形成水平。下表显示up-sec测量结果。hmw含量与单体含量相关。单体损失导致hmw增加。
[0598]
表13:通过up-sec测量的储存于5℃、25℃及40℃下的七种制剂的hmw[%]。
[0599][0600]
hp-sec确认up-sec结果。与up-sec相比,hp-sec未生成额外信息。
[0601]
结果与讨论
[0602]
总体而言,具有低hmw物种量的全部制剂即使在40℃下储存之后亦是稳定的。
[0603]
3.2.3.测量lmw含量
[0604]
使用up-sec以测定lmw形成水平。下表显示up-sec测量结果。
[0605]
表14:通过up-sec测量的储存于5℃、25℃及40℃下的七种制剂的lmw含量[%]。
[0606][0607]
结果与讨论
[0608]
总体而言,具有低量lmw物种的全部制剂即使在40℃下储存之后亦是稳定的。
[0609]
3.2.4.测量lmw含量
[0610]
为评估制剂稳定性,亦通过hp-sec分析测量lmw含量。此分析结果显示如下。
[0611]
表15:通过hp-sec测量的储存于5℃、25℃及40℃下的七种制剂的lmw含量[%]。
[0612][0613]
结果与讨论
[0614]
lmw含量随时间推移仅略微地增加,但全部所测试制剂一般引起低水平片段化。
[0615]
3.2.5.浊度测量
[0616]
乳白光结果概述如下。在不同条件下在储存时间内未观测到乳白光变化。含有l-精氨酸hcl的制剂(f3及f5)显示最高乳白光。然而,在针对f3及f5的研究过程中无渐增乳白光。在所测试制剂中的每一者中均未观测到可见粒子。
[0617]
表16:储存于5℃、25℃及40℃下的七种制剂的乳白光[fnu]。
[0618][0619]
结果与讨论
[0620]
含有l-精氨酸hcl的制剂显示乳白光增加。
[0621]
3.3.另外分析及结果
[0622]
另外,对所测试的七种制剂执行另外分析(储存时间及温度如上文所描述),其中结果如下。
[0623]
·
在18个月的储存时间内及在所测试的不同储存温度下蛋白质浓度保持基本上恒定。
[0624]
·
在18个月的储存时间内及在所测试的不同储存温度下ph值保持基本上恒定。
[0625]
·
在18个月的储存时间内及在所测试的不同储存温度下渗透重量摩尔浓度保持基本上恒定。所测试值范围为298-326mosm/kg。
[0626]
·
未观测到可见粒子。
[0627]
·
在5℃下达所测试储存时间的制剂的iec/wcx测量显示以下的恒定含量:主峰(69.7-72.2%)、apg(18-20%)及bpg(8-13%)。在25℃及40℃下在类似范围内全部制剂的主峰减少且apg含量增加。在25℃及40℃下ph为6.0的制剂的bpg含量轻微地低于(至多2%)ph为5.7的制剂。
[0628]
·
在18个月的储存时间内及在所测试的不同储存温度下通过mfi测量的粒子含量保持基本上恒定。特别是,对于≥10μm及≥25μm的粒子,在储存时间内在5℃及25℃/60%r.h.下,对于全部制剂,皆不可观测到相关渐增粒子计数。对于≥2μm的粒子,在25℃下的粒
子计数增加。对于全部制剂,增加皆在类似范围内。
[0629]
·
在18个月的储存时间内及在所测试的不同储存温度下特异性结合活性保持基本上恒定。特异性结合活性在95%-100%范围内。
[0630]
·
在18个月的储存时间内及5℃下松动力及滑移力保持基本上恒定。在储存时间内在25℃下全部制剂的最大滑移力、平均滑移力及松动力皆增加。在制剂之间未观测到差异。最大滑移力范围为7.1-23.6n,平均滑移力范围为6.7-20.5n,且松动力范围为3.4-7.1n。
[0631]
·
在18个月的储存时间内及在所测试的不同储存温度下所测量的在20℃下的动态黏度保持基本上恒定。动态黏度在8.3-10.7mpas范围内。
[0632]
3.4.结果概述
[0633]
本实施例描述七种不同150mg/ml瑞沙珠单抗制剂的储存稳定性。使用海藻糖及甘露醇代替山梨醇以调节张力。18个月之后再分析f2。
[0634]
up-sec显示,在所测试制剂中,与ph 5.7相比,ph 6.0引起略微较高的瑞沙珠单抗降解,呈现出较低含量单体及较高hmw形式。含有l-精氨酸hcl的制剂显示,通过up-sec所测量,降解略微地较低,但乳白光增加且lmw含量略微地增加。iec显示制剂之间无相关差异且因此不是决定性因素。ph、蛋白质浓度、渗透重量摩尔浓度、黏度、松动力及滑移力、不可目视粒子及可见粒子同样如此。根据此资料,在制剂之间未看见差异。
[0635]
4.比较在长期储存内具有不同ph值的乙酸盐与丁二酸盐缓冲系统
[0636]
本实施例分析七种不同150mg/ml瑞沙珠单抗制剂在neopak注射器中的储存稳定性以分析制剂的储存稳定性且识别有利制剂。与前一实施例的七种制剂相比,张力经略微地改良。再次测试三种条件(如上文所识别)。所分析制剂概述于表17中。
[0637]
表17:所分析制剂的组成。
[0638][0639]
通过混合起始物质与经浓缩的加料溶液(包含辅助剂,亦即赋形剂及缓冲剂)来制备制剂。
[0640]
4.1.分析
[0641]
为分析样品,尤其执行up-sec且测量乳白光。下文描述所用分析方法的另外细节。
[0642]
4.2.结果
[0643]
4.2.1.测量hmw含量
[0644]
表18:在5℃、25℃及40℃下长期储存的up-sec分析的以%为单位的所测量hmw含量。
[0645][0646]
结果与讨论
[0647]
全部所测试制剂中的hmw含量保持总体上低,指示所用高浓度制剂可使瑞沙珠单抗稳定。up-sec结果进一步显示,与ph 5.7相比,ph 6.0引起较高的瑞沙珠单抗降解,呈现出较低含量单体及较高含量hmw形式。因此,ph 5.7对本发明制剂是特别地有利的。尽管如此,鉴于up-sec分析结果,诸如f4、f5及f6的具有6.0的较高ph值的制剂亦显示总体上良好的效能。
[0648]
4.2.2.测量lmw含量
[0649]
表19:在5℃、25℃及40℃下长期储存的up-sec分析的以%为单位的所测量lmw含量。
[0650][0651]
结果与讨论
[0652]
在针对全部所测试温度的测量时间内所测试制剂是稳定的。因此,使用所测试制剂有效地使高蛋白质浓度的150mg/ml瑞沙珠单抗稳定。在较高储存温度下,观测到含有l-精氨酸hcl的制剂的lmw含量略微地增加。此种情况为出乎意料的发现,这是因为通常已知含有l-精氨酸的制剂进一步使制剂稳定。因此,就此而言,150mg/ml瑞沙珠单抗制剂不同于其他蛋白质制剂。因此,本发明的不具有精氨酸的制剂是优选的。
[0653]
4.2.3.测量乳白光
[0654]
表20:在5℃、25℃及40℃下长期储存的以fnu为单位的所测量乳白光。
[0655][0656]
结果与讨论
[0657]
总体而言,观测到乳白光随时间推移不增加或仅略微地增加,指示全部所测试制剂的稳定性。对于含有l-精氨酸hcl的制剂(f3及f5),观测到较高乳白光。
[0658]
4.3.结果概述
[0659]
所测量参数显示,全部制剂皆适用于以稳定方式制备150mg/ml高浓度瑞沙珠单抗。长期稳定性揭露制剂之间的一些差异:
[0660]-up-sec显示,与ph 5.7相比,ph 6.0引起较高的呈较低含量单体及较高hmw形式的瑞沙珠单抗降解。
[0661]-含有l-精氨酸hcl的制剂显示,通过up-sec所测量,降解较低,但乳白光增加且lmw略微地增加。
[0662]
18个月之后额外分析了f2。
[0663]
值得注意的是,制剂f1及f7亦是稳定的。不含缓冲剂的制剂及包含超过一种类型的张力剂的制剂亦是稳定的且因此适合于提供包含150mg/ml瑞沙珠单抗的制剂。
[0664]
总而言之,就指示优良稳定性的所测量lmw及hmw含量以及乳白光而言,发现制剂f2特别地稳定。此结果极为出乎意料,这是因为通常已知瑞沙珠单抗为以较高ph值使用。因此,特别地高浓度的瑞沙珠单抗使最佳ph值位移至约5.7,此种情况是出人意料的。此外,出乎意料地,l-精氨酸hcl不引起进一步稳定,而是实际上降低较高乳白光及所测量lmw含量所支持的制剂稳定性。因此,呈例如150mg/ml的高浓度的瑞沙珠单抗的特定特性使与先前
已知的瑞沙珠单抗制剂不同的最佳条件成为必需。
[0665]
5.比较摇动时具有不同ph值的乙酸盐与丁二酸盐缓冲系统
[0666]
本实施例的目标在于评估摇动应力对不同150mg/ml瑞沙珠单抗制剂的产品质量的影响。就不同制剂使瑞沙珠单抗抵抗摇动应力而稳定的能力而言对其进行测试。因此,使呈150mg/ml抗体浓度的制剂暴露于不同摇动应力。
[0667]
在全部十一种ph不同的制剂中,将缓冲剂及张力剂填充至6r小瓶及具有27号规1/2英寸针的1ml neopak注射器中且在室温下摇动21天。摇动、储存且亦分析不具有蛋白质的对应缓冲溶液。摇动条件:
[0668]-摇动温度:室温(约25℃)
[0669]-摇动时间:21天
[0670]-摇动类型:水平摇动器(小瓶)、摇荡式摇动器(注射器);避光进行摇动
[0671]
为排除作为额外应力的温度对产品质量的影响,在不摇动的情况下将另外小瓶及注射器储存于室温下。
[0672]
5.1.制备制剂
[0673]
制备11种瑞沙珠单抗测试制剂(参见表21)且使其经受:
[0674]
a)在水平摇动器中以300u/min摇动小瓶1、5、7、14、21天(避光);
[0675]
b)在摇荡式摇动器中摇动注射器1、5、7、14、21天,运动调节至各别黏度以确保气泡运动(避光);及
[0676]
c)室温(25℃)达1、5、7、14、21天(避光)。
[0677]
表21:经选择用于摇动研究的制剂。
[0678][0679]
将制剂作为封装材料添加至小瓶(schott)或neopak注射器中。将经无菌过滤的蛋白质溶液在层流下填充至经灭菌初级封装材料中。小瓶的填充体积定义为3.6ml。注射器各自填充有1.04ml。检查全部小瓶及注射器的可视粒子且记录结果。
[0680]
5.2.分析
[0681]
在取样之后直接执行各分析时间点的分析,惟如sec的色谱分析除外,将样品储存于-70℃下直至测量为止以进行分析。使用以下设备以进行分析:
[0682]-uv-vis分光亮度计solo vpe:在280nm下的浓缩,在320nm下的基线校正,消光系数:1.52;c technologies,inc.,nj,usa
[0683]-乳白光计:hach lange乳白光计;过滤器:400-600nm;hach lange gmbh,d
ü
sseldorf,germany
[0684]-超效粒径排阻色谱法(up-sec):uplc26,在280nm下的h级uv检测waters,milford,ma
[0685]-根据弱阳离子交换色谱法(wcx)的电荷不均一性:hplc75;荧光检测消光:278nm,发射:350nm;waters,milford,ma
[0686]-il-23结合活性:biacore t200芯片:cm5 ge healthcare,chalfont st giles,uk
[0687]-ph计:sevengo-mettler toledo,columbus,oh
[0688]-粒径分析仪:micro flow imaging
tm
流式显微镜;利用微流成像(mfi);
brightwell technologies inc,ottawa,on,canada
[0689]-渗透压计:利用冰点降低的osmomat 030,gonotec gmbh,berlin,germany
[0690]
下文描述所用分析方法的另外细节。
[0691]
5.3.结果
[0692]
5.3.1.测量单体含量
[0693]
单体含量是应力诱导的储存期间蛋白质稳定性及质量的关键质量属性。使用hp-sec及up-sec以测量制剂的单体含量。
[0694]
up-sec分析
[0695]
表22:注射器及小瓶的以%为单位的up-sec-单体:初始值及摇动1/5/7/14/21天之后的值以及在25℃下无运动21天之后的值。*对应于无运动,而摇动其他样品达所指示时间量。
[0696][0697][0698]
hp-sec分析
[0699]
hp-sec分析趋势类似于up-sec分析趋势且因此确认这些结果。获得在97.4%-98.8%范围内的单体值。
[0700]
结果与讨论
[0701]
总体而言,注射器及小瓶中的测量显示类似趋势,且证明全部制剂皆是稳定的,其中单体含量仅略微地降低。
[0702]
5.3.2.测量hmw含量
[0703]
使用hp-sec及up-sec以测量制剂的单体含量。使用hp-sec以测定在摇动注射器及
小瓶期间的聚集物(hmw)形成水平。
[0704]
up-sec分析
[0705]
up-sec分析结果显示如下。数据显示与hp-sec分析类似的结果,亦即聚集物形成主要由ph驱动。当比较初始值时,显而易见地,ph为6.0或6.2的制剂显示相较于ph为5.7的所调配溶液而言0.2%至0.5%的略微地增加的hmw含量。此趋势亦可在21天摇动之后看见,其中ph≥6.0的制剂中的hmw含量为约1.6%且ph为5.7的制剂中的hmw含量为1.3%。
[0706]
如f3及f7的含有l-精氨酸的制剂在摇动21天之后显示最低聚集水平。在up-sec及hp-sec中所观测的此研究中所测试的十一种制剂的单体含量中的差异是非显著的。单体含量损失在所测试的全部制剂的可接受范围内。一般而言,可概述以下:与无运动21天之后的结果相比,摇动不显著地增加hmw含量。
[0707]
使用up-sec获得的数据概述于表23中。
[0708]
表23:注射器及小瓶的以%为单位的up-sec hmw含量:初始值及摇动1/5/7/14/21天之后的值以及在25℃下无运动21天之后的值。*对应于无运动,而摇动其他样品达所指示时间量。
[0709][0710]
hp-sec分析
[0711]
hp-sec分析数据趋势类似于up-sec分析数据趋势且因此确认这些结果。
[0712]
结果与讨论
[0713]
总体而言,证明全部所测试制剂皆是稳定的。小瓶及注射器获得了类似结果。
[0714]
5.3.3.测量乳白光及另外参数
[0715]
在水平摇动器上摇动注射器以及在摇荡式摇动器上摇动小瓶21天之后全部所测试制剂的乳白光、渗透重量摩尔浓度、ph值及蛋白质浓度保持基本上不变(参见后续数据)。在不具有如乙酸盐或丁二酸盐的任何额外缓冲剂的不含缓冲剂的制剂f11中观测到最低乳白光水平。关于目视检查,无法给出意见。通过比较小瓶与注射器的所生成数据,不可观测到显著差异。
[0716]
1天之后的f6及5天之后的f10的经增加乳白光水平可不由以下取样时间点结果确认。因此,发生测量错误且这些结果不具有关于结果解释的相关性是有可能的。
[0717]
表24:注射器及小瓶中的制剂摇动:乳白光、渗透重量摩尔浓度、ph值及蛋白质浓度的初始值、摇动1/5/7/14/21天之后的值及无运动21天之后的值(在室温下摇动)。*对应于无运动,而摇动其他样品达所指示时间量。
[0718]
[0719]
[0720]
[0721][0722]
结合活性
[0723]
spr(biacore)测量结果显示,摇动不影响摇荡式摇动器上的注射器以及水平摇动器上的小瓶的分子结合活性。总体而言,结合活性保持高,在91%-111%范围内,且特异性结合活性保持在98%-107%范围内。
[0724]
结果与讨论
[0725]
乳白光取决于制剂组成且在不含赋形剂的制剂或不含缓冲剂的制剂中分别在5fnu至14fnu范围内,但不随时间推移而显著地增加。
[0726]
在整个研究期内全部制剂的ph值、渗透重量摩尔浓度、乳白光及蛋白质浓度以及针对il-23的结合活性保持不变。
[0727]
5.4.另外分析及结果
[0728]
另外,对所测试的十一种制剂执行另外分析,其中结果如下。摇动类型及时间、储存及所用注射器及小瓶如上文所描述。
[0729]
·
在小瓶及注射器中在摇动时间内hp-sec片段含量保持基本上恒定。片段含量在0.3%-0.5%范围内。在小瓶及注射器中在摇动时间内up-sec lmw含量保持基本上恒定。片段含量在1.3%-1.4%范围内。
[0730]
·
弱阳离子交换色谱法(wcx)显示,在研究期间所测试的全部制剂的主峰、apg及bpg的分布百分比保持在恒定水平。在摇动时间内主峰、apg及bpg的含量不显著地改变。在制剂之间未观测到差异。
[0731]
·
在21天摇动时间内通过微流成像(mfi)测量的粒子含量保持基本上恒定。
[0732]
5.5.概述
[0733]
总之,在暴露于摇动应力之后的制剂之间仅检测到指示稳定性的参数中的微小差异。举例而言,制剂f3及f7显示最高单体含量(hp-sec及up-sec),但其亦显示最高乳白光水平。可概述以下:在此研究中测试的制剂是可行的制剂。
[0734]
6.比较在多个冷冻/解冻循环中具有不同ph值的乙酸盐与丁二酸盐缓冲系统
[0735]
评估不同150mg/ml瑞沙珠单抗制剂的冷冻及解冻行为及其对产品质量的影响。因此,使制剂以150mg/ml的希望目标浓度及12ml的填充体积在小型袋中暴露于冷冻及解冻应力以仿真小规模或大规模的袋冷冻条件。
[0736]
在全部十一种ph不同的制剂中,将缓冲策略剂及张力剂加中间物储存块体以12ml的填充体积填充至小型袋中,接着进行受控冷冻步骤达到-40℃。另外,将袋储存于5℃下。应注意,十一种制剂对应于在前一实施例中测试的制剂。
[0737]
表25:实验排程概述
[0738][0739][0740]
浅灰色阴影:冷冻;较暗灰色阴影:解冻
[0741]
使用由经典冷冻-干燥器提供的冷冻-解冻装置执行冷冻步骤。此处,以0.5℃/min的冷冻斜坡冷冻控制样品体积为12ml的小型袋达到-40℃。此时,温度在十六个小时内保持恒定以确保样品体积的完全冷冻。根据冷冻步骤以0.5℃/min的加热速率执行解冻步骤。在室温下的保持时间设定成四个小时。
[0742]
完整冷冻/解冻循环(1
×
f/t)定义如下:
[0743]
1.自室温冷冻至-40℃(0.5℃/min)
[0744]
2.在-40℃下的保持时间为16个小时
[0745]
3.自-40℃解冻至室温(0.5℃/min)
[0746]
4.在室温下的保持时间为4个小时
[0747]
此程序进行1
×
f/t、3
×
f/t及6
×
f/t。在完成最终过程循环之后,将袋转移至-40℃下的冰箱中且储存直至同时解冻且分析样品为止。
[0748]
6.1.制备制剂
[0749]
如前一实施例中所描述来制备制剂(参见表21)。制备含有0.02%ps20、ph为5.7的不含赋形剂的另一制剂f12。将12ml经无菌过滤的蛋白质溶液在层流下填充至经灭菌初级封装材料中,所述经灭菌初级封装材料为体积为15ml的小型flexboy袋。检查全部袋的可视粒子且记录结果。
[0750]
在各冷冻-解冻运作中,将十二个袋置于冷冻-干燥器内的各盘上。冷冻/解冻总计36个袋,各运作包括三个袋/种制剂。在所界定的流程中分布袋以消除冷冻-干燥器内的袋位置的影响。
[0751]
6.2.分析
[0752]
在根据上文实验规划进行全部循环之后,在额外解冻步骤中连续解冻袋。此程序具有可一起分析样品的优点。将袋转移至-40℃下的预冷却的冷冻-干燥器中,接着进行解冻步骤。执行hp-sec、up-sec、渗透重量摩尔浓度、ph、蛋白质浓度、乳白光、结合活性及不可目视粒子测量。使用以下设备以进行分析:
[0753]-uv-vis分光亮度计solo vpe:在280nm下的浓缩,在320nm下的基线校正,消光系数:1.52;c technologies,inc.,nj,usa
[0754]-乳白光:hach lange乳白光计;过滤器:400-600nm;hach lange gmbh,d
ü
sseldorf,germany
[0755]-超效粒径排阻色谱法(up-sec):uplc26,在280nm下的h级uv检测waters,milford,ma
[0756]-根据弱阳离子交换色谱法(wcx)的电荷不均一性:hplc75;荧光检测消光:278nm,发射:350nm;waters,milford,ma
[0757]-il-23结合活性:biacore t200芯片:cm5 ge healthcare,chalfont st giles,uk
[0758]-ph计:sevengo-mettler toledo,columbus,oh
[0759]-粒径分析仪:micro flow imaging
tm
流式显微镜;利用微流成像(mfi);brightwell technologies inc,ottawa,on,canada
[0760]-渗透压计:利用冰点降低的osmomat 030,gonotec gmbh,berlin,germany
[0761]
下文描述所用分析方法的另外细节。
[0762]
6.3.结果
[0763]
6.3.1.测量单体及hmw含量
[0764]
单体含量是应力诱导的储存期间蛋白质稳定性及质量的关键质量属性。使用hp-sec及up-sec以测定在冷冻/解冻小型袋期间的聚集物形成水平。后续表概述hp-sec及up-sec分析结果。
[0765]
表26:hp-sec/up-sec:以%为单位的初始值及1/3/6个f/t循环之后的值以及在5℃下三周之后的值。
[0766]
[0767]
[0768]
[0769][0770]
结果与讨论
[0771]
数据显示,聚集物形成主要由ph驱动。通过比较六个f/t循环之后的结果,显而易见地,ph为6.0或6.2的制剂相较于ph为5.7的所调配溶液而言显示0.2%-0.6%的略微地增加的hmw含量。如f3及f7的含有l-精氨酸的制剂在六个f/t循环之后显示最低聚集水平。一般而言,可概述以下:与5℃下21天之后的结果相比,冷冻/解冻应力不显著地增加hmw含量。
[0772]
6.3.2.测量乳白光及另外参数
[0773]
在6个f/t循环之后及在5℃下储存三周之后全部所测试制剂的乳白光、渗透重量摩尔浓度、ph值及蛋白质浓度保持不变。在不含缓冲剂的制剂(f11及f12)中观测到最低乳白光水平。
[0774]
表27:以fnu为单位的乳白光、以mosm/kg为单位的渗透重量摩尔浓度、ph值及以g/l为单位的蛋白质浓度的初始值及1/3/6个f/t循环之后的值。
[0775]
[0776]
[0777]
[0778][0779]
结合活性
[0780]
il23结合活性的spr(biacore)测量结果显示,冷冻/解冻循环不影响分子结合活性。结合活性范围在96%-117%之间。
[0781]
结果与讨论
[0782]
所测量乳白光取决于制剂。与应力条件(f/t及在5℃下的保持时间)无关,在整个研究期内全部制剂的ph值、渗透重量摩尔浓度、乳白光及蛋白质浓度以及il-23结合基本上保持不变且因此是稳定的。
[0783]
6.3.3.测量粒子
[0784]
后续表概述各stp的粒子数目。对于所测试的全部制剂,不可观测到清晰趋势。与所测试的其他制剂相比,制剂f3、f7及f9显示略微地增加量的svp。此观测结果主要针对≥2μm及≥10μm的svp看见。
[0785]
表28:不可目视粒子-mfi:初始值及一个、三个及六个f/t循环之后的值以及在5℃下三周之后的值。
[0786][0787]
结果与讨论
[0788]
虽然观测到≥2μm粒子的类似趋势,但与其他制剂相比,观测到f3、f7及f9的尺寸
≥10μm的粒子的略微增加。对于≥25μm粒子,观测到6
×
f/t之后的f3的略微增加。总体而言,在f/t期间全部所测试制剂的粒子形成不是主要问题。
[0789]
6.4.另外分析及结果
[0790]
另外,对所测试的十二种制剂执行另外分析(冷冻/解冻循环如上文所描述),其结果如下。
[0791]
·
弱阳离子交换色谱法(wcx)显示,在研究期间所测试的全部制剂的主峰、apg及bpg的分布百分比保持在恒定水平。在6个冷冻/解冻循环内主峰、apg及bpg的含量不显著改变。主峰范围为65%-67%,apg含量范围为21%-23%,bpg含量范围为约11%-14%。在制剂之间未观测到差异。
[0792]
6.5.结果概述
[0793]
结果可概述如下:
[0794]-目视检查:在六个f/t循环之后,在目视检查期间不可对全部制剂作出观测。
[0795]-svp:关于不可目视粒子含量,无重大问题可观测到。与其他制剂相比,f3、f7及f9略微地增加,但显著低于药典规格。
[0796]-hp-sec及up-sec:对于如hp-sec及up-sec的聚焦于蛋白质完整性的测试方法,证明f3为最稳定制剂且f4为最不稳定制剂。不具有任何缓冲剂或赋形剂的f12在冷冻/解冻循环期间展现可接受稳定性。
[0797]-iec:对于iec结果,无任何制剂的区别可观测到。f/t循环不负面地影响apg及bpg的贡献。
[0798]-乳白光:乳白光视制剂而定且范围由不含赋形剂或不含缓冲剂的制剂的4fnu至13fnu。
[0799]-不论应力条件(f/t及在5℃的保持时间),在整个研究期间全部制剂的ph值、渗透重量摩尔浓度、乳白光及蛋白质浓度以及结合保持不变。
[0800]
可概述以下:对于150mg/ml制剂而言,在此实施例中测试的大部分制剂为可行制剂。仅观测到冷冻/解冻应力对蛋白质稳定性的微小影响。由于含有山梨醇的制剂的医疗问题,可能会发现这些制剂对亦处理果糖不耐受患者不太有利。尽管如此,对于其他患者,可能会发现含山梨醇的溶液是有用的。总之在暴露于f/t之后的制剂之间仅可检测到指示稳定性参数中的微小差异。举例而言,制剂f3在单体含量方面为最稳定(hp-sec),但相反地可检测到增加量的不可目视粒子。
[0801]
7.ph对制剂稳定性的影响
[0802]
以表29中所示的制剂测试ph值对150mg/ml瑞沙珠单抗制剂的稳定性的影响。
[0803]
表29:制剂的组成。
[0804][0805]
7.1.制备制剂
[0806]
如上文所描述来制备制剂。
[0807]
7.2.分析
[0808]
在1、3、6、9、12、18、24及36个月储存时以及最初在储存之前执行样品测量。使用各种分析方法,包括hic、up-sec、iec以及黏度、松动力及滑移力以及结合特异性测量。下文描述所用分析方法的另外细节。
[0809]
7.3.结果
[0810]
7.3.1.测量单体含量
[0811]
如同先前实施例中一般使用up-sec分析测量单体含量,结果示于表30中。
[0812]
表30:具有不同ph值的制剂的以%为单位的up-sec-单体测量结果。
[0813]
[0814][0815]
结果与讨论
[0816]
单体含量测量显示,所测试ph值范围为ph 5.0至6.2的所测试制剂是稳定的。因此,宽范围的ph值是可应用的以便获得高稳定性150mg/ml瑞沙珠单抗制剂。对于约5.7的ph值,获得高单体值,而对于约ph 5.0的更酸性条件,测量到相对低单体含量(参见例如在25℃或40℃下的最后一个ph 5.0测量点)。因此,证明ph为约5.7的高浓度瑞沙珠单抗(此处为150mg/ml)制剂是特别地有利的,尤其在所提供的本实施例的制剂中如此。
[0817]
7.3.2.测量hmw含量
[0818]
亦使用up-sec测定制剂的hmw含量,由此获得以下结果:
[0819]
表31:具有不同ph值的制剂的以%为单位的up-sec-hmw测量结果。
[0820]
[0821][0822]
结果与讨论
[0823]
hmw含量与单体测量结果相关。总体而言,在一定范围的ph值内的所测试制剂是稳定的。对于约5.7的ph值,获得特别地低的hmw含量增加。然而,较高ph值(例如,ph 6.2)似乎已引起略微地较高的hmw值。
[0824]
7.3.3.测量lmw含量
[0825]
通过up-sec分析测量lmw含量,该分析揭露以下结果:
[0826]
表32:具有不同ph值的制剂的以%为单位的up-sec-lmw测量结果。
[0827][0828][0829]
结果与讨论
[0830]
lmw含量与单体测量结果相关。对于约5.7的ph值,获得特别地低的lmw含量增加。然而,较低ph值似乎已引起略微地较高的lmw值。总体而言,在一定范围的ph值内的所测试制剂是稳定的。
[0831]
7.3.4.通过离子交换色谱法(iec)测量物种
[0832]
通过离子交换色谱法来执行离子物种测量。随后,将结果分类至主峰、酸性峰群(apg)及碱性峰群(bpg)中。
[0833]
表33:具有不同ph值的制剂的以%为单位的iec主峰测量结果。
[0834][0835]
表34:具有不同ph值的制剂的以%为单位的iec apg测量结果。
[0836]
[0837][0838]
表35:具有不同ph值的制剂的以%为单位的iec bpg测量结果。
[0839][0840][0841]
结果与讨论
[0842]
iec测量总体上显示,所测试制剂是稳定的。全部ph值皆引起高含量主峰。值得注意的是,与分别显示apg或bpg物种增加的最高及最低所测试ph值相比,5.7的中间ph值及约5.7的ph值显示良好折衷。因此,证明约5.7的ph是有利的。
[0843]
7.3.5.通过疏水相互作用色谱法(hic)测量物种
[0844]
通过疏水相互作用色谱法(hic)执行瑞沙珠单抗的变异体/亚种测量。随后,将结果分类至主峰、前峰及后峰中。
[0845]
表36:具有不同ph值的制剂的以%为单位的hic主峰测量结果。
[0846][0847]
表37:具有不同ph值的制剂的以%为单位的hic前峰测量结果。
[0848][0849][0850]
表38:具有不同ph值的制剂的以%为单位的hic后峰测量结果。
[0851]
[0852]
结果与讨论
[0853]
hic测量总体上显示,所测试制剂是稳定的。全部ph值皆引起高含量主峰。值得注意的是,与分别显示前峰及后峰增加的最高及最低所测试ph值相比,5.7的中间ph值及约5.7的ph值显示良好折衷。
[0854]
7.3.6.结合活性
[0855]
使用biacore t200执行瑞沙珠单抗针对il-23的结合活性测量。获得以下结果:
[0856]
表39:具有不同ph值的制剂的以%为单位的结合活性。
[0857][0858]
表40:具有不同ph值的制剂的以%为单位的特异性结合活性。
[0859][0860]
结果与讨论
[0861]
结合活性测量显示所测试制剂的总体上高的值。因此,所测试制剂使瑞沙珠单抗稳定以使得达成在范围为5.0至6.2的ph下的高结合活性。
[0862]
7.3.7.测量乳白光
[0863]
此外,测量制剂的乳白光。乳白光在分析时间内略微地改变,但保持总体上高度恒定在3至11的范围内。结果指示制剂总体上稳定。值得注意的是,较低ph值一般显示低于较高ph值的乳白光(对于ph 6.2,7至11fnu)的乳白光(对于ph 5.0,3至6fnu)。5.7的中间ph具有在范围5至7fnu内的乳白光,指示提供ph为约5.7的制剂是有利的,尤其在根据本实施例的制剂中如此。
[0864]
7.3.8.测量黏度以及注射器滑移力及松动力
[0865]
测量作为另外参数的黏度及注射器力,所述注射器力包括平均及最大滑移力以及松动力。获得以下结果:
[0866]
表41:随时间推移具有不同ph值的所测试制剂的以mpas为单位的黏度测量结果。
[0867][0868]
表42:随时间推移具有不同ph值的所测试制剂的以n为单位的最大滑移力测量结果。
[0869][0870]
表43:随时间推移具有不同ph值的所测试制剂的以n为单位的平均滑移力测量结果。
[0871]
[0872][0873]
表44:随时间推移具有不同ph值的所测试制剂的以n为单位的松动力测量结果。
[0874][0875]
结果与讨论
[0876]
对于较高ph值,黏度测量揭露略微地较高的黏度。因此,可发现诸如ph5.7的较低ph值是有利的以便获得具有较低黏度的制剂。应注意,滑移力及松动力的机械测量揭露总体上极类似的效能。
[0877]
7.4.另外分析及结果
[0878]
另外,对所测试的六种制剂执行另外分析,其中结果如下。储存时间及温度为如上文所描述。
[0879]
·
在36、24、12及3个月的储存时间内在分别为5℃、25℃及40℃的所测试的不同储存温度下蛋白质浓度保持基本上恒定。蛋白质浓度(145-155mg/ml(24个月)及145-158mg/ml(36个月))的小偏差为归因于分析变化。
[0880]
·
在36、24、12及3个月的储存时间内在分别为5℃、25℃及40℃的所测试的不同储存温度下ph值保持基本上恒定。因此,所测量ph值在4.9-6.3范围内。
[0881]
·
在36、24、12及3个月的储存时间内在分别为5℃、25℃及40℃的所测试的不同储存温度下渗透重量摩尔浓度保持基本上恒定。所测试值范围为301-323mosm/kg。
[0882]
·
在储存时间内在所测试的不同储存温度下蛋白质相关粒子及外来粒子保持基本上恒定地低。
[0883]
7.5.结果概述
[0884]
在长达24及36个月的长储存时间内在全部所测试ph值下的制剂是稳定的。虽然温度似乎对稳定性具有影响(亦即,较高温度诱导更多不稳定性相关效应),但全部制剂即使在高温下亦引起足够稳定性。
[0885]
总而言之,5.7的ph值及约5.7(例如,5.5、5.9)的ph值似乎在所用测试条件下引起关于储存参数的有利折衷。举例而言,up-sec测量显示对于ph 5.7的中间至低hmw及lmw值,而最高及最低ph各自分别显示最高hmw及lmw含量。在iec及hic测量中获得类似结果。
[0886]
8.乙酸盐浓度对制剂稳定性的影响
[0887]
在不同时间点内在三个不同温度(5℃、25℃及40℃)下储存含有不同浓度的乙酸盐的制剂(参见表45)。
[0888]
表45:制剂的组成。
[0889][0890]
8.1.制备制剂
[0891]
如上文所描述来制备制剂。
[0892]
8.2.分析
[0893]
在1、3、6、9、12、18、24及36个月储存时以及最初在储存之前执行样品测量。将储存温度调节至5℃、25℃或40℃。通过使用up-sec测量单体、hmw及lmw含量且使用biacore测量结合活性来执行分析。此外,测量所需滑移力及松动力以及渗透重量摩尔浓度、乳白光及ph值。下文描述所用分析方法的另外细节。
[0894]
8.3.结果
[0895]
8.3.1.测量单体含量
[0896]
执行up-sec分析以测量单体含量。获得以下结果。
[0897]
表46:包含变化量的乙酸盐的制剂的以%为单位的up-sec-单体测量结果。
[0898][0899]
结果与讨论
[0900]
单体测量显示,在一定范围的乙酸盐含量内的制剂是稳定的,指示含有缓冲剂及不含缓冲剂的具有150mg/ml瑞沙珠单抗的制剂及根据本实施例的制剂的稳定性。
[0901]
8.3.2.测量hmw含量
[0902]
亦经由up-sec分析测定制剂的hmw含量,其中结果如下:
[0903]
表47:包含变化量的乙酸盐的制剂的以%为单位的up-sec-hmw测量结果。
[0904][0905]
结果与讨论
[0906]
hmw含量测量显示,在一定范围的乙酸盐含量内的制剂是稳定的,指示含有缓冲剂及不含缓冲剂的具有150mg/ml瑞沙珠单抗的制剂及根据本实施例的制剂的稳定性。
[0907]
8.3.3.测量lmw含量
[0908]
对于lmw含量测量,执行up-sec分析。获得以下结果。
[0909]
表48:包含变化量的乙酸盐的制剂的以%为单位的up-sec-lmw测量结果。
[0910][0911]
结果与讨论
[0912]
lmw测量显示,在一定范围的乙酸盐含量内的制剂是稳定的,指示含有缓冲剂及不含缓冲剂的制剂的稳定性。
[0913]
8.3.4.测量结合活性
[0914]
为分析乙酸盐含量是否对瑞沙珠单抗与il-23的结合活性具有影响,执行biacore分析。结合活性测量显示范围为92%-105%结合活性及97%-100%特异性结合活性的全部所测试制剂针对人类il-23的高结合活性及储存时间。这些结果支持所测试制剂的有利稳定性且根据本发明指示含有乙酸盐及不含缓冲剂的制剂为可应用的。
[0915]
8.3.5.测量渗透重量摩尔浓度
[0916]
因为乙酸盐含量亦对制剂的渗透重量摩尔浓度具有影响,故测量此参数。结果示于表49中。
[0917]
表49:包含变化量的乙酸盐的制剂在不同温度下及储存时间时的以mosm/kg为单位的制剂渗透重量摩尔浓度。
[0918][0919]
结果与讨论
[0920]
测量显示,渗透重量摩尔浓度在约290至338mosm/kg之间变化,取决于所添加乙酸盐的量。所添加乙酸盐愈多,所测量渗透重量摩尔浓度愈高。通常需要约310mosm/kg的渗透重量摩尔浓度,且10mm的乙酸盐浓度产生所需渗透重量摩尔浓度为约310mosm/kg(测量范围为305至314mosm/kg)的所测试制剂。在需要另一浓度的乙酸盐的情况下,可能有利的是修改制剂的其他化合物(例如,另一赋形剂,诸如海藻糖)的含量以将渗透重量摩尔浓度调节至约310mosm/kg。
[0921]
8.3.6.测量乳白光
[0922]
亦测量本实施例的制剂的乳白光以评估稳定性。不同制剂的所测量乳白光总体上相同,范围在4-9fnu之间。与较低浓度的乙酸盐的乳白光(对于0mm乙酸盐的4-6fnu)相比,较高浓度的乙酸盐引起对于20mm乙酸盐的7-9fnu的略微地较高的乳白光。鉴于所测量乳白光,根据本实施例的全部制剂皆是稳定的。
[0923]
8.3.7.测量ph
[0924]
为测定包含变化量的缓冲剂,亦即在此实施例中乙酸盐的制剂的ph稳定性,测量在储存时间内在不同温度下的ph值。结果示于后续表中。
[0925]
表50:在变化储存时间内在5℃、25℃或40℃下含有变化量的乙酸盐的制剂的所测量ph值。
[0926][0927]
结果与讨论
[0928]
ph值测量展现,根据本实施例的所测试制剂的ph总体上保持恒定。因此,对于全部乙酸盐含量,包括不包含乙酸盐的制剂,就ph值而言,制剂是稳定的。
[0929]
8.3.8.测量滑移力及松动力
[0930]
测量含有根据本实施例的不同制剂的注射器的最大及平均滑移力以及松动力。这些测量结果显示如下。
[0931]
表51:包含变化量的乙酸盐的制剂最初及在5℃、25℃或40℃下所指示储存时间之后以n为单位的最大滑移力。
[0932][0933]
表52:包含变化量的乙酸盐的制剂最初及在5℃、25℃或40℃下所指示储存时间之后以n为单位的平均滑移力。
[0934]
[0935][0936]
表53:包含变化量的乙酸盐的制剂最初及在5℃、25℃或40℃下所指示储存时间之后以n为单位的松动力。
[0937]
[0938][0939]
结果与讨论
[0940]
滑移力及松动力测量显示,全部制剂皆是稳定的,且滑移力及松动力不随时间推移而显著地增加。值得注意的是,不包含乙酸盐的制剂(f1)或包含极低浓度的乙酸盐的制剂(f2)显示较高力,指示添加诸如乙酸盐的缓冲剂是有用的,特别地当旨在将应用于注射器的所需力减至最小时如此。
[0941]
8.4.另外分析及结果
[0942]
另外,对所测试的五种制剂执行另外分析,其中结果如下。储存时间及温度为如上文所描述。
[0943]
·
在24及36个月内在5℃下iec主峰、apg及bpg含量保持恒定。在制剂之间未观测到关于主峰、apg及bpg的差异。
[0944]
·
在24个月内在5℃下hic主峰含量保持恒定在96.8%-97.2%范围内,以及hic前峰含量保持恒定在1.4%-1.7%范围内及hic后峰含量保持恒定在1.5%-1.9%范围内。在36个月内在5℃下,获得在96.3%-97.2%范围内的hic主峰含量以及在1.4%-1.7%范围内的hic前峰含量及在1.5%-2.2%范围内的hic后峰含量。在25℃下达长达12个月储存时间,获得在94.3%-97.1%之间的主峰含量以及在1.4%-3.0%之间之前峰含量及在1.5%-2.7%之间之后峰含量。在40℃下达长达3个月储存时间,获得在92.0%-97.1%之间的主峰含量以及在1.4%-4.6%之间之前峰含量及在1.5%-3.4%之间之后峰含量。在制剂之间未观测到关于主峰、前峰及后峰的差异。
[0945]
·
在所测试的不同储存温度下蛋白质浓度保持基本上恒定长达24及36个月的储存时间。蛋白质浓度的小偏差为归因于分析变化,引起范围为147-155mg/ml(24个月)及147-157mg/ml(36个月)。
[0946]
·
在所测试的不同储存温度下动态黏度保持基本上恒定长达24及36个月的储存时间。动态黏度在8.9-10.0mpas范围内。
[0947]
·
在储存时间内在所测试的不同储存温度下蛋白质相关粒子及外来粒子保持基本上恒定地低。
[0948]
8.5.结果概述
[0949]
所测试制剂显示总体上相当的高稳定性。因此,含有乙酸盐的制剂及不含缓冲剂的制剂均适用于本发明制剂。鉴于待施加至注射器的所需力,已证明含有诸如乙酸盐缓冲剂的缓冲剂的溶液优于不含缓冲剂的制剂。此外,为达成310mosm/kg的渗透重量摩尔浓度,考虑到根据本实施例的制剂中所存在的其他化合物,已证明10mm的乙酸盐含量是合适的。
[0950]
iv.实施例3:分析另外赋形剂
[0951]
1.摇动实验中ps20含量的影响
[0952]
制备制剂(参见表54),其中ps20(聚山梨醇酯20)含量在0、0.05、0.075、0.1、0.2、0.3至0.5mg/ml之间变化且在0、1、5、7、14及21天的摇动时间期间对其加以分析。
[0953]
表54:制剂的组成。
[0954][0955]
1.1.制备制剂
[0956]
如上文所描述来制备制剂。对于各制剂以及对于对照及未经摇动制剂,将制剂封装在2r小瓶(1.0ml)或预填充注射器(pfs,neopak,1.0ml)中。
[0957]
1.2.分析
[0958]
在第0、1、5、7、14及21天执行样品测量。因此,小瓶及pfs两者的总摇动持续时间为21天。在室温(25℃)下以200u/min对小瓶执行摇动(回转式摇动器),且对pfs进行运动调节达到各别黏度以确保气泡运动(倾斜式摇动器(vari mix平台摇荡器))。全部样品皆避光。在所指示测量点测量制剂的乳白光。下文描述所用分析方法的另外细节。
[0959]
1.3.结果
[0960]
测量乳白光
[0961]
为测量含有变化量的ps20且经受摇动应力的制剂的稳定性,在不同时间点测量乳白光。通过乳白光测量获得的结果显示如下:
[0962]
表55:注射器中具有变化量的ps20的制剂的以fnu为单位的乳白光。
[0963][0964]
表56:小瓶中具有变化量的ps20的制剂的以fnu为单位的乳白光。
[0965][0966][0967]
1.4.结果概述
[0968]
摇动研究清楚地揭露,在21天摇动时间内不包含ps20的制剂的乳白光显著地增加。相比之下,包含ps20,亦即甚至0.05g/l的最低量的ps20的全部制剂皆显示乳白光不随时间推移而增加。结果证实诸如非离子表面活性剂ps20的表面活性剂在本发明制剂,详言之包含150mg/ml瑞沙珠单抗的制剂中的重要性。
[0969]
2.储存期间ps20含量的影响
[0970]
在三个不同储存温度(5℃、25℃及40℃)下的不同时间点内分析所制备制剂(参见表54)。
[0971]
2.1.分析
[0972]
在1、3、6、9、12、18、24及36个月储存时以及最初在储存之前执行样品测量。执行up-sec分析以便测定单体、hmw及lmw含量。此外,测量不可目视粒子含量、滑移力及松动力。下文描述所用分析方法的另外细节。
[0973]
2.2.结果
[0974]
2.2.1.测量单体含量
[0975]
通过使用up-sec分析测量单体含量来评估制剂稳定性。结果显示如下。
[0976]
表57:包含变化量的ps20的制剂的以%为单位的up-sec-单体测量结果。
[0977]
[0978][0979]
结果与讨论
[0980]
单体测量显示,在一定范围的ps20含量内的制剂是稳定的。对于约0.2mg/ml的ps20含量,获得特别地高的单体值。
[0981]
2.2.2.测量hmw含量
[0982]
通过再次使用up-sec测量hmw含量来进一步评估制剂稳定性。结果显示如下。
[0983]
表58:包含变化量的ps20的制剂的以%为单位的up-sec hmw测量结果。
[0984]
[0985][0986]
结果与讨论
[0987]
hmw含量与单体测量结果相关。总体而言,在一定范围的ps20含量内的所测试制剂是稳定的。对于0.2mg/ml的ps20含量,获得特别地低的hmw含量增加。然而,最高及最低所测试ps20含量似乎已引起略微地较高的hmw值。
[0988]
2.2.3.测量lmw含量
[0989]
亦使用up-sec测量lmw含量且获得以下结果:
[0990]
表59:包含变化量的ps20的制剂的以%为单位的up-sec-lmw测量结果。
[0991]
[0992][0993]
结果与讨论
[0994]
lmw含量与单体测量结果相关。总体而言,在一定范围的ps20含量内的所测试制剂是稳定的。对于0.2mg/ml的ps 20含量,获得特别地低的lmw含量增加。最低所测试ps20含量(参见f1)似乎已引起略微地较高的lmw值。
[0995]
2.2.4.测量乳白光
[0996]
此外,测量含有变化量的ps20的制剂的乳白光。结果描绘如下。
[0997]
表60:包含变化量的ps20的制剂的以fnu为单位的乳白光测量结果。
[0998][0999][1000]
结果与讨论
[1001]
测量显示,在25℃及40℃的较高温度下,全部制剂皆不引起乳白光增加。然而,在5℃的温度下及后续储存时间点(例如,18、24及36个月)时,制剂f1(无ps20)显示乳白光增加。因此,并有诸如非离子表面活性剂ps20的表面活性剂是有利的。
[1002]
2.2.5.测量不可目视粒子含量
[1003]
就储存于5℃下24及36个月内的制剂的不可目视粒子(≥2μm、≥10μm及≥25μm)含量而言对制剂进行分析。
[1004]
表61:包含变化量的ps20的制剂的在5℃下储存长达24及36个月的尺寸为≥2μm、≥10μm及≥25μm的粒子的不可目视粒子含量测量结果。
[1005]
[1006][1007]
结果与讨论
[1008]
不可目视粒子含量测量显示,在5℃下达长达24及36个月的全部制剂皆是稳定的。仅不具有ps20的制剂(f1)似乎导致一些粒子形成,证实向本发明制剂中添加诸如非离子表面活性剂ps20的表面活性剂是有利的。
[1009]
2.2.6.测量滑移力及松动力
[1010]
测量包含变化量的ps20的制剂的最大及平均滑移力以及松动力。测量结果显示如下。
[1011]
表62:以n为单位的最大滑移力。制剂包含变化量的ps20。
[1012]
[1013][1014]
表63:以n为单位的平均滑移力。制剂包含变化量的ps20。
[1015][1016]
表64:以n为单位的松动力。制剂包含变化量的ps20。
[1017]
[1018][1019]
结果与讨论
[1020]
滑移力测量揭露0.5g/l高含量的ps20相较于较低含量而言之相对高滑移力。虽然0g/l含量显示最低滑移力增加,但0.2g/l中间浓度显示高滑移力与低滑移力之间的良好折衷。值得注意的是,就松动力而言在制剂之间基本上未观测到差异。
[1021]
2.3.另外分析及结果
[1022]
另外,对所测试的七种制剂执行另外分析,其中结果如下。储存时间及温度为如上文所描述。
[1023]
·
在24及36个月内在5℃下iec主峰、apg及bpg含量保持恒定。在制剂之间未观测到关于主峰、apg及bpg的差异。
[1024]
·
在24个月内在5℃下hic主峰含量保持恒定在96.5%-97.3%范围内,以及hic前峰含量保持恒定在1.4%-1.7%范围内及hic后峰含量保持恒定在1.4%-1.9%范围内。在36个月内在5℃下,获得在95.9%-97.3%范围内的hic主峰含量以及在1.4%-1.7%范围内的hic前峰含量及在1.4%-2.4%范围内的hic后峰含量。在25℃下达长达12个月储存时间,获得在93.9%-96.8%之间的主峰含量以及在1.4%-3.0%之间之前峰含量及在1.7%-2.7%之间之后峰含量。在40℃下达长达3个月储存时间,获得在90.3%-95.2%之间的主峰含量以及在2.5%-6.0%之间之前峰含量及在2.3%-3.7%之间之后峰含量。在制剂之间未观测到关于主峰、前峰及后峰的差异。
[1025]
·
在所测试的不同储存温度下特异性结合活性保持基本上恒定长达24及36个月的储存时间。特异性结合活性在97%-101%范围内。
[1026]
·
在所测试的不同储存温度下蛋白质浓度保持基本上恒定长达24及36个月的储存时间。蛋白质浓度的小偏差为归因于分析变化,引起范围为147-155mg/ml(24个月)及147-159mg/ml(36个月)。
[1027]
·
在所测试的不同储存温度下ph值保持基本上恒定长达24及36个月的储存时间。ph在5.7-5.9范围内。
[1028]
·
在所测试的不同储存温度下渗透重量摩尔浓度保持基本上恒定长达24及36个月的储存时间。所测试值范围为305-322mosm/kg。
[1029]
·
在所测试的不同储存温度下动态黏度保持基本上恒定长达24及36个月的储存时间。动态黏度在9.2-11.0mpas范围内。
[1030]
·
在储存时间内在所测试的不同储存温度下蛋白质相关粒子及外来粒子保持基本上恒定地低。
[1031]
2.4.结果概述
[1032]
总而言之,在长达24及36个月的长期储存内在范围为5℃至40℃的温度下所测试制剂是稳定的。特别是,发现包含诸如ps20的表面活性剂的制剂是稳定的,而缺乏ps20的制剂显示一些不可目视粒子形成及乳白光增加。缺乏ps20的制剂的lmw含量亦略微地增加。在所测试条件下诸如非离子表面活性剂ps20的表面活性剂的特别地合适的含量似乎为0.2g/l。
[1033]
3.改变海藻糖含量
[1034]
在此实施例中,海藻糖浓度在145、165、185、205至225mm之间变化且在三个不同储存温度(5℃、25℃及40℃)下的不同时间点内对其加以分析。所制备制剂示于表65中。
[1035]
表65:制剂的组成。
[1036][1037]
3.1.分析
[1038]
在1、3、6、9、12、18、24及36个月储存时以及最初在储存之前执行样品测量。下文描述所用分析方法的另外细节。
[1039]
3.2.结果
[1040]
3.2.1.测量单体含量
[1041]
通过使用up-sec分析测量单体含量来评估包含变化量的海藻糖的制剂的稳定性,揭露如下显示的结果。
[1042]
表66:包含不同量的海藻糖的制剂的以%为单位的up-sec-单体测量结果。
[1043][1044][1045]
结果与讨论
[1046]
单体测量显示,在一定范围的海藻糖含量内的制剂是稳定的,此种情况指示在一定范围的海藻糖含量内的稳定性。
[1047]
3.2.2.测量hmw含量
[1048]
使用up-sec测量制剂的hmw含量。分析结果显示如下。
[1049]
表67:包含不同量的海藻糖的制剂的以%为单位的up-sec hmw测量结果。
[1050][1051][1052]
结果与讨论
[1053]
hmw含量测量显示,在一定范围的海藻糖含量内的制剂是稳定的。
[1054]
3.2.3.测量lmw含量
[1055]
亦经由up-sec测量包含变化量的海藻糖的制剂的lmw含量。结果显示如下。
[1056]
表68:包含不同量的海藻糖的制剂的以%为单位的up-sec-lmw测量结果。
[1057][1058][1059]
结果与讨论
[1060]
lmw测量显示,在一定范围的海藻糖含量内的制剂是稳定的。
[1061]
3.2.4.测量结合活性
[1062]
测量本发明制剂中所包含的瑞沙珠单抗的结合活性。抗原结合测量显示范围为92%-122%结合活性及96%-100%特异性结合活性的全部所测试制剂与il-23的高结合活性。这些结果支持所测试制剂的有利稳定性且根据本发明指示各种浓度的含有海藻糖的制剂为可应用的。
[1063]
3.2.5.测量渗透重量摩尔浓度
[1064]
测量渗透重量摩尔浓度以便确保所测试制剂具有适用于注射的渗透重量摩尔浓度。结果显示如下:
[1065]
表69:包含变化量的海藻糖的制剂的以mosm/kg为单位的所测量渗透重量摩尔浓度。
[1066][1067][1068]
结果与讨论
[1069]
对于145至225mm的海藻糖浓度,渗透重量摩尔浓度值范围为约245至380mosm/kg。因为最佳渗透重量摩尔浓度为约310mosm/kg,故提供具有该渗透重量摩尔浓度的制剂可能是有利的。此举可例如使用185mm的海藻糖浓度以及根据本实施例的制剂来达成。
[1070]
3.3.另外分析及结果
[1071]
另外,对所测试的五种制剂执行另外分析(储存时间及温度如上文所描述)。
[1072]
·
在24及36个月内在5℃下iec主峰、apg及bpg含量保持恒定。在制剂之间未观测到关于主峰、apg及bpg的差异。
[1073]
·
在24个月内在5℃下hic主峰含量保持恒定在96.4%-97.4%范围内,以及hic前峰含量保持恒定在1.4%-1.8%范围内及hic后峰含量保持恒定在1.2%-2.0%范围内。在36个月内在5℃下,获得在96.0%-97.4%范围内的hic主峰含量以及在1.4%-1.8%范围内的hic前峰含量及在1.2%-2.3%范围内的hic后峰含量。在25℃下达长达12个月储存时间,获得在94.2%-97.4%之间的主峰含量以及在1.4%-3.0%之间之前峰含量及在1.2%-2.8%之间之后峰含量。在40℃下达长达3个月储存时间,获得在90.3%-97.4%之间的主峰含量以及在1.4%-5.9%之间之前峰含量及在1.2%-3.7%之间之后峰含量。在制剂之间未
观测到关于主峰、前峰及后峰的差异。
[1074]
·
在所测试的不同储存温度下蛋白质浓度保持基本上恒定长达24及36个月的储存时间。蛋白质浓度的小偏差为归因于分析变化,引起范围为145-153mg/ml(24个月)及148-158mg/ml(36个月)。
[1075]
·
在所测试的不同储存温度下ph值保持基本上恒定长达24及36个月的储存时间。ph在5.7-5.9范围内。
[1076]
·
在所测试的不同储存温度下乳白光保持基本上恒定长达24及36个月的储存时间。乳白光在5-9fnu范围内。
[1077]
·
在所测试的不同储存温度下动态黏度保持基本上恒定长达24及36个月的储存时间。动态黏度在8.9-10.3mpas范围内。
[1078]
·
在24个月内在5℃下滑移力保持恒定在6.5-7.7n(最大)及5.8-7.4n(平均)范围内,同样松动力保持恒定在3.9-5.0n范围内。在36个月内在5℃下滑移力保持恒定在6.1-8.5n(最大)及5.8-7.7n(平均)范围内,同样松动力保持恒定在3.9-5.0n范围内。在25℃下达长达12个月储存时间,滑移力范围在6.7-15.7n(最大)及6.2-12.4n(平均)之间,以及松动力范围在3.9-5.6n之间。在40℃下达长达3个月储存时间,滑移力范围在8.7-23.1n(最大)及7.3-16.4n(平均)之间,以及松动力范围在5.1-6.6n之间。
[1079]
·
在储存时间内在所测试的不同储存温度下蛋白质相关粒子及外来粒子保持基本上恒定地低。
[1080]
3.4.结果概述
[1081]
总而言之,全部所测试制剂皆是稳定的,证实虽然海藻糖浓度可变化,但维持高稳定性。因此,可灵活地应用所指示海藻糖浓度以便产生150mg/ml瑞沙珠单抗的稳定蛋白质制剂。
[1082]
v.实施例4:分析特定制剂的另外参数
[1083]
鉴于先前实施例的结果,特别地合适的制剂包含以下化合物:
[1084]-150mg/ml瑞沙珠单抗,
[1085]-10mm乙酸盐缓冲剂,
[1086]-185mm海藻糖,及
[1087]-0.2mg/ml ps20;
[1088]
其中制剂的ph为5.7。
[1089]
此制剂之外观为清晰的至略微地乳白色且基本上不含外来粒子。渗透重量摩尔浓度为约310mosm/kg。制剂特别地适用于注射,尤其适用于皮下注射。此外,测量约9.6mpas的黏度,使其适用于使用注射器进行的注射。在20℃下的电导率为约1.53ms/cm,在20℃下的密度为约1.067g/cm3且在4℃下的密度为约1.071g/cm3。
[1090]
可如下提供此150mg/ml瑞沙珠单抗制剂:
[1091][1092]
缩写清单
[1093]
[1094]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。