芦笋中抗旱性aosap8_p基因、核酸分子及其应用
技术领域
1.本发明属于是生物基因及其研究应用技术领域,尤其涉及一种芦笋中抗旱性aosap8_p基因、核酸分子及其应用。
背景技术:
2.目前,芦笋(asparagus officinalis l.)又名石刁柏,属于天门冬科天门冬属,是一种宿根性多年生草本植物。具有较高的营养价值和药用价值。食用部分为芦笋的嫩茎,其嫩茎营养价值较高,富含多种维生素、多种氨基酸及矿物质等营养成分,因而,芦笋的营养价值高于其他蔬菜。更重要的是,芦笋中富含黄酮、甾体皂苷等活性物质,使之具有较高的药用价值,在增强免疫力、抗肿瘤、抗衰老、降血脂等方面有明显功效。此外,芦笋中还有能有效地防止癌细胞的增值与扩散的组蛋白,能促使细胞正常生长。因而,芦笋是一种食药同源的保健型蔬菜,被称为“蔬菜之王”、“防癌蔬菜”等。芦笋是典型的雌雄异株植物,分为雌株和雄株,也有部分两性株(未完全退化的雌蕊,正常发育的雄蕊,可正常结实)。雌株芦笋枝叶稀疏,发笋数量少,产量低。而雄株芦笋因不结果实(种子)养分消耗少,生长旺盛,枝繁叶茂,发笋多、大、产量高且品质好。因而在同样生长环境下,雄株芦笋比雌株具有更强的抗逆境能力,产量比雌株高许多,导致在育种与生产上希望获得雄株植株材料。
3.芦笋中aosap8基因,属于a20/an1型锌指蛋白基因。锌指蛋白(zinc finger proteins,zfps),因含有手指状的锌指结构域而得名。锌指蛋白最初发现于动物中的非洲爪蟾卵母细胞的转录因子tfiiia中,后来发现还广泛存在于动植物和微生物的蛋白质中。植物中现已在水稻、拟南芥、小麦、玉米和棉花等多种植物中发现zfps。锌指蛋白是植物中最大的转录因子家族之一,可以在转录和翻译水平来调控基因的表达,进而调控植物的生长发育和胁迫应答等。锌指蛋白可根据其二级结构中半胱氨酸(cys)和/或组氨酸(his)残基的数目和顺序分为很多亚家族,如cys2/his2型(c2h2)、c2c2、c2c2c2c2、c2hcc2c2型等,目前研究最广泛且成员较多的一类是c2h2型锌指蛋白。近些年来,被研究者们称为胁迫相关蛋白(stress-associated proteins,saps)的锌指蛋白,具有a20和/或an1型锌指结构域,因此也称为a20/an1型锌指蛋白。这类蛋白因在功能上有重要性和多样性,迄今为止,在很多植物中的功能分析研究表明该家族蛋白对非生物胁迫产生应答反应。但现有技术中关于植物抗旱性基因的相关研究尚未见报道。因此,亟需确定一种新的植物抗旱性基因。
4.通过上述分析,现有技术存在的问题及缺陷转基因插入片段的位置是随机的,无法判断和预测。如果插入到重要的功能位点,可能会造成其他功能的损坏,或者对该研究结果有干扰,比如说转基因植株表现出来的症状该基因的功能还是因为片段的插入造成的。
5.解决方法:该实验选择两个转基因株系跟野生型做对比,就能排除上述疑虑。
6.现有技术中关于芦笋抗旱性基因的相关研究尚未见报道。
7.解决以上问题及缺陷的难度为:通过常规抗旱植株的筛选,周期长,见效慢。
8.解决以上问题及缺陷的意义为:该基因可为抗旱育种提供优良抗旱基因。
技术实现要素:
9.针对现有技术存在的问题,本发明提供了一种芦笋中抗旱性aosap8_p基因、核酸分子、重组载体及其应用。
10.本发明是这样实现的,一种芦笋中抗旱性aosap8_p基因,所述芦笋中抗旱性aosap8_p基因的核苷酸序列如seq id no:1所示。涉及的aosap8_p基因通过转基因植株的抗旱性证明,转入该基因导致转基因植株的抗旱性增加。
11.本发明的另一目的在于提供一种应用所述芦笋中抗旱性aosap8_p基因的芦笋中抗旱性aosap8_p基因的克隆方法,所述芦笋中抗旱性aosap8_p基因的克隆方法包括以下步骤:
12.步骤一,分别提取总rna并检测总rna的质量后,合成第一链cdna;
13.步骤二,进行aosap8_p基因cdna的克隆和测序:分别进行pcr产物加a反应以及加a后的pcr产物纯化,将cdna片段与pgem-t easy载体连接后,进行菌液pcr检测阳性克隆及测序。
14.进一步,步骤一中,所述分别提取总rna并检测总rna的质量后,合成第一链cdna,包括:
15.(1)总rna的提取:用镊子采集两性紫芦笋新鲜花蕾迅速置于液氮中,用easyspin plus植物rna快速提取试剂盒提取总rna。
16.(2)检测总rna的质量:用1%琼脂糖凝胶电泳检测总rna的质量;
17.将电泳槽、梳子清洗干净,在电泳槽中加入新的50
×
tae电泳缓冲行液;称取0.25g琼脂糖至三角瓶中,量入25ml 50
×
tae,置于微波炉中加热2~3min至溶液透明,待溶液冷却至50~60℃后加入2.5μl的核酸染料,充分混合均匀后,快速倒胶;20min琼脂糖胶凝固,小心拔出梳子,取出胶板,放入电泳槽中,取2μlrna、6μl ddh2o及loading buffer混合进行点样,再点5μl 2000bp marker。调节电压120v,110ma进行琼脂糖凝胶电泳检测;电泳30min后,置于凝胶成像系统下观察并拍照,检测rna的完整性以用于反转cdna。
18.(3)第一链cdna的合成:参照试剂公司的反转录试剂盒说明书,进行cdna合成,用于后面基因pcr扩增,42℃孵育15min,95℃孵育3min使酶灭活后,将得到的cdna在-20℃保存。
19.进一步,步骤二中,所述aosap8_p基因cdna的克隆和测序,包括:
20.(1)pcr反应体系:以反转录合成的cdna为模板,用基因特异性引物,利用phanta max super-fidelity高保真酶扩增cdna片段;pcr反应程序:预变性95℃处理3min,95℃变性处理15s,58℃退火处理15s,72℃延伸处理5min 40s,处理循环30个;pcr产物胶回收:配置1.2%的琼脂糖凝胶电泳检测pcr扩增产物,在紫外照胶仪的照射下切下条带大小正确的目的基因的胶块,用试剂公司柱式胶回收试剂盒进行目的片段回收。
21.(2)pcr产物加a反应:高保真dna聚合酶扩增后的平末端片段要3’端加a,从而利于片段与3’端为粘性末端的t载体连接;在已灭菌的pcr小管中加入经纯化的平末端cdna片段15μl,加a反应液4μl,2.5u/μl的taq酶1μl;加样品后,在手掌型离心机上轻轻混匀,72℃反应30min。
22.(3)加a后的pcr产物纯化:由于加a反应前已经将pcr扩增产物胶回收成单一条带的片段,故加a后的pcr产物只需使用试剂公司的sanprep柱式pcr产物纯化试剂盒,按照说
明进行纯化目的片段。
23.(4)cdna片段与pgem-t easy载体连接:将所述纯化的目的片段与pgem-t easy克隆载体连接,连接体系共10μl,离心混匀后,16℃金属恒温浴连接过夜。
24.(5)菌液pcr检测阳性克隆及测序:挑取适量白色单菌落摇菌;用已灭过菌的牙签挑取白色单菌落在新的、含amp 100mg/l的固体lb培养基上划线,然后将牙签插入到含有600μl液体和amp 100mg/l的lb培养基的1.5ml离心管中轻轻转动,再丢弃牙签;在37℃,200rpm条件下,振荡培养5h;取1μl菌液进行菌液pcr检测,反应体系按照pcr体系进行,并送试剂公司测序。将测序含有目标片段的重组子阳性重组载体命名为pgem-t-aosap8。
25.本发明的另一目的在于提供一种应用所述芦笋中抗旱性aosap8_p基因的编码所述芦笋抗逆性相关aosap8_p蛋白的核酸分子,所述核酸分子包括dna分子和rna分子;其中,所述dna分子包括基因组dna、cdna或重组dna;所述rna分子包括mrna、hnrna或trna。
26.核酸分子dna序列为seq id no:1:519bp
[0027][0028]
核酸分子蛋白序列为seq id no:11:
[0029][0030]
本发明的另一目的在于提供一种应用所述芦笋中抗旱性aosap8_p基因的含有编码芦笋耐逆性相关aosap8_p基因的重组载体、表达盒、转基因细胞系或重组菌,所述芦笋aosap8_p基因的核苷酸序列如seq id no:1所示。
[0031]
进一步,所述重组表达载体包括双元农杆菌载体和植物微弹轰击的载体,包括pbin438、pcambia1301、pcambia1300、pcambia1302、pcambia2301、pbi121-egfp、pcambia1391-xa或pcambia1391-xb;
[0032]
本发明优选只用到植物表达载体,pbi121-egfp。dna序列为seq id no:12;13832bp
[0033]
[0034]
[0035]
[0036]
[0037][0038]
其中,5462bp-5807bp的
[0039]039]
为35spromotor片段。
[0040]
5946bp-5949bp的“atg”为atg起始密码子片段。
[0041]
5961bp-5691bp的“catcaccatcaccatcaccatcaccatcac为10*his片段。
[0042]
6023bp-6791bp的“[0043][0043][0043]
为egfp增强型绿色荧光蛋白基因片段。
[0044]
6748bp-6766bp的“catcaccatcaccatcac“为6*his片段。
[0045]
6773bp-6776bp的“tga”为tga终止密码子片段。
[0046]
6801bp-7054bp的
[0047][0047]
为nosterminator片段。
[0048]
使用所述aosap8_p基因构建重组表达载体时,在转录起始核苷酸前可加上任何一种增强型、组成型、组织特异型或诱导型启动子,单独使用或与其它的启动子结合使用;利用aosap8_p基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子;对所用植物表达载体进行加工,对转基因植物细胞或植物进行鉴定及筛选;包括加入在植物中表达产生颜色变化的酶或发光化合物的基因,所述基因包括gus基因、gfp基因、萤光素酶基因;或是具有抗性的抗生素标记物,所述抗生素标记物包括卡那霉素标记物、庆大霉素标记物;从转基因植物的安全性考虑,不加任何选择性标记基因,直接以逆境筛选转化植株。
[0049]
本发明的另一目的在于提供一种所述芦笋抗逆性相关aosap8_p基因或含有编码彩色马铃薯耐盐性相关aosap8_p蛋白的aosap8_p基因的重组载体、表达盒、转基因细胞系或重组菌在调节植物盐胁迫应答以及调节植物渗透胁迫应答中的应用,所述调节植物盐胁迫应答为使植物的耐盐性增强,所述调节植物渗透胁迫应答为使植物的耐旱性增强;其中,所述植物为单子叶植物或双子叶植物;所述双子叶植物为烟草或芦笋,所述芦笋为紫色芦笋。
[0050]
其中,表达盒结构:p35s aosap8 tnos。
[0051]
重组载体:将目的基因aosap8_p与载体pbi121-egfp双酶切产物纯化后用t4dna酶连接。
[0052]
琼脂糖凝胶电泳检测菌液pcr产物后,将阳性重组子提取质粒并用载体上设计的引物(pbi121-f/r,见表1)送去生工测序,最后将测序鉴定含有目的基因的阳性重组载体命名为pbi121-aosap8_p。
[0053]
pbi121-aosap8载体电转至农杆菌eha105,挑取单菌落摇菌后,进行菌液pcr验证,选择阳性的农杆菌菌株pbi121-aosap8就是重组菌。
[0054]
本发明的另一目的在于提供一种所述芦笋抗逆性相关aosap8_p基因或含有编码、芦笋抗逆性相关aosap8_p基因的重组载体、表达盒、转基因细胞系或重组菌在培育转基因植物耐盐性中的应用,所述在培育转基因植物抗逆性中的应用中,所述转基因植物具有植物的耐旱性增强或植物的耐盐性增强中的至少一种性状。
[0055]
本发明的另一目的在于提供一种应用所述芦笋中抗旱性aosap8_p基因的提高目的植物抗逆性的方法,所述提高目的植物抗逆性的方法,包括:
[0056]
将所述核苷酸序列如seq idno:1所示的aosap8_p基因导入目的植物,获得转基因植物,所述转基因植物与所述目的植物相比,具有植物的耐盐性增强或植物的耐旱性增强中的至少一种性状;其中,所述植物为双子叶植物或单子叶植物;所述双子叶植物具体为烟草,所述单子叶植物为芦笋。
[0057]
结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明提供的芦笋中抗旱性aosap8_p基因及其应用,利用芦笋中aosap8_p基因的抗逆性与应用,属于研究
应用技术领域。本发明通过该基因转化烟草后的应用,其转基因烟草比非转基因烟草耐逆性显著提高,丰富了培育高抗逆性作物的基因资源与应用。
[0058]
本发明从紫色激情四倍体芦笋品种中克隆出aosap8_p基因,成功构建植物过表达载体,采用农杆菌介导“叶盘法”转化烟草,与对照相比,转基因烟草比非转基因烟草耐逆性显著提高。因此,本发明首次提出,并验证了aosap8_p基因在烟草中的耐逆性功能,丰富了培育强耐逆性作物的基因资源。
附图说明
[0059]
为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
[0060]
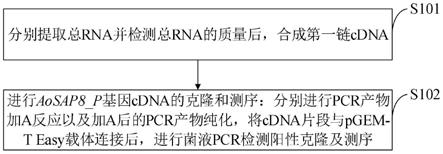
图1是本发明实施例提供的芦笋中抗旱性aosap8_p基因克隆方法流程图。
[0061]
图2是本发明实施例提供的pbi121-egfp质粒图谱。
[0062]
图3是本发明实施例提供的3 aosap8_p基因cdna的pcr扩增图,m:dl2000 dna marker;1-6:目的基因cdna的pcr产物。
[0063]
图4是本发明实施例提供的pgem-aosap8_p克隆载体的菌液pcr图,m:dl2000 dna marker;1-17:菌液pcr产物。
具体实施方式
[0064]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0065]
针对现有技术存在的问题,本发明提供了一种芦笋中抗旱性aosap8_p基因及其应用,下面结合附图对本发明作详细的描述。
[0066]
本发明提供一种芦笋中抗旱性aosap8_p基因,所述芦笋中抗旱性aosap8_p基因的核苷酸序列如seq id no:1所示:519bp
[0067][0068][0069]
如图1所示,本发明实施例提供的芦笋中抗旱性aosap8_p基因的克隆方法包括以下步骤:
[0070]
s101,分别提取总rna并检测总rna的质量后,合成第一链cdna;
[0071]
s102,进行aosap8_p基因cdna的克隆和测序:分别进行pcr产物加a反应以及加a后的pcr产物纯化,将cdna片段与pgem-t easy载体连接后,进行菌液pcr检测阳性克隆及测序。
[0072]
下面结合具体实施例对本发明的技术方案作进一步描述。
[0073]
实施例1
[0074]
本发明涉及一种利用芦笋中aosap8_p基因的抗逆性与应用,属于研究应用技术领域;所述aosap8_p基因编码的核苷酸序列如seq id no:1所示;通过该基因转化烟草后的应用,其转基因烟草比非转基因烟草耐逆性显著提高,丰富了培育高抗逆性作物的基因资源与应用。涉及的引物见表1、表2.
[0075]
引物:表1基因克隆及转基因烟草检测引物
[0076]
注:下划线表示xho i和xba
ꢀⅰ
的酶切位点。
[0077]
表2实时荧光定量pcr引物
[0078][0079][0080]
表1-表2中所示的是编码芦笋耐逆性相关aosap8_p基因的核苷酸序列。其开放阅读框架(orf)为自5’末端第1963位核苷酸。
[0081]
序列表中seq id no:3所示的是引物aosap8_p-f和aosap8_p-r的碱基序列。
[0082]
序列表中seq id no:4所示的是引物aosap8_p-orf-f和aosap8_p-orf-r的碱基序列。
[0083]
序列表中seq id no:5所示的是引物pbi121-f和pbi121-r的碱基序列。
[0084]
序列表中seq id no:6所示的是引物kan-f和kan-r的碱基序列。
[0085]
序列表中seq id no:7所示的是引物35s-f和35s-r的碱基序列。
[0086]
序列表中seq id no:8所示的是引物aosap8-qf和aosap8-qr的碱基序列。
[0087]
序列表中seq id no:9所示的是引物aoactin-f和aoactin-r的碱基序列。
[0088]
序列表中seq id no:10所示的是引物nt26s-f和nt26s-r的碱基序列。
[0089]
具体分析如下:
[0090]
1、两性紫芦笋aosap8_p基因的克隆方法:
[0091]
(1)总rna的提取:用镊子采集两性紫芦笋新鲜花蕾迅速置于液氮中,用easyspin plus植物rna快速提取试剂盒提取总rna,具体操作步骤按照说明书进行。检测总rna的质量:用1%琼脂糖凝胶电泳检测总rna的质量,步骤如:将电泳槽、梳子清洗干净,在电泳槽中加入新的50
×
tae电泳缓冲行液。称取0.25g琼脂糖至三角瓶中,量入25ml 50
×
tae,置于微波炉中加热2~3min至溶液透明,待溶液冷却至50~60℃后加入2.5μl的核酸染料,充分混合均匀后,快速倒胶。20min琼脂糖胶凝固,小心拔出梳子,取出胶板,放入电泳槽中,取2μlrna、6μl ddh2o及loadingbuffer混合进行点样,再点5μl 2000bp marker。调节电压120v,110ma进行琼脂糖凝胶电泳检测。电泳30min后,置于凝胶成像系统下观察并拍照,检测rna的完整性以用于反转cdna。第一链cdna的合成:参照试剂公司的反转录试剂盒说明书,进行cdna合成,用于后面基因pcr扩增,42℃孵育15min,95℃孵育3min使酶灭活,然后将得到的cdna在-20℃保存。
[0092]
aosap8_p基因cdna的克隆和测序:(1)pcr反应体系:以反转录合成的cdna为模板,用基因特异性引物,利用phantamax super-fidelity高保真酶扩增cdna片段,pcr反应程序:预变性95℃处理3min,95℃变性处理15s,58℃退火处理15s,72℃延伸处理5min40s,处理循环30个。pcr产物胶回收:配置1.2%的琼脂糖凝胶电泳检测pcr扩增产物,在紫外照胶仪的照射下切下条带大小正确的目的基因的胶块,用试剂公司柱式胶回收试剂盒进行目的片段回收。
[0093]
(2)pcr产物加a反应:高保真dna聚合酶扩增后的平末端片段要3’端加a,从而利于片段与3’端为粘性末端的t载体连接。在已灭菌的pcr小管中加入经纯化的平末端cdna片段15μl,加a反应液4μl,taq酶(2.5u/μl)1μl。加样品后,在手掌型离心机上轻轻混匀,然后72℃反应30min。加a后的pcr产物纯化:由于加a反应前已经将pcr扩增产物胶回收成单一条带的片段,故加a后的pcr产物只需使用试剂公司的sanprep柱式pcr产物纯化试剂盒,按照说明进行纯化目的片段。cdna片段与pgem-t easy载体连接:将上述纯化的目的片段与pgem-t easy克隆载体连接,连接体系共10μl,离心混匀后,16℃金属恒温浴连接过夜。菌液pcr检测阳性克隆及测序:挑取适量白色单菌落摇菌。用已灭过菌的牙签挑取白色单菌落在新的固体lb培养基(含amp 100mg/l)上划线,然后将牙签插入到含有600μl液体lb(含amp 100mg/l)培养基的1.5ml离心管中轻轻转动几下,再丢弃牙签。在37℃,200rpm条件下,振荡培养5h。取1μl菌液进行菌液pcr检测,反应体系按照一般的pcr体系进行,之后按照正常步骤送试剂公司测序。将测序含有目标片段的重组子阳性重组载体命名为pgem-t-aosap8。
[0094]
2、编码技术方案1所述的芦笋抗逆性相关aosap8_p蛋白的核酸分子,所述核酸分子是dna分子,如基因组dna、cdna或重组dna;所述核酸分子也可能是rna分子,如mrna、hnrna或trna。
[0095]
核酸分子dna序列为seq id no:1:519bp
[0096][0097]
核酸分子蛋白序列为seq id no):11:
[0098][0099]
3、含有编码芦笋耐逆性相关aosap8_p基因的重组载体、表达盒、转基因细胞系或重组菌,所述芦笋aosap8_p基因的核苷酸序列如seq id no:1所示。
[0100]
4、根据技术方案3所述的重组载体、表达盒、转基因细胞系或重组菌,所述重组表达载体包括双元农杆菌载体和植物微弹轰击的载体,具体为pbin438、pcambia1301、pcambia1300、pcambia1302、pcambia2301、pbi121、pcambia1391-xa或pcambia1391-xb。使用所述aosap8_p基因构建重组表达载体时,在其转录起始核苷酸前可加上任何一种增强型、组成型、组织特异型或诱导型启动子,它们可单独使用或与其它的启动子结合使用。此外,使用本发明的aosap8_p基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入在植物中表达可产生颜色变化的酶或发光化合物的基因(gus基因、gfp基因、萤光素酶基因等)或是具有抗性的抗生素标记物(卡那霉素标记物、庆大霉素标记物等)等。从转基因植物的安全性考虑,不加任何选择性标记基因,直接以逆境筛选转化植株。
[0101]
所述重组表达载体包括双元农杆菌载体和植物微弹轰击的载体,包括pbin438、pcambia1301、pcambia1300、pcambia1302、pcambia2301、pbi121-egfp、pcambia1391-xa或pcambia1391-xb;
[0102]
本发明优选只用到植物表达载体,pbi121-egfp。dna序列为seq id no:12。
[0103]
如图2所示,pbi121-egfp质粒图谱。
[0104]
5、扩增编码芦笋耐逆性相aosap8_p基因的核苷酸序列如seq id no:1所示。
[0105]
6、芦笋抗逆性相关aosap8_p基因或含有编码彩色马铃薯耐盐性相关aosap8_p蛋白的aosap8_p基因的重组载体、表达盒、转基因细胞系或重组菌在如(6.1)或(6.2)中的应用:(6.1)调节植物盐胁迫应答,所述调节植物盐胁迫应答为使植物的耐盐性增强;(6.2)调节植物渗透胁迫应答,所述调节植物渗透胁迫应答为使植物的耐旱性增强;
[0106]
(6.1)和(6.2)中所述植物为单子叶植物或双子叶植物,所述双子叶植物为烟草或芦笋,所述芦笋为紫色芦笋;
[0107]
7、芦笋抗逆性相关aosap8_p基因或含有编码、芦笋抗逆性相关aosap8_p基因的重组载体、表达盒、转基因细胞系或重组菌在培育转基因植物耐盐性中的应用。进一步,所述
在培育转基因植物抗逆性中的应用中转基因植物具有如下至少一种性状:1)植物的耐旱性增强;2)植物的耐盐性增强。
[0108]
8、本发明还提供一种提高目的植物抗逆性的方法,是将本发明所述的核苷酸序列如seq idno:1所示的aosap8_p基因导入目的植物,获得转基因植物,所述转基因植物与所述目的植物相比,具有如下至少一种性状:1)植物的耐盐性增强;2)植物的抗旱性增强,所述植物为双子叶植物或单子叶植物;所述双子叶植物具体为烟草,单子叶植物为芦笋。
[0109]
本发明从紫色激情四倍体芦笋品种中克隆出aosap8_p基因,成功构建植物过表达载体,采用农杆菌介导“叶盘法”转化烟草,与对照相比,转基因烟草比非转基因烟草耐逆性显著提高,因此,本发明首次提出,并验证了aosap8_p基因在烟草中的耐逆性功能,丰富了培育强耐逆性作物的基因资源。
[0110]
紫色芦笋品种由云南农业大学农学与生物技术学院提供,公众人员可以从云南农业大学获得或者商业途径得到。
[0111]
实施例2:芦笋aosap8_p基因的获得
[0112]
紫色芦笋(紫色激情)两性株、雄株、雌株种植于云南农业大学后山农场,在芦笋长出3~4株主茎后,取幼嫩叶片分别提取基因组dna和总rna,提取的总rna经反转录合成cdna。分别以基因组dna和cdna为模板,以aosap8_p基因特异引物rt-pcr扩增。上述pcr扩增的aosap8_p基因特异引物由引物aosap8_p f1和引物aosap8_p r1组成,所述引物aosap8_p f1的碱基序列,如seq id no:3所示,所述引物aosap8_p的碱基序列seq id no:4所示(引物aosap8_p f1和引物aosap8_p r1的碱基序列。根据其他不同物种aosap8_p蛋白编码基因多序列比对的保守区域序列设计而得)。
[0113]
pcr反应体系为50μl,反应体系为:1μl模板(cdna或基因组dna),2μl上下游混合引物(10μm)(上、下游引物各1μl,浓度均为10μm),5μl 10
×
la buffer,4μl dntp(2.5mm each),1μl la taq酶,ddh2o补平至50μl。
[0114]
pcr反应程序,如:94℃反应5min;94℃反应30s,52℃反应30s,72℃反应1min,30个循环;72℃反应5min40s。
[0115]
pcr产物经电泳切胶后以琼脂糖凝胶回收试剂盒回收,连接至pmd18-t载体,转化至大肠杆菌dh5α感受态细胞,经x-gal/iptg蓝白斑筛选及pcr鉴定阳性克隆,将鉴定正确的克隆送一般试剂公司测序。测序结果表明,以基因组dna为模板扩增得到的片段与以cdna为模板扩增得到的片段大小相同,通过分析测序结果,对比cdna序列与基因组dna序列,发现该基因没有内含子;上述pcr扩增得到核酸片段的核苷酸序列如表中seq id no:1所示,共963bp(包含终止子),其编码序列表中序列1所示的氨基酸序列,共320个氨基酸残基,分子量35.339kd,蛋白理论等电点为8.33。将该表1中seq id no:1所示的核苷酸序列命名为aosap8_p基因。
[0116]
实施例3:芦笋aosap8_p基因的功能验证
[0117]
(1)紫芦笋中aosap8_p基因的组织特异性表达
[0118]
紫色芦笋“紫色激情”两性株、雄株、雌株种植于云南农业大学后山农场,在芦笋长出3~4株主茎后,取各组植株根、茎、花,液氮速冻,保存于-70℃冰箱,用于rna提取。
[0119]
采用ctab法提取紫色芦笋总rna,反转录得到cdna后,以aosap8-qf和aosap8-qr为引物,进行qrt-pcr分析。aosap8-qf和aosap8-qr的碱基序列如seq id no:8所示,(引物
aosap8-qf和引物aosap8-qr的碱基序列根据seq id no:2设计而得)。qrt-pcr反应体系为:cdna1μl,2
×
sybr green mix 12.5μl,10mmaosap8_pf2引物1μl,10mmaosap8_pr2引物1μl,ddh2o9.5μl,总计25μl体系。反应程序为:95℃预变性30s,95℃变性15s,60℃退火35s,72℃延伸40s,35个循环;72℃5min。
[0120]
目的基因qrt-pcr分析结果,结果表明,aosap8_p基因在雌性中无表达,在雄性和两性紫芦笋中的根、茎、和花中均有表达,但在两性和雄性紫芦笋中的表达模式又有差异。aosap8_p基因在花中的表达不是最高的,在雄株中,茎中表达量最高,其次是花中,根中表达量较少;两性株的根中表达量最高,其次是茎,花中表达量最少。两性株跟雄株的同一组织部位表达量比较显示雄花高于两性花,雄茎高于两性茎,两性根高于雄根。以上结果说明aosap8_p基因只在雄性和两性紫芦笋中表达。
[0121]
紫芦笋不同组织中aosap8_p基因的相对表达量中,***表示极显著差异(p《0.001)。
[0122]
(2)利用aosap8_p基因获得抗旱性的植物
[0123]
植物表达载体pbi121-aosap8_p的制备
[0124]
将引物aosap8_pf和aosap8_pr分别引入限制性内切酶位点,命名为引物aosap8_p-orf-f和引物aosap8_p-orf-r,引物aosap8_pf3的碱基序列如seq id no:4所示,所述引物aosap8_p-orf-f和aosap8_p-orf-r的碱基序列seq id no:4所示(引物aosap8_p-orf-f和引物aosap8_p-orf-r的碱基序列根据seq id no:1设计而得)。
[0125]
下面结合实验结果对本发明的效果作进一步描述。
[0126]
如图3aosap8_p基因cdna的pcr扩增所示,m:dl2000 dnamarker;1-6:目的基因cdna的pcr产物。
[0127]
pgem-aosap8_p克隆载体构建与测序验证:高保真dna聚合酶扩增后的平末端片段要3’端加加poly尾,才能与3’端为粘性末端的t载体连接。将目的片段胶回收后,进行加a反应,然后与pgem-teasy克隆载体连接并转化dh5α感受态,经菌液pcr检测后送阳性克隆测序,如图4pgem-aosap8_p克隆载体的菌液pcr,m:dl2000 dnamarker;1-17:菌液pcr产物。
[0128]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。