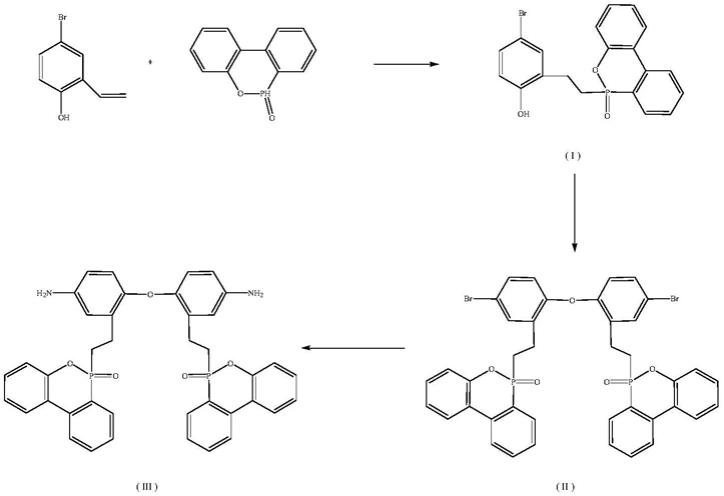
1.本发明属于辅助生殖技术领域,更具体地,本发明涉及雌性生殖干细胞转分化至功能精子的方法及应用。
背景技术:
2.国际卫生组织规定,男性的精子每毫升不低于2千万,如果低于2千万就归为少精症。少精症的病因较多,包括内源性因素如精索静脉曲张、隐睾、生殖道感染、自身免疫产生抗精子抗体。一些外源性因素也会引起少精症。目前也有一些为病因不明的特发性少精症。少精症导致男性不育,越来越多人受此困扰,生育方面有很大影响。因此,人工诱导体外产生精子,是少精症治疗的一个可行性方案。
3.干细胞是一类具有自我更新及多向分化潜能的细胞群体的总称。按干细胞的分化潜能的大小可以分为全能干细胞,多能干细胞和单能干细胞。胚胎干细胞(embryonic stem cell,es/esc细胞)是一种从早期胚胎或者原始性腺中分离出来的细胞,可以向多种组织进行分化,同时在体外还具有无限增殖的能力。胚胎干细胞作为一种未分化细胞,具有全能性,也就是发育为各种不同细胞的特性。其中人类的胚胎干细胞可以分化为多种细胞组织,包括滋养层细胞、神经细胞、神经胶质细胞、造血细胞、心肌细胞等。从形态上来讲,胚胎干细胞的细胞核较大而细胞质较少,且细胞结构比较简单,其中胚胎干细胞的细胞核中大多为常染色质。胚胎干细胞是一种高度未分化细胞。它具有发育的全能性,能分化出成体动物的所有组织和器官,包括生殖细胞。然而,由胚胎干细胞分化获得长形精子细胞存在技术难度,难以获得高活性、带有完整的尾部结构的长形精子细胞。
4.雌性生殖干细胞是从动物卵巢内分离获得的一类干细胞。以往科学家一直认定,雌性哺乳动物一出生,卵母细胞就停止产生,从此只会不断减少;而本发明人此前的工作中,在成年哺乳动物的卵巢中发现了雌性生殖干细胞,可以不断分化出卵母细胞。
5.然而,雌性生殖干细胞能否在体外发育为功能性精子细胞及其体外发育特征尚未见报道。
技术实现要素:
6.本发明的目的在于提供一种雌性生殖干细胞转分化至功能精子的方法及应用
7.在本发明的第一方面,提供一种体外制备功能性精子的方法,包括:以雌性生殖干细胞为出发细胞,将之与睾丸体细胞混合,进行预培养以及诱导分化;从诱导分化产物中生成功能性精子。
8.在一个或多个实施方式中,所述预培养包括:将雌性生殖干细胞与睾丸体细胞以1:10~10:1,较佳地1:5~5:1,更佳地1:2~2:1的比例混合,在细胞培养基中进行培养;较佳地所述细胞培养基为含血清的培养基;较佳地所述细胞培养基包括dmem培养基。
9.在一个或多个实施方式中,用于混合培养的培养基为液体培养基(培养液)。
10.在一个或多个实施方式中,用于混合培养的培养基中含有5%~15%胎牛血清。
11.在一个或多个实施方式中,所述雌性生殖干细胞与睾丸体细胞诱导分化包括:第1阶段诱导:以knockout血清替代物、bmp-2、bmp-4、bmp-7、全反式维甲酸和activin a诱导;第2阶段诱导:以knockout血清替代物、睾酮、fsh和垂体提取物诱导。
12.在一个或多个实施方式中,第1阶段中,各组分用量包括:knockout血清替代物20
±
4%(v/v)、bmp-2 20
±
5ng/ml、bmp-4 20
±
5ng/ml、bmp-7 20
±
5ng/ml、全反式维甲酸1
±
0.4μm和activin a 100
±
40ng/ml。
13.在一个或多个实施方式中,第2阶段中,各组分用量包括:knockout血清替代物20
±
4%,睾酮10
±
3mm、fsh 200
±
30ng/ml和垂体提取物50
±
15mg/ml。
14.在一个或多个实施方式中,各个组分被添加于细胞培养基中;更佳地,所述细胞培养基为memα培养基。
15.在一个或多个实施方式中,用于诱导的培养基为液体培养基(培养液)。
16.在一个或多个实施方式中,第1阶段中,适时更换新鲜培养基;较佳地1-2天更换一次新鲜培养基;更佳地每天更换一次新鲜培养基。
17.在一个或多个实施方式中,第2阶段中,适时更换新鲜培养基;较佳地1-2天更换一次新鲜培养基;更佳地每天更换一次新鲜培养基。
18.在一个或多个实施方式中,所述的分离后睾丸体细胞中不含有生殖细胞,其不会产生精子细胞。
19.在一个或多个实施方式中,在动物实验时,所述的睾丸体细胞分离自kit
w/wv
小鼠。
20.在一个或多个实施方式中,第1阶段中,knockout血清替代物优选为20
±
3%、更优选为20
±
2%,更优选为20
±
1%。
21.在一个或多个实施方式中,第1阶段中,bmp-2优选为20
±
4ng/ml,更优选为20
±
3ng/ml,优选为20
±
2ng/ml,优选为20
±
1ng/ml。
22.在一个或多个实施方式中,第1阶段中,bmp-4优选为20
±
4ng/ml,更优选为20
±
3ng/ml,优选为20
±
2ng/ml,优选为20
±
1ng/ml。
23.在一个或多个实施方式中,第1阶段中,bmp-7优选为20
±
4ng/ml,更优选为20
±
3ng/ml,优选为20
±
2ng/ml,优选为20
±
1ng/ml。
24.在一个或多个实施方式中,第2阶段中,knockout血清替代物优选为20
±
3%、更优选为20
±
2%,更优选为20
±
1%。
25.在一个或多个实施方式中,第2阶段中,睾酮优选为10
±
2mm,更优选10
±
1mm。
26.在一个或多个实施方式中,第2阶段中,fsh优选为200
±
20ng/ml,更优选为fsh 200
±
15ng/ml,更优选为fsh 200
±
10ng/ml,更优选为fsh 200
±
5g/ml。
27.在一个或多个实施方式中,第2阶段中,垂体提取物优选50
±
12mg/ml,更优选50
±
10mg/ml,更优选50
±
5mg/ml,更优选50
±
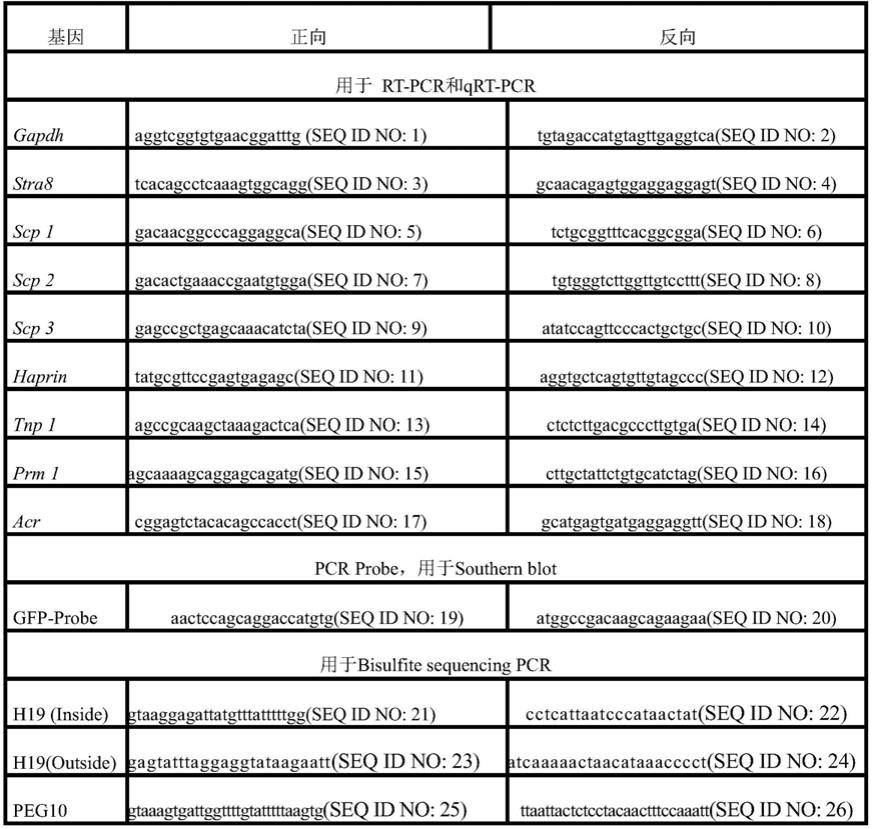
3mg/ml。
28.在一个或多个实施方式中,所述的从诱导分化产物中生成功能性精子包括:观测诱导分化产物,从中分离末端携带尾部结构的功能性精子。
29.在一个或多个实施方式中,所述雌性生殖干细胞包括如下方法培养(扩增):将雌性生殖干细胞置于胚胎成纤维细胞(sto细胞)饲养层,在含有丙酮酸钠、l-谷氨酰胺、β-巯基乙醇、非必需氨基酸、表皮生长因子、人碱性成纤维细胞生长因子、神经胶质细胞生长因子、白血病抑制因子的细胞培养基中培养;较佳地,所述细胞培养基包括memα培养基;较佳
地所述细胞培养基为含血清的培养基。
30.在一个或多个实施方式中,各个组分的用量包括:1
±
0.3mm丙酮酸钠、2
±
0.6mm l-谷氨酰胺、50
±
15μmβ-巯基乙醇、1
±
0.3mm非必需氨基酸,20
±
5ng/ml表皮生长因子,10
±
3ng/ml人碱性成纤维细胞生长因子,10
±
3ng/ml神经胶质细胞生长因子,10
±
3ng/ml白血病抑制因子;
31.较佳地,各个组分被添加于细胞培养基中;更佳地,所述细胞培养基为memα培养基;更佳地,所述的细胞培养基为含血清培养基。
32.在一个或多个实施方式中,用于雌性生殖干细胞培养的细胞培养基为液体培养基(培养液)。
33.在一个或多个实施方式中,用于雌性生殖干细胞培养的细胞培养基中含有5%~15%胎牛血清。
34.在一个或多个实施方式中,丙酮酸钠为1
±
0.2mm丙酮酸钠,更优选的1
±
0.1mm。
35.在一个或多个实施方式中,l-谷氨酰胺为2
±
0.4mm,更优选的2
±
0.2mm,更优选的2
±
0.1mm。
36.在一个或多个实施方式中,β-巯基乙醇为50
±
12μm,优选地50
±
10,更优选地50
±
5;更优选地50
±
2。
37.在一个或多个实施方式中,非必需氨基酸1
±
0.2mm,优选地1
±
0.1mm。
38.在一个或多个实施方式中,表皮生长因子20
±
3ng/ml,优选地20
±
1ng/ml。
39.在一个或多个实施方式中,人碱性成纤维细胞生长因子10
±
2ng/ml,优选地10
±
1ng/ml。
40.在一个或多个实施方式中,神经胶质细胞生长因子10
±
2ng/ml,优选地10
±
1ng/ml。
41.在一个或多个实施方式中,白血病抑制因子10
±
2ng/ml,优选地10
±
1ng/ml。
42.在本发明的另一方面,提供一种雌性生殖干细胞诱导与睾丸体细胞混合诱导培养的产物或由其产生的功能性精子,其由前面所述的方法制备获得;较佳地,其具有选自下组的特征:所述的功能性精子末端携带尾部结构;诱导体系中雄性生殖细胞减数分裂标志物呈现阳性:stra8,scp1,scp2,scp3;精子形成标志物呈现阳性;较佳地所述标志物包括:prm1,acrosin,tnp1,haprin和/或acrosin;所述的功能性精子为单倍体核型;和/或,注射至卵胞浆中后,所述的功能性精子启动发育,移植活体子宫能生产子代。
43.在一个或多个实施方式中,该雌性生殖干细胞诱导与睾丸体细胞混合诱导培养的产物或由其产生的功能性精子本身不能独立地繁殖为动物。
44.在本发明的另一方面,提供雌性生殖干细胞和睾丸体细胞的应用,用于体外制备功能性精子。
45.在本发明的另一方面,提供一种制备动物子代的方法,包括:(1)以前面所述的方法制备功能性精子;(2)将(1)的功能性精子引入到卵细胞胞浆内(icsi),使卵子受精,体外发育(如发育至2细胞期、4细胞期或囊胚期);较佳地,在体外发育至适当阶段移植至子宫、着床、发育为健康后代。
46.在一个或多个实施方式中,所述的动物包括人。
47.在一个或多个实施方式中,所述的动物包括非人哺乳动物,较佳地包括(但不限
于):啮齿类动物(包括小鼠,大鼠,仓鼠等),非人灵长类动物(如猴,猩猩等),家畜(如牛,羊,狗,猪,兔等)。
48.在一个或多个实施方式中,所述的动物包括濒危动物。
49.在本发明的另一方面,提供一种用于体外制备功能性精子的试剂盒,其中包括:雌性生殖干细胞;睾丸体细胞;预培养剂,包括细胞培养基;较佳地所述细胞培养基为含血清的培养基;较佳地所述细胞培养基包括dmem培养基;第1阶段诱导剂,包括knockout血清替代物、bmp-2、bmp-4、bmp-7、视黄酸和activin a;较佳地各组分用量包括:knockout血清替代物20
±
4%(v/v)bmp-2 20
±
5ng/ml、bmp-4 20
±
5ng/ml、bmp-7 20
±
5ng/ml、视黄酸1
±
0.4μm和activin a 100
±
40ng/ml;第2阶段诱导剂,包括knockout血清替代物(ksr)、睾酮(t)、卵泡刺激素(fsh)和垂体提取物(bpe);较佳地各组分用量包括:knockout血清替代物20
±
4%,睾酮10mm、fsh200ng/ml和垂体提取物50mg/ml。
50.在一个或多个实施方式中,诱导剂的各个组分被添加于细胞培养基中。
51.在一个或多个实施方式中,所述的试剂盒中还含有培养和繁殖雌性生殖干细胞的培养基/试剂,和/或用于分离和维持睾丸体细胞的培养基/试剂。
52.本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
53.图1、本发明的由雌性生殖干细胞分化为精子细胞的分化体系示意图。
54.图2、雌性生殖干细胞体外精子发生;
55.a)体外转分化体系中雌性生殖干细胞发育特征形态图;
56.b)免疫荧光法观察联会复合体的形成(scp1/scp3)及减数分裂过程(细线期,偶线期,粗线期,双线期);
57.c)rt-pcr检测培养产物表达雄性减数分裂(stra8,scp1,scp2,scp3)、精子形成标志物(prm1,acrosin,tnp1,haprin)的情况。
58.d)流式细胞仪分析单倍体;
59.e)核型分析单倍体;
60.f)免疫荧光精子形成标志物acrosin。
61.图3、精子细胞(雌性生殖干细胞体外分化而来的)的功能鉴定。
62.a),b),c),d),e),f),g),h)从精子样细胞注射至卵胞浆中体外发育过程(2细胞,4细胞,囊胚);
63.i)2细胞移植至小鼠子宫可出生后代,移植后出生小鼠自然分娩;
64.j)sourthern blot法鉴定出生后代含gfp序列;
65.k)重亚硫酸盐甲基化测序鉴定出生后代印迹基因甲基化状态未有改变。
具体实施方式
66.本发明人在深入研究的基础上,建立了一种在体外诱导雌性生殖干细胞分化的方法体系,从而获得精子细胞(较佳地其为单倍体的精子细胞)。本发明首次提出体外诱导雌性生殖干细胞,其能够分化成单倍体精子细胞。该方法可为临床及科研提供精子细胞源,为
辅助生殖技术领域提供了新的途径。
67.术语
68.如本文所用,术语“细胞培养基”在本发明中为“基础培养基”,其为普遍适合于细胞(干细胞)培养的,能为细胞(干细胞)提供足够营养成分的、满足细胞生长所需的培养基。
69.如本文所用,所述的“雌性生殖干细胞”或“卵巢雌性生殖干细胞”可互换使用。
70.如本文所用,所述的“哺乳动物”是脊索动物门(chordata)脊椎动物亚门(vertebrata)哺乳纲(mammalia)的动物。所述的哺乳动物包括但不限于灵长类动物(包括人),偶蹄目动物,食肉目动物,啮齿目动物等。本发明所述的哺乳动物包括人,也包括非人哺乳动物。所述的非人哺乳动物例如但不限于包括啮齿类动物(具体如小鼠、大鼠),灵长类动物(具体如猿、猴、猩猩),家畜(具体如兔、狗、兔、猪、牛、羊、马)等等。
71.在本发明的一些实施方式中,以鼠作为模式生物,和人类相比,它无论在基因组的组成、个体的发育、代谢方式、器官解剖、疾病发病机制等都和人类非常接近;因此,本发明列举的一些适用于鼠的情况可以毫无疑义地适用于人等其它哺乳动物。
72.如本文所用,所述的“含有”,“具有”或“包括”包括了“包含”、“主要由
……
构成”、“基本上由
……
构成”、和“由
……
构成”;“主要由
……
构成”、“基本上由
……
构成”和“由
……
构成”属于“含有”、“具有”或“包括”的下位概念。
73.如本文所用,“功能性”是指根据所描述的方法获得的精子具有与所预期的相同或相似的功能。
74.培养及诱导方法
75.本发明中首次以雌性生殖干细胞作为出发细胞、与睾丸体细胞混合,成功诱导产生精子细胞。根据雌性生殖干细胞的特点,本发明人进行了深入研究实验,诱导的培养及诱导的方案。本发明的培养及诱导方法,包含雌性生殖干细胞的以及睾丸体细胞的分离,混合,预培养,第1阶段诱导及第2阶段诱导。在睾丸体细胞组成的微环境、细胞因子(激活素、bmp2、bmp4、bmp7、fsh、bpe、睾酮)、全反式维甲酸(ra)等体外培养条件的作用下,无y染色体的雌性生殖干细胞的表观遗传状态和基因表达发生显著性改变,可完成雄性减数分裂,发育成功能性精子样细胞。本发明的由雌性生殖干细胞分化为精子细胞的分化体系示意图如图1。
76.因此,本发明提供了一种体外制备功能性精子的方法,包括:以雌性生殖干细胞为出发细胞,将之与睾丸体细胞混合,进行预培养以及诱导分化;从诱导分化产物中生成功能性精子。在培养期间,还可以根据培养情况,更换新鲜的培养基。
77.本发明中,所述的雌性生殖干细胞可以是来自动物体的雌性生殖干细胞,也可以来自本领域在先技术已经扩增培养/传代的雌性生殖干细胞。例如,本发明人的在先研究中已经扩增了雌性生殖干细胞,可以应用这些体外扩增获得的雌性生殖干细胞。优选地,运用来自动物体的雌性生殖干细胞及其传代的细胞。
78.作为本发明的优选方式,所述雌性生殖干细胞包括如下方法培养(扩增)获得的雌性生殖干细胞:将雌性生殖干细胞置于胚胎成纤维细胞(sto细胞)饲养层,在含有丙酮酸钠、l-谷氨酰胺、β-巯基乙醇、非必需氨基酸、表皮生长因子、人碱性成纤维细胞生长因子、神经胶质细胞生长因子、白血病抑制因子的细胞培养基中培养。
79.本发明中,所述的睾丸体细胞优选地为分离后维持稳定、来自无生殖细胞的动物。
所述的睾丸体细胞分离自kit
w/wv
小鼠。
80.在本发明的优选方式中,所述预培养包括:将雌性生殖干细胞与睾丸体细胞以1:10~10:1,较佳地1:5~5:1,更佳地1:2~2:1的比例混合,进一步更佳地以1:1的比例混合。在细胞培养基中进行培养;较佳地所述细胞培养基为含血清的培养基。较佳地,用于混合培养的培养基为液体培养基(培养液)。较佳地,用于混合培养的培养基中含有胎牛血清。本发明人发现,根据雌性生殖干细胞的特点,这一阶段的混合培养非常显著地促进后续诱导培养阶段的效率;而若是直接进行诱导培养,则转化效率相对低、诱导阶段耗时更长。
81.在本发明的优选方式中,所述雌性生殖干细胞与睾丸体细胞诱导分化包括:第1阶段诱导:以knockout血清替代物(knockout serum replacement,ksr)、bmp-2、bmp-4、bmp-7、全反式维甲酸和activin a诱导;第2阶段诱导:以knockout血清替代物、睾酮、fsh和垂体提取物诱导。根据雌性生殖干细胞的特点,本发明人优化了组分的用量,例如,knockout血清替代物优选地为20
±
4%,本发明人发现了knockout血清替代物若是在10%或更低时,其诱导阶段后的细胞产物精子形成标志物的表达几乎无法测得。又例如,垂体提取物优选地为50
±
15mg/ml,若是其在较低的水平时,则导致诱导效率很低。
82.除非另外说明,本发明中用于培养或用于诱导的培养基为液体培养基(培养液)。
83.所述的从诱导分化产物中生成功能性精子包括:观测诱导分化产物,从中分离末端携带尾部结构的功能性精子。可以理解的是,带有尾部结构的精子与天然的精子在形态上更为接近,活力更好。
84.较佳地,各个组分的用量包括:1mm丙酮酸钠、2mm l-谷氨酰胺、50μmβ-巯基乙醇、1mm非必需氨基酸,20ng/ml小鼠表皮生长因子,10ng/ml人碱性成纤维细胞生长因子,10ng/ml神经胶质细胞生长因子,10ng/ml小鼠白血病抑制因子;
85.较佳地,各个组分被添加于细胞培养基中;更佳地,所述细胞培养基为memα培养基;更佳地,所述的细胞培养基为含血清培养基。
86.运用本发明的培养方法以及培养基,可以通过二维或三维培养体系培养。
87.在本发明的具体实施例中,首先获得雌性生殖干细胞以及睾丸体细胞、将它们混合,然后通过预培养以及分阶段调整培养基中的细胞生长因子及其他组分实现雌性生殖干细胞转分化为精子细胞。分阶段培养的前期(第1阶段)是用以促进增殖以及诱导分化为主的成分发挥作用,后期是用以成熟分化为主的成分发挥作用。本发明在体外培养约16-18天(优选地17天)内将雌性生殖干细胞诱导分化为精子细胞,并通过一系列体外实验(细胞染色,rt-pcr、流式鉴定单倍体细胞,免疫荧光法观察联会复合体的形成及减数分裂过程等)以及动物体内实验验证所获精子细胞的特征和功能。
88.本发明还提供了一种制备动物的方法,包括:(1)如前述方法制备功能性精子;(2)将(1)的功能性精子引入到卵细胞胞浆内,使卵子受精,体外发育(如发育至2细胞期、4细胞期或囊胚期);较佳地,在体外发育至适当阶段移植至子宫、着床、发育为动物。
89.在本发明的具体实施例中,成功地从雌性生殖干细胞诱导分化出功能性的精子(精子样细胞)。体外转分化体系中雌性生殖干细胞可表达雄性减数分裂、精子形成标志物stra8,scp1,scp2,scp3,prm1,acrosin,tnp1,haprin等,免疫荧光法可观察到联会复合体的形成(scp1/scp3)及减数分裂过程(细线期,偶线期,粗线期,双线期)。精子样细胞注射至卵胞浆中体外发育可致囊胚,2细胞移植至小鼠子宫可出生后代。移植后出生小鼠自然分
娩。sourthern blot法鉴定出生后代含gfp序列。重亚硫酸盐甲基化测序鉴定出生后代印迹基因甲基化状态未有改变。
90.本发明的方法的几个主要特点和优势如下:第一,本发明在整个培养体系采用人源细胞生长因子、化学分子,不引入涉及重编程或转分化功能的外源性基因(但可以引入报告基因),因此可以避免外源基因对原干细胞的基因组稳定性的干扰和外源细胞相关的移植安全隐患。第二,用雌性生殖干细胞制备获得的精子细胞带有尾巴状结构、活性良好。
91.培养基
92.本发明人提供了用于预培养以及各阶段诱导培养的培养基,包括:预培养培养基,其可为基础培养基,其中添加血清;第1阶段培养基,其在细胞培养基基础上,添加ksr、bmp-2、bmp-4、bmp-7、视黄酸和activin a;第2阶段培养基,其在细胞培养基基础上,添加ksr、睾酮、fsh和垂体提取物。
93.除了本发明实施例中所列举的具体细胞因子或化学组分以外,本领域公知的与它们具有相同或相近功能的细胞因子或化学组分也可被应用于本发明中。所述具体列举的成分的类似物、同功能蛋白(如生长因子的同功能蛋白)或化合物、诱导相同靶点的等效化合物、类似物、衍生物和/或它们的盐、水合物或前体,也可用于替换上述具体列举的成分,以实现同样的技术效果。这些类似物、同功能蛋白或化合物也应被包含在本发明中。化合物的类似物包括但不限于:化合物的异构体、外消旋体。化合物具有一个或多个不对称中心。所以,这些化合物可以作为外消旋的混合物、单独的对映异构体、单独的非对映异构体、非对映异构体混合物、顺式或反式异构体存在。所述的“化合物的前体”指当用适当的方法施用或处理后,该化合物的前体在培养基中可转变成上述任一化合物的一种化合物,或上述任一化合物的一种化合物所组成的盐或溶液。
94.作为本发明的优选方式,所述的培养基中还加入用于预防细胞培养的细菌污染,特别是革兰氏阳性和阴性细菌污染的成分,例如一些抗生素。
95.所述的细胞培养基(基础培养基)例如可以是但不限于:dmem/f12、mem、dmem、rpmi1640、neuronal basal或fischers等。应理解,本领域技术人员熟悉所述的基础细胞培养基的配制或购买途径。而本发明的实施例中则提供了的优选的细胞培养基。
96.本发明还提供了一种试剂盒,其中含有本发明所述的预培养培养基,第1阶段培养基,第2阶段培养基;其中还含有出发细胞,包括雌性生殖干细胞和睾丸体细胞。较佳地,在需要的情况下,所述的试剂盒中还含有培养和扩增雌性生殖干细胞的培养基/试剂,以及用于分离和维持睾丸体细胞的培养基/试剂。较佳地,所述试剂盒中还包含使用说明书,从而便于本领域人员在研究中或在临床上应用。
97.基于本发明的新发现,本发明还提供了一种由本发明所述的方法获得的雌性生殖干细胞培养产物以及由其产生的精子细胞。本发明人发现,本发明的方法获得的功能性精子末端携带尾部结构,呈现了良好的状态。同时,所述精子细胞具有典型的精子形成标志物,包括:prm1,acrosin,tnp1,haprin和/或acrosin等;且所述的功能性精子为单倍体核型。
98.从细胞培养物中富集或分离纯化细胞的方法也是本领域人员熟知的,例如可基于精子细胞的形态特征来进行富集;或基于精子细胞所表达的特殊蛋白(如albumin等)或分子标记来选择收集(例如采用特异性抗体或配体)。作为一种可选的实施方式,可利用流式
细胞分选技术,通过精子细胞表面的分子标记,将细胞分离纯化出来。
99.本发明培养的精子细胞可应用于辅助生殖。根据本发明的实施例,其在注射至卵胞浆中后,可顺利地继续体外发育过程,在适当的时间移植受体动物子宫后,可以顺利产生后代。
100.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社中所述的条件,或按照制造厂商所建议的条件。
101.材料和方法
102.1、实验动物
103.kit
w/wv
小鼠购自杰克逊实验室(美国)。
104.c57bl/6小鼠购自上海斯莱克实验动物有限责任公司。
105.2、rt-pcr
106.从细胞中抽提总rna,使用ii q rt supermix( gdna wiper)试剂盒(vazyme,r223-01)按照说明书进行反转录。使用taq聚合酶(takara,r10t1m)进行rt-pcr,引物见表1,进行35个循环。pcr扩增的gapdh基因用作内参。使用2%琼脂糖凝胶进行电泳,dna条带用溴化乙锭(eb)染色。获得pcr产物,通过测序确定该条带是否为相应的基因。
107.表1、用于分析雌性生殖干细胞向精子分化基因表达情况pcr引物
[0108][0109]
3、精母细胞表面铺展技术
[0110]
精母细胞表面铺展技术用于鉴定体外精子发生过程中产生的精母细胞。用0.05%胰蛋白酶(gibco)将细胞消化成单细胞悬液,然后用磷酸盐缓冲生理盐水(pbs)在室温下洗涤。然后将细胞置于新鲜制备的缓冲液(30mm tris,ph 8.2,50mm蔗糖,17mm柠檬酸,5mm edta,0.5mm dtt,0.1mm pmsf,ph 8.2-8.4)中30-60min。细胞经离心(350g,5min)后加入100mm蔗糖(ph8.2)20min。最后将细胞悬浮液置于含有1%多聚甲醛pfa(ph 9.2)和0.15%triton x-100pbs的载玻片上,并将载玻片置于高湿度的密闭箱中过夜干燥。
[0111]
4、免疫荧光染色
[0112]
用4%pfa固定培养细胞30min,用0.1%tween 20洗涤3次(pbst),然后在1%triton x-100pbs中孵育15min(对于用pmsf铺展的细胞,省略了这一步骤)。用5%山羊血清在pbs中室温下封闭细胞或载玻片30min,然后用pbs稀释的一抗在4℃孵育过夜。一抗稀释比例:mvh(1:200;abcam),fragilis(1:100,abcam),oct4(1:100,abcam),scp3(1:200,santa cruz),scp1(1:100,abcam)和acr(1:200,santa cruz)。
[0113]
孵育过夜后,用pbs洗3次,然后在37℃下用二抗(1:200)孵育,用pbs洗3次,接着用dapi染细胞核,并用荧光显微镜观察荧光信号。
[0114]
5、卵胞浆单精子显微注射(icsi)
[0115]
用bdf1小鼠作为卵母细胞供体。采用流式细胞分选法对精子样细胞(gfp阳性细胞或者单倍体细胞)进行分选。将这些分选后的精子样细胞去除细胞质后,注射到无卵丘卵母细胞中。荧光显微镜观察荧光蛋白在不同发育阶段的变化。将培养24h后达到2细胞阶段的胚胎移植到胚胎期0.5天cd1假妊娠母鼠输卵管中或在ksomaa培养基中进一步培养至囊胚期(37℃,5%co2。移植后出生小鼠自然分娩。sourthern blot法鉴定出生后代含gfp序列。重亚硫酸盐甲基化测序鉴定出生后代印迹基因甲基化状态未有改变。
[0116]
实施例1、雌性生殖干细胞诱导分化为精子
[0117]
1、小鼠雌性生殖干细胞分离
[0118]
从新生小鼠卵巢(出生后6天,c57bl/6)中分离、纯化、体外培养雌性生殖干细胞;从β-actin-gfp转基因小鼠中分离、纯化雌性生殖干细胞(方法参考:zou,k.,z.yuan,z.yang,et al.,production of offspring from a germline stem cell line derived from neonatal ovaries.nat cell biol,2009.11(5):p.631-636)。雌性生殖干细胞可以获得野生型小鼠;在需要的情况下,以带有gfp的小鼠用于体外分化细胞的示踪或后代小鼠的示踪。
[0119]
将雌性生殖干细胞在小鼠胚胎成纤维细胞(sto细胞)饲养层上,在含有10%胎牛血清(fbs)、1mm丙酮酸钠(amresco)、2mm l-谷氨酰胺(amresco)、50μmβ-巯基乙醇(biotech)、1mm非必需氨基酸(neaa)(invitrogen),20ng/ml小鼠表皮生长因子(peprotech),10ng/ml人碱性成纤维细胞生长因子(bfgf)(peprotech),10ng/ml小鼠神经胶质细胞生长因子(gdnf)(peprotech),10ng/ml小鼠白血病抑制因子(lif)(santa cruz)的memα培养基中培养。
[0120]
通过免疫荧光和rt-pcr鉴定雌性生殖干细胞。
[0121]
2、kit
w/wv
小鼠睾丸体细胞分离
[0122]
收集并提取出生后2-7天kit
w/ww
小鼠睾丸体细胞(kit
w/ww
雄性睾丸中缺乏生殖细胞,可确保分化精子样细胞并非来源于kit
w/ww
雄性小鼠的睾丸细胞)。小鼠颈椎脱臼处死,无菌取其睾丸,去囊,切成小片,用胶原酶ⅳ(1mg/ml,sigma)在37℃水浴中消化10min,再0.05%胰蛋白酶(gibco)消化6min。
[0123]
用72μm细胞筛过滤后获得单细胞悬液,离心收集细胞。
[0124]
3、转分化
[0125]
3-1转分化1
[0126]
从第0天至第6天,用含20%knockout血清替代物(简称血清替代物或ksr)(gibco)、bmps-2/4/7(各20ng/ml,r&d)、全反式维甲酸(1μm,sigma)和activin a(100ng/ml,r&d)的memα培养基中诱导转分化,每天换液一次。
[0127]
紧接着,从第7天到第14天,在含有20%血清替代物(ksr)(gibco)、10mm睾酮、200ng/ml fsh、50mg/ml垂体提取物(bpe,stem cell)的memα培养液中诱导分化,每天换液一次。细胞在5%co2中培养,37℃诱导分化。
[0128]
该过程将小鼠睾丸体细胞与雌性生殖干细胞进行直接分阶段诱导。然而本发明人发现,在诱导过程中转化效率低、耗时长,14天后的细胞产物精子形成标志物prm1,acrosin,tnp1,haprin的表达比较低。
[0129]
3-2转分化2
[0130]
(1)混合培养
[0131]
将kit
w/wv
小鼠睾丸体细胞与雌性生殖干细胞按1:1的比例直接混合,在含10%fbs的dmem培养液中培养3天。
[0132]
(2)诱导分化
[0133]
从第0天至第6天,用含10%血清替代物(ksr)(gibco)、bmps-2/4/7(各20ng/ml,r&d)、全反式维甲酸(1μm,sigma)和activin a(100ng/ml,r&d)的memα培养基中诱导转分化,每天换液一次。
[0134]
紧接着,从第7天到第14天,在含有10%血清替代物(ksr)(gibco)、10mm睾酮、200ng/ml fsh、50mg/ml垂体提取物(bpe,stem cell)的memα培养液中诱导分化,每天换液一次。细胞在5%co2中培养,37℃诱导分化。
[0135]
该过程将小鼠睾丸体细胞与雌性生殖干细胞先进行预培养,之后进行分阶段诱导。然而,本发明人发现14天后的细胞产物精子形成标志物prm1,acrosin,tnp1,haprin的表达比较低。
[0136]
3-3、转分化3
[0137]
(1)混合培养
[0138]
将kit
w/wv
小鼠睾丸体细胞与雌性生殖干细胞按1:1的比例直接混合,在含10%fbs的dmem培养液中培养3天。
[0139]
(2)诱导分化
[0140]
从第0天至第6天,用含20%血清替代物(ksr)(gibco)、bmps-2/4/7(各20ng/ml,r&d)、全反式维甲酸(1μm,sigma)和activin a(100ng/ml,r&d)的memα培养基中诱导转分化,每天换液一次。
[0141]
紧接着,从第7天到第14天,在含有20%血清替代物(ksr)(gibco)、10mm睾酮、200ng/ml fsh、50ug/ml垂体提取物(bpe,stem cell)的memα培养液中诱导分化,每天换液一次。细胞在5%co2中培养,37℃诱导分化。
[0142]
该过程将小鼠睾丸体细胞与雌性生殖干细胞先进行预培养,之后进行分阶段诱导。然而,本发明人发现,在诱导过程中转化效率相对低,分化过程中产生的细胞不带有尾巴。
[0143]
3-4、转分化4
[0144]
(1)混合培养(与培养)
[0145]
将小鼠睾丸体细胞与雌性生殖干细胞按1:1的比例直接混合,在含10%fbs的dmem培养液中培养3天。
[0146]
(2)诱导分化
[0147]
从第0天至第6天,用含20%血清替代物(ksr)(gibco)、bmps-2/4/7(各20ng/ml,r&d)、全反式维甲酸(1μm,sigma)和activin a(100ng/ml,r&d)的memα培养基中诱导转分化,每天换液一次。
[0148]
紧接着,从第7天到第14天,在含有20%血清替代物(ksr)(gibco)、10mm睾酮、200ng/ml fsh、50mg/ml垂体提取物(bpe,stem cell)的memα培养液中诱导分化,每天换液一次。细胞在5%co2中培养,37℃诱导分化。
[0149]
该过程将小鼠睾丸体细胞与雌性生殖干细胞先进行预培养,之后进行分阶段诱
导。诱导过程转化效率高且精子形成标记物非常显著,能够高效形成功能性精子,具体见后续实施例2。
[0150]
实施例2、实施例1中3-4诱导分化产物的验证
[0151]
(1)细胞形态
[0152]
体外转分化体系中雌性生殖干细胞发育形态图如图2a。尤其出乎意料的是,本发明的方法诱导后形成的精子,其存在明晰的尾巴结构,这是现有的技术中无法实现的。
[0153]
(2)联会复合体的形成及减数分裂过程
[0154]
获取分化过程中(d6-d10)的细胞,利用免疫荧光法观察联会复合体的形成及减数分裂过程。
[0155]
结果如图2b,可观察到联会复合体的形成(scp1/scp3)及减数分裂过程(细线期,偶线期,粗线期,双线期)。
[0156]
(3)精子形成标志物分析
[0157]
在诱导培养起的d1、d3、d6、d8、d10、d14天,从细胞中抽提总rna,利用rt-pcr分析表达雄性减数分裂(stra8,scp1,scp2,scp3)、精子形成标志物(prm1,acrosin,tnp1,haprin)等。
[0158]
rt-pcr检测结果如图2c,可见随着诱导时间的增加,精子形成标志物相继呈现阳性,证明本发明的方法能够很好地诱导雌性生殖干细胞体外精子形成。
[0159]
(4)单倍体分析
[0160]
对于雌性生殖干细胞体外产生的精子(精子样细胞),本发明人利用流式细胞仪分析其倍性,并以sto细胞、fgsc细胞、fslc细胞,sertoli细胞为对照。结果如图2d,可见所产生的精子为单倍体。
[0161]
对于雌性生殖干细胞体外产生的精子(精子样细胞),本发明人也进行了核型分析,结果呈现单倍体核型,如图2e。
[0162]
雌性生殖干细胞的核型为xx,可以确定所述精子为x精子,从而可以获得雌性后代。
[0163]
(5)免疫荧光分析精子形成标志物
[0164]
除了在mrna水平上以rt-pcr分析精子形成标志物,对于雌性生殖干细胞体外产生的精子(精子样细胞),本发明人也利用免疫荧光来检测精子形成标志物acrosin的存在情况。
[0165]
结果如图2f,可见acrosin呈现阳性。
[0166]
实施例3、实施例1中3-4诱导分化后获得的精子细胞的功能鉴定
[0167]
本发明人将雌性生殖干细胞体外分化而来的精子细胞注射至卵胞浆中,观测其体外发育过程。
[0168]
如图3a~h所示,精子样细胞注射至卵胞浆中后,细胞可起始发育,包括从2细胞、4细胞发育至囊胚。
[0169]
本发明人将处于2细胞时期的细胞移植至小鼠子宫。结果,小鼠可产生后代,移植后小鼠自然分娩,出生后代小鼠,如3i(图中tg指transgene小鼠)。
[0170]
利用sourthern blot法鉴定出生后代,结果可见其含有gfp序列,如图3j。
[0171]
利用重亚硫酸盐甲基化测序鉴定出生后代印迹基因的甲基化状态。结果显示其甲
基化状态未有改变,如图3k。
[0172]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。同时,在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。