1.本发明属于农作物病害诊断分子生物学技术领域,涉及生物检测技术,具体涉及基于一步法反转录聚合酶链式反应(rt-pcr)技术同步检测4种瓜类病毒的引物组、rt-pcr试剂、rt-pcr试剂盒及其应用和方法。
背景技术:
2.目前侵染瓜类作物的主要病害病毒有:黄瓜花叶病毒属(cucumovirus)的黄瓜花叶病毒(cucumbermosaic virus,cmv)、马铃薯y病毒属(potyvirus)的小西葫芦黄花叶病毒(zucchini yellow mosaic virus,zymv)、西瓜花叶病毒(watermelon mosaic virus,wmv)、烟草花叶病毒属(tobamovirus)的黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,cgmmv)、烟草花叶病毒(tobaccomosaic virus,tmv)、豇豆花叶病毒属(comovirus)的南瓜花叶病毒(squash mosaic virus,sqmv)以及近几年新发现的西瓜潜隐病毒(citrullus lanatus cryptic virus,cilcv)等等。由于病毒病害田间多复合侵染,且病毒具有传播途径广泛且变异速度快等特点,加大了病害早期诊断、检测预警以及病毒防控的难度。因此生产上急需一种快速、准确、简便的方法同时鉴定多种病毒病害。
3.随着生物学信息的发展,基于核酸的病毒检测技术在生产中发挥了巨大作用,如聚合酶链式反应(pcr),实时荧光定量pcr等,具有操作简便、特异性高的优点。在一个体系中检测多个靶标,可以通过多重pcr来实现。多重pcr是在一个pcr体系中加入两对及其以上引物,同时进行多个目的片段的扩增,从而区别多种靶标病原物的方法。目前本领域尚且没有可以同步检测sqmv、cgmmv、zymv和cilcv等4种病毒复合侵染瓜类作物的手段,瓜类田间病害的早期诊断和预防措施不够高效与便捷。
技术实现要素:
4.本发明要解决的技术问题为如何在同一体系中同步扩增sqmv、cgmmv、zymv和cilcv等4种病毒,用以检测待测植物样本是否同时感染上述四种病毒中的一种或多种,为瓜类作物病毒早起诊断和预警提供手段;也可以用于确定待测病毒是否为sqmv、cgmmv、zymv和cilcv中的一种或多种。
5.针对上述现有技术缺陷,本发明目的之一在于提供一种能够同步扩增sqmv、cgmmv、zymv和cilcv四种瓜类病毒基因组片段的引物组;本发明目的之二是提供一种能够同步扩增sqmv、cgmmv、zymv和cilcv四种瓜类病毒基因组片段的试剂;本发明目的之三是提供一种能够同步扩增sqmv、cgmmv、zymv和cilcv四种瓜类病毒基因组片段的试剂盒;本发明目的之四是提供上述的引物组、试剂和试剂盒的应用;本发明的目的之五是提供一种检测待测植物材料是否感染sqmv、cgmmv、zymv和cilcv中至少一种瓜类病毒的方法;本发明目的之六是提供一种检测待测病毒是否为sqmv、cgmmv、zymv和cilcv中至少一种瓜类病毒的方法。
6.为了实现上述目的,本发明采用了以下技术方案:
7.第一方面,本发明提供一种能够同步扩增sqmv、cgmmv、zymv和cilcv四种瓜类病毒基因组片段的引物组,所述引物组包括:第一引物对、第二引物对、第三引物对和第四引物对;
8.所述第一引物对中的正向引物sqmv-1224-f,其核苷酸序列如seq id no.1所示;所述第一引物对中的反向引物sqmv-1224-r,其核苷酸序列如seq id no.2所示;
9.所述第二引物对中的正向引物cgmmv-831-f,其核苷酸序列如seq id no.3所示;所述第二引物对中的反向引物cgmmv-831-r,其核苷酸序列如seq id no.4所示;
10.所述第三引物对中的正向引物zymv-440-f,其核苷酸序列如seq id no.5所示;所述第三引物对中的反向引物zymv-440-r,其核苷酸序列如seq id no.6所示;
11.所述第四引物对中的正向引物cilcv-206-f,其核苷酸序列如seq id no.7所示;所述第四引物对中的反向引物cilcv-206-f,其核苷酸序列如seq id no.8所示。
12.第二方面,本发明提供一种能够同步扩增sqmv、cgmmv、zymv和cilcv四种瓜类病毒基因组片段的试剂,所述试剂包括上述引物组。
13.在上述试剂中,作为一种优选实施方式,所述试剂中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔比值为:1:1:2:1或2:2:4:3或2:3:6:5或2:3:7:6;优选地,所述试剂中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔比值为:2:3:5:4。
14.第三方面,本发明提供一种能够同步扩增sqmv、cgmmv、zymv和cilcv四种瓜类病毒基因组片段的试剂盒,所述试剂盒中含有上述引物组或上述试剂;所述试剂盒还包括用于rt-pcr扩增的辅助试剂;
15.优选地,所述辅助试剂还包括反转录酶和/或dna聚合酶;
16.优选地,所述辅助试剂还包括阳性对照样品。
17.第四方面,本发明还提供上述引物组、上述试剂或上述试剂盒在如下a1或a2中的应用:
18.a1、同步检测sqmv、cgmmv、zymv和cilcv四种瓜类病毒;
19.a2、制备同步检测sqmv、cgmmv、zymv和cilcv四种瓜类病毒的制剂。
20.在上述应用中,作为一种优选实施方式,a1是指:检测待测植物材料是否感染sqmv、cgmmv、zymv和cilcv四种瓜类病毒中的四种、任意三种、任意两种或任意一种;或检测待测病毒是否为sqmv、cgmmv、zymv和cilcv四种瓜类病毒中的四种、任意三种、任意两种或任意一种;
21.优选地,a2是指:制备检测待测植物材料是否感染sqmv、cgmmv、zymv和cilcv中至少一种瓜类病毒的制剂;或制备检测待测病毒是否为sqmv、cgmmv、zymv和cilcv中至少一种瓜类病毒的制剂。
22.第五方面,本发明还提供一种检测待测植物材料是否感染sqmv、cgmmv、zymv和cilcv中至少一种瓜类病毒的方法,所述方法包括:
23.b1、采用上述的引物组对所述待测植物材料的核酸进行pcr扩增;b2、根据所述扩增的产物确定所述待测植物材料是否感染sqmv、cgmmv、zymv和cilcv四种瓜类病毒中的四种、任意三种、任意两种或任意一种。
24.在上述方法中,作为一种优选实施方式,所述待测植物材料为植物叶片或种子;优选地,所述待测植材料物为瓜类作物的植物叶片或种子;
25.优选地,所述待测植物材料的核酸为所述待测植物材料的总rna;
26.优选地,所述pcr扩增为rt-pcr扩增,其中,先将所述总rna反转录成cdna,然后再以cdna作为模板构建多重pcr体系;
27.优选地,所述确定的步骤为:表征所述pcr扩增产物中的dna片段,当所述pcr扩增产物中不含有1224bp的dna片段时,判定所述待测植物材料中没有感染所述sqmv病毒,当所述pcr扩增产物中含有1224bp的dna片段时,判定所述待测植物材料中感染了所述sqmv病毒;
28.当所述pcr扩增产物中不含有831bp的dna片段时,判定所述待测植物材料中没有感染所述cgmmv病毒,当所述pcr扩增产物中含有831bp的dna片段时,判定所述待测植物材料中感染了所述cgmmv病毒;
29.当所述pcr扩增产物中不含有440bp的dna片段时,判定所述待测植物材料中没有感染所述zymv病毒,当所述pcr扩增产物中含有440bp的dna片段时,判定所述待测植物材料中感染了所述zymv病毒;
30.当所述pcr扩增产物中不含有206bp的dna片段时,判定所述待测植物材料中没有感染所述cilcv病毒,当所述pcr扩增产物中含有206bp的dna片段时,判定所述待测植物材料中感染了所述cilcv病毒;
31.优选地,所述表征是通过对所述扩增产物进行琼脂糖凝胶电泳实现的;
32.优选地,所述pcr扩增采用的温度程序为:
33.(1)95℃反应3min;
34.(2)循环反应;
35.(3)72℃反应5min;
36.所述循环反应步骤为:95℃反应15s;52-60℃反应15s;72℃反应20s,循环30次;
37.优选地,所述循环反应步骤为:95℃反应15s;59.4℃反应15s;72℃反应20s,循环30次;
38.优选地,所述多重pcr体系中,第一引物对:第二引物对:第三引物对:第四引物对的总摩尔比值为:1:1:2:1或2:2:4:3或2:3:6:5或2:3:7:6;优选地,所述试剂中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔比值为:2:3:5:4;
39.优选地,所述多重pcr体系总体积为25μl,其中:
40.所述cdna模板在体系中的终浓度为10-200ng/μl;进一步优选为50ng/μl。
41.第六方面,本发明提供一种检测待测病毒是否为sqmv、cgmmv、zymv和cilcv中至少一种瓜类病毒的方法,所述方法包括:
42.c1、采用上述引物组对所述待测病毒样本的核酸进行pcr扩增;c2、根据所述扩增的产物确定所述待测病毒是否为sqmv、cgmmv、zymv和cilcv四种瓜类病毒中的四种、任意三种、任意两种或任意一种。
43.在上述方法中,作为一种优选实施方式,所述待测病毒样本的核酸为所述待测病毒样本的总rna;
44.优选地,所述pcr扩增为rt-pcr扩增,其中,先将所述总rna反转录成cdna,然后再以cdna作为模板构建多重pcr体系;
45.优选地,所述确定的步骤为:表征所述pcr扩增产物中的dna片段,当所述pcr扩增
产物中不含有1224bp的dna片段时,判定所述待测病毒样本中不含有所述sqmv病毒;当所述pcr扩增产物中含有1224bp的dna片段时,判定所述待测病毒样本中含有所述sqmv病毒;
46.当所述pcr扩增产物中不含有831bp的dna片段时,判定所述待测病毒样本中不含有所述cgmmv病毒;当所述pcr扩增产物中含有831bp的dna片段时,判定所述待测病毒样本中含有所述cgmmv病毒;
47.当所述pcr扩增产物不含有有440bp的dna片段时,判定所述待测病毒样本中不含有zymv病毒;当所述pcr扩增产物中含有440bp的dna片段时,判定所述待测病毒样本中含有所述zymv病毒;
48.当所述pcr扩增产物中不含有206bp的dna片段时,判定所述待测植物材料中没有感染所述cilcv病毒;当所述pcr扩增产物中含有206bp的dna片段时,判定所述待测病毒样本中含有所述cilcv病毒;
49.优选地,所述表征是通过对所述扩增产物进行琼脂糖凝胶电泳实现的;
50.优选地,所述pcr扩增采用的温度程序为:
51.(1)95℃反应3min;
52.(2)循环反应;
53.(3)72℃反应5min;
54.所述循环反应步骤为:95℃反应15s;52-60℃反应15s;72℃反应20s,循环30次;
55.优选地,所述循环反应步骤为:95℃反应15s;59.4℃反应15s;72℃反应20s,循环30次;
56.优选地,所述多重pcr体系中,第一引物对:第二引物对:第三引物对:第四引物对的总摩尔比值为:1:1:2:1或2:2:4:3或2:3:6:5或2:3:7:6;优选地,所述试剂中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔比值为:2:3:5:4;
57.优选地,所述多重pcr体系总体积为25μl,其中:
58.所述cdna模板在体系中的终浓度为10-200ng/μl;进一步优选为50ng/μl。相比于现有技术,本发明具有以下优点:
59.1.本发明所设计的引物具有良好的特异性和兼容性,可以同时鉴定四种病毒混合侵染的作物;
60.2.本发明优化了pcr扩增的体系和反应条件,在保证准确性的条件下,极大地提高了检测效率;
61.3.本发明是在同一个体系中检测四种病毒,反应经一次扩增完成,节约检测材料以及扩增所需的各种试剂,降低了检测成本,节约了时间和人力。
附图说明
62.图1示出了实施例4的四对引物特异性试验的结果,在电泳图a、b、c和d中,a:cilcv引物特异性试验,扩增所用引物为第四引物对,b:zymv引物特异性试验,扩增所用引物为第三引物对,c:cgmmv引物特异性试验,扩增所用引物为第二引物对,d:sqmv引物特异性试验,扩增所用引物为第一引物对。泳道m代表核酸标准分子量(dl2000bpdna marker),从上到下依次为2000bp、1000bp、750bp、500bp、250bp和100bp;泳道1-8依次对应为cilcv、cgmmv、zymv、sqmv、pvy、cmev、prsv和wmv等8种病毒的阳性对照;泳道n皆为阴性对照。
63.图2示出了实施例5中四对引物灵敏度试验的结果,在电泳图a中所用引物为用于扩增cilcv的第四引物对,泳道1-8对应的模板依次为稀释100、10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
倍的cilcv阳性模板;在电泳图b中所用引物为用于扩增zymv的第三引物对,泳道1-8对应的模板依次为稀释100、10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
倍的zymv阳性模板;在电泳图c中所用引物为用于扩增cgmmv的第二引物对,泳道1-8对应的模板依次为稀释100、10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
倍的cgmmv阳性模板;在电泳图d中所用引物为用于扩增sqmv的第一引物对,泳道1-8对应的模板依次为稀释100、10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
倍的sqmv阳性模板;泳道m代表核酸标准分子量(dl2000bpdna marker),从上到下依次为2000bp、1000bp、750bp、500bp、250bp和100bp;泳道n皆为阴性对照。
64.图3示出了实施例6中多重pcr体系中引物浓度优化试验的结果,其中电泳图a中引物组的第一引物对、第二引物对、第三引物对和第四引物对的pcr体系终浓度皆为40nm;电泳图b中引物组的第一引物对、第二引物对、第三引物对和第四引物对的pcr体系终浓度(上游引物或者下游引物在体系内的总浓度)依次是40、40、80、40nm;电泳图c中:引物组的第一引物对、第二引物对、第三引物对和第四引物对的pcr体系终浓度(上游引物或者下游引物在体系内的总浓度)依次是40、40、80、60nm;电泳图d中:引物组的第一引物对、第二引物对、第三引物对和第四引物对的pcr体系终浓度(上游引物或者下游引物在体系内的总浓度)依次是40、60、100、80nm;电泳图e中:引物组的第一引物对、第二引物对、第三引物对和第四引物对的pcr体系终浓度(上游引物或者下游引物在体系内的总浓度)依次是40、60、120、100nm;电泳图f中:引物组的第一引物对、第二引物对、第三引物对和第四引物对的pcr体系终浓度(上游引物或者下游引物在体系内的总浓度)依次是40、60、140、120nm;泳道m代表核酸标准分子量(dl2000bpdna marker),从上到下依次为2000bp、1000bp、750bp、500bp、250bp和100bp;泳道100、10-1
、10-2
皆表示相应pcr体系中所用阳性模板的稀释倍数。
65.图4示出了实施例6中多重pcr体系中退火温度优化的试验结果,泳道m代表核酸标准分子量(dl2000bpdna marker),从上到下依次为2000bp、1000bp、750bp、500bp、250bp和100bp,泳道1-8对应的退火温度依次为52.0℃、52.5℃、53.5℃、55.1℃、56.9℃、58.4℃、59.4℃、60.0℃。
66.图5示出了实施例7中多重pcr体系的试验结果,泳道m代表核酸标准分子量(dl2000bpdna marker),泳道1对应为实施例1制备的四种病毒(sqmv、cgmmv、zymv和cilcv)混合阳性的cdna为模板,使用包含第一引物对、第二引物对、第三引物对和第四引物对的引物组同步检测的结果;泳道2-5分别对应为以sqmv、cgmmv、zymv和cilcv 4种病毒单一阳性的样本的总rna为模板,使用包含第一引物对、第二引物对、第三引物对和第四引物对的引物组进行检测的结果;泳道m代表核酸标准分子量(dl2000bpdna marker),从上到下依次为2000bp、1000bp、750bp、500bp、250bp和100bp;泳道n为阴性对照。
67.图6示出了实施例8中是多重pcr体系的灵敏度的试验结果,其中电泳图a是用于扩增sqmv的第一引物对的单重灵敏度试验结果;电泳图b是用于扩增cgmmv的第二引物对的单重灵敏度的试验结果;电泳图c是用于扩增zymv的第三引物对的单重灵敏度试验结果;电泳图d是用于扩增cilcv的第四引物对的单重灵敏度的试验结果;电泳图e是多重pcr体系灵敏度试验结果;泳道m代表核酸标准分子量(dl2000bpdna marker),从上到下依次为2000bp、1000bp、750bp、500bp、250bp和100bp;泳道100、10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
皆表示相
应的pcr体系中所用阳性对照模板的稀释倍数,泳道n为阴性对照。
68.图7示出了实施例9中应用多重pcr体系检测田间瓜类样品的试验结果,泳道m代表核酸标准分子量(dl2000bpdna marker),从上到下依次为2000bp、1000bp、750bp、500bp、250bp和100bp;泳道p为同时含有四种病毒的阳性对照,泳道1-10为不同的瓜类叶片样品,泳道n为阴性对照。
具体实施方式
69.本发明的目的在于提供一种同时检测四种侵染瓜类作物的病毒病原的方法。该方法可以准确、高效、灵敏的检测多种瓜类作物病毒病原。
70.本发明基于多重pcr原理建立了sqmv、cgmmv、zymv和cilcv等4种病毒的同步rt-pcr检测体系,该体系可以准确、高效的鉴定田间感病植株,为瓜类作物病毒早起诊断和预警提供手段。
71.一种同步检测sqmv、cgmmv、zymv和cilcv四种瓜类病毒的多重rt-pcr方法,在同一pcr体系中,包含有如下特异性引物对:
72.用于扩增sqmv的特异性引物(即第一引物对)核苷酸序列为:
73.seq id no.1:5
’‑
gagctgctgacacggacata-3’,
74.seq id no.2:5
’‑
aaccattatttggccccgct-3’;
75.用于扩增cgmmv的特异性引物(即第二引物对)核苷酸序列为:
76.seq id no.3:5
’‑
cctgtcaagttgttgcgtgg-3’,
77.seq id no.4:5
’‑
ggaccgttgaggaaagcgta-3’;
78.用于扩增zymv的特异性引物(即第三引物对)核苷酸序列为:
79.seq id no.5:5
’‑
ggaaaattgtgccgcgtctt-3’,
80.seq id no.6:5
’‑
aagcaaaccatacctcggca-3’;
81.用于扩增cilcv的特异性引物(即第四引物对)核苷酸序列为:
82.seq id no.7:5
’‑
tgccattgagactgctgttcc-3’,
83.seq id no.8:5
’‑
tctgggtacactaactgtcggatc-3’。
84.所述pcr体系中sqmv、cgmmv、zymv和cilcv引物的总摩尔比为1:1:2:1或2:2:4:3或2:3:6:5或2:3:7:6;
85.在上述pcr体系中,作为一种优选实施方式,所述pcr体系中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔比值为:2:3:5:4。
86.在上述pcr体系中,作为一种优选实施方式,所述pcr体系总体积为25μl,其中:所述cdna模板在体系中的终浓度为10-200ng/μl;进一步优选为50ng/μl。
87.本发明同步扩增四种瓜类病毒基因组片段的方法所用的rt-pcr采用二步法完成,即先将待测样本的总rna反转录成cdna,然后再以cdna作为模板构建多重引物的pcr体系。
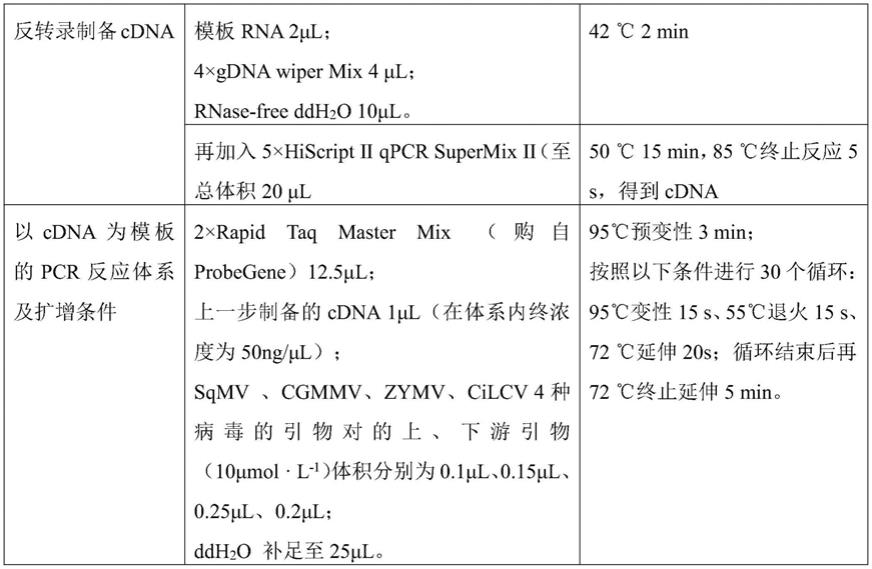
88.在本发明的一种优选方案中,所述rt-pcr的两步法反应体系及条件如下表1所示。
89.表1
90.[0091][0092]
上述方法在同步检测四种瓜类病毒病原sqmv、cgmmv、zymv和cilcv中的应用。
[0093]
一种检测试剂盒,含有上述四对引物。
[0094]
本发明所提供的sqmv、cgmmv、zymv和cilcv四种病毒的特异性引物对,也就是第一引物对、第二引物对、第三引物对和第四引物对,通过rt-pcr分别可以获得1224bp,831bp,440bp和206bp的单一特异性条带。通过对pcr反应条件和体系的优化,建立了同时检测上述四种病毒的多重rt-pcr,突破了同时检测侵染瓜类作物的sqmv、cgmmv、zymv和cilcv等四种病毒的技术瓶颈,也可以其他病原技术鉴定提供借鉴。
[0095]
具体发明内容涉及到:1)病毒rna提取及cdna的合成;2)特异性引物对的设计和特异性及灵敏性分析;3)多重pcr检测体系的优化;4)四种病毒的多重pcr体系建立;5)多重pcr体系灵敏度的测定;6)多重pcr体系在田间样品检测中的应用。
[0096]
在本发明的一个优选方案中,多重pcr的体系和条件为:2
×
rapid taq master mix 12.5μl,cdna模板1μl,sqmv、cgmmv、zymv、cilcv 4种病毒的引物对的上、下游引物(10μmol
·
l-1
)体积分别为0.1μl、0.15μl、0.25μl、0.2μl,剩余组分由ddh2o补足至25μl,其中cdna模板在体系中的终浓度为10-200ng/μl,优选为50ng/μl。
[0097]
多重pcr扩增的最佳反应条件为:95℃预变性3min;按照以下条件进行30个循环:95℃变性15s、59.4℃退火15s、72℃延伸20s;循环结束后再72℃终止延伸5min。
[0098]
所述四种病毒的特异性引物对可作为组合同步检测瓜类作物上的sqmv、cgmmv、zymv和cilcv四种病毒,pcr检测均能获得单一的特异性条带,可以用于鉴定四种瓜类病毒病原。该检测方法可制作成试剂盒,用于检测四种病毒病原。
[0099]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进或应用的基础,并不以任何方式构成对本发明的具体限制。下述实施例中的实验方法中,如无特殊说明,均为常规方法,可按照本领域内的文献所描述的技术或
条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从常规商业途径得到。下面结合具体实施例,进一步阐述本发明,这些实施例仅用于说明本发明而不用于限制本发明应用的范围。
[0100]
下述实施例中的黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,cgmmv)、南瓜花叶病毒(squash mosaic virus,sqmv)、小西葫芦黄花叶病毒(zucchini yellow mosaic virus,zymv)、西瓜潜隐病毒(citrullus lanatus cryptic virus,cilcv)、西瓜花叶病毒(watermelon mosaic virus,wmv)、甜瓜内生病毒(cucumis melo alphaendornavirus,cmev)、马铃薯y病毒(potato virus y,pvy)和番木瓜环斑病毒(papaya ringspot virus,prsv)均为本领域常规生物材料,为本实验室自行收集和保存,这些病毒的rna提取也可以采用实施例1的方法进行。
[0101]
实施例1.瓜类叶组织总rna的提取及cdna的合成
[0102]
采用美国invitrogen公司的trizol试剂提取瓜类叶片(选取感染sqmv、cgmmv、zymv或cilcv4四种病毒的南瓜、西瓜或甜瓜叶片)总rna。操作步骤如下:
[0103]
1)取0.1g新鲜样品叶片于液氮中研成粉末,转移到1.5ml无核酸酶的ep管中,迅速加入1ml trizol,充分震荡混匀;2)加入200μl三氯甲烷(氯仿),充分震荡混匀后,静置2min;3)4℃下12000rpm离心10min,取上清液约450μl转移至新的1.5ml无核酸酶的ep管中,加入等体积的异丙醇,上下颠倒混匀10次左右,放置-20℃冰箱;4)30min后取出,置于室温静置10min,4℃下12000rpm离心10min,弃上清,rna沉于ep管底;5)加入1ml 75%的乙醇(使用depc配置所述乙醇),4℃下12000rpm离心5min,弃上清;6)重复步骤5;7)4℃下12000rpm离心2min,然后用枪头吸出残余液体,注意不要吸出沉淀;8)室温开盖或通风橱中风干几分钟;9)加入50μl rnase-free ddh2o溶解沉淀,即得呈sqmv、cgmmv、zymv或cilcv4阳性的瓜类叶组织的总rna,浓度为500ng/μl,将其保存于-80℃冰箱备用。
[0104]
cdna合成:将以上述提取的分别呈sqmv、cgmmv、zymv或cilcv4阳性的总rna,以相同比例混合,作为反转录制备cdna的模板rna,利用反转录试剂盒ii q rt supermix for qpcr( gdna wiper)(r223-01,vazyme)进行反转录。第1步:基因组dna去除,总体系为16μl,在反应管中加入上述模板rna 2μl,4
×
gdna wiper mix4μl,rnase-free ddh2o 10μl。用移液器轻轻吹打混匀,保持42℃2min。第2步:在第1步反应管中加入5
×
hiscript ii qpcr supermix ii(至总体积20μl),用移液器轻轻吹打混匀,保持50℃15min,85℃终止反应5s。即可合成上述四种病毒混合阳性的样本的cdna,浓度为1200ng/μl。
[0105]
实施例2.四种病毒特异性引物设计
[0106]
根据genbank登录号为eu421060的sqmv、登录号为mk933286的cgmmv、登录号为jx502677的zymv和登录号为ky081285的cilcv等4种病毒序列,利用mega6进行序列比对找到相对保守序列,在保守序列区域利用ncbi网站上的primer(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?link_loc=blasthome)对每种病毒进行特异性引物对设计,11对病毒特异性引物具体情况见表2,由生工生物工程(上海)股份有限公司合成。
[0107]
表2.sqmv、cgmmv、zymv和cilcv四种病毒的特异性引物对
[0108][0109]
实施例3.四种病毒引物测试
[0110]
由于多重pcr要求在同一体系和退火温度下进行多个目标片段的扩增,所以对引物扩增效果要求较高。
[0111]
(i)首先对实施例2中设计的引物进行单引物rt-pcr检测,检测是否为单一目的条带。对单引物对进行特异性的检测,使用一步法rt-pcr,即以呈sqmv、zymv、cgmmv或cilcv单一阳性的瓜类叶组织的总rna为模板,使用酶:2
×
one step mix(dye plus)直接进行rt-pcr。
[0112]
上述一步法rt-pcr的体系为:2
×
one step mix(dye plus)12.5μl,one step enzyme mix 1.25μl,上、下游引物(10μmol
·
l-1
)各1μl,模板rna(本实验室保存的sqmv、zymv、cgmmv、cilcv分别呈阳性的rna,其浓度为500ng/μl)1μl,剩余组分由ddh2o补足至25μl。
[0113]
上述一步法rt-pcr的反应条件为:50℃反转录30min;95℃预变性3min;按照以下条件进行30个循环:95℃变性15s、55℃退火15s、72℃延伸20s;循环结束后再72℃终止延伸10min。单引物测试结果显示第七引物对、第八引物对、第九引物对出现非特异性条带。
[0114]
(ii)在其他未出现非特异性条带的引物对之间,使扩增不同病毒的引物对两两组合,进行适合多重pcr的引物的筛选。多重引物筛选使用两步法rt-pcr,即先将待测样本的总rna反转录成cdna,然后再以cdna作为模板构建多重pcr体系。
[0115]
其中,第一步反转录步骤已在实施例1中完成,制备得到四种病毒混合阳性的cdna。
[0116]
第二步的多重pcr体系为:总体积为25μl,其中包含2
×
rapid taq master mix 12.5μl,实施例1中制备的四种病毒混合阳性的cdna 1μl,用于扩增2种病毒的引物对(10μmol
·
l-1
)的上下游引物体积分别为1μl,最后加入ddh2o补足至25μl。pcr反应条件为:95℃预变性3min;按照以下条件进行30个循环:95℃变性15s、55℃退火15s、72℃延伸20s;循环结束后再72℃终止延伸5min。根据两对引物相互组合的pcr结果(具体汇总结果见表3),且保证每对引物在同一体系内扩增后的目的条带特异且清晰明亮,成功筛选出4对符合预期目标的引物进行后续实验,分别为第一引物对、第二引物对、第三引物对和第四引物对。
[0117]
表3.两组引物对相互组合pcr结果汇总
[0118][0119][0120]
注:
×
表示:两对引物组合未出正确条带;√表示:两对引物组合后pcr条带正确
[0121]
实施例4.四种病毒引物的特异性分析
[0122]
对实施例3中筛选出来的4对引物(第一引物对、第二引物对、第三引物对和第四引
物对)进一步检测其特异性。对单引物对进行特异性检测,使用一步法rt-pcr,即以本实验室保存的,呈sqmv、zymv、cgmmv、cilcv、wmv、cmev、pvy或prsv单一阳性的瓜类叶组织的总rna为模板,使用酶:2
×
one step mix(dye plus)直接进行rt-pcr检测相应引物对的特异性。
[0123]
上述一步法rt-pcr的体系为:2
×
one step mix(dye plus)12.5μl,one step enzyme mix 1.25μl,上、下游引物(10μmol
·
l-1
)各1μl,模板rna(本实验室保存的呈sqmv、zymv、cgmmv、cilcv、wmv、cmev、pvy或prsv单一阳性的rna,其浓度为500ng/μl)1μl,剩余组分由ddh2o补足至25μl。
[0124]
上述一步法rt-pcr的反应条件为:50℃反转录30min;95℃预变性3min;按照以下条件进行30个循环:95℃变性15s、55℃退火15s、72℃延伸20s;循环结束后再72℃终止延伸10min。
[0125]
分别使用第一引物对、第二引物对、第三引物对、第四引物对,对呈sqmv、zymv、cgmmv、cilcv、wmv、cmev、pvy或prsv单一阳性的rna进行rt-pcr检测相应引物对的特异性,其结果如图1所示,其中图a中检测所用引物为第四引物对,图b中检测所用引物为第三引物对,图c中检测所用引物为第二引物对,图d中检测所用引物为第一引物对;
[0126]
根据图1中电泳图a可以看出,使用第四引物对,分别对呈sqmv、zymv、cgmmv、cilcv、wmv、cmev、pvy或prsv单一阳性的rna样品进行rt-pcr检测,只有对应为cilcv阳性的泳道1中有大小为206bp的条带(第四引物对的特异性条带),其他泳道无条带,这说明第四引物对的特异性良好;
[0127]
根据图1中电泳图b可以看出,使用第三引物对,分别对呈sqmv、zymv、cgmmv、cilcv、wmv、cmev、pvy或prsv单一阳性的rna样品进行rt-pcr检测,只有对应为zymv阳性的泳道3中有对应大小为440bp的条带(第三引物对的特异性条带),其他泳道无条带,这说明第三引物对的特异性良好;
[0128]
根据图1中电泳图c可以看出,使用第二引物对,分别对呈sqmv、zymv、cgmmv、cilcv、wmv、cmev、pvy或prsv单一阳性的rna样品进行rt-pcr检测,只有对应为cgmmv阳性的泳道2中有对应大小为831bp的条带(第二引物对的特异性条带),其他泳道无条带,这说明第二引物对的特异性良好;
[0129]
根据图1中电泳图d可以看出,使用第一引物对,分别对呈sqmv、zymv、cgmmv、cilcv、wmv、cmev、pvy或prsv单一阳性的rna样品进行rt-pcr检测,只有对应为sqmv阳性的泳道4中有对应大小为1224bp的条带(第一引物对的特异性条带),其他泳道无条带,这说明第一引物对的特异性良好;
[0130]
结果显示:本发明所设计的4种病毒引物均不能扩增出其他毒源的目的条带,仅能相应的扩增出sqmv、cgmmv、zymv和cilcv4种病毒的特异性条带(图1)。因此,本发明所设计的引物特异性良好,检测结果可信。
[0131]
实施例5.四种病毒引物的灵敏度分析
[0132]
分别对实施例3中筛选出来的4对引物(第一引物对、第二引物对、第三引物对和第四引物对)通过一步法rt-pcr进行单引物对的灵敏度检测,即以本实验室保存的,呈sqmv、zymv、cgmmv或cilcv单一阳性的瓜类叶组织的总rna为模板,使用酶:2
×
one step mix(dye plus)直接进行rt-pcr,所述总rna模板初始浓度为500ng/μl,依次稀释100、10-1
、10-2
、10-3
、
10-4
、10-5
、10-6
、10-7
倍后加入pcr体系中,检测相应引物对的灵敏性。
[0133]
上述一步法rt-pcr的体系为:2
×
one step mix(dye plus)12.5μl,one step enzyme mix 1.25μl,上、下游引物(10μmol
·
l-1
)各1μl,稀释后的模板rna 1μl,剩余组分由ddh2o补足至25μl。
[0134]
上述一步法rt-pcr的反应条件为:50℃反转录30min;95℃预变性3min;按照以下条件进行30个循环:95℃变性15s、55℃退火15s、72℃延伸20s;循环结束后再72℃终止延伸10min。
[0135]
结果显示,cilcv引物灵敏度可达到10-3
,cgmmv引物灵敏度可达到10-6
,zymv引物灵敏度可达到10-4
,sqmv引物灵敏度可达到10-7
(图2)。
[0136]
实施例6.多重pcr体系优化
[0137]
本发明对多重pcr体系的引物浓度和退火温度进行了优化,使用的是两步法rt-pcr,即先将待测样本的总rna反转录成cdna,然后再以cdna作为模板构建多重pcr体系。
[0138]
其中,第一步反转录步骤在实施例1中完成,将实施例1中所提取的呈四种病毒混合阳性的cdna依次稀释为100、10-1
、10-2
倍作为第二步多重pcr体系的模板。同时对三组不同浓度的模板进行pcr扩增,以确定该扩增体系变化是由引物浓度变化所引起的,而不是由引物扩增灵敏度所造成。
[0139]
第二步的多重pcr体系为:总体积为25μl,其中包含2
×
rapid taq master mix 12.5μl,稀释后的cdna模板1μl,4种病毒的引物对(10μmol
·
l-1
)的上下游引物体积分别为按照不同比例依次加入,最后加入ddh2o补足至25μl。
[0140]
第二步的多重pcr反应条件为:95℃预变性3min;按照以下条件进行30个循环:95℃变性15s、55℃退火15s、72℃延伸20s;循环结束后再72℃终止延伸5min。pcr扩增结束后,进行dna凝胶电泳,结果如图3所示。
[0141]
图3a多重pcr体系中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔浓度比值为1:1:1:1;
[0142]
图3b多重pcr体系中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔浓度比值为1:1:2:1;
[0143]
图3c多重pcr体系中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔浓度比值为2:2:4:3;
[0144]
图3d多重pcr体系中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔浓度比值为2:3:5:4;
[0145]
图3e多重pcr体系中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔浓度比值为2:3:6:5;
[0146]
图3f多重pcr体系中第一引物对:第二引物对:第三引物对:第四引物对的总摩尔浓度比值为2:3:7:6;
[0147]
结果显示,图3a的比例不能同时检测出所述四种病毒,图3b-图3f的引物对总摩尔浓度的比值都可以同步检测出所述四种病毒,混合引物对的最佳浓度比例为第一引物对:第二引物对:第三引物对:第四引物对=2:3:5:4,4对引物分别扩增到1224bp、831bp、440bp、206bp的单一条带,具有良好的兼容性(图3)。图4为本实施例中多重pcr体系中退火温度优化的试验结果,退火温度设置52.0℃、52.5℃、53.5℃、55.1℃、56.9℃、58.4℃、59.4
℃、60.0℃共8个梯度,结果显示当退火温度为52.0至55.1℃时,zymv的特异性条带相比于其他条带较弱,随着退火温度升高,zymv的特异性条带逐渐变强。当退火温度为60.0℃时,sqmv和cgmmv的特异性条带变弱,因此选择最佳退火温度为59.4℃。
[0148]
实施例7.多重pcr体系的建立
[0149]
使用两步法进行rt-pcr,即先将待测样本的总rna反转录成cdna,然后再以cdna作为模板构建多重pcr体系。
[0150]
其中,第一步反转录步骤在实施例1中完成,制备得到四种病毒混合阳性的cdna作为第二步多重pcr的模板。
[0151]
第二步pcr的最佳体系为:总体积为25μl,其中包含2
×
rapid taq master mix 12.5μl,cdna模板1μl,用于扩增sqmv、cgmmv、zymv、cilcv 4种病毒的第一引物对、第二引物对、第三引物对和第四引物对的上、下游引物(10μmol
·
l-1
)的体积分别为0.1μl、0.15μl、0.25μl、0.2μl,最后加入ddh2o补足至25μl。
[0152]
第二步pcr的最佳反应条件为:95℃预变性3min;按照以下条件进行30个循环:95℃变性15s、59.4℃退火15s、72℃延伸20s;循环结束后再72℃终止延伸5min。
[0153]
将多重扩增结果与单重pcr扩增结果进行比较,pcr反应产物在2%的琼脂糖凝胶上点样,凝胶电泳的电压120v,电泳30分钟,紫外灯下观察照相。电泳结果显示,sqmv、cgmmv、zymv、cilcv这4种病毒各自的特异性引物分别扩增得到1224bp、831bp、440bp、206bp的目的条带,条带特异且清晰明亮(图5),在本实施例的多重pcr体系与条件下可以清楚、准确、稳定的同步扩增四种瓜类病毒。
[0154]
实施例8.多重pcr体系的灵敏度测定
[0155]
使用两步法进行rt-pcr对多重pcr体系的灵敏度进行测定,即先将待测样本的总rna反转录成cdna,然后再以cdna作为模板构建多重pcr体系,检测多重pcr体系中第一引物对、第二引物对、第三引物对和第四引物对的灵敏度。
[0156]
其中,第一步反转录步骤与实施例1中相同,制备得到四种病毒混合阳性的cdna,cdna浓度为1200ng/μl,依次稀释为100、10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
倍,作为第二步多重pcr的模板。按照实施例6中多重pcr的反应体系和反应条件,进行单重和多重pcr扩增,比较两者的灵敏度,其中单重pcr体系仅加入一种引物,用量与多重pcr体系中该种引物对用量相同,检测结果如图6所示。
[0157]
图6中,a为sqmv的单重灵敏度试验结果;b为cgmmv的单重灵敏度试验结果;c为zymv的单重灵敏度试验结果;d为cilcv的单重灵敏度试验结果;e为多重pcr体系的灵敏度试验结果。
[0158]
对比图6中b和e可以看到,在单重pcr体系和多重pcr体系中,用于扩增cgmmv的第二引物对的灵敏度相当,当模板稀释至10-4
时,在b和e中,都能观察到微弱的第二引物对扩增出的cgmmv的特异性条带;
[0159]
对比图6中d和e可以看到,在单重pcr体系和多重pcr体系中,用于扩增cilcv的第四引物对的灵敏度相当,当模板稀释至10-2
时,在d和e中,都可以观察到微弱的第四引物对扩增出的cilcv的特异性条带。
[0160]
从图6中a和c可以看到,单重pcr体系中,对于用于扩增sqmv的第一引物对和用于扩增zymv的第三引物对的灵敏度分别可达到10-6
和10-3
,而在图6e的多重rt-pcr体系中,用
于扩增sqmv的第一引物对和用于扩增zymv的第三引物对的灵敏度分别可达到10-5
和10-2
。因此,总体比较来说,本发明的引物组在多重rt-pcr体系中的灵敏度已经非常接近单重rt-pcr检测体系的灵敏度,能够充分满足实际应用中对混合侵染所述四种病毒的作物的检测需求。
[0161]
实施例9.四种病毒多重pcr体系的应用
[0162]
应用本发明实施例6中所建立的最佳多重rt-pcr体系和反应条件,对2020年采集于北京地区的10份瓜类叶片组织,其中包括4份甜瓜(图7,泳道1-4)和7份西瓜(图7,泳道5-10),采用实施例1的方法提取rna、制备cdna的方法进行rt-pcr检测病毒侵染情况,扩增结束后,进行dna凝胶电泳,结果如图7所示。由图7可以看出:其中4个样品为sqmv和cgmmv两种病毒复合侵染(图7,泳道1-4),2个样品为cgmmv和zymv两种病毒复合侵染(图7,泳道5和6),1个样品为sqmv和cgmmv复合侵染(图7,泳道10),1个健康植株样品(图7,泳道7)以及被sqmv和cilcv单独侵染的样品(图7,泳道8和9),且多重rt-pcr的检测结果与单重rt-pcr结果相对应,pcr产物序列与参考序列相一致,进一步证实了多重体系的准确性,说明本发明所建立的体系可用于田间检测且结果可靠。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。