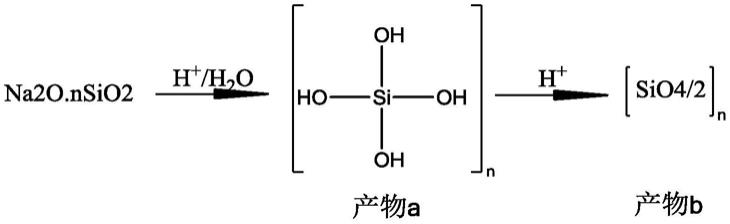
猕猴桃转录因子acarf1基因在抗灰霉病中的应用
技术领域
1.本发明涉及植物基因工程技术领域,具体涉及一种猕猴桃转录因子acarf1 基因在果实抗灰霉病中的应用。
背景技术:
2.猕猴桃(actinidia chinensis)营养丰富,素有“水果之王”等美誉。我国是猕猴桃的起源地和主产区,据联合国粮农组织(fao)统计,2018年我国猕猴桃栽培面积达16.8万公顷,年产量约203.5万吨(http://www.fao.org/faostat/en/#data/qc)。然而猕猴桃果实易遭受多种真菌病原菌的侵害而腐烂变质。由灰葡萄孢菌(botrytis cinerea)引起的灰霉病通常给猕猴桃产业造成高达30%以上的损失,严重威胁猕猴桃产业的健康发展。目前关于猕猴桃灰霉病的研究主要集中在应用防治、抗病生理及抗病蛋白筛选等方面。国内外关于猕猴桃对灰霉病抗性的分子机制研究相对迟缓,目前对抗灰霉病相关基因功能、调控机制还未见报道。
技术实现要素:
3.本发明目的在于提供一种猕猴桃acarf1基因的新应用,该基因能够显著增强猕猴桃对灰霉病菌的抗性。
4.本发明目的通过如下技术方案实现:
5.一种猕猴桃转录因子acarf1基因在猕猴桃果实抗灰霉病中的应用,该基因的编码序列如seq id no.1所示的核苷酸序列或seq id no.1所示的核苷酸序列经取代、缺失和/或添加一个或多个核苷酸,且能编码相同功能蛋白质的核苷酸序列。
6.其中seq id no.1序列长度:1599bp;组成为436a;341c;385g;437t;百分比:27.3%a;21.3%c;24.1%g;27.3%t。分子量(kda):ssdna(单链):494.53 dsdna(双链):985.71。
7.生长素响应因子(auxin response factor,arf)是iaa信号转导的关键因子,本发明根据红阳猕猴桃基因组数据库,克隆了猕猴桃acarf1基因,并采用病毒诱导的基因沉默(vigs)技术鉴定了该基因在灰霉病抗性中的功能。
8.采用上述基因编码的蛋白在猕猴桃果实抗灰霉病中的应用,所述氨基酸序列如seq id no.2所示或seq id no.2所示的氨基酸序列经取代、缺失和/或添加一个或多个氨基酸,且能表达相同功能蛋白质的氨基酸序列。
9.本发明还提供一种包含上述猕猴桃转录因子acarf1基因的工程菌。
10.一种提高猕猴桃果实抗灰霉病的方法,其特征在于:包括(1)构建含有 acarf1基因的重组表达载体,所述acarf1基因的核苷酸序列如seq id no:01 所示、氨基酸序列如seq id no:02所示;(2)将构建的重组表达载体转化到植物组织或细胞中;(3)培育筛选得到抗灰霉病的转基因植株。
11.本发明具有如下有益效果:
12.本发明通过将植物激素生长素途径转录因子acarf1抑制表达后,通过实验证实抑制表达acarf1基因能够增强猕猴桃对灰霉病菌的抗性,具体表现为接种病毒后与对照相比,本发明获得的转基因果实的发病症状减轻,发病率降低,病菌含量减少,为猕猴桃抗病育种提供重要的基因库及新的种质资源。
附图说明
13.图1:本发明acarf1基因在转基因农杆菌侵染猕猴桃后对照组中的表达量。
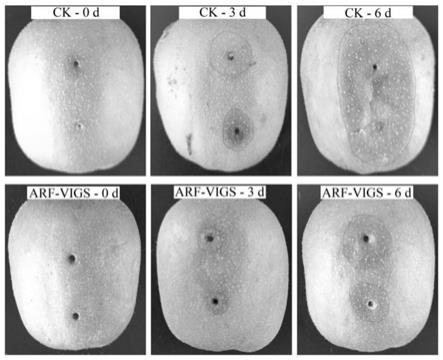
14.图2:抑制表达acarf1与对照组猕猴桃受灰霉菌侵染的表型观察。
15.图3:抑制表达acarf1与对照组猕猴桃受灰霉菌侵染3天和6天的病斑面积统计。
16.图4:抑制表达acarf1与对照组猕猴桃受灰霉菌侵染3天和6天pod活性变化。
17.图5:抑制表达acarf1与对照组猕猴桃受灰霉菌侵染3天和6天sod活性变化。
18.图6:抑制表达acarf1与对照组猕猴桃受灰霉菌侵染3天和6天总酚含量变化。
具体实施方式
19.下面对本发明的具体实施方式进行描述,以便于本领域技术人员理解本发明,但本发明不限于具体实施方式的范围。
20.以下实施例中涉及的各载体、猕猴桃品种
‘
红阳’猕猴桃,以及各种试剂均为市售,猕猴桃灰葡萄孢菌菌株由中国农业微生物菌种保藏管理中心提供(accc caasf-122)。
21.实施例1猕猴桃转录因子acarf1基因的获得
22.采用rnaiso plus kits(takara,japan)提取猕猴桃总rna,采用transscriptall-in-one first-strand cdna synthesis supermix for qpcr(one-step gdna removal) kit(transgen,china)反转录合成cdna,总rna采用takara isoplus试剂盒提取。猕猴桃叶加入液氮研磨成粉,装入rnase-free的1.5ml离心管中,加入1mlfruitmate(takara)试剂颠倒混匀后于4℃
×
12000g离心5min,将600μl上清液转移至新管,加入600μl rnaiso plus,静置5min后4℃
×
12000g离心5min。将上清液转移到新管中加入300μl氯仿颠倒混匀,静置5min,4℃
×
12000g离心15min。将上清液转移至新的离心管,加600μl异丙醇混匀后静置10min,4℃
×
12000g离心10min。弃上清,沉淀中加入1ml 75%乙醇洗涤沉淀4℃
×
7500g 离心5min,弃上清并风干。加入30μl rnase-free ddh2o溶解沉淀。对所得的 rna进行琼脂糖凝胶电泳,于凝胶成像系统中进行成像分析。以总rna为实验模板,采用全式金transscript onestep gdna removal and cdna synthesissupermix试剂盒合成反转录产物。1.5ml的离心管中依次加入10μl 2
×
es reactionmix,5μl total rna,2μl rnase-free water,1μl gdna remover,1μleasyscript@rt/ri enzyme,1μl oligo(dt),42℃孵化30min,再于85℃孵化5 s以终止反应。置于-20℃冰箱保存。
23.采用如下引物序列进行pcr扩增:
24.上游引物:atgattacgtttatagattcgaaagat(seq id no.3)
25.下游引物:caatccccactcaacattcc(seq id no.4)
26.扩增产物连接至克隆载体pmd-19t simple vector(transgen,china),转化大肠杆菌top10,筛选阳性克隆进行测序验证,其核苷酸序列如seq id no.1所示,再利用orf finder软件将所得基因翻译成氨基酸序列,按氨基酸序列如seqid no.2所示。
27.seqidno.1所示的核苷酸序列为红阳猕猴桃的acarf1序列信息(cds)。序列长度:1599bp。组成:436a;341c;385g;437t。百分比:27.3%a;21.3%c;24.1%g;27.3%t。分子量(kda):ssdna(单链):494.53dsdna(双链):985.71。
28.seqidno.2所示的编码氨基酸序列信息:translationofdnaman1(1-1599)通用codetotalaminoacidnumber:532,mw=59449;maxorfstartsataapos1(maybednapos1)for532aa(1596bases),mw=59449origin。
29.实施例2acarf1基因的遗传转化
30.1、表达载体构建:
31.pcr克隆基因干扰片段:以猕猴桃cdna为模板,使用phantasuper-fidelitydnapolymerase试剂盒进行pcr扩增。pcr反应体系如表1所示,反应程序如表2所示,pcr反应完成后,进行琼脂糖凝胶电泳,在凝胶成像系统中进行观察分析。将正确扩增的条带切胶回收,并进行琼脂糖凝胶电泳检测,将回收得到的片段保存于-20℃。电泳检测条带单一,切胶回收目的基因片段、片段长度395bp,如seqidno.7序列所示,采用如下引物:
32.上游引物ccatccatccatctttcacc(seqidno.5)
33.下游引物acgggggaaattgtatcctc(seqidno.6)。
34.表1pcr反应体系
35.名称用量cdna2μl5
×
sf buffer5μlzoccoaomt-ford(短引物)1μlzoccoaomt-rev(短引物)1μl10mm dntpmix0.5μlphanta super-fidelity dna polymerase0.5μlddh2o15μltotal volume25μl
36.表2pcr反应条件
[0037][0038]
将上述acarf1的seqidno.7所示基因片段连接至克隆载体pmd-19b(全式金),xbai/bamhi双酶切回收的acarf1基因片段和ptrv2载体,纯化回收基因片段和载体骨架,t4dna连接酶酶连后转化大肠杆菌dh5α,涂布kana抗性平板,对抗性菌落进行pcr检测,并从中挑取pcr阳性的菌样提取质粒,采用载体上通用引物:rv-xiayou(5’aacctaaaacttcagacacg3’)(seqidno.8)进行测序。测序结果和参考序列相一致。将构建
好的acarf1-ptrv2载体和ptrv1 按照1:1比例混合转化农杆菌gv301。
[0039]
2、抗病性分析
[0040]
上述农杆菌gv301通过注射方式瞬时转化授粉后130d大小均匀、无损伤、无病虫害的近成熟状态
‘
红阳’猕猴桃果实。随后每天固定时间在注射孔周围取材并于-80度冰箱保存。采用qrt-pcr技术检测acarf1的表达量,7天后该基因表达量明显下降(图1)。随后采用10μl灰葡萄孢菌(104-106个/ml)孢子悬浮液和无菌水分别对转基因组及对照组猕猴桃果实进行侵染。表型观察(图2)和病斑面积(图3)统计结果显示,在灰葡萄孢菌侵染3天时已经可以看到两组猕猴桃腐烂程度出现明显的差异;6天时对照组猕猴桃果实伤口周围发生大面积腐烂,acarf1发生沉默的果实伤口处则表现出相对轻微的腐烂症状。进一步检测转基因及对照组猕猴桃在灰葡萄孢菌侵染过程中防御酶、抗性物质含量的变化(图4-6)。采用愈创木酚法测定过氧化物酶pod活性,以每分钟内470nm处的光密度增加0.01为1个酶活力单位;采用氮蓝四唑(nbt)光化还原法测定超氧化物歧化酶sod活性,以抑制nbt光化还原50%的酶用量为1个酶活力单位;采用福林酚法测定总酚含量。结果显示,acarf1沉默表达后pod、 sod及总酚含量均有所增加,且在灰霉菌侵染后3天增加明显。这些结果说明灰葡萄孢菌侵染可以诱导猕猴桃果实pod、sod酶活性和总酚含量增加,而 acarf1沉默表达的果实受灰霉菌侵染后相关生理指标的增加更明显。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。