1.本发明属于发酵工程技术领域,具体涉及一种石斛多糖及其制备方法与应用。
背景技术:
2.石斛味甘,性微寒,具有益胃生津,滋阴清热的功效。研究表明,石斛中含有的主要活 性成分为石斛多糖、石斛碱、氨基酸、芪类及其衍生物以及多种挥发性成分,多糖是其最主 要的有效成分,多糖含量的高低决定石斛生物活性的强弱,其具有增强免疫、抗疲劳、抗氧 化、降血压、降血糖、抗肿瘤等作用,在化妆品原料开发中具有很好的应用前景。目前通过 酶提法、酸提法、碱提法、水提法、超声提取等多种方法提取多糖并应用于化妆品。
3.近几年有研究表明:通过微生物法发酵石斛可提高多糖的提取量,微生物在生长代谢过 程中分泌大量的蛋白酶、纤维素酶、半纤维素酶、糖苷酶、淀粉酶、果胶酶等胞外酶,可使 植物细胞破裂,细胞间隙增大,加快中药有效成分的溶出,有效提高中药有效成分的提取率。 通过微生物发酵不仅可以提高多糖的提取率,而且通过微生物的生物转化作用,可以将原有 的植物多糖转化成活性更高的新型发酵多糖;此外,部分微生物在发酵过程中,可利用小分 子碳水化合物自身合成胞外多糖,尤其一些乳杆菌和双歧杆菌等肠道益生菌,利用该微生物 发酵石斛不仅可以纯化石斛多糖,而且产生的菌体胞外多糖与石斛多糖起到协同增效作用。 但微生物的上述作用依赖于菌株的代谢酶系,具有很强的株特异性,有的菌株无法利用石斛 原料进行发酵增殖,有的菌株即使增殖亦无法进行多糖的生物转化,有的菌株甚至会降低多 糖的活性,能够产胞外多糖的菌株亦具有很强的特异性。
4.近年来,肠道益生菌被广泛研究,被证明具有绝对安全性和广泛的功效潜能。利用益生 菌发酵石斛原料,挖掘能够发酵石斛提高多糖其得率,提高发酵后多糖的活性的菌株和发酵 工艺,不但可以节约石斛资源,还可以提高石斛的有效性及应用范围。
5.石斛多糖在皮肤健康中的应用一直被关注,其在增加细胞活性、皮肤免疫、抗氧化、抗 辐射、保湿等方面都有应用。皮肤作为人体的第一道防线,对抵御外界有害因素的损伤以及 维持人体内环境的稳态有着至关重要的作用。皮肤的屏障功能是防止外界物质进入人体和体 内水分丢失的主要屏障,而皮肤屏障受损和皮肤免疫应答反应同时发生。皮肤屏障功能受损 导致皮肤免疫应答失调,而皮肤免疫应答失调会加重皮肤屏障受损,从而恶性循环。只有在 维持皮肤屏障完整性同时促使皮肤免疫应答正常化,才是保证皮肤健康的重要凭证。而石斛 多糖既可以修复皮肤屏障功能,又能用于调节皮肤免疫。但是,目前尚无能够有效发酵石斛 原料,在提高发酵多糖得率的同时,对皮肤屏障修复和皮肤免疫调节功效均提高的菌株和发 酵工艺。因此,利用现代发酵工程技术使发酵过程中限制性因素得到解决,使中药原料得到 充分的开发利用,提高其有效成分多糖得率,筛选出一株益生菌能够发酵石斛原料,且发酵 后提取多糖在屏障修复和免疫调节功效方面均提高,具有重要价值。
技术实现要素:
6.本发明的第一方面的目的,在于提供一种石斛多糖的制备方法。
7.本发明的第二方面的目的,在于提供本发明第一方面的制备方法得到的石斛多糖。
8.本发明的第三方面的目的,在于提供本发明第一方面的制备方法和/或本发明第二方面的 石斛多糖在制备产品中的应用。
9.本发明的第四方面的目的,在于提供一种产品。
10.为了实现上述目的,本发明所采取的技术方案是:
11.本发明的第一个方面,提供一种石斛多糖的制备方法,将罗伊氏乳杆菌(lactobacillus reuteri)接种于发酵原料中,发酵,得到石斛多糖;
12.所述发酵原料包含石斛。
13.在本发明的一种实施方式中,所述罗伊氏乳杆菌为罗伊氏乳杆菌ccfm8631 (lactobacillus reuteri),罗伊氏乳杆菌ccfm8631(lactobacillus reuteri)于2017年07月07 日保藏于中国微生物菌种保藏管理委员会普通微生物中心cgmcc,保藏地址为北京市朝阳 区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.14394;已在专利 文献cn107523526a中公开。
14.在本发明的一种实施方式中,所述发酵原料还包含乳杆菌增殖因子和微量元素。
15.在本发明的一种实施方式中,所述石斛为石斛粉末。
16.在本发明的一种实施方式中,所述石斛粉末的制备方法如下:将石斛粉碎至全部过60目。
17.在本发明的一种实施方式中,所述石斛为新鲜石斛或干石斛。
18.在本发明的一种实施方式中,所述发酵原料包含:40~80g/l石斛、10~40g/l乳杆菌 增殖因子和0.1~1.0g/l微量元素;进一步地,所述发酵原料包含:40~60g/l石斛、10~25g/l 乳杆菌增殖因子和0.25~0.83g/l微量元素。
19.在本发明的一种实施方式中,所述乳杆菌增殖因子为酵母浸粉、酵母提取物、酵母蛋白 胨、胰蛋白胨和大豆蛋白胨中的至少一种。
20.在本发明的一种实施方式中,所述微量元素为硫酸镁和硫酸锰中的至少一种;进一步为 硫酸镁和硫酸锰。
21.在本发明的一种实施方式中,所述发酵原料还包含助溶剂。
22.在本发明的一种实施方式中,所述助溶剂为吐温-80。
23.在本发明的一种实施方式中,所述发酵原料的ph为5~7;进一步为6~7。
24.在本发明的一种实施方式中,所述罗伊氏乳杆菌的接种量按罗伊氏乳杆菌的终浓度计为 1.0
×
106~5.0
×
107cfu/ml;进一步为1.0
×
106~1.0
×
107cfu/ml。
25.在本发明的一种实施方式中,所述发酵的条件为32~38℃下发酵15~24h;进一步为 36.5~37.5℃下发酵16~24h。
26.在本发明的一种实施方式中,所述发酵的ph为5~7;进一步为6~7。
27.在本发明的一种实施方式中,所述发酵为恒温恒ph发酵。
28.在本发明的一种实施方式中,所述制备方法还包括如下步骤:超声提取;固液分离,得 到上清液a;除蛋白,得到上清液b;醇沉。
29.在本发明的一种实施方式中,所述超声提取的条件为:温度为20~90℃,超声功率为 100~500w,时间为10~60min;进一步为:温度为25~80℃,超声功率为200~500w,时 间为10~30min。
30.在本发明的一种实施方式中,所述固液分离的方式为离心。
31.在本发明的一种实施方式中,所述离心的条件为6000~10000g下离心5~20min;进一 步为6000~8000g下离心5~15min。
32.在本发明的一种实施方式中,所述除蛋白的方法为:将上清液a与三氯乙酸混合,静置, 离心,得到上清液b。
33.在本发明的一种实施方式中,三氯乙酸的添加量按三氯乙酸在三氯乙酸与上清液a的混 合液中的体积百分比计为2%~8%;进一步为2%~5%。
34.在本发明的一种实施方式中,所述三氯乙酸的浓度为700~900g/l。
35.在本发明的一种实施方式中,所述除蛋白的方法中静置的条件为0~4℃下静置30~60 min。
36.在本发明的一种实施方式中,所述除蛋白的方法中离心的条件为6000~10000g下离心 5~20min。
37.在本发明的一种实施方式中,所述醇沉的方法为:将上清液b与乙醇混合,静置,离心, 得到石斛多糖。
38.在本发明的一种实施方式中,所述上清液b与乙醇混合后乙醇的终浓度为60~90%。
39.在本发明的一种实施方式中,所述醇沉的方法中静置的条件为0~4℃下静置8~14h。
40.在本发明的一种实施方式中,所述醇沉的方法中离心的条件为6000~10000g下离心5~ 20min。
41.在本发明的一种实施方式中,所述石斛多糖的制备方法还包括如下步骤:将醇沉得到的 石斛多糖与水混合至无沉淀,干燥,得到石斛多糖粉末。
42.在本发明的一种实施方式中,所述石斛多糖与水的质量比为1:1~1:2。
43.在本发明的一种实施方式中,所述干燥的条件为:预冻温度为-60~-50℃,时间为3~5h; 一次干燥温度为-25~-35℃,压力为180~220μbar,时间为22~26h;二次干燥温度为20~ 30℃,压力为0μbar,时间为15~20h。
44.本发明的第二个方面,提供一种石斛多糖,通过本发明第一方面的制备方法得到。
45.在本发明的一种实施方式中,所述石斛多糖的重均分子量小于32000;进一步为1500~ 32000;更进一步为1619~30827。
46.在本发明的一种实施方式中,所述石斛多糖的单糖组成为木糖、葡萄糖、半乳糖和阿拉 伯糖。
47.在本发明的一种实施方式中,所述石斛多糖中木糖、葡萄糖、半乳糖和阿拉伯糖的质量 比为(60~75):(25~32):(1~4):(0.5~1)。
48.本发明的第三个方面,提供第二方面的石斛多糖在制备产品中的应用。
49.在本发明的一种实施方式中,所述产品用于:
50.(1)修复皮肤屏障;和/或
51.(2)提高免疫力。
52.在本发明的一种实施方式中,所述产品用于:
53.(1)修复皮肤屏障;和/或
54.(2)提高皮肤免疫力。
55.在本发明的一种实施方式中,所述产品包括食品、药品和化妆品。
56.本发明的第四个方面,提供一种产品,包含本发明第二方面的石斛多糖。
57.在本发明的一种实施方式中,所述产品用于:
58.(1)修复皮肤屏障;和/或
59.(2)提高免疫力。
60.在本发明的一种实施方式中,所述产品用于:
61.(1)修复皮肤屏障;和/或
62.(2)提高皮肤免疫力。
63.在本发明的一种实施方式中,所述产品包括食品、药品和化妆品。
64.本发明的有益效果是:
65.本发明提供了一种石斛多糖的制备方法,以石斛为发酵原料,罗伊氏乳杆菌为发酵菌种, 发酵,经罗伊氏乳杆菌发酵后,石斛多糖的得率提高了60%~70%;所得到的石斛多糖可以 显著提高经sds诱导的hacat细胞存活率,即可以提高皮肤屏障修复效果;可以降低经lps 诱导的raw264.7细胞中no含量,即可以提高免疫调节功效;可见,本发明提供的制备方 法不仅可以提高石斛多糖的提取率,还可以提高所得到的石斛多糖的皮肤屏障修复效果和免 疫调节功效,且效果优于未发酵石斛多糖。
66.本发明通过添加乳杆菌增殖因子和有利于促进罗伊氏乳杆菌增殖的微量元素,使罗伊氏 乳杆菌能够在包含石斛的发酵原料中快速增殖。
67.本发明通过限定超声提取条件为温度为20~90℃,超声功率为100~500w,时间为10~ 60min;将温浸法与超声法相结合:其中,温浸法提取多糖利用“相似相溶”原理,将原料中 大分子多糖通过加热,利用溶剂水将多糖有效溶解出,其工艺安全,成本低廉,适宜大规模 生产;超声法提取多糖,可将菌体表面的多糖通过超声波萃取下来,将原料中的粗多糖通过 超声波空化作用,形成高温和高压的环境,增加物质分子运动的频率和速度、溶剂的穿透力, 从而将石斛原料中大分子多糖分解成可以利用的小分子多糖,加速目标成分多糖进入溶剂, 提高多糖的提取率,利用超声法提取石斛多糖,不但提高了多糖提取率,而且节约溶剂、时 间,避免高温对石斛多糖活性产生影响;而本发明中将二者相结合,将菌体表面产生的多糖 剥离,将原料中的多糖有效溶解出来,既节约了成本,又节约了时间,且将发酵液中的多糖 充分提取出,极大提高了发酵后多糖的提取率,而且利于大规模工业化生产,有很好的的应 用价值。
68.本发明提供了一种石斛多糖,与未发酵石斛多糖相比,该石斛多糖中的大分子量多糖显 著减少,单糖组分减少(未发酵石斛多糖中单糖组成为阿拉伯糖、半乳糖、葡萄糖、木糖、 半乳糖醛酸和葡萄糖醛酸,本发明的石斛多糖中单糖组成为阿拉伯糖、半乳糖、葡萄糖和木 糖),且各单糖组分含量有所差别;该石斛多糖可用于制备食品、药品和化妆品。
附图说明
69.图1是实施例1得到的石斛多糖粉末的直观图。
70.图2是不同提取方法的多糖提取率图:**表示“与对比例1相比,p<0.01”。
71.图3是不同提取方法得到的石斛多糖处理sds诱导的hacat细胞后的存活率图:**表 示“与模型组相比,p<0.01”。
72.图4是不同提取方法得到的石斛多糖处理lps诱导的raw264.7细胞后的no含量图: **表示“与模型组相比,p<0.01”。
73.图5是实施例1得到的石斛多糖(罗伊氏乳杆菌ccfm8631发酵石斛多糖)的液相色谱 图。
74.图6是对比例1得到的石斛多糖(未发酵石斛多糖)的液相色谱图。
75.图7是对比例1得到的石斛多糖(未发酵石斛多糖)的水解产物的液相色谱图。
76.图8是实施例1得到的石斛多糖(罗伊氏乳杆菌ccfm8631发酵石斛多糖)的水解产物 的液相色谱图。
具体实施方式
77.以下通过具体的实施例对本发明的内容作进一步详细的说明。
78.本实施例中所使用的材料、试剂等,如无特别说明,为从商业途径得到的试剂和材料。
79.下述实施例中涉及罗伊氏乳杆菌ccfm8631(lactobacillus reuteri),于2017年07月07 日保藏于中国微生物菌种保藏管理委员会普通微生物中心cgmcc,保藏地址为北京市朝阳 区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.14394;已在专利 文献cn107523526a中公开。
80.下述实施例中提取率计算方法、活菌数检测方法、细胞存活率计算方法以及细胞抑制率 的计算方法如下:
81.提取率=(发酵后/未发酵提取多糖含量/未发酵石斛原料含量)
×
100%;
82.活菌数的检测方法:采用国标《gb 4789.35-2016食品安全国家标准食品微生物学检测 乳酸菌检测》;
83.细胞存活率=(多糖干预组od-空白组od)/(阴性对照组od-空白组od)*100%;
84.细胞抑制率=1-细胞存活率。
85.下述实施例中石斛原料的制备方法如下:将干燥石斛粉碎后,过60目筛备用。
86.下述实施例中的瑞士乳杆菌m10(lactobacillus helveticus m10)由江南大学食品生物技 术中心菌种保藏中心提供,于2018年09月20日保藏于广东省微生物菌种保藏中心,保藏地 址为广州市先烈中路100号大院59号楼5楼,保藏编号为gdmcc no.60452;已在专利文 献cn 109402019 a中公开。
87.下述实施例中的植物乳杆菌x1(lactobacillus plantarum x1)由江南大学食品生物技术 中心菌种保藏中心提供,已在文献“王玉林,黄洁,崔树茂,等.植物乳杆菌最适生长底物 解析及高密度培养工艺[j].食品与发酵工业,2020,46(4):19-27.”中公开。
[0088]
下述实施例中的脆弱拟杆菌fahbz17k2(bacteroides fragilis fahbz17k2)由江南大学食 品生物技术中心菌种保藏中心提供,从中国广西的人群粪便样本中筛选得到,已
平板中在真空冷冻干燥机中干燥46h(预冻温度为-50℃,时间为4h;一次干燥温度为-30℃, 压力为200μbar,时间为24h;二次干燥温度为25℃,压力为0μbar,时间为18h),得到石斛 多糖粉末。
[0099]
实施例3罗伊氏乳杆菌ccfm8631提取石斛多糖
[0100]
(1)石斛原料发酵培养基的配制:取干燥石斛原料、酵母浸粉、七水硫酸镁、硫酸锰、 吐温80,混合,添加纯净水,定容(石斛原料的终浓度为40g/l,酵母浸粉的终浓度为10g/l, 七水硫酸镁的终浓度为0.58g/l,硫酸锰的终浓度为0.25g/l,吐温-80的终浓度为0.1%(v/v)), 调节ph值至7.0,于115℃条件下加热20min灭菌;
[0101]
(2)将灭过菌的石斛原料发酵培养基冷却到40℃以下,于无菌环境下在石斛原料发酵 培养基中加入罗伊氏乳杆菌ccfm8631(罗伊氏乳杆菌ccfm8631的终浓度为1.0
×
106cfu/ ml),在温度37℃,ph值为7.0条件下恒温恒ph发酵16h,此时,活菌数达到5.0
×
108cfu/ ml;
[0102]
(3)继续发酵至24h,达到发酵终点,得到石斛原料发酵液;利用超声法提取石斛多糖: 将石斛原料发酵液在超声清洗机中以200w功率,25℃,超声30min;然后,8000g,5min离 心,除掉菌体和石斛原料发酵液残渣,得到石斛原料发酵液上清;
[0103]
(4)在石斛原料发酵液上清中添加三氯乙酸,三氯乙酸占三氯乙酸和上清的混合液的 2%(v/v),三氯乙酸的浓度为800g/l,除掉石斛原料发酵液上清中的蛋白质;在4℃冰箱中 放置30min,然后8000g,5min离心,得到的上清液与无水乙醇以1:9比例(体积比)混合, 沉淀多糖,在4℃冰箱中放置过夜;然后,8000g,5min离心,得到石斛多糖,用超纯水复溶 石斛多糖(石斛多糖与超纯水的质量比为1:1)至无明显固体沉淀,将得到的溶液放置在平板 中在真空冷冻干燥机中干燥46h(预冻温度为-50℃,时间为4h;一次干燥温度为-30℃,压 力为200μbar,时间为24h;二次干燥温度为25℃,压力为0μbar,时间为18h),得到石斛多 糖粉末。
[0104]
对比例1超声法提取石斛多糖
[0105]
(1)取干燥石斛原料,加纯净水混合,石斛原料的终浓度为40g/l,利用超声法提取石 斛多糖:将石斛原料在超声清洗机中以500w功率,80℃,超声10min;然后,8000g,5min 离心,除掉石斛原料残渣,得到石斛原料提取液上清;
[0106]
(2)在石斛原料提取液上清中添加三氯乙酸,三氯乙酸占三氯乙酸和上清的混合液的 5%(v/v),三氯乙酸的浓度为800g/l,除掉石斛原料提取液上清中的蛋白质;在4℃冰箱中 放置30min,然后8000g,5min离心,得到的上清液与95%的乙醇以1:4比例(体积比)混 合,沉淀多糖,在4℃冰箱中放置过夜;然后,8000g,5min离心,得到石斛多糖,用超纯水 复溶石斛多糖(石斛多糖与超纯水的质量比为1:1)至无明显固体沉淀,将得到的溶液放置在 平板中在真空冷冻干燥机中干燥46h(预冻温度为-50℃,时间为4h;一次干燥温度为-30℃, 压力为200μbar,时间为24h;二次干燥温度为25℃,压力为0μbar,时间为18h),得到石斛 多糖粉末。
[0107]
对比例2瑞士乳杆菌m10提取石斛多糖
[0108]
(1)石斛原料发酵培养基的配制:取干燥石斛原料、酵母浸粉、七水硫酸镁、硫酸锰、 吐温80,混合,添加纯净水,定容(石斛原料的终浓度为40g/l,酵母浸粉的终浓度为10g/ l,七水硫酸镁的终浓度为0.58g/l,硫酸锰的终浓度为0.25g/l,吐温-80的终浓度为
0.1%(v /v)),调节ph值至7.0,于115℃条件下加热20min灭菌;
[0109]
(2)将灭过菌的石斛原料发酵培养基冷却到40℃以下,于无菌环境下在石斛原料发酵 培养基中加入瑞士乳杆菌m10(瑞士乳杆菌m10的终浓度为1.0
×
106cfu/ml),在温度37℃, ph值为7.0条件下恒温恒ph发酵16h,此时,活菌数达到2.1
×
107cfu/ml。
[0110]
由于瑞士乳杆菌m10未明显增殖,可见瑞士乳杆菌m10未能发酵石斛原料,因此,未 继续进行发酵。
[0111]
对比例3植物乳杆菌x1提取石斛多糖
[0112]
(1)石斛原料发酵培养基的配制:取干燥石斛原料、酵母浸粉、七水硫酸镁、硫酸锰、 吐温80,混合,添加纯净水,定容(石斛原料的终浓度为40g/l,酵母浸粉的终浓度为10g/l, 七水硫酸镁的终浓度为0.58g/l,硫酸锰的终浓度为0.25g/l,吐温-80的终浓度为0.1%(v/v)), 调节ph值至7.0,于115℃条件下加热20min灭菌;
[0113]
(2)将灭过菌的石斛原料发酵培养基冷却到40℃以下,于无菌环境下在石斛原料发酵 培养基中加入植物乳杆菌x1(植物乳杆菌x1的终浓度为1.0
×
106cfu/ml),在温度37℃, ph值为7.0条件下恒温恒ph发酵16h,此时,活菌数达到1.9
×
108cfu/ml;
[0114]
(3)继续发酵至24h,达到发酵终点,得到石斛原料发酵液;利用超声法提取石斛多糖: 将石斛原料发酵液在超声清洗机中以500w功率,80℃,超声10min;然后,8000g,5min离 心,除掉菌体和石斛原料发酵液残渣,得到石斛原料发酵液上清;
[0115]
(4)在石斛原料发酵液上清中添加三氯乙酸,三氯乙酸占三氯乙酸和上清的混合液的 5%(v/v),三氯乙酸的浓度为800g/l,除掉石斛原料发酵液上清中的蛋白质;在4℃冰箱中 放置30min,然后8000g,5min离心,得到的上清液与95%的乙醇以1:4比例(体积比)混 合,沉淀多糖,在4℃冰箱中放置过夜;然后,8000g,5min离心,得到石斛多糖,用超纯水 复溶石斛多糖(石斛多糖与超纯水的质量比为1:1)至无明显固体沉淀,将得到的溶液放置在 平板中在真空冷冻干燥机中干燥46h(预冻温度为-50℃,时间为4h;一次干燥温度为-30℃, 压力为200μbar,时间为24h;二次干燥温度为25℃,压力为0μbar,时间为18h),得到石斛 多糖粉末。
[0116]
对比例4脆弱拟杆菌fahbz17k2提取石斛多糖
[0117]
(1)石斛原料发酵培养基的配制:取干燥石斛原料、酵母浸粉、七水硫酸镁、硫酸锰、 吐温80,混合,添加纯净水,定容(石斛原料的终浓度为40g/l,酵母浸粉的终浓度为10g/l, 七水硫酸镁的终浓度为0.58g/l,硫酸锰的终浓度为0.25g/l,吐温-80的终浓度为0.1%(v/v)), 调节ph值至7.0,于115℃条件下加热20min灭菌;
[0118]
(2)将灭过菌的石斛原料发酵培养基冷却到40℃以下,于无菌环境下在石斛原料发酵 培养基中加入脆弱拟杆菌fahbz17k2(脆弱拟杆菌fahbz17k2的终浓度为1.0
×
106cfu/m l),在温度37℃,ph值为7.0条件下恒温恒ph发酵16h,此时,活菌数达到1.3
×
109cfu/ml;
[0119]
(3)继续发酵至24h,达到发酵终点,得到石斛原料发酵液;利用超声法提取石斛多糖: 将石斛原料发酵液在超声清洗机中以500w功率,80℃,超声10min;然后,8000g,5min离 心,除掉菌体和石斛原料发酵液残渣,得到石斛原料发酵液上清;
[0120]
(4)在石斛原料发酵液上清中添加三氯乙酸,三氯乙酸占三氯乙酸和上清的混合液的 5%(v/v),三氯乙酸的浓度为800g/l,除掉石斛原料发酵液上清中的蛋白质;在4℃冰
箱中 放置30min,然后8000g,5min离心,得到的上清液与95%的乙醇以1:4比例(体积比)混 合,沉淀多糖,在4℃冰箱中放置过夜;然后,8000g,5min离心,得到石斛多糖,用超纯水 复溶石斛多糖(石斛多糖与超纯水的质量比为1:1)至无明显固体沉淀,将得到的溶液放置在 平板中在真空冷冻干燥机中干燥46h(预冻温度为-50℃,时间为4h;一次干燥温度为-30℃, 压力为200μbar,时间为24h;二次干燥温度为25℃,压力为0μbar,时间为18h),得到石斛 多糖粉末。
[0121]
效果实施例
[0122]
1.石斛原料发酵培养基对不同菌株增殖活菌数的影响
[0123]
不同菌株(罗伊氏乳杆菌ccfm8631、瑞士乳杆菌m10、植物乳杆菌x1、脆弱拟杆菌 fahbz17k2)在石斛原料发酵培养基中发酵16h后,活菌数如表1所示:罗伊氏乳杆菌 ccfm8631、植物乳杆菌x1、脆弱拟杆菌fahbz17k2在石斛原料发酵培养基中发酵后,活 菌数显著增加,而瑞士乳杆菌m10在石斛原料发酵培养基中发酵后,却未有明显增殖,可见 瑞士乳杆菌m10未能发酵石斛原料。
[0124]
表1不同菌株在石斛原料发酵培养基中发酵16h后的活菌数
[0125]
菌株活菌数(cfu/ml)初始接种活菌数1.0
×
106罗伊氏乳杆菌ccfm8631(实施例1)5.0
×
108罗伊氏乳杆菌ccfm8631(实施例2)8.0
×
108瑞士乳杆菌m10(对比例2)2.1
×
107植物乳杆菌x1(对比例3)1.9
×
108脆弱拟杆菌fahbz17k2(对比例4)1.3
×
109[0126]
2.不同提取方法对石斛多糖提取率的影响
[0127]
分别计算实施例1、2、3,对比例1、3、4方法的石斛多糖提取率,结果如图2所示: 与石斛未发酵多糖(对比例1)相比,罗伊氏乳杆菌ccfm8631发酵石斛多糖(实施例1、2、 3)、植物乳杆菌x1发酵石斛多糖(对比例3)可显著提高石斛多糖的提取率,尤其,罗伊氏 乳杆菌ccfm8631发酵石斛多糖(实施例1)的提取率最高可达未发酵石斛多糖(对比例1) 的1.65倍。
[0128]
3.不同提取方法得到的石斛多糖的屏障修复效果
[0129]
(1)细胞培养:于37℃、5%co2、饱和湿度培养箱中培养人角质形成细胞(hacat细 胞),待细胞达到90%融合度时传代培养;弃去完全培养基,pbs洗去残余完全培养基,胰酶 消化,添加完全培养基(90%dmem高糖培养基 10%胎牛血清 100u/ml青链霉素)终止 消化,吹打并收集细胞悬液,1000rpm离心5min,完全培养基重悬细胞,传代培养;取对数 生长期且状态良好的细胞用于实验。
[0130]
(2)mtt法检测细胞活率:实验分组为空白组(只含mtt工作液,无细胞)、阴性对 照组、模型组、多糖干预组,每组设3个重复孔。空白组od测量方法:每孔添加mtt工作 液(称取mtt试剂溶于pbs配制成5mg/ml的储存液,过滤除菌后,于-20℃冰箱避光保存; 使用时,将mtt储存液按1:9的比例(体积比)添加到无血清培养基中配置mtt工作液) 100μl,于培养箱中继续孵育4h,弃去mtt工作液,每孔加入150μl dmso溶液,于振 荡器上中速震荡5min后,酶标仪检测570nm波长处吸光度(od值);阴性对照组od测 量方法如下:将细胞以每孔5000
细胞,待细胞达到90%融合时传代培养;弃去完全培养基,pbs洗去残余完全培养基,加入 2ml完全培养基(90%dmem高糖培养基 10%胎牛血清 100u/ml青链霉素),用细胞刮刀 将细胞刮打下来,吹打均匀收集至离心管,1200rpm离心3min,收集细胞沉淀,完全培养基 重悬细胞,传代培养;取对数生长期且状态良好的细胞用于实验。
[0135]
(2)no含量评价石斛多糖的效果:将细胞接种于6孔板中培养,每孔1
×
105个细胞, 培养24h;随机分为阴性对照组、脂多糖(lps)模型组、多糖干预组,每组3个复孔:阴 性对照组更换完全培养基,模型组和干预组更换含lps的完全培养基(lps终浓度为5ug/ml),继续培养24h;阴性对照组和模型组更换完全培养基,干预组更换含石斛多糖的完全培 养基(实施例1、对比例1得到石斛多糖,终浓度为1000μg/ml),继续培养24h;细胞处理 后,分别取各组培养上清50ul于96板中,加入格里斯试剂检测no含量;酶标仪检测540nm波长吸光度(od),制作标准曲线,计算no含量,结果如表3及图4所示:与对比例1 得到的石斛多糖(未发酵石斛多糖)相比,实施例1得到石斛多糖(罗伊氏乳杆菌ccfm8631发酵石斛多糖)处理lps诱导的raw264.7细胞后no含量有所下降,表明实施例1得到 石斛多糖(罗伊氏乳杆菌ccfm8631发酵石斛多糖)的免疫效果优于对比例1得到的石斛多 糖(未发酵石斛多糖)。
[0136]
表3不同方法得到的石斛多糖对lps诱导的raw264.7细胞no含量的影响
[0137]
分组no含量(μm)lps模型组42.859阴性对照组13.420石斛多糖浓度(μg/ml)1000未发酵石斛多糖(对比例1)23.825罗伊氏乳杆菌ccfm8631发酵石斛多糖(实施例1)22.556
[0138]
5.不同提取方法得到的石斛多糖的分子量分布
[0139]
(1)准确称取50mg如下葡聚糖标准品:dextran t-2000(mw 2000000)、dextran t-300(mw 300600)、dextran t-150(mw 135030)、dextran t-10(mw 9750)、dextran t-5(mw 2700)、葡萄 糖(mw 180)以及实施例1、对比例1得到的石斛多糖,分别将上述标准品及样品置于10ml 容量瓶中,以0.1m nano3溶解并定容至10ml,随后使用0.22μm的滤膜过滤;
[0140]
(2)采用高效液相色谱仪和2410示差折光检测器,进样量为5μl,色谱柱 (ultrahydrogeltmlinear 300mm
×
7.8mmid
×
2)与保护柱(agilent,pl aquagel-oh guard 8μm, 50mm
×
7.5mm)串联,流动相为0.1m硝酸钠溶液,流速为0.8ml/min,柱温为40℃。根据 标准样品的保留时间以及峰面积,积分计算该样品的分子量分布范围,结果如表4、表5、图 5、图6所示:对比例1得到的石斛多糖的重均分子量为1549~1001496(其中,重均分子量 为1001496的石斛多糖的面积达99.44%,重均分子量为1549的石斛多糖的面积仅为0.56%), 实施例1得到的石斛多糖的重均分子量为1619~30827(其中,重均分子量为30827的石斛 多糖的面积达52.57%,重均分子量为16199的石斛多糖的面积为47.43%),即实施例1得到 的大分子量多糖显著减少,罗伊氏乳杆菌ccfm8631可以将石斛原料中大分子多糖分解成小 分子多糖。
[0141]
表4对比例1得到的石斛多糖(未发酵石斛多糖)的分子量分布
[0142] 保留时间mn(数均分子量)mw(重均分子量)mp(峰位分子量)面积%面积113.867281195100149666000649886699.44
218.96714121549137327870.56
[0143]
表5实施例1得到的石斛多糖(罗伊氏乳杆菌ccfm8631发酵石斛多糖)的分子量分布
[0144] 保留时间mn(数均分子量)mw(重均分子量)mp(峰位分子量)面积%面积117.483916330827713815297752.57218.65112291619178713800447.43
[0145]
6.不同提取方法得到的石斛多糖中单糖组成
[0146]
(1)混标的制备和衍生:在真空密封安瓿管中,将各单标(岩藻糖,鼠李糖,阿拉伯糖, 半乳糖,葡萄糖,木糖,甘露糖,果糖,半乳糖醛酸,葡萄糖醛酸)和混标(岩藻糖,鼠李 糖,阿拉伯糖,半乳糖,葡萄糖,木糖,甘露糖,果糖,半乳糖醛酸和葡萄糖醛酸的混合物) 溶解,配制浓度为1.0mg/ml标准溶液,精确吸取250μl混合标准溶液到5ml ep管中,分 别加入0.3mol/l naoh和0.5mol/l pmp(3-甲基-1-苯基-5-吡唑啉酮,甲醇溶解)各250μl, 70℃水浴1h,冷却至室温,加入0.3mo1/l hc1溶液250μl终止反应,再加入250μl氯仿, 振荡摇匀后静置20min,弃去下层氯仿层,萃取三次,水层过膜上机。
[0147]
(2)样品的水解和衍生:分别准确称取实施例1及对比例1得到的石斛多糖10mg于安 瓿管中,加入浓度4mol/l的三氟乙酸(tfa)1ml,真空封管;在120℃高温条件下水解反 应2h,氮气吹干,水解后的溶液分别加入0.3mol/l naoh和0.5mol/l pmp(3-甲基-1-苯基-5
‑ꢀ
吡唑啉酮,甲醇溶解)各0.1ml,70℃水浴1h,冷却至室温,加入0.3mol/l hcl溶液1ml 终止反应,再加入1ml氯仿,振荡摇匀后静置20min,弃去下层氯仿层,萃取三次,水层过 膜上机。
[0148]
(3)agilent 1200配紫外检测器,检测波长245nm;色谱柱:shiseido c18 (4.6mm*250mm*5urn);流动相洗脱液:83%(v/v)0.1m kh2po4,17%(v/v)乙腈。柱 温:25℃;进样体积:10ul,流速:1ml/min。实施例1及对比例1得到的石斛多糖中单糖 组成如表6、表7及图7、图8所示:与对比例1得到的石斛多糖相比,实施例1得到的石斛 多糖(罗伊氏乳杆菌ccfm8631发酵石斛多糖)中的单糖组分减少(对比例1得到的石斛多 糖水解后单糖为阿拉伯糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸,实施例1得 到的石斛多糖水解后单糖为阿拉伯糖、半乳糖、葡萄糖和木糖),且各单糖含量不同,表明: 罗伊氏乳杆菌ccfm8631可以将石斛原料中的多糖转变成新型多糖。
[0149]
表6对比例1得到的石斛多糖(未发酵石斛多糖)的单糖组成
[0150]
[0151][0152]
表7实施例1得到的石斛多糖(罗伊氏乳杆菌ccfm8631发酵石斛多糖)的单糖组成
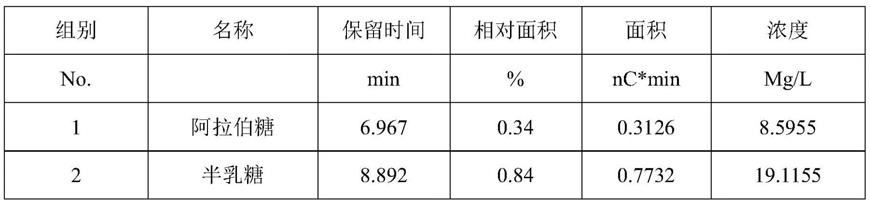
[0153]
组别名称保留时间相对面积面积浓度no. min%nc*minmg/l1阿拉伯糖6.9170.710.19615.39202半乳糖8.8592.930.811320.05753葡萄糖10.06729.048.0504268.84054木糖12.4567.3318.6681449.9542最大值
ꢀꢀ
67.3318.6681 最小值
ꢀꢀ
0.710.1961 总和
ꢀꢀ
10027.7259 [0154]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制, 其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应 为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。