hyperforcinol k在制备预防与治疗非酒精性脂肪性肝病药物中的应用
技术领域
1.本发明属于医药领域,涉及来源于金丝桃属药用植物中的酰基间苯三酚混源萜类化合物hyperforcinol k(hk)在制备防治非酒精性脂肪性肝病药物或保健品中应用。
背景技术:
2.非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,nash)是非酒精性脂肪性肝病(nonalcoholic fatty liver disease,nafld)的进展期,可诱发肝纤维化、肝硬化甚至肝癌,我国nafld总体患病率接近30%,其中约25%是nash,临床尚无治疗nash的有效手段,目前,在研发管线上的抗nash药物主要包括fasn抑制剂(asc40和ft-4101)、acc抑制剂(pf-05221304和firsocostat)、scd-1抑制剂(aramchol)、pparα/δ双重激动剂(elafibranor)、法尼酯x受体(fxr)激动剂(odeoxycholic acid)、趋化因子受体(ccr2/ccr5)双拮抗剂(cenicriviroc)、凋亡信号调节激酶1(ask1)抑制剂(selonsertib)等等。但这些在研化学合成药物有些由于副作用较大(严重瘙痒/心血管事件),有些ii期或iii临床数据未能达到主要终点,使得它们能否上市成为nash治疗药物充满着不确定性。因此发现并探究nash进程中重要靶标及相关药物显得尤为迫切和重要。有研究表明,nash中mtor(mammalian target ofrapamycin)通路呈持续激活状态,且脂代谢紊乱是nash的一个重要表现形式和诱发因素,研究证实mtor可调控脂代谢关键蛋白srebp(sterol regulatory element bindingprotein)从而激活肝脏从头脂肪生成(de novo lipogenesis,dnl),加重脂代谢紊乱。因此,抑制mtor信号通路减少肝脏脂肪合成有可能成为防治nash的有效策略。
3.传统中药黄花香为金丝桃属药用植物栽秧花(hypericum beanii)的根,具有清热利湿,解毒散瘀之功效,主湿热淋病、肝炎等。酰基间苯三酚混源萜类化合物hyperforcinol k(hk)是从黄花香石油醚部位浸膏中分离纯化得到的活性成分之一,分子量为551.37,分子结构式为:
4.文献调研发现hk是贯叶金丝桃素(金丝桃属抗抑郁植物药圣约翰草中的代
[0005][0006]
表活性成分)的衍生物,在多种金丝桃属药用植物中均有发现,是否有预防和治疗nash的作用,尚未有文献报道。
技术实现要素:
[0007]
发明目的:本发明提供了hyperforcinol k的新用途。
[0008]
技术方案:
[0009]
hyperforcinol k在制备预防或治疗非酒精性脂肪肝病药物或保健品中应用。
[0010]
一种药物组合物在制备预防或治疗非酒精性脂肪肝病药物或保健品中应用,其特征在于所述的药物组合物包括hyperforcinol k与药学上可接受的辅料。
[0011]
所述的应用,其特征在于,hyperforcinol k制成口服剂型和非口服剂型;所述口服剂型为片剂、胶囊、散剂或颗粒,所述非口服剂型为注射液针剂。
[0012]
具体而言:
[0013]
本发明用于制备防治非酒精性脂肪性肝炎、肝损伤的药物时,酰基间苯三酚混源萜类化合物hyperforcinol k口服或非口服给药均属安全有效的。口服给药可以制成任何常规剂型,如片剂、胶囊、散剂、颗粒等;非口服用药,可制成注射液针剂等。
[0014]
本发明用于制备防治非酒精性脂肪性肝炎、肝损伤的保健品时,其辅料及制备方法可选用药学上可接受的任何形式。
[0015]
本发明所述化合物hyperforcinol k的给药剂量,可根据给药方式、患病程度、患者年龄、有无既往病史等因素综合考虑进行调整。
[0016]
本发明通过棕榈酸(palmitic acid,pa)诱导hepg2细胞损伤的细胞模型以及高脂饮食(high fat diet,hfd)诱导nash的小鼠模型实验证实hk抑制非酒精性脂肪性肝炎的药理活性。
[0017]
在细胞模型中,共分为两组,其中对照组为bsa刺激的hepg2细胞,模型组为pa刺激的hepg2细胞,给药组为给予不同浓度的hk后pa刺激的hepg2细胞,油红o与bodipy试剂盒检测细胞中脂滴含量;western blot检测细胞中mtor信号通路p-mtor/mtor和p-s6k/s6k的蛋白表达量。
[0018]
在动物模型中,以奥贝胆酸(obeticholicacid,oca)作为阳性药,共分为三组,其中模型组为hfd喂养12周的c57bl/6j雄鼠,阳性药组为喂养hfd和灌胃给予oca的c57bl/6j雄鼠,给药组为喂养hfd和灌胃给予hk的c57bl/6j雄鼠。给药4周后取小鼠血液进行生化指标分析;取小鼠肝脏进行he和油红o染色;检测小鼠血液中甘油三酯(tg)和总胆固醇(tc)含量;检测小鼠肝脏中脂质代谢途径相关基因如胆固醇合成与吸收途径(hmgcr,cyp7a1)、脂肪酸吸收途径(cd36,acc)、脂肪酸合成途径(fasn,srebp1)和脂肪酸氧化途径(cpt1,pparα)的含量。
[0019]
有益效果
[0020]
细胞与动物模型的结果表明:
[0021]
1.pa刺激的细胞模型组中出现数量较多的脂滴聚集,而给药后的细胞内脂滴数目明显减少,说明给药后能显著减少pa诱导的hepg2细胞中脂滴的积累。
[0022]
2.pa刺激后,细胞中p-mtor/mtor和p-s6k/s6k蛋白表达量比值相对于bsa组别中明显升高,说明pa刺激后细胞中mtor信号通路明显被激活,而给药后,细胞中p-mtor/mtor和p-s6k/s6k比值呈剂量依赖性的减少,说明给药后能抑制mtor信号通路的激活。
[0023]
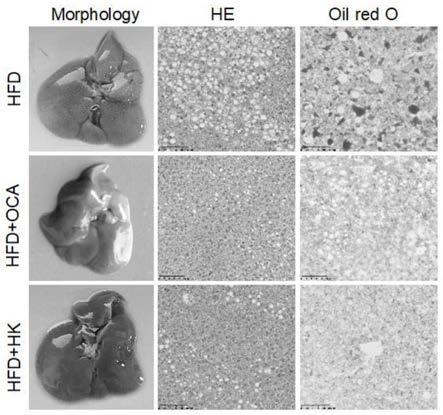
3.阳性药组与给药组小鼠血浆中谷丙转氨酶(alt)/谷草转氨酶(ast)比值较模型组小鼠中明显降低,且给药组小鼠的alt/ast比值略低于阳性药组的,说明给药后能有效缓解小鼠的肝损伤。模型组小鼠肝脏he与油红o染色中出现了明显的脂肪变、气球样变与脂肪沉积,阳性药组和给药组小鼠肝脏中气球样变与脂肪沉积得到明显改善。阳性药组和给药组小鼠血浆中tg和tc含量明显低于模型组小鼠,且给药组小鼠的tg和tc含量低于阳性药组
的,说明给药后有效减少了nash小鼠中脂肪沉积。
[0024]
4.给药组小鼠肝脏中cyp7a1、acc、fasn、srebp1的mrna表达量相对于模型组明显降低,cpt1、pparα的mrna表达量明显升高,说明hk可通过改善小鼠肝脏中脂质代谢从而缓解nash。
[0025]
由此,本发明提供酰基间苯三酚混源萜类化合物hyperforcinol k在制备防治非酒精性脂肪性肝炎药物或保健品中具有良好的市场前景和临床价值。
附图说明
[0026]
图1为pa刺激的hepg2细胞中给予hk 20μm后的油红o染色结果。
[0027]
图2为pa刺激的hepg2细胞中给予hk 20μm后的bodipy染色结果。
[0028]
图3为pa刺激的hepg2细胞中分别给予hk 5,10,20μm后mtor信号通路相关蛋白表达量(a)、mtor定量图(b)和s6k定量图(c)。
[0029]
图4为灌胃给予hk后小鼠脏器的he染色图。
[0030]
图5为灌胃给予oca和hk后小鼠肝脏的形态、he染色图和油红o染色图。
[0031]
图6为灌胃给予oca和hk后小鼠血浆的alt/ast比值。
[0032]
图7为灌胃给予oca和hk后小鼠血浆的tg含量。
[0033]
图8为灌胃给予oca和hk后小鼠血浆的tc含量。
[0034]
图9为灌胃给予hk后小鼠肝脏中hmgcr,cyp7a1,cd36,acc,fasn,srebp1,cpt1,pparα的mrna相对表达量
具体实施方式
[0035]
下面结合附图和实施例对本发明进行详细描述,但所述内容是对本发明的解释而不是限定;下述实施例中的实验方法,除非另有指明,所涉及原料和试剂均为普通市售品,皆可通过市场购买获得。
[0036]
实施例1hyperforcinol k的提取工艺
[0037]
1.实验方法
[0038]
本发明所使用的hyperforcinol k从中药黄花香(hypericum beanii)中提取分离得到,具体为:用黄花香(hypericum beanii)20kg为原料,粉碎后用95%乙醇70l冷浸提取3次,合并3次提取液减压浓缩至干,得到浸膏1.8kg。浸膏用1.5l水混悬后用石油醚萃取,萃取5次,每次溶剂体积为4l,得到石油醚部位萃取物(506.0g)。将石油醚部位浸膏溶解拌样后以3:1的比例(硅胶填料重量:浓缩物重量)上样,通过常压正相硅胶柱色谱进行分离,以体积比分别为100:1、10:1、5:2、1:1、1:5的石油醚和二氯甲烷混合溶液进行梯度洗脱,每个梯度洗脱5个柱体积,收集石油醚比二氯甲烷体积比为10:1的洗脱液,合并且减压浓缩至干得到11.7g淡黄色油状物,后经ods反相键合中压柱色谱纯化,以体积比分别为68:32、78:22、88:12、98:2的甲醇水混合溶液依次进行梯度洗脱,每个梯度洗脱5个柱体积,收集甲醇比水体积比为78:22的洗脱液,合并且减压浓缩至干,再经制备型高效液相色谱分离得到化合物hyperforcinol k(0.87g),核磁数据与文献(j.org.chem.2004,69,7869-7874)对照一致,确定其结构为hyperforcinol k,纯度》95%。
[0039]
2.实验结果
[0040]
无色油状,esi-ms m/z 533.47[m h]
,575.43[m na]
;1h nmr(cdcl3,600mhz)δh1.02(3h,d,j=6.8hz),1.06(3h,s,overlapped),1.07(3h,d,j=7.0hz,overlapped),1.51(1h,m),1.58(1h,m),1.59(2h,m),1.61(3h,s,overlapped),1.62(3h,s,overlapped),1.67(3h,s),1.68(3h,s),1.70(3h,s),1.73(3h,br s,overlapped),1.73(3h,br s,overlapped),1.74(1h,m,overlapped),1.81(3h,s),1.97(2h,m),2.02(2h,m,h
2-20),2.16(1h,br d,j=14.9hz),2.48(1h,m),2.76(1h,dd,j=15.2,10.0hz),3.00(1h,s),5.01(1h,m,overlapped),5.02(1h,m,overlapped),5.09(1h,m,overlapped),5.11(1h,s,overlapped),5.56(1h,d,j=11.3hz),6.12(1h,d,j=11.3hz);
13
c nmr(150mhz,cdcl3)δ
c 207.5,201.4,175.3,147.9,137.6,137.2,134.5,132.0,123.7,122.9,118.4,117.1,102.6,87.2,61.0,50.0,43.5,43.1,39.3,37.8,33.4,32.9,28.3,26.3,26.1,26.1,25.9,21.9,18.7,18.5,18.3,18.2,18.2,17.8,16.6。
[0041]
实施例2 hk对棕榈酸(pa)诱导的hepg2细胞损伤的保护作用
[0042]
1.实验方法
[0043]
1.1脂性培养基制备
[0044]
用pbs配置20%d-bsa(无脂肪酸bsa)溶液;用0.1m naoh溶液配制20mm pa溶液,在70-75℃水浴锅中溶解配制,充分皂化;取等体积的d-bsa溶液迅速加入保温的pa溶液中,可置于50-55℃水浴锅中助溶,得到澄清的10mm pa 10%d-bsa溶液,于超净台中过滤除菌即为棕榈酸脂性培养基(pa储存液),分装后于4℃保存。对照组溶液为20%d-bsa溶液与等体积的0.1m naoh溶液混合后过滤除菌所得溶液(bsa储存液)。
[0045]
1.2构建pa诱导的hepg2细胞损伤模型
[0046]
取pa和bsa储存液,加入细胞培养基中使终浓度为0.1mm,培养16h后进行油红o和bodipy染色或收细胞进行western blot实验。
[0047]
1.3hk处理方法
[0048]
在给药组细胞中给予20μm hk处理48h,最后16h时加入pa储存液使终浓度为0.1mm;模型组细胞用溶剂dmso处理48h,最后16h同样采用pa处理;对照组细胞用溶剂dmso处理48h,最后16h时加入bsa储存液使终浓度为0.1mm。
[0049]
2.实验结果
[0050]
油红o染色结果显示,模型组hepg2细胞在光镜下观察到许多大小不一的、被染为红色的脂滴,细胞核被染为蓝色;给药组中脂滴的数目明显减少,说明细胞脂肪蓄积程度减轻。
[0051]
bodipy染色结果中,脂滴显示出绿色荧光,细胞核由dapi染为蓝色,模型组中的绿色荧光较为明亮,给药组中绿色荧光面积及强度明显减小,说明细胞脂肪沉积量减少。
[0052]
western blot检测细胞中mtor信号通路关键蛋白p-mtor/mtor和p-s6k/s6k比值后,发现模型组中p-mtor
ser2448
与p-s6k
thr389
磷酸化水平显著增加,说明pa诱导能够激活细胞中mtor信号通路;在分别给予5,10,20μm hk后,发现给药组中p-mtor
ser2448
与p-s6k
thr389
磷酸化水平呈剂量依赖性下降,说明hk能够抑制pa诱导的mtor信号通路激活。
[0053]
实施例3hk对高脂饮食(hfd)诱导的nash小鼠模型的影响
[0054]
1.实验方法
[0055]
1.1 nash小鼠模型构建方法
[0056]
采用21只6-8周龄的c57bl/6j雄鼠,随机分为三组,分别为模型组(hfd 溶剂)、阳性药组(hfd oca)和给药组(hfd hk),每组7只。三组小鼠均在8周龄时开始喂养hfd,共12周;16周龄时开始灌胃给药,模型组灌胃给予溶剂橄榄油,阳性药组灌胃给予10mg/kg的oca,给药组灌胃给予20mg/kg的hk,共灌胃4周。
[0057]
1.2样本采集
[0058]
模型到期后,小鼠禁食不禁水6小时,摘眼球取小鼠全血,采血管事先用肝素钠浸润,取血后冰上放置半小时,4℃、4000rpm离心10min,小心吸取上清得到血浆,分装后保存于-80℃。取血后取小鼠肝脏,记录小鼠当天体重和对应肝重,肝脏最大叶放入多聚甲醛固定,进行后续组化分析,其余叶经液氮速冻后于-80℃保存。
[0059]
1.3实时荧光定量pcr(real time quantitative polymerase chain reaction,rt-qpcr)
[0060]
首先采用rna提取试剂盒提取细胞或组织中总rna,酶标仪测定rna浓度,取1μg rna用试剂盒逆转录成cdna,可于-20℃保存作后续实验用。将适量的cdna用rnase free dh2o稀释5倍,按说明书配置好pcr反应液,反应条件如下:
[0061]
表1 rt-qpcr反应条件
[0062][0063]
实验中用到的引物序列如下:
[0064]
表2相关基因的引物序列
[0065]
geneforward primer(5
’→3’
)reverse primer(5
’→3’
)hmgcratcatgtgctgcttcggctgcataaattggacgaccctcacggctcyp7a1ctgggctgtgctctgaagtttgccttcgcagaagtagtgtcd36gagccatctttgagccttcggaaccaaactgaggaatggaccggccagtgctatgctgagatagggtcaagtgctgctccafasntgggttctagccagcagagtaccaccagagaccgttatgcsrebp1tggattgcacatttgaagacatggccagagaagcagaagagacpt1ctccgcctgagccatgaagcaccagtgatgatgccattctpparαtattcggctgaagctggtgtacctggcatttgttccggttct
[0066]
1.4蛋白免疫印迹(western blot,wb)
[0067]
(1)配置分离胶与浓缩胶:夹好厚薄玻璃板,按比例配制适量的分离胶溶液,混匀后小心倒入玻璃板间隙中,倒至离顶部约1cm处,沿一侧缓慢加入超纯水覆盖胶面,室温静置30-60min使浓缩胶凝固,待胶层与水层之间有一条清晰明显的分界线时,小心倒去超纯水,用滤纸吸干残余水分,将配置好的浓缩胶溶液用移液枪加在分离胶上方,并迅速插入干净的梳齿,注意不要产生气泡,室温放置15-45min使分离胶凝固,如不立即电泳,可用湿纸巾包裹后4℃保存。
[0068]
(2)电泳:将配好胶的玻璃板夹好放入电泳槽中,倒入适量电泳液,竖直向上拔出梳齿,用细枪头将煮好的蛋白样品缓缓加入各个泳道中,两端分别加入少量蛋白预染marker,上样完成后接通装置电源,恒压80v开始电泳。当蛋白样品完全进入分离胶后,可将电压调高至120v加速电泳,直至溴酚蓝前沿接近分离胶底部,电泳完成。
[0069]
(3)湿法转膜:取出玻璃板并轻轻撬开,依据marker位置切取目的凝胶条带,暂放入转移缓冲液中,剪取合适大小的pvdf膜,甲醇活化5-30s后放入转移缓冲液中,按转膜夹白面-海绵-滤纸-pvdf膜-凝胶-滤纸-海绵-转膜夹黑面的顺序固定好转膜夹,注意凝胶与pvdf膜之间不能产生气泡,放入转移槽中并倒入适量的转移缓冲液,整个转移槽置于冰水浴中,恒流300ma转膜30-60min。
[0070]
(4)封闭:转膜结束后取出pvdf膜,做好标记,放入tbst配置的5%脱脂奶粉中,脱色摇床上摇晃封闭30-60min。
[0071]
(5)一抗和二抗孵育:封闭结束后,tbst溶液洗膜3次,每次10min,将膜放入塑封膜或者抗体孵育盒中,加入适量的一抗稀释液,封口或盖紧盖子,室温下孵育1h,4℃孵育过夜。一抗孵育结束后回收,tbst溶液洗膜3次,每次10min,将膜放入塑封膜或者抗体孵育盒中,加入适量的二抗稀释液,封口或盖紧盖子,室温下孵育1-2h。
[0072]
(6)显影:二抗孵育结束后,tbst溶液洗膜3次,每次10min,期间配置ecl发光液,在膜上均匀滴上发光液,采用chemidoc xrs 凝胶成像系统拍照成像,而后使用image lab软件处理图像并定量。
[0073]
1.5数据统计方法
[0074]
采用graphpad prism 7软件作统计分析,数据用平均值
±
标准误(mean
±
s.e.m.)表示,两组数据采用t检验统计,多组数据采用单因素方差分析(one-way anova)统计,分析结果*表示p《0.05,有显著性差异;**表示p《0.01,有特别显著性差异;***表示p《0.001,有极显著性差异。
[0075]
2.实验结果
[0076]
2.1hk对小鼠无毒
[0077]
造模结束后收集模型组与给药组小鼠的各脏器,观察脏器病理染色,无中毒迹象及死亡发生,表明药物安全性较高。
[0078]
2.2hk能显著缓解nash小鼠模型的肝脏损伤
[0079]
收集模型组、阳性药组和给药组小鼠的血液和肝脏后,检测血浆中alt/ast比值发现(表3),阳性药组与给药组小鼠中alt/ast比值相对于模型组均明显下降,且给药组小鼠中alt/ast比值相对于阳性药组更低,说明hk能有效缓解hfd诱导的小鼠肝损伤。
[0080]
检测血浆中tg、tc含量发现,阳性药组与给药组小鼠中血浆的tg、tc含量均明显降低,且给药组小鼠中tg、tc含量相对于阳性药组的更低,说明hk能够有效减少hfd诱导的小鼠肝脏中脂质积累。
[0081]
表3.hk对nash小鼠血浆中alt/ast、tg、tc含量的影响
[0082] alt/astplasmatg(mmol/l)plasmatc(mmol/l)模型组1.50
±
0.040.70
±
0.037.24
±
0.26阳性药组1.11
±
0.03**0.56
±
0.03*5.94
±
0.45*给药组0.95
±
0.13***0.50
±
0.04**5.93
±
0.26*
[0083]
与模型组相比,*p《0.05,**p《0.01,***p《0.001
[0084]
2.3 hk可改善nash小鼠肝脏的脂质代谢
[0085]
通过rt-qpcr检测肝组织脂代谢相关基因的mrna水平,给药后,胆固醇合成的cyp7a1显著增加,脂肪酸吸收的acc下降,脂肪酸合成的srebp1c与fasn均显著下调,脂肪酸β氧化的cpt1和pparα均显著上升,这些结果表明给予hk后,小鼠肝脏的脂肪酸从头合成明显减少,氧化增多,因此肝脏脂肪变程度减轻,说明hk可以从脂肪变性的起始环节介入,实现干预nash进程的作用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。