1.本发明属于水草组培繁殖技术领域,具体涉及一种水草组培污染菌的防治方法。
背景技术:
2.植物组织培养技术是20世纪初以植物生理学为基础发展起来的一门新兴技术,已广泛地应用于生产和科研,并且在许多农作物生产中发挥巨大的优势和作用,实现了种苗产业化,并取得巨大的经济效益和社会效益。尽管组织培养理论研究已相当精深,但在生产上应用时仍存在一些不足之处,如组织培养中培养基的污染问题一直是该领域的技术盲区,尤其是水草组培的防污染方面,目前鲜见报道。
3.通常情况下,若在接种前发现组培瓶内细菌污染,可能是培养瓶不干净而带有不易被杀死的耐高压、高温的杂菌引起的;若在接种后发现组培瓶细菌污染,可能是植物材料本身带菌引起的,也可能是由于使用了未彻底消毒的接种工具,操作者的不规范操作造成的,或者是接种者未能及时发现污染苗,在接种过程中由于交叉感染而造成的;若在接种前组培瓶内存在大量真菌污染,多数情况是由于培养基瓶口封得不严、超净工作台的滤网已经不干净或培养基存放的环境中真菌孢子浓度过大导致的;若接种后组培瓶内发现外植体周围出现真菌污染,可能是因为外植体材料就携带有内生菌导致的;若在组培瓶内发现污染的真菌是零星的分散在培养基中,则可以确定是人为因素带入造成的。在水草组培过程中,因操作不当和灭菌不彻底等其它因素易发生接种的茎段、节段和芽尖等染菌现象,如图1所示,茎段周围出现颜色呈青色、白色、或黄色且形状呈雾状、弥散状或粘稠状的菌落,这导致愈伤组织无法正常进行分生、分化,使组培过程被遏制在早期,白白耗费大量的人力、物力和财力,而无法获得正常的水草苗,用于后期扩繁、科研实验和市场销售。
4.对于上述情况,若在接种前的植物组培过程中,进行严格的实验操作可以对大部分菌污染起到较好的预防效果,但是对工作人员的知识和能力要求较高,且对仪器设备要求先进齐全,导致总体成本较高。目前,常规的植物组培抑菌方法多为通过加青霉素、头孢霉素、利福平等抗生素和多菌灵、代森锰锌与百菌清等农药来抑制杂菌生长,不仅成本较高、操作不便,且有一定的药物残留,产生不良的环境污染。然而,目前大多数抑菌研究报道多集中在陆生的经济作物和园艺植物上,对水生的水草抑菌研究较少。
5.公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
6.本发明的目的在于提供一种水草组培污染菌的防治方法,该方法通过分离鉴定出水草组培污染的优势菌种类,并针对分离、鉴定水草组培苗污染的优势菌株进行药物的筛选和治疗,筛选出可有效抑制杂菌生长的药物,来预防染菌情况的发生,从而确保组培苗的正常分化和生长。
7.为实现上述目的,本发明提供了一种水草组培污染菌的防治方法,包括如下步骤:
8.(1)取水草外植体进行组织培养,观察外植体生长情况,判断是否发生污染菌感染;
9.(2)挑选污染明显和出现症状较为频繁的污染菌进行分离及鉴定,确定污染菌的种类;
10.(3)根据污染的种类选择合适的抑菌制剂,并加入至组织培养基中,进行水草组培繁殖。
11.具体的,所述步骤(1)中,还包括将所述水草外植体进行清洗并消毒的步骤。
12.具体的,所述步骤(1)中,所述组织培养的培养基包括ms培养基。
13.具体的,所述步骤(2)中,所述污染菌包括隔孢伏革菌属、寡营养丛孢霉菌株、枝孢菌属。
14.具体的,所述步骤(3)中,所述抑菌制剂包括卡那霉素、氯霉素和/或山梨酸钾。
15.具体的,所述步骤(3)中,所述抑菌制剂的添加浓度包括:
16.所述卡那霉素的终浓度为25~100mg/μl,优选50mg/μl;
17.所述氯霉素的终浓度为10~50mg/μl,优选25mg/μl;
18.所述山梨酸钾的浓度为0.015625~0.0625wt%,优选0.015625wt%。
19.具体的,所述步骤(3)中,所述水草组培繁殖步骤包括叶芽诱导的步骤、生根培养的步骤以及炼苗和移栽的步骤。
20.具体的,所述步骤(3)中,所述叶芽诱导步骤的组织培养基包括ms培养基。
21.具体的,所述步骤(3)中,所述生根培养步骤的组织培养基包括1/2ms培养基。
22.本发明还公开了所述方法在水草组培领域的应用。
23.本发明所述水草组培污染菌的防治方法,通过对污染菌中优势菌的分离鉴定,并基于组培瓶污染优势细菌和真菌的种类分离与鉴定结果,针对性的筛选出抑菌效果突出的防治方式。本发明所述水草组培污染菌的防治方法,采用常见抗生素的卡那霉素、氯霉素及山梨酸钾联合抑菌的方法,可同时抑制水草组培瓶内优势细菌和真菌的污染,通过组培培养基的优化有效预防并解决水草组织培养过程中的污染问题,使水草可以顺利进行生长及分化,并且,可将已污染组培瓶的正常部分转移其上,顺利进行再次扩繁并正常生长,以达到应急抢救污染植株的效果。
24.本发明所述水草组培污染菌的防治方法,一定程度上降低了组培实验的操作难度,对有效提高成苗率和后期组培中心工厂化生产能力具有重大的实际意义。
附图说明
25.图1为水草茎段早期和中早期染菌情况;其中,a:正常茎段;b:染菌后的茎段;c:正常分化的水草幼苗;d:染菌后的水草幼苗;
26.图2为组培容器内细菌污染的表型特征;其中,a-f:组培过程中组培平皿内细菌污染;
27.图3为污染源细菌的16s rdna序列电泳检测图;其中,m:dna maker;1-2:a-1和a-2;3-5:b-1、b-2和b-3;6-9:c-1、c-2、c-3和c-4;10:d;11-12:e-1和e-2;13-16:f-1、f-2、f-3和f-4;
28.图4为水草组培培养基的真菌污染情况;其中,a:白色羽毛状的真菌;b:白色成团
状的真菌;c:青黑色的毛状真菌;
29.图5为污染源真菌的its序列电泳检测图;其中,m:dna maker;1-3:a1、g和h;
30.图6为抗生素、纳米银和山梨酸钾对真菌的抑制作用,按列观察,从左至右依次为:0.25%的山梨酸钾、1000ppm的纳米银、200mg/μl的壮观霉素、25mg/μl的氯霉素和空白对照组;
31.图7为山梨酸钾对水草幼苗生长的影响,由上至下分别是:正面观和反面观;
32.图8为水草组培及移栽实践流程图。
具体实施方式
33.下面结合附图,对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
34.除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
35.实施例1细菌的分离、鉴定及保藏
36.通过查阅文献资料,本实施例针对水草组培出现污染菌的现象进行探索研究,分离并鉴定水草组培污染的优势菌。
37.本实施例中,水草采自山东省潍坊市水草水美超市,水族箱设备采自青岛市北区鹿疆造景有限公司。
38.本实施例中,组培培养基为:ms (1mg/l)kt (1mg/l)iba 0.2%活性炭 3%蔗糖 0.65%琼脂粉;其中,ms购于青岛高科技工业园海博生物技术有限公司,琼脂粉购于北京索莱宝科技有限公司,蔗糖购于国药集团化学试剂有限公司,活性炭购于天津恒兴化学制造有限公司,kt、iba皆购于上海麦克林生化科技有限公司;
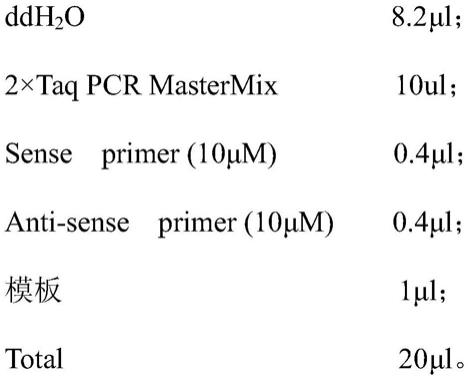
39.本实施例中,2
×
taq pcr mastermix购于青岛睿博兴科生物技术有限公司,16s rdna通用引物(27f:5
’‑
agagtttgatcctggctca-3’;
40.1492r:5
’‑
ggttaccttgttacgactt-3’)(liu et al.,int j syst evol microbiol.2018)由青岛睿博兴科生物技术有限公司合成。
41.本实施例中,研究基于水草(红丝青叶、宫廷草等)的组织培养研究,水草外植体采用75%酒精浸泡30s,20%h2o
2 10min,进行表面消毒,用无菌水洗3-6次后接种于组培培养基中,当外植体周围或培养基表面产生明显的诸如黏液状或浑浊的水渍状、油污状和云雾状痕迹,甚至出现泡沫发酵状,或干缩的呈现红、黄、乳白等颜色的菌落时,即为受到了细菌污染(如图2所示),这些污染菌包括外植体本身材料带菌(内生菌)和消毒处理过程中引入的菌(外来菌)。
42.进一步,挑选污染明显和出现症状较为频繁的污染菌于lb培养基划线,挑取单菌落置于液体lb培养基,后放置摇床进行150rpm
×
16h震摇,一式三份,其中两份加终浓度15%左右的甘油混匀后置于-20℃和-80℃分别保存备用;另一份以菌液为模板进行16s rdna序列分析。
43.本实施例中,pcr配制体系如下,所用引物分别为16s rdna的通用检测引物:
[0044][0045]
本实施例中,pcr反应条件为:95℃5min;95℃30sec-55℃30sec-72℃1min,共计30个循环;72℃5min;16℃∞。
[0046]
反应结束后,取各反应产物5μl在的1.2%的琼脂糖凝胶上180v电泳10min,电泳检测并拍照(见图3),剩余反应产物送青岛睿博兴科生物技术有限公司完成测序。测序结果采用ncbi blast软件进行序列比对,选取相似度最高(99%或100%)的作为菌种归属的判断标准,比对结果如下表1所示。
[0047]
表1污染源细菌序列的比对分析
[0048][0049]
[0050]
实施例2污染细菌的防治
[0051]
在上述实施例中,外植体在组培前虽然进行了严格的消毒灭菌,但几天后仍发现严重的菌污染现象,污染率高达60%以上,并且一旦被污染,菌落就会很快布满培养基表层及外植体的基部,大量消耗营养,造成外植体停止生长的现象,最终逐渐枯萎死亡,严重影响组培苗的正常生长和分化。
[0052]
按照抗生素:培养基=1:1000的比例分别向液体培养基中加入卡那霉素(kanamycin,kan
,50mg/μl)、氨苄青霉素(ampicillin,amp
,100mg/μl)、红霉素(erythromycin,ery
,250mg/μl)、壮观霉素(spectacular mycin,spc
,200mg/μl),氯霉素(chloromycetin,chl
,25mg/μl)的方法,对细菌进行抑制,结果如下表2所示。
[0053]
表2外加抗生素抑制污染源细菌生长的情况
[0054][0055][0056]
注:“ ”表示添加抗生素对细菌生长无抑制作用;
“‑”
表示添加抗生素对细菌生长有抑制作用。
[0057]
可见,卡那霉素和氯霉素对细菌抑制效果明显,因此,本方案确定将终浓度50mg/μl的卡那霉素和25mg/μl的氯霉素添加到ms培养基中。
[0058]
实施例3真菌的分离鉴定
[0059]
本实施例涉及试验材料同实施例1。
[0060]
当外植体周围或培养容器内出现白色、黑色、绿色等不同颜色的菌丝块,即主要污染源为真菌,其中最为常见的是曲霉属、毛霉属和青霉属真菌,主要种类为镰孢菌、拟茎点
霉种腐菌和黑斑菌等。如图4所示结果,白色羽毛状的真菌a1、白色成团状的真菌g和青黑色的毛状真菌h。这些病菌主要以菌丝形式传播,其污染特点为病原初期生长缓慢,形成明显菌丝约需3-5d时间,但形成明显菌丝后,仅需2~3d后菌丝便可迅速蔓延至整个培养器皿。
[0061]
本实施例中,针对上面的污染源的真菌菌株的进行分离、鉴定。
[0062]
首先,用无菌镊子夹取菌丝转移至新配制的灭菌pda培养基上,分成两份:一份用于分离菌丝进一步严格无菌纯培养;另一份取菌丝块,采用真菌基因组dna提取试剂盒(solarbio,beijing)进行真菌基因组dna的提取,进行its序列分析(white et al.,in book:pcr protocols(pp.315-322).1990),its引物为:its1(sense primer):5
’‑
tccgtaggtgaacctgcgg-3’;its4(anti-sense primer):5
’‑
tcctccgcttattgatatgc-3’,由青岛睿博兴科生物技术有限公司合成。
[0063]
pcr配制体系和反应条件同实施例1。
[0064]
反应结束后,同样进行测序和序列比对(如附图5),结果如下表3所示。
[0065]
表3污染源真菌序列的比对结果分析
[0066]
样品名称菌落特征菌英文名菌中文名a1白毛peniophora sp.隔孢伏革菌属g乳白色无味plectosphaerella oligotrophica strain寡营养丛孢霉菌株h绿毛无味cladosporium crousii isolate枝孢菌属
[0067]
实施例4污染真菌的防治
[0068]
本实施例中,我们尝试使用各种生化药物进行真菌的抑菌实验。结果显示,纳米银和抗生素(25mg/μl的氯霉素、200mg/μl的壮观霉素)对其无效(如图6所示结果),250mg/μl的红霉素、50mg/μl的卡那霉素也是一样(图片未显示)。然而,质量分数为0.25%的山梨酸钾能够完全抑制多种真菌的生长(图5中最左列),并且,质量分数低于0.25%的山梨酸钾依然有很好的抑菌效果(图片未显示)。
[0069]
进一步,本实施例通过在培养基中添加山梨酸钾和苯甲酸钠(见下表4),实验结果显示:
[0070]
(1)在接种7d后,在质量分数小于0.0625%的情况下,山梨酸钾和苯甲酸钠组均表现正常,但14d后,苯甲酸钠组各浓度均表现不良,如0.015625%和0.03125%的苯甲酸钠分别表现为50%染菌和轻微枯叶,而0.015625%和0.03125%的山梨酸钾组均表现良好,因此,山梨酸钾组优于苯甲酸钠组的抑菌效果;
[0071]
(2)虽然山梨酸钾浓度越高,抑菌效果越好,但高浓度的山梨酸钾不利于幼苗的生长。
[0072]
表4山梨酸钾和苯甲酸钠的抑菌结果统计
[0073][0074]
对此,本实施例逐级降低山梨酸钾的用量,分别降低至0.25%、0.125%、0.0625%、0.03125%、0.015625%,进行抑菌培养。
[0075]
结果显示,0.015625%和0.03125%的山梨酸钾均有很好的抑菌效果且并不影响苗子的正常生长(如图7所示)。因此,本技术选择0.015625%的山梨酸钾作为最终使用浓度。随后,将组培获得幼苗顺利移栽入水族箱,并且幼苗长势优佳,没有发现任何不良现象(如图8所示)。
[0076]
综上,本实施例通过在传统ms培养基中添加25mg/μl的氯霉素、50mg/μl的卡那霉素和0.015625%山梨酸钾,起到很好的抑制细菌和真菌的效果,可以使愈伤组织顺利度过易染菌的早期,最终完成整个组培分生、分化过程,长成美丽的水草幼苗。
[0077]
实施例5红丝青叶的快繁培养
[0078]
本实施例所述红丝青叶的快繁培养,包括如下步骤:
[0079]
(1)红丝青叶切段消毒
[0080]
选择生长健壮,颜色鲜绿,无病虫害的红丝青叶作为外植体,用自来水冲洗干净,再用纱布吸干,用75%酒精浸泡30s,2%naclo消毒10min,无菌水冲洗3~5遍后,切除与灭菌剂接触部分,备用;
[0081]
(2)红丝青叶芽诱导
[0082]
选择添加如下组分的ms固体培养基:琼脂0.65% 3%蔗糖 1.0mg/l 6-kt 1.0mg/l iba 0.015625%山梨酸钾 0.2%活性炭,ph调至5.8
±
1;固体培养基经过121℃灭菌处理20min,冷却至50℃左右后,加入终浓度50mg/μl的卡那霉素和25mg/μl的氯霉素,混匀后倒入组培瓶(约50ml/每瓶),接入灭菌处理后的0.5~1cm的红丝青叶外植体,每瓶接种一个茎段,实验设5次重复,于光照培养箱中静置培养观察3-4周,待幼芽长至1.0-1.5cm进行生根培养;
[0083]
(3)生根培养
[0084]
按照如下组分配比配制1/2ms固体培养基:琼脂0.65% 3%蔗糖 0.5mg/liba 0.015625%山梨酸钾 0.2%活性炭,ph调至5.8
±
1,固体培养基装于200ml组培瓶中,每瓶50ml;固体培养基经过121℃灭菌处理20min,冷却至50℃左右后,加入终浓度50mg/μl的卡那霉素和25mg/μl的氯霉素,混匀后倒入组培瓶(约50ml/每瓶),接入步骤(2)中的诱导的丛生芽,培养观察4周左右,待生根;
[0085]
(4)炼苗和移栽
[0086]
待步骤(3)中无菌苗长至4.0cm即可取出后放入小型水族箱进行生长观察,期间可滴加营养液和补充光照,以供给充足营养。
[0087]
经观察发现,通过前期抑菌剂的添加,红丝青叶水草的外植体顺利度过易染菌的早期,顺利进入分生、分化阶段,长出正常健康的芽、茎、叶片和根,且移栽入水族箱后,表现良好,叶片舒展新绿,茎节挺直,根系白透,无任何畸形、矮小、脱色等不良现象。后期也不断分生出新的腋芽,摘取后移栽入水族箱,均生长良好。
[0088]
实施例6宫廷草的快繁培养
[0089]
本实施例所述宫廷草的快繁培养步骤同前述实施例5中方案,其区别仅在于:
[0090]
所述ms固体培养基包括:琼脂0.65% 3%蔗糖 0.5mg/l 6-kt 0.25mg/lga3 0.2%活性炭 0.015625%山梨酸钾 50mg/μl的卡那霉素和25mg/μl的氯霉素;
[0091]
所述1/2ms固体培养基包括:琼脂0.65% 3%蔗糖 0.25mg/l iba 0.2%活性炭 0.015625%山梨酸钾 50mg/μl的卡那霉素和25mg/μl的氯霉素。
[0092]
经观察发现,通过前期抑菌剂的添加,宫廷草的外植体顺利度过易染菌的早期,顺利进入分生、分化阶段,长出正常健康的芽、茎、叶片和根,且移栽入水族箱后,整体表现良好,植株茂密成簇,叶片稚嫩新绿,茎节柔软,根系白透,无任何畸形、矮小、衰老等不良现象,后期可摘取顶端部分,移栽入水族箱进行无性繁殖,均生长良好。
[0093]
实施例7金鱼藻的快繁培养
[0094]
本实施例所述金鱼藻的快繁培养步骤同前述实施例5中方案,其区别仅在于:
[0095]
所述ms固体培养基包括:琼脂0.6% 3%蔗糖 0.5mg/l 6-ba 1.30mg/l iaa 0.2%活性炭 0.015625%山梨酸钾 50mg/μl的卡那霉素和25mg/μl的氯霉素;
[0096]
所述1/2ms固体培养基包括:琼脂0.65% 3%蔗糖 0.5-2.00mg/l 6-ba 0.01~1.00mg/l iaa 0.2%活性炭 0.015625%山梨酸钾 50mg/μl的卡那霉素和25mg/μl的氯霉素。
[0097]
经观察发现,前期抑菌剂的添加可使金鱼藻的外植体顺利度过组培早期,顺利进入分生、分化阶段,长出正常健康的芽、茎、叶和根,且移栽入水族箱后,植株叶片稚嫩油绿,茎节成簇柔软,无任何畸形、矮小等生长不良现象。后期可摘取顶端部分或腋芽部分,移栽入水族箱进行无性繁殖,且生长良好。
[0098]
实施例8绿萝的快繁培养
[0099]
本实施例所述绿萝的快繁培养步骤类同前述实施例5中方案,其区别仅在于:
[0100]
所述ms固体培养基包括:琼脂0.65% 3%蔗糖 1.00mg/l 6-kt 0.01mg/l iba 0.2%活性炭 0.015625%山梨酸钾 50mg/μl的卡那霉素和25mg/μl的氯霉素;
[0101]
所述1/2ms液体培养基包括:0.1mg/l iba 0.2%活性炭 0.015625%山梨酸钾 50mg/μl的卡那霉素和25mg/μl的氯霉素。
[0102]
经观察发现,前期抑菌剂的添加可使绿萝的外植体幼嫩茎段顺利度过组培早期,顺利进入分生、分化阶段,诱导出不定芽,芽的生长旺盛,增殖率高,利用1/2ms 0.1mg/l的培养液进行瓶外扦插生根,生根迅速,生根率达到95%以上,根的数量多,且根粗壮,待根长到3.0~5.0cm时可驯化移栽。移栽入水族箱生长一段时间后,植株叶片油绿,无任何畸形、矮小等不良现象。后期可腋芽部分,移栽入水族箱进行无性繁殖,均生长良好。
[0103]
实施例9碗莲的快繁培养
[0104]
本实施例所述碗莲的快繁培养步骤类同前述实施例5中方案,其区别仅在于:
[0105]
(1)将碗莲顶芽中的茎尖进行常规消毒后,接种于固液结合培养基上,固液结合:上层为5ml厚的ms 1.0mg/l 6-ba 0.25mg/l naa 1.0mg/l ga3液态培养基,下层为1cm厚的ms 1.0mg/l 6-ba 0.25mg/l naa 1.0mg/l ga3固态培养基(0.7%琼脂)。每瓶接种一个茎尖,实验设2个重复,20~30d后观察效果。上、下层培养基均加入终浓度50mg/μl的卡那霉素、25mg/μl的氯霉素和0.015625%山梨酸钾作为抑菌剂,用于抑菌;
[0106]
(2)碗莲芽增殖
[0107]
将已分化的丛生芽切成单芽后又接种在添加如上抑菌剂 ms 2.00mg/l的6-ba 0.25mg/l的iba 30.00g/l葡萄糖的增殖培养基(0.7%琼脂)上,进行继代培养(40d继代一次);
[0108]
(3)碗莲生根培养
[0109]
选择ms或1/2ms 0.05~1.00mg/l 6-ba 1.00mg/l iba或0.3mg/l iaa(0.7%琼脂 3%蔗糖),培养基中同样要添加上述抑菌剂,接入幼芽置于光照培养箱中静置,进行生根诱导培养;
[0110]
莲藕组培研究中光照时间一般用12h/d,红光下莲藕组培苗生长最佳,叶面积大、叶色深、茎粗壮、根系发达.培养30d后,生长量达到6.2g,繁殖系数可达4.8。其次为白光,生长量为5.7g,繁殖系数为4.6。蓝光条件下组培苗干物质含量最大,达到18.7%,叶片深绿、伸展少,叶茎短、粗壮,根系发达,但生物产量只有红光的77.4%。黄光和绿光不利于莲藕组培苗生长;
[0111]
(4)炼苗和移栽
[0112]
将已生根的植株在培养室里先炼苗5d后,然后再去掉封口膜再炼苗2d,然后取出植株,洗净根上附带的培养基,移植到配制好的基质中(基质为糖泥加草炭加蛭石,比例为2:1:1,先加水搅拌成泥浆状,静置2~3d),然后遮阴,套塑料薄膜保持空气湿度85%左右,置于室温20~25℃环境中培养观察30天左右;
[0113]
经观察发现,前期抑菌剂的添加可使碗莲的外植体顶芽中的茎尖顺利进入分生、分化阶段,诱导分化出丛生芽,增殖率高,将已分化的丛生芽切成单芽后又转移于上述(2)增殖培养基中,苗的增殖、生长状况比较好,增殖倍数较高,且此时苗仍处于旺盛的生长状态;将诱导获得的丛生芽切成单芽后,再转移到生根培养基上进行诱导,5d后有根原基发生,14d后便可开始生根,25d生根率达82.5%,根长4.5cm,根数2~6条,生根后芽可进一步伸长,20d每节都可长出5~9条须根,生根率100%;炼苗后进行移栽,莲藕组培苗生长俱佳,叶面积大、叶色深、茎粗壮、根系发达。
[0114]
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变
和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。