1.本发明属于植物小分子活性肽领域,具体涉及一种人参来源的小分子抗血管生成及抗肿瘤活性肽及其制备方法和应用。
背景技术:
2.生物活性肽的分布十分广泛,对机体的生命活动有重要的生理作用。许多生物活性肽通常都是以非活性的状态存在于蛋白质的长链中,可以通过适当的蛋白酶进行水解,将其分子片段和活性释放出来。与蛋白质相比,生物活性肽的结构更简单,消化吸收更快更好,稳定性较高,免疫原性较低甚至无免疫原性,同时还具有多种生物学功能,如抗氧化、免疫调节、降血压、抗炎、抗癌等。活性多肽类已应用于药物、营养治疗、保健、食品等领域,而且越来越多的多肽药物被开发并应用于临床。当前多肽药物主要来源于一些天然多肽或内源性多肽,存在生物体内含量低、提取难、难以获得等问题,随着生物酶解技术的兴起与不断进步,酶解来源的活性多肽成为获得活性多肽的有效途径,应用前景广阔。
3.我国资源丰富,研究和开发酶解活性多肽的原料众多,从植物到动物,从陆地到海洋。目前已有报道从不同来源的蛋白酶解液中分离出抗氧化、降血糖等功能的活性肽,例如大豆、苦瓜、骨胶原、海洋鱼、牡蛎、大鲵等。
4.人参是五加科人参属多年生草本植物,在我国药用历史悠久,自古就有“人参冠百草”的称号。我国现存最早的药物学专著《神农本草经》中记载:“人参味甘微寒,主补五脏,安精深,定魂魄,止惊悸,除邪气,明目,开心益智。久服,轻身延年。”现代药理学研究表明人参具有抗氧化、抗疲劳、改善大脑功能、抗肿瘤、增强免疫力、降血糖、保肝、调整血压、抗衰老等作用。人参蛋白通过不同的蛋白酶酶解可获得多种活性肽段。当前关于人参中活性肽的抗氧化、降血糖功能,已有相关报道,如专利cn201910600912.5报道了一种添加人参低聚肽的抗氧化食品组合物;专利cn201810646091.4报道了一种添加人参肽的辅助降血糖产品组合物;专利cn201510357188.x报道了一种吉林人参低聚肽的抗氧化作用,但是其中的人参肽成分都是酶解技术制备的混合肽,没有经过分离纯化,导致肽的种类复杂,肽段的氨基酸序列不清楚,具体哪种肽发挥作用不明确,功效不显著。目前未有人参来源的、通过分离纯化得到明确氨基酸组成的、具有抗血管生成及抑制肺癌肿瘤生长作用的活性肽的报道。
5.目前在中国,肺癌的发病率排在所有恶性肿瘤中的第一位,是威胁人类生命健康最大的恶性肿瘤之一。传统的治疗手段主要是手术结合放、化疗,周期长,毒副反应大,而且许多肺癌患者发现时已经是晚期,治疗效果不理想。自1971年肿瘤新生血管学说提出以来,肿瘤血管生成已经被确定为治疗恶性肿瘤的重要靶标。新生血管的形成对于实体肿瘤的生长和转移非常重要,新生血管能为肿瘤细胞带来丰富的养料,肿瘤细胞还可以通过新生血管向外转移扩散。而且肺癌的治疗费用较高,也给社会和家庭都带来严重的经济负担。因而开发具有良好抗血管生成及抗肿瘤作用、廉价易得的药物具有十分重要的意义。
技术实现要素:
6.本发明针对上述存在问题、现状及发展前景,从人参低聚肽中分离纯化获得一种抗血管生成及抗肿瘤活性肽,该活性肽分子量小,活性强,易于分离纯化,制备工艺简单,纯度高,可用于肺癌等相关疾病的保健及治疗,在食品、保健品及医药生物等领域有广阔的应用前景。
7.本发明为实现上述目的所采取的技术方案为:
8.本发明的有益效果:
9.(1)本发明在前期对人参低聚肽进行高效液相色谱-质谱分析鉴定和利用在线数据库进行活性筛选,获得高活性小分子肽,在此基础上利sephadex lh-20凝胶柱层析及高效液相色谱等分离技术对此活性肽进行分离纯化,验证其活性,最终获得一个高抗血管生成及抗肿瘤活性肽,其氨基酸序列为:leu-asp-asp-pro-val-phe-arg-pro,经在线数据库biopep及erop-moscow检索,所述序列为新的小分子活性肽。
10.(2)该活性肽的分子量小,活性高,分离纯化步骤简单,易于获得,属食源性的活性肽,具有抗血管生成活性及抑制肺癌肿瘤生长的作用,可应用于肺癌等相关疾病的保健、治疗及相关产品的开发,在医药领域等有广阔的应用前景。
11.(3)在此基础上,对此抗血管生成活性肽进行计算机辅助药物设计,发现众多具有潜在抗血管生成活性的小分子肽,后续可进一步进行活性的验证及相关的产品的研究开发。
附图说明
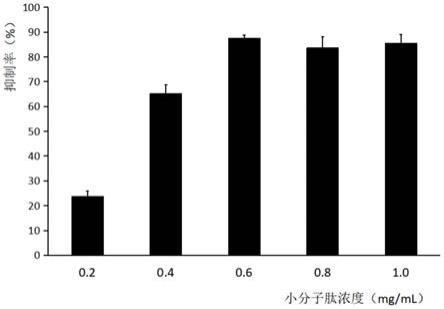
12.图1为本发明小分子活性肽的血管生成抑制率图。
13.图2为本发明小分子活性肽对lewis肺癌小鼠的抑癌率图。
14.图3为实施例3中小分子活性肽的血管生成抑制率图。
具体实施方式
15.下面结合附图与实施例对本发明进一步说明,但本发明不局限于具体实施例。
16.实施例1
17.一种人参(panax ginseng c.a.meyer)来源的抗血管生成及抗肿瘤活性肽,所述活性肽其氨基酸序列为leu-asp-asp-pro-val-phe-arg-pro。
18.实施例2
19.实施例1中所述人参来源的抗血管生成及抗肿瘤活性肽的制备方法,包括以下步骤:
20.s1、人参低聚肽的制备:
21.1000g人参用粉碎机粉碎,加水匀浆制成匀浆液置于酶解罐中,人参与水的质量体积比为1:20,加入人参质量(以干重计)0.6%的纤维素酶,在50℃下酶解2小时,酶反应ph值控制在5.5,然后加入人参蛋白质质量4%的复合蛋白酶,该蛋白酶配比为:碱性蛋白酶:菠萝蛋白酶:风味蛋白酶=5:2:2,在52℃下酶解4小时,酶反应ph值控制在9.0,酶解结束后升温至85℃灭酶10分钟,得到人参酶解液,将酶解液8000转/分钟离心10分钟,去除颗粒状物质,然后采用膜分离技术进行分离,截留分子量为3000da,过膜液喷雾干燥得人参低聚肽
粉。
22.s2、小分子活性肽的分离纯化:
23.将s1中的人参低聚肽粉加水溶解,配制成100mg/ml,采用葡聚糖凝胶sephadex lh-20柱色谱法(3.0
×
100cm)进行分离纯化,流动相为35%甲醇,流速为0.5ml/min,洗脱液280nm测定吸光度,根据吸光度值收集所需峰。
24.采用高效液相色谱进一步纯化,色谱条件如下:依利特c18色谱柱(4.6mm
×
250mm,5μm),流动相a为0.07%三氟乙酸水(v/v),流动相b为乙腈,梯度洗脱条件为:0~15min,5%b;15~20min,5%~15%b;20~30min,15%b~25%b;30~40min,25%b~40%b;流速为0.8ml/min,检测波长为280nm,收集保留时间在17分钟的色谱峰,浓缩后冷冻干燥得小分子活性肽。
25.s3、纯度及结构测定:
26.收集的小分子肽经液相色谱检测为单一峰,利用高效液相色谱-质谱测定结构,其氨基酸序列为:leu-asp-asp-pro-val-phe-arg-pro,其分子量为958da。
27.抗血管生成活性测定:
28.取健康鸡胚于培养箱中,37℃、相对湿度60%的条件下孵育7天,随后在超净工作台中将鸡胚尿囊膜(cam)暴露。把鸡胚随机分为6组(对照组和实验组1、2、3、4、5),每组10只,分别将吸附有20μl生理盐水和0.2mg/ml、0.4mg/ml、0.6mg/ml、0.8mg/ml、1.0mg/ml小分子活性肽溶液的玻璃纤维滤纸覆盖在cam上,继续孵育72小时。去除玻璃纤维滤纸,取出尿囊膜,用10%的甲醛进行固定后,在显微镜下观察新生血管生成情况,计算血管生成抑制率。
29.血管生成抑制率计算公式为:
30.血管生成抑制率(%)=(对照组血管分支点数-实验组血管分支点为数)/对照组血管生成分支点数
×
100%
31.实验结果见图1,不同浓度的小分子活性肽溶液对cam血管均有抑制作用,其中0.6mg/ml小分子活性肽的血管生成抑制效果最好,抑制率达87.52%
±
1.33%,表明该小分子活性肽具有很好的抗血管生成活性。
32.抗肿瘤活性测定:
33.小鼠lewis肺癌模型的构建:造模前12小时昆明小鼠禁食不禁水。在无菌条件下,取生长良好的lewis肺癌小鼠肿瘤组织,加入生理盐水,按照1:5的比例制备成肿瘤组织细胞悬液,于小鼠左前肢腋窝皮下接种0.2ml。
34.接种24小时后将lewis肺癌昆明小鼠随机随机分为6组(模型组和实验组1、2、3、4、5),每组10只。实验组1、2、3、4、5的小鼠分别灌胃200mg/(kg
·
d)、400mg/(kg
·
d)、600mg/(kg
·
d)、800mg/(kg
·
d)、1000mg/(kg
·
d)小分子活性肽,模型组灌胃等量的生理盐水,连续干预12天。12天后用电子分析天平称量小鼠的体重,随后脱椎处死小鼠,摘取完整的肿瘤组织,再用电子分析天平称小鼠的肿瘤组织质量,最后计算抑瘤率。
35.抑瘤率的计算公式为:
36.抑瘤率(%)=(模型组平均瘤质量-实验组平均瘤质量)/模型组平均瘤质量
×
100%;
37.实验结果见图2,抑瘤率随着小分子肽剂量的增加而增加,其中1000mg/(kg
·
d)剂
量组的抑瘤率最高,达88.05%,表明该小分子活性肽具有明显的抑制肺癌肿瘤生长的作用。
38.实施例3
39.以所述活性肽序列为核心,任何对其进行的相应的调整或修饰。如对其进行相应的调整或修饰后的应用,包括对活性肽进行进一步的抗血管生成药物设计:将第四位和第八位的氨基酸pro可单独或同时被氨基酸leu所替代,替代后的小分子肽均具有潜在的抗血管生成活性。
40.将实施例2中活性肽序列的第八位氨基酸pro替换为leu,得到新的活性肽段,氨基酸序列为leu-asp-asp-pro-val-phe-arg-leu。
41.采用鸡胚尿囊膜实验,验证其抗血管生成活性。
42.具体实验过程如下:取健康鸡胚于培养箱中,37℃、相对湿度60%的条件下孵育7天,随后在超净工作台中将鸡胚尿囊膜(cam)暴露。把鸡胚随机分为6组(对照组和实验组1、2、3、4、5),每组10只,分别将吸附有20μl生理盐水和0.2mg/ml、0.4mg/ml、0.6mg/ml、0.8mg/ml、1.0mg/ml小分子活性肽溶液的玻璃纤维滤纸覆盖在cam上,继续孵育72小时。去除玻璃纤维滤纸,取出尿囊膜,用10%的甲醛进行固定后,在显微镜下观察新生血管生成情况,计算血管生成抑制率。
43.血管生成抑制率计算公式为:
44.血管生成抑制率(%)=(对照组血管分支点数-实验组血管分支点为数)/对照组血管生成分支点数
×
100%
45.实验结果如图3所示,结果表明替换后得到的小分子活性肽仍具有较好的抗血管生成活性,其中0.8mg/ml的小分子活性肽对血管生成的抑制效果最好,抑制率达83.66%
±
4.01%。
46.实施例4
47.本实施例中所述的人参来源的抗血管生成及抗肿瘤活性肽的制备方法的各步骤均与实施例2中相同,不同点为:
48.(1)步骤s1中,1000g人参样品粉碎处理后,加入17倍质量体积的水制成匀浆液置于酶解罐中,加入人参质量(以干重计)1.0%的纤维素酶,在48℃下酶解1小时,酶反应ph值控制在6.0,然后加入人参蛋白质质量3%的复合蛋白酶,该蛋白酶配比为:碱性蛋白酶:菠萝蛋白酶:风味蛋白酶=4:2:3,在50℃下酶解4小时,酶反应ph值控制在9.5,酶解结束后升温至80℃灭酶15分钟,得到人参酶解液,将酶解液7000转/分钟离心8分钟,去除颗粒状物质,然后采用膜分离技术进行分离,截留分子量为3000da,过膜液喷雾干燥得人参低聚肽粉。
49.(2)步骤s2中流动相为35%甲醇,流速为0.4ml/min;
50.(3)步骤s2中流动相a为含体积百分数0.05%三氟乙酸水,流速为0.9ml/min。
51.实施例5
52.本实施例中所述的人参来源的抗血管生成及抗肿瘤活性肽的分离纯化方法的各步骤均与实施例2中相同,不同点为:
53.(1)步骤s1中,1000g人参样品粉碎处理后,加入15倍质量体积的水制成匀浆液置于酶解罐中,加入人参质量(以干重计)0.8%的纤维素酶,在45℃下酶解1.5小时,酶反应ph
值控制在5.0,然后加入人参蛋白质质量5%的复合蛋白酶,该蛋白酶配比为:碱性蛋白酶:菠萝蛋白酶:风味蛋白酶=6:4:3,在50℃下酶解3小时,酶反应ph值控制在9.7,酶解结束后升温至90℃灭酶10分钟,得到人参酶解液,将酶解液6000转/分钟离心10分钟,去除颗粒状物质,然后采用膜分离技术进行分离,截留分子量为3000da,过膜液喷雾干燥得人参低聚肽粉。
54.(2)步骤s2中流动相为35%甲醇,流速为0.6ml/min;
55.(3)步骤s2中流动相a为含体积百分数0.06%三氟乙酸水,流速为1.0ml/min。
56.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。