1.本发明属于食品加工技术领域。
背景技术:
2.乳清蛋白是从牛奶中提取的蛋白质,具有最佳的氨基酸比例,营养价值高,易于人体消化吸收,且具有多种功能特性和生物活性。作为重要成分或添加基料,乳清蛋白被广泛应用于食品工业中。但是天然的乳清蛋白已不能满足加工需要和消费者需求,因此,有必要对蛋白质进行改造。
3.蛋白质的改性是食品研究的热点之一。常见的蛋白质改性方法主要包括物理改性、化学改性和酶法改性。物理改性如超声破碎的方法将电能转化为声能,利用空穴效应使其产生极高能量破碎细胞或其他物质。酶法改性可以使蛋白质分子发生水解或交联,该方法优点是条件温和,具有更高特异性,且无有毒副产物产生。
4.经改性处理后的蛋白质,其功能特性有明显改善,不仅满足生产加工需要,还可以满足消费者多种需求。然而,目前一些蛋白质的改性方法存在安全性问题,如有机溶剂残留等,还有一些技术对乳清蛋白的稳定性或致敏性作用效果不明显。
技术实现要素:
5.本发明要解决现有乳清蛋白改性方法,或存在安全性问题,或存在稳定性差且具有致敏性的问题,进而提供一种高功能特性的蛋白质配料的制备方法。
6.一种高功能特性的蛋白质配料的制备方法,它是按以下步骤进行的:
7.一、乳清蛋白的处理:
8.在超声功率为200w~600w的条件下,对乳清蛋白溶液超声处理10min~20min,然后冷冻干燥,得到超声后的乳清蛋白;
9.二、加入转谷氨酰胺酶:
10.配制超声后的乳清蛋白溶液,向超声后的乳清蛋白溶液中加入转谷氨酰胺酶溶液,在温度为37℃的水浴中,加热1h~4h,然后在温度为90℃~100℃的条件下,灭酶5min,冷却,最后冷冻干燥,即完成制备方法;
11.所述的超声后的乳清蛋白溶液的质量百分数为1%~5%;所述的转谷氨酰胺酶溶液的浓度为5u/g~20u/g;所述的超声后的乳清蛋白溶液与转谷氨酰胺酶溶液的体积比为(2~6):1。
12.本发明的有益效果是:
13.1、本发明所用原料为乳清蛋白,来源广泛,有较高的营养价值,可以满足多种人群需求。
14.2、本发明所涉及的高功能性蛋白配料的制备方法,过程均是安全绿色的,无有毒有害物质生成,制备工艺简单,且条件温和。
15.3、本发明采用超声技术和酶法改性技术相结合,超声技术可以使用不同的频率范
围,导致蛋白质分子发生交联,改变蛋白质的化学结构,从而引起蛋白质功能性质的强烈变化。酶法改性利用酶的交联聚合反应,使得蛋白质或多肽链的构象或分子结构发生改变,从而达到提高蛋白质功能性质的目的。转谷氨酰胺酶是一种能够催化酰基发生转移反应的酶,可在蛋白质分子间或分子内部生成ε-(r-谷氨酰基)赖氨酸共价键,形成强度较大的凝胶,从而使蛋白质的功能性质得到改善,具有较强的乳化稳定性、泡沫稳定性,且有效降低过敏原的致敏性。且该反应体系环境温和,反应迅速,毒副作用小,专一性强。因此,通过两种最优技术结合,以制备出稳定性更好、致敏性更低的蛋白质。
16.说明书附图
17.图1为乳清蛋白乳化性影响的柱状图,a为乳化活性,b为乳化稳定性,a为乳清蛋白,b为对比实验一制备的超声后的乳清蛋白,c为实施例一制备的超声及酶处理的乳清蛋白;
18.图2为乳清蛋白起泡性和泡沫稳定性影响的柱状图,a为起泡性,b为泡沫稳定性,a为乳清蛋白,b为对比实验一制备的超声后的乳清蛋白,c为实施例一制备的超声及酶处理的乳清蛋白;
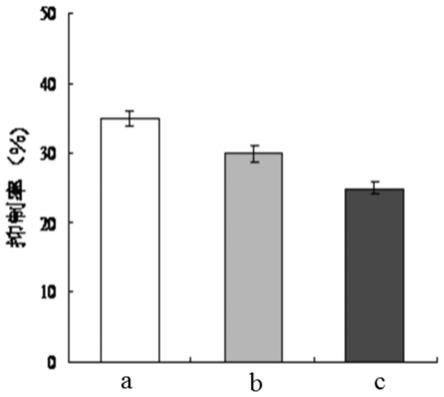
19.图3为乳清蛋白致敏性影响的柱状图,a为乳清蛋白,b为对比实验一制备的超声后的乳清蛋白,c为实施例一制备的超声及酶处理的乳清蛋白。
具体实施方式
20.具体实施方式一:本实施方式一种高功能特性的蛋白质配料的制备方法,它是按以下步骤进行的:
21.一、乳清蛋白的处理:
22.在超声功率为200w~600w的条件下,对乳清蛋白溶液超声处理10min~20min,然后冷冻干燥,得到超声后的乳清蛋白;
23.二、加入转谷氨酰胺酶:
24.配制超声后的乳清蛋白溶液,向超声后的乳清蛋白溶液中加入转谷氨酰胺酶溶液,在温度为37℃的水浴中,加热1h~4h,然后在温度为90℃~100℃的条件下,灭酶5min,冷却,最后冷冻干燥,即完成制备方法;
25.所述的超声后的乳清蛋白溶液的质量百分数为1%~5%;所述的转谷氨酰胺酶溶液的浓度为5u/g~20u/g;所述的超声后的乳清蛋白溶液与转谷氨酰胺酶溶液的体积比为(2~6):1。
26.本实施方式的有益效果是:
27.1、本实施方式所用原料为乳清蛋白,来源广泛,有较高的营养价值,可以满足多种人群需求。
28.2、本实施方式所涉及的高功能性蛋白配料的制备方法,过程均是安全绿色的,无有毒有害物质生成,制备工艺简单,且条件温和。
29.3、本实施方式采用超声技术和酶法改性技术相结合,超声技术可以使用不同的频率范围,导致蛋白质分子发生交联,改变蛋白质的化学结构,从而引起蛋白质功能性质的强烈变化。酶法改性利用酶的交联聚合反应,使得蛋白质或多肽链的构象或分子结构发生改变,从而达到提高蛋白质功能性质的目的。转谷氨酰胺酶是一种能够催化酰基发生转移反
应的酶,可在蛋白质分子间或分子内部生成ε-(r-谷氨酰基)赖氨酸共价键,形成强度较大的凝胶,从而使蛋白质的功能性质得到改善,具有较强的乳化稳定性、泡沫稳定性,且有效降低过敏原的致敏性。且该反应体系环境温和,反应迅速,毒副作用小,专一性强。因此,通过两种最优技术结合,以制备出稳定性更好、致敏性更低的蛋白质。
30.具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一及步骤二中所述的冷冻干燥具体为在真空度为0.01mpa~0.5mpa及冷阱温度为-72℃至-45℃的条件下,干燥时间为8h~18h。其它与具体实施方式一相同。
31.具体实施方式三:本实施方式与具体实施方式一或二之一不同的是:步骤一中在超声功率为400w~600w的条件下,对乳清蛋白溶液超声处理10min。其它与具体实施方式一或二相同。
32.具体实施方式四:本实施方式与具体实施方式一至三之一不同的是:步骤一中在超声功率为400w的条件下,对乳清蛋白溶液超声处理10min。其它与具体实施方式一至三相同。
33.具体实施方式五:本实施方式与具体实施方式一至四之一不同的是:步骤二中在温度为37℃的水浴中,加热3h~4h。其它与具体实施方式一至四相同。
34.具体实施方式六:本实施方式与具体实施方式一至五之一不同的是:步骤二中在温度为37℃的水浴中,加热3h。其它与具体实施方式一至五相同。
35.具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:步骤二中在温度为95℃~100℃的条件下,灭酶5min。其它与具体实施方式一至六相同。
36.具体实施方式八:本实施方式与具体实施方式一至七之一不同的是:步骤二中所述的超声后的乳清蛋白溶液的质量百分数为3%~5%。其它与具体实施方式一至七相同。
37.具体实施方式九:本实施方式与具体实施方式一至八之一不同的是:步骤二中所述的转谷氨酰胺酶溶液的浓度为10u/g~20u/g。其它与具体实施方式一至八相同。
38.具体实施方式十:本实施方式与具体实施方式一至九之一不同的是:步骤二中所述的超声后的乳清蛋白溶液与转谷氨酰胺酶溶液的体积比为(3~6):1。其它与具体实施方式一至九相同。
39.采用以下实施例验证本发明的有益效果:
40.实施例一:
41.一种高功能特性的蛋白质配料的制备方法,它是按以下步骤进行的:
42.一、乳清蛋白的处理:
43.在超声功率为400w的条件下,对乳清蛋白溶液超声处理10min,然后冷冻干燥,得到超声后的乳清蛋白;
44.二、加入转谷氨酰胺酶:
45.配制超声后的乳清蛋白溶液,向超声后的乳清蛋白溶液中加入转谷氨酰胺酶溶液,在温度为37℃的水浴中,加热3h,然后在温度为95℃的条件下,灭酶5min,冷却,最后冷冻干燥,得到超声及酶处理的乳清蛋白;
46.所述的超声后的乳清蛋白溶液的质量百分数为3%;所述的转谷氨酰胺酶溶液的浓度为10u/g;所述的超声后的乳清蛋白溶液与转谷氨酰胺酶溶液的体积比为3:1。
47.步骤一及步骤二中所述的冷冻干燥具体为在真空度为0.5mpa及冷阱温度为-65℃
的条件下,干燥时间为12h。
48.步骤二中所述的配制超声后的乳清蛋白溶液具体是将超声后的乳清蛋白与去离子水混合制备得到。
49.对比实验:本对比实验与实施例一不同的是:省略步骤二。其它与实施例一相同。
50.对乳清蛋白、对比实验制备的超声后的乳清蛋白及实施例一制备的超声及酶处理的乳清蛋白进行如下测试:
51.乳化性:用浓度为0.1mol/l的磷酸盐缓冲液(ph为7.0)溶解蛋白质样品,得到浓度为1g/l的样品溶液,将样品溶液与大豆油以体积比为3:1混合,在转速为12000r/min的条件下,高速分散1min,分散后在静止0min和静止10min时分别从底部取50μl乳化液,然后分别加入5ml浓度为1g/l的sds溶液并混合均匀,最后在500nm处测定吸光度,具体实验结果见图1。
52.图1为乳清蛋白乳化性影响的柱状图,a为乳化活性,b为乳化稳定性,a为乳清蛋白,b为对比实验一制备的超声后的乳清蛋白,c为实施例一制备的超声及酶处理的乳清蛋白;由图可知,超声后的乳清蛋白其乳化活性增加,乳化稳定性降低;而超声后再经转谷氨酰胺酶处理后的乳清蛋白其乳化活性下降,且具有较强的乳化稳定性,可达40m2/g和91%。
53.起泡能力和泡沫稳定性:用浓度为50mmol/l的磷酸盐缓冲液(ph为7.0)溶解蛋白质样品,得到浓度为1g/l的样品溶液,取200ml样品溶液于高速组织捣碎机中,在转速为12000r/min的条件下,搅打1min,记录搅打前液体体积v
l
,搅打刚停止时泡沫体积v0,以及搅打后静止30min时泡沫体积v
30
;计算起泡性(fc)和泡沫稳定性(fs),具体实验结果见图2。
[0054][0055]
图2为乳清蛋白起泡性和泡沫稳定性影响的柱状图,a为起泡性,b为泡沫稳定性,a为乳清蛋白,b为对比实验一制备的超声后的乳清蛋白,c为实施例一制备的超声及酶处理的乳清蛋白。由图可知,超声后的乳清蛋白其起泡性增加,泡沫稳定性增加;而超声后再经转谷氨酰胺酶处理后的乳清蛋白其起泡性下降,且具有较强的泡沫稳定性,可达43%和86%。
[0056]
致敏性分析:通过间接elisa方法检测。将微量酶标板每孔加入100μl蛋白样品进行包被,在温度为4℃的条件下孵育过夜。包被完成后,取出酶标板,排出残余液体,加入pbst洗液,共洗4次,得到包被后的蛋白样品。
[0057]
将微量酶标板每孔加入350μl的明胶封闭液,置于温度为37℃恒温培养箱中孵育2h。将包被后的蛋白样品与工作浓度的抗体按体积比为1:1混合均匀,置于温度为37℃的恒温培养箱中,孵育1h,得到蛋白样品和稀释的一抗混合物。向封闭完成的酶标板每孔加入100μl孵育完成的蛋白样品和稀释的一抗混合物,置于温度为37℃的条件下孵育2h。随后每孔加入100μl hrp标记的羊抗人ige,37℃避光孵育1h。立即向每孔加入100μltmb显色液,37℃避光反应45min,加入100μl硫酸溶液终止反应,在450nm测定吸光度。
[0058]
图3为乳清蛋白致敏性影响的柱状图,a为乳清蛋白,b为对比实验一制备的超声后的乳清蛋白,c为实施例一制备的超声及酶处理的乳清蛋白;由图可知,与未处理乳清蛋白相比,超声后的乳清蛋白其抑制率(即ige与蛋白质内抗原的结合能力)降低,说明致敏性降低;而超声后再经转谷氨酰胺酶处理后的乳清蛋白其抑制率降低更为明显,有效降低过敏
原的致敏性,可达24%。
[0059]
综上表明,乳清蛋白经超声和转谷氨酰胺酶处理后其功能性质得到显著改善。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。