1.本发明涉及仿树状结构生物活性支架及其制备方法和应用,属于生物材料领域。
背景技术:
2.天然骨组织具有相互连通的哈弗斯管和福尔克曼管构成的复杂生理结构,并伴有神经穿行于哈弗斯管和福尔克曼管。一方面,骨骼为骨内神经提供化学、机械和电子信号,以保持它们的生理活动正常进行。同时,感觉和交感神经通过分泌神经递质、神经肽和神经营养因子参与骨骼的生长和再生。因此,同时修复骨和骨内神经对功能性骨的再生,尤其是神经支配骨的再生至关重要。
3.然而,目前还没有关于使用组织工程生物材料或支架进行神经支配骨再生的报道。在过去的几十年里,具有特定微结构的组织工程支架在诱导骨和神经再生方面得到了广泛的应用1。在设计支架结构时,许多研究集中在模拟复杂的解剖形态或整合所需的物理特性2。然而,传统研究对支架结构的优化不能解决神经相关细胞和营养因子来源不足的问题。同时,传统的封闭式支架细胞负载率较低,影响支架与周围组织的整合效率。出于对支架设计的整体考虑,适当的细胞递送及与周围组织的整合也应一同进行。
4.动物和植物的形态进化都具有相当大的灵活性。植物的叶和动物的肢的形状变化可能得益于图案化过程的多样性3。叶序是植物叶片排列的空间布局,决定了植物独特的结构,合理的叶序分布有利于植物获取更多的光、水和养分,从而保证植物对环境的适应
4,5
。同样,组织工程支架的设计也是为了优化物质交换和信息传递。因此,叶片间距、辐散角度等叶序的多样性为支架的设计提供了良好的解决方案。同时,树木的开放式结构为设计旨在促进细胞渗入和输送以及组织整合的支架提供了思路。
5.现有技术文献:1、cerri f,et al.peripheral nerve morphogenesis induced by scaffold micropatterning.biomaterials 35,4035-4045(2014);2、hollister sj.scaffold design and manufacturing:from concept to clinic.adv.mater.21,3330-3342(2009);3、mentink ra,et al.from limbs to leaves:common themes in evolutionary diversification of organ form.frontiers in genetics 6(2015);4、lee b-h,et al.control of plant architecture:the role of phyllotaxy and plastochron.journal of plant biology 52,277-282(2009);5、ten tusscher k.of mice and plants:comparative developmental systems biology.dev.biol.460,32-39(2020).
技术实现要素:
6.针对现有技术存在的问题,本发明的目的在于提供一种仿树状结构生物活性支架及其制备方法和应用。
7.具体来说,一方面,本发明提供了一种3d打印仿树状结构生物活性支架,包括一体化的树干和多层叶片结构;所述生物活性支架能够进行细胞渗入与递送以及生物组织整合。
8.生物细胞与组织工程支架的设计在于优化物质交换和信息传递。因此,树木叶片间距、辐散角度等叶序的多样性为仿树状生物活性支架的设计提供了良好的解决方案与参考价值。同时,树木的开放式结构也为设计旨在促进细胞渗入和输送以及组织整合的生物活性支架提供了思路。
9.较佳地,所述生物活性支架的直径为6~10mm,高度为3~8mm,所述树干的直径为2.4~6mm。本发明设计的支架尺寸是基于直径6mm的临界骨缺损设计的,小于2.4mm直径的树干在结构上不足以支撑叶片,大于6mm直径的树干超出了临界骨缺损的直径大小。
10.较佳地,所述叶片的厚度为0.1~1mm,0.1mm为设备能够打印的最小尺寸,过小的厚度会使得叶片力学性能较差,容易碎裂,而超过1mm厚度的叶片不能体现其高比表面、高细胞负载率的优势。叶片表面梯度结构厚度为25~100μm。上下层叶片在沿树干方向的间距为0.1~2mm,低于0.1mm的间距会使上下层叶片重叠,高于2mm的间距会使得叶片数量过少,从而会降低支架的细胞负载率,无法体现树状结构的优势。上下层叶片之间的螺旋角度为0~45
°
。同一水平面有四个相同的叶片且相邻叶片夹角为90
°
时,根据旋转对称性可知叶片螺旋角度超过45
°
的支架都可以通过顺时针或逆时针旋转90
°
得到与螺旋角度在0~45
°
之间结构相同的支架。
11.较佳地,所述生物活性支架的材质为具有生物活性的材料,优选为生物陶瓷或金属,更优选为β-磷酸三钙陶瓷。生物陶瓷或金属材质的生物活性支架具有良好的生物相容性,材料表面能够有效吸附蛋白,有助于细胞的黏附和增殖。同时,材料降解过程中释放的生物活性离子能够促进细胞的增殖和分化,有利于成骨相关因子的表达。支架材料的三维结构有利于细胞渗入与递送,而树状支架与传统支架相比具有更高的比表面积,更有利于周围骨组织的长入。
12.第二方面,本发明提供了一种上述生物活性支架的制备方法,包括以下步骤:(1)光敏树脂制备;(2)光固化浆料制备;(3)支架生坯打印;(4)烧结。
13.较佳地,步骤(2)中,按照1:(0.66~1.5)的质量比称取粉体原料与步骤(1)中制备得到的光敏树脂,球磨后得到所述光固化浆料。
14.较佳地,步骤(3)中,通过利用制图软件预先设计支架模型的参数,然后将设计好的支架模型导入切片软件进行切片,再导入光固化3d打印机进行打印。
15.较佳地,步骤(4)中,所述烧结的温度为1100~1150℃,时间为3~5小时。
16.第三方面,本发明还提供了一种上述生物活性支架在负载具有成骨作用的细胞和具有成神经作用的细胞进行共培养或者神经化骨缺损再生中的应用。
17.较佳地,所述具有成骨作用的细胞为骨髓间充质干细胞;所述具有成神经作用的细胞为雪旺细胞。
18.有益效果本发明的生物活性支架很好地模拟了树木的多级结构,这种多级结构能够通过递送骨驻留细胞和神经驻留细胞促进成骨及成神经的潜能,可用于神经化骨缺损再生。
附图说明
19.图1为传统45
°
交叉式3d打印支架对照组与本发明实施例1制备的不同叶片螺旋角度的仿树状结构生物活性支架的结构示意图;图2为传统45
°
交叉式3d打印支架对照组与本发明实施例1制备的叶片螺旋角度为0
°
,20
°
,30
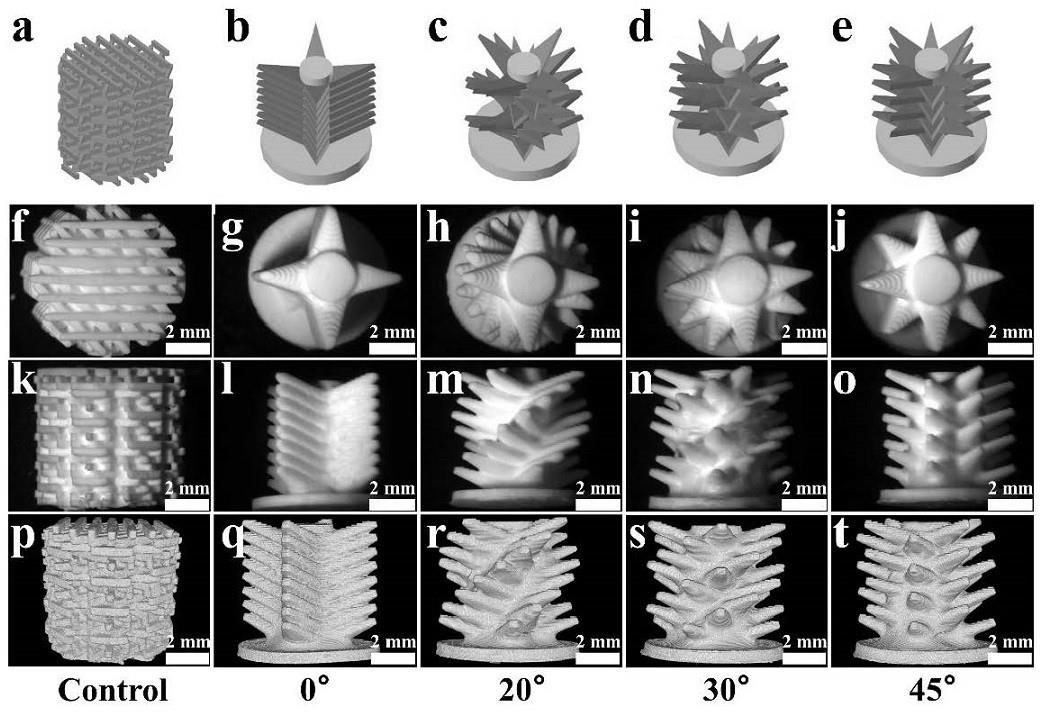
°
,45
°
的仿树状结构生物活性支架负载rbmsc细胞的增殖结果对比图;图3为实施例2中制备的不同上下层相邻叶片沿树干方向间距的仿树状结构生物活性支架的结构与表面积/体积示意图;图4为实施例3制备的不同树干直径的仿树状结构生物活性支架的结构与抗压强度示意图;图5为实施例4制备的不同叶片表面梯度生物活性支架的表面梯度结构示意图;图6为利用实施例1中制备的螺旋角度为20
°
的生物活性支架负载rbmsc和rsc两种细胞共培养与单培养的对比实验结果示意图;图7为实施例4制备的不同叶片表面梯度的生物活性支架负载共培养细胞的对比实验结果示意图;图8为基于实施例1中制备的螺旋角度为20
°
的仿树状结构生物活性支架的rbmsc-rsc细胞共培养与单培养系统在体内的成骨效果示意图;图9为基于实施例1中制备的螺旋角度为20
°
的仿树状结构生物活性支架的rbmsc-rsc细胞共培养与单培养系统在骨缺损处的神经修复效果示意图;图10为基于实施例1中制备的螺旋角度为20
°
的仿树状结构生物活性支架的rbmsc-rsc细胞共培养系统在骨缺损处及其周围的神经染色结果示意图。
具体实施方式
20.下面结合具体实施例对本发明进行进一步说明,应理解,本发明的保护范围并不限于所述内容。
21.本发明提供了一种仿树状结构的生物活性支架,其直径为6~10mm,高度为3~8mm。该种生物活性支架包括一体化的树干和多层叶片结构,选用的材质可以为生物陶瓷或金属等具有生物活性的材料。
22.本发明提供的生物活性支架模拟树木结构,其树干及叶片结构的尺寸及比例均可调整。其中,多层叶片可用于多细胞的负载和递送,起到物质传输和信息交流的作用,尤其是可以递送共培养的骨髓间充质干细胞和雪旺细胞,用于神经化骨组织的修复。树干为叶片的载体,起到力学支撑的作用。
23.所述树干的直径为2.4~6mm,高度为3~8mm,可以通过调节树干的直径来调节所述支架的抗压强度。在一些优选的实施例中,树干的直径可以为2.4mm,高度可以为6mm。
24.所述叶片的形状为三角形、四边形、扇形或其他不规则形状,其厚度可以为0.1~1mm。在一些优选的实施例中,叶片的形状为三角形,厚度为0.5mm。叶片表面梯度结构厚度为25~100μm。
25.上述叶片在垂直于树干方向的数量可以为2~8个,相邻叶片间夹角为45
°
~180
°
。在一些优选的实施例中,叶片在垂直于树干方向的数量为4个,相邻叶片间夹角为45
°
。
26.所述上下层叶片在沿树干方向的间距为0.1~2mm,优选为0.5~1.4mm,上下两层
叶片之间的螺旋角度为0~45
°
。在一些优选的实施例中,上下层叶片在沿树干方向的间距为0.8mm,上下两层叶片之间的螺旋角度为20
°
。
27.所设计支架的树干和多层叶片的直径、高度、形状、厚度、数量、夹角、间距、螺旋角度等参数均是可调的。
28.本发明中的仿树状结构是开放式宏观大孔结构,可以在特定叶片上负载特定种类的细胞,以此实现在同一支架上不同种类细胞的非接触式共培养,同时有利于组织的长入,而叶片表面的梯度结构可以进一步调节细胞的增殖和分化行为。支架的叶片间距是决定叶片数量以及开放孔结构大小的关键参数,过大的叶片间距使得叶片数量少,递送细胞的数量也变少,而过小的叶片间距使得组织不易长入,难以实现支架与周围组织的整合。叶片螺旋角度是支架负载细胞量大小的关键参数,合适的螺旋角度使得接种过程中细胞能均匀地附着在叶片表面而不会被上层叶片遮挡,有利于后续的细胞递送。树干直径是决定支架抗压强度与比表面积的参数,过大的树干直径使得叶片占比过小,降低了比表面积,无法体现树状支架高细胞负载率的优势,而过小的树干直径则会使支架抗压强度过低,无法支撑叶片,不满足骨植入的需求。
29.上述仿树状结构生物活性支架的制备方法,可以采用以下四个步骤进行。
30.(1)光敏树脂制备。分别取1,6-己二醇二丙烯酸酯20~60g、聚乙二醇二丙烯酸酯(分子量200)20~60g、聚乙二醇辛基苯基醚2.4~7.2g、(2,4,6-三甲基苯甲酰基)二苯基氧化膦0.8~6.4g,室温下混合搅拌均匀,得到所述光敏树脂。
31.(2)光固化浆料制备。按照1:(0.66~1.5)的质量比,分别称取粉体原料与步骤(1)中制备得到的光敏树脂,置于球磨罐中混合球磨1~3h,转速500rpm,无需溶剂,即可得到所述光固化浆料。其中,所述粉体原料可以为陶瓷粉或金属粉,在一些实施例中,可以选择β-磷酸三钙陶瓷粉。
32.(3)支架生坯打印。利用3ds max、rhino、solidworks或cad等三维制图软件设计支架模型,其中,可以选择设计的参数如下:树状结构支架的直径为6~10mm,高度为3~8mm;树干直径为2.4~6mm、高度为3~8mm;叶片厚度为0.1~1mm;叶片在垂直于树干方向的数量为2~8个、相邻叶片间夹角为45
°
~180
°
;上下层叶片在沿树干方向的间距为0.1~2mm、上下两层叶片之间的螺旋角度为0~45
°
。然后,将设计好的支架模型导入切片软件进行切片,设置切片厚度为25~100μm,再导入光固化3d打印机(北京十维科技有限责任公司,型号autocera-m),利用步骤(2)制备得到的光固化浆料进行打印,得到所述支架生坯。通过利用制图软件预先设计支架模型而后再行打印的方式,可以精确、可控地制备出仿树状结构生物活性支架。
33.(4)烧结。将上述支架生坯于1100~1150℃下煅烧3~5小时,即可得到所述仿树状结构生物活性支架,特别是仿骨哈弗斯系统生物活性支架。
34.本发明中的树状支架具有开放式宏观大孔结构和微观表面梯度结构,是通过光固化3d打印技术一次成型的,传统技术无法实现,且这种技术可以广泛用于生物活性陶瓷和金属材料。微观表面梯度结构是由光固化过程中面堆积的方式实现的,且与叶片的倾斜角度有关。这种树状结构具有比传统交叉支架更高的细胞负载率,更有利于细胞的高效递送,而支架的开放式结构和高比表面积更有利于组织的长入和支架与组织的整合。树状支架的叶片是天然分离互不连接的,为非接触式共培养细胞提供了有利条件,能很好地模拟生物
组织内部不同细胞的互不接触但通过旁分泌进行物质运输和信号传递的交流方式。
35.将骨髓间充质干细胞和雪旺细胞接种在所述生物活性支架相邻的叶片上,可以实现在一个支架上非接触式负载两种细胞进行共培养。另外,也可以将所述骨髓间充质干细胞换成其他具有成骨作用的细胞,或者将上述雪旺细胞换成其他具有成神经作用的细胞,其他条件不变,来构建支架负载的成骨和成神经相关细胞的共培养体系。
36.下面进一步例举实施例以详细说明本发明。同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。下述示例具体的工艺参数等也仅是合适范围中的一个示例,即本领域技术人员可以通过本文的说明做合适的范围内选择,而并非要限定于下文示例的具体数值。
37.实施例1
38.(1)光敏树脂制备。分别取1,6-己二醇二丙烯酸酯(麦克林)40g,聚乙二醇二丙烯酸酯(分子量200,麦克林)40g,聚乙二醇辛基苯基醚(麦克林)4.8g,(2,4,6-三甲基苯甲酰基)二苯基氧化膦(麦克林)1.6g,混合搅拌均匀,得到光敏树脂。
39.(2)光固化浆料制备。分别称取β-磷酸三钙陶瓷粉(昆山华侨科技新材料有限公司)120g与步骤(1)中制备得到的光敏树脂80g,置于球磨罐中混合球磨1h,转速500rpm,无需溶剂,即可得到所述光固化浆料。
40.(3)支架生坯打印。利用3dsmax软件设计支架模型,其中,选择设计的参数如下:树状结构支架的直径为8mm、高度为8mm;树干直径为2.4mm、高度为8mm;叶片厚度为0.5mm;叶片在垂直于树干方向的数量为4个、同一层相邻叶片间夹角为90
°
;相邻叶片在沿树干方向的间距为0.8mm、上下两层叶片之间的螺旋角度分别为0
°
、20
°
、30
°
、45
°
。然后,将设计好的支架模型导入切片软件进行切片,设置切片厚度为50μm,再导入光固化3d打印机(北京十维科技有限责任公司,型号autocera-m),利用步骤(2)制备得到的光固化浆料进行打印,得到所述支架生坯。
41.(4)烧结。将上述支架生坯于1150℃下煅烧3小时,得到纯的β-磷酸三钙陶瓷支架。
42.图1为传统45
°
交叉式3d打印支架对照组与本发明实施例1制备的不同叶片螺旋角度的仿树状结构生物活性支架的结构示意图。a-e为对照组及叶片螺旋角度为0
°
,20
°
,30
°
,45
°
的仿树状结构生物活性支架模型图;f-j为对照组及叶片螺旋角度为0
°
,20
°
,30
°
,45
°
的仿树状结构生物活性支架光学照片俯视图;k-o为对照组及叶片螺旋角度为0
°
,20
°
,30
°
,45
°
的仿树状结构生物活性支架光学照片侧视图;p-t为对照组及叶片螺旋角度为0
°
,20
°
,30
°
,45
°
的仿树状结构生物活性支架micro-ct图像。
43.通过骨髓间充质干细胞培养实验来对比实施例1中制备的不同叶片螺旋角度支架的细胞负载和增殖情况。细胞采用大鼠骨髓间充质干细胞rbmsc(rat bone marrow-derived mesenchymal stem cells),用dmem完全培养基(赛业)在37℃培养箱中培养,细胞接种在放置于48孔板内的支架上,接种数量为50000个/孔,在细胞接种后6小时、3天和7天分别加入cck8试剂(日本同仁),通过溶液吸光度测试来比较细胞的增殖情况。
44.图2为传统45
°
交叉式3d打印支架对照组与本发明实施例1制备的叶片螺旋角度为0
°
,20
°
,30
°
,45
°
的仿树状结构生物活性支架负载rbmsc细胞的增殖结果对比图。其中,横坐标为细胞培养时间,纵坐标为450nm波长下测得的cck8工作液与细胞培养所得溶液的吸光
度。从图中可以看出,螺旋角度为20
°
的仿树状结构生物活性支架负载rbmsc细胞在第7天的增殖活性优于对照组及其它叶片螺旋角度的支架组。
45.将本发明实施例1中制备的螺旋角度为20
°
的生物活性支架放置于48孔板中,单培养组将rbmsc(赛业)或rsc(赛业)细胞接种至支架全部叶片上,接种数量为20000个/孔,接种细胞悬液的体积为10μl,共培养组将rbmsc(赛业)和rsc(赛业)细胞分别接种至支架同一层相邻的两个叶片上,接种数量均为10000个/孔,接种细胞悬液的体积均为5μl。接种后每孔加入200μl dmem完全培养基(生工)使支架浸润,培养1小时待细胞黏附后再补充800μldmem完全培养基培养。
46.图6为利用实施例1中制备的螺旋角度为20
°
的生物活性支架负载rbmsc和rsc(rat schwann cells)两种细胞共培养与单培养的对比实验结果示意图。在支架的同一层相邻叶片上分别接种rbmsc和rsc两种细胞。a-d为rbmsc和rsc共培养和单培养(rbmsc和rsc)在第1天的黏附对比图,可以看出共培养的两种细胞黏附及铺展良好。e-h为rbmsc和rsc共培养和单培养在第7天的增殖对比图,可以看出共培养细胞的增殖效果良好。i为rbmsc和rsc共培养和单培养在1-14天的增殖结果定量分析图,可以看出在第14天共培养细胞的增殖效果优于单培养细胞。j和k分别为rbmsc和rsc共培养和单培养成骨及成神经分化对比图,可以看出共培养细胞的成骨及成神经分化效果优于单培养细胞,证明仿树状结构生物活性支架用于递送共培养细胞能够促进细胞的增殖及成骨和成神经分化(bmp2:bone morphogenetic protein 2;opn:osteopontin;ngf:nerve growth factor;gdnf:glial cell-derived neurotrophic factor)。
47.将实施例1中制备的螺旋角度为20
°
的仿树状结构生物活性支架放置于48孔板中,将rbmsc(赛业)和rsc(赛业)细胞分别接种至支架同一层相邻的两个叶片上,接种数量均为100000个/孔,接种细胞悬液的体积均为5μl,每孔加入200μldmem完全培养基(生工)使支架浸润,培养1小时待细胞黏附后再补充800μldmem完全培养基培养3天后植入动物体内,进行动物培养实验。动物实验采用新西兰大白兔,分为五个组(blank,tcp,rbmsc,rsc,coculture)进行,每组6只,在兔股骨松质骨部位造6mm直径的缺损,实验组植入支架材料,空白组不植入支架材料,植入8周后取材。
48.图8为基于实施例1中制备的螺旋角度为20
°
的仿树状结构生物活性支架的rbmsc-rsc(rabbit bone marrow mesenchymal stem cells
–
rabbit schwann cells)细胞共培养与单培养系统在体内的成骨效果示意图。blank为空白组,tcp为纯支架组。a和b为基于实施例1中制备的螺旋角度为20
°
的仿树状结构生物活性支架的rbmsc-rsc细胞共培养系统成骨效果的micro-ct图像;c和d为基于实施例1中制备的螺旋角度为20
°
的仿树状结构生物活性支架的rbmsc-rsc细胞共培养系统成骨效果的vg染色图像;e为micro-ct结果的统计图;f为vg染色结果的统计图,可以看出仿树状结构生物活性支架负载的共培养细胞组的成骨效果优于单培养组(rbmsc和rsc)、纯支架组(tcp)及空白组(blank),说明基于仿树状结构生物活性支架的rbmsc-rsc细胞共培养系统具有优异的骨再生能力。
49.图9为基于实施例1中制备的螺旋角度为20
°
的仿树状结构生物活性支架的rbmsc-rsc细胞共培养与单培养系统在骨缺损处的神经修复效果示意图。a为仿树状结构生物活性支架的rbmsc-rsc细胞共培养系统在骨缺损处的细胞核(dapi)染色图像;b为仿树状结构生物活性支架的rbmsc-rsc细胞共培养系统在骨缺损处的神经纤维(nf200)染色图像;c为a和
b的叠加图像;d为神经纤维染色的统计结果。可以看出,仿树状结构生物活性支架负载的共培养细胞组的神经纤维再生效果优于单培养组(rbmsc和rsc)、纯支架组(tcp)及空白组(blank),说明基于仿树状结构生物活性支架的rbmsc-rsc细胞共培养系统具有优异的神经再生能力。
50.图10为基于实施例1中制备的螺旋角度为20
°
的仿树状结构生物活性支架的rbmsc-rsc细胞共培养系统在骨缺损处及其周围的神经染色结果示意图。可以看出,骨缺损部位周围有丰富的神经纤维,这为神经纤维的再生与长入提供了来源,而骨缺损内部的再生神经纤维证明了基于仿树状结构生物活性支架的rbmsc-rsc细胞共培养系统的成神经能力。
51.实施例2
52.(1)光敏树脂制备。分别取1,6-己二醇二丙烯酸酯(麦克林)40g,聚乙二醇二丙烯酸酯(分子量200,麦克林)40g,聚乙二醇辛基苯基醚(麦克林)4.8g,(2,4,6-三甲基苯甲酰基)二苯基氧化膦(麦克林)1.6g,混合搅拌均匀,得到光敏树脂。
53.(2)光固化浆料制备。分别称取β-磷酸三钙陶瓷粉(昆山华侨科技新材料有限公司)120g与步骤(1)中制备得到的光敏树脂80g,置于球磨罐中混合球磨1h,转速500rpm,无需溶剂,即可得到所述光固化浆料。
54.(3)支架生坯打印。利用3ds max软件设计支架模型,其中,选择设计的参数如下:树状结构支架的直径为8mm、高度为8mm;树干直径为2.4mm、高度为8mm;叶片厚度为0.5mm;叶片在垂直于树干方向的数量为4个、同一层相邻叶片间夹角为90
°
;相邻叶片在沿树干方向的间距分别为0.5mm、0.8mm、1.1mm、1.4mm,上下两层叶片之间的螺旋角度为20
°
。然后,将设计好的支架模型导入切片软件进行切片,设置切片厚度为50μm,再导入光固化3d打印机(北京十维科技有限责任公司,型号autocera-m),利用步骤(2)制备得到的光固化浆料进行打印,得到所述支架生坯。
55.(4)烧结。将上述支架生坯于1150℃下煅烧3小时,得到纯的β-磷酸三钙陶瓷支架。
56.图3为实施例2中制备的不同上下层相邻叶片沿树干方向间距的仿树状结构生物活性支架的结构与表面积/体积示意图。其中,a-d示出了叶片间距为0.5mm,0.8mm,1.1mm,1.4mm的仿树状结构生物活性支架模型图;e-h为叶片间距为0.5mm,0.8mm,1.1mm,1.4mm的仿树状结构生物活性支架光学照片俯视图;i-l为叶片间距为0.5mm,0.8mm,1.1mm,1.4mm的仿树状结构生物活性支架光学照片侧视图;m-p为叶片间距为0.5mm,0.8mm,1.1mm,1.4mm的仿树状结构生物活性支架micro-ct图像;q为叶片间距为0.5mm,0.8mm,1.1mm,1.4mm的仿树状结构生物活性支架模型的表面积/体积。可以看出,叶片间距为0.8mm的仿树状结构生物活性支架的表面积/体积最高,更有利于细胞的黏附、增殖及组织的长入。
57.实施例3
58.(1)光敏树脂制备。分别取1,6-己二醇二丙烯酸酯(麦克林)40g,聚乙二醇二丙烯酸酯(分子量200,麦克林)40g,聚乙二醇辛基苯基醚(麦克林)4.8g,(2,4,6-三甲基苯甲酰基)二苯基氧化膦(麦克林)1.6g,混合搅拌均匀,得到光敏树脂。
59.(2)光固化浆料制备。分别称取β-磷酸三钙陶瓷粉(昆山华侨科技新材料有限公司)120g与步骤(1)中制备得到的光敏树脂80g,置于球磨罐中混合球磨1h,转速500rpm,无需溶剂,即可得到所述光固化浆料。
60.(3)支架生坯打印。利用3ds max软件设计支架模型,其中,选择设计的参数如下:树状结构支架的直径为8mm、高度为8mm;树干直径分别为2.4mm、3.6mm、4.8mm、6mm,高度为8mm;叶片厚度为0.5mm;叶片在垂直于树干方向的数量为4个、同一层相邻叶片间夹角为90
°
;相邻叶片在沿树干方向的间距为0.8mm,上下两层叶片之间的螺旋角度为20
°
。然后,将设计好的支架模型导入切片软件进行切片,设置切片厚度为50μm,再导入光固化3d打印机(北京十维科技有限责任公司,型号autocera-m),利用步骤(2)制备得到的光固化浆料进行打印,得到所述支架生坯。
61.(4)烧结。将上述支架生坯于1150℃下煅烧3小时,得到纯的β-磷酸三钙陶瓷支架。
62.图4为实施例3制备的不同树干直径的仿树状结构生物活性支架的结构与抗压强度示意图。a-d为树干直径为2.4mm,3.6mm,4.8mm,6mm的仿树状结构生物活性支架模型图;e-h为树干直径为2.4mm,3.6mm,4.8mm,6mm的仿树状结构生物活性支架光学照片俯视图;i-l为树干直径为2.4mm,3.6mm,4.8mm,6mm的仿树状结构生物活性支架光学照片侧视图;m-p为树干直径为2.4mm,3.6mm,4.8mm,6mm的仿树状结构生物活性支架micro-ct图像。q为树干直径为2.4mm,3.6mm,4.8mm,6mm的仿树状结构生物活性支架模型的表面积/体积,可以看出表面积/体积随着树干直径的增大而减小。r为树干直径为2.4mm,3.6mm,4.8mm,6mm的仿树状结构生物活性支架的抗压强度示意图,可以看出抗压强度随着树干直径的增大而增大。
63.实施例4
64.(1)光敏树脂制备。分别取1,6-己二醇二丙烯酸酯(麦克林)40g,聚乙二醇二丙烯酸酯(分子量200,麦克林)40g,聚乙二醇辛基苯基醚(麦克林)4.8g,(2,4,6-三甲基苯甲酰基)二苯基氧化膦(麦克林)1.6g,混合搅拌均匀,得到光敏树脂。
65.(2)光固化浆料制备。分别称取β-磷酸三钙陶瓷粉(昆山华侨科技新材料有限公司)120g与步骤(1)中制备得到的光敏树脂80g,置于球磨罐中混合球磨1h,转速500rpm,无需溶剂,即可得到所述光固化浆料。
66.(3)支架生坯打印。利用3ds max软件设计支架模型,其中,选择设计的参数如下:树状结构支架的直径为8mm、高度为8mm;树干直径为2.4mm,高度为8mm;叶片厚度为0.5mm;叶片在垂直于树干方向的数量为4个、同一层相邻叶片间夹角为90
°
;相邻叶片在沿树干方向的间距为0.8mm,上下两层叶片之间的螺旋角度为20
°
。然后,将设计好的支架模型导入切片软件进行切片,设置切片厚度分别为25μm,50μm和100μm,再导入光固化3d打印机(北京十维科技有限责任公司,型号autocera-m),利用步骤(2)制备得到的光固化浆料进行打印,得到所述支架生坯。
67.(4)烧结。将上述支架生坯于1150℃下煅烧3小时,得到纯的β-磷酸三钙陶瓷支架。
68.图5为实施例4制备的不同叶片表面梯度生物活性支架的表面梯度结构示意图。a,b,c依次为25μm,50μm和100μm的叶片表面梯度结构示意图。
69.将实施例4制备的不同叶片表面梯度生物活性支架放置于48孔板中,将rbmsc(赛业)和rsc(赛业)细胞分别接种至支架同一层相邻的两个叶片上,接种数量均为10000个/孔,接种细胞悬液的体积均为5μl,每孔加入200μl dmem完全培养基(生工)使支架浸润,培养1小时待细胞黏附后再补充800μl dmem完全培养基进行培养。
70.图7为实施例4制备的不同叶片表面梯度的生物活性支架负载共培养细胞的对比实验结果示意图。a和b分别为叶片表面梯度25μm,50μm和100μm的支架负载共培养rbmsc和
rsc(rbmsc-co和rsc-co)1天的rbmsc共聚焦及电镜照片;c和d分别为叶片表面梯度25μm,50μm和100μm的支架负载共培养rbmsc和rsc(rbmsc-co和rsc-co)1天的rsc共聚焦及电镜照片,可以看出共培养的细胞在不同表面梯度的叶片上生长良好,伪足丰富。e为叶片表面梯度分别为25μm,50μm和100μm的支架负载共培养细胞1、3、7、14天的增殖结果,可以看出叶片表面梯度为100μm的支架负载共培养细胞在第7天和第14天的增殖活性最好。f为叶片表面梯度分别为25μm,50μm和100μm的支架负载共培养细胞的成神经分化结果,可以看出叶片表面梯度为100μm的支架负载共培养细胞的神经生长因子ngf和神经营养因子gdnf基因表达量最高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。