1.本发明涉及一种酪氨酸激酶浓度的检测方法及试剂盒。
背景技术:
[0002] bruton酪氨酸激酶(bruton tyrosine kinase,btk)是一种位于胞质内的非受体酪氨酸激酶,该激酶主要表达于b细胞,是b细胞受体(b cell receptor,bcr)信号通路中的关键激酶。b细胞受体(bcr,b cell receptor)、生长因子和细胞因子受体、g蛋白偶联受体等可以活化btk。bcr与抗原结合后,诱导下游lyn、fyn等src家族激酶活化,导致btk迁移到质膜及酪氨酸223位点的自身磷酸化(btk活化)。活化的btk随后和b细胞衔接蛋白(blnk)结合,导致plc-磷酸化,引起钙离子释放和内流,从而激活nfat转录因子;同时磷酸化的plc-激活pkc及mapk、nf-b及akt等下游信号通路,导致b细胞的存活、增殖、分化,细胞因子释放,甚至b细胞凋亡。
[0003]
bcr信号的活化,可以驱动恶性b细胞的增殖,如慢性淋巴细胞白血病、套细胞林淋巴瘤、滤泡性淋巴瘤、小淋巴细胞淋巴瘤等。活化的btk调节炎性信号通路,如炎性细胞因子的过表达或错误表达,导致炎性反应的发生,如风湿性关节炎、系统性红斑狼疮、银屑病等。近十年,btk抑制剂(如伊布替尼ibrutinib、泽布替尼zanubrutinib)在慢性淋巴细胞白血病、套细胞淋巴瘤等的治疗上发挥明显作用。btk抑制剂的使用,有可能缓解ra等的炎性反应。因此,现今国内外众多厂家争相布局btk抑制剂,针对不同适应症的btk抑制剂处于临床前或临床研究的不同时期。
[0004]
外周血单个核细胞(pbmc)裂解液中游离btk的检测,结合pbmc裂解液中总btk的检测,是验证btk抑制剂的效果的有效手段,可以用于受体占有率的评价,支持药物临床研究中药效学的评价。然而,现有技术中pbmc裂解液中游离btk的检测方法稳定性参差不齐,精密度也有待进一步提高。
技术实现要素:
[0005]
本发明为了解决现有技术中酪氨酸激酶浓度的检测方法存在的精密度低、稳定性差的缺陷,从而提供了一种酪氨酸激酶浓度的检测方法及试剂盒。本发明所述的检测方法精密度高、稳定性好,可以用于受体占有率的评价,支持药物临床研究中药效学的评价。
[0006]
为了实现上述目的,本发明采用以下技术方案:本发明提供了一种酪氨酸激酶浓度的检测方法,其通过电化学发光免疫分析法测定酪氨酸激酶的浓度,包括以下步骤:(1)取酶标板,清洗,拍干;封闭液封闭,封板膜封板,振荡孵育,清洗,拍干;(2)孔内加入探针溶液,封板膜封板,2~8℃振荡孵育,清洗,拍干;(3)在0~4℃的温度下配制标准品溶液和供试品溶液;孔内分别加入标准品溶液和供试品溶液,封板膜封板,振荡孵育,清洗,拍干;(4)加入第一抗体溶液,封板膜封板,振荡孵育,清洗,拍干;
(5)加入第二抗体溶液,封板膜封板,振荡孵育,清洗,拍干;(6)加显色液显色,使用电化学发光仪测量各孔的发光强度,记录数据;(7)建立标准曲线,计算供试品溶液中酪氨酸激酶的浓度。
[0007]
本发明中,步骤(1)中,所述振荡孵育的温度较佳地为25
±
1℃。
[0008]
步骤(1)中,所述振荡孵育的频率较佳地为600~700rpm。
[0009]
步骤(1)中,所述振荡孵育的时间较佳地为60~90min。
[0010]
步骤(1)中,所述封闭液可为本领域常规,较佳地为5% bsa-pbs。所述封闭液的加入量一般为每孔加入150
µ
l。
[0011]
步骤(1)中,所述酶标板可为本领域常规的酶标板,优选96孔酶标板。所述96孔酶标板的型号例如为streptavidin msd/l15sa-1。
[0012]
本发明中,步骤(2)中,所述探针可为本领域常规的不可逆btk抑制剂,较佳地为依鲁替尼-生物素(ibrutinib-biotin)。
[0013]
步骤(2)中,所述探针溶液的浓度较佳地为0.15
µ
m。
[0014]
步骤(2)中,所述探针溶液的加入量一般为每孔加入50
µ
l。
[0015]
步骤(2)中,所述振荡孵育的频率较佳地为600~700rpm。
[0016]
步骤(2)中,所述振荡孵育的时间较佳地为20~40min。
[0017]
本发明中,步骤(2)和步骤(3)中,所述探针溶液、标准品溶液和供试品溶液的溶剂称为稀释液,所述稀释液可为本领域常规,较佳地为bre溶液,即“1%bsa-ripa裂解液 2%蛋白酶抑制剂 2�ta”。其中,所述蛋白酶抑制剂可以有效抑制哺乳动物细胞或组织提取物中的各种蛋白酶活性,如丝氨酸蛋白酶、氨基肽酶、半胱氨酸蛋白酶、苏氨酸和天冬氨酸蛋白酶、金属蛋白酶等。
[0018]
本发明中,步骤(3)中,所述标准品可为重组btk蛋白(recombinant btk protein)。
[0019]
步骤(3)中,所述标准品溶液的配制方法较佳地为:先配制1000 ng/ml的标准品溶液,然后依次稀释2.5倍,得到系列浓度的标准品溶液。例如,所述标准品溶液的系列浓度分别为0ng/ml(空白)、1.638ng/ml(低锚定点)、4.096 ng/ml(定量下限)、10.24 ng/ml、25.6 ng/ml、64 ng/ml、160 ng/ml、400 ng/ml(定量上限)和1000 ng/ml(高锚定点)。
[0020]
步骤(3)中,所述供试品溶液较佳地为含游离btk的pbmc裂解液。所述pbmc裂解液是用“1%bsa-ripa裂解液 2%蛋白酶抑制剂 2�ta”作为溶液,裂解pbmc细胞制备所得。
[0021]
步骤(3)中,所述标准品溶液和供试品溶液的加入量一般分别为每孔加入50
µ
l。
[0022]
步骤(3)中,所述振荡孵育的温度较佳地为25
±
1℃。
[0023]
步骤(3)中,所述振荡孵育的频率较佳地为600~700rpm。
[0024]
步骤(3)中,所述振荡孵育的时间较佳地为60~90min。
[0025]
本发明中,步骤(4)中,所述第一抗体可为小鼠抗人btk单克隆抗体(purified mouse anti-human btk),较佳地为igg2a型小鼠抗人btk单克隆抗体。
[0026]
步骤(4)中,所述第一抗体溶液的浓度较佳地为0.25
µ
g/ml。
[0027]
步骤(4)中,所述第一抗体溶液的溶剂较佳地为1% bsa-pbs。
[0028]
步骤(4)中,所述第一抗体溶液的加入量一般为每孔加入50
µ
l。
[0029]
步骤(4)中,所述振荡孵育的温度较佳地为25
±
1℃。
[0030]
步骤(4)中,所述振荡孵育的频率较佳地为600~700rpm。
[0031]
步骤(4)中,所述振荡孵育的时间较佳地为60~80min。
[0032]
本发明中,步骤(5)中,所述第二抗体可为羊抗小鼠多克隆抗体(goat anti-mouse antibody),较佳地为sulfo-tag
tm
羊抗小鼠多克隆抗体。
[0033]
步骤(5)中,所述第二抗体溶液的浓度较佳地为0.1
µ
g/ml。
[0034]
步骤(5)中,所述第二抗体溶液的溶剂较佳地为1% bsa-pbs。
[0035]
步骤(5)中,所述第二抗体溶液的加入量一般为每孔加入50
µ
l。
[0036]
步骤(5)中,所述振荡孵育的温度较佳地为25
±
1℃。
[0037]
步骤(5)中,所述振荡孵育的频率较佳地为600~700rpm。
[0038]
步骤(5)中,所述振荡孵育的时间较佳地为60~80min。
[0039]
本发明中,步骤(6)中,所述显色液可为本领域常规,较佳地为msd read buffer(2
×
)。所述显色液的加入量一般为每孔加入150
µ
l。
[0040]
步骤(6)中,所述显色的时间可为0~30min。当所述显色时间为0时,表示立即显色。
[0041]
步骤(6)中,所述电化学发光仪可为本领域常规,较佳地为meso
®ꢀ
sector s 600。
[0042]
本发明中,步骤(7)中,所述标准曲线可采用本领域常规的方法建立,一般采用softmax pro gxp software软件建立。
[0043]
较佳地,所述标准曲线的建立方法如下:以所述标准品溶液的理论浓度为横坐标,以所述标准品溶液的发光强度为纵坐标;其中,所述标准品溶液的发光强度较佳地为标准品溶液的复孔均值与空白复孔均值的值差;所述标准曲线的拟合方式为四参数回归模型,公式:y=(a-d)/[1 (x/c)b] d,设置权重:f(x)=1/(v*v);其中,a为曲线下渐近线估值,d为曲线上渐近线估值,b为曲线的斜率,c为最大结合一半时对应的浓度,“v”为发光强度。
[0044]
本发明中,步骤(1)~(5)中,所述清洗可采用本领域常规的洗液进行,所述洗液较佳地为0.05% pbst。所述清洗较佳地为每孔加入300
µ
l洗液洗板3次。
[0045]
本发明中,步骤(1)~(5)中,所述拍干可为本领域常规操作,一般在纸上拍干。
[0046]
本发明中,步骤(1)~(5)中,所述封板膜可为本领域常规,所述封板膜封板可为本领域常规操作。
[0047]
本发明还提供了一种试剂盒,用于进行本发明所述的酪氨酸激酶浓度的检测方法,其包括酶标板、标准品、第一抗体、第二抗体、洗液、封闭液、稀释液和显色液。
[0048]
其中,所述酶标板、标准品、第一抗体、第二抗体、洗液、封闭液、稀释液和显色液如前所述。
[0049]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0050]
本发明所用试剂和原料均市售可得。
[0051]
本发明的积极进步效果在于:本发明提供了一种酪氨酸激酶浓度的检测方法,通过在2~8℃进行探针孵育,提高了方法的精密度;同时,将在0~4℃的温度下(例如在冰上)进行样品配制,提高了方法的稳
定性。本发明对该检测方法进行了符合监管机构要求的方法学验证,验证内容包括校准曲线与定量范围、平行性和最小稀释倍数、精密度和准确度、回收率、稳定性、特异性、方法耐用性等。
[0052]
本发明的方法尤其适用于pbmc裂解液中游离btk的检测,结合pbmc裂解液中总btk的检测,可以用于受体占有率的评价,支持药物临床研究中药效学的评价。
附图说明
[0053]
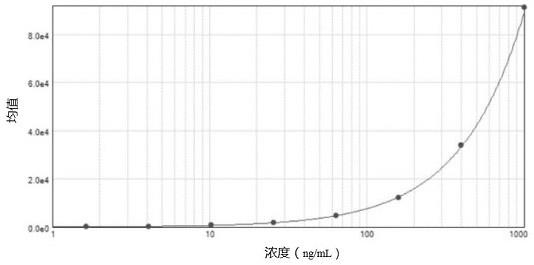
图1为本发明的实施例1的标准曲线。
具体实施方式
[0054]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0055]
实施例1对pbmc裂解液中游离btk的浓度进行检测,所用的试剂及试剂的工作液浓度、仪器和耗材等如表1~3所示。具体包括以下步骤:(1)取出96孔酶标板,每孔加入300
µ
l洗液洗板3次,在纸上拍干;每孔加入150
µ
l封闭液进行封闭,封板膜封板,在25
±
1℃,600rpm振荡孵育60~90min;甩去板内液体,每孔加入300
µ
l洗液洗板3次,在纸上拍干。
[0056]
(2)每孔加入50
µ
l 探针溶液,封板膜封板,在2~8℃,600rpm,振荡孵育20~40min;甩去板内液体,每孔加入300
µ
l洗液洗板3次,在纸上拍干。
[0057]
(3)以稀释液为溶剂,在冰上配制标准品溶液和供试品溶液;其中,标准品溶液如表4所示,供试品溶液为含游离btk的pbmc裂解液,pbmc裂解液是用“ripa裂解液 2%蛋白酶抑制剂 2�ta”作为溶液,裂解pbmc细胞制备所得。
[0058]
向对应的孔内分别加入50
µ
l标准品溶液和供试品溶液,封板膜封板,在25
±
1℃,600rpm振荡孵育60~90min;甩去板内液体,每孔加入300
µ
l洗液洗板3次,在纸上拍干。
[0059]
(4)每孔加入50
µ
l第一抗体溶液,封板膜封板,在25
±
1℃,600rpm振荡孵育约60~80min;甩去板内液体,每孔加入300
µ
l洗液洗板3次,在纸上拍干。
[0060]
(5)每孔加入50
µ
l第二抗体溶液,封板膜封板,在25
±
1℃,600rpm振荡孵育约60~80min;甩去板内液体,每孔加入300
µ
l洗液洗板3次,在纸上拍干。
[0061]
(6)每孔加入150
µ
l显色液显色,立即读数;使用电化学发光仪测量各孔的发光强度,记录数据。
[0062]
(8)使用softmax pro gxp software软件分析数据,建立标准曲线,计算供试品溶液中btk的浓度。
[0063]
其中,标准曲线的建立方法如下:以表4中标准品溶液的理论浓度为横坐标,以标准品溶液的复孔均值与空白复孔均值的值差为纵坐标,建立标准曲线(如图1所示)。标准曲线的拟合方式为四参数回归模型,公式:y=(a-d)/[1 (x/c)b] d,设置权重:f(x)=1/(v*v);其中,a为曲线下渐近线估值,d为曲线上渐近线估值,b为曲线的斜率,c为最大结合一半时对应的浓度。不同批次a、b、c和d
的取值不同,表5为a、b、c和d的取值情况示例。
[0064]
表1 试剂表2 仪器和耗材表3 试剂的工作液浓度 表4 标准品溶液浓度
表5 标准曲线的拟合公式相关参数验证实施例对上述实施例1的方法进行了符合监管机构要求的方法学验证,验证内容包括定量范围、平行性和最小稀释倍数、精密度和准确度、加样回收率和特异性。验证结果如表6~10所示。
[0065]
1、定量范围统计方法学验证10个分析批次(runs)标准曲线各浓度点的cv%和re%所得结果,即10条标准曲线,定量范围为4.096ng/ml~400ng/ml浓度点的数据。具体数据见表6,由表6可知,实施例1的方法满足方法学要求:定量上限及定量下限的精密度(cv%)不大于25.0%,准确度满足在
±
25.0范围内;其他点精密度(cv%)不大于20.0%,准确度满足在
±
20.0范围内。
[0066]
表6 定量范围结果表中,cv为变异系数,re为相对误差。
[0067]
2、平行性和最小稀释倍数3个个体pbmc裂解液分别经1、2、4和8倍稀释后,计算各稀释样品终浓度的cv%,即
检测浓度*稀释倍数后浓度的cv%,即回算浓度cv%。具体数据见表7。由表7可知,回算浓度精密度良好,满足不大于20%的一般方法学要求。说明样品不进行稀释或最大进行8倍稀释,结果可靠。
[0068]
表7 平行性和最小稀释倍数结果3、精密度和准确度作为验证样品,每个批次配制定量上限(uloq)、高浓度质控(hqc)、中浓度质控(mqc)、低浓度质控(lqc)和定量下限(lloq)五个浓度,每个浓度配制3个平行样品,每个样品2复孔检测,报告2个复孔的均值为检测值。按照行业要求,共进行6个批次的实验。所以每个浓度每个批次共有3个检测值,6个批次共有18个检测值,共有6个检测均值。
[0069]
验证结果见表8,其中,批内cv%是计算每个浓度3个平行性样品检测值的cv%,此处范围为6个批次的批内cv%的统计范围;批内re%则是计算3个平行性样品均值与理论值的误差,此处范围是6个批内re%的统计范围;批内te%则是批内cv%与批内re%绝对值的和,此处范围是6个批内te%的统计范围。批间cv%是计算18个检测值的cv%的均值,批间re%则是计算18个检测值均值与理论值的误差;批间te%则是批间cv%与批间re%绝对值的和。
[0070]
由表8可知,本技术的检测方法精密度和准确度高,结果符合一般方法学要求。精密度和准确度的接受标准为:定量上限(uloq)批内批间精密度(cv%)不大于25.0%,准确度(re%)满足在
±
25范围内;其他质控批内批间精密度(cv%)不大于20.0%,准确度(re%)满足在
±
20.0范围内;定量上限和定量下限的方法学总误差(te%)不大于40.0,其他点不大于30.0。
[0071]
表8 精密度和准确度结果
4、加样回收率3个个体pbmc裂解液中分别加入中浓度质控水平(mqc浓度)的btk标准品,同时检测加入、不加入mqc浓度的btk标准品的个体样品,回收率%=检测值加入btk/(检测值个体pbmc裂解液 mqc浓度)*100%。结果如表9所示。由表9可知,本技术的检测方法满足一般方法学要求的回收率(recovery%)在80%~120%范围内。
[0072]
5、特异性一定浓度的(终浓度为30ng/ml)btk标准品中加入bre溶液进行系列稀释后的探针溶液后,孵育一段时间(至少30min)后检测,其中,探针溶液的浓度分别为200nm(t2)、2 nm(t4)和0 nm(t6)。结果见表10,其中,回算浓度即为检测浓度,cv%为复孔cv%。由表10可知,随着探针溶液浓度的升高,回算得到的标准品浓度逐渐降低,说明探针特异性的抑制btk的检测,方法具有特异性。
[0073]
表9 回收率结果表10 特异性结果对比例1按照实施例1的方法对pbmc裂解液中游离btk的浓度进行检测,其中,与实施例1不同之处在于:步骤(2)中探针孵育的温度为常温,步骤(3)中在常温下配制标准品溶液和供试品溶液。
[0074]
对上述对比例1的方法进行了符合监管机构要求的方法学验证,验证内容包括精密度和准确度。配制定量上限(puloq)、高浓度质控(phqc)、中浓度质控(pmqc)、低浓度质控(plqc)及定量下限(plloq进行精密度和准确度的考察。验证结果如表11所示。由表11可见,使用对比例1的检测方法,大多数批次的精密度和准确度不能满足接受标准。
[0075]
表11 对比例1的精密度和准确度结果
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。