基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度的系统和方法
1.相关申请的交叉引用
2.本技术要求于2019年8月6日提交的美国申请号62/883,320的优先权,该申请题为“systems and methods for determining protein concentrations of unknown protein samples based on automated multi-wavelength calibration[基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度的系统和方法]”,将其通过引用以其全文并入本文。
技术领域
[0003]
本披露内容总体上涉及与治疗药物的自动化和工程化相关的基于紫外线(uv)的成像系统和方法,并且更具体地,涉及基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度的基于uv的成像系统和方法。
背景技术:
[0004]
在药物治疗产品的制备和开发中,过程监测和产品质量属性控制是常规执行的。例如,通常使用关于过程监测和产品质量属性控制的技术来确保此类药物治疗产品的功效。
[0005]
当前的仪器(包括当前的固定路径长度和可变路径长度的仪器(例如,机械仪器))是围绕着应用而设计的,并且受限于对本质上是线性的比尔-朗伯定律公式的依赖。具体地,由于吸光度的线性范围有限,因此当吸光度超出线性范围时,此类仪器可能无法正确测量样品的浓度。
[0006]
下面的公式说明了比尔-朗伯定律:
[0007]
a=ε*c*l
[0008]
在上述公式中,a是吸光度值,ε是消光系数,c是浓度值,并且l是光束通过样品的路径长度。吸光度值(a)通常作为光束穿过样品的响应因子来测量。消光系数(ε)衡量物质对给定波长的光的吸收强度。关于治疗剂测量,消光系数(ε)通常是蛋白质的固有特性,并且不会改变。
[0009]
浓度值(c)是指给定样品(例如,治疗产品或其他基于蛋白质的产品的样品)的浓度。更一般地说,浓度是组分的丰度除以混合物的总体积。浓度可以指几种不同的类型,包括质量浓度、摩尔浓度、计数浓度(number concentration)和/或体积浓度。浓度通常可以针对任何类型的化学混合物,但最常见的是溶质或溶剂溶液。
[0010]
如上所述,比尔-朗伯定律公式假设线性,使得当前的蛋白质测量仪器和技术限于样品浓度值、固定消光系数和静态光路长度的线性函数。应用比尔-朗伯公式可能无法正确测量非线性样品的浓度与吸光度比率,这可能导致过程监测和产品质量属性控制过程中的偏差、假阳性和/或假阴性。
[0011]
由于比尔-朗伯局限性,制备用于测量的样品并用固定路径长度的uv光谱仪进行
产品质量属性控制典型地既耗时又容易出错。例如,产品质量属性的测量可能需要连续稀释,直到样品浓度落入动态范围。这种稀释可能容易产生误差,尤其是在测量几个产品样品的值时,因为在整个过程中可能需要不同的样品稀释因子,并且使用稀释因子进行浓度计算可能容易出错。应用于几个产品样品的稀释过程以及典型地由这种过程引入的误差,通常在相关产品质量属性的测量中产生差异。在过程监测和产品质量属性控制过程中,此类错误的测量可能导致不可接受数量的假阳性和假阴性。
[0012]
已开发了可变路径长度仪器,以允许在可变路径长度下测量uv吸光度(与传统的固定路径长度uv吸光度测量相反)。在此类仪器中,路径长度定义为光传输光纤(fibrette)尖端和样品容器内部底部之间的距离。通过集成硬件装置,通过在样品中上下移动光纤,动态控制路径长度。可变路径长度仪器解决了直接测量的浓度范围问题。在固定路径长度仪器中,直接测量范围很窄,因此,实际上总是需要样品稀释。然而,使用可变路径长度仪器,由于此类仪器可以扫描可变路径长度,因此它可以直接测量高蛋白质浓度,而不需要任何稀释。然而,此类仪器的获取和维护典型地是昂贵的,并且从根本上说,还容易由于光传输光纤的机械运动和操纵而导致测量误差。例如,光纤的常规校准或维护的缺乏和/或可变光仪器的机械部件的轻微变化通常导致误差,其中测量结果由于机械故障、错误校准或机械变化的程度而发生偏移。这些误差通常导致样品测量的差异,并且使得无法获得可重复结果并且无法在可接受限度内进行充分校准,包括例如用于产品测量和质量控制目的。
[0013]
出于前述原因,需要基于uv的成像系统和方法,用于基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度。
技术实现要素:
[0014]
本披露内容总体上涉及治疗药物的自动化和测试,包括与此类治疗药物相关的开发、加工、监测和/或产品质量属性控制。在各种实施例中,披露了基于uv的成像系统和方法,用于基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度。测定的蛋白质浓度可以是治疗药物或产品的未知样品的浓度。此类蛋白质浓度的测定可以用于过程监测和产品质量属性控制,例如,在治疗剂或其他基于蛋白质的产品的制造过程中。此类蛋白质浓度的测定也可以用于与产品质量控制相关的过程监测和产品质量属性控制,和/或确保此类产品的规则性符合性或其他功效。
[0015]
因此,如本文所述,在各种实施例中,基于uv的成像系统可以被配置成基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度。基于uv的成像系统可以包括被配置成投射多波长光束的光源。另外,基于uv的成像系统可以包括单色仪,其被配置成接收多波长光束,并且基于多波长光束投射uv光谱的一系列单波长光束。
[0016]
基于uv的成像系统可以进一步包括可操作用于接收蛋白质样品的样品保持器。在各种实施例中,蛋白质样品可以是(1)选自一组标准蛋白质样品的标准蛋白质样品,或者(2)选自一组未知蛋白质样品的未知蛋白质样品。如本文所述,未知蛋白质样品具有未知蛋白质浓度。样品保持器通常被定位成允许该系列单波长光束穿过蛋白质样品的至少一部分,无论蛋白质样品是标准蛋白质类型还是未知蛋白质类型。
[0017]
基于uv的成像系统可以进一步包括检测器,其可操作以检测穿过蛋白质样品的至少一部分的该系列单波长光束。
[0018]
基于uv的成像系统可以进一步包括存储程序指令的存储器和通信地耦合到存储器的处理器。处理器可以被配置成执行程序指令,以使处理器接收如由检测器为该组标准蛋白质样品中的每个标准蛋白质样品记录的一组标准波长数据。对于每个标准蛋白质样品,该组标准波长数据可以包括跨从该系列单波长光束中选择的第一波长范围的第一系列第一吸光度与波长值对。另外,每个第一吸光度与波长值对可以包括uv吸光度值和波长值。
[0019]
另外,基于uv的成像系统的处理器可以进一步被配置成执行程序指令,以使处理器基于该组标准波长数据的第一系列第一吸光度与波长值对中的每一个生成多波长校准模型。
[0020]
基于uv的成像系统的处理器可以进一步被配置成执行程序指令,以使处理器接收如由检测器为该组未知蛋白质样品中的每个未知蛋白质样品记录的一组未知波长数据。对于每个未知蛋白质样品,该组未知波长数据可以包括跨从该系列单波长光束中选择的第二波长范围的第二系列第二吸光度与波长值对。每个第二吸光度与波长值对可以包括uv吸光度值和波长值。
[0021]
另外,基于uv的成像系统的处理器可以进一步被配置成执行程序指令,以使处理器用多波长校准模型,并且对于该组未知蛋白质样品中的每个未知蛋白质样品,确定多个蛋白质浓度值。该多个蛋白质浓度值中的每个蛋白质浓度值可以对应于从该系列单波长光束中选择的第二波长范围。
[0022]
在本文描述的另外实施例中,描述了基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度的基于uv的成像方法。基于uv的成像方法包括在处理器处接收如由检测器为一组标准蛋白质样品中的每个标准蛋白质样品记录的一组标准波长数据。对于每个标准蛋白质样品,该组标准波长数据可以包括跨从uv光谱的一系列单波长光束中选择的第一波长范围的第一系列第一吸光度与波长值对。每个第一吸光度与波长值对可以包括uv吸光度值和波长值。
[0023]
基于uv的成像方法可以进一步包括用处理器,基于该组标准波长数据的第一系列第一吸光度与波长值对中的每一个生成多波长校准模型。
[0024]
基于uv的成像方法可以进一步包括在处理器处接收如由检测器为一组未知蛋白质样品中的每个未知蛋白质样品记录的一组未知波长数据。对于每个未知蛋白质样品,该组未知波长数据可以包括跨从该系列单波长光束中选择的第二波长范围的第二系列第二吸光度与波长值对。每个第二吸光度与波长值对可以包括uv吸光度值和波长值。
[0025]
基于uv的成像方法可以进一步包括用如在处理器上实施的多波长校准模型,为该组未知蛋白质样品中的每个未知蛋白质样品确定多个蛋白质浓度值。该多个蛋白质浓度值中的每个蛋白质浓度值可以对应于从该系列单波长光束中选择的第二波长范围。
[0026]
在本文描述的另外实施例中,描述了一种有形的、非暂时性的计算机可读介质,其存储用于基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度的指令。当由计算装置的一个或多个处理器执行时,该计算装置包括一个或多个存储器,这些指令使得该计算装置在处理器处接收如由检测器为一组标准蛋白质样品中的每个标准蛋白质样品记录的一组标准波长数据。对于每个标准蛋白质样品,该组标准波长数据可以包括跨从uv光谱的一系列单波长光束中选择的第一波长范围的第一系列第一吸光度与波长值对。每个第一吸光度与波长值对可以包括uv吸光度值和波长值。
[0027]
另外,当由一个或多个处理器执行时,这些指令可以进一步使得计算装置用处理器,基于该组标准波长数据的第一系列第一吸光度与波长值对中的每一个生成多波长校准模型。
[0028]
此外,当由一个或多个处理器执行时,这些指令可以进一步使得计算装置在处理器处接收如由检测器为一组未知蛋白质样品中的每个未知蛋白质样品记录的一组未知波长数据。另外,对于每个未知蛋白质样品,该组未知波长数据可以包括跨从该系列单波长光束中选择的第二波长范围的第二系列第二吸光度与波长值对。每个第二吸光度与波长值对可以包括uv吸光度值和波长值。
[0029]
另外,当由一个或多个处理器执行时,这些指令可以使得计算装置用如在处理器上实施的多波长校准模型,为该组未知蛋白质样品中的每个未知蛋白质样品确定多个蛋白质浓度值。该多个蛋白质浓度值中的每个蛋白质浓度值可以对应于从该系列单波长光束中选择的第二波长范围。
[0030]
在本文描述的另外实施例中,描述了基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度的成像设备。成像设备包括用于接收一组标准蛋白质样品中每个标准蛋白质样品的一组标准波长数据的装置。对于每个标准蛋白质样品,该组标准波长数据包括跨从uv光谱的一系列单波长光束中选择的第一波长范围的第一系列第一吸光度与波长值对。每个第一吸光度与波长值对包括uv吸光度值和波长值。
[0031]
成像设备进一步包括用于基于该组标准波长数据的第一系列第一吸光度与波长值对中的每一个生成多波长校准模型的装置。
[0032]
成像设备进一步包括用于接收一组未知蛋白质样品中每个未知蛋白质样品的一组未知波长数据的装置。对于每个未知蛋白质样品,该组未知波长数据包括跨从该系列单波长光束中选择的第二波长范围的第二系列第二吸光度与波长值对。每个第二吸光度与波长值对包括uv吸光度值和波长值。
[0033]
成像设备进一步包括用于用多波长校准模型,为该组未知蛋白质样品中的每个未知蛋白质样品确定多个蛋白质浓度值的装置。该多个蛋白质浓度值中的每个蛋白质浓度值对应于从该系列单波长光束中选择的第二波长范围。
[0034]
本披露内容的基于uv的成像系统和方法改进了当前已知仪器的局限性。例如,如本文所述,本披露内容的基于uv的成像系统和方法描述了在药物治疗产品的制备和开发中使用的过程监测和产品质量属性控制的自动化工作流程。另外,自动化工作流程通过提供uv光谱的全扫描而不是局限于单波长或双波长来增强并改进当前已知的方法。例如,代替在常规仪器中典型的那样依赖于单个uv波长(例如,280nm)来测量样品蛋白质浓度,本披露内容的基于uv的成像系统和方法测量蛋白质浓度,允许在宽范围(包括例如280-315nm的uv范围)内进行扫描。
[0035]
另外,本披露内容的基于uv的成像系统和方法克服了对固定路径长度和多路径长度uv光谱仪两者的限制,包括与测量光波长、吸光度值的动态范围相关的常规问题,以及由更近的仪器引入的机械挑战。例如,当前的仪器依赖于比尔-朗伯定律的应用,并受其限制。为了克服比尔-朗伯定律的线性限制,本披露内容的基于uv的成像系统和方法被配置成检测针对给定样品测量的每个波长的吸光度值,然后根据相关消光系数的变化动态校准吸光度响应因子。结果,应用本披露内容的基于uv的成像系统和方法,可以改进固定路径长度的
uv光谱仪及其相关数据输出,这将在宽范围内,包括例如在每毫升(ml)0.1-126毫克(mg)的范围内提供蛋白质浓度的精确测量。
[0036]
另外,在各种实施例中,本披露内容的基于uv的成像系统和方法通常在蛋白质浓度测量的宽范围内产生波长值的重叠。在此类实施例中,可以通过应用波长范围的平均值、中值、推导、导数或以其他方式编译来产生增强的预测(例如,浓度测量的增强精度),以产生增强的多样品测量。例如,在一些实施例中,可以将信号平均值应用于重叠浓度测量,从而导致精度增强。例如,相对于基于单波长的参考预测,“增强”预测可以具有更高的准确度(如更紧的置信区间或更小的标准误差)。
[0037]
此外,不同于使用机械光导以不同路径长度扫描,从而扩展了线性蛋白质浓度范围的可变uv路径长度仪器,本发明的基于uv的成像系统和方法的自然消光系数调谐没有机械误差,并且适用于任何常规uv光谱仪。
[0038]
另外,本披露内容的基于uv的成像系统和方法提供了对计算机功能的改进和/或对其他技术的改进,至少是因为基于uv的成像系统和方法提高了测量蛋白质相关产品信息的计算装置(如分光光度计)的准确度和精度。也就是说,本披露内容描述了对计算机装置本身(例如,分光光度计或用于测量或监测蛋白质相关产品的装置或系统)的功能的改进,因为本文描述的基于uv的成像技术的应用增加了此类仪器、装置或系统的准确度和精度,这不仅导致底层系统的可靠性增加,而且导致系统的最终用途的可靠性增加,例如监测和/或测量蛋白质相关产品(如治疗剂)的蛋白质浓度,如本文所述。这相对于现有技术有所改进,至少是因为如本文所述的,现有仪器,如固定路径长度的仪器和机械的、基于变量的仪器是受限的、容易出错的和/或使用起来昂贵的。相反,本披露内容的基于uv的成像系统和方法与任何具有全扫描能力的uv光谱仪兼容。这允许在整个分析监测和/或测试网络中部署基于uv的成像系统和方法。出于类似的原因,所披露的系统和方法扩展了现有系统和仪器的分析能力,而不需要资本投资或大的设备占用空间。
[0039]
类似地,本披露内容的基于uv的成像系统和方法涉及对治疗药物的自动化和工程化领域中的其他技术或技术领域的改进,至少是因为基于uv的成像系统和方法提供了完全自动化的工作流程,使得能够用零离线样品和数据处理进行实时测量和监测。使用这种自动化工作流程,可以消除或减少样品稀释和人工数据处理,这减少了人为错误并提高整个过程的可靠性。
[0040]
如本文所述,至少在一些实施例中,基于uv的成像系统和方法包括使用和应用或通过使用特定的机器,例如分光光度计和/或通过分光光度计或其他此类uv成像装置使用的相关部件。
[0041]
另外,本披露内容的基于uv的成像系统和方法包括实现特定物品向不同状态或事物的转变或还原,例如,将多波长光束转变或还原为多波长校准模型,用于预测可以用于监测或测量蛋白质相关产品的蛋白质浓度的多个蛋白质浓度值。这种监测和测量可以在蛋白质相关产品的制造过程中使用和/或可以用于确定蛋白质相关产品是否符合与蛋白质相关产品相关的已知规范或规定,例如用于治疗产品或其制造。举例来说,基于所测量的蛋白质浓度,蛋白质相关产品的蛋白质浓度可以增加或减少到落入蛋白质浓度的特定范围内。举例来说,一批蛋白质相关产品可以被接受或拒绝,这取决于所测量的蛋白质浓度是落入(分别)特定范围之内还是之外。
[0042]
另外,本披露内容的基于uv的成像系统和方法包括除了该领域中充分了解的、惯例的、常规的活动之外的特定特征,或者添加将权利要求限制于特定有用应用的非常规步骤,例如包括当前仪器所缺乏的预测、增强和测量的应用。例如,如本文所述,常规仪器受限于对比尔-朗伯定律、机械仪器(例如,导向灯)或操纵等的依赖,这是本披露内容的基于uv的成像系统和方法所克服的。
[0043]
对于本领域的普通技术人员来说,根据以下对已经通过说明的方式示出和描述的优选实施例的描述,优点将变得更加明显。如将认识到的,本发明实施例可以具有其他和不同的实施例,并且可以在各个方面对其细节进行修改。因此,附图和说明书将在本质上被视为是说明性的而非限制性的。
附图说明
[0044]
下文描述的附图描绘了其中披露的系统和方法的各方面。应理解的是,每个附图描绘了披露的系统和方法的特定方面的实施例,并且附图中的每一个旨在与其可能的实施例一致。进一步地,在任何可能的情况下,以下说明涉及包括在以下附图中的附图标记,其中,在多个附图中描绘的特征是用一致的附图标记表示的。
[0045]
在附图中示出了当前讨论的安排,然而,应理解的是,本发明的实施例不限于所示出的精确安排和工具,其中:
[0046]
图1示出了根据本文披露的各种实施例的、示例性的基于uv的成像系统,该系统用于基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度。
[0047]
图2a和图2b示出了根据本文披露的各种实施例的、示例性的基于uv的成像方法的流程图,该方法用于基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度。
[0048]
图3a和图3b示出了根据本文披露的各种实施例的、包括伪代码的示例计算机程序列表,用于实施图2a和图2b的基于uv的成像方法。
[0049]
图4a示出了根据本文披露的各种实施例,表示跨单波长光束的uv光谱的一组标准蛋白质样品的图。
[0050]
图4b示出了根据本文披露的各种实施例,表示跨从uv光谱中选择的第一波长范围、各种系列的第一吸光度与波长值对(absorbance-to-wavelength value pair)的图。
[0051]
图5a示出了根据本文披露的各种实施例,表示由单波长校准模型构成的多波长校准模型的图。
[0052]
图5b示出了根据本文披露的各种实施例,表示图5a的各种单波长校准模型的斜率和y截距的图。
[0053]
图6示出了根据本文披露的各种实施例,表示跨从uv光谱中选择的第二波长范围、各种系列的第二吸光度与波长值对的图。
[0054]
图7示出了根据本文披露的各种实施例,表示用图5a的多波长校准模型确定的蛋白质浓度值的图。
[0055]
图8示出了根据本文披露的各种实施例,描绘应用图5a的多波长校准模型来监测或测量蛋白质相关产品的蛋白质浓度的流程图。
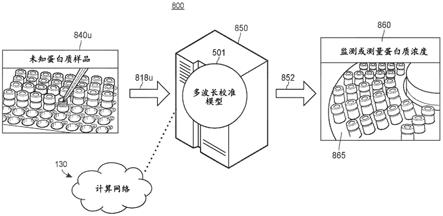
[0056]
附图仅出于说明目的描绘了优选实施例。在没有偏离本文所描述的本发明的原则的情况下,可以采用本文所展示的系统和方法的替代实施例。
具体实施方式
[0057]
图1示出了根据本文披露的各种实施例的示例基于uv的成像系统100,该系统用于基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度。在各种实施例中,系统100可以包括uv成像装置101,其可以是uv分光光度计或其他这样的成像设备。uv成像装置101包括光源102,其被配置成将多波长光束104投射到单色仪106上。在各种实施例中,单色仪106可以是棱镜、衍射装置或实施衍射光栅以将多波长光束分成单波长光束的任何其他装置。在图1的实施例中,单色仪106被配置成接收多波长光束104,并且使用多波长光束014作为光源来投射或以其他方式提供uv光谱的一系列单波长光束108。
[0058]
在各种实施例中,该系列单波长光束108可以包括从200纳米(nm)至400纳米(nm)的uv光谱中的单波长光束。另外,单波长光束108可以包括大量波长(例如,在uv光谱的小跨度上扩展的多个波长),其中单波长光束108的每个间隔是uv光谱中的一个波长。例如,在一些实施例中,uv光谱中的每个单波长光束108可以分开单个纳米间隔。然而,本文考虑了不同的间隔和间隔大小,使得单个纳米间隔仅作为一个示例实施例。
[0059]
uv成像装置101可以进一步包括样品保持器110,其可操作以相对于uv成像装置101接收、保持或定位蛋白质样品。样品保持器110可以被配置成保持流通池、比色管或用于封装蛋白质样品的其他容器的至少一部分。样品保持器110通常被定位在uv成像装置101内或作为其一部分,以允许该系列单波长光束穿过蛋白质样品的至少一部分,无论蛋白质样品是标准蛋白质类型还是未知蛋白质类型。样品保持器可以由塑料、玻璃、熔融石英或允许光透射通过材料和蛋白质样品的其他此类材料形成。
[0060]
在各种实施例中,根据本文的各种实施例,蛋白质样品可以是标准蛋白质样品(例如,标准蛋白质样品140s)或未知蛋白质样品(例如,未知蛋白质样品140u)。如本文所用的术语“未知蛋白质样品”是指具有未知蛋白质浓度的蛋白质样品。蛋白质样品可以是液体、半液体、固体或其他测量状态。给定蛋白质样品的蛋白质可以是治疗药物产品的专有蛋白质。
[0061]
如本文各种实施例所述,未知蛋白质样品具有未知蛋白质浓度,并且标准蛋白质样品具有已知蛋白质浓度。注意,未知蛋白质样品包含至少一种未知浓度的蛋白质;当然,可以存在多于一种蛋白质。该样品可以包括其他不含蛋白质的组分,如缓冲液、盐和其他有机和无机分子。标准蛋白质样品可以是参考标准或其他已知的、预先测量的或预定的样品,其具有已知的、预先测量的或预定的稀释度、浓度或其他已知的基于蛋白质的百分比或分配。
[0062]
在各种实施例中,蛋白质样品可以是(1)选自一组标准蛋白质样品(例如,标准蛋白质样品140s)的标准蛋白质样品,或者(2)选自一组未知蛋白质样品(例如,未知蛋白质样品140u)的未知蛋白质样品。如本文所用,一组蛋白质样品(例如,标准的或未知的)包括一个或多个蛋白质样品。例如,在一个实施例中,一组标准蛋白质样品(例如,标准蛋白质样品140s)可以包括具有各自已知浓度的多个标准蛋白质样品(例如,标准蛋白质样品140s),并且一组未知蛋白质样品(例如,未知蛋白质样品140u)可以包括具有未知蛋白质浓度的单个蛋白质样品。
[0063]
uv成像装置101可以进一步包括检测器114,该检测器可操作以检测穿过如由样品保持器110所保持的蛋白质样品的至少一部分的一系列单波长光束112。单波长光束112可
以包括与单波长光束108相同或不同数量、类型、强度和/或大小的光。单波长光束108和多波长光束112之间的相似性或差异通常由位于样品保持器110内的蛋白质样品(及其相关的蛋白质浓度)引起,其中这种相似性或差异引起如由检测器114记录的特定于该蛋白质样品(基于其蛋白质浓度)的波长数据118(例如,对于标准或未知样品)的产生和/或输出116。
[0064]
检测器114可以是或可以包括光电倍增管、光电二极管、光电二极管阵列、电荷耦合装置(ccd)或被配置成收集和/或记录各种波长的光的各自值的其他光敏装置或阵列。例如,对于基于ccd的检测器,单波长光束112可以聚焦到检测器114的像素阵列上,其中阵列的像素可以测量每个波长(例如,在可见区域中的情况下的每种颜色)的强度,并记录为一个或多个值。然后基于ccd的检测器可以输出116其测量值,作为波长数据118,其可以一起表示光的每个波长强度的光谱或者一个或多个值。更一般地说,波长数据118测量被测量的蛋白质样品的吸光度值(例如,当前在样品保持器110中的蛋白质样品的蛋白质浓度的吸光度)。也就是说,穿过样品保持器110的单波长光束108中的至少一些被至少部分吸收,或者根据蛋白质样品的浓度而改变,使得单波长光束112也类似地改变。例如,如果位于样品保持器110中的蛋白质样品吸收了特定波长的光,则该波长的光将在单波长光束112中不存在或部分不存在。因此,通常,检测器114测量单波长光束108和单波长光束112之间的差异,以确定吸光度或吸光度值作为一个或多个响应因子。
[0065]
至少在一些实施例中,uv成像装置101的光源102、单色仪106、样品保持器110和检测器118中的每一个可以形成分光光度计装置的至少一部分。例如,至少在一个实施例中,分光光度计可以是thermo fisher scientific
tm evolution
tm
分光光度计或其他这样的成像设备。
[0066]
检测器114可以经由总线123(即,电子通信总线)通信地耦合到uv成像装置101的各种部件121至128。例如,检测器114可以通信地耦合到处理器124。处理器124可以是微处理器或中央处理单元(cpu),如基于基于或其他这样的微处理器。处理器124可以负责控制经由总线123通信地耦合的各种部件。例如,处理器124可以控制检测器114的输出116作为波长数据118,在一个实施例中,该波长数据存储在存储器121中。另外,处理器124可以从输入/输出部件126接收命令或其他指令。输入/输出部件126可以与各种输入/输出装置(如键盘、鼠标或类似部件)接口或以其他方式连接。此类部件可以用于访问或以其他方式操纵或检索波长数据118(例如,在存储器121中)作为检测器116的输出116。处理器124也可以通信地连接到显示器128。显示器128可以是显示屏,其中处理器124将在显示器128的显示屏上呈现波长数据118的表示,如二维(2d)、三维(3d)或其他表示。
[0067]
处理器124可以进一步经由总线123通信地连接到收发器122。处理器124经由收发器122可以通过计算网络130通信地耦合到计算装置151。在所显示的实施例中,计算装置151可以经由计算机网络130、经由计算装置151的远程处理器154和远程收发器152发送134和接收132数据(例如像波长数据118)。远程处理器154和远程收发器152可以经由总线153(例如,电子通信总线)彼此通信地耦合。计算装置151可以进一步包括经由总线153通信地耦合的远程存储器159,以存储如经由远程收发器152接收的数据(例如,波长数据118)。计算装置151可以进一步包括经由总线153通信地耦合的显示器158和输入/输出部件156,以便于输入/输出操作,例如像经由触摸屏、键盘等接收命令,并且在显示器158的屏幕上显示数据,例如波长数据118。这样,计算装置151包括可以用于存储和/或处理远离uv成像装置
101的波长数据110的远程处理器154和远程存储器159。
[0068]
在图1的实施例中,存储器121和/或远程存储器159可以存储程序指令,以使处理器124和/或154中的任一个或两个执行程序指令,从而实施如本文图2a和图2b所描述的基于uv的成像方法200。程序指令可以是为编程语言(如python、java、c#或其他编程语言)的程序代码。在一些实施例中,程序指令可以是基于客户端-服务器的,其中远程处理器154作为客户端通过计算网络130与作为服务器的处理器124通信。在此类实施例中,远程处理器154可以请求有待从uv成像装置101向计算装置151传输的数据,如波长数据118(例如,存储在存储器121中或作为检测器114的新输出116)。波长数据118可以由远程处理器154经由在线应用编程接口(api)(如表示性状态传送(restful)api)来请求,其中处理器124实施该api以从远程处理器154接收请求,并且通过经由计算机网络130提供波长数据118来响应。在其他实施例中,uv成像装置101可以实施基于推送的接口,其中新生成和/或输出116波长数据118经由计算机网络130传输到计算装置151。在仍进一步的实施例中,uv成像装置101或计算装置151的用户可以经由输入/输出126或156接收或提取外部存储装置(未示出)(如磁盘或拇指驱动器)上的波长数据。
[0069]
图2a和图2b示出了根据本文披露的各种实施例的示例基于uv的成像方法200的流程图,该方法用于基于自动多波长校准来确定未知蛋白质样品(例如,未知蛋白质样品140u)的蛋白质浓度。基于uv的成像方法200克服了现有技术的限制,包括依赖于比尔-朗伯定律及其关于线性的假设和限制。图2a和图2b与图3a和图3b一起显示。图3a和图3b示出了根据本文披露的各种实施例的包括伪代码的示例计算机程序列表,用于实施图2a和图2b的基于uv的成像方法200。如关于图3a和图3b所示,为了克服比尔-朗伯定律的线性限制,程序代码(如伪python代码所示)可以应用样品过滤器来确定每个波长的线性吸光度范围,并且根据一个或多个消光系数的变化动态校准吸光度响应因子。结果,uv成像装置101(例如,包括uv成像装置101是固定路径长度uv光谱仪的实施例)可以在宽范围内精确测量一种或多种蛋白质浓度,例如在0.1至126mg/ml范围内的蛋白质浓度。
[0070]
如由图2a所描绘,基于uv的成像方法200开始(202)于框204处,其中处理器(例如,处理器125或远程处理器154)接收如由检测器(例如,检测器114)为一组标准蛋白质样品(例如,标准蛋白质样品140s)中的每个标准蛋白质样品记录的一组标准波长数据(例如,波长数据118)。在一些实施例中,例如,该组标准波长数据(例如,波长数据118)可以作为逗号分隔值(csv)数据被接收。在其他实施例中,该组标准波长数据可以以数据库格式、可扩展标记语言(xml)、javascript object notation(json)或其他数据或文本格式来接收。在图3a和图3b的实施例计算机程序列表中,例如,在代码段5处,标准蛋白质样品(例如,标准蛋白质样品140s)的波长数据由处理器(例如,处理器124或远程处理器154)作为csv数据读入存储器(例如,存储器121或远程存储器159),其中每个蛋白质标准样品被分配其已知浓度。图3a和图3b的计算机程序列表是以伪python编写的,其中熊猫库“pd”用于读入波长数据。这在代码段1和5中示出。代码段1还示出了另外的库“sklearn”的导入,其提供了线性回归训练算法作为用于说明如本文所述的预测模型的训练的实施例。
[0071]
对于每个标准蛋白质样品,该组标准波长数据(例如,波长数据118)可以包括跨从uv光谱的一系列单波长光束中选择的第一波长范围的第一系列第一吸光度与波长值对。每个第一吸光度与波长值对可以包括uv吸光度值和波长值。例如,图4a示出了根据本文披露
的各种实施例,表示在单波长光束404的uv光谱上的一组标准蛋白质样品(例如,标准蛋白质样品140s)400a至400m的图400。具体地,图400包括uv吸光度轴402(y轴),其具有吸光度值的范围,将其用作响应因子测量。通常,对于给定波长,吸光度值越大,(例如,通过检测器114)检测到的光越少。另外,图400包括波长轴404(x轴),其具有以纳米为间隔(尽管本文也考虑了其他间隔)的光波长的范围。
[0072]
在图4a的实施例中,具有0.1-126mg/ml范围内的蛋白质标准溶液的标准蛋白质样品(例如,标准蛋白质样品140s)经由分光光度计在200-400nm uv光谱(具有1nm间隔)上扫描。标准蛋白质样品装在1cm路径长度的石英比色管中。uv光谱的波长数据被保存为csv数据。因此,图400描绘了在200nm至400nm的波长范围内扫描的蛋白质校准标准品(例如,标准蛋白质样品(例如,标准蛋白质样品140s))的原始uv光谱数据。
[0073]
如图4a所示,图400表示13个标准蛋白质样品(例如,标准蛋白质样品140s)400a至400m。对于每个标准蛋白质样品,通过蛋白质浓度测量相同的蛋白质(例如,蛋白质分子)。蛋白质分子可以是分子,如专有蛋白质或用于开发治疗产品或其他此类药物产品的其他蛋白质。
[0074]
如图4a所示,每个标准蛋白质样品(例如,标准蛋白质样品400a和标准蛋白质样品400m)由图400内多个吸光度与波长值对的对应图表示。例如,关于标准蛋白质样品400m,吸光度与波长值对400m305是标准蛋白质样品400m在波长值为305且吸光度值为大约2.5时的测量值。因此,吸光度与波长值对400m305位于图400内对应的uv吸光度轴402(y轴)和对应的波长轴404(x轴)处。作为进一步的实例,关于标准蛋白质样品400a,吸光度与波长值对400a230是标准蛋白质样品400a在波长值为230且吸光度值为大约1.0时的测量值。因此,吸光度与波长值对400a230位于图400内对应的uv吸光度轴402(y轴)和对应的波长轴404(x轴)处。各个标准蛋白质样品表示400a至400m的剩余吸光度与波长值对类似地绘制在图400内,各自表示以200纳米(nm)至400纳米(nm)的波长光谱中的每个波长值(沿着波长轴404)扫描并测量的uv吸光度值(沿着uv吸光度轴402)。
[0075]
关于图2a的基于uv的成像方法200,在框206处,处理器(例如,处理器124或远程处理器154)确定是否过滤该组标准波长数据。可以基于(例如,通过检测器114)检测到的波长数据的范围来进行确定,其中一些数据集包括宽的波长范围。如果没有应用过滤器,则基于uv的成像方法200进行到框210。
[0076]
然而,在框208处,应用了标准波长数据过滤器。标准波长数据过滤器可以包括存储在uv成像系统100的存储器中(例如在存储器121或远程存储器154中)的一组程序指令。例如,在图3a和图3b的计算机程序列表中,伪python指令示出了标准波长数据过滤器(代码段6)的实施例,用于从图4a的原始单波长光范围和原始uv吸光度值范围中移除数据点,以确保用于训练如本文所述校准模型的最佳数据质量。在图3a的实例中,代码段6应用过滤标准,设置为用户定义的变量(代码段4),以允许对过滤范围的灵活操纵。例如,如代码段4所示,标准蛋白质样品(例如,标准蛋白质样品140s)的过滤标准被配置成选择对于280至315nm的波长范围具有0.1至1.5的uv吸光度的数据点。
[0077]
在框208处,处理器(例如,处理器124或远程处理器154)针对一系列单波长光束实施标准波长数据过滤器,以选择或限制第一波长范围。另外,处理器可以实施标准波长数据过滤器,以基于uv吸光度值的第一过滤器范围内的uv吸光度值来选择或限制每个第一系列
的第一吸光度与波长值对。例如,标准波长数据过滤器的应用(例如,在框208处)产生图4b的图450,其表示图4a的图400的绘制的吸光度与波长值对的有限的或过滤的数据范围组(为波长和吸光度值两者,即吸光度与波长值对)。
[0078]
具体地,图4b示出了根据本文披露的各种实施例,表示跨从uv光谱中选择的第一波长范围(例如,波长轴454)的各种系列的第一吸光度与波长值对的图450。如由图4b所示,示出了每个标准蛋白质样品(例如,标准蛋白质样品140s)400a至400m的吸光度与波长值对,然而如本文所述,一些吸光度与波长值对已经被标准波长数据过滤器过滤(例如,在框208处)。具体地,图4b示出了一个实施例,其中将标准波长数据过滤器应用于在图4a的单波长光束范围200至400(nm)内绘制的吸光度与波长值对。
[0079]
如由图4b所示,标准波长数据过滤器(例如,在框208处)已经应用于图4a的单波长光束范围200至400(nm),以选择图4b的第一波长范围280至315(nm)。波长范围280至315(nm)的第一波长范围在图4b的波长轴454上描绘。因此,图4b的波长范围280至315(nm)的第一波长范围已经从图4a的单波长光束范围200至400(nm)中选择。
[0080]
另外,在图4b的实施例中,应用了标准波长数据过滤器(例如,在框208处),以基于uv吸光度值的第一过滤器范围(例如,(例如,uv吸光度轴452)内的uv吸光度值来选择每个第一系列的第一吸光度与波长值对。uv吸光度值0.1至1.5的第一过滤范围在图4b的uv吸光度轴452上描绘。因此,图4b的uv吸光度值范围0.1至1.5的第一过滤器范围已经从图4a的uv吸光度值范围0至7中选择。因此,图4b总体上示出了校准标准品的过滤uv光谱,具体地,示出了在波长值280至315nm和吸光度值0.1至1.5的有限范围内的蛋白质校准标准品的过滤uv光谱。当与图4a进行比较时,过滤值(波长值280至315nm和吸光度值0.1至1.5)通常包括跨每个标准蛋白质样品(例如,400a和标准蛋白质样品400m)的那些吸光度与波长值对,它们没有相对于彼此折叠或者在彼此之上,如由图400所示。
[0081]
在图4a和图4b的实例中,标准蛋白质样品(例如,标准蛋白质样品140s)是0.1至126mg/mg范围内的蛋白质标准溶液,如图4b所示。这在代码段2处的图3a和图3b的示例计算机程序列表中进一步说明,其中标准蛋白质样品值被设置为对应范围。然而,本文考虑了更宽范围的此类标准蛋白质样品(例如,标准蛋白质样品140s)/蛋白质标准溶液,例如,其中该组标准蛋白质样品可以是每毫升(ml)0.1至220毫克(mg)范围内的蛋白质标准溶液。
[0082]
关于图2a,在框210处,基于uv的成像方法200包括用处理器(例如,处理器124或远程处理器154)生成多波长校准模型。多波长校准模型基于每个标准蛋白质样品的该组标准波长数据及其各种吸光度值对。在某些实施例中,在过滤这种数据的情况下(例如,在框208处),多波长校准模型基于该组标准波长数据的第一系列第一吸光度与波长值对中的每一个。
[0083]
图5a示出了根据本文披露的各种实施例,表示由单波长校准模型(即,“校准曲线”)组成的多波长校准模型501的图500。在图5a的实施例中,多波长校准模型501由跨图4b的uv光谱的单波长校准模型组成。这包括280nm至315nm的每个波长的模型。例如,图500鉴定单波长校准模型501s280(其是波长280nm的单波长模型)、501s294(其是波长294nm的单波长模型)和501s300(其是波长300nm的单波长模型)。生成每个单波长校准模型,以针对特定波长(例如,280nm、294nm和300nm)预测给定uv吸光度值(跨uv吸光度轴502的uv吸光度值的范围)的蛋白质浓度值(跨蛋白质浓度轴504的蛋白质浓度值的范围)。图5a的uv吸光度轴
502对应于图4b的uv吸光度轴。因此,对于uv光谱的给定波长,可以通过将uv吸光度值输入对应单波长校准模型或uv光谱波长的校准曲线来进行蛋白质浓度预测。如本文所述,这些预测可以用于确定未知蛋白质样品(例如,未知蛋白质样品140u)的未知蛋白质浓度。
[0084]
在图5a的实施例中,使用线性回归算法来确定每个单波长校准模型(例如,501s280、501s294和501s300)。每个这样的模型包括y截距值和斜率值,将其用于预测蛋白质浓度。y截距值和斜率值通常被确定为恒定值,其中斜率值被应用于所提供的uv吸光度值,其结果被添加到y截距值,以产生对应的蛋白质浓度预测或值。图5a的图500示出了当不同的uv吸光度值被提供给各个单波长校准模型(例如,501s280、501s294和501s300)中的每一个时,每个单波长校准模型的蛋白质浓度的各种预测或值(跨蛋白质浓度轴504)。这样,整个单波长校准模型包括多波长校准模型,该多波长校准模型可以接受每个波长的吸光度值和如针对图4a和图4b确定并描述的uv吸光度值。
[0085]
图5b示出了根据本文披露的各种实施例,表示图5a的各种单波长校准模型(例如,单波长校准模型501s280、501s294和501s300)的斜率560s和y截距560y的图550。图5b示出了跨波长轴554的280nm和315nm之间的每个波长处的成对斜率值560s和y截距值560y的图。图5b包括与图5a相同的uv吸光度值范围(例如,uv吸光度轴552)和相同的波长值范围(例如,波长轴554)。成对的斜率560s和y截距值560y对应于图5a的单波长校准模型(例如,单波长校准模型501s280、501s294和501s300)。例如,如由图5b所示,斜率值562a对应于与单波长校准模型501s280对应的280nm波长的y截距值562b。同样,如由图5b所示,斜率值564a对应于与单波长校准模型501s290对应的290nm波长的y截距值564b。y轴(uv吸光度轴552)显示给定斜率值或y截距值有助于单波长校准模型的任何给定预测的uv吸光度量。
[0086]
因此,至少相对于图5b的实施例,图5a的多波长校准模型501可以被生成并且包括一系列单波长校准模型,用于从该系列单波长光束(例如,如图4a所描述的波长200nm至400nm)中选择的第一波长范围(例如,如图4b所描述的波长280nm至315nm)中的每一个,其中每个单波长校准模型(例如,501s280、501s294和501s300)包括对应于特定单波长(例如,波长分别为280nm、294nm和300nm)的uv吸光度的斜率值560s和y截距值560y。通过输入波长值和uv吸光度值,实施多波长校准模型501的处理器(例如,处理器124和/或远程处理器154)可以选择对应的单波长校准模型来正确和准确地预测蛋白质浓度值。
[0087]
图3a和图3b的示例计算机程序列表示出了第一波长范围(例如,如图4b所描述的波长280nm至315nm)中的每一个的单波长校准模型的生成。例如,在代码段8处,在标准波长数据被过滤之后,由处理器(例如,处理器124或远程处理器154)对每个标准蛋白质样品的数据执行线性回归算法(linearregression.fit),这导致在特定波长下为单波长校准模型生成系数值(即,斜率值)和截距值(即,y截距值)。因此,可以以这种方式生成每个单波长校准模型(例如,501s280、501s294和501s300)。单波长校准模型可以存储在存储器(例如,存储器121或远程存储器159)中,并且可以作为如本文所述的综合多波长校准模型一起被访问(例如,经由包装器api或作为数据结构经由数据库)。在图3a和图3b的实施例中,每个单波长校准模型包括某个阈值的质量或拟合评分。例如,在代码段3中,仅最小质量或拟合值为0.99的单波长校准模型可以包括在多波长校准模型中。这样,多波长校准模型501保持并使用一组具有精确预测能力的高质量预测模型。
[0088]
在图5a和图5b的上述实施例中,经由线性回归生成单波长校准,并且将其编译成
生成的多波长校准模型501。然而,也可以使用其他预测技术(technologies)或技术(techniques)。例如,机器学习模型,可以使用有监督或无监督的机器学习程序或算法来训练。机器学习程序或算法可以采用神经网络,其可以是卷积神经网络、深度学习神经网络,或者在特定感兴趣区域中的两个或更多个特征或特征数据集中学习的组合学习模块或程序。机器学习程序或算法还可以包括自然语言处理、语义分析、自动推理、回归分析、支持向量机(svm)分析、决策树分析、随机森林分析、k-最近邻分析、朴素贝叶斯分析、聚类、强化学习和/或其他机器学习算法和/或技术。机器学习可以包括鉴定并识别现有数据中的模式(如标准蛋白质样品(例如标准蛋白质样品140s)在uv光谱上的uv吸光度值),以便于对后续数据进行预测(如本文所述,预测未知蛋白质样品(例如未知蛋白质样品140u)的未知浓度)。
[0089]
可以基于示例(例如,“训练数据”)输入或数据(其可以被称为“特征”和“标签”)来创建并训练一种或多种机器学习模型,如上文描述的那些机器学习模型,以便对新的输入,如测试水平或生产水平数据或输入做出有效和可靠的预测。在有监督的机器学习中,在服务器、计算装置或其他一个或多个处理器上操作的机器学习程序可以设置有示例输入(例如,“特征”)及其相关联的或观察到的输出(例如,“标签”),以便机器学习程序或算法确定或发现规则、关系或其他机器学习“模型”,其将此类输入(例如,“特征”)映射到输出(例如,标签),例如,通过跨其各种特征类别向模型确定和/或分配权重或其他度量。然后此类规则、关系或其他模型可以被提供在服务器、计算装置或其他一个或多个处理器上执行的模型的后续输入,以基于所发现的规则、关系或模型来预测预期的输出。
[0090]
在无监督的机器学习中,服务器、计算装置或其他一个或多个处理器可能需要在未标记的示例输入中找到其自身的结构,其中,例如由该服务器、计算装置或其他一个或多个处理器执行多个训练迭代,以训练多代模型,直到生成令人满意的模型,例如,当给定测试水平或生产水平数据或输入时提供足够预测准确度的模型。本文的披露内容可以使用此类有监督或无监督的机器学习技术中的一种或两种。
[0091]
因此,多波长校准模型的单波长校准模型或多波长校准模型本身可以用标准蛋白质样品(例如,标准蛋白质样品140s)的波长数据来训练,其中(例如,如本文所述的各种吸光度与波长值对的)波长值和uv吸光度值被输入作为特征数据,并且其中标准蛋白质样品(例如,标准蛋白质样品140s)的蛋白质浓度值可以被用作标记数据。然后,多波长校准模型的经训练的单波长校准模型,或多波长校准模型可以用于预测如本文所述具有未知浓度的样品的蛋白质浓度。
[0092]
关于图2a,基于uv的成像方法200包括处理器(例如,处理器124或远程处理器154),其接收(在框212处)如由检测器(例如,检测器114)为一组未知蛋白质样品(例如,未知蛋白质样品140u)中的每个未知蛋白质样品记录的一组未知波长数据(例如,波长数据118)。
[0093]
在一些实施例中,该组未知波长数据(例如,波长数据118)可以作为逗号分隔值(csv)数据被接收。在其他实施例中,该组标准波长数据可以以如本文所述的数据库格式、可扩展标记语言(xml)、javascript object notation(json)或其他数据或文本格式来接收。在图3a和图3b的实施例计算机程序列表中,例如,在代码段8和10处,未知蛋白质样品(例如,未知蛋白质样品140u)的波长数据由处理器(例如,处理器124或远程处理器154)作
为csv数据读入存储器(例如,存储器121或远程存储器159),其中用户将数据作为含有未知蛋白质样品(例如,未知蛋白质样品140u)的波长数据的文件输入。
[0094]
对于每个未知蛋白质样品,该组未知波长数据(例如,波长数据118)可以包括跨从该系列单波长光束中选择的第二波长范围的第二系列第二吸光度与波长值对。每个第二吸光度与波长值对可以包括uv吸光度值和波长值。如本文所述,可以以与针对图4a的标准蛋白质样品(例如,标准蛋白质样品140s)所述相同的方式捕获和/或测量该组未知波长数据。
[0095]
如图2a和图2b所示,基于uv的成像方法200继续(214),其中,在框216处,处理器(例如,处理器124或远程处理器154)确定是否过滤该组未知波长数据。可以基于(例如,通过检测器114)检测到的波长数据的范围来进行确定,其中一些数据集包括宽的波长范围。如果没有应用过滤器,则基于uv的成像方法200进行到框220。
[0096]
然而,在框218处,应用了未知波长数据过滤器。未知波长数据过滤器可以包括存储在uv成像系统100的存储器中(例如在存储器121或远程存储器154中)的一组程序指令。例如,在图3a和图3b的计算机程序列表中,伪python指令示出了未知波长数据过滤器(代码段7)的实施例,用于从如由检测器114测量的原始单波长光范围和原始uv吸光度值范围中移除数据点,以确保用于训练如本文所述校准模型的最佳数据质量。在图3a的实例中,代码段7应用过滤标准设置,作为用户定义的变量(代码段4),以允许对过滤范围的灵活操纵。例如,如代码段4所示,未知蛋白质样品(例如,未知蛋白质样品140u)的过滤标准被配置成选择对于280至315nm的波长范围具有0.2至1.2的uv吸光度值的数据点。
[0097]
在框218处,处理器(例如,处理器124或远程处理器154)针对一系列单波长光束实施未知波长数据过滤器,以选择或限制第二波长范围。另外,处理器可以实施未知波长数据过滤器,以基于uv吸光度值的第二过滤器范围内的uv吸光度值来选择或限制每个第二系列的第二吸光度与波长值对。例如,未知波长数据过滤器的应用(例如,在框218处)产生图6的图600,其表示在框212处检测和/或接收的未知蛋白质样品数据的有限或过滤的数据范围组(为波长和吸光度值两者,即吸光度与波长值对)。
[0098]
具体地,图6示出了根据本文披露的各种实施例,表示跨从uv光谱中选择的第二波长范围(例如,波长轴604)的各种系列的第二吸光度与波长值对的图600。图6类似于图4b,但是示出了未知蛋白质样品(例如,未知蛋白质样品140u)的过滤数据。如由图6所示,13个单独的未知蛋白质样品(例如,未知蛋白质样品140u)的吸光度与波长值对由未知蛋白质样品600a至600m(包括600a、600c、600f和600m中的每一个)的图表示。在图6的实施例中,如本文所述,一些吸光度与波长值对已经被未知波长数据过滤器过滤(例如,在框218处),并且未在图600中示出。具体地,图6示出了一个实施例,其中将未知波长数据过滤器应用于在用于检测未知波长数据(例如,波长数据118)的uv光谱上绘制的吸光度与波长值对。
[0099]
如由图6所示,应用了未知波长数据过滤器(例如,在框218处),以选择图6的第二波长范围280nm至315nm。波长范围280nm至315nm的第二波长范围在图6的波长轴604上描绘。在各种实施例中,图6的波长范围280至315(nm)的第二波长范围可以从图4a的单波长光束范围200nm至400nm中选择。
[0100]
另外,在图6的实施例中,应用了未知波长数据过滤器(例如,在框218处),以基于uv吸光度值的第二过滤器范围(例如,uv吸光度轴602)内的uv吸光度值来选择每个第二系列的第二吸光度与波长值对。uv吸光度值0.2至1.2的第二过滤范围在图6的uv吸光度轴602
上描绘。因此,图6的uv吸光度值范围0.2至1.2的第二过滤器范围已经从图4a的uv吸光度值范围0至7中选择。因此,图6示出了未知蛋白质样品(例如,未知蛋白质样品140u)的过滤uv光谱,具体地,示出了未知蛋白质样品(例如,未知蛋白质样品140u)在波长值280至315nm和吸光度值0.2至1.2的有限范围内的过滤uv光谱。
[0101]
在图6的实例中,未知蛋白质样品(例如,未知蛋白质样品140u)是0.1至126mg/mg范围内的蛋白质溶液。至少对于图6的实施例,未知蛋白质样品(例如,未知蛋白质样品140u)的蛋白质溶液使用与以上针对图4a和图4b所述相同的蛋白质溶液范围。
[0102]
关于图2b,在基于uv的成像方法200的框220处,处理器(例如,处理器124或远程处理器154)用多波长校准模型,为该组未知蛋白质样品(例如,未知蛋白质样品140u)中的每个未知蛋白质样品确定多个蛋白质浓度值。该多个蛋白质浓度值中的每个蛋白质浓度值可以对应于从该系列单波长光束(例如,图4a的范围200nm至400nm)中选择的第二波长范围(例如,图6的范围280nm至315nm)。
[0103]
在一些实施例中,该组未知蛋白质样品(例如,未知蛋白质样品140u)中的至少一个未知蛋白质样品可以包括蛋白治疗剂。在此类实施例中,蛋白治疗剂可以是抗体、抗原结合抗体片段、抗体蛋白产物、双特异性t细胞接合物分子、双特异性抗体、三特异性抗体、fc融合蛋白、重组蛋白,以及重组蛋白的活性片段中的任一种。
[0104]
在图3a和图3b的示例计算机程序列表中,处理器(例如,处理器124或远程处理器154)用多波长校准模型,为该组未知蛋白质样品(例如,未知蛋白质样品140u)中的每个未知蛋白质样品确定多个蛋白质浓度值。具体地,在代码段10中,调用了“calc_unk”代码函数。calc_unk代码函数(代码段9)读入该组未知蛋白质样品(例如,未知蛋白质样品140u)中每个未知蛋白质样品的波长数据(例如,波长数据118)作为csv数据。然后,“calc_unk”代码函数(代码段9)用多波长校准模型(即,以变量“df”存储在存储器中)确定多个蛋白质浓度值,这些值以“conc”变量存储。在图3a和图3b的实施例中,“calc_unk”代码函数(代码段9)被配置成通过对值(例如,每个单独预测浓度的“conc”变量的各种值)求和并产生第二波长范围(例如,图6的280nm至315nm范围)的所有蛋白质浓度预测的平均预测值,来生成增强预测。
[0105]
图7示出了根据本文披露的各种实施例,描绘用图5a的多波长校准模型501确定的蛋白质浓度值的图700。在图7的实施例中,图700表示多波长校准模型501应用于如针对未知蛋白质样品(例如,未知蛋白质样品140u)过滤的第二波长范围(例如,图6的范围280至315(nm))。图700中描绘了每个适用波长的蛋白质浓度值。
[0106]
如由图7所示,未知蛋白质样品(例如,未知蛋白质样品140u)被表示为未知蛋白质样品700a至700m,并且被绘制为沿着蛋白质浓度轴702(y轴)的蛋白质浓度值和沿着波长轴704(x轴)的波长值。波长轴704(x轴)包括与图6的波长轴604相同的波长值(即,280nm至315nm的范围)。如本文所述,未知蛋白质样品700a、700c、700f和700m中的每一个对应于图6的未知蛋白质样品600a、600c、600f和600m。
[0107]
图7包括缩放部分710,其以放大比例描绘了几个未知蛋白质样品,包括700a和700c。也就是说,缩放部分710等同于图700,只是比例不同。具体地,缩放部分710在0至5mg/ml的放大范围内显示蛋白质浓度值,其中几个未知蛋白质样品(包括700a、700c和700f)具有在该范围内的蛋白质浓度值。由缩放部分710描绘的未知蛋白质样品700a至700f中的每
一个对应于由图700描绘的未知蛋白质样品700a至700f。
[0108]
给定未知蛋白质样品(例如,700a至700m)的每个点提供给定样品在给定波长下的蛋白质浓度值的预测。例如,如由缩放部分710所示,未知蛋白质样品700c包括两个点700c1和700c2。缩放部分710表示对于点700c1,多波长校准模型501预测未知蛋白质样品700c在大约290nm的波长值下具有大约0.5的蛋白质浓度值预测。同样,缩放部分710表示对于点700c2,多波长校准模型501预测未知蛋白质样品700c在大约298nm的波长值下具有大约0.5的蛋白质浓度值预测。
[0109]
作为进一步的实例,如由缩放部分710所示,未知蛋白质样品700f包括两个点700f1和700f2。缩放部分710表示对于点700f1,多波长校准模型501预测未知蛋白质样品700f在大约300nm的波长值下具有大约4.0的蛋白质浓度值预测。同样,缩放部分710表示对于点700f2,多波长校准模型501预测未知蛋白质样品700f在大约303nm的波长值下具有大约3.8的蛋白质浓度值预测。
[0110]
作为另一个实例,如由图700所示,未知蛋白质样品700m包括两个点700m1和700m2。图400表示对于点700m1,多波长校准模型501预测未知蛋白质样品700m在大约312nm的波长值下具有大约122的蛋白质浓度值预测。同样,图700表示对于点700m2,多波长校准模型501预测未知蛋白质样品700m在大约313nm的波长值下具有大约121的蛋白质浓度值预测。
[0111]
这样,如由图7所示,多波长校准模型(例如,多波长校准模型501)可以输入一系列吸光度与波长值对(例如,如针对图6所描述的第二系列第二吸光度与波长值对)来预测每个多个蛋白质浓度值。在一些实施例中,仅需要提供每个吸光度与波长值对的波长值或吸光度值作为多波长校准模型501的输入,以生成预测。因此,可以输入特定波长(对应于单波长模型)的一个或多个波长值和/或一个或多个吸光度值,以针对该特定吸光度值和/或该特定波长预测蛋白质浓度值。
[0112]
关于图2b,在基于uv的成像方法200的框222处,处理器(例如,处理器124或远程处理器154)基于由多波长校准模型501确定的多个蛋白质浓度值来确定是否生成增强预测。如果不进行增强预测,则基于uv的成像方法200进行到框226。
[0113]
在基于uv的成像方法200的框224处,处理器(例如,处理器124或远程处理器154)已经确定生成增强预测。这种确定可以例如通过设置阈值预测质量值(例如在由处理器执行的程序指令中)来进行,从而要求预测具有足够的质量或适合度。这例如由图3a的代码段3证明。这也在图3b的代码段9中得到证明,其中每个蛋白质浓度值被自动平均,从而在一定波长值范围(例如,如针对图6和图7所描述的第二波长范围)内以增强的精度创建增强预测。在其他实施例中,可以在程序指令或代码中设置或向其提供标志,以指示将生成增强预测。因此,在各种实施例中,增强预测的生成可以包括对对应于第二波长范围的该多个蛋白质浓度值中的每个蛋白质浓度值进行平均(或以其他方式操纵)。增强预测可以包括由多波长校准模型(例如,多波长校准模型501)确定的蛋白质浓度值的平均值、中值、导数或其他操纵。
[0114]
如由图7所示,增强预测利用了每个样品(例如,未知蛋白质样品700a至700m)的波长范围和预测浓度值的重叠,并提供了重叠的浓度测量,这与单独的单个预测点(例如,点700c1或700c2)相比导致了增强的精度。在各种实施例中,多波长校准模型(例如,多波长校
准模型501)可以用增强预测来更新,或者被配置成计算和/或输出(如图3b的代码段9所示)该增强预测。
[0115]
关于图2b,在基于uv的成像方法200的框226处,处理器(例如,处理器124或远程处理器154)使用在框220处生成的或由增强预测进一步更新或配置(例如,在框224处操纵的)的多波长校准模型来监测或测量蛋白质相关产品的蛋白质浓度。在各种实施例中,蛋白质相关产品是治疗产品。
[0116]
图8示出了根据本文披露的各种实施例,描绘应用图5a的多波长校准模型501来监测或测量蛋白质相关产品860的蛋白质浓度的流程图800。如由图800所示,一批未知蛋白质样品840u由uv成像装置(例如,如本文所述的uv成像装置101)扫描,以产生每个未知蛋白质样品840u的波长数据818u。未知蛋白质样品840u可以是未知蛋白质样品140u或者可以是一组新的样品。波长数据818u是与如本文针对图1、2a、2b等关于波长数据118描述的相同的数据或相同类型的数据。波长数据818u可以被输入到多波长校准模型501中,该多波长校准模型可以是先前从标准蛋白质样品数据生成的,如本文参考图2b、2b、3a、3b、4和5a等所描述。
[0117]
在图8的实施例中,多波长校准模型501被加载到过程控制装置850的存储器(未示出)中。过程控制装置850包括处理器(未示出),用于实施多波长校准模型501以监测或测量蛋白质相关产品860的蛋白质浓度。在一些实施例中,过程控制装置850经由计算机网络130从uv成像装置101和/或计算装置151接收多波长校准模型501,如通过经由传输控制协议和互联网协议(tcp/ip)或经由其他此类相似协议的数据包传输。
[0118]
过程控制装置850可以通过输出预测852(增强预测或基于如本文所述的每个标准蛋白质样品的一个或多个计算的蛋白质浓度值的预测)来应用多波长校准模型501。然后,预测852可以用于监测或测量蛋白质相关产品860的蛋白质浓度。例如,在一些实施例中,预测852或基于预测852产生的信号或数据传输可以被传输或以其他方式提供给过程控制或制造系统的子装置(未示出),如经由过程控制网络通信地耦合到过程控制装置850的现场装置,用于监测或测量蛋白质相关产品860的蛋白质浓度。因此,预测852可以从过程控制装置850输出,并且用于监测、测试、测量或开发最终用途产品中的蛋白质浓度。例如,在一个实施例中,预测852可以用于在蛋白质相关产品865的制造过程中监测或测量蛋白质相关产品865的蛋白质浓度860。蛋白质相关产品865可以是经由使用过程控制装置850的过程控制场所中的装配或自动化系统开发的产品。举例来说,基于所测量的蛋白质浓度,蛋白质相关产品的蛋白质浓度可以增加或减少到落入蛋白质浓度的特定范围内。举例来说,一批蛋白质相关产品可以被接受或拒绝,这取决于所测量的蛋白质浓度是落入(分别)特定范围之内还是之外。由于如在过程控制装置850上实施的多波长校准模型501的鲁棒性,可以在宽范围的uv光谱(包括如本文所述的uv光谱范围)中测量或监测蛋白质相关产品865的蛋白质浓度。
[0119]
在进一步的实例中,如由过程控制装置850提供的多波长校准模型501的预测852可以用于针对蛋白质相关产品的已知规格来监测或测量蛋白质相关产品865的蛋白质浓度860,或者与蛋白质相关产品的已知规格进行比较。已知的规格可以例如由标准蛋白质样品140s来定义。在此类实施例中,过程控制装置850可以将预测852应用于蛋白质相关产品865,以比较已知的规格并测量与监管要求、功效或质量阈值或者其他监管或质量问题的符合性。
[0120]
因此,如本文所提供的,本披露内容的基于uv的成像系统和方法改进了当前已知仪器和方法的局限性。本文描述的基于uv的成像系统和方法通过生成和应用用一组蛋白质样品标准品校准的独特的多波长校准模型501,克服了比尔-朗伯定律的线性限制。另外,不同于其他仪器,如通过机械方式扫描扩展的线性蛋白质浓度范围的机械路径长度仪器,本披露内容的基于uv的成像系统和方法生成并使用避免机械误差问题的多波长校准模型(例如,多波长校准模型501)。
[0121]
治疗蛋白有多种形式和格式;该方法与治疗蛋白的类型无关。在抗体作为治疗蛋白的情况下,例如,抗体架构已经被用于产生越来越多的替代形式,其跨越至少约12-150kda的分子量范围,并且具有从单体(n=1)、至二聚体(n=2)、至三聚体(n=3)、至四聚体(n=4)并且可能更高的效价(n)范围;此类替代形式在本文中称为“抗体蛋白质产物”。抗体蛋白产物包括基于完整抗体结构的那些和模拟保留完整抗原结合能力的抗体片段的那些,例如scfv、fab和vhh/vh(以下讨论的)。保留其完整抗原结合位点的最小抗原结合抗体片段为fv片段,其完全由可变(v)区组成。使用可溶性柔性氨基酸肽接头将v区连接至scfv片段(可变单链片段)以使该分子稳定,或将恒定(c)结构域添加至v区以产生fab片段[抗原结合片段]。scfv和fab片段可以容易地在宿主细胞(例如原核宿主细胞)中产生。其他抗体蛋白产物包括经二硫键稳定的scfv(ds-scfv)、单链fab(scfab)以及二聚及多聚抗体形式,如双功能抗体、三功能抗体和四功能抗体,或包含由与寡聚结构域连接的scfv组成的不同形式的迷你抗体(miniab)。最小的片段是骆驼科重链ab的vhh/vh以及单结构域ab(sdab)。最常用于建造新颖抗体形式的构件为单链可变(v)结构域抗体片段(scfv),其包含由具有约15个氨基酸残基的肽接头连接的来自重链和轻链的v结构域(vh结构域和vl结构域)。肽体(peptibody)或肽-fc融合物是另一种抗体蛋白产物。肽体的结构由接枝到fc结构域上的生物活性肽组成。本领域已充分描述了肽体。参见,例如,shimamoto等人.,mabs 4(5):586-591(2012)。
[0122]
其他抗体蛋白产物包括单链抗体(sca)、双功能抗体、三抗体;四抗体;双特异性或三特异性抗体等。双特异性抗体可分成五个主要类别:bsigg、附加igg、bsab片段、双特异性融合蛋白以及bsab缀合物。参见,例如,spiess等人,molecular immunology[分子免疫学]67(2)部分a:97/-106(2015)。
[0123]
在示例性方面中,治疗蛋白包含这些抗体蛋白质产物中的任一种。在示例性方面中,治疗蛋白包含以下中的任一种:scfv、fab vhh/vh、fv片段、ds-scfv、scfab、二聚体抗体、多聚体抗体(例如,双抗体、三抗体、四抗体)、miniab、肽体、骆驼重链抗体的vhh/vh、sdab、双抗体;三抗体;四抗体;双特异性或三特异性抗体、bsigg、附加igg、bsab片段、双特异性融合蛋白和bsab结合物中的任一个。
[0124]
在示例性方面,治疗蛋白是双特异性t细胞接合物分子。分子是包含连接在一起的两个抗体结合结构域(或靶向区)的双特异性抗体构建体或双特异性融合蛋白质。分子由两个单链可变片段(scfv)通过柔性接头串联构成(scfc-scfc,huehls等人,2015)。该分子的一个臂被工程化为与细胞毒性t细胞表面发现的蛋白质结合,另一臂被设计为与主要发现于肿瘤细胞上的特异性蛋白质结合。当这两个靶标都被接合时,分子在细胞毒性t细胞和肿瘤细胞之间形成桥,这使t细胞能够识别肿瘤细胞并通过注入有毒分子来对抗它。可以改变分子的肿瘤结合臂,以创建针对不同类型癌症的不
同抗体构建体。关于分子的术语“结合结构域”是指(特异性)结合至靶分子(抗原)的给定靶表位或给定靶位点/与该靶表位或靶位点相互作用/识别该靶表位或靶位点的结构域。第一结合结构域(识别肿瘤细胞抗原)的结构和功能以及优选地还有第二结合结构域(细胞毒性t细胞抗原)的结构和/或功能是基于抗体(例如,全长或完整免疫球蛋白分子)的结构和/或功能。例如,分子包含第一结合结构域,其特征在于存在三个轻链cdr(即,vl区的cdr1、cdr2和cdr3)和三个重链cdr(即,vh区的cdr1、cdr2和cdr3)。第二结合结构域优选还包含允许靶结合的抗体的最小结构要求。更优选地,第二结合结构域包含至少三个轻链cdr(即vl区的cdr1、cdr2和cdr3)和/或三个重链cdr(即vh区的cdr1、cdr2和cdr3)。设想第一结合结构域和/或第二结合结构域是通过噬菌体展示或文库筛选方法产生或可获得的,而不是通过将cdr序列从预先存在的(单克隆)抗体移植到支架中产生或可获得的。结合结构域可以典型地包含抗体轻链可变区(vl)和抗体重链可变区(vh);然而,它不一定两者都包含。例如,fd片段具有两个vh区并且通常保留完整抗原结合结构域的一些抗原结合功能。(经修饰的)结合抗原的抗体片段的实例包括(1)fab片段,一种具有vl、vh、cl和ch1结构域的单价片段;(2)f(ab')2片段,一种具有由二硫桥在铰链区连接的两个fab片段的双价片段;(3)具有两个vh和ch1结构域的fd片段;(4)具有抗体的单臂的vl和vh结构域的fv片段;(5)具有vh结构域的dab片段(ward等人,(1989)nature[自然]341:544-546);(6)经分离的互补决定区(cdr),和(7)单链fv(scfv),后者是优选的(例如,衍生自scfv文库)。
[0125]
在示例性方面,治疗蛋白是双特异性抗体、三特异性抗体、分子或fc融合蛋白。在一些方面,治疗蛋白包含结合至第一靶标的单链可变片段(scfv),任选地,其中治疗蛋白包含结合至第二靶标(任选地不同于第一靶标)的第二scfv。
[0126]
在一些方面,治疗蛋白是重组治疗蛋白或其活性片段。在其他方面,治疗蛋白对于细胞或生物体是内源性的,并且是从细胞或生物体分离的。
[0127]
本披露内容的各方面
[0128]
本披露内容的以下方面仅是示例性的并且不旨在限制本披露内容的范围。
[0129]
1.一种基于紫外线(uv)的成像系统,其被配置成基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度,该基于uv的成像系统包括:光源,其被配置成投射多波长光束;单色仪,其被配置成接收该多波长光束,并且基于该多波长光束投射uv光谱的一系列单波长光束;样品保持器,其可操作以用于接收蛋白质样品,该蛋白质样品是(1)选自一组标准蛋白质样品的标准蛋白质样品,或者(2)选自一组未知蛋白质样品的未知蛋白质样品,该未知蛋白质样品具有未知蛋白质浓度,其中该样品保持器被定位成允许该系列单波长光束穿过该蛋白质样品的至少一部分;检测器,其可操作以检测穿过该蛋白质样品的至少一部分的该系列单波长光束;存储程序指令的存储器;以及通信地耦合到该存储器的处理器,其中该处理器被配置成执行这些程序指令,以使该处理器:接收如由该检测器为该组标准蛋白质样品中的每个标准蛋白质样品记录的该组标准波长数据,其中对于每个标准蛋白质样品,该该组标准波长数据包括跨从该系列单波长光束中选择的第一波长范围的第一系列第一吸光度与波长值对,每个第一吸光度与波长值对包括uv吸光度值和波长值,基于该该组标准波长数据的第一系列第一吸光度与波长值对中的每一个生成多波长校准模型,接收如由该检测器为该组未知蛋白质样品中的每个未知蛋白质样品记录的一组未知波长数据,其中对于每个未知蛋白质样品,该组未知波长数据包括跨从该系列单波长光束中选择的第二
波长范围的第二系列第二吸光度与波长值对,每个第二吸光度与波长值对包括uv吸光度值和波长值,并且用该多波长校准模型,为该组未知蛋白质样品中的每个未知蛋白质样品确定多个蛋白质浓度值,该多个蛋白质浓度值中的每个蛋白质浓度值对应于从该系列单波长光束中选择的该第二波长范围。
[0130]
2.如方面1所述的基于uv的成像系统,其中该光源、该单色仪、该样品保持器和该检测器包括分光光度计装置的一部分。
[0131]
3.如前述方面中任一项所述的基于uv的成像系统,其中该处理器通信地耦合到该检测器。
[0132]
4.如前述方面中任一项所述的基于uv的成像系统,其中该存储器或该处理器远离该检测器。
[0133]
5.如前述方面中任一项所述的基于uv的成像系统,其中该组标准蛋白质样品包括多个标准蛋白质样品,并且其中该组未知蛋白质样品包括具有未知蛋白质浓度的单个蛋白质样品。
[0134]
6.如前述方面中任一项所述的基于uv的成像系统,其中该组标准蛋白质样品是每毫升(ml)0.1至220毫克(mg)范围内的蛋白质标准溶液。
[0135]
7.如前述方面中任一项所述的基于uv的成像系统,其中该系列单波长光束包括从200纳米(nm)至400纳米(nm)的uv光谱中的单波长光束。
[0136]
8.如方面7所述的基于uv的成像系统,其中该uv光谱中的每个单波长光束以一纳米的间隔分开。
[0137]
9.如前述方面中任一项所述的基于uv的成像系统,其中生成该多波长校准模型包括为从该系列单波长光束中选择的该第一波长范围中的每一个生成单波长校准模型,每个单波长校准模型包括对应于特定单波长的uv吸光度的斜率值和y截距值。
[0138]
10.如前述方面中任一项所述的基于uv的成像系统,其中该多波长校准模型被训练为机器学习模型。
[0139]
11.如前述方面中任一项所述的基于uv的成像系统,其进一步包括标准波长数据过滤器,该处理器进一步被配置成执行这些程序指令,以使该处理器针对该系列单波长光束实施该标准波长数据过滤器,从而选择该第一波长范围。
[0140]
12.如方面12所述的基于uv的成像系统,其中该处理器进一步被配置成执行这些程序指令,以使该处理器实施该标准波长数据过滤器,从而基于uv吸光度值的第一过滤器范围内的uv吸光度值来限制每个第一系列的第一吸光度与波长值对。
[0141]
13.如前述方面中任一项所述的基于uv的成像系统,其进一步包括未知波长数据过滤器,该处理器进一步被配置成执行这些程序指令,以使该处理器针对该系列单波长光束实施该未知波长数据过滤器,从而选择该第二波长范围。
[0142]
14.如方面13所述的基于uv的成像系统,其中该处理器被配置成执行这些程序指令,以使该处理器实施该未知波长数据过滤器,从而基于uv吸光度值的第二过滤器范围内的uv吸光度值来限制每个第二系列的第二吸光度与波长值对。
[0143]
15.如前述方面中任一项所述的基于uv的成像系统,其中该处理器进一步包括基于该多个蛋白质浓度值生成增强预测。
[0144]
16.如方面15所述的基于uv的成像系统,其中该增强预测的生成包括对对应于该
第二波长范围的该多个蛋白质浓度值中的每个蛋白质浓度值进行平均。
[0145]
17.如前述方面中任一项所述的基于uv的成像系统,其中该多波长校准模型用于监测或测量蛋白质相关产品的蛋白质浓度。
[0146]
18.如方面17所述的基于uv的成像系统,其中在该蛋白质相关产品的制造过程中,在该蛋白质相关产品的制造过程中监测或测量该蛋白质浓度。
[0147]
19.如方面17或18中任一项或多项所述的基于uv的成像系统,其中将该蛋白质相关产品的蛋白质浓度与该蛋白质相关产品的已知规格进行比较。
[0148]
20.如方面17至19中任一项或多项所述的基于uv的成像系统,其中该蛋白质相关产品是治疗产品。
[0149]
21.如方面17至20中任一项或多项所述的基于uv的成像系统,其中该多波长校准模型输入这些第二系列第二吸光度与波长值对,以预测每个多个蛋白质浓度值。
[0150]
22.一种基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度的基于紫外线(uv)的成像方法,该基于uv的成像方法包括:在处理器处接收如由检测器为一组标准蛋白质样品中的每个标准蛋白质样品记录的该组标准波长数据,其中对于每个标准蛋白质样品,该该组标准波长数据包括跨从uv光谱的一系列单波长光束中选择的第一波长范围的第一系列第一吸光度与波长值对,每个第一吸光度与波长值对包括uv吸光度值和波长值;用该处理器,基于该该组标准波长数据的这些第一系列第一吸光度与波长值对中的每一个生成多波长校准模型。在该处理器处接收如由该检测器为一组未知蛋白质样品中的每个未知蛋白质样品记录的一组未知波长数据,其中对于每个未知蛋白质样品,该组未知波长数据包括跨从该系列单波长光束中选择的第二波长范围的第二系列第二吸光度与波长值对,每个第二吸光度与波长值对包括uv吸光度值和波长值;以及用如在该处理器上实施的该多波长校准模型,为该组未知蛋白质样品中的每个未知蛋白质样品确定多个蛋白质浓度值,该多个蛋白质浓度值中的每个蛋白质浓度值对应于从该系列单波长光束中选择的该第二波长范围。
[0151]
23.如方面22所述的基于uv的成像方法,其中该检测器包括分光光度计装置的一部分。
[0152]
24.如方面22至23中任一项或多项所述的基于uv的成像方法,其中该处理器通信地耦合到该检测器。
[0153]
25.如方面22至24中任一项或多项所述的基于uv的成像方法,其中该处理器远离该检测器。
[0154]
26.如方面22至25中任一项或多项所述的基于uv的成像方法,其中该组标准蛋白质样品包括多个标准蛋白质样品,并且其中该组未知蛋白质样品包括具有未知蛋白质浓度的单个蛋白质样品。
[0155]
27.如方面22至26中任一项或多项所述的基于uv的成像方法,其中该组标准蛋白质样品是每毫升(ml)0.1至220毫克(mg)范围内的蛋白质标准溶液。
[0156]
28.如方面22至27中任一项或多项所述的基于uv的成像方法,其中该系列单波长光束包括从200纳米(nm)至400纳米(nm)的uv光谱中的单波长光束。
[0157]
29.如方面28所述的基于uv的成像方法,其中该uv光谱中的每个单波长光束以一纳米的间隔分开。
[0158]
30.如方面22至28中任一项或多项所述的基于uv的成像方法,其中生成该多波长校准模型包括为从该系列单波长光束中选择的该第一波长范围中的每一个生成单波长校准模型,每个单波长校准模型包括对应于特定单波长的uv吸光度的斜率值和y截距值。
[0159]
31.如方面22至30中任一项或多项所述的基于uv的成像方法,其中该多波长校准模型被训练为机器学习模型。
[0160]
32.如方面22至31中任一项或多项所述的基于uv的成像方法,其进一步包括标准波长数据过滤器,该处理器进一步被配置成执行这些程序指令,以使该处理器针对该系列单波长光束实施该标准波长数据过滤器,从而选择该第一波长范围。
[0161]
33.如方面32所述的基于uv的成像方法,其中该处理器进一步被配置成执行这些程序指令,以使该处理器实施该标准波长数据过滤器,从而基于uv吸光度值的第一过滤器范围内的uv吸光度值来限制每个第一系列的第一吸光度与波长值对。
[0162]
34.如方面22至33中任一项或多项所述的基于uv的成像方法,其进一步包括未知波长数据过滤器,该处理器进一步被配置成执行这些程序指令,以使该处理器针对该系列单波长光束实施该未知波长数据过滤器,从而选择该第二波长范围。
[0163]
35.如方面34所述的基于uv的成像方法,其中该处理器被配置成执行这些程序指令,以使该处理器实施该未知波长数据过滤器,从而基于uv吸光度值的第二过滤器范围内的uv吸光度值来限制每个第二系列的第二吸光度与波长值对。
[0164]
36.如方面22至35中任一项或多项所述的基于uv的成像方法,其中该处理器进一步包括基于该多个蛋白质浓度值生成增强预测,
[0165]
37.如方面36所述的基于uv的成像方法,其中该增强预测的生成包括对对应于该第二波长范围的该多个蛋白质浓度值中的每个蛋白质浓度值进行平均。
[0166]
38.如方面22至37中任一项或多项所述的基于uv的成像方法,其中该多波长校准模型用于监测或测量蛋白质相关产品的蛋白质浓度。
[0167]
39.如方面38所述的基于uv的成像方法,其中在该蛋白质相关产品的制造过程中监测或测量该蛋白质浓度。
[0168]
40.如方面38或39所述的基于uv的成像方法,其中将该蛋白质相关产品的蛋白质浓度与该蛋白质相关产品的已知规格进行比较。
[0169]
41.如方面38至40中任一项或多项所述的基于uv的成像系统,其中该蛋白质相关产品是治疗产品。
[0170]
42.如方面22至41中任一项或多项所述的基于uv的成像方法,其中该多波长校准模型输入这些第二系列第二吸光度与波长值对,以预测每个多个蛋白质浓度值。
[0171]
43.一种有形的、非暂时性的计算机可读介质,其存储用于基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度的指令,这些指令当由计算装置的一个或多个处理器执行时使得该计算装置进行以下操作,该计算装置包括一个或多个存储器:在处理器处接收如由检测器为一组标准蛋白质样品中的每个标准蛋白质样品记录的该组标准波长数据,其中对于每个标准蛋白质样品,该该组标准波长数据包括跨从uv光谱的一系列单波长光束中选择的第一波长范围的第一系列第一吸光度与波长值对,每个第一吸光度与波长值对包括uv吸光度值和波长值;用该处理器,基于该该组标准波长数据的这些第一系列第一吸光度与波长值对中的每一个生成多波长校准模型;在该处理器处接收如由该检测器为一组未知
蛋白质样品中的每个未知蛋白质样品记录的一组未知波长数据,其中对于每个未知蛋白质样品,该组未知波长数据包括跨从该系列单波长光束中选择的第二波长范围的第二系列第二吸光度与波长值对,每个第二吸光度与波长值对包括uv吸光度值和波长值;以及用如在该处理器上实施的该多波长校准模型,为该组未知蛋白质样品中的每个未知蛋白质样品确定多个蛋白质浓度值,该多个蛋白质浓度值中的每个蛋白质浓度值对应于从该系列单波长光束中选择的该第二波长范围。
[0172]
44.一种用于基于自动多波长校准来确定未知蛋白质样品的蛋白质浓度的成像设备,该成像设备包括:用于接收一组标准蛋白质样品中每个标准蛋白质样品的该组标准波长数据的装置,其中对于每个标准蛋白质样品,该该组标准波长数据包括跨从uv光谱的一系列单波长光束中选择的第一波长范围的第一系列第一吸光度与波长值对,每个第一吸光度与波长值对包括uv吸光度值和波长值;用于基于该该组标准波长数据的第一系列第一吸光度与波长值对中的每一个生成多波长校准模型的装置;用于接收一组未知蛋白质样品中每个未知蛋白质样品的一组未知波长数据的装置,其中对于每个未知蛋白质样品,该组未知波长数据包括跨从该系列单波长光束中选择的第二波长范围的第二系列第二吸光度与波长值对,每个第二吸光度与波长值对包括uv吸光度值和波长值;以及用于用该多波长校准模型,为该组未知蛋白质样品中的每个未知蛋白质样品确定多个蛋白质浓度值的装置,该多个蛋白质浓度值中的每个蛋白质浓度值对应于从该系列单波长光束中选择的该第二波长范围。
[0173]
45.如方面22至41中任一项或多项所述的基于uv的成像方法,其中该组未知蛋白质样品中的至少一个未知蛋白质样品包含蛋白治疗剂。
[0174]
46.如方面45所述的基于uv的成像方法,其中该蛋白治疗剂选自由以下组成的组:抗体、抗原结合抗体片段、抗体蛋白产物、双特异性t细胞接合物分子、双特异性抗体、三特异性抗体、fc融合蛋白、重组蛋白,以及重组蛋白的活性片段。
[0175]
附加考虑
[0176]
尽管本文的披露内容阐述了对许多不同实施例的详细说明,但应理解的是,本说明书的合法范围由在本专利的结尾处所阐述的权利要求的文字及其等效物限定。该详细说明仅被解释为是示例性的并且未描述每个可能的实施例,因为描述每个可能的实施例将是不切实际的。可以使用当前技术或在本专利提交日之后开发的技术来实施许多替代实施例,其仍然落入本权利要求的范围内。
[0177]
以下附加考虑适用于前述讨论。贯穿整个说明书,多个实例可以实施被描述为单个实例的部件、操作或结构。尽管一种或多种方法的各个操作被示出和描述为单独的操作,但是可以同时执行各个操作中的一个或多个,并且不需要以所展示的顺序执行操作。在示例配置中作为单独部件呈现的结构和功能可以实施为组合结构或部件。类似地,作为单个部件呈现的结构和功能可以实施为单独的部件。这些和其他变化、修改、添加和改进都落入本文主题的范围内。
[0178]
另外,本文将某些实施例描述为包括逻辑或许多例程、子例程、应用或指令。这些可以构成软件(例如,在机器可读介质上或在传输信号中具体化的代码)或者硬件。在硬件中,例程等是能够执行某些操作的有形单元并且可以以某种方式进行配置或安排。在示例实施例中,可以通过软件(例如,应用或应用部分)将一个或多个计算机系统(例如,独立的
客户端或服务器计算机系统)或计算机系统的一个或多个硬件模块(例如,处理器或一组处理器)配置为操作以执行如本文所描述的某些操作的硬件模块。
[0179]
在各个实施例中,可以以机械方式或电子方式来实施硬件模块。例如,硬件模块可以包括被永久地配置(例如,作为专用处理器,如现场可编程门阵列(fpga),或作为专用集成电路(asic))以执行特定的操作的专用电路系统或逻辑。硬件模块还可以包括由软件临时配置为执行特定的操作的可编程逻辑或电路系统(例如,如包含在通用处理器或其他可编程处理器内)。将理解的是,可以因成本和时间考虑来驱动在专用且永久配置的电路系统中还是在临时配置的电路系统(例如,由软件配置)中以机械方式实施硬件模块的决定。
[0180]
相应地,术语“硬件模块”应被理解为包括有形实体,是指以物理方式构造、永久地配置(例如,硬接线)或临时地配置(例如,编程)以便以特定方式操作或执行本文所描述的特定操作的实体。考虑其中硬件模块被临时配置(例如,编程)的实施例,每个硬件模块不需要在任何一个时刻被配置或实例化。例如,在硬件模块包括使用软件配置的通用处理器的情况下,通用处理器可以在不同时间被配置为各自不同的硬件模块。软件可以相应地配置处理器,例如,以在一个时刻构成特定的硬件模块,并在不同的时刻构成不同的硬件模块。
[0181]
硬件模块可以向其他硬件模块提供信息并从其他硬件模块接收信息。因此,所描述的硬件模块可以被认为是通信地耦合的。当多个这样的硬件模块同时存在时,可以通过连接硬件模块的信号传输(例如,通过适当的电路和总线)来实现通信。在其中在不同时间对多个硬件模块进行配置或实例化的实施例中,可以例如通过在多个硬件模块可以访问的存储器结构中存储和取得信息来实现这种硬件模块之间的通信。例如,一个硬件模块可以执行操作并将该操作的输出存储在该硬件模块通信地耦合到的存储装置中。然后,另一硬件模块可以在稍后的时间访问存储装置以取得并处理所存储的输出。硬件模块还可以发起与输入或输出装置的通信,并且可以在资源(例如,信息的集合)上进行操作。
[0182]
本文所描述的示例方法的各种操作可以至少部分地由被临时配置(例如,通过软件)或永久配置成执行相关操作的一个或多个处理器来执行。无论是临时配置还是永久配置,这种处理器可以构成操作以执行一种或多种操作或功能的处理器实施的模块。在一些示例实施例中,本文提及的模块可以包括处理器实施的模块。
[0183]
类似地,本文所描述的方法或例程可以至少部分地由处理器实施。例如,方法的至少一些操作可以由一个或多个处理器或由处理器实施的硬件模块来执行。对操作中的某些操作的执行可以分布在一个或多个处理器中,不仅驻留在单个机器内,还跨多个机器部署。在一些示例实施例中,一个或多个处理器可以位于单个位置中,而在其他实施例中,处理器可以跨多个位置分布。
[0184]
对操作中的某些操作的执行可以分布在一个或多个处理器中,不仅驻留在单个机器内,还跨多个机器部署。在一些示例实施例中,一个或多个处理器或处理器实施的模块可以位于单个地理位置中(例如,在家庭环境、办公室环境或服务器群内)。在其他实施例中,一个或多个处理器或处理器实施的模块可以跨多个地理位置分布。
[0185]
此详细描述仅被解释为是示例性的并且未描述每个可能的实施例,因为描述每个可能的实施例如果不是不可能也将是不切实际的。本领域普通技术人员可以使用当前技术或者在本技术的提交日之后开发的技术来实施许多替代实施例。
[0186]
本领域普通技术人员将了解到,在不脱离本发明的范围的情况下,关于上文描述
的实施例可以做出各种各样的修改、改变和组合,并且可以将这种修改、改变和组合视为在本发明构思的范围内。
[0187]
除非明确列举传统的装置加功能语言,如在(多项)权利要求中明确列举的“用于
……
的装置”或“用于
……
的步骤”的语言,否则本专利申请结尾处的专利权利要求不旨在根据35 u.s.c.
§
112(f)来解释。本文所描述的系统和方法涉及改进计算机功能,并改进常规计算机的运行。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。