新型药物制剂
1.本发明涉及包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的药物组合物和剂型,特别地,其中药物组合物和剂型可用于治疗患有癌症的受试者。本公开还提供了用于制备这些药物组合物和剂型的方法,以及利用本文所提供的药物组合物和剂型治疗患有癌症的受试者的方法。本发明总体上涉及用于目标人群(诸如小儿和老年患者)的对患者而言更容易的药物递送系统。具体地,本发明涉及一种呈微型片形式的药物组合物。特别地,本发明提供了尤其适用于吞咽困难的患者(特别是小儿和儿童人群的顺应剂型。
[0002]
化合物n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺及其制备已公开于美国专利号8,299,057中,其内容据此全文以引用方式并入本文。n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺为酪氨酸激酶、ntrk1/2/3-转化酪氨酸激酶蛋白(trka,trkb,trkc)、原癌基因酪氨酸蛋白激酶1(ros1)和间变性淋巴瘤激酶(alk)的有效抑制剂。在各项体外研究中,n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺抑制crc细胞系km12的增殖,该细胞系的增殖和存活依赖于trka激酶活性。该化合物还有效抑制了alk依赖性间变性大细胞淋巴瘤细胞系的细胞增殖。
[0003]
wo2019018570公开了一种包含恩曲替尼的药物组合物,该药物组合物呈胶囊的形式。
[0004]
在针对不包含至少一种酸化剂的制剂中的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的犬单剂量食物效应研究中,与空腹条件下观察到的结果相比,餐后条件下犬体内n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的暴露量高出约2倍。此类食物效应可能导致人体药物试验产生困难,因为患者的空腹或餐后状态可能导致药物的暴露量或生物利用度相差很大。
[0005]
在早期人体临床研究中,已表明n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺对患有各种形式的癌症(在alk、ros1、trka、trkb和trkc中的一者或多者中具有至少一种分子改变)的患者具有抗肿瘤作用。
[0006]
任何药物递送系统的目标都是将治疗量的药物递送至体内适当的部位,以达到并且维持所需的药物浓度。过去最方便并且最常用的药物递送途径为固体口服剂型,特别是片剂和胶囊。但是,常规片剂和胶囊受限于其刚性剂量含量。此外,难以吞咽片剂和胶囊是许多患者特别是小儿人群所面临的问题,并且可能导致各种不良事件以及患者不依从治疗方案。
[0007]
无乳糖制剂有助于应对患者潜在的乳糖不耐受。
[0008]
本发明在生产工艺中表现出令人惊讶的较少的粘附问题。此外,本发明出人意料地改善了流动性。
[0009]
将胶体二氧化硅在颗粒内和颗粒外与颗粒外甘露醇相结合,出人意料地解决了流动性问题。例如,本发明的成人制剂(实施例7)中ffc的流动性为4.26至8.93。
[0010]
此外,根据本发明,含芯片剂的崩解速度出人意料地快速。这一快速崩解的原因在于颗粒内以及在颗粒外相中存在交联羧甲基纤维素钠。
[0011]
通过使用协同发生作用的颗粒内硬脂富马酸钠和颗粒外硬脂酸镁,出人意料地克服了压片过程中的挑战,尤其是粘附问题。
[0012]
本领域需要改善的药物递送系统以用于无法吞咽片剂和胶囊的患者人群,例如小儿和老年人群。具体地,本领域需要新颖的恩曲替尼制剂。甚至更具体地,本领域需要具有精确的药理学和药代动力学特性的新颖的恩曲替尼多颗粒剂型,特别是微型片、丸剂或颗粒剂型,更特别是微型片剂型。
[0013]
标准包衣通常用于减少粉尘、谨慎处理、美观以及区分剂量规格。它们不适合与恩曲替尼组合物一起使用,因为其释放速度快,并且无法掩盖药物的苦味。本发明通过具有ph非依赖性的膜包衣克服了这些问题,并且在适当的时间释放药物。因此,例如,自来水ph变化不影响药物释放的开始。这些问题与知道也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,具有苦味的小儿患者尤其相关。已知这些苦味影响患者的依从性。因此,在另一个实施例中,本发明提供了一种用于n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的膜包衣,该膜包衣具有ph非依赖性。
附图说明
[0014]
图1:制剂a、制剂b和成人制剂(制剂g)中恩曲替尼的溶出曲线。
[0015]
图2:制剂c粘附在冲床上的图示。
[0016]
图3:制剂d不粘附在冲床上的图示。
[0017]
图4:制剂b的微型片。
[0018]
图5:用于生产微型片的冲床图纸。b:直径=2.35mm
±
0.06mm;h:片剂高度=2.25mm
±
0.10mm;a:基高=1.37mm
±
0.10mm;x:帽高=0.44mm
±
0.02mm;c:最长长度=2.72mm
±
0.10mm。
[0019]
图6:制剂f的稳定性。
[0020]
图7:棒状包的使用示例:即,将小片撒在一勺酸奶上。
[0021]
本文提及的所有出版物、专利申请、专利和其他参考文献均全文以引用方式并入。
[0022]
除非另外指出,否则本技术中使用的命名法基于iupac系统命名法。
[0023]
本文公开了本发明的各种特征和实施例,然而,基于所提供的教导内容,本发明的其他特征、修改和等同方案对于相关领域的技术人员将是显而易见的。所描述的本发明不限于所提供的实例和实施例,本领域技术人员将会知道各种替代性等同方案。如本文所用,单数形式“一个”、“一种”和“该”包括复数,除非上下文另有明确规定。例如,“一个”个体也将包括“多个个体”。
[0024]
除非另外定义,否则本说明书和权利要求中使用的所有技术和科学术语所具有的含义与本发明所属领域普通技术人员通常理解的含义相同。尽管在本发明的实践或测试中,可使用与本文所述的那些方法和材料类似或等同的方法和材料,但下文描述了合适的
方法和材料。
[0025]
术语“api”是指根据本发明所述的活性物质恩曲替尼。
[0026]
术语“n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺”是指具有化学文摘社登记号1108743-60-7并且具有以下化学结构的化合物:
[0027][0028]“n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺”也以其inn名称“恩曲替尼”指称,并且两者可互换使用。在一个特定实施例中,n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺为晶体或无定形形式的固体,更特别是晶体形式,甚至更特别是形式a或c,最特别是形式c。形式a的恩曲替尼已在申请w02013/174876中公开为“形式2”,并且该申请公开了其制备方法。形式c的恩曲替尼已在申请wo 2017/202674中公开为“形式4”,并且该申请公开了其制备方法。
[0029]
在下文中对n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺的所有引用包括对其溶剂化物、复合物、多晶型、立体异构体及其同位素标记形式的引用。在本文所提供的范围内,还包括含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺的溶剂化物、复合物、多晶型、立体异构体及其同位素标记形式的药物组合物。特别地,本发明
[0030]
如本文所用,术语“约”意指在所提供的值的正负10%以内,或修约至最接近的有效数字,其在所有情况下均包括所提供的值。在提供范围的情况下,这些范围包括边界值。
[0031]
如本文所用,术语“酸化剂”意指本质上呈酸性的化合物。如本文所用,术语“有机酸化剂”意指化学组成中含有碳的酸化剂。如本文所用,术语“无机酸化剂”意指其组成中不含碳的酸化剂。
[0032]
如本文所用,术语“施用(administration/administering)”是指通过施用途径将生物活性组合物或制剂递送给受试者,该施用途径包括但不限于口服、静脉内、动脉内、肌内、腹膜内、皮下、肌内、局部或其组合。在一些实施例中,受试者的施用途径为口服。
[0033]
如本文所用,术语“混合物”意指一种或多种化合物在组合物中的混合物。本领域的普通技术人员应当理解,本文所公开的药物组合物包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺与至少一种酸化剂的混合物。
[0034]
如本文所用,术语“alk”意指间变性淋巴瘤激酶受体或cd246(分化簇246),其为在
人体中由alk基因编码的酶,并且还具有uniprot标识符alk_human。
[0035]
如本文所用,术语“auc”意指受试者血浆中的化合物浓度与时间的曲线下面积。
[0036]
如本文所用,术语“盐酸甜菜碱”意指具有化学文摘社登记号590-46-5并且通用名为1-羧基-n,n,n-三甲基氯化甲胺和(羧甲基)三甲基氯化铵的化合物。
[0037]
如本文所用,术语“棒状包”意指密封的小包装,其中包含一定量的材料,该量供单次使用或为单位剂量。
[0038]
如本文所用,术语“生物样品”意指从生物体中获得的可用于诊断或监测测定的样品。样品可以是健康组织、患病组织或疑似患病组织的组织。样品可以是例如在手术操作期间采集的活体组织。可通过细针抽吸、刮擦或清洗腔体来采集样品以从中收集细胞或组织。样品可以是肿瘤,诸如实体瘤和造血肿瘤以及邻近的健康组织。样品可以是受试者细胞的涂片或组织切片。该术语涵盖血液和其他生物学来源的液体样品、固体组织样品,诸如活检样本或组织培养物或由其衍生的细胞及其后代。该术语涵盖在采购后以任何方式处理过的样品,诸如通过使用试剂、增溶或某些成分富集来处理的样品。该术语涵盖临床样品,并且还包括细胞培养物中的细胞、细胞上清液、细胞裂解物、细胞提取物、细胞匀浆和亚细胞组分(包括合成的蛋白质)、血清、血浆、体液以及其他生物体液和组织样品。生物样品可以包含不与自然界中的细胞或组织自然混合的化合物,诸如防腐剂、抗凝剂、缓冲剂、固定剂、营养物、抗生素等。在一些实施例中,将样品保存为冷冻样品或保存为甲醛固定或多聚甲醛固定的石蜡包埋(ffpe)组织制剂。例如,样品可以包埋在基质中,例如,ffpe块或冷冻样品。
[0039]
如本文所用,术语“c
max”意指化合物或包含该化合物的组合物被施用于受试者后,该化合物在受试者血浆中达到的峰值浓度。在一些实施例中,将化合物或包含该化合物的药物组合物经口施用于受试者以达到特定的c
max
。
[0040]
如本文所用,术语“流动性”意指并且包括材料在不施加过度的力的情况下从一个位置平滑地移至另一个位置的能力,特别是就粉末而言。松散材料特别是粉末的流动性可通过其流动因子系数(ffc)来确定。ffc值是本领域技术人员已知的,并且还描述于例如dietmar schulze发表在wiley vch的杂志《chemie ingenieur technik》1995年第67卷第1期第60-68页的“zurvon sch
ü
ttg
ü
tern
–
definition und meβverfahren”的文章以及由springer-verlag berlin heidelberg出版于2008年的dietmar schulze的《powders and bulk solids-behavior,characterization,storage and flow》中。ffc值可以根据http://www.uspbpep.com/usp29/v29240/usp29nf24s0_c1174.htmlit获得,该方法为usp方法以及pheur方法。例如,ffc值可通过单轴压缩试验来确定。在单轴压缩试验中,通常在一个空心圆柱体(理想情况下具有无摩擦壁)中填充待研究的松散材料,特别是粉末;并且第一步是在垂直方向上施加应力σ1(固结应力)。随后,解除施加于试样的固结应力σ1,并且移除空心圆柱体。然后,在固结的圆柱形松散材料试样(特别是固结的粉末试样上)施加不断增加的垂直压应力,直至达到圆柱试样断裂(或失效)的应力σc。应力σc可称为抗压强度或无侧限屈服强度。当施加应力σc时,固结的圆柱试样的断裂表明固结的松散材料(特别是固结粉末)刚开始流动。然后可以将ffc值确定为比率ffc=σc/σ1。
[0041]
术语“癌症”或“肿瘤”可互换使用,是指存在具有致癌细胞典型特征的细胞,诸如不受控制的增殖、永生、转移潜力、快速生长和增殖率以及某些特征性形态特征。癌细胞通常以肿瘤的形式存在,但此类细胞可单独存在于动物体内,或者可以是非致瘤性癌细胞,诸
如白血病细胞。这些术语包括实体瘤、软组织瘤或转移性病变。如本文所用,术语“癌症”包括癌前癌和恶性肿瘤。在某些实施例中,癌症为实体瘤、软组织肿瘤或转移性病变。这些术语还指以形成它们的细胞类型命名的实体瘤以及血液、骨髓或淋巴系统的癌症。实体瘤的实例包括但不限于肉瘤和癌。血癌的实例包括但不限于白血病、淋巴瘤和骨髓瘤。这些术语包括但不限于起源于身体特定部位的原发性癌症、从开始的部位扩散至身体其他部位的转移性癌症、原发性癌症缓解后的复发以及第二原发性癌症(具有既往癌症病史的人所罹患的一种不同于既往癌症类型的新的原发性癌症)。如本文所用,“癌症”是指由任何恶性和/或侵袭性生长或由异常细胞生长引起的肿瘤。
[0042]
术语“多颗粒”是指包含多个颗粒的剂型,其总和代表恩曲替尼的预期治疗有用的剂量。
[0043]
诸如“x%
±
y%”的术语意指x%-y%至x% y%的范围。例如,5%
±
1%意指4%(包含在内)至6%(包含在内)的范围。
[0044]
在任何崩解剂、填料、助流剂、润滑剂和/或恩曲替尼的上下文中,诸如“x%
±
y%”的术语意指片芯总重量的“按重量计x%
±
y%”(该总重量为不含膜包衣重量的药物组合物的重量)。例如,对于200mg片剂内核中的50mg恩曲替尼,称恩曲替尼按重量计占总内核重量的25%。
[0045]
在任何包衣剂、着色剂、增塑剂和/或抗粘剂的上下文中,诸如“按重量计x%
±
y%”的术语意指膜包衣总重量的“按重量计x%
±
y%”。例如,对于6mg片剂包衣中的1.5mg二氧化钛,称其按重量计占“膜包衣系统”、“膜包衣”或“包衣系统”的总重量的25%。
[0046]
术语“化疗剂”是指用于治疗病状(特别是癌症)的化学物质,诸如细胞毒剂或细胞抑制剂。
[0047]
术语“干法制粒”是指以下方法:将成分共混,然后将混合物压实并且减小其尺寸,以便得到尺寸均匀的颗粒混合物。干法制粒通常涉及在不使用热和溶剂的情况下通过压缩将粉末混合物制粒。优选地,干法制粒将在约室温至约45℃并且更优选在约20℃至约30℃的温度下进行。一种特定的“干法制粒”方法为“辊压”,其是指使用碾压机在高压下压缩材料混合物(例如固体)的方法。
[0048]
如本文所用,术语“粒度分布”或“psd”意指具有给定粒度的化合物的颗粒的相对比例。虽然球形物体的粒度可通过其直径明确并且定量地定义,但包含活性药物成分或赋形剂的颗粒的形状可能是非球形和不规则的。本领域的普通技术人员可通过多种方法测量并且表达非球形和不规则颗粒的尺寸,诸如使用激光衍射仪测量此类颗粒的尺寸,并且基于将给定颗粒替换为具有该颗粒的许多特性之一的假想球体来表达此类颗粒的尺寸。此类特性可选自例如但不限于:与被测颗粒具有相同体积的假想球体的直径(基于体积的粒度)、与被测颗粒具有相同重量的假想球体的直径(基于重量的粒度)以及与被测颗粒具有相同表面积的假想球体的直径(基于面积的粒度)。本领域的普通技术人员熟悉此类方法以及表达此类方法的结果的方式,并且此类方法在不进行过度实验的情况下即可应用于本文所公开的实施例中。粒度分布可例如以图形方式表示为曲线图。一种常见类型的曲线图为累积筛下物曲线图,其表示小于规定粒度的颗粒的比例(例如,按数量、体积或质量)。根据本发明,psd通过激光衍射法测得。
[0049]
如本文所用,参数dv10、dv50和dv90表示在10%、50%、90%的累积数量或体积的
筛下物粒度分布的粒度。因此,材料的“dv10”表示其中按数量或体积计10%的该材料由粒度等于或小于dv10值的颗粒组成。材料的“dv50”表示其中按数量或体积计50%的该材料由粒度等于或小于dv50值的颗粒组成。材料的“dv90”表示其中按数量或体积计90%的该材料由粒度等于或小于dv90值的颗粒组成。
[0050]
如本文所用,“ros1”意指具有uniprot名称ros1_human的ros1受体酪氨酸蛋白激酶。
[0051]
如本文所用,术语“受试者”意指人类。
[0052]“患者”是指人类。术语“患者”包括成人和儿童,并且包括男性和女性。更特别地,根据本发明,患者是指婴儿、儿童和青少年。
[0053]
如本文所用,术语“t
max”意指在向受试者施用化合物或包含该化合物的药物组合物后,该化合物在受试者血浆中达到峰值浓度的时间。
[0054]
术语“治疗有效量”是指一种或多种化合物或其药用盐在施用于受试者后将在一定程度上缓解所治疗的疾病的症状中的一种或多种的量。关于癌症的治疗,治疗有效量意指具有以下效果的量:(1)减小癌症肿瘤的大小,(2)抑制(即,在一定程度上减缓,优选停止)癌症肿瘤转移,(3)在一定程度上抑制(即,在一定程度上减缓,优选停止)癌症肿瘤的生长,和/或(4)在一定程度上缓解(或优选消除)与癌症相关的一种或多种症状。
[0055]
术语“原肌球蛋白受体激酶”、“trk”和“trk”是指由神经营养蛋白家族的肽激素活化的原肌球蛋白受体激酶(trk)家族,其包括但不限于trka、trkb和trkc。如本文所用,术语“trka”意指具有uniprot标识符ntrk1_human的野生型原肌球蛋白受体激酶a。如本文所用,术语“trkb”意指具有uniprot标识符ntrk2_human的野生型原肌球蛋白受体激酶b。如本文所用,术语“trkc”意指具有uniprot标识符ntrk3_human的野生型原肌球蛋白受体激酶c。trka、trkb和trkc也被本领域的普通技术人员分别称为trk1、trk2和trk3。提及trka即表示提及trk1。提及trkb即表示提及trk2。提及trkc即表示提及trk3。
[0056]
本发明的所有实施例可以组合。
[0057]
本发明(实施例1)涉及一种药物组合物,该药物组合物包含:
[0058]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0059]
b)胶体二氧化硅,和
[0060]
c)甘露醇。
[0061]
在另一个实施例(实施例2)中,本发明涉及根据本文所列举的实施例中任一者所述的药物组合物,该药物组合物包含:
[0062]
1)颗粒内组分,所述颗粒内组分包含:
[0063]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0064]
b)胶体二氧化硅,
[0065]
2)颗粒外组分,所述颗粒外组分包含:
[0066]
a)胶体二氧化硅,和
[0067]
b)甘露醇。
[0068]
在另一个实施例(实施例3)中,本发明涉及一种药物组合物,该药物组合物包含:
[0069]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0070]
b)硬脂酸镁,和
[0071]
c)硬脂富马酸钠。
[0072]
在另一个实施例(实施例4)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0073]
1)颗粒内组分,所述颗粒内组分包含:
[0074]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0075]
b)硬脂富马酸钠,
[0076]
2)颗粒外组分,所述颗粒外组分包含:
[0077]
a)硬脂酸镁。
[0078]
在另一个实施例(实施例5)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0079]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0080]
b)胶体二氧化硅,
[0081]
c)甘露醇,
[0082]
d)硬脂酸镁,和
[0083]
e)硬脂富马酸钠。
[0084]
在另一个实施例(实施例6)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0085]
1)颗粒内组分,所述颗粒内组分包含:
[0086]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0087]
b)胶体二氧化硅,
[0088]
c)硬脂富马酸钠,
[0089]
2)颗粒外组分,所述颗粒外组分包含:
[0090]
a)胶体二氧化硅,
[0091]
b)甘露醇,和
[0092]
c)硬脂酸镁。
[0093]
在另一个实施例(实施例7)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0094]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0095]
b)硬脂酸镁,
[0096]
c)硬脂富马酸钠,和
[0097]
d)交联羧甲基纤维素钠。
[0098]
在另一个实施例(实施例8)中,根据本文所列举的实施例中任一者所述的药物组
合物包含:
[0099]
1)颗粒内组分,所述颗粒内组分包含:
[0100]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0101]
b)硬脂富马酸钠,
[0102]
c)交联羧甲基纤维素钠,
[0103]
2)颗粒外组分,所述颗粒外组分包含:
[0104]
a)硬脂酸镁,和
[0105]
b)交联羧甲基纤维素钠。
[0106]
在另一个实施例(实施例9)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0107]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0108]
b)胶体二氧化硅,
[0109]
c)甘露醇,
[0110]
d)硬脂酸镁,
[0111]
e)硬脂富马酸钠,和
[0112]
f)交联羧甲基纤维素钠。
[0113]
在另一个实施例(实施例10)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0114]
1)颗粒内组分,所述颗粒内组分包含:
[0115]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0116]
b)胶体二氧化硅,
[0117]
c)硬脂富马酸钠,
[0118]
d)交联羧甲基纤维素钠,
[0119]
2)颗粒外组分,所述颗粒外组分包含:
[0120]
c)胶体二氧化硅,
[0121]
d)甘露醇,
[0122]
e)硬脂酸镁,和
[0123]
f)交联羧甲基纤维素钠。
[0124]
在一个更具体的实施例(实施例11)中,本发明涉及如上所述的药物组合物,该药物组合物进一步包含微晶纤维素。
[0125]
在一个更具体的实施例(实施例12)中,提供了根据本文所提及的实施例中任一者所述的药物组合物,该药物组合物另外包含至少一种酸化剂。特别地,所述至少一种酸化剂选自酒石酸、马来酸、富马酸、柠檬酸和盐酸甜菜碱。更特别地,所述至少一种酸化剂为酒石酸。甚至更特别地,如本文所述的药物组合物另外包含酒石酸。最特别地,如本文所述的药物组合物另外包含(d)或(l)酒石酸或其混合物,更特别地为(l)酒石酸。
[0126]
在另一个实施例(实施例13)中,药物组合物包含:
[0127]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0128]
b)胶体二氧化硅,
[0129]
c)甘露醇,
[0130]
d)硬脂酸镁,
[0131]
e)硬脂富马酸钠,
[0132]
f)交联羧甲基纤维素钠,和
[0133]
g)微晶纤维素。
[0134]
在另一个实施例(实施例14)中,本发明涉及一种药物组合物,该药物组合物包含:
[0135]
1)颗粒内组分,所述颗粒内组分包含:
[0136]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0137]
b)胶体二氧化硅,
[0138]
c)硬脂富马酸钠,
[0139]
d)交联羧甲基纤维素钠,
[0140]
e)微晶纤维素,
[0141]
2)颗粒外组分,所述颗粒外组分包含:
[0142]
a)胶体二氧化硅,
[0143]
b)甘露醇,
[0144]
c)硬脂酸镁,和
[0145]
d)交联羧甲基纤维素钠。
[0146]
在另一个实施例(实施例15)中,药物组合物包含:
[0147]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0148]
b)胶体二氧化硅,
[0149]
c)甘露醇,
[0150]
d)硬脂酸镁,
[0151]
e)硬脂富马酸钠,
[0152]
f)交联羧甲基纤维素钠,
[0153]
g)微晶纤维素,以及
[0154]
h)酒石酸。
[0155]
在另一个实施例(实施例16)中,药物组合物包含:
[0156]
1)颗粒内组分,所述颗粒内组分包含:
[0157]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0158]
b)胶体二氧化硅,
[0159]
c)硬脂富马酸钠,
[0160]
d)交联羧甲基纤维素钠,
[0161]
e)微晶纤维素,
[0162]
f)酒石酸,
[0163]
2)颗粒外组分,所述颗粒外组分包含:
[0164]
a)胶体二氧化硅,
[0165]
b)甘露醇,
[0166]
c)硬脂酸镁,和
[0167]
d)交联羧甲基纤维素钠。
[0168]
在另一个实施例(实施例17)中,本发明涉及一种药物组合物,该药物组合物由以下各项组成:
[0169]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0170]
b)胶体二氧化硅,
[0171]
c)甘露醇,
[0172]
d)硬脂酸镁,
[0173]
e)硬脂富马酸钠,
[0174]
f)交联羧甲基纤维素钠,
[0175]
g)微晶纤维素,
[0176]
h)酒石酸,以及
[0177]
i)ph非依赖性膜包衣,特别是如本文所定义。
[0178]
在另一个实施例(实施例18)中,本发明涉及一种药物组合物,该药物组合物由以下各项组成:
[0179]
1)颗粒内组分,该颗粒内组分由以下各项组成:
[0180]
a)也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0181]
b)胶体二氧化硅,
[0182]
c)硬脂富马酸钠,
[0183]
d)交联羧甲基纤维素钠,
[0184]
e)微晶纤维素,
[0185]
f)酒石酸,
[0186]
2)颗粒外组分,该颗粒外组分由以下各项组成:
[0187]
a)胶体二氧化硅,
[0188]
b)甘露醇,
[0189]
c)硬脂酸镁,和
[0190]
d)交联羧甲基纤维素钠,
[0191]
3)ph非依赖性膜包衣,特别是如本文所定义。
[0192]
本发明的一个具体实施例(实施例19)涉及如本文所述的药物组合物,该药物组合物包含按重量计在5%与45%之间的恩曲替尼,特别是按重量计在15%与35%之间的恩曲替尼,更特别是按重量计25%
±
5%的恩曲替尼,最特别是按重量计25%
±
1%的恩曲替尼。
[0193]
本发明的一个具体实施例(实施例20)涉及如本文所述的药物组合物,该药物组合物包含按重量计在2%与20%之间的甘露醇,更特别是按重量计在5%与15%之间的甘露
醇,更特别是按重量计10%
±
1%的甘露醇。
[0194]
本发明的一个具体实施例(实施例21)涉及如本文所述的药物组合物,该药物组合物包含按重量计在0.2%与1.2%之间的胶体二氧化硅作为颗粒内组分以及按重量计在0.1%与1.0%之间的胶体二氧化硅作为颗粒外组分,更特别是按重量计在0.5%与1.0%之间的胶体二氧化硅作为颗粒内组分以及按重量计在0.2%与0.8%之间的胶体二氧化硅作为颗粒外组分,最特别是按重量计0.9%
±
0.1%的胶体二氧化硅作为颗粒内组分以及按重量计0.20%
±
0.05%的胶体二氧化硅作为颗粒外组分。
[0195]
本发明的一个具体实施例(实施例22)涉及如本文所述的药物组合物,该药物组合物包含按重量计在0.1%与2.0%之间的硬脂酸镁,更特别是按重量计在0.25%与1.0%之间的硬脂酸镁,最特别是按重量计0.45%
±
0.05%的硬脂酸镁。
[0196]
本发明的一个具体实施例(实施例23)涉及如本文所述的药物组合物,该药物组合物包含按重量计在0.5%与5%之间的硬脂富马酸钠,更特别是按重量计在1.0%与3.0%之间的硬脂富马酸钠,最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠。
[0197]
本发明的一个具体实施例(实施例24)涉及如本文所述的药物组合物,该药物组合物包含按重量计在5%与80%之间的微晶纤维素,特别是按重量计在20%与60%之间的微晶纤维素,更特别是按重量计47.5%
±
5%的微晶纤维素,最特别是按重量计47.5%
±
1%的微晶纤维素。
[0198]
本发明的一个具体实施例(实施例25)涉及如本文所述的药物组合物,该药物组合物包含按重量计在1.0%与8%之间的交联羧甲基纤维素钠作为颗粒内组分以及按重量计在0.5%与5%之间的交联羧甲基纤维素钠作为颗粒外组分,更特别是按重量计在2.0%与6%之间的交联羧甲基纤维素钠作为颗粒内组分以及按重量计在1.0%与3%之间的交联羧甲基纤维素钠作为颗粒外组分,最特别是按重量计4.5%
±
0.05%的交联羧甲基纤维素钠作为颗粒内组分以及2.25%
±
0.05%的交联羧甲基纤维素钠作为颗粒外组分。
[0199]
本发明的一个具体实施例(实施例26)涉及如本文所述的药物组合物,该药物组合物包含按重量计在0.3%与13.3%之间的酒石酸,更特别是按重量计在4.42%与10.32%之间的酒石酸,最特别是按重量计7.37%
±
0.5%的酒石酸。
[0200]
在又一个实施例(实施例27)中,本发明涉及根据本文所列举的实施例中任一者所述的药物组合物,该药物组合物包含:
[0201]
a)按重量计在5%与45%之间、特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0202]
b)按重量计在0.3%与2.2%之间、更特别是按重量计在0.7%与1.8%之间、最特别是按重量计1.10%
±
0.15%之间的胶体二氧化硅,以及
[0203]
c)按重量计在2%与20%之间、更特别是按重量计在5%与15%之间、最特别是按重量计10%
±
1%的甘露醇。
[0204]
在另一个实施例(实施例28)中,本发明涉及根据本文所列举的实施例中任一者所述的药物组合物,该药物组合物包含:
[0205]
1)颗粒内组分,所述颗粒内组分包含:
[0206]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按
重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0207]
b)按重量计在0.2%与1.2%之间、更特别是按重量计在0.5%与1.0%之间、最特别是按重量计0.9%
±
0.10%的胶体二氧化硅,
[0208]
2)颗粒外组分,所述颗粒外组分包含:
[0209]
a)按重量计在0.1%与1.0%之间、更特别是按重量计在0.2%与0.8%之间、最特别是按重量计0.20%
±
0.05%之间的胶体二氧化硅,以及
[0210]
b)按重量计在2%与20%之间、更特别是按重量计在5%与15%之间、最特别是按重量计10%
±
1%的甘露醇。
[0211]
在另一个实施例(实施例29)中,本发明涉及根据本文所列举的实施例中任一者所述的药物组合物,该药物组合物包含:
[0212]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0213]
b)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特别是按重量计0.45%
±
0.5%的硬脂酸镁,以及
[0214]
c)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠。
[0215]
在另一个实施例(实施例30)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0216]
1)颗粒内组分,所述颗粒内组分包含:
[0217]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0218]
b)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠,
[0219]
2)颗粒外组分,所述颗粒外组分包含:
[0220]
a)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特别是按重量计0.45%
±
0.05%的硬脂酸镁。
[0221]
在另一个实施例(实施例31)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0222]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0223]
b)按重量计在0.3%与2.2%之间、更特别是按重量计在0.7%与1.8%之间、最特别是按重量计1.10%
±
0.15%之间的胶体二氧化硅,
[0224]
c)按重量计在2%与20%之间、更特别是按重量计在5%与15%之间、最特别是按重量计10%
±
1%的甘露醇,
[0225]
d)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特
别是按重量计0.45%
±
0.05%的硬脂酸镁,以及
[0226]
e)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠。
[0227]
在另一个实施例(实施例32)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0228]
1)颗粒内组分,所述颗粒内组分包含:
[0229]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0230]
b)按重量计在0.2%与1.2%之间、更特别是按重量计在0.5%与1.0%之间、最特别是按重量计0.9%
±
0.10%的胶体二氧化硅,
[0231]
c)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠,
[0232]
2)颗粒外组分,所述颗粒外组分包含:
[0233]
a)按重量计在0.1%与1.0%之间、更特别是按重量计在0.2%与0.8%之间、最特别是按重量计0.20%
±
0.05%的胶体二氧化硅,
[0234]
b)按重量计在2%与20%之间、更特别是按重量计在5%与15%之间、最特别是按重量计10%
±
1%的甘露醇,以及
[0235]
c)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特别是按重量计0.45%
±
0.05%的硬脂酸镁。
[0236]
在另一个实施例(实施例33)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0237]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0238]
b)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特别是按重量计0.45%
±
0.05%的硬脂酸镁,
[0239]
c)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠,以及
[0240]
d)按重量计在1.5%与13%之间、更特别是按重量计在3%与9%之间、最特别是按重量计6.75%
±
0.1%的交联羧甲基纤维素钠。
[0241]
在另一个实施例(实施例34)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0242]
1)颗粒内组分,所述颗粒内组分包含:
[0243]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0244]
b)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠,
[0245]
c)按重量计在1.0%与8.0%之间、更特别是按重量计在2.0%与6.0%之间、最特别是按重量计4.5%
±
0.05%的交联羧甲基纤维素钠。
[0246]
2)颗粒外组分,所述颗粒外组分包含:
[0247]
a)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特别是按重量计0.45%
±
0.05%的硬脂酸镁,以及
[0248]
b)按重量计在0.5%与5.0%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计2.25%
±
0.05%的交联羧甲基纤维素钠。
[0249]
在另一个实施例(实施例35)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0250]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0251]
b)按重量计在0.3%与2.2%之间、更特别是按重量计在0.7%与1.8%之间、最特别是按重量计1.10%
±
0.15%之间的胶体二氧化硅,
[0252]
c)按重量计在2%与20%之间、更特别是按重量计在5%与15%之间、最特别是按重量计10%
±
1%的甘露醇,
[0253]
d)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特别是按重量计0.45%
±
0.05%的硬脂酸镁,
[0254]
e)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠,以及
[0255]
f)按重量计在1.5%与13%之间、更特别是按重量计在3%与9%之间、最特别是按重量计6.75%
±
0.1%的交联羧甲基纤维素钠。
[0256]
在另一个实施例(实施例36)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0257]
1)颗粒内组分,所述颗粒内组分包含:
[0258]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0259]
b)按重量计在0.2%与1.2%之间、更特别是按重量计在0.5%与1.0%之间、最特别是按重量计0.9%
±
0.10%的胶体二氧化硅,
[0260]
c)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠,
[0261]
d)按重量计在1.0%与8.0%之间、更特别是按重量计在2.0%与6.0%之间、最特别是按重量计4.5%
±
0.05%的交联羧甲基纤维素钠。
[0262]
2)颗粒外组分,所述颗粒外组分包含:
[0263]
a)按重量计在0.1%与1.0%之间、更特别是按重量计在0.2%与0.8%之间、最特别是按重量计0.20%
±
0.05%的胶体二氧化硅,
[0264]
b)按重量计在2%与20%之间、更特别是按重量计在5%与15%之间、最特别是按重量计10%
±
1%的甘露醇,
[0265]
c)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特别是按重量计0.45%
±
0.05%的硬脂酸镁,以及
[0266]
d)按重量计在0.5%与5.0%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计2.25%
±
0.05%的交联羧甲基纤维素钠。
[0267]
在另一个实施例(实施例37)中,根据本文所列举的实施例中任一者所述的药物组合物包含:
[0268]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0269]
b)按重量计在0.3%与2.2%之间、更特别是按重量计在0.7%与1.8%之间、最特别是按重量计1.10%
±
0.15%之间的胶体二氧化硅,
[0270]
c)按重量计在2%与20%之间、更特别是按重量计在5%与15%之间、最特别是按重量计10%
±
1%的甘露醇,
[0271]
d)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特别是按重量计0.45%
±
0.05%的硬脂酸镁,
[0272]
e)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠,
[0273]
f)按重量计在1.5%与13%之间、更特别是按重量计在3%与9%之间、最特别是按重量计6.75%
±
0.1%的交联羧甲基纤维素钠,以及
[0274]
g)按重量计在5%与80%之间、特别是按重量计在20%与60%之间、更特别是按重量计47.5%
±
5%、最特别是按重量计47.5%
±
1%的微晶纤维素。
[0275]
在另一个实施例(实施例38)中,本发明涉及根据本文所列举的实施例中任一者所述的药物组合物,该药物组合物包含:
[0276]
1)颗粒内层,所述颗粒内层包含:
[0277]
a)按重量计在5%与45%之间、更特别是按重量计在15%与35%之间、更特别是按重量计25%
±
5%、最特别是按重量计25%
±
1%的也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,
[0278]
b)按重量计在0.2%与1.2%之间、更特别是按重量计在0.5%与1.0%之间、最特别是按重量计0.9%
±
0.10%的胶体二氧化硅,
[0279]
c)按重量计在0.5%与5%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计1.8%
±
0.2%的硬脂富马酸钠,
[0280]
d)按重量计在1.0%与8.0%之间、更特别是按重量计在2.0%与6.0%之间、最特别是按重量计4.5%
±
0.05%的交联羧甲基纤维素钠,
[0281]
e)按重量计在5%与80%之间、特别是按重量计在20%与60%之间、更特别是按重量计47.5%
±
5%、最特别是按重量计47.5%
±
1%的微晶纤维素,
[0282]
2)颗粒外层,所述颗粒外层包含:
[0283]
a)按重量计在0.1%与1.0%之间、更特别是按重量计在0.2%与0.8%之间、最特别是按重量计0.20%
±
0.05%的胶体二氧化硅,
[0284]
b)按重量计在2%与20%之间、更特别是按重量计在5%与15%之间、最特别是按
重量计10%
±
1%的甘露醇,
[0285]
c)按重量计在0.1%与2.0%之间、更特别是按重量计在0.25%与1.0%之间、最特别是按重量计0.45%
±
0.05%的硬脂酸镁,以及
[0286]
d)按重量计在0.5%与5.0%之间、更特别是按重量计在1.0%与3.0%之间、最特别是按重量计2.25%
±
0.05%的交联羧甲基纤维素钠。
[0287]
在根据本文所提及的实施例中任一者所述的药物组合物的一个更特定的实施例(实施例39)中,其中胶体二氧化硅为具有200m2/g表面积的亲水性气相二氧化硅(即cas 7631-86-9),最特别地,该胶体二氧化硅为evonic销售的200。
[0288]
在根据本文所提及的实施例中任一者所述的药物组合物的一个更特定的实施例(实施例40)中,其中甘露醇为可压缩性d-甘露醇(即cas 69-65-8),更特别地,该甘露醇包含少于0.05%的由生产工艺所产生的作为杂质的还原糖,最特别地,该甘露醇为m200。根据本文的实施例中任一者所述的甘露醇具有142-231μm的d50。
[0289]
在根据本文所提及的实施例中任一者所述的药物组合物的一个更特定的实施例(实施例41)中,其中交联羧甲基纤维素钠具有≤10%的干燥失重。
[0290]
在根据本文所提及的实施例中任一者所述的药物组合物的一个更特定的实施例(实施例42)中,其中硬脂富马酸钠具有142.2至146.0的皂化值,特别是具有13.6μm的dv50,更特别地,硬脂富马酸钠为
[0291]
在根据本文所提及的实施例中任一者所述的药物组合物的一个更特定的实施例(实施例43)中,其中微晶纤维素为cas 9004-34-6,特别是具有在40μm与75μm之间的dv50,更特别地为ph101。
[0292]
在另一个实施例(实施例44)中,本发明涉及一种药物组合物,该药物组合物包含:也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,特别地,其中包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的组合物如本技术中所述;以及ph非依赖性膜包衣。
[0293]
在一个特定实施例中(实施例45)中,本发明涉及一种药物组合物,该药物组合物包含:n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,特别地,其中包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的组合物如本技术中所述;以及膜包衣,特别是ph非依赖性膜包衣,该膜包衣包含羟丙基纤维素和乙基纤维素。
[0294]
在另一个特定实施例中(实施例46)中,本发明涉及一种药物组合物,该药物组合物包含:n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,特别地,其中包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的组合物如本技术中所述;以及ph非依赖性膜包衣,该膜包衣包含羟丙基纤维素和乙基纤维素。
[0295]
在另一个特定实施例(实施例47)中,本发明涉及一种药物组合物,该药物组合物包含:n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,特别地,其中包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的组合物如本技术中所述;以及如
本文所定义的ph非依赖性膜包衣,其中羟丙基纤维素被掺入乙基纤维素中。
[0296]
在另一个特定实施例中(实施例48)中,本发明涉及一种药物组合物,该药物组合物包含:n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,特别地,其中包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的组合物如本技术中所述;以及ph非依赖性膜包衣,其中羟丙基纤维素被掺入乙基纤维素中。
[0297]
在另一个特定实施例中(实施例49)中,本发明涉及一种药物组合物,该药物组合物包含:n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,特别地,其中包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的组合物如本技术中所述;以及膜包衣,特别是ph非依赖性膜包衣,该膜包衣包含:
[0298]
a)羟丙基纤维素和
[0299]
b)乙基纤维素。
[0300]
在另一个特定实施例中(实施例50)中,本发明涉及一种药物组合物,该药物组合物包含:n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,特别地,其中包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的组合物如本技术中所述;以及膜包衣,特别是ph非依赖性膜包衣,该膜包衣包含:
[0301]
a)羟丙基纤维素,
[0302]
b)乙基纤维素,和
[0303]
c)中链辛酸癸酸甘油三酯gb。
[0304]
在另一个特定实施例中(实施例51)中,本发明涉及一种药物组合物,该药物组合物包含:n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,特别地,其中包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的组合物如本技术中所述;以及膜包衣,特别是ph非依赖性膜包衣,该膜包衣包含:
[0305]
a)羟丙基纤维素,
[0306]
b)乙基纤维素,
[0307]
c)中链辛酸癸酸甘油三酯gb,和
[0308]
d)油酸。
[0309]
在另一个特定实施例中(实施例52)中,本发明涉及一种药物组合物,该药物组合物包含:n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺,特别地,其中包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的组合物如本技术中所述;以及膜包衣,特别是ph非依赖性膜包衣,该膜包衣包含:
[0310]
a)羟丙基纤维素,
[0311]
b)乙基纤维素,
[0312]
c)中链辛酸癸酸甘油三酯gb,
[0313]
d)油酸,和
[0314]
e)氧化铁红。
[0315]
在另一个特定实施例(实施例53)中,本发明如上所述,其中膜包衣(特别是其中膜包衣为ph非依赖性膜包衣)包含:
[0316]
a)按重量计1%至8%、特别是按重量计2%至8%、更特别是按重量计4.5%至5.5%的羟丙基纤维素,
[0317]
b)按重量计60%至90%、特别是按重量计65%至80%、更特别是按重量计70%至75%的乙基纤维素,
[0318]
c)按重量计1%至25%、特别是按重量计5%至20%、更特别是按重量计12%至16%的中链辛酸癸酸甘油三酯gb,
[0319]
d)按重量计3%至15%、特别是按重量计5%至12%、更特别是按重量计7.5%至9%的油酸,以及
[0320]
e)按重量计0.05%至0.6%、特别是按重量计0.1%至0.5%、更特别是按重量计0.2%至0.4%的氧化铁红。
[0321]
在本发明的特定实施例(实施例54)中,药物组合物仅包含一种活性药物成分(api),更特别地,其中该唯一api为也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺。
[0322]
在根据本文所提及的实施例中任一者所述的又一个实施例(实施例55)中,本发明提供了根据本文所提及的实施例中任一者所述的药物组合物,该药物组合物呈微型片的形式。在特定实施例中,微型片包含如本文所定义的颗粒内组分、颗粒外组分以及膜包衣,更特别地,其中微型片包含如本文所定义的颗粒内组分、颗粒外组分以及如本文所定义的ph非依赖性膜包衣。在其他特定实施例中,微型片具有如图5所示的形状,更特别地,根据图5所示的微型片具有2.25mm
±
0.10mm的片高(h),特别是还具有2.35mm
±
0.06mm的直径(b);更特别地,还具有1.37mm
±
0.10mm的基高(a);即使更特别地,还具有0.44mm
±
0.02mm的帽高(x);最特别地具有2.72mm
±
0.10mm的最长长度(c)。特别地,微型片可灌装到胶囊中或棒状包中。更特定地,微型片可灌装到棒状包中。
[0323]
在根据本文所提及的实施例中任一者所述的药物组合物的特定实施例(实施例56)中,药物组合物包含约2.5mg至约100mg n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺。
[0324]
在如本文所述的药物组合物的特定实施例(实施例57)中,其中药物组合物呈微型片的形式,这些微型片具有1.00mm至3.00mm、更特别是1.5mm至2.5mm、最特别是2.4mm
±
0.2mm的直径。
[0325]
在如本文所述的药物组合物的特定实施例(实施例58)中,其中药物组合物呈微型片的形式,这些微型片具有2.4mm
±
0.2mm的直径和2.4mm
±
0.2mm的高度。
[0326]
在如本文所述的药物组合物的特定实施例(实施例59)中,其中药物组合物呈微型片的形式,这些微型片具有2.5mg恩曲替尼的单个剂量。
[0327]
在又一个特定实施例(实施例60)中,本发明提供了微型片s having a diameter of 2.4mm
±
0.2mm的直径和2.4mm
±
0.2mm的高度的微型片,这些微型片包含根据本文的实施例中任一者所述的药物组合物。
[0328]
在又一个特定实施例(实施例61)中,本发明提供了包含根据本文的实施例中任一
者所述的药物组合物的微型片,特别是每微型片包含剂量为2.5mg的恩曲替尼。
[0329]
在如本文所述的药物组合物的特定实施例(实施例62)中,其中药物组合物呈微型片的形式,并且该药物组合物可随食物一起施用,例如随酸奶一起施用。
[0330]
在如本文所述的药物组合物的特定实施例(实施例63)中,其中药物组合物呈微型片的形式,并且其中微型片被撒在食物中,例如撒在酸奶中,更特别是撒在一勺酸奶中,甚至更特别是撒在约15ml酸奶中。
[0331]
在又一个特定实施例(实施例64)中,本发明提供了一种棒状包,该棒状包包含根据本文所述的实施例中任一者所述的微型片,特别地,其中微型片具有根据本文所述的实施例中任一者所述的药物组合物,更特别地,其中棒状包包含在5片与100片之间的微型片,更特别是在10片与50片之间的微型片,甚至更特别是20片微型片,最特别地,其中微型片具有2.5mg恩曲替尼的单个剂量。
[0332]
在又一个特定实施例(实施例65)中,本发明提供了一种棒状包,该棒状包包含根据本文所述的实施例中任一者所述的微型片,特别地,其中微型片具有根据本文所述的实施例中任一者所述的药物组合物,更特别地,其中棒状包包含在5片与100片之间的微型片,更特别是在10片与50片之间的微型片,甚至更特别是20片微型片,最特别地,其中微型片具有2.5mg恩曲替尼的单个剂量。
[0333]
在另一个实施例(实施例66),本发明提供了一种试剂盒,该试剂盒包含:如本文所述的药物组合物,该药物组合物呈胶囊、片剂或棒状包的形式,包含治疗有效量的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺;处方信息,也称为“小册子”;泡罩包装或瓶(hdpe或玻璃);以及容器。处方信息优选地包括提供给患者的有关随餐、特别是在早餐后30分钟内施用n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺的建议。
[0334]
在另一个实施例(实施例67)中,本发明涉及一种生产如本文所述的药物组合物的方法,特别地,该方法包含以下步骤:
[0335]
i)在容器1中,将也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺、胶体二氧化硅、硬脂富马酸钠、交联羧甲基纤维素钠、微晶纤维素和酒石酸共混;
[0336]
ii)对容器1中的混合物进行干法制粒,优选辊压;
[0337]
iii)将胶体二氧化硅、甘露醇、硬脂酸镁和交联羧甲基纤维素钠的混合物筛混到容器2中,对于胶体二氧化硅、甘露醇和交联羧甲基纤维素,筛网尺寸为约0.8mm,对于硬脂酸镁,筛网尺寸为0.5mm;
[0338]
iv)将容器1中的混合物与容器2中的混合物制粒;
[0339]
v)将iv)中获得的颗粒共混;
[0340]
vi)将v)iv)中的共混物压制成片剂内核;以及
[0341]
vii)制备膜包衣系统:
[0342]
a)将部分水解的聚乙烯醇、二氧化钛、聚乙二醇/peg(mw3350,聚乙二醇4000jp)、滑石、氧化铁黄、氧化铁红、四氧化三铁(nf)/氧化铁黑(jpe)混合为膜包衣混合物,
[0343]
b)将混合物悬浮于纯化水中,以及
[0344]
viii)将所述膜包衣系统vii)喷射到所述片剂内核上。
[0345]
在另一个实施例(实施例68)中,本发明涉及一种生产如本文所述的药物组合物的方法,特别地,该方法包含以下步骤:
[0346]
i)在容器1中,将也称为恩曲替尼的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺、胶体二氧化硅、硬脂富马酸钠、交联羧甲基纤维素钠、微晶纤维素和酒石酸共混;
[0347]
ii)对容器1中的混合物进行干法制粒,优选辊压;
[0348]
iii)将胶体二氧化硅、甘露醇、硬脂酸镁和交联羧甲基纤维素钠的混合物筛混到容器2中,对于胶体二氧化硅、甘露醇和交联羧甲基纤维素,筛网尺寸为约0.8mm,对于硬脂酸镁,筛网尺寸为0.5mm;
[0349]
iv)将容器1中的混合物与容器2中的混合物制粒,特别是干法制粒;
[0350]
v)将iv)中获得的颗粒共混;
[0351]
vi)将v)中的共混物压制成片剂内核;以及
[0352]
vii)制备膜包衣系统:
[0353]
a)将纯化水和氧化铁红混合并且均质化,特别是使用均质机polytron,
[0354]
b)将羟丙基纤维素悬浮于a)中的均质化混合物中,特别是使用螺旋桨搅拌器,
[0355]
c)特别地,使用桨式搅拌器将b)中的悬浮液加入膜包衣分散体中,所述膜包衣分散体包含纯化水、乙基纤维素20cp、氢氧化铵28%、中链辛酸癸酸甘油三酯gb和油酸;
[0356]
viii)将所述膜包衣系统vii)喷射到所述片剂内核上。
[0357]
在另一个特定实施例(实施例69)中,本发明提供了通过本文所述的方法所获得的药物组合物。
[0358]
在另一个实施例(实施例70)中,提供如上所提及的实施例中所述的包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺的药物组合物,这些药物组合物可以以任何合适的剂量(例如,以达到治疗有效量)施用于哺乳动物。例如,治疗有效量的合适剂量为2.5mg/天至600mg/天。在一个方面,提供了包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺的药物组合物,这些药物组合物将以在约2.5mg/天与约600mg/天之间的量适用于患者。所期望的剂量优选为50mg/天至约600mg/天。
[0359]
在又一个实施例(实施例71)中,根据本文所提及的实施例中任一者所述的药物组合物用于治疗癌症,所述癌症包含但不限于以下的癌症:循环系统,例如心脏(肉瘤[血管肉瘤、纤维肉瘤、横纹肌肉瘤、脂肪肉瘤]、黏液瘤、横纹肌瘤、纤维瘤、脂肪瘤和畸胎瘤)、纵隔和胸膜,以及其他胸内器官、血管肿瘤和肿瘤相关血管组织;呼吸道,例如鼻腔和中耳、副鼻窦、喉、气管、支气管和肺,诸如小细胞肺癌(sclc)、非小细胞肺癌(nsclc)、支气管癌(鳞状细胞癌、未分化小细胞癌、未分化大细胞癌、腺癌)、肺泡(细支气管)癌、支气管腺瘤、肉瘤、淋巴瘤、软骨瘤性错构瘤、间皮瘤;胃肠系统,例如,食道(鳞状细胞癌、腺癌、平滑肌肉瘤、淋巴瘤)、胃(癌、淋巴瘤、平滑肌肉瘤)、胃、胰腺(导管腺癌、胰岛素瘤、胰高血糖素瘤、胃泌素瘤、类癌、血管活性肠肽瘤)、小肠(腺癌、淋巴瘤、类癌、卡波西肉瘤、平滑肌瘤、血管瘤、脂肪瘤、神经纤维瘤、纤维瘤)、大肠(腺癌、管状腺瘤、绒毛状腺瘤、错构瘤、平滑肌瘤);泌尿生殖道,例如,肾脏(腺癌、wilm氏瘤[肾母细胞瘤]、淋巴瘤、白血病)、膀胱和/或尿道(鳞状细胞癌、移行细胞癌、腺癌)、前列腺(腺癌、肉瘤)、睾丸(精原细胞瘤、畸胎瘤、胚胎性癌、畸胎癌、
绒毛膜癌、肉瘤、间质细胞癌、纤维瘤、纤维腺瘤、腺瘤样瘤、脂肪瘤);肝脏,例如肝癌(肝细胞癌)、胆管癌、肝母细胞瘤、血管肉瘤、肝细胞腺瘤、血管瘤、胰腺内分泌肿瘤(诸如嗜铬细胞瘤、胰岛素瘤、血管活性肠肽瘤、胰岛细胞瘤和胰高血糖素瘤);骨骼,例如骨源性肉瘤(骨肉瘤)、纤维肉瘤、恶性纤维组织细胞瘤、软骨肉瘤、尤文氏肉瘤、恶性淋巴瘤(网状细胞肉瘤)、多发性骨髓瘤、恶性巨细胞瘤脊索瘤、骨软骨瘤(骨软骨性外生性骨疣)、良性软骨瘤、成软骨细胞瘤、软骨粘液样纤维瘤、骨样骨瘤和巨细胞瘤;神经系统,例如中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、头骨癌(骨瘤、血管瘤、肉芽肿、黄瘤、变形性骨炎)、脑膜(脑膜瘤、脑膜肉瘤、胶质瘤)、脑癌(星形细胞瘤、髓母细胞瘤、胶质瘤、室管膜细胞瘤、生殖细胞瘤[松果体瘤]、多形性胶质母细胞瘤、少突神经胶质瘤、施旺氏细胞瘤、视网膜母细胞瘤、先天性肿瘤)、脊髓神经纤维瘤、脑膜瘤、胶质瘤、肉瘤);生殖系统,例如妇科、子宫(子宫内膜癌)、宫颈(宫颈癌、瘤前宫颈非典型增生)、卵巢(卵巢癌[浆液性囊腺癌、粘液性囊腺癌、未分类癌]、颗粒-泡膜细胞瘤、sertoli-leydig细胞瘤、无性细胞瘤、恶性畸胎瘤)、外阴(鳞状细胞癌、上皮内癌、腺癌、纤维肉瘤、黑色素瘤)、阴道(透明细胞癌、鳞状细胞癌、葡萄状肉瘤(胚胎性横纹肌肉瘤)、输卵管(癌)以及与女性生殖器官相关的其他部位;胎盘、阴茎、前列腺、睾丸以及与男性生殖器官相关的其他部位;血液系统,例如血液(髓系白血病[急性和慢性]、急性淋巴细胞白血病、慢性淋巴细胞白血病、骨髓增生性疾病、多发性骨髓瘤、骨髓增生异常综合征)、霍奇金氏病、非霍奇金氏淋巴瘤[恶性淋巴瘤];口腔,例如唇、舌、牙龈、口底、上颚以及口腔的其他部分、腮腺以及唾液腺的其他部分、扁桃体、口咽、鼻咽、梨状窝、下咽部、以及唇部、口腔和咽部的其他部位;皮肤,例如恶性黑素瘤、皮肤黑色素瘤、基底细胞癌、鳞状细胞癌、卡波西肉瘤、痣发育不良痣、脂肪瘤、血管瘤、皮肤纤维瘤和瘢痕疙瘩;肾上腺:神经母细胞瘤;以及其他组织,包含结缔组织和软组织、腹膜后和腹膜、眼睛、眼内黑素瘤和附件、乳腺、头或/和颈、肛区、甲状腺、甲状旁腺、肾上腺以及其他内分泌腺和相关结构,继发性及未特指的恶性淋巴结肿瘤、呼吸系统和消化系统的继发性恶性肿瘤以及其他部位的继发性恶性肿瘤。
[0360]
更具体地,在本文中与根据本文所提及的实施例中任一者所述的药物组合物结合使用的癌症的实例包括选自以下各项的癌症:肺癌(nsclc和sclc)、头颈癌、卵巢癌、结肠癌、直肠癌、前列腺癌、肛周、胃癌、乳腺癌、肾癌或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、非霍奇金氏淋巴瘤、脊髓轴肿瘤或上述癌症中的一种或多种的组合。
[0361]
在一些更特定的实施例(实施例72)中,根据本文所提及的实施例中任一者所述的药物组合物可用于治疗癌症,所述癌症包含spitz黑色素瘤、神经浸润、肺大细胞神经内分泌癌、子宫癌、幼年乳腺癌、鼻咽癌、腺样囊性癌、甲状腺髓样癌、唾液腺癌、先天性婴儿纤维肉瘤、中胚层性肾瘤、食道癌(鳞状细胞癌)、弥漫性大b细胞淋巴瘤、甲状腺乳头状癌和涎腺分泌性癌。
[0362]
在一些其他实施例(实施例73)中,本发明提供了用于治疗由蛋白激酶活性失调引起和/或与之相关的疾病的方法,这些蛋白激酶特别是plk家族、不同同种型的蛋白激酶c、met、pak-4、pak-5、zc-1、stlk-2、ddr-2、aurora 1、aurora 2、bub-1、chk1、chk2、her2、raf1、mek1、mapk、egf-r、pdgf-r、fgf-r、flt3、jak2、igf-r、alk、pi3k、weel激酶、src、abl、akt、mapk、ilk、mk-2、ikk-2、cdc7、nek、cdk/细胞周期蛋白激酶家族,更特别是aurora 2、
igf-1r和alk活性以及ros1活性,并且更特别是alk活性和/或ros1活性,该方法包含向有此需要的哺乳动物施用有效量的根据本文所提及的实施例中任一者所述的药物组合物。
[0363]
本文公开的其他实施例(实施例74)涉及治疗由选自癌症和细胞增殖性病症的蛋白激酶活性失调引起和/或与之相关的疾病。
[0364]
特定实施例(实施例75)提供了治疗特定类型癌症的方法,所述癌症包含癌、鳞状细胞癌、髓系或淋巴系造血肿瘤、间质源肿瘤、中枢和周围神经系统肿瘤、黑色素瘤、精原细胞瘤、畸胎癌、骨肉瘤、着色性干皮病、血管肉瘤、胶质母细胞瘤、胆管癌、炎性肌纤维母细胞瘤、上皮样恶性血管内皮瘤、星形细胞瘤、脑膜瘤、血管肉瘤、上皮样血管内皮瘤、角化棘皮瘤、甲状腺滤泡癌、卡波西肉瘤和胰腺癌。
[0365]
本文公开的特定实施例(实施例76)涉及治疗特定类型的癌症,所述癌症诸如但不限于乳腺癌、肺癌、结肠直肠癌、前列腺癌、卵巢癌、子宫内膜癌、胃癌、肾透明细胞癌、浸润性导管癌(乳腺)、葡萄膜黑色素瘤、多发性骨髓瘤、横纹肌肉瘤、尤文氏肉瘤、卡波西肉瘤、胰腺癌和髓母细胞瘤。
[0366]
特定实施例(实施例77)提供了治疗alk 间变性大细胞淋巴瘤(alcl)的方法以及其中alk活性可能发挥作用的可能的其他适应症,如神经母细胞瘤、横纹肌肉瘤、胶质母细胞瘤、炎性肌纤维母细胞瘤以及某些种类的黑色素瘤、乳腺癌、尤文氏肉瘤、视网膜母细胞瘤和非小细胞肺癌(nsclc)。
[0367]
特定实施例(实施例78)提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1活性的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用根据本文所提及的实施例中任一者所述的药物组合物来进行。
[0368]
特定实施例(实施例79)提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1活性的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用根据本文所提及的实施例中任一者所述的药物组合物来进行。在一些实施例中,提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1活性的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。
[0369]
特定实施例(实施例80)提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,alk、ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,alk、ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。
[0370]
特定实施例(实施例81)提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1活性的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1活性的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1活性的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。
[0371]
特定实施例(实施例82)提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,alk、ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。
[0372]
特定实施例(实施例83)提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。
[0373]
特定实施例(实施例84)提供了治疗与ros1下调缺陷相关的胰腺癌、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述与ros1下调缺陷相关的胰腺癌的方法,所述ros1下调缺陷为例如无效突变诸如ros1缺失,该方法通过识别受试者的癌症或癌前胰腺细胞中的ros1下调缺陷例如无效突变诸如ros1缺失并且向受试者施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗与ros1下调缺陷相关的胰腺癌、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述与ros1下调缺陷相关
的胰腺癌的方法,所述ros1下调缺陷为例如无效突变诸如ros1缺失,该方法通过识别受试者的癌症或癌前胰腺细胞中的ros1下调缺陷例如无效突变诸如ros1缺失并且向受试者施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗与ros1下调缺陷相关的胰腺癌、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述与ros1下调缺陷相关的胰腺癌的方法,所述ros1下调缺陷为例如无效突变诸如ros1缺失,该方法通过识别受试者的癌症或癌前胰腺细胞中的ros1下调缺陷例如无效突变诸如ros1缺失并且向受试者施用如本文所提供的药物组合物来进行。
[0374]
特定实施例(实施例85)提供了治疗与alk、ros1、trka、trkb或trkc下调缺陷相关的胰腺癌、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述与alk、ros1、trka、trkb或trkc下调缺陷相关的胰腺癌的方法,所述alk、ros1、trka、trkb或trkc下调缺陷为例如无效突变诸如alk、ros1、trka、trkb或trkc缺失,该方法通过识别受试者的癌症或癌前胰腺细胞中的alk、ros1、trka、trkb或trkc下调缺陷例如无效突变诸如alk、ros1、trka、trkb或trkc缺失并且向受试者施用如本文所提供的药物组合物来进行。
[0375]
特定实施例(实施例86)提供了治疗选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症的方法,在所述选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症中,alk、ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗胰腺癌以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述胰腺癌以及可能的其他适应症的方法,在所述胰腺癌以及可能的其他适应症中,ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。
[0376]
特定实施例(实施例87)提供了治疗选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症的方法,在所述选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症中,ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症的方法,在所述选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症中,ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症、减轻其症状、改善其症状、延缓其发作或以其
他方式通过药物解决所述选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症的方法,在所述选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状以及可能的其他适应症中,ros1、trka、trkb或trkc活性或其组合的调节缺陷或其上调、误调节或缺失可能发挥作用,该方法通过施用如本文所提供的药物组合物来进行。
[0377]
特定实施例(实施例88)提供了治疗选自与ros1下调缺陷相关的非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述选自与ros1下调缺陷相关的非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状的方法,所述ros1下调缺陷为例如无效突变诸如ros1缺失,该方法通过识别受试者的癌症或癌前细胞中的ros1下调缺陷例如无效突变诸如ros1缺失并且向受试者施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗选自与ros1下调缺陷相关的非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述选自与ros1下调缺陷相关的非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状的方法,所述ros1下调缺陷为例如无效突变诸如ros1缺失,该方法通过识别受试者的癌症或癌前细胞中的ros1下调缺陷例如无效突变诸如ros1缺失并且向受试者施用如本文所提供的药物组合物来进行。在一些实施例中,提供了治疗选自与ros1下调缺陷相关的非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述选自与ros1下调缺陷相关的非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状的方法,所述ros1下调缺陷为例如无效突变诸如ros1缺失,该方法通过识别受试者的癌症或癌前细胞中的ros1下调缺陷例如无效突变诸如ros1缺失并且向受试者施用如本文所提供的药物组合物来进行。
[0378]
特定实施例(实施例89)提供了治疗选自与alk、ros1、trka、trkb或trkc下调缺陷相关的非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状、减轻其症状、改善其症状、延缓其发作或以其他方式通过药物解决所述选自与alk、ros1、trka、trkb或trkc下调缺陷相关的非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌的病状的方法,所述alk、ros1、trka、trkb或trkc下调缺陷为例如无效突变诸如alk、ros1、trka、trkb或trkc缺失,该方法通过识别受试者的癌症或癌前细胞中的alk、ros1、trka、trkb或trkc下调缺陷例如无效突变诸如alk、ros1、trka、trkb或trkc缺失并且向受试者施用如本文所提供的药物组合物来进行。
[0379]
特定实施例(实施例90)提供了治疗有此需要的受试者的癌症的方法,该方法包含通过向受试者施用如本文所提供的药物组合物来抑制alk、ros1、trka、trkb或trkc活性或其组合,该药物组合物包含有效量的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺。
[0380]
特定实施例(实施例91)提供了治疗受试者的非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌或结肠直肠癌的方法,该方法包含向所述受试者施用如本文所提供的药物组合物,该药物组合物包含有效量的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺。
[0381]
特定实施例(实施例92)提供了治疗受试者的肿瘤的方法,所述方法包含向受试者施用如本文所提供的药物组合物,该药物组合物包含有效量的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺。
[0382]
特定实施例(实施例93)提供了本文所述的任何方法,其中该受试者或受试者患有癌症,并且该癌症选自非小细胞肺癌、甲状腺乳头状癌、神经母细胞瘤、胰腺癌和结肠直肠癌中的至少一种。一些实施例提供了本文所述的任何方法,其中该受试者或受试者患有非小细胞肺癌。一些实施例提供了本文所述的任何方法,其中该受试者或受试者患有甲状腺乳头状癌。一些实施例提供了本文所述的任何方法,其中该受试者或受试者患有神经母细胞瘤。一些实施例提供了本文所述的任何方法,其中该受试者或受试者患有胰腺癌。一些实施例提供了本文所述的任何方法,其中该受试者或受试者患有结肠直肠癌。
[0383]
在本文提供的方法的一些情况下,癌症选自选自下组,该组由以下各项组成:间变性大细胞淋巴瘤(alcl)、结肠直肠癌(crc)、胆管癌、胃癌、胶质母细胞瘤(gbm)、平滑肌肉瘤、黑色素瘤、非小细胞肺癌(nsclc)、鳞状细胞肺癌、神经母细胞瘤(nb)、卵巢癌、胰腺癌、前列腺癌、甲状腺髓样癌、乳腺癌和甲状腺乳头状癌。
[0384]
特定实施例(实施例94)涉及根据本文所提及的实施例中任一者所述的药物组合物,其用作药物。一些实施例涉及本文提供的任何药物组合物在制备用于治疗异常细胞生长的药物中的用途。
[0385]
在一些实施例中,提供了本文实施例中任一者所述的药物组合物,该药物组合物包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺,其中所述药物组合物以约300mg/m2所述n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺的总剂量施用于空腹或餐后状态下的受试者时,在所述受试者中提供了药代动力学特征,其中所述n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-吡喃-4-基氨基)-苯甲酰胺在所述受试者的血浆中的t
max
在向所述受试者施用所述药物组合物后约2小时与约5小时之间,或在约2.5小时与约4.7小时之间,或在约2.4小时与约4.7小时之间,或在约2.6小时与约4.8小时之间。
[0386]
在特定实施例(实施例95)中,本发明提供了治疗患有癌症的受试者的方法,该方法包含向受试者施用如本文所述的药物组合物。
[0387]
在另一个实施例(实施例96)中,本发明提供了治疗患有alk、ros1、trka、trkb或trkc阳性癌症或其组合的受试者的方法,该方法包含向受试者施用如本文所述的药物组合物。
[0388]
在另一个实施例(实施例97)中,本发明提供了治疗患有alk阳性癌症的受试者的方法,该方法包含向受试者施用如本文所述的药物组合物。
[0389]
在另一个实施例(实施例98)中,本发明提供了治疗患有ros1、trka、trkb或trkc阳性癌症或其组合的受试者的方法,该方法包含向受试者施用如本文所述的药物组合物。
[0390]
在另一个实施例中,本发明提供了治疗患有ros1阳性癌症的受试者的方法,该方法包含向受试者施用如本文所述的药物组合物。
[0391]
在另一个实施例(实施例99)中,本发明提供了治疗患有trka、trkb或trkc阳性癌症或其组合的受试者的方法,该方法包含向受试者施用如本文所述的药物组合物。
[0392]
在另一个实施例中,本发明提供了治疗患有trka阳性癌症的受试者的方法,该方
法包含向受试者施用如本文所述的药物组合物。
[0393]
在另一个实施例(实施例100)中,本发明提供了治疗患有trkb阳性癌症的受试者的方法,该方法包含向受试者施用如本文所述的药物组合物。
[0394]
在另一个实施例(实施例101)中,本发明提供了治疗患有trkc阳性癌症的受试者的方法,该方法包含向受试者施用如本文所述的药物组合物。
[0395]
[在另一个实施例(实施例102)中,本发明提供了一种如本文所述的药物组合物,该药物组合物用于治疗患有癌症的受试者的方法中。
[0396]
在另一个实施例(实施例103)中,本发明提供了一种如本文所述的药物组合物,该药物组合物用于治疗患有alk、ros1、trka、trkb或trkc阳性癌症或其组合的受试者的方法中。
[0397]
在另一个实施例(实施例104)中,本发明提供了一种如本文所述的药物组合物,该药物组合物用于治疗患有alk阳性癌症的受试者的方法中。
[0398]
在另一个实施例(实施例105)中,本发明提供了一种如本文所述的药物组合物,该药物组合物用于治疗患有ros1、trka、trkb或trkc阳性癌症或其组合的受试者的方法中。
[0399]
在另一个实施例(实施例106)中,本发明提供了一种如本文所述的药物组合物,该药物组合物用于治疗患有ros1阳性癌症的受试者的方法中。
[0400]
在另一个实施例(实施例107)中,本发明提供了一种如本文所述的药物组合物,该药物组合物用于治疗患有trka、trkb或trkc阳性癌症或其组合的受试者的方法中。
[0401]
在另一个实施例(实施例108)中,本发明提供了一种如本文所述的药物组合物,该药物组合物用于治疗trka阳性癌症的受试者的方法中。
[0402]
在另一个实施例(实施例109)中,本发明提供了一种如本文所述的药物组合物,该药物组合物用于治疗trkb阳性癌症的受试者的方法中。
[0403]
在另一个实施例(实施例110)中,本发明提供了一种如本文所述的药物组合物,该药物组合物用于治疗trkc阳性癌症的受试者的方法中。
[0404]
在另一个实施例(实施例111)中,本发明提供了如本文所述的药物组合物用于制备药物的用途,该药物用于治疗癌症。
[0405]
在另一个实施例(实施例112)中,本发明提供了如本文所述的药物组合物用于制备药物的用途,该药物用于治疗alk、ros1、trka、trkb或trkc阳性癌症或其组合。
[0406]
在另一个实施例(实施例113)中,本发明提供了如本文所述的药物组合物用于制备药物的用途,该药物用于治疗alk阳性癌症。
[0407]
在另一个实施例(实施例114)中,本发明提供了如本文所述的药物组合物用于制备药物的用途,该药物用于治疗ros1、trka、trkb或trkc阳性癌症或其组合。
[0408]
在另一个实施例(实施例115)中,本发明提供了如本文所述的药物组合物用于制备药物的用途,该药物用于治疗ros1阳性癌症。
[0409]
在另一个实施例(实施例116)中,本发明提供了如本文所述的药物组合物用于制备药物的用途,该药物用于治疗trka、trkb或trkc阳性癌症或其组合。
[0410]
在另一个实施例(实施例117)中,本发明提供了如本文所述的药物组合物用于制备药物的用途,该药物用于治疗trka阳性癌症。
[0411]
在另一个实施例(实施例118)中,本发明提供了如本文所述的药物组合物用于制备药物的用途,该药物用于治疗trkb阳性癌症。
[0412]
在另一个实施例(实施例119)中,本发明提供了如本文所述的药物组合物用于制备药物的用途,该药物用于治疗trkc阳性癌症。
[0413]
本发明的其他特征和实施例根据以下实例将变得显而易见,提供这些实例的目的在于说明本发明而非限制其预期范围。
[0414]
实例1:制剂a
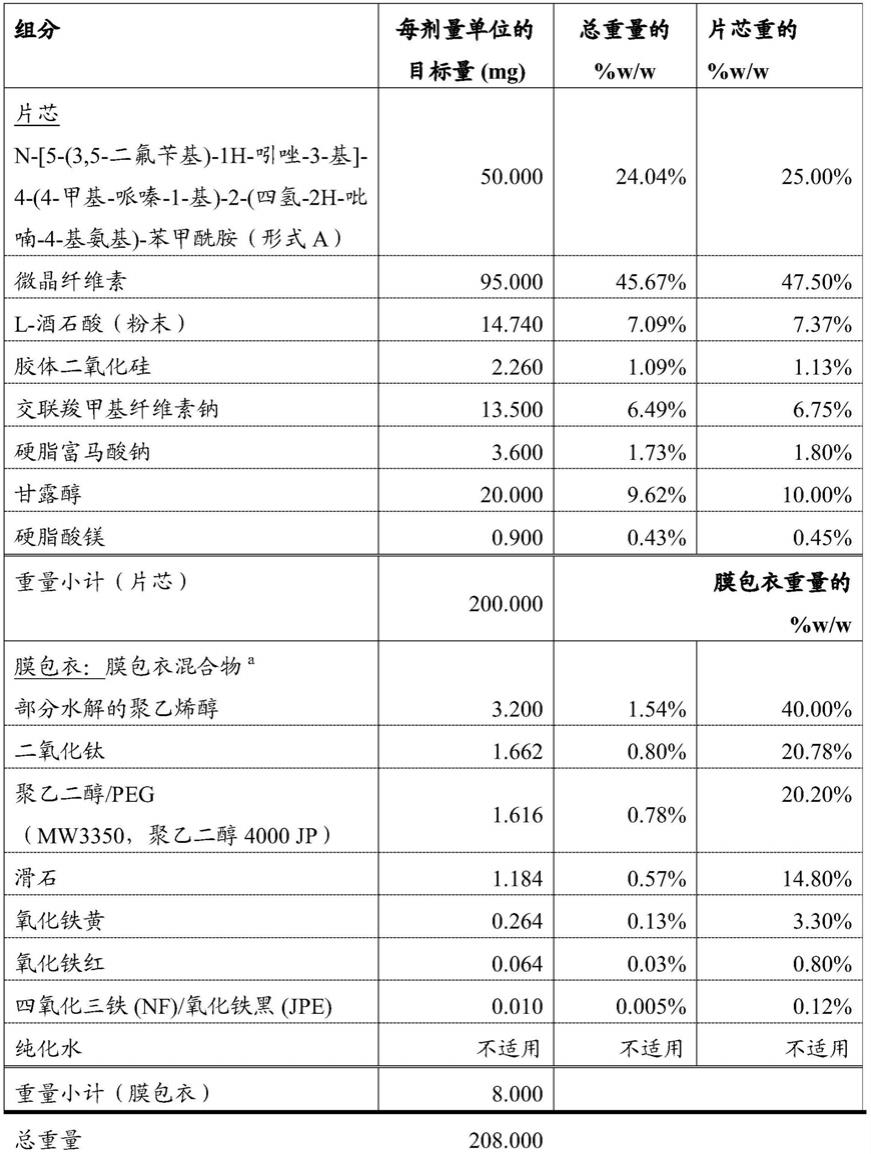
[0415]
包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的药物组合物的制备方法如下。
[0416]
表1:制剂a的组成
[0417]
[0418]a可使用colocorn的市售膜包衣混合物(例如,opadry)。
[0419]
b纯化水用于水性膜包衣;其在加工过程中基本去除。
[0420]
生产一个8kg批次。称取api、纤维素、酒石酸、胶体二氧化硅(第1部分)和交联羧甲基纤维素钠(第1部分)并且转移到合适的20l金属桶中,以20upm的速度混合3min。然后将混合物手动通过0.8mm筛后加入50l容器中。然后在15upm下额外混合5min。共混-过筛-共混方法对于确保不存在团聚体是必要的。压制小片尤其重要。
[0421]
将硬脂富马酸钠手动通过0.5mm筛,并且加入粉末混合物中。然后在15upm下混合5min。
[0422]
然后,使用碾压机进行干法制粒。粒度增加,并且流动性得到改善。将制粒得到的产物在20l金属桶中以20upm混合1min。将甘露醇、交联羧甲基纤维素钠(第2部分)和交替二氧化硅(第2部分)手动通过0.8mm筛,并且加入制粒机中,然后在金属桶中以20upm共混3min。这些赋形剂有助于稳定压制过程以及片剂快速崩解。然后使用0.5mm筛手动筛选硬脂酸镁,并且将其加入制粒机中,然后在金属桶中以20upm共混3min。在标准制造压片机(fette)上使用多尖端小片工具进行压片。
[0423]
对于制剂a和b,从共混到压片的步骤相同。然后使用wurster装置在流化床干燥器中以1kg的批量对内核进行不同的包衣。对于制剂a,在配备螺旋桨搅拌器的1l钢制烧杯中,将混合物以450upm的速度在纯化水中悬浮至少60min,以制备包衣悬浮液。在开始该过程之前,使悬浮液过筛(0.5mm)。在包衣过程中,将悬浮液用桨叶搅拌器以75upm的速度搅拌。
[0424]
实例2:制剂b
[0425]
包含n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的药物组合物的制备方法如下。
[0426]
表2:制剂b的组成
2h-吡喃-4-基氨基)-苯甲酰胺的药物组合物的制备方法如下。
[0434]
表3:制剂c的组成
[0435][0436]
制剂c以实验室规模(约60g)制备。将恩曲替尼、微晶纤维素、酒石酸、胶体二氧化硅(第1部分)和交联羧甲基纤维素钠(第1部分)在0.4l容器中共混3min。然后使其通过0.9mm筛。过筛后,进行第二次共混(3min)。然后使硬脂富马酸钠通过0.5mm筛,随后共混5min。然后通过实施冲击实验来模拟辊压。此时已经观察到粘附。将小块压实后,使用conidur 0.8mm筛进行研磨。将交联羧甲基纤维素钠(第2部分)和胶体二氧化硅(第2部分)通过0.5mm筛后加入。
[0437]
实例4:制剂d
[0438]
本实例按照实例1的片芯的组成制得,其中将n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺形式a用形式c替换。该制剂的组成如表4所示。
[0439]
表4:制剂d的组成
[0440][0441]
实例5:制剂e
[0442]
制剂e为不含酸化剂的制剂。制剂e的组成如表5所示。制剂e可按照wo2019018570制得。
[0443]
表5:制剂e的组成
[0444][0445]
实例6:制剂f
[0446]
制剂f是最初针对小儿患者设计的无定形制剂。制剂f的组成如表6所示。制剂f可按照wo2019077506制得。
[0447]
表6:制剂f的组成
[0448][0449]
制剂f已被证明是不稳定的。
[0450]
对氢键的红外评估显示,没有证据表明无定形分散体中的氢键相互作用产生额外的稳定性。除表6中提及的代表载药量为80%的恩曲替尼与共聚维酮的制剂以外,还包括载药量为90%的恩曲替尼与共聚维酮的无定形混合物。
[0451]
afm:在80%和90%的载药量下获得api与共聚维酮的均匀的无定形混合物。如图6所示,两种无定形固体分散体均在40℃/75%相对湿度下可稳定数小时,但在加速强制降解储存条件下(40℃/75%相对湿度,超过14天)发生相分离。
[0452]
实例7:制剂g
[0453]
制剂g是一种成人制剂,其将被封装在hpmc 0号胶囊中。制剂g的组成如表7所示。制剂g可按照wo2019018570制得。
[0454]
表7:制剂g的组成
[0455][0456][0457]
实例8:制剂a、b和g的溶出度
[0458]
使用usp i型篮法装置在下列条件下测试制剂a、b和g的药物释放,其中水浴温度为37℃,并且在300nm下进行uv检测。使用本文所述的条件对这些制剂进行测试,并且表8中提供了溶出结果,其中列出了平均药物释放百分比(基于溶媒中包含的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的实测量相比于胶囊或片剂中包含的n-[5-(3,5-二氟苄基)-1h-吲唑-3-基]-4-(4-甲基-哌嗪-1-基)-2-(四氢-2h-吡喃-4-基氨基)-苯甲酰胺的总量得到)。
[0459]
表8:制剂a、b和g的溶出度
[0460][0461]
本文引用的所有参考文献(包括但不限于已公开和未公开的申请、专利和文献)均通过引用整体并入本文,并据此构成本说明书的一部分。在以引用方式并入本文的出版物和专利或专利申请与本说明书中包含的公开相矛盾的范围内,本说明书旨在取代和/或优先于任何此类矛盾的材料。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。