新的癌抗原和方法
发明领域
1.本发明涉及用于治疗或预防癌症、尤其用于治疗或预防黑素瘤(例如皮肤黑素瘤或葡萄膜黑素瘤)的抗原性多肽和相应的多核苷酸。本发明尤其进一步涉及包含所述核酸和多肽的药物组合物和免疫原性组合物、加载所述多肽和多核苷酸和/或受其刺激的免疫细胞、对所述多肽特异的抗体和以识别所述多肽的分子基因工程化的(自体或其他)细胞。
2.发明背景
3.作为针对致病微生物的正常免疫监视的部分,全部细胞均降解胞内蛋白以产生肽,所述肽加载到表达于全部细胞的表面上的主要组织相容性复合体(mhc)i类分子。大部分衍生自宿主细胞的这些肽被视为自我并且对适应性免疫系统保持不可见。然而,外来(非自我)的肽能够刺激初始cd8 t细胞扩充,所述细胞编码紧密结合mhc i-肽复合体的t细胞受体(tcr)。这种扩充的t细胞群体可以产生效应子cd8 t细胞(包括细胞毒性t-淋巴细胞-ctls),其可以消除加外来抗原标签的细胞,以及记忆cd8 t细胞,其可以在加外来抗原标签的细胞稍后在动物的一生中出现时再扩充。
4.mhc ii类分子,其表达正常情况下限于专业性抗原呈递细胞(apcs)如树状细胞(dcs),通常加载已经自细胞外环境内化的肽。在各种因子(包括t细胞黏附分子(cd54、cd48)和共刺激分子(cd40、cd80、cd86))存在下,来自初始cd4 t细胞的互补性tcr与mhc ii-肽复合体的结合使成熟cd4 t细胞诱导成效应细胞(例如,th1、th2、th17、t
fh
、t
reg
细胞)。这些效应子cd4 t-细胞可以促进b细胞分化成分泌抗体的浆细胞以及促进抗原特异性cd8 ctl分化,因而有助于诱导针对外来抗原的适应性免疫应答,所述适应性免疫应答包括短期效应子功能和更长期的免疫记忆。dc可以通过输送外源衍生的抗原(如从病原体或肿瘤细胞释放的肽或蛋白质)到其mhc i分子上,执行肽抗原的交叉呈递过程,有助于通过提供刺激初始cd8 t细胞扩充的旁路途径产生免疫记忆。
5.免疫记忆(特别是抗原特异性b细胞/抗体和抗原特异性ctl)是控制微生物感染中的关键角色,并且已经利用免疫记忆开发了预防重要致病微生物所致疾病的众多疫苗。还已知免疫记忆在控制肿瘤形成中发挥关键作用,但几乎尚未开发有效的癌疫苗。
6.癌是第二大主导病因,占全球所有死亡例的1/6。2015年,癌症所致的8.8百万例死亡当中,夺去大部分生命的癌来自肺癌(169万例)、肝癌(788,000例)、结直肠癌(774,000例)、胃癌(754,000例)和乳腺癌(571,000例)。估计癌症在2010年的经济影响是1.16万亿美元,并且接下来的二十年期间预计新病例数升高大约70%(2017年世界卫生组织癌症现实)。
7.当前的皮肤黑素瘤疗法各异且高度地依赖于肿瘤位置和疾病阶段。主要的非转移性黑素瘤疗法是手术摘除肿瘤和周围组织。晚期黑素瘤可能需要包括淋巴结清扫术、放疗或化疗的治疗。免疫检查点阻断策略,包括使用靶向负向免疫调节物如pd-1/pd-l1和ctla4的抗体,最近已经给多种恶性肿瘤(包括黑素瘤)的治疗带来革命(ribas,a.和wolchok,j.d.(2018)science,359:1350
–
1355)。异乎寻常的检查点阻断疗法价值和其临床获益与患者对其自身癌抗原的适应性免疫应答(基于免疫应答的特异性t细胞)的充分认可联系已经
给研究有效的癌疫苗、疫苗模式和癌疫苗抗原带来革命。
8.人内源逆转录病毒(herv)是外源性传染性逆转录病毒的祖先胚系整合物的残余物。herv属于一组内源性逆转录元件,其以存在侧置于病毒基因组的长末端重复序列(ltr)为特征。这个组还包括哺乳动物表观ltr逆转座子(malr)并且因此统称称作ltr元件(此处统称为erv以意指全部ltr元件)。erv构成可观比例的哺乳动物基因组(8%),并且可以基于序列同源性,分组成大约100个家族。许多erv序列编码缺陷性前病毒,所述前病毒共有由旁侧有ltr的gag、pro、pol和env基因组成的原型逆转录病毒基因组结构。一些完好的erv orf产生与外源性传染性逆转录病毒如hiv-1编码的蛋白质共有诸特征的逆转录病毒蛋白质。这类蛋白质可以充当诱导强力免疫应答的抗原(hurst和magiorkinis,2015,j.gen.virol 96:1207-1218),显示erv编码的多肽可能逃避t细胞受体选择过程与b细胞受体选择过程和中央耐受性与外周耐受性。针对erv产物的免疫反应性可以在感染或癌症中自发地出现,并且erv产物已经作为一些自身免疫疾病的病因牵涉(kassiotis和stoye,2016,nat.rev.immunol.16:207-219)。
9.归因于进化期间突变和重组事件积累,大部分erv已经丧失其一些或全部基因的有功能可读框并因此丧失其产生传染性病毒的能力。然而,这些erv元件如同其他基因那样维持在种系dna中并且仍然具有从其至少一些基因产生蛋白质的潜力。实际上,herv编码的蛋白质已经在多种的人类癌症中检出。例如,herv-k env基因即rec和np9的剪接变体只存在于恶性睾丸生殖细胞中而不存在于健康细胞中(ruprecht等人,2008,cell mol life sci 65:3366-3382)。如与健康组织相比,还已经在多种癌如那些前列腺癌中观察到升高水平的herv转录物(wang-johanning,2003,cancer 98:187-197;andersson等人,1998,int.j.oncol,12:309-313)。另外,已经显示herv-e和herv-h的过量表达有免疫抑制性,这还可能促成癌形成(mangeney等人,2001,j.gen.virol.82:2515-2518)。然而,herv可能促成癌形成或致病性的确切机理仍是未知的。
10.除对周围的相邻宿主基因的表达解除管制之外,erv调节元件的活性和转座至新基因组部位可能导致产生新转录物,其中某些可以具有致瘤特性(babaian和mager,mob.dna,2016;lock等人,pnas,2014,111:3534-3543)。
11.广泛类型的疫苗模式已知。一个充分描述的方案包括向受试者直接递送抗原性多肽,以便升高免疫应答(包括b细胞反应和t细胞反应)和刺激免疫记忆。备选地,可以将多核苷酸借助载体施用至受试者,从而多核苷酸编码的免疫原性多肽在体内表达。已经充分探索使用病毒载体(例如腺病毒载体)在针对癌症的预防性接种和治疗性处理策略中递送抗原(wold等人current gene therapy,2013,adenovirus vectors for gene therapy(基因治疗的腺病毒载体),vaccination and cancer gene therapy,13:421
–
433)。免疫原性肽、多肽或编码它们的多核苷酸也可以用来加载患者衍生的抗原呈递细胞(apc),后者随后可以作为激发治疗性或预防性免疫应答的疫苗输注至受试者中。这种方法的示例是provenge,其目前是fda核准的唯一抗癌疫苗。
12.也可以通过使用癌抗原产生多种非疫苗治疗性模式,在治疗和预防癌症中利用这些癌抗原。这些治疗药分成两个不同类别:1)抗原结合性生物制品,2)过继细胞治疗药。
13.抗原结合性生物产品一般由识别抗原修饰的癌细胞并且促进癌细胞摧毁的多价工程化多肽组成。这些生物制品的抗原结合性要素可以由基于tcr的生物制品组成,所述生
物制品包括但不限于通过各种技术产生的tcr、高亲和力tcr和tcr拟似物(包括基于单克隆抗体技术的那些)。这类多价生物制品的溶细胞部分可以由促进靶向和活化免疫细胞的细胞毒性化学物、生物毒素、导引基序和/或免疫刺激基序组成,前述任一者促进治疗性摧毁肿瘤细胞。
14.过继细胞疗法可以基于患者的自身t细胞,其中取出所述t细胞并用疫苗抗原制剂离体刺激(在其他因子(包括细胞组分和非细胞组分)存在或不存在时与t细胞一起培养)(yossef等人jci insight.2018oct 4;3(19).pii:122467.doi:10.1172/jci.insight.122467)。备选地,过继细胞疗法可以基于已经过人为工程化以表达识别癌抗原的抗原结合多肽的细胞(包括患者衍生或非患者衍生的细胞)。这些抗原结合多肽属于上文对抗原结合性生物制品所述相同的类别。因此,可以将已经过遗传操作以表达癌抗原结合性多肽的淋巴细胞(自体或非自体)施用至患者,作为治疗其癌症的过继细胞疗法。
15.使用erv衍生的抗原升高针对癌症的有效免疫反应已经在鼠的癌症模型中显示出促进肿瘤消退和预后更有利的有前景结果(kershaw等人,2001,cancer res.61:7920-7924;slansky等人,2000,immunity 13:529-538)。因此,已经在人类中构思了herv抗原中心免疫治疗试验(sacha等人,2012,j.immunol 189:1467-1479),不过进展已经受限,部分地归因于已鉴定的肿瘤特异性erv抗原的重度限制。
16.wo 2005/099750在针对传染性病原体的现有疫苗中鉴定了锚定的序列,所述序列共同之处在于升高针对herv-k mel肿瘤抗原的交叉反应免疫应答并且赋予对抗黑素瘤的保护。
17.wo 00/06598涉及鉴定在黑素瘤中偏好表达的herv-avl3-b肿瘤相关基因,和诊断和治疗以表达所述基因为特征的病状的方法和产品。
18.wo 2006/119527提供从黑素瘤相关的内源逆转录病毒(merv)衍生的抗原性多肽,及其检测和诊断黑素瘤以及疾病预后的用途。还公开了抗原性多肽作抗癌疫苗的用途。
19.wo 2007/137279公开了用于检测、预防和治疗herv-k 癌的方法和组合物,例如使用herv-k 结合抗体预防或抑制癌细胞增殖。
20.wo 2006/103562公开了一种用于治疗或预防癌症的方法,其中表达来自herv-k的env基因的免疫抑制性np9蛋白。该发明还涉及药物组合物,所述药物组合物包含能够抑制所述蛋白质的活性的核酸或抗体,或能够诱导针对所述蛋白质的免疫应答的免疫原或疫苗组合物。
21.wo 2007/109583提供通过以下方式预防或治疗哺乳动物受试者中肿瘤性疾病的组合物和方法:提供包含富集的免疫细胞群体的组合物,所述免疫细胞群体与肿瘤细胞上的herv-e抗原有反应性。
22.humer j等人,2006,canc.res.,66:1658-63鉴定了从黑素瘤相关的内源逆转录病毒衍生的黑素瘤标志物。
23.需要进一步鉴定可以用于免疫治疗癌症、特别是黑素瘤、尤其皮肤黑素瘤和葡萄膜黑素瘤的herv相关抗原性序列。
24.发明简述
25.发明人已经惊讶地发现某些rna转录物,它们包含ltr元件,所述转录物在皮肤黑素瘤细胞中以高水平存在,但在正常的健康组织中不可检出或以很低水平存在(参见实施
例1)。这类转录物在本文中称作癌特异性跨ltr元件转录物(clt)。进一步地,发明人已经显示,由这些clt编码的潜在多肽序列(即,可读框(orf))的子集在癌细胞中翻译、由抗原加工装置的组分加工并且在肿瘤组织中存在的细胞的表面上与i类人白细胞抗原(hla i类)分子缔合时呈递(参见实施例2)。根据事实本身,这些结果显示这些多肽(本文中称作clt抗原)有抗原性。因此,clt抗原的癌细胞呈递预计使这些细胞易受携带clt抗原的同族t细胞受体(tcr)的t细胞清除,并且扩充携带这些同族tcr的t细胞的基于clt抗原的接种方法/治疗方案预计激发针对癌细胞(和含有它们的肿瘤)、特别是黑素瘤、尤其皮肤黑素瘤肿瘤的免疫应答。来自黑素瘤受试者的t细胞的确与衍生自本文公开的clt抗原的肽有反应性(参见实施例3)。发明人已经证实,对clt抗原特异的t细胞并未因中央耐受性从正常受试者的t细胞库删除(参见实施例4)。最后,qrt-pcr研究已经确认,如与非黑素瘤对照细胞系相比,clt在提取自黑素瘤肿瘤组织的rna中特异性表达(参见实施例5)。
26.发明人还具有惊讶地发现,某些编码clt抗原及在皮肤黑素瘤中过量表达的clt还在葡萄膜黑素瘤中过量表达。这些clt编码的clt抗原多肽序列预计针对葡萄膜黑素瘤细胞和含有它们的肿瘤激发免疫应答。
27.作为本发明主题的clt和clt抗原不是可以从癌基因组图集中存在的已知肿瘤基因组序列轻易导出的典型序列。clt是因受erv源转录控制序列驱动的复杂转录和剪接事件产生的转录物。由于clt以高水平表达并且由于clt抗原多肽序列不是正常的人蛋白质序列,故而预计它们将能够激发强烈的特异性免疫应答并且是因此适于癌症免疫治疗环境下的治疗性用途。
28.可以按几种模式使用在表征肿瘤细胞的高表达转录物中发现的clt抗原,在本发明之前不知所述抗原在人类中存在及产生蛋白质产物。首先,可以将本发明的clt抗原多肽直接输送至受试者,作为针对肿瘤细胞激发治疗性或预防性免疫应答的疫苗。其次,可以将本发明的核酸(其可以经密码子优化以增强其表达编码的clt抗原)直接施用或另外插入用于体内递送的载体中,以在受试者中产生编码的蛋白质产物作为针对肿瘤细胞激发治疗性或预防性免疫应答的疫苗。第三,本发明的多核苷酸和/或多肽可以用来加载患者衍生的抗原呈递细胞(apc),后者随后可以作为激发针对癌细胞的治疗性或预防性免疫应答的疫苗输注至受试者中。第四,本发明的多核苷酸和/或多肽可以用于离体刺激受试者的t细胞,产生刺激的t细胞制备物,这种制备物可以作为治疗癌症的治疗药施用至受试者。第五,识别与mhc i分子复合的clt抗原并且已经过进一步修饰以允许其杀伤(或促进杀伤)癌细胞的生物分子(如t细胞受体(tcr)或tcr拟似物)可以作为治疗癌症的治疗药施用至受试者。第六,可以向(自体或非自体)t细胞引入识别与mhc细胞复合的clt抗原的生物分子的嵌合形式,并且所产生的细胞可以作为治疗癌症的治疗药施用至受试者。下文更详细地描述这些应用和其他应用。
29.因此,本发明尤其提供一种分离的多肽,所述多肽包含选自以下的序列:
30.(a)seq id no.1-8中任一者的序列和
31.(b)(a)的序列的变体;和
32.(c)(a)的序列的免疫原性片段
33.(以下简称为“本发明多肽”)。
34.本发明也提供编码本发明多肽的核酸分子(以下简称为“本发明的核酸”)。
35.本发明的多肽和本发明的核酸,以及本发明的相关方面,预计在一系列实施方案中可用于癌症免疫治疗和预防、尤其黑素瘤免疫治疗和预防,如下文更详细地讨论。
36.附图简述
37.图1-14.上部小图显示肽的提取的ms/ms谱(连同指派的碎片离子),所述肽从患者的肿瘤样品获得,并且下部小图显示指示线形肽序列的位置的波谱呈献,所述线形肽序列已经定位至碎片离子。
38.图1.从患者mel-27的肿瘤样品获得的seq id no.9的肽的波谱。
39.图2.从患者mel-21的肿瘤样品获得的seq id no.10的肽的波谱。
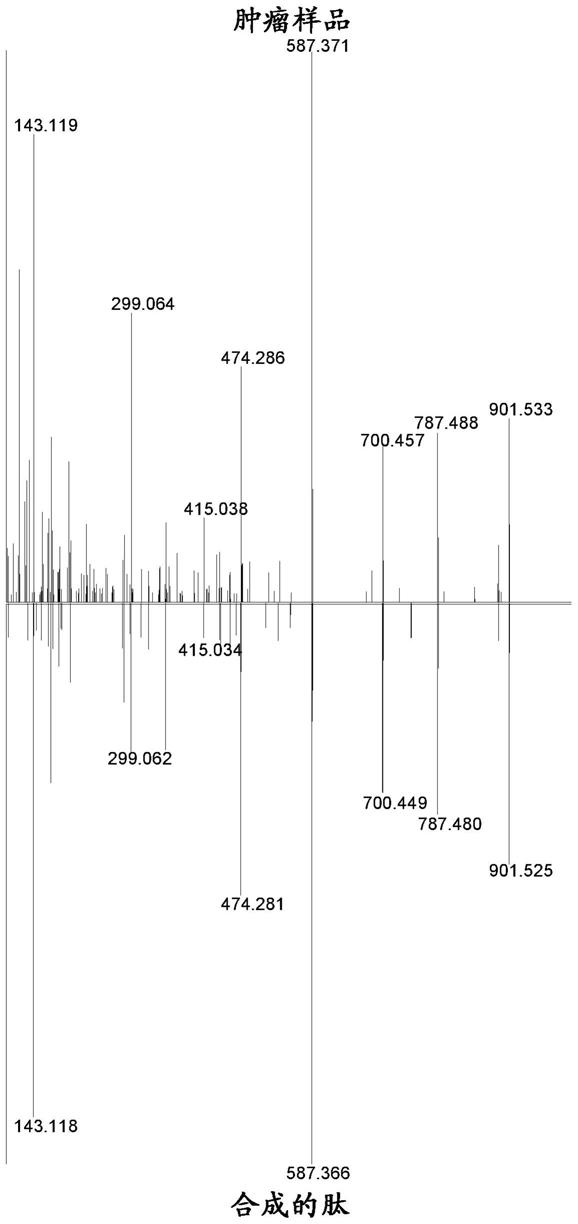
40.图3.从患者mel-41的肿瘤样品获得的seq id no.11的肽的波谱。
41.图4.从患者mel-41的肿瘤样品获得的seq id no.12的肽的波谱。
42.图5.从患者mel-41的肿瘤样品获得的seq id no.13的肽的波谱。
43.图6.从患者mel-41的肿瘤样品获得的seq id no.14的肽的波谱。
44.图7.从患者mel-21的肿瘤样品获得的seq id no.15的肽的波谱。
45.图8.从患者mel-21的肿瘤样品获得的seq id no.16的肽的波谱。
46.图9.从患者mel-21的肿瘤样品获得的seq id no.17的肽的波谱。
47.图10.从患者mel-15的肿瘤样品获得的seq id no.18的肽的波谱。
48.图11.从患者mel-27的肿瘤样品获得的seq id no.19的肽的波谱。
49.图12.从患者mel-27的肿瘤样品获得的seq id no.20的肽的波谱。
50.图13.从患者mel-25的肿瘤样品获得的seq id no.21的肽的波谱。
51.图14.从患者mel-25的肿瘤样品获得的seq id no.22的肽的波谱。
52.图15-28中的每幅图显示从患者肿瘤样品获得的肽的天然ms/ms谱与对应于相同序列的合成肽的天然波谱的比对。
53.图15.从患者mel-27的肿瘤样品获得的seq id no.9的肽的波谱。
54.图16.从患者mel-20的肿瘤样品获得的seq id no.10的肽的波谱。
55.图17.从患者mel-41的肿瘤样品获得的seq id no.11的肽的波谱。
56.图18.从患者mel-41的肿瘤样品获得的seq id no.12的肽的波谱。
57.图19.从患者mel-41的肿瘤样品获得的seq id no.13的肽的波谱。
58.图20.从患者mel-41的肿瘤样品获得的seq id no.14的肽的波谱。
59.图21.从患者mel-21的肿瘤样品获得的seq id no.15的肽的波谱。
60.图22.从患者mel-21的肿瘤样品获得的seq id no.16的肽的波谱。
61.图23.从患者mel-21的肿瘤样品获得的seq id no.17的肽的波谱。
62.图24.从患者mel-15的肿瘤样品获得的seq id no.18的肽的波谱。
63.图25.从患者mel-27的肿瘤样品获得的seq id no.19的肽的波谱。
64.图26.从患者mel-27的肿瘤样品获得的seq id no.20的肽的波谱。
65.图27.从患者mel-25的肿瘤样品获得的seq id no.21的肽的波谱。
66.图28.从患者mel-25的肿瘤样品获得的seq id no.22的肽的波谱。
67.图29.从患者2mt3的肿瘤样品获得的seq id no.15的肽的波谱。
68.图30.从患者2mt4的肿瘤样品获得的seq id no.20的肽的波谱。
69.图31.从患者2mt4的肿瘤样品获得的seq id no.21的肽的波谱。
70.图32显示扩充的、五聚物分选的cd8 t细胞杀伤转染了clt抗原6的可读框(seq id no.6)的caski细胞。
71.图33显示来自正常献血者的针对来自clt抗原1的hla-a*02:01限制肽(seq id no.9)的cd8 t细胞反应。
72.图34显示来自正常献血者的针对来自clt抗原1的hla-a*03:01限制肽(seq id no.10)的cd8 t细胞反应。
73.图35显示来自正常献血者的针对来自clt抗原2的hla-b*07:02限制肽(seq id no.13)的cd8 t细胞反应。
74.图36显示来自正常献血者的针对来自clt抗原3的hla-a*03:01限制肽(seq id no.15)的cd8 t细胞反应。
75.图37显示来自正常献血者的针对来自clt抗原5的hla-a*03:01限制肽(seq id no.18)的cd8 t细胞反应。
76.图38显示来自正常献血者的针对来自clt抗原6的hla-a*02:01限制肽(seq id no.39)的cd8 t细胞反应。
77.图39的小图a至c显示验证在黑素瘤癌细胞系中编码clt抗原2的clt(seq id no.24)、编码clt抗原3的clt(seq id no.25)和编码clt抗原6的clt(seq id no.28)转录的qrt-pcr分析结果。
78.序列说明
79.seq id no.1是clt抗原1的多肽序列
80.seq id no.2是clt抗原2的多肽序列
81.seq id no.3是clt抗原3的多肽序列
82.seq id no.4是clt抗原4的多肽序列
83.seq id no.5是clt抗原5的多肽序列
84.seq id no.6是clt抗原6的多肽序列
85.seq id no.7是clt抗原7的多肽序列
86.seq id no.8是clt抗原8的多肽序列
87.seq id no.9和10是衍生自clt抗原1的肽序列
88.seq id no.11-14是衍生自clt抗原2的肽序列
89.seq id no.15是衍生自clt抗原3的肽序列
90.seq id no.16和17是衍生自clt抗原4的肽序列
91.seq id no.18是衍生自clt抗原5的肽序列
92.seq id no.19和20是衍生自clt抗原6的肽序列
93.seq id no.21是衍生自clt抗原7的肽序列
94.seq id no.22是衍生自clt抗原8的肽序列
95.seq id no.23是编码clt抗原1的clt的cdna序列
96.seq id no.24是编码clt抗原2的clt的cdna序列
97.seq id no.25是编码clt抗原3的clt的cdna序列
98.seq id no.26是编码clt抗原4的clt的cdna序列
99.seq id no.27是编码clt抗原5的clt的cdna序列
100.seq id no.28是编码clt抗原6的clt的cdna序列
101.seq id no.29是编码clt抗原7的clt的cdna序列
102.seq id no.30是编码clt抗原8的clt的cdna序列
103.seq id no.31是编码clt抗原1的cdna序列
104.seq id no.32是编码clt抗原2的cdna序列
105.seq id no.33是编码clt抗原3的cdna序列
106.seq id no.34是编码clt抗原4的cdna序列
107.seq id no.35是编码clt抗原5的cdna序列
108.seq id no.36是编码clt抗原6的cdna序列
109.seq id no.37是编码clt抗原7的cdna序列
110.seq id no.38是编码clt抗原8的cdna序列
111.seq id no.39是衍生自clt抗原6的肽序列。
具体实施方案
112.多肽
113.术语“蛋白质”、“多肽”和“肽”在本文中互换地使用并且指任何肽连接的氨基酸链,无论长度为多少、是否有共翻译或翻译后修饰。
114.术语“氨基酸”指任何一种天然存在的氨基酸,以及按照与天然存在氨基酸相似的方式发挥作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的那20种l-氨基酸,以及稍后经修饰的那些氨基酸,例如,羟脯氨酸、γ-羧谷氨酸和o-磷酸丝氨酸。术语“氨基酸类似物”指一种化合物,其具有与天然存在氨基酸相同的基本化学结构,即,与氢、羧基、氨基和r基团结合的α-碳,和r基团,但是与天然氨基酸相比,具有修饰的r基团或修饰的肽主链。示例包括高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基硫鎓和正亮氨酸。氨基酸模拟物指这样的化学化合物,它们具有与氨基酸的一般化学结构不同的结构,但是按照与天然存在氨基酸类似的方式发挥作用的化学化合物。适当地,氨基酸是天然存在的氨基酸或氨基酸类似物,尤其天然存在的氨基酸并且特别是遗传密码编码的那20种l-氨基酸之一。
115.氨基酸可以在本文中通过其公知的三字母符号或通过iupac-iub生物化学命名委员会(iupac-iub biochemical nomenclature commission)推荐的单字母符号提到。同样,核苷酸可以由其通常接受的单字母代码指称。
116.因此,本发明提供一种分离的多肽,所述多肽包含选自以下的序列:
117.(a)seq id no.1-8中任一者的序列;和
118.(b)(a)的序列的变体;和
119.(c)(a)的序列的免疫原性片段
120.本发明也提供一种分离的多肽,所述多肽包含选自以下的序列:
121.(a)减去起始甲硫氨酸残基的seq id no.1-8中任一者的序列;和
122.(b)(a)的序列的变体;和
123.(c)(a)的序列的免疫原性片段
124.从总体上看,本发明的多肽序列的变体包含与之具有高程度序列同一性的序列。
例如,变体适当地与相关的参考序列在其整个长度范围内具有至少约80%同一性、更优选地至少约85%同一性和最优选地至少约90%同一性(如至少约95%、至少约98%或至少约99%)。
125.适当地,变体是免疫原性变体。某变体在如下情况视为免疫原性变体:例如在采用多肽作为抗原的pbmc或全血体外重刺激分析中(例如,重刺激持续几小时到长达1年(如长达6个月、1天至1个月或1至2周)之间的时间),它激发这样的反应,所述反应是参考序列(即变体是所述参考序列的变体)的活性的至少20%、适当地至少50%和特别地至少75%(如至少90%),其中所述体外重刺激分析借助淋巴细胞增殖(例如,t细胞增殖)、培养物上清液中细胞因子(例如,ifn-γ)产生(通过elisa测量等)或通过胞内和胞外染色(例如,使用对免疫标志物如cd3、cd4、cd8、il2、tnf-α、ifng、1型ifn、cd40l、cd69等特异的抗体),随后以流式细胞仪分析对t-细胞反应表征,测量细胞的活化。
126.变体可以例如是保守性修饰的变体。“保守性修饰的变体”是这样的变体,其中更改导致某氨基酸置换成功能相似的氨基酸或置换/缺失/添加基本上不影响变体的生物学功能的残基。一般,变体的这种生物学功能将诱导针对黑素瘤例如皮肤黑素瘤癌抗原的免疫应答。
127.本领域熟知提供功能相似的氨基酸的保守性置换表。变体可以包括在其他物种中存在的多肽同源物。
128.与参考序列相比时,本发明多肽的变体可以含有多个置换,例如,保守性置换(例如,1-25个,如1-10个、尤其1-5个并且尤其1个氨基酸残基可以改变)。置换(例如,保守性置换)的数目可以是参考序列的残基数目的直至20%,例如,直至10%例如,直至5%例如,直至1%。通常,保守性置换将落于下文指定的氨基酸分组之一的范围内,不过在一些情况下,其他置换可以是有可能的,同时不大幅度影响抗原的免疫原性特性。以下八个组各自含有一般彼此互为保守性置换的氨基酸:
129.1)丙氨酸(a)、甘氨酸(g);
130.2)天冬氨酸(d)、谷氨酸(e);
131.3)天冬酰胺(n)、谷氨酰胺(q);
132.4)精氨酸(r)、赖氨酸(k);
133.5)异亮氨酸(我)、亮氨酸(l)、甲硫氨酸(m)、缬氨酸(v);
134.6)苯丙氨酸(f)、酪氨酸(y)、色氨酸(w);
135.7)丝氨酸(s)、苏氨酸(t);和
136.8)半胱氨酸(c)、甲硫氨酸(m)
137.(参见,例如,creighton,proteins 1984)。
138.适当地,这类置换不改变表位的免疫结构(例如,它们不出现在如一级序列中所定位的表位区域内部),并且因此不显著影响抗原的免疫原性特性。
139.多肽变体还包括其中与参考序列相比,插入额外氨基酸的那些变体,例如,这类插入可以涉及在1-10个位置(如1-5个位置,适当地1或2个位置,尤其1个位置),并且可以例如包括在每个位置添加50个或更少(如20个或更少、尤其10个或更少、特别地5个或更少)的氨基酸。适当地,这类插入不出现在表位的区域内,并且因此不显著影响抗原的免疫原性特性。一个插入示例包括辅助表达和/或纯化所讨论抗原的短段组氨酸残基(例如,2-6个残
基)。
140.多肽变体包括其中与参考序列相比,已经缺失氨基酸的那些变体,例如,这类缺失可以出现在1-10个位置(如1-5个位置,适当地1或2个位置,尤其1个位置),并且可以例如涉及在每个位置删除50个或更少(如20个或更少、尤其10个或更少、特别地5个或更少)的氨基酸。适当地,这类缺失不出现在表位的区域内,并且因此不显著影响抗原的免疫原性特性。
141.本领域普通技术人员将认识到,特定的蛋白质变体可以包含置换、缺失和添加(或其任意组合)。例如,置换/缺失/添加可能增强与所需的患者hla分子结合(或对其具有中性影响),从而可能增加免疫原性(或保持免疫原性不改变)。
142.本发明的免疫原性片段一般将包含至少9个(例如,至少9或10个)来自全长多肽序列的连续氨基酸,如至少12个连续氨基酸(例如,至少15或至少20个连续氨基酸),尤其至少50个连续氨基酸,如至少100个连续氨基酸(例如至少200个连续氨基酸),这取决于clt抗原的长度。适当地,免疫原性片段将是全长多肽序列的长度的至少10%,如至少20%,如至少50%、如至少70%或至少80%。
143.免疫原性片段一般包含至少一个表位。表位包括b细胞表位和t细胞表位,并且适当地,免疫原性片段包含至少一个t细胞表位如cd4 t细胞表位或cd8 t细胞表位。
144.t细胞表位是与hla分子结合时为t细胞(例如,cd4 t细胞或cd8 t细胞)识别的邻接氨基酸短段。可以通过本领域技术人员充分已知的表位定位实验实现t细胞表位的鉴定(参见,例如,paul,fundamental immunology,第3版,243-247(1993);beiβbarth等人,2005,bioinformatics,21(suppl.1):i29-i37)。
145.作为癌症中决定性参与t-细胞反应的结果,很明显seq id no.1-8中的全长多肽的含有至少一个t细胞表位的片段可以有免疫原性并且可以有助于免疫保护。
146.应当理解在多样性远交群体(如人类)中,不同的hla型意味着特定表位可以不为群体的全部成员所识别。因此,为了最大限度增加识别水平和针对多肽的免疫应答的规模,通常合乎需要的是,免疫原性片段含有来自全长序列的多个表位(适当地在clt抗原内部的全部表位)。
147.seq id no.1-8的多肽的可能有用的特定片段包括那些含有至少一个cd8 t细胞表位、适当地至少两个cd8 t细胞表位和尤其全部cd8 t细胞表位的片段,尤其与多个hla i类等位基因相关的那些片段,例如,与2、3、4、5个或更多个等位基因相关的那些片段。seq id no.1-8的多肽的可能有用的特定片段包括那些含有至少一个cd4 t细胞表位、适当地至少两个cd4 t细胞表位和尤其全部cd4 t细胞表位的片段(尤其与多个hla ii类等位基因相关的那些片段,例如,与2、3、4、5个或更多个等位基因相关的那些片段)。然而,设计疫苗的技术人员可能将外源cd4 t细胞表位与本发明的cd8 t细胞表位组合并且实现针对本发明cd8 t细胞表位的所需应答。
148.如若使用全长多肽的独立片段,则这个片段在如下情况视为有免疫原性:它激发这样的反应,所述反应是参考序列(即片段是所述参考序列的片段)的活性(例如在采用多肽作为抗原的pbmc或全血体外重刺激分析中(例如,重刺激持续几小时到长达1年(如长达6个月、1天至1个月或1至2周)之间的时间)的活性)的至少20%、适当地至少50%和尤其至少75%(如至少90%),其中所述体外重刺激分析借助淋巴细胞增殖(例如,t细胞增殖)、培养物上清液中细胞因子(例如,ifn-γ)产生(通过elisa测量等)或通过胞内和胞外染色(例
如,使用对免疫标志物如cd3、cd4、cd8、il2、tnf-α、ifn-γ、1型ifn、cd40l、cd69等特异的抗体),随后以流式细胞仪分析对t-细胞反应表征,测量细胞的活化。
149.在一些情况下,全长多肽的多个片段(它们可以重叠或可以不重叠并且可以覆盖或可以不覆盖全长序列整体)可以用来获得针对全长序列本身的等同生物学反应。例如,如上文所述的至少两个免疫原性片段(如三个、四个或五个),组合时提供参考序列在pbmc或全血体外重刺激分析(例如,t细胞增殖和/或ifn-γ生成分析)中的活性的至少50%、适当地至少75%和尤其至少90%。
150.seq id no.1-8的多肽的示例免疫原性片段并且因此本发明肽的示例,包括了包含seq id no.9-22和39的序列或由其组成的多肽。从免疫肽组学分析中鉴定seq id no.9-22的序列为结合于hla i类分子(参见实施例2)。seq id no.39的序列经netmhc软件预测为结合于hla i类分子并且用于免疫学验证分析中(参见实施例4)。
151.核酸
152.本发明提供编码本发明多肽的分离的核酸(称作本发明的核酸)。例如,本发明的核酸包含选自seq id no.23-30或31-38的序列或由其组成。
153.术语“核酸”和“多核苷酸”在本文中互换地使用并且指从核苷酸单体、尤其脱氧核糖核苷酸单体或核糖核苷酸单体产生的聚合大分子。该术语涵盖含有已知的核苷酸类似物或已修饰的主链残基或键的核酸,所述核酸是天然存在和非天然存在的,具有与参考核酸相似的特性,并且意图按照与参考核苷酸类似的方式代谢或意图在系统中具有延长的半衰期。这类类似物的示例包括而不限于硫代磷酸酯、磷酰胺酯、甲基膦酸酯、手性-甲基膦酸酯、2'-o-甲基核糖核苷酸、肽核酸(pna)。适当地,术语“核酸”指脱氧核糖核苷酸单体或核糖核苷酸单体的天然存在聚合物。适当地,本发明的核酸分子是重组的。重组意指核酸分子是克隆步骤、限制酶切步骤或连接步骤中至少一者的产物或产生与自然界中存在的核酸分子迥异的核酸分子(例如,在cdna的情况下)的其他方法的产物。在一个实施方案中,本发明的核酸是人工核酸序列(例如,具有非自然存在的密码子选择的cdna序列或核酸序列)。在一个实施方案中,本发明的核酸是dna。备选地,本发明的核酸是rna。
154.dna(脱氧核糖核酸)和rna(核糖核酸)指具有糖部分的主链的核酸分子,所述糖部分分别是脱氧核糖基部分和核糖基部分。糖部分可以连接于碱基,后者是4种天然碱基(dna中腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)和胸腺嘧啶(t)并且rna中腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)和尿嘧啶(u))。如本文所用,“相应rna”是除dna中的胸腺嘧啶(t)置换成rna中的尿嘧啶(u)之外,与参考dna具有相同序列的rna。糖部分也可以连接于非天然碱基如肌苷、黄苷、7-甲基鸟苷、二氢尿苷和5-甲基胞苷。糖(脱氧核糖基/核糖基)部分之间的天然磷酸二酯键可以任选地以硫代磷酸酯键替换。适当地,本发明的核酸由天然碱基组成,所述天然碱基与具有介于糖部分之间磷酸二酯键的脱氧核糖基主链或核糖基糖主链连接。
155.在一个实施方案中,本发明的核酸是dna。例如,该核酸包含选自seq id no.23-30或31-38的序列或由其组成。还提供一种核酸,其包含选自seq id no.23-30或31-38的序列的变体或由其组成,所述变体编码相同的氨基酸序列但基于遗传密码简并性,具有不同的核酸。
156.因此,归因于遗传密码简并性,众多不同的但功能相同的核酸可以编码任何给定的多肽。例如,密码子gca、gcc、gcg和gcu均编码氨基酸丙氨酸。因而,在其中丙氨酸由某个
密码子指定的每个位置,可以将该密码子变成任一个所述的相应密码子,而不改变编码的多肽。这种核酸变种导致“沉默性”(有时称作“简并”或“同义”)变体,这些变体是一个种类的保守性修饰的变异。本文公开的编码多肽的每个核酸序列也使核酸的每种可能沉默变异成为可能。技术人员将认识到,可以修饰核酸中的每个密码子(例外是aug,它通常是甲硫氨酸的唯一密码子,和ugg,它通常是色氨酸的唯一密码子)以产生功能相同的分子。因此,编码多肽的核酸的每种沉默性变异内含于每个描述的序列中并且作为本发明的一个方面提供。
157.还可以通过产生其中一个或多个选择的(或全部)密码子的第三位置用混合型碱基和/或脱氧肌苷残基置换的序列,实现简并密码子置换(batzer等人,1991,nucleic acid res.19:5081;ohtsuka等人,1985,j.biol.chem.260:2605-2608;rossolini等人,1994,mol.cell.probes 8:91-98)。
158.与参考序列相比时,包含选自seq id no.23-30或31-38的序列或由其组成的本发明核酸可以含有多个沉默性变异(例如,1-50个,如1-25个、尤其1-5个并且尤其1个密码子可以改变)。
159.本发明的核酸可以包含选自seq id no.31-38并且不具有甲硫氨酸的起始密码子(即,atg或aug)的序列或由其组成,或如上所述的其变体。
160.在一个实施方案中,本发明的核酸是rna。提供rna序列,其对应于本文提供的dna序列并且具有核糖核苷酸主链,而非脱氧核糖核苷酸主链并且具有侧链碱基尿嘧啶(u)替代胸腺嘧啶(t)。
161.因此,与参考序列相比时,本发明的核酸包含选自seq id no.23-30或31-38的cdna序列的rna等同物或由其组成,并且可以含有多个沉默性变异(例如,1-50个,如1-25个、尤其1-5个并且尤其1个密码子可以改变)。“rna等同物”意指一种rna序列,其含有与参考cdna序列相同的遗传信息(即含有相同的密码子,同时具有核糖核苷酸主链,而非脱氧核糖核苷酸主链,并且具有侧链碱基尿嘧啶(u)替代胸腺嘧啶(t))。
162.本发明还包含与前述cdna序列和rna序列互补的序列。
163.在一个实施方案中,本发明的核酸针对人类宿主细胞中的表达作密码子优化。
164.本发明的核酸能够在dna核酸的情况下转录和翻译成本发明的多肽,并且在rna核酸的情况下翻译成本发明的多肽。
165.多肽和核酸
166.适当地,分离本发明中所用的多肽和核酸。“分离的”多肽或核酸是从其原始环境取出的那种。例如,如果天然存在的多肽或核酸与天然体系中的一些或全部共存物质分离,则它是分离的。例如,如果将核酸克隆至不是其天然环境的部分的载体中,则核酸视为分离的。
167.当提及参考多肽或核酸序列时使用时,“天然存在的”意指自然界中存在并且未按合成方式修饰的序列。
168.当提及参考多肽或核酸序列时使用时,“人工”意指不在自然界中存在的序列,其中所述序列例如是天然序列的合成修饰物或含有非天然序列。
169.当用于提及一个核酸或多肽与另一个核酸或多肽的关系时,术语“异源”表示两个或更多个序列并不以彼此在自然界中相同的关系存在。“异源”序列还可以意指这样的序
列,其不分离自、衍生自或基于宿主生物中存在的天然存在的核酸或多肽序列。
170.如上文所示,多肽变体优选地与相关的参考序列在其整个长度范围内具有至少约80%同一性、更优选地至少约85%同一性和最优选地至少约90%同一性(如至少约95%、至少约98%或至少约99%)。
171.出于比较两个密切相关的多肽序列或多核苷酸序列的目的,可以计算第一序列和第二序列之间的“序列同一性%”。如果多肽序列在其整个长度范围共有100%序列同一性,则多肽序列据称与其他多肽序列相同或同一。顺序中的残基从左至右即从多肽的n末端至c末端编号。在两个或更多个多肽序列的情况下,术语“相同”或“同一性”百分数指为了比较窗口范围内的最大对应性而比较并且对齐时,相同或具有指定百分数的相同氨基酸残基(即,在指定的区域范围内70%同一性,任选地75%、80%、85%、90%、95%、98%或99%同一性)的两个或更多个序列或子序列。适当地,在与参考序列的整个长度对应的窗口范围内进行比较。
172.对于序列比较,一个序列充当与测试序列比较的参考序列。当使用序列比较算法时,将测试序列和参考序列输入计算机,如果需要,指定子序列坐标,并指定序列算法程序参数。可以使用默认程序参数,或可以指定备选参数。基于程序参数,序列比较算法随后相对于参考序列计算测试序列的序列同一性百分数。
173.如本文所用,“比较窗口”指一个区段,其中一个序列可以与具有相同连续位置数的参考序列在最佳对齐这两个序列后比较。本领域熟知用于比较的序列对齐方法。用于比较的最佳序列比对可以这样进行,例如通过smith和waterman,1981,adv.appl.math.2:482的局部同源性算法、通过needleman和wunsch,1970,j.mol.biol.48:443的同源性比对算法、通过pearson和lipman,1988,proc.nat’l.acad.sci.usa 85:2444的相似性搜索方法、通过这些算法的计算机化执行(wisconsin genetics软件包中的gap、bestfit、fasta和tfasta,genetics computer group,575science dr.,madison,wi)或通过手工比对和目视审查(参见,例如,current protocols in molecular biology(ausubel等人编著,1995增补))。
174.一个有用算法的示例是pileup。使用累进配对比对法,pileup从一组相关的序列中产生多重序列比对结果,以显示关系和序列同一性百分数。它也绘制进化树或树状图,后者显示用来产生该比对结果的聚类关系。pileup使用feng和doolittle累进比对法(feng和doolittle,1987,j.mol.evol.35:351-360)的简化形式。所用方法类似于higgins和sharp,1989,cabios 5:151-153描述的方法。该程序可以对齐多达300个序列,每者最大长度为5,000个核苷酸或氨基酸。多重比对程序始于两两对齐两个最相似的序列,产生两个已对齐序列的聚类。这个聚类随后与下一个最相关的序列或已对齐序列的聚类对齐。通过单纯延长两个独立序列的两两对齐结果,对齐两个序列聚类。通过一系列递进的两两对齐实现最终对齐。通过为序列比较区域指定具体序列及其氨基酸坐标并通过指定程序参数,运行该程序。使用pileup,将参考序列与其他测试序列比较以使用以下参数,确定序列同一性百分数关系:默认空位权重(3.00)、默认缺口长度权重(0.10)和加权末端空位。pileup可以从gcg序列分析软件包获得,例如,版本7.0(devereaux等人,1984,nuc.acids res.12:387-395)。
175.另一个适用于确定序列同一性和序列相似性百分数的算法示例是blast算法和blast 2.0算法,它们分别在altschul等人,1977,nuc.acids res.25:3389-3402以及
altschul等人,1990,j.mol.biol.215:403-410中描述。用于执行blast分析的软件是通过国家生物技术信息中心可公开获得的(网站地址:www.ncbi.nlm.nih.gov/)。这种算法涉及首先通过确定查询序列中长度为w的短字,鉴定高评分序列对(hsp),其中与数据库序列中具有相同长度的字比对时,所述短字匹配或满足某些正值阈评分t。t称作相邻字评分阈值(altschul等人,上文)。这些初始相邻字命中充当种子,所述种子用于启动检索以找到含有这些种子的更长hsp。所述字命中在两个方向沿每个序列尽可能远地延伸,只要可以提高累积比对评分。对于核苷酸序列,使用参数m(一对匹配残基的报酬评分;总是》0)和n(错配残基的惩罚评分;总是《0)计算累积评分。对于氨基酸序列,使用评分矩阵计算累积评分。字命中在每个方向上的延伸在以下情况时停止:累积比对评分从其最大实现值下降达到量x;累积评分因积累一个或更多负评分残基比对结果而达到或低于零;或抵达两个序列中任一序列的末端。对于氨基酸序列,blastp程序使用字长度3和期望(e)10,以及blosum62评分矩阵(参见henikoff和henikoff,1989,proc.natl.acad.sci.usa 89:10915)、比对结果(b)50、期望(e)10、m=5、n=-4和两条链的比较作为默认。
176.blast算法也执行两个序列之间相似性的统计分析(参见,例如,karlin和altschul,1993,proc.nat’l.acad.sci.usa 90:5873-5787)。由blast算法提供的相似性的一种度量是最小总和概率(p(n)),其提供两个核苷酸序列或氨基酸序列之间的匹配会因偶然发生的概率指示。
177.序列之间的“差异”指与第一序列相比,单个残基在第二序列的位置中的插入、缺失或置换。两个序列可以含有一个、两个或更多个这类差异。否则与第一序列相同(100%序列同一性)的第二序列中的插入、缺失或置换导致序列同一性%降低。例如,如果相同序列长9个残基,则第二序列中的一个置换产生88.9%的序列同一性。如果相同序列长17个氨基酸残基,则第二序列中的两个置换产生88.2%的序列同一性。
178.备选地,出于比较第一参考序列与第二比较序列的目的,可以确定为产生第二序列对第一序列所做的添加、置换和/或缺失的数目。添加是向第一序列中添加一个残基(包括在第一序列的任一末端添加)。置换是将第一序列中的一个残基置换成一个不同的残基。缺失是从第一序列缺失一个残基(包括在第一序列的任一末端缺失)。
179.产生本发明的多肽
180.可以使用例如green和sambrook 2012molecular cloning:a laboratory manual第4版cold spring harbour laboratory press中公开的技术,获得和操作本发明的多肽。尤其,人工基因合成法可以用来产生多核苷酸(nambiar等人,1984,science,223:1299-1301;sakamar和khorana,1988,nucl.acids res.,14:6361-6372;wells等人,1985,gene,34:315-323以及grundstrom等人,1985,nucl.acids res.,13:3305-3316),随后在合适的生物中表达以产生多肽。可以例如通过固相dna合成法,合成地产生编码本发明多肽的基因。完整基因可以从头合成,无需前体模板dna。为了获得想要的寡核苷酸,使结构单元按产物序列所要求的顺序依次偶联于生长中的寡核苷酸链。当完成链组装时,产物从固相释放至溶液,去保护,并收集。可以通过高效液相色谱法(hplc)分离产物以获得高纯度的所需寡核苷酸(verma和eckstein,1998,annu.rev.biochem.67:99-134)。通过使用多种基因扩增方法(methods mol biol.,2012;834:93-109),将这些相对短的区段轻易地组装成适合用于无数基于重组dna的表达系统中的更长dna分子。在本发明的背景下,本领域技术人员将
理解,本发明中所述的编码多肽抗原的多核苷酸序列可以轻易地用于多种疫苗产生系统中,所述系统例如包括病毒载体。
181.出于在微生物(例如,细菌或真菌)宿主中产生本发明多肽的目的,本发明的核酸将包含合适的调节与控制序列(包括启动子、终止信号等)和促进适于宿主中产生蛋白质的多肽分泌的序列。类似地,可以通过用本发明的核酸转导真核细胞(例如,中国仓鼠卵巢细胞或果蝇s2细胞)的培养物,产生本发明的多肽,其中所述核酸已经与合适的调节与控制序列(包括启动子、终止信号等)和促进适于这些细胞中产生蛋白质的多肽分泌的序列组合。
182.可以任选地通过添加一段组氨酸残基(通称为ahis标签)至多肽的一个末端,促进通过重组手段产生的本发明多肽的分离改进。
183.也可以合成地产生多肽。
184.载体
185.在额外的实施方案中,在体内向细胞引入包含一种或多种本发明核酸的遗传构建体,从而在体内产生本发明的多肽,激发免疫应答。核酸(例如,dna)可以存在于本领域普通技术人员已知的多种递送系统的任一者内部,所述递送系统包括核酸表达系统、细菌表达系统和一些病毒表达系统。本领域熟知众多的基因递送技术,如rolland,1998,crit.rev.therap.drug carrier systems 15:143-198和其中所引用参考文献描述的那些技术。下文为说明目的略述这些方案中的数个。
186.因此,提供包含本发明核酸分子的载体(本文也称作“dna表达构建体”或“构建体”)。
187.适当地,载体包含编码调节元件(如合适的启动子和终止信号)的核酸分子,所述调节元件适于允许有翻译活性的rna分子在人类宿主细胞中转录。“有翻译活性的rna分子”是能够由人细胞的翻译装置翻译成蛋白质的rna分子。
188.因此,提供一种包含本发明核酸的载体(下文称作“本发明的载体”)。
189.尤其,载体可以是病毒载体。病毒载体可以是腺病毒、腺相关病毒(aav)(例如,aav5型和2型)、甲病毒(例如,委内瑞拉马脑炎病毒(veev)、辛德毕斯病毒(sin)、semliki森林病毒(sfv))、疱疹病毒、砂粒病毒(例如,淋巴细胞性脉络丛脑膜炎病毒(lcmv))、麻疹病毒、痘病毒(如改良安卡拉痘苗病毒(mva))、副黏病毒、慢病毒或弹状病毒(如水泡性口炎病毒(vsv))载体,即载体可以衍生自前述病毒的任一者。腺病毒特别适合用作基因转移载体,原因在于其基因组大小中等、操纵便利、滴度高、靶细胞范围广和感染性高。病毒基因组的两个末端含有100-200碱基对的反向重复序列(itr),所述序列是病毒dna复制和包装必需的顺式元件。基因组的早期(e)区和晚期(l)区含有依照病毒dna复制启动划分的不同转录单位。e1区(e1a和e1b)编码负责调节病毒基因组和一些细胞基因转录的蛋白质。e2区(e2a和e2b)的表达导致合成用于病毒dna复制的蛋白质。这些蛋白质参与dna复制、晚期基因表达和宿主细胞关闭(renan,1990)。晚期基因的产物,包括大部分的病毒衣壳蛋白,仅在显著加工主要晚期启动子(mlp)发布的单一初级转录物后才表达。mlp在感染晚期期间特别高效,并且从这个启动子转录的全部mrna均拥有5
‘‑
三联前导(tpl)序列,所述序列使这些mrna成为翻译首选的mrna。从缺失一个或多个早期基因的病毒基因组中产生的复制缺陷腺病毒特别有用,因为它们的复制有限并且在已接种宿主内部和对已接种宿主的接触者致病性传播的可能性更小。
190.其他的多核苷酸递送
191.在本发明的某些实施方案中,包含一个或多个多核苷酸序列的表达构建体可以单纯由裸的重组dna质粒组成。参见乌尔姆等人,1993,science 259:1745-1749和cohen,1993,science 259:1691-1692综述。可以进行构建体转移,例如,通过以物理或化学方式透化细胞膜的任何方法进行。这特别地适用于体外转移,不过它也可以体内使用。构思编码目的基因的dna也可以按照相似方式体内转移并且表达基因产物。多个递送系统已经用来向动物模型和向人类递送dna分子。已经许可一些基于这项技术的产品用于动物中,并且其他处于ii期和iii期人体临床试验。
192.rna递送
193.在本发明的某些实施方案中,包含一个或多个多核苷酸序列的表达构建体可以由裸的重组dna衍生质粒组成(ulmer等人,2012,vaccine 30:4414
–
4418)。就基于dna的表达构建体而言,多种方法可以用来向体外或体内细胞引入rna分子。可以设计基于rna的构建体以模仿简单的信使rna(mrna)分子,从而引入的生物分子由宿主细胞的翻译装置直接翻译,以在引入该生物分子的细胞中产生其编码的多肽。备选地,可以按照这样的方式设计rna分子,所述方式通过向所述分子的结构中并入病毒rna依赖性rna聚合酶基因,允许它们在引入所述分子的细胞中自我扩增。因此,这些类型的rna分子,称作自我扩增型mrna(sam
tm
)分子(geall等人,2012,pnas,109:14604
–
14609),与一些基于rna的病毒载体共有特性。可以进一步修饰基于mrna的rna或sam
tm rna(例如,通过改变其序列或通过使用修饰的核苷酸),以增强稳定性和翻译(schlake等人,rna biology,9:1319
–
1330),并且两个类型的rna均可以被配制(例如,配制于乳液(brito等人,molecular therapy,2014 22:2118
–
2129)或脂质纳米粒子(kranz等人,2006,nature,534:396-401)中),以促进稳定性和/或进入体外或体内细胞。修饰(和未修饰)的rna的无数制剂已经作为疫苗在模型中和人体中受测,并且多个基于rna的疫苗正用于持续进行的临床试验中。药物组合物
194.可以配制本发明的多肽、核酸和载体用于在药物组合物如免疫原性组合物和疫苗组合物(下文均称作“本发明的组合物”)中递送。本发明的组合物适当地包含本发明的多肽、核酸或载体连同可药用载体。
195.因此,在一个实施方案中,提供一种包含本发明多肽、核酸或载体连同可药用载体的免疫原性药物组合物。
196.在另一个实施方案中,提供一种包含本发明多肽、核酸或载体连同可药用载体的疫苗组合物。例如通常在powell和newman编著,vaccine design(亚单位和佐剂方案),1995中描药物组合物的制备。本发明的组合物还可以含有可能有生物活性或无活性的其他化合物。适当地,本发明的组合物是适于肠胃外施用的无菌组合物。
197.在本发明的某些优选的实施方案中,提供本发明的药物组合物,所述药物组合物包含与可药用载体组合的一种或多种(例如,一种)本发明多肽。
198.在本发明的某些优选的实施方案中,提供本发明的药物组合物,所述药物组合物包含与可药用载体组合的一种或多种(例如,一种)本发明核酸或一种或多种(例如,一种)本发明载体。
199.在一个实施方案中,本发明的组合物可以包含一种或多种(例如,一种)多核苷酸和一种或多种(例如,一种)多肽组分。备选地,组合物可以包含一种或多种(例如,一种)载
体和一种或多种(例如,一种)多肽组分。备选地,组合物可以包含一种或多种(例如,一种)载体和一种或多种(例如,一种)多核苷酸组分。这类组合物可以提供增强的免疫应答。
200.可药用盐:
201.将显而易见的是,本发明的组合物可以含有本文提供的核酸或多肽的可药用盐。这类盐可以从可药用的无毒碱制备,所述碱包括有机碱(例如,伯胺、仲胺和叔胺和碱性氨基酸的盐)和无机碱(例如,钠盐、钾盐、锂盐、铵盐、钙盐和镁盐)。
202.可药用载体
203.尽管本领域普通技术人员已知的许多可药用载体可以用于本发明的组合物中,但所用载体的最佳类将根据施用模式变动。可以配制本发明的组合物用于任何适宜的施用方式,施用方式例如包括肠胃外、局部、经口、经鼻、静脉内、颅内、腹膜内、皮下或肌内施用,优选地肠胃外施用例如,肌内、皮下或静脉内施用。对于肠胃外施用,载体优选地包含水并且可以含有ph控制用缓冲液、稳定剂,例如,表面活性剂和氨基酸和张力调节剂例如,盐和糖。如果组合物意在以冻干形式提供用于在使用点稀释,制剂可以含有冻干保护剂,例如,糖如海藻糖。对于口服施用、可以使用上述任一载体或固态载体、如甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、蔗糖和碳酸镁。
204.因此、本发明的组合物可以包含缓冲液(例如,中性缓冲盐水或磷酸盐缓冲盐水)、糖类(例如,葡萄糖、甘露糖、蔗糖或葡聚糖)、甘露醇、蛋白质、多肽或氨基酸如甘氨酸、抗氧化剂、抑菌剂、络合剂如edta或谷胱甘肽、使制剂对受者的血液等渗、低渗或微弱低渗的溶质、助悬剂、增稠剂和/或防腐剂。备选地,本发明的组合物可以配制为冻干产物。
205.免疫刺激剂
206.本发明的组合物还可以包含一种或多种免疫刺激剂。免疫刺激剂可以是增强或激动外源抗原免疫应答(抗体和/或细胞介导的)的任何物质。在疫苗制剂语境下经常称作佐剂的免疫刺激剂示例包括铝盐如氢氧化铝凝胶(明矾)或磷酸铝;皂素(包括qs21)、免疫刺激性寡核苷酸如cpg、水包油乳液(例如,其中油是鲨烯)、氨烷基氨基葡糖苷4-磷酸、脂多糖或其衍生物例如3-de-o-酰化单磷酸酯类脂a和其他的tlr4配体、tlr7配体、tlr8配体、tlr9配体、il-12和干扰素。因此,适当地,本发明组合物的一种或多种免疫刺激剂选自铝盐、皂素、免疫刺激性寡核苷酸、水包油乳液、氨烷基氨基葡糖苷4-磷酸、脂多糖及其衍生物和其他tlr4配体、tlr7配体、tlr8配体和tlr9配体。免疫刺激剂还可以包含与其他免疫组分特异性相互作用的单克隆抗体,例如阻断免疫检查点受体(包括pd-1和ctla4)相互作用的单克隆抗体。
207.在重组核酸方法递送(例如,dna,rna,病毒载体)的情况下,可以将编码基于蛋白质的免疫刺激剂的基因连同编码本发明多肽的基因一起轻易地递送。
208.缓释
209.本文所述的组合物可以作为实现施用后化合物缓慢/持续释放的持续释放制剂的部分施用(即,制剂如胶囊剂、海绵剂、糊剂或凝胶剂(例如由多糖组成))。
210.储存和包装
211.本发明的组合物可以存在于单位剂量容器或多剂量容器(如密封的安瓿或小瓶)中。这类容器优选地全密封,以保持制剂的无菌性直至使用为止。通常,制剂可以作为油质溶媒或含水溶媒中的悬液、溶液或乳液储存。备选地,本发明的组合物可以在冷冻干燥状态
下储存,仅需要在临用前再添加无菌液态载体(如水或注射用盐水)。
212.剂量
213.可以按如此方式准备本发明每种组合物中核酸、多肽或载体的量,从而将获得合适剂量的治疗用途或预防用途。制备这类组合物的本领域技术人员将构思诸多因素如溶解度、生物利用度、生物半寿期、施用途径、产物货架期以及其他药理学注意事项,并且就此而论,多种剂量和治疗方案可以是合乎需要的。
214.一般,包含治疗有效量或预防有效量的组合物每次施用递送约0.1ug至约1000ug的本发明多肽,更一般每次施用递送约2.5ug至约100ug的多肽。如果以短的、合成的长肽形式递送,则剂量可能是1至200ug/肽/剂量。就多核苷酸组合物而言,这些剂量一般每次施用递送约10ug至约20mg本发明核酸,更一般每次施用递送约0.1mg至约10mg本发明核酸。
215.待治疗或预防的疾病
216.如他处所示,seq id no.1-8是与皮肤黑素瘤中过量表达的clt抗原相对应的多肽序列。
217.在一个实施方案中,本发明提供用于药物中的本发明多肽、核酸、载体或组合物。
218.本发明的其他方面涉及一种在人类中产生免疫应答的方法,所述方法包括向所述人类施用本发明的多肽、核酸、载体或组合物。
219.本发明还提供本发明的多肽、核酸、载体或组合物用于在人类中产生免疫应答。
220.还提供本发明多肽、核酸、载体或组合物用于制造药物的用途,所述药物用于在人类中产生免疫应答。
221.适当地,针对癌性肿瘤产生免疫应答,所述癌性肿瘤表达选自seq id no.1-8的相应序列及其任一者的变体和免疫原性片段。“相应”在这种情况下意指如果肿瘤表达,举例而言,seq.id no.a(a是seq id no.1-8之一)或其变体或免疫原性片段,则本发明的多肽、核酸、载体或组合物和涉及这些的药物将基于seq id no.a或其变体或免疫原性片段。
222.适当地,免疫应答包含cd8 t细胞、cd4 t细胞和/或抗体应答,尤其cd8 溶细胞性t-细胞反应和cd4 辅助t细胞反应。
223.适当地,针对肿瘤、尤其表达选自seq id no.1-8的序列及其变体及其免疫原性片段的肿瘤产生免疫应答。
224.在一个优选的实施方案中,肿瘤是黑素瘤肿瘤,例如皮肤黑素瘤肿瘤。
225.肿瘤可以是原发肿瘤或转移性肿瘤。
226.本发明的其他方面涉及一种治疗患有癌症的人类患者的方法,其中癌的细胞表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,或本发明的其他方面涉及一种预防人类患癌症的方法,所述癌将表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,所述方法包括向所述人类施用本发明的相应多肽、核酸、载体或组合物。
227.本发明还提供用于治疗或预防人类中癌症的本发明多肽、核酸、载体或组合物,其中癌的细胞表达选自seq id no.1-8的相应序列及其任一者的免疫原性片段。
228.与seq id no.23、24、25、27和30相对应的转录物还过量表达于葡萄膜黑素瘤中。因此,在备选实施方案中,肿瘤是葡萄膜黑素瘤肿瘤和/或表达选自seq id no.1、2、3、5和8的序列的肿瘤。
229.因此,本发明提供根据本发明用途的方法或多肽、核酸、载体或组合物,其中多肽
包含选自以下的序列:
230.(a)seq id no.1、2、3、5和8中任一者的序列;和
231.(b)(a)的序列的变体;和
232.(c)(a)的序列的免疫原性片段,
233.并且例如,多肽包含选自seq id no.9-15、18和22中任一者的序列或由其组成,并且例如,核酸包含选自seq id no.23、24、25、27和30中任一者、或者选自seq id no.31、32、33、35和38中任一者的序列或由其组成;
234.并且其中癌是葡萄膜黑素瘤。
235.词“防止”和“预防”在本文中互换地使用。
236.治疗和接种方案
237.治疗方案可以包括同时(如共施用)或依次(如初免-强化)递送(i)本发明的多肽、核酸或载体连同(ii)一种或多种进一步本发明多肽、核酸或载体和/或(iii)其他组分,如多种其他治疗有用的化合物或分子,如抗原性蛋白质,任选地与佐剂同时施用。共施用示例包括同侧共施用和对侧共施用。“同时”施用适当地指全部组分均在相同治疗轮次期间递送。适当地,全部组分均在相同时间施用(如同时施用dna和蛋白质),然而,一种组分可以在数分钟内(例如,在相同的医疗预约或医生访视时)或在数小时内施用。
238.在一些实施方案中,“初免”或首次施用本发明的多肽、核酸或载体之后是一次或多次“加强”或后续施用本发明的多肽、核酸或载体(“初免和强化”法)。在一个实施方案中,本发明的多肽、核酸或载体用于初免-强化接种方案中。在一个实施方案中,初免和强化均采用本发明的多肽,在每种情况下采用相同的本发明多肽。在一个实施方案中,初免和强化均采用本发明的核酸或载体,在每种情况下采用相同的本发明核酸或载体。备选地,可以使用本发明的核酸或载体进行初免并且使用本发明的多肽进行强化,或可以使用本发明的多肽进行初免并且使用本发明的核酸或载体进行强化。通常首次或“初免”施用和二次或“强化”施用约1-12周后或至多4-6个月后给予。后续“强化”施用可以如每1-6周那样频率给予或可以相当晚地给予(最长数年后)。
239.抗原组合
240.本发明的多肽、核酸或载体可以与本发明的一种或多种其他多肽或核酸、载体和/或与引起针对黑素瘤例如皮肤黑素瘤或葡萄膜黑素瘤的免疫应答产生的其他抗原性多肽(或编码它们的多核苷酸或载体)组合使用。这些其他抗原性多肽可以衍生自多样来源,它们可能包括充分描述的黑素瘤相关抗原,如gpr143、prame、mage-a3或pmel(gp100)。备选地,它们可能包括其他类型的黑素瘤抗原,包括患者特异性新生抗原(lauss等人,(2017).nature communications,8(1),1738.http://doi.org/10.1038/s41467-017-01460-0)、保留内含子的新生抗原(smart等人,(2018).nature biotechnology.http://doi.org/10.1038/nbt.4239)、剪接的变体新生抗原(hoyos等人,cancer cell,34(2),181
–
183.http://doi.org/10.1016/j.ccell.2018.07.008;kahles等人,(2018).cancer cell,34(2),211
–
224.e6.http://doi.org/10.1016/j.ccell.2018.07.001)、归属于称作编码与肽加工受损相关的t细胞表位的抗原的类别内部的黑素瘤抗原(tiepps;gigoux,m.和wolchok,j.(2018).jem,215,2233;marijt等人,(2018).jem 215,2325)或待发现的新生抗原(包括clt抗原)。另外,来自这些多样来源的抗原性肽还可能与以下者组合:(i)非特异性
免疫刺激剂/佐剂种类和/或(ii)抗原,所述抗原例如包括已知激发强烈cd4辅助t细胞的通用cd4辅助表位(作为多肽或作为编码这些cd4抗原的多核苷酸或载体递送),以放大由共施用的抗原激发的抗黑素瘤特异性反应。
241.可以将不同的多肽、核酸或载体配制在相同的制剂中或在分立的制剂中。备选地,可以将多肽作为其中本发明多肽与第二或其他多肽融合的融合蛋白提供(参见下文)。
242.可以提供编码前述融合蛋白的核酸。
243.更一般地,当联合使用两种或更多种组分时,这些组分可以例如按如下方式存在:
244.(1)作为两种或更多种独立的抗原性多肽组分;
245.(2)作为包含两种(或其他)多肽组分的融合蛋白;
246.(3)作为一种或多种多肽和一种或多种多核苷酸组分;
247.(4)作为两种或更多种独立的多核苷酸组分;
248.(5)作为编码两种或更多种独立多肽组分的单一多核苷酸;或
249.(6)作为编码融合蛋白的单一多核苷酸,所述融合蛋白包含两种(或其他)多肽组分。
250.为了方便,当存在多种组分时,往往需要它们含于单一融合蛋白或编码单一融合蛋白的多核苷酸内部(参见下文)。在本发明的一个实施方案中,全部组分均作为多肽提供(例如,在单一融合蛋白内部)。在本发明的一个备选实施方案中,全部组分作为多核苷酸提供(例如,单一多核苷酸,如编码单一融合蛋白的那种)。
251.融合蛋白
252.作为上文抗原组合讨论的实施方案,本发明还提供分离的本发明多肽,其通过产生使编码独立抗原的序列融合在一起的核酸构建体,与本发明的第二或其他多肽融合(下文称作“本发明的组合多肽”)。本发明的组合多肽预计具有本文对本发明多肽所述的用途,并且可以具有免疫原活性或疫苗活性或预防或治疗效果优异的优点(包括增加应答的宽度和深度),并且可能在远交群体中特别有价值。本发明多肽的融合物还可以提供益处:增加构建和制造疫苗抗原和/或导向型疫苗(包括核酸疫苗)的效率。
253.如上文在抗原组合部分中所述,本发明的多肽和本发明的组合多肽也可以融合于不是本发明多肽的多肽序列,所述的多肽序列包括以下一者或多者:
254.(a)作为黑素瘤相关抗原并且因此可能可用作疫苗中的免疫原性序列的其他多肽(例如,gpr143、prame,mage-a3和pmel(gp100),参阅上文);和
255.(b)能够增强免疫应答的多肽序列(即免疫刺激序列)。
256.(c)能够提供强烈cd4 辅助以增加对clt抗原表位的cd8 t细胞反应的多肽序列,例如包含通用cd4辅助表位。
257.本发明也提供编码前述融合蛋白的核酸和就本发明多肽而言已作必要修正情况下的本发明其他方面(载体、组合物、细胞等)。
258.clt抗原结合多肽
259.可以设计对肿瘤表达的抗原(本发明的多肽)有免疫特异性的抗原结合多肽,以召集溶胞性细胞至抗原修饰的肿瘤细胞,介导摧毁后者。这样一个通过抗原结合多肽召集溶胞性细胞的机制称作抗体依赖的细胞介导细胞毒性(adcc)。因此,本发明提供对本发明多肽有免疫特异性的抗原结合多肽。抗原结合多肽包括可以在非人类动物物种(例如,啮齿类
或驼类(camelid))中产生并且人源化或可以在非人类物种(例如,经基因修饰以具有人免疫系统的啮齿类)中产生的抗体,如单克隆抗体及其片段,例如结构域抗体、fab片段、fv片段和vhh片段。
260.可以通过技术人员熟知的方法产生抗原结合多肽。例如,可以使用杂交瘤技术,通过以下方式产生单克隆抗体:使产生特异性抗体的b细胞与就其能够在组织培养中生长和不存在抗体链合成受到选择的骨髓瘤(b细胞癌)细胞融合(和milstein,1975,nature 256(5517):495-497以及nelson和,2000(jun),mol pathol.53(3):111-7,所述文献通过引用的方式完整并入本文)。
261.可以例如以下方式获得针对已确定抗原的单克隆抗体:
262.a)永生化从事先免疫接种/暴露于已确定抗原、永生细胞和优选地与骨髓瘤细胞永生细胞的动物(包括人类)的外周血获得的淋巴细胞,旨在形成杂交瘤,
263.b)培养形成的永生化细胞(杂交瘤)并且回收产生具有所需特异性的抗体的细胞。
264.可以通过以下方法获得单克隆抗体,所述方法包括步骤:
265.a)向载体、尤其噬菌体和更具体地丝状噬菌体中克隆从(适当地事先用已确定的抗原免疫接种的)动物的淋巴细胞、尤其外周血淋巴细胞获得的dna或cdna序列,
266.b)在允许产生抗体的条件下用上述载体转化原核细胞,
267.c)通过使抗体经历抗原-亲和力选择,选择抗体,
268.d)回收具有所需特异性的抗体
269.e)表达编码抗体的核酸分子,所述核酸分子从暴露于抗原的患者的或以实验方式用抗原免疫接种的动物的b细胞获得。
270.随后可以使用常规的重组蛋白产生技术(例如,从基因工程化的cho细胞中)产生选定的抗体。
271.本发明提供对本发明多肽有免疫特异性的分离的抗原结合多肽。适当地,抗原结合多肽是单克隆抗体或其片段。
272.在某些实施方案中,抗原结合多肽偶联于细胞毒性部分。示例细胞毒部分包括抗体的fc结构域,其将召集促进adcc的携带fc受体的细胞。备选地,抗原结合多肽可以连接于生物学毒素或细胞毒性化学物。
273.另一个重要类别的抗原结合多肽包括与本发明抗原的hla展示片段结合的t细胞受体(tcr)衍生分子。在这个实施方案中,识别肿瘤细胞表面上clt抗原(或其衍生物)的基于tcr的生物制品(包括直接从患者衍生的tcr,或特异性操作的高亲和力tcr)还可以包含识别t细胞(或另一个类别的免疫细胞)上组分的导引部分,所述组分吸引这些免疫细胞至肿瘤,从而提供治疗益处。在一些实施方案中,导引部分还可以刺激再受指导的免疫细胞的有益活性(包括溶胞活性)。
274.因此,在一个实施方案中,抗原结合多肽对hla结合的多肽有免疫特异性,所述hla结合的多肽是本发明的多肽或是其部分。例如,抗原结合多肽是t细胞受体。
275.在一个实施方案中,本发明的抗原结合多肽可以偶联于能够与受试者中的细胞毒性细胞或其他免疫组分结合的另一种多肽。
276.在一个实施方案中,抗原结合多肽用于药物中。
277.在一个实施方案中,提供一种包含本发明的抗原结合多肽连同可药用载体的药物
组合物。这种组合物可以是适于肠胃外施用的无菌组合物。参见,例如,上文的药物组合物公开。
278.本发明提供一种治疗患有癌症的人类的方法,其中癌的细胞表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,或本发明提供一种预防人类患癌症的方法,其中癌的细胞将表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,所述方法包括向所述人类施用抗原结合多肽或包含本发明的所述抗原结合多肽的组合物。
279.在一个实施方案中,提供本发明的抗原结合多肽,其可以偶联于细胞毒性部分,或提供包含所述本发明的抗原结合多肽的组合物,用于治疗或预防人类中的癌症,其中癌的细胞表达选自seq id no.1-8的相应序列及其任一者的免疫原性片段。
280.适当地,在以上任一实施方案中,癌是黑素瘤,特别是皮肤黑素瘤。
281.在一个实施方案中,提供用于根据本发明用途的方法或抗原结合多肽或组合物,其中多肽包含选自以下的序列:
282.(a)seq id no.1、2、3、5和8中任一者的序列;和
283.(b)(a)的序列的变体;和
284.(c)(a)的序列的免疫原性片段。
285.并且例如,多肽包含选自seq id no.9-15、18和22中任一者的序列或由其组成,并且例如,核酸包含选自seq id no.23、24、25、27和30中任一者或者选自seq id no.31、32、33、35和38中任一者的序列或由其组成;
286.并且其中癌是葡萄膜黑素瘤。
287.抗原结合多肽(如抗体或其片段)可以按例如5-1000mg例如25-500mg,例如100-300mg例如约200mg的剂量施用。
288.促进抗原体内呈递的细胞疗法
289.多种细胞递送载具中任一者可以用于药物组合物内部以促进抗原特异性免疫应答产生。因此,本发明提供一种细胞,所述细胞是分离的抗原呈递细胞,所述抗原呈递细胞通过离体修饰加载本发明多肽或经基因工程化以表达本发明的多肽(下文称作“本发明的apc”)。抗原呈递细胞(apc),如树状细胞、巨噬细胞、b细胞、单核细胞和其他细胞可以经工程化成为高效apc。这类细胞可以,但不必要经基因修饰以增加抗原呈递能力,以改善t-细胞反应的活化和/或维持和/或免疫上相容于接受者(即,hla单倍型匹配)。apc可以通常从多种生物流体和器官中任一者分离,并且可以是自体、同种异体、同基因的或异种细胞。
290.本发明的某些优选实施方案使用树状细胞或其祖细胞作为apc。因此,在一个实施方案中,本发明的apc是树状细胞。树状细胞是高效力的apc(banchereau和steinman,1998,nature,392:245-251)并且已经显示作为激发预防性或治疗性免疫力的生理佐剂有效(参见timmerman和levy,1999,ann.rev.med.50:507-529)。通常,可以基于树状细胞的典型形状(原位星状,体外可见明显胞质突起)、其高效率摄取、加工和呈递抗原的能力及其激活初始t-细胞反应的能力鉴定树状细胞。当然,树状细胞可以经工程化以表达在体内或离体的树状细胞上通常不存在的特定细胞表面受体或配体,并且本发明构思了这类修饰的树状细胞。作为树状细胞的备选、加载抗原的分泌型小泡(称作外来体)可以用于免疫原性组合物内部(参见zitvogel等人,1998、nature med.4:594-600)。因此,在一个实施方案中,提供加载本发明多肽的外来体。
291.树状细胞和祖细胞可以从外周血、骨髓、淋巴结、脾、皮肤、脐带血或任何其他合适的组织或流体获得。例如,可以通过向收获自外周血的单核细胞的培养物添加细胞因子(如gm-csf、il-4、il-13和/或tnfα)组合,离体分化树状细胞。备选地,可以通过向培养基添加gm-csf、il-3、tnfα、cd40配体、lps、flt3配体和/或诱导树状细胞分化、成熟和增殖的其他化合物的组合,使从外周血、脐带血或骨髓收获的cd34阳性细胞分化成树状细胞。
292.树状细胞便利地分类为“不成熟”细胞和“成熟”细胞,这带来在两个充分表征的表型之间区分的简单方式。然而,这种命名法不应当解释成排除全部可能的分化中间阶段。不成熟的树状细胞表征为抗原摄取和加工能力高的apc,这与fcγ受体和甘露糖受体高表达相关。成熟表型一般特征在于这些标志物的表达较低,但高表达负责t细胞激活的细胞表面分子,如i类和ii类mhc分子、黏附分子(例如,cd54和cd11)和共刺激分子(例如,cd40、cd80、cd86和4-1bb)。
293.apc也可以经基因工程化,例如,用编码蛋白质(或其部分或其他变体)的多核苷酸转染,从而该多肽表达在细胞表面上。这种转染可以离体进行,并且包含这类已转染细胞的药物组合物随后可以如本文所述那样使用。备选地,可以将靶向树状细胞或其他抗原呈递细胞的基因递送载具施用至患者,产生体内发生的转染。例如,可以通常使用本领域已知的任何方法(如wo 97/24447中描述的那些方法或mahvi等人,1997,immunology and cell biology 75:456-460描述的基因枪方案)进行树状细胞体内和离体转染。可以通过将树状细胞或祖细胞与多肽、dna(例如,质粒载体)或rna温育;或与表达抗原的重组细菌或病毒(例如,腺病毒、腺相关病毒(aav)(例如,aav 5型和2型)、甲病毒(例如,委内瑞拉马脑炎病毒(veev)、辛德毕斯病毒(sin)、semliki森林病毒(sfv)、疱疹病毒、砂粒病毒(例如,淋巴细胞性脉络丛脑膜炎病毒(lcmv))、麻疹病毒、痘病毒(如改良安卡拉痘苗病毒(mva)或禽痘病毒)、副黏病毒、慢病毒或弹状病毒(如水泡性口炎病毒(vsv))温育,实现树状细胞的抗原加载。在多肽加载之前,多肽可以共价缀合于提供t细胞辅助的免疫配偶体(例如,载体分子)。备选地,可以独立地或在多肽或载体存在下用非缀合的免疫配偶体脉冲标记树状细胞。
294.本发明提供向抗原呈递细胞递送多肽抗原的专门设计的化学合成的编码表位的片段。本领域技术人员将认识到,这些类型分子,又称作合成性长肽(slp),提供治疗性平台以使用本发明的抗原性多肽刺激(或加载)体外细胞(gornati等人,2018,front.imm,9:1484)、或作为向体内抗原呈递细胞引入多肽抗原的方法(melief和van der burg,2008,nat rev cancer,8:351-60)。
295.在一个实施方案中,提供一种包含本发明的抗原呈递细胞(其适当地是树状细胞)连同可药用载体的药物组合物。这种组合物可以是适于肠胃外施用的无菌组合物。参见,例如,上文的药物组合物公开。
296.在一个实施方案中,提供本发明的抗原呈递细胞(其适当地是树状细胞)用于药物中。
297.还提供一种治疗患有癌症的人类的方法,其中癌的细胞表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,或提供一种预防人类患癌症的方法,其中癌的细胞将表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,所述方法包括向所述人类施用本发明的所述抗原呈递细胞,其适当地是树状细胞,或包含本发明所述抗原呈递细胞的组合物。
298.在一个实施方案中,提供本发明的抗原呈递细胞,其适当地是树状细胞,或包含所述本发明所述抗原呈递细胞的组合物,用于治疗或预防人类中的癌症,其中癌的细胞表达选自seq id no.1-8的相应序列及其任一者的免疫原性片段。
299.在一个实施方案中,提供一种包含本发明的外来体连同可药用载体的药物组合物。这种组合物可以是适于肠胃外施用的无菌组合物。参见,例如,上文的药物组合物公开。组合物可以任选地包含免疫刺激剂
–
参见上文的免疫刺激剂公开。
300.在一个实施方案中,提供本发明的外来体用于药物中。
301.还提供一种治疗患有癌症的人类的方法,其中癌的细胞表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,或提供一种预防人类患癌症的方法,其中癌的细胞将表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,所述方法包括向所述人类施用本发明的外来体或包含本发明所述外来体的组合物。
302.在一个实施方案中,提供本发明的外来体或包含所述本发明所述外来体的组合物,用于治疗或预防人类中的癌症,其中癌的细胞表达选自seq id no.1-8的相应序列及其任一者的免疫原性片段。在以上任一实施方案中,癌适当地是黑素瘤,特别是皮肤黑素瘤。
303.刺激的t细胞疗法
304.除apc介导在体内或离体产生对本发明多肽有免疫特异性的t细胞之外,自体或非自体的t细胞可以分离自受试者,例如,分离自外周血、脐带血和/或通过血液成分术分离,并且在加载于apc细胞mhc分子(信号1)上的肿瘤相关抗原存在下受刺激,以诱导携带对这种抗原有免疫特异性的tcr的t细胞增殖。
305.成功的t细胞活化需要分别结合抗原呈递细胞和t细胞上的共刺激表面分子b7和cd28(信号2)。为实现最佳的t细胞活化,需要信号1和2。反过来,在共刺激作用(信号2)不存在情况下的抗原性肽刺激(信号1)不能诱导完整的t细胞活化并且可能导致t细胞耐受性。除共刺激分子之外,还存在诱导防止t细胞活化的信号的抑制性分子,如ctla-4和pd-1。
306.自体或非自体t细胞因此可以在本发明的多肽存在下受刺激,并且扩充及复转移至面临癌症风险或患有癌症的患者,所述患者的癌细胞表达本发明的相应多肽,前提是抗原特异性tcr将识别该患者的mhc呈递的抗原,其中它们将瞄准表达所述相应多肽的所述癌细胞并且诱导对其杀伤。
307.在一个实施方案中,提供本发明的多肽、核酸、载体或组合物用于离体刺激和/或扩充从患癌症的人类衍生的t细胞,以便后续向所述人类再引入所述刺激和/或扩充的t细胞,以治疗所述人类中的所述癌症。
308.本发明提供一种治疗人类中癌症的方法,其中癌的细胞表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,其包括从所述人类取得包含至少t细胞、任选地连同抗原呈递细胞的白细胞群体,在本发明的相应多肽、核酸、载体或组合物存在下刺激和/或扩充所述t细胞,并且向人类再引入一些或全部的所述白细胞,其包括至少刺激和/或扩充的t细胞。
309.在以上任一实施方案中,癌适当地是黑素瘤,特别是皮肤黑素瘤。
310.在一个实施方案中,提供一个制备对癌细胞有细胞毒性的t细胞群体的方法,所述癌细胞表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,所述方法包括(a)从癌症患者获得t细胞和抗原呈递细胞;并且(ii)用本发明的相应多肽、核酸、载体或组
合物离体刺激并扩充t细胞群体。
[0311]“相应”在这种情况下意指如果癌细胞表达,举例而言,seq id no.a(a是seq id no.1-8之一)或其变体或免疫原性片段,则以处于多肽、核酸或载体或含有前述之一者的组合物形式的seq id no.a或其变体或免疫原性片段离体刺激并扩充t细胞群体。
[0312]
例如,在这类方法中,在树状细胞存在下进行培养和扩充。树状细胞可以用本发明的核酸分子或载体转染并表达本发明的多肽。
[0313]
本发明提供通过前述任一方法可获得的t细胞群体(下文称作本发明的t细胞群体)。
[0314]
在一个实施方案中,提供一种细胞,所述细胞是已用本发明的多肽、核酸、载体或组合物刺激过的t细胞(下文称作本发明的t细胞)。
[0315]
在一个实施方案中,提供一种包含本发明t细胞群体或t细胞连同可药用载体的药物组合物。这种组合物可以例如是适于肠胃外施用的无菌组合物。
[0316]
在一个实施方案中,提供本发明的t细胞群体或t细胞用于药物中。
[0317]
还提供一种治疗患有癌症的人类的方法,其中癌的细胞表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,或提供一种预防人类患癌症的方法,其中癌的细胞将表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,所述方法包括向所述人类施用本发明的所述t细胞群体或t细胞或包含本发明所述t细胞群体或t细胞的组合物。
[0318]
在一个实施方案中,提供本发明的t细胞群体、本发明的t细胞或包含本发明所述t细胞群体或t细胞的组合物,用于治疗或预防人类中的癌症,其中癌的细胞表达选自seq id no.1-8的相应序列及其任一者的免疫原性片段。在以上任一实施方案中,癌适当地是黑素瘤,特别是皮肤黑素瘤。
[0319]
在一个实施方案中,提供用于根据本发明用途的方法或t细胞群体、t细胞、抗原呈递细胞、外来体或组合物,其中多肽包含选自以下的序列:
[0320]
(a)seq id no.1、2、3、5和8中任一者的序列;和
[0321]
(b)(a)的序列的变体;和
[0322]
(c)(a)的序列的免疫原性片段。
[0323]
并且例如,多肽包含选自seq id no.9-15、18和22中任一者的序列或由其组成,并且例如,核酸包含选自seq id no.23、24、25、27和30中任一者、或者选自seq id no.31、32、33、35和38中任一者的序列或由其组成;
[0324]
并且其中癌是葡萄膜黑素瘤。
[0325]
工程化的免疫细胞疗法
[0326]
上文描述的所有类型clt抗原结合多肽的衍生物,包括识别与人hla分子复合的clt抗原衍生肽的tcr或tcr拟似物(参见dubrovsky等人,2016,oncoimmunology),可以经工程化以表达在(自体或非自体)t细胞的表面上,所述t细胞随后可以作为治疗癌症的过继t细胞疗法施用。
[0327]
这些衍生物归属于“嵌合抗原受体(car)”类别内部,其中如本文所用,所述的嵌合抗原受体可以例如指人工t细胞受体、嵌合t细胞受体或嵌合免疫受体并且涵盖移植人工特异性到特定免疫效应细胞上的工程化受体。car可以用来将单克隆抗体的特异性赋予到t细
胞上,因而允许众多特异性t细胞生成,例如,用于过继细胞疗法中。car可以指导细胞针对肿瘤相关抗原(本发明的多肽)的特异性,其中多肽是hla结合的。
[0328]
另一个治疗患者中癌症的方案是通过表达嵌合抗原受体(car)以遗传方式修饰t细胞以靶向肿瘤细胞上表达的抗原。这项技术综述于wendell和june,2017,cell,168:724-740中(所述文献通过引用的方式完整并入)。
[0329]
可以通过以下方法产生这类cart细胞:从受试者(例如,从外周血、脐带血和/或通过单采血液成分术)获得细胞的样品,其中所述样品包含t细胞或t细胞祖细胞,并且用编码对本发明多肽有免疫特异性的嵌合t细胞受体(car)的核酸转染所述细胞,其中多肽是hla结合的。这种核酸将能够整合入细胞的基因组,并且细胞可以按有效量施用至受试者以提供针对表达本发明多肽的细胞的t细胞反应。例如,可以收集来自受试者的细胞的样品。
[0330]
可以理解,用来产生所述表达car的t细胞的细胞可以是自体或非自体的。
[0331]
表达car的转基因t细胞可以具有失活的内源t细胞受体和/或内源hla表达例如,细胞可以经工程化以消除内源α/βt细胞受体(tcr)表达。
[0332]
本领域熟知转染细胞的方法,不过可以使用高度有效的转染方法如电穿孔法。例如,可以使用核转染装置,向细胞引入表达car构建体的本发明核酸或载体。
[0333]
可以在转染细胞后富集表达car的t细胞的细胞群体。例如,表达car的细胞可以通过使用受car或car结合抗体结合的抗原,与不表达的那些细胞(例如,通过facs)分选开。备选地,富集步骤包括耗尽非t细胞或耗尽缺少car表达的细胞。例如,可以从培养群体耗尽cd56 细胞。
[0334]
表达car的转基因细胞群体可以在选择性增强表达car的t细胞增殖的培养基中离体培养。因此,可以离体扩充表达car的t细胞。
[0335]
car细胞的样品可以保存(或在培养下维持)。例如,样品可以冷冻保存供稍后扩充或分析。
[0336]
表达car的t细胞可以与其他治疗药组合使用,例如检查点抑制蛋白,包括pd-l1拮抗剂。
[0337]
在一个实施方案中,提供一种细胞毒性细胞,其已经过工程化以在其表面上表达前述任一抗原结合多肽。适当地,细胞毒性细胞是t细胞。
[0338]
在一个实施方案中,提供一种细胞毒性细胞用于药物中,所述细胞毒性细胞适当地是t细胞,经工程化以在其表面上表达前述任一抗原结合多肽。
[0339]
本发明提供一种包含本发明细胞毒性细胞的药物组合物,所述细胞毒性细胞适当地是t细胞。
[0340]
提供一种治疗患有癌症的人类患者的方法,其中癌的细胞表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,或提供一种预防人类患癌症的方法,所述癌将表达选自seq id no.1-8的序列及其任一者的免疫原性片段和变体,所述方法包括向所述人类施用本发明的细胞毒性细胞,其适当地是t细胞。
[0341]
在一个实施方案中,本发明的细胞毒性细胞,其适当地是t细胞,用于治疗或预防人类中的癌症,其中癌的细胞表达选自seq id no.1-8的相应序列及其任一者的免疫原性片段。
[0342]
联合疗法
[0343]
本发明的癌症治疗方法可以与其他疗法、尤其检查点抑制蛋白和干扰素组合下进行。
[0344]
多肽、核酸、载体、抗原结合多肽和过继细胞疗法(基于apc和t细胞)可以与其他组分组合使用,旨在提高其免疫原性,例如,旨在改善激发的免疫应答的幅度和/或宽度或提供其他活性(例如,激活天然或适应性免疫应答的其他方面或摧毁肿瘤细胞)。
[0345]
因此,本发明提供本发明的组合物(即免疫原性组合物、疫苗组合物或药物组合物)或数种这类组合物的试剂盒,所述组合物包含本发明的多肽、核酸或载体连同可药用载体,和(i)一种或多种其他免疫原性多肽或免疫刺激多肽(例如,干扰素、il-12、检查点阻断分子或编码前者的核酸,或包含这类核酸的载体)、(ii)将增强作为本发明主题的多肽产物翻译和/或呈递的小分子(例如,hdac抑制剂或调节癌细胞表观遗传特征的其他药物)或生物制品(作为多肽或编码前者的核酸或包含这类核酸的载体递送)。
[0346]
检查点抑制蛋白,其阻断癌细胞上的正常蛋白质或响应于这些蛋白质的t细胞上的蛋白质,可能是一类与基于clt抗原的疗法组合的特别重要的药物,原因是这些抑制剂寻求克服癌症对抗免疫系统攻击的主要防御之一。
[0347]
因此,本发明的一个方面包括施用与检查点抑制蛋白组合的本发明多肽、核酸、载体、抗原结合多肽、组合物、t细胞、t细胞群体或抗原呈递细胞。检查点抑制蛋白的示例选自pd-1抑制剂如派姆单抗(keytruda)与纳武单抗(opdivo)、pd-l1抑制剂如阿特朱单抗(tecentriq)、阿维鲁单抗(bavencio)与德瓦鲁单抗(imfinzi)和ctla-4抑制剂如伊匹木单抗(yervoy)。
[0348]
干扰素(例如,α、β和γ)是身体以极少量产生的蛋白质家族。干扰素可以减缓或终止癌细胞分裂、降低癌细胞自我保护免遭免疫系统影响的能力和/或增强适应性免疫系统的多个方面。干扰素一般作为例如在大腿或腹部中的皮下注射剂施用。
[0349]
因此,本发明的一个方面包括施用与干扰素例如干扰素α组合的本发明多肽、核酸、载体、抗原结合多肽或组合物。
[0350]
本发明的不同模式也可以组合,例如本发明的多肽、核酸和载体可以与本发明(尤其讨论过的)的apc、t细胞或t细胞群体组合。
[0351]
本发明的一种或多种模式也可以与常规的抗癌化疗和/或照射组合。
[0352]
诊断药
[0353]
在另一个方面,本发明提供了使用一种或多种本发明多肽或核酸来诊断癌症、尤其黑素瘤例如皮肤黑素瘤或来诊断适于用本发明多肽、核酸、载体、抗原结合多肽、过继细胞疗法或组合物治疗的人类受试者的方法。
[0354]
因此,本发明提供一种诊断某人患有癌症的方法,所述方法包括步骤:确定所述癌的细胞是否表达选自seq id no.1-8及其任一者的免疫原性片段或变体(例如选自序列seq id no.9-22和39)的多肽序列,或编码所述多肽序列的核酸(例如选自序列seq id no.23-30和seq id no.31-38),并且如果所述多肽或相应核酸在所述癌细胞中过量表达,則诊断所述人为患有癌症。
[0355]
本发明提供一种诊断某人患有皮肤黑素瘤的方法,所述方法包括步骤:确定所述癌的细胞是否表达选自seq id no.4、6和7中任一者及其免疫原性片段或变体的多肽序列,或编码所述多肽序列的核酸,并且如果所述多肽或相应核酸在所述癌细胞中过量表达,則
诊断所述人为患有皮肤黑素瘤。
[0356]
如本文所用,癌细胞中的“过量表达”意指癌细胞中的表达水平高于正常细胞中。
[0357]
本发明提供一种诊断某人患有皮肤黑素瘤或葡萄膜黑素瘤的方法,所述方法包括步骤:确定所述癌的细胞是否表达选自seq id no.1、2、3、5和8的多肽序列及其任一者的免疫原性片段或变体;或编码所述多肽序列的核酸,并且如果所述多肽或相应核酸在所述癌细胞中过量表达,則诊断所述人患有皮肤黑素瘤或葡萄膜黑素瘤。
[0358]
可以通过参考已知未患癌症的对照人类受试者中本发明核酸或多肽的水平,确定过量表达。因此,过量表达表示本发明的核酸或多肽在试验受试者中以比对照受试者中显著更高的水平(例如,高30%、50%、100%或500%的水平)检出。如若对照人类受试者具有无法觉察水平的本发明核酸或多肽,则可以通过检测本发明的核酸或多肽实现诊断。
[0359]
本发明也提供一种治疗患有癌症的人的方法,所述方法包括步骤:
[0360]
(a)确定所述癌的细胞是否表达选自seq id no.1-8及其任一者的免疫原性片段或变体(例如选自seq id no.9-22和39的序列)的多肽序列或编码所述多肽的核酸(例如选自序列seq id no.23-30和31-38);并且如果表达,则
[0361]
(b)向所述人施用本发明的相应肽、核酸、载体、组合物、t细胞群体、t细胞、抗原呈递细胞、抗原结合多肽或细胞毒性细胞。
[0362]
还提供多肽的用途,所述多肽包含选自以下的序列:
[0363]
(a)seq id no.1-8中任一者的序列;或
[0364]
(b)(a)的序列的变体;和
[0365]
(c)(a)的序列的免疫原性片段,其从患有癌症的人的肿瘤分离,或编码所述多肽的核酸的用途,用作确定所述人是否将适于用疫苗治疗的生物标记物,所述疫苗包含本发明的相应多肽、核酸、载体、组合物、t细胞群体、t细胞、抗原呈递细胞、抗原结合多肽或细胞毒性细胞。
[0366]
适当地,癌是黑素瘤,特别是皮肤黑素瘤。
[0367]
本发明也提供一种根据本发明的方法或用途,其中多肽包含选自以下的序列:
[0368]
(a)seq id no.1、2、3、5和8中任一者的序列;和
[0369]
(b)(a)的序列的变体;和
[0370]
(c)(a)的序列的免疫原性片段。
[0371]
并且例如,多肽包含选自seq id no.9-15、18和22中任一者的序列或由其组成,并且例如,核酸包含选自seq id no.23、24、25、27和30中任一者、或者选自seq id no.31、32、33、35和38中任一者的序列或由其组成;
[0372]
并且其中癌是葡萄膜黑素瘤。
[0373]
适当地,本发明多肽具有选自seq id no.1-8的序列或其片段,如其免疫原性片段(例如,选自序列seq id no.9-22和39)。
[0374]
适当地,本发明的核酸具有或包含选自seq id no.23-30或31-38中任一者的序列,或其片段,如其免疫原性片段。
[0375]
用于检测核酸存在的试剂盒是熟知的。例如,包括与多核苷酸杂交的至少两种寡核苷酸的试剂盒可以用于实时pcr(rt-pcr)反应内部以允许检测特定核酸并对其半定量。这类试剂盒可以允许依据因forster共振能量转移(fret)(例如试剂盒)或当双
链dna结合(例如,green剂盒)时生成荧光信号来检测pcr产物。一些试剂盒(例如,含有跨靶dna中外显子的探针的那些试剂盒)允许检测mrna(例如编码本发明核酸的转录物)并对其定量。可以按同时检测反应内部多种核酸的多重样式建立使用某些试剂盒的分析。也可以使用检测活跃dna(即携带提示表达的特定表观遗传特征标识的dna)的试剂盒。可以在这类试剂盒内部存在的额外组分包括促进检测本发明核酸的诊断试剂或报道分子。
[0376]
也可以借助液体活检法,使用来自患者的血液样品检测本发明的核酸。这种方法提供手术活检法的非侵入性备选。可以分离来自这类血样的血浆并分析本发明核酸的存在。
[0377]
可以借助抗原特异性抗体,在患者肿瘤样品的均化制备物内检测本发明多肽的elisa型分析中检测本发明的多肽。备选地,可以借助免疫组织化学分析检测本发明的多肽,所述免疫组织化学分析通过使用光学显微术检查患者肿瘤样品的切片,鉴定多肽抗原的存在,其中所述切片已经通过使用适宜标记的抗体制备物染色。作为又一个备选,可以借助免疫组织化学分析检测本发明的多肽,所述免疫组织化学分析通过使用光学显微术检查患者肿瘤样品的切片,鉴定多肽抗原的存在,其中所述切片已经通过使用适宜标记的抗体制备物染色。
[0378]
也可以通过以下方式检测本发明的多肽:确定它们是否能够刺激针对所述多肽的t细胞产生。
[0379]
一种治疗人类中癌症、尤其黑素瘤、例如皮肤黑素瘤的方法包括(i)检测本发明核酸或多肽的存在和(ii)向受试者施用本发明的核酸、多肽、载体、细胞、t细胞或t细胞群体或组合物(和优选地施用已经检测到的相同核酸或多肽或其片段)。
[0380]
一种治疗人类中癌症、尤其黑素瘤、例如皮肤黑素瘤的方法还包括向受试者施用本发明的核酸、多肽、载体、细胞、t细胞或t细胞群体或组合物,在所述受试者中已经检测到本发明的(和优选地相同)核酸或多肽的存在。
[0381]
尤其,待诊断和酌情治疗的癌症是黑素瘤,例如皮肤黑素瘤。
[0382]
如若检出seq id no.1、2、3、5或8的本发明多肽或其片段,则癌症可能是皮肤黑素瘤或葡萄膜黑素瘤。
[0383]
具体实施方案
[0384]
在一个实施方案中,clt抗原多肽包含seq id no.1或由其组成。示例性片段包含seq id no.9和10中的任一者或由其组成。编码所述多肽序列的示例性核酸包含seq id no.23或seq id no.31或由其组成。提供如上文描述的相应核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体。所述核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体可以用于治疗癌症,尤其黑素瘤,例如皮肤黑素瘤或葡萄膜黑素瘤。还提供了相关的诊断方法。
[0385]
在一个实施方案中,clt抗原多肽包含seq id no.2或由其组成。示例性片段包含seq id no.11-14中的任一者或由其组成。编码所述多肽序列的示例性核酸包含seq id no.24或seq id no.32或由其组成。提供如上文描述的相应核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体。所述核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体可以用于治
疗癌症,尤其黑素瘤,例如皮肤黑素瘤或葡萄膜黑素瘤。还提供了相关的诊断方法。
[0386]
在一个实施方案中,clt抗原多肽包含seq id no.3或由其组成。示例性片段包含seq id no.15或由其组成。编码所述多肽序列的示例性核酸包含seq id no.25或seq id no.33或由其组成。提供如上文描述的相应核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体。所述核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体可以用于治疗癌症,尤其黑素瘤,例如皮肤黑素瘤或葡萄膜黑素瘤。还提供了相关的诊断方法。
[0387]
在一个实施方案中,clt抗原多肽包含seq id no.4或由其组成。示例性片段包含seq id no.16和17中的任一者或由其组成。编码所述多肽序列的示例性核酸包含seq id no.26或seq id no.34或由其组成。提供如上文描述的相应核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体。所述核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体可以用于治疗癌症,尤其黑素瘤,例如皮肤黑素瘤。还提供了相关的诊断方法。
[0388]
在一个实施方案中,clt抗原多肽包含seq id no.5或由其组成。示例性片段包含seq id no.18或由其组成。编码所述多肽序列的示例性核酸包含seq id no.27或seq id no.35或由其组成。提供如上文描述的相应核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体。所述核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体可以用于治疗癌症,尤其黑素瘤,例如皮肤黑素瘤或葡萄膜黑素瘤。还提供了相关的诊断方法。
[0389]
在一个实施方案中,clt抗原多肽包含seq id no.6或由其组成。示例性片段包含seq id no.19和20中的任一者或由其组成。进一步的示例性片段包含seq id no.39或由其组成。编码所述多肽序列的示例性核酸包含seq id no.28或seq id no.36或由其组成。提供如上文描述的相应核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体。所述核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体可以用于治疗癌症,尤其黑素瘤,例如皮肤黑素瘤。还提供了相关的诊断方法。
[0390]
在一个实施方案中,clt抗原多肽包含seq id no.7或由其组成。示例性片段包含seq id no.21或由其组成。编码所述多肽序列的示例性核酸包含seq id no.29或seq id no.37或由其组成。提供如上文描述的相应核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体。所述核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体可以用于治疗癌症,尤其黑素瘤,例如皮肤黑素瘤。还提供了相关的诊断方法。
[0391]
在一个实施方案中,clt抗原多肽包含seq id no.8或由其组成。示例性片段包含seq id no.22或由其组成。编码所述多肽序列的示例性核酸包含seq id no.30或seq id no.38或由其组成。提供如上文描述的相应核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体。所述核酸(例如,dna或rna)、t细胞、t细胞群体、细胞毒性细胞、抗原结合多肽、抗原呈递细胞和外来体可以用于治疗癌症,尤其黑素瘤,例如皮肤黑素瘤或葡萄膜黑素瘤。还提供了相关的诊断方法。
[0392]
实施例
[0393]
实施例1
–
clt鉴定
[0394]
目的是鉴定完全或部分地由ltr元件组成的癌特异性转录物。
[0395]
作为第一步骤,我们从头组装完整的泛癌转录组。为实现这个目的,来自768份患者样品的rna测序用读段用于基因组指导的组装,其中所述患者样品从癌症基因组图谱(the cancer genome atlas tcga)联盟获得并且代表广泛种类的癌类型(来自32个癌类型中每个类型(31例原发性黑素瘤和1例转移性黑素瘤)的24份性别均衡样品;表s1)。使用cutadapt(v1.13)(marcel m.,2011,embnet j.,17:3)对性别均衡样品(不包括性别特有组织)进行接头和质量(q20)修整及长度过滤(两种读段为≥35核苷酸对),并且对于分别为200和3的最大深度和最小深度,使用khmer(v2.0)(crusoe等人,2015,f1000res.,4:900)对其进行kmer归一化(k=20)。使用star(2.5.2b)连同与跨tcga所用那些设置相同的设置,将读段映射至grch38并且传送至trinity(v2.2.0)(trinity,grabherr,m.g.等人,2011,nat.biotechnol.,29:644-52)以进行基因组指导的组装,计算机上内建的深度归一化禁用。大部分组装过程在32核hpc节点上的256gb ram范围内完成,使用1.5tb ram节点复运行失败的过程。所得的重叠群接受聚腺苷酸修整(seqclean v110222内部的trimpoly)和熵过滤(≥0.7),以移除低质量与人为重叠群(bbmap v36.2内部的bbduk)。根据癌类型,使用salmon(v0.8.2或v0.9.2)(patro,r.等人,2017,nat.methods,14:417-419),将原始24份样品准映射至净化过的组装物,移除发现按每百万(tpm)《0.1个转录物所表达的重叠群。使用gmap(v161107)(wu等人,2005,bioinf.,21:1859-1875),将剩余的那些重叠群映射至grch38,并且从组装中移除在其≥85%的长度范围内不以≥85%同一性对齐的重叠群。最后,使用gffread(cufflinks v2.2.1)(trapnell等人,2010,nat.biotech.,28:511-515),使全部癌类型的组装物一起扁平化并且复合成最长的连续转录物。由于专门设计这个组装过程以使得评估重复性元件成为可能,单外显子转录物保留,但加上标记。通过用gencode v24basic和mitranscriptome1比较,评估转录物组装完整度和质量(iye等人2015,nat.genet.,47:199-208)。我们在gencode内部编纂了唯一剪接位点清单并且检验剪接位点是否存在于转录组组装物内部的2核苷酸宽限窗口(grace window)内。这个过程导致鉴定1,001,931个转录物,其中771,006个是剪接的并且230,925个是单外显子的。
[0396]
单独地,将组装的重叠群以基因组重复序列注释叠加,以鉴定含有ltr元件的转录物。ltr元件和非ltr元件如先前所述那样注释(attig等人,2017,front.in microbiol.,8:2489)。简而言之,使用以nhmmer(wheeler等人,2013,bioinform.,29:2487-2489)配置的repeatmasker open-3.0(smit,a.,r.hubley和p.green,http://www.repeatmasker.org,1996-2010),代表已知的人重复序列家族的隐匿马尔科夫模型(hmms)(dfam 2.0库v150923)用来注释grch38。与基于blast的方法相比,基于hmm的扫描提高注释准确度(hubley等人,2016,nuc.acid.res.,44:81-89)。repeatmasker分别注释ltr和内部区域,因此剖析表格化输出结果以合并相同元件的毗邻注释。这种过程产生181,967个转录物,所述转录物含有一个或多个、完全或部分的ltr元件。
[0397]
使用salmon,对全部转录物估计百万分之转录物(tpm),并且将每个癌类型内部的表达与跨811份健康组织样品的表达比较,其中针对所有癌症类型的健康组织匹配的对照来自tcga(若可获得)并且单独地来自gtex(基因型-组织表达联盟,2015,science,348:648-60)。如果在任何样品中按多于1个tpm检出,则转录物视为在癌症中表达,并且如果满
足以下标准,则视为癌特异性:i.在每个癌类型的24份样品≥6者中表达;ii.在≥90%的全部健康组织样品中按《10tpm表达;iii.在目的癌类型中的表达≥3倍任何对照组织类型的中位表达;和iv.当可获得时,在目的癌类型中的表达≥3倍相应健康组织的90百分位数。
[0398]
癌特异性转录物清单随后与含有完整或部分ltr元件的转录物清单相交以产生有5,923个满足所有标准的转录物的清单(称作癌特异性跨ltr元件转录物,clt)。
[0399]
对黑素瘤中特异性表达的403个clt进行进一步的管理,以排除潜在的错误组装重叠和对应于细胞基因组装的那些。进行额外的手动评估,以确保来自确定其特异性表达的癌症的原始rna测序读取支持剪接模式。对clt进行额外的分类使得丢弃在任何gtex正常组织中中位表达超过1tpm的那些。
[0400]
在皮肤黑素瘤的403个clt中,97个clt通过了这些过滤。
[0401]
实施例2
–
免疫肽组学分析
[0402]
基于质谱法(ms)的免疫肽组学(immunopeptidomic)分析是允许直接检测与hla分子(hlap)缔合并且呈递在细胞表面的特定肽的有力技术。该技术包括通过抗hla抗体捕获从生物样品(如细胞或组织)中亲和纯化hlap。然后将分离的hla分子和结合的肽彼此分离,并通过纳米超高效液相色谱与质谱法联用(nuplc-ms)分析洗脱的肽(freudenmann等人,2018,immunology 154(3):331-345)。在质谱仪中,选择、分离、破碎具有确定荷质比(m/z)的特定肽段,然后进行第二轮质谱法(ms/ms)以揭示其产生的碎片离子的m/z。然后可以查询碎片谱(ms/ms)以精确鉴定产生检测到的碎片离子的所选肽的氨基酸序列。
[0403]
ms/ms谱的解释和随后的肽序列鉴定依赖于实验数据与从参考数据库中发现的肽序列创建的理论谱之间的匹配。虽然通过使用与衍生自已知转录组或甚至完整基因组的全部可读框(orf)相对应的预定义清单(nesvizhskii等人,2014,nat.methods 11:1114
–
1125),可以检索ms数据,但查询这些非常庞大的序列数据库导致极高的错误发现率(fdr),后者限制对所呈递肽的鉴定。其他技术问题(例如,亮氨酸的质量=异亮氨酸的质量)和理论问题(例如,肽剪接(liepe等人,2016,science 354(6310):354
–
358))增加与使用非常庞大的数据库(如从已知转录组或完整基因组产生的那些)相关的局限性。因此,在实践中,不参考充分确定的潜在多肽序列集合情况下,执行精确的免疫肽组学分析以鉴定新抗原是异常困难的(li,等人,2016,bmc genomics 17(suppl 13):1031)。
[0404]
因此,我们构建了来自实施例1的97个皮肤黑素瘤clt中的≥10个残基的所有预测多肽序列(orf)的数据库。这产生了2,269个长度为10至207个氨基酸的orf。
[0405]
比照对人完整蛋白质组所报道的多肽序列,bassani-sternberg等人(bassani-sternberg等人,2016,nature commun.,7:13404;数据库链接:https://www.ebi.ac.uk/pride/archive/projects/pxd004894)查询了从衍生自25位皮肤黑素瘤患者的hla结合型肽样品采集的ms/ms数据。这些分析揭示出成千上万种与人类已知蛋白质匹配的肽。如预期,这些肽包括在多种肿瘤相关抗原(taa)(包括prame、magea3和trpm1(melastatin))内部找到的肽。
[0406]
发明人从2名诊断为黑素瘤的患者获得了冷冻的肿瘤组织。将0.6-1g的样品均质化,高速离心裂解液,将澄清的裂解液与共价连接到抗人hla i类单克隆抗体(w6/32)的蛋白a(proa)珠混合。将混合物在4℃下孵育过夜以改善hla i类分子与抗体的结合(ternette等人,2018proteomics 18,1700465)。使用10%乙酸从抗体中洗脱hla i类结合肽,然后使
用反相柱层析将肽与其它高分子量组分分离(ternette等人,2018)。对纯化、洗脱的肽进行nuplc-ms,并在质谱仪内选择特定荷质比(m/z)的特定肽,将其分离、破碎,并进行第二轮质谱(ms/ms)以揭示所得碎片离子的m/z(ternette等人,2018),生成与这些肿瘤样本中的每个的免疫肽组相对应的ms/ms数据集。
[0407]
通过应用详细的免疫肽组学评价知识,使用peaks
tm
软件(v8.5和vx,bioinformatics solutions inc),发明人查询了来自25位黑素瘤患者的pxd004894hla-i类数据集的波谱(bassani-sternberg等人,2016)以及由发明人制备的具有大于9aa的clt衍生的orf的10个黑素瘤样品的hla-i类数据集的波谱,连同人类蛋白质组(uniprot)存在的全部多肽序。由于细胞中存在的大部分hla i类结合肽衍生自组成型表达的蛋白质,用uniprot蛋白质组同时查询这些数据库有助于确保我们的clt orf序列正确指派给ms/ms谱。peaks软件与其他ms/ms查询软件类似,为每个指定波谱指派一个概率值(-10lgp;见表1),以量化指定。
[0408]
这些研究结果鉴定到与从bassani-sternberg等人检查的25名患者的肿瘤样品以及发明人的数据集中2名黑素瘤患者样品中免疫沉淀的hla i类分子缔合的》50种独立肽,这些肽对应于clt衍生的orf的氨基酸序列,并且不对应于人类已知蛋白质组(uniprot)内部存在的多肽序列。
[0409]
对由peaks软件指派的肽谱的进一步手动检测用于确认指定到肽的波谱,这些肽定位至8个clt衍生的orf,因此定义为clt抗原(表1;seq id no.1-8)。
[0410]
检测到这些与hla i类分子缔合的肽确认,从这些肽衍生的8个orf首先在黑素瘤组织中被翻译,借助hla i类途径受到加工,并且最终与hla i类分子复合时呈递给免疫系统。表1显示了在clt抗原中发现的肽的特性。图1-14和29-31显示了表1中所示肽的每种的代表性ms/ms谱。这些图中每幅图的顶部小图显示了ms/ms肽碎片特征,标准ms/ms注释(b:n末端碎片离子;y:c端片段离子;-h2o:失水;-nh3:失氨;[2 ]:带双重电荷的肽离子;pre:未碎裂的前体肽离子;a
n-n:内部碎片离子)显示在最丰富的碎片离子峰(由peaks
tm
软件从发明人的内部数据集或从存储在pride数据库链接:https://www.ebi.ac.uk/pride/archive/projects/pxd004894的bassani-sternberg等人的数据集提取的图像)之上。每幅图的下半小图指示线形肽序列的位置的波谱呈献,所述线形肽序列已经定位至碎片离子。与指派给表1中肽的高-10lgp评分一致,这些波谱含有与我们在这些分析中发现的肽序列(seq id no.9-22)精确匹配的众多碎片。
[0411]
评估来自表1的与hla i类分子缔合时检出的长度大于9aa的所有肽,以通过使用netmhcpan 4.0预测软件(http://www.cbs.dtu.dk/services/netmhcpan/),确定其与hla i类a型和b超型结合的预测强度。这些预测研究的结果表明,预测所有14种肽(或每个完整序列中包含的9-mer)与至少一种测试的超型结合(参见表2)。其中,预测许多序列以高置信度(低等级评分%)与所检查的hla i类超型内的特定类型结合。预期所有检测到的肽都与预期存在于患者群体中的hla类型结合的事实与其检测结果一致。此外,虽然由bassani-sternberg等人报道的hla类型仅针对查询肿瘤样品的一部分(20%),由netmhcpan 4.0预测在分型患者的肿瘤样品中鉴定的、或在来自发明人数据集的肿瘤样品中发现的每一种肽都与报告的患者hla类型之一结合。。
[0412]
为了提供肿瘤组织衍生的ms谱向我们发现的肽序列指派的进一步确定性,合成具
有已发现序列的肽并且使用适用于原始研究中(bassani-sternberg等人,2016,nature commun.,7:13404;发明人的数据库)肿瘤样品的相同条件,使其经历nuplc-ms2。图15-28显示所选择肽的波谱比较。在每幅图中,上部波谱对应于肿瘤样品(来自pride数据库(bassani-sternberg等人,2016,nature commun.,7:13404;数据库链接:https://www.ebi.ac.uk/pride/archive/projects/pxd004894,或在发明人的数据库)并且下部波谱对应于序列相同的合成产生的肽。在这些ms/ms谱中每个碎片峰上方/下方显示已检出离子碎片的选定m/z值。这些图揭示了精确的碎片比对结果(肿瘤衍生的碎片离子和合成肽衍生的碎片离子之间实验测定的m/z值的微小差异完全落在《0.05道尔顿的m/z公差内部),确认肿瘤组织衍生的波谱中的每一个向clt编码的肽指派的真实性。
[0413]
总之,表1和表2、图1-14和29-31以及图15-28中所示的肽数据为黑素瘤患者中相应的clt抗原的翻译、加工和呈递提供异乎寻常强烈的支持。
[0414]
为了进一步确认这些clt的癌特异性,发明人处理了37份正常组织样品(10份正常皮肤样品、9份正常肺样品和18份正常乳房组织样品)并且制备供免疫肽组学分析。发明人查询了来自这些正常组织样品的hla-i类数据集的波谱,检索从clt抗原1至8的多肽序列衍生的全部可能的肽序列。在正常组织样品集合中未检出从这些clt抗原衍生的肽(表3),从而额外确认clt具有癌特异性表达。
[0415]
总结:这种对衍生自预测的orf的免疫肽组学肽的鉴定,表明这些clt在肿瘤组织中被翻译成多肽(seq id no.1-8;称为clt抗原)。然后这些抗原被细胞的免疫监视器加工,并且组分肽被加载到hla i类分子上,使细胞能够被识别所得肽/hla i类复合物的t细胞靶向,进行细胞溶解。因此,预期这些clt抗原及其片段可用于以多种治疗方式治疗其肿瘤表达这些抗原的患者中的黑色素瘤。
[0416]
表1:通过免疫肽组学分析黑素瘤肿瘤样品鉴定的肽清单,连同clt抗原名称和对seq id no的交叉引用。
[0417][0418][0419]1通过质谱法鉴定的hla i类肽。
[0420]2bassani-sternberg等人,2016,nature comm.,7:13404。发明人的数据集(2mt3,2mt4)
[0421]3计算的肽质量。
[0422]4peaks
tm
程序-显示肽的肽/患者最高匹配度的10lgp值,对于所述肽获得超过一种的波谱检测。
[0423]5其中检测到肽的波谱数。
[0424]6观测质量和计算质量之间的偏差;显示对其获得多于一份波谱的肽的选定ppm值。
[0425]
表2:质谱鉴定的肽(长度≥9个残基)与18种hla i类超型等位基因(hla-a0101,hla-a0201,hla-a0301,hla-a1101,hla-a2402,hla-a2501,hla-a2601,hla-a6801,hla-b0702,hla-b0801,hla-b1501,hla-b1801,hla-b2705,hla-b3501,hla-b3503,hla-b4001,hla-b4002,hla-b5101)的预测netmhcpan4.0结合,连同clt抗原名称以及对seq id no.的交叉引用。
[0426]
[0427]1以≤2.0%分的等级评分与查询的hla i类超型的预测结合。
[0428]2预测以≤2.0%的等级评分结合的18hla i类超型的数目(全部结合)。
[0429]3预测以≤0.5%的等级评分结合的18hla i类超型的数目(强结合)。
[0430]4.bassani-sternberg等人2016,nature comm.,7:13404
[0431]
表3正常组织样品集合中从clt抗原1至8衍生的肽的数目。
[0432]
抗原皮肤肺乳腺clt抗原10/100/90/18clt抗原20/100/90/18clt抗原30/100/90/18clt抗原40/100/90/18clt抗原50/100/90/18clt抗原60/100/90/18clt抗原70/100/90/18clt抗原80/100/90/18
[0433]
此处在实施例1和2中呈现的结果总体上或部分地基于癌症基因组图谱(tcga)研究网络(http://cancergenome.nih.gov/)和基因型-组织表达(gtex)项目(美国国家卫生研究院总监办公室共同基金会支持及nci、nhgri、nhlbi、nida、nimh和ninds支持)生成的数据。
[0434]
实施例3
–
证实黑素瘤患者中针对clt抗原的t细胞特异性的测定
[0435]
(a)用clt抗原肽五聚物染色反应性t细胞
[0436]
可以通过使用hla i类/肽-五聚物(“五聚物”)染色和/或体外杀伤分析测量黑素瘤患者中clt抗原特异性循环型cd8 t细胞的存在和活性。因此,这些方法应用于使用实施例1和2中阐明的方法所发现的clt抗原(表1-3、图1-31)可以用来展示癌症患者中存在有治疗意义的针对clt抗原的t细胞反应。
[0437]
对于这些研究,使用多种培养方法,例如抗cd3和抗cd28包覆的微珠加白介素-2,扩充从患者血液分离的cd8 t细胞。随后,使用clt肽五聚物,扩充的细胞可以就其t细胞受体的特异性clt抗原反应性染色,所述的肽五聚物由结合于hla分子的肽-结合沟中相关clt抗原肽的hla i类分子的五聚物组成。通过用藻红蛋白缀合或别藻蓝蛋白缀合的对五聚物结构的卷曲螺旋多聚化结构域特异的抗体片段检测,测量结合作用。除五聚物染色之外,可以查询其他表面标志物,如记忆标志物cd45ro和溶酶体释放标志物cd107a。五聚物阳性与特异性表面标志物的关联可以用来推测五聚物反应性t细胞群体的数目和状态(记忆细胞与初始细胞/干细胞)。
[0438]
也可以使用荧光激活细胞分选(facs)分选并纯化五聚物染色的细胞。随后可以在体外杀伤分析中进一步测试已分选细胞杀伤靶细胞的能力。这些分析包含cd8 t细胞群体和荧光标记的靶细胞群体。在这种情况下,cd8群体对已知诱导强烈杀死反应的阳性对照抗原如mart-1有clt抗原特异性或是经cd8 t细胞五聚物分选过且对前述阳性对照抗原有特异性。这些研究的靶细胞可以包括表达hla-a*02的肽脉冲标记的t2细胞、经hla-a*02,03或b*07转染的肽脉冲标记的c1r细胞、先前显示表达clt/clt抗原的黑素瘤细胞系或患者肿瘤细胞或如clt可读框转染的caski等细胞系。7aad的摄取表明靶细胞死亡。以这种方式,随着
靶细胞遭cd8 t细胞介导的凋亡杀伤,它们获得红色荧光。因此,这类杀伤分析对五聚物分选的clt抗原特异性cd8 t细胞的应用可以用来计数黑素瘤患者或健康供体t细胞的离体培养物中clt抗原特异性t细胞的细胞毒活性。
[0439]
图32显示在五聚物阳性细胞的荧光激活细胞分选以及使用抗cd3和抗cd28包被的珠加il-2扩充14天后,具有衍生自clt抗原6的肽(肽slyghihnea(seq id no.39))的健康供体cd8 t细胞的hla五聚物染色。右侧小图显示这些cd8 t细胞对肽脉冲的a2靶细胞的抗原特异性杀伤非常弱,但对转染了clt抗原6可读框的caski细胞具有有效的抗原特异性杀伤。这种体外杀伤分析的阴性对照包括没有肽的无关t2细胞和未转染的caski细胞。
[0440]
(b)黑素瘤患者中t细胞特异性的hervfest分析
[0441]
特定t细胞功能扩充(fest)技术已用于鉴定存在于对检查点阻断疗法有反应的患者的肿瘤细胞中的“突变相关新抗原”(mana)库中存在的特定肿瘤衍生的表位(anagnostou等人,cancer discovery 2017;le等人,science2017)。将此技术应用于使用实施例1和2(表1至3,图1-31)中阐明的方法发现的clt抗原可以证实癌症患者中存在针对clt抗原的治疗相关t细胞反应。
[0442]
与在受到免疫暴露的受试者中鉴定表位特异性t细胞的其他分析(例如,elispot)类似,“fest”技术通过在体外培养物中扩充同源t细胞来获得它们的特异性,所述体外培养物中包含抗原呈递细胞和合适的抗原肽。该技术与其他免疫学分析的不同之处在于,它利用这些扩充培养物中存在的t细胞受体(tcr)mrna的下一代测序(特别是:针对tcr-vβcdr3区的tcrseq)来检测在与目标肽一起培养的细胞中扩充的特定tcr(使用标准hla结合算法预先选择以匹配患者的hla类型)。将tcrseq应用于在成功的检查点阻断疗法后收获的同一患者的肿瘤组织,然后可用于确定在体外、肽刺激培养物中检测到的哪些tcr/t细胞也存在于癌症的免疫抑制位点。在manafest的情况下,该方法用于鉴定识别mhc呈递的新抗原肽的特定tcr,这些新抗原肽在每个患者的肿瘤中进化,并且也在患者肿瘤的t细胞中检测到,从而允许在对每位患者的正常和肿瘤组织进行全外显子组测序发现的数千种可能的突变肽中鉴定功能相关的新抗原肽(le等人,science 2017)。
[0443]
如下所述将manafest(anagnostou等人,2017cancer discovery)技术应用于clt抗原。步骤1:在clt抗原中鉴定预测包含有效结合选定hla超型的表位的肽。步骤2:选择来自适当患者的pbmc,并按hla类型将其与步骤1中选择的肽库匹配。步骤4:将来自这些患者的pbmc分为t细胞和非t细胞部分。非t细胞经过辐射(以防止增殖),并重新添加到患者的t细胞中,然后分成20-50个样本,并在t细胞生长因子和单独的clt特异性合成肽(在步骤1中选择的)中培养10至14天。步骤4:对所有孔进行tcrseq(表位特异性tcr-vβcdr3序列的测序),以鉴定在测试肽存在下已扩充的同源t细胞/tcr;通过与使用tcrseq在未扩充/增殖的t细胞中检测到的tcr进行比较来确定这些tcr的特异性。从该步骤获得的数据可以确认哪些肽在患者中引发免疫反应。步骤5:对肿瘤样本进行tcrseq,以确定哪些特异性扩充的tcr归属于对检查点阻断疗法有反应的患者的肿瘤,提供证据表明携带该tcr的t细胞可能有助于检查点阻断疗法的有效性。
[0444]
实施例4-证明对尚未从正常受试者t 细胞库中删除的clt抗原具有特异性的高亲和力t细胞的分析
[0445]
elispot分析可用于显示clt抗原特异性cd8 t细胞存在于健康个体的正常t细胞
库中,因此尚未因中央耐受缺失,原因是在这些患者的初始和胸腺组织中表达癌症特异性clt抗原。这种类型的elispot分析包括多个步骤。步骤1:cd8 t细胞和cd14单核细胞可以从正常献血者的外周血中分离出来,这些细胞经过hla分型以匹配被测试的特定clt抗原。cd8 t细胞可以使用针对记忆标志物cd45ro的磁性标记抗体进一步细分为初始和记忆亚型。步骤2:将cd14单核细胞用独立或汇集的clt抗原肽脉冲三小时,之后与cd8 t细胞共培养14天。步骤3:将扩充的cd8 t细胞从这些培养物分离并且采用经肽脉冲的新鲜单核细胞再刺激过夜。这些肽可以包括;各个clt抗原肽、无关对照肽或已知针对传染性抗原(例如,cmv、ebv、flu、hcv)或自身抗原(例如mart-1)激发稳健应答的肽。在抗干扰素γ(ifnγ)抗体包被的平板上进行再刺激。抗体捕获肽刺激的t细胞分泌的任何ifnγ。在过夜活化后,从平板洗下细胞并且用其他抗ifnγ抗体和标准比色染料检测在平板上捕获的ifnγ。如若产生ifnγ的细胞最初在平板上,则留下暗点。从这类分析衍生的数据包括点计数、点中位大小和点中位强度。这些数据是产生ifnγ的t细胞频率和每个细胞的ifnγ量的度量。另外,可以从刺激指数(si)导出clt抗原响应幅度的度量,所述刺激指数是特异性响应,以点计数或点中位大小除以无特定肽时对单核细胞的背景响应计量。通过点数目的刺激指数乘以点强度的刺激指数,导出刺激强度的计量。以这种方式,比较clt抗原的响应和对照抗原的响应可以用来展示:初治受试者含有可以通过基于clt抗原的免疫原性制剂接种加以扩充的稳健clt抗原反应性t细胞库。表4提供了从hla匹配的正常献血者中诱导显著cd8 t细胞反应的一系列clt抗原衍生肽。结果如图33-38所示。水平标度代表数据的平均值。m t表示无肽、阴性对照(单核细胞和t细胞)。cef表示阳性对照(23个cmv、ebv和流感肽的混合物)。使用kruskall wallis检验单向方差分析检测统计学显著性,并使用dunns校正对重复测量进行校正。图33显示正常献血者对来自clt抗原1(图中的clt001)的hla-a*02:01限制性肽的显著cd8 t细胞反应。图34显示正常献血者对来自clt抗原1(图中的clt001)的hla-a*0301限制性肽的显著cd8 t细胞反应。图35显示正常献血者对来自clt抗原2(图中的clt002)的hla-b*0702限制性肽的显著cd8 t细胞反应。图36显示正常献血者对来自clt抗原3(图中的clt003)的hla-a*0301限制性肽的显著cd8 t细胞反应。图37显示正常献血者对来自clt抗原5(图中的clt005)的hla-a*0301限制性肽的显著cd8 t细胞反应。图38显示正常献血者对来自clt抗原6(图中的clt006)的hla-a*0201限制性肽的显著cd8 t细胞反应。
[0446]
表4:来自hla匹配的正常献血者中诱导显著的cd8 t细胞反应的clt抗原衍生肽
[0447]
参考clt抗原seq id no肽序列肽的hla类型(由netmhc预测)1seq id.no.9glnsiiwrlhla-a*02:011seq id.no.10iliqttgifkhla-a*03:012seq id.no.13fpfykdtvllhla-b*07:023seq id.no.15ivldapvtkhla-a*03:015seq id.no.18alravtltakhla-a*03:016seq id.no.39slyghihneahla-a*02:01
[0448]
实施例5
–
验证clt在黑素瘤细胞中表达的分析
[0449]
a)qrt-pcr验证黑素瘤细胞系中的clt表达
[0450]
定量实时聚合酶链反应(qrt-pcr)是一种确定从给定生物样品提取的rna中存在的特定转录物数量的普遍技术。针对目的转录物设计特异性核酸引物序列,并且随后通过
一系列热循环反应扩增引物之间的区域并且通过使用嵌入性染料(sybr green)以荧光方式定量。针对clt设计引物对,并且针对从黑素瘤细胞系或原代患者组织提取的rna进行分析。利用非黑素瘤细胞系作为阴性对照。所使用的黑素瘤细胞系包括colo 829(atcc参考号crl-1974)、mewo(atcc参考号htb-65)、sh-4(atcc参考号crl-7724)和对照细胞系hepg2(肝细胞癌,atcc参考号hb-8065)、jurkat(t细胞白血病,atcc参考号tib152)和mcf7(腺癌,atcc参考号htb-22)。从6个原发病灶和6个转移病灶获得患者来源的黑色素瘤组织,所有病灶均来自至少iic期疾病的患者。从每个样品提取rna并且遵循标准程序逆转录成cdna。遵循标准技术,用针对每种clt的两个区域和参比基因设计的引物进行qrt-pcr分析连同sybr green检测。相对定量(rq)计算为:
[0451]
rq=2[ct(参考)-ct(靶)]。
[0452]
图39中显示这些实验的结果。小图a显示来自qrt-pcr分析的结果,其中两个引物组(76 77和78 79)靶向从12个黑素瘤组织样品和一个非黑素瘤细胞系中提取的rna上编码clt抗原2的clt(seq id no.24)的不同区域。小图b显示来自qrt-pcr分析的结果,其中两个引物组(44 45和46 47)靶向从12个黑素瘤组织样品和一个非黑素瘤细胞系中提取的rna上编码clt抗原3的clt(seq id no.25)的不同区域。小图c显示来自qrt-pcr分析的结果,其中两个引物组(80-81和82-83)靶向从12个黑素瘤组织样品和一个非黑素瘤细胞系中提取的rna上编码clt抗原6的clt(seq id no.28)的不同区域。这些结果证实了与非黑素瘤细胞系相比,从黑素瘤组织样品中提取的rna中clt的特异性表达。在分析的两个或更多个组织样品中检测到每种clt,而在非黑素瘤对照细胞系中有很少甚至没有检测到表达。
[0453]
b)rnascope验证原位黑素瘤细胞中的clt表达
[0454]
转录物表达分析的原位杂交(ish)方法允许可视化给定转录物在标本的组织病理学背景内部的存在和表达水平。传统rna ish分析包括用针对预期rna序列短段特异的寡核苷酸探针原位识别天然rna分子,所述识别借助基于抗体或酶的比色反应的组合产生的信号可视化。rnascope是一种新近开发的基于原位杂交的采用更先进探针化学的技术,所述探针化学确保产生的信号的特异性并允许靶转录物的灵敏、单分子视觉化(wang等人2012jmol diagn.14(1):22-29)。转录物分子的阳性染色作为给定细胞中的小红点出现,其中多个点表示存在的多种转录物。
[0455]
针对clt设计rnascope探针并且对12个福尔马林固定、石蜡包埋的皮肤黑素瘤肿瘤芯部的切片进行分析。如下对来自每个芯部的代表性图像评定表达信号:
[0456]
·
估计的clt探针阳性染色细胞%,修约直至最接近的10
[0457]
·
跨给定切片的估计每细胞表达水平为:
[0458]
·
0=无染色
[0459]
·
1=每细胞1-2个点
[0460]
·
2=每细胞2-6个点
[0461]
·
3=每细胞6-10个点
[0462]
·
4=每细胞》10个点
[0463]
跨多个不同患者肿瘤芯部检出每个clt各自表达,从而独立地验证从肿瘤衍生的rnaseq数据发现的clt,并且跨某些样品确认肿瘤组织内部表达的均一性,以及还凸显在分析的每位患者芯部存在至少一个clt。
[0464]
表5
–
黑素瘤患者组织芯部中的rnascope评定
[0465][0466]
在本说明书和后续的权利要求书通篇范围内,除非内容要求,否则词汇“包含”和其变异形式如“包括了”和“包含有”将理解为表示纳入所述的整数、步骤、整数群或步骤群,但将不排除任何其它的整数、步骤、整数群或步骤群。
[0467]
本发明的说明书通篇提到的全部专利、专利申请和参考文献均通过引用的方式完整并入本文。
[0468]
本发明包括上文提及的优选群组与更优选群组和合适群组与更多群组及群组的实施方案的全部组合。
[0469]
序列表
[0470]
seq id no.1(clt抗原1的多肽序列)
[0471][0472]
seq id no.2(clt抗原2的多肽序列)
[0473][0474]
seq id no.3(clt抗原3的多肽序列)
[0475][0476]
seq id no.4(clt抗原4的多肽序列)
[0477][0478]
seq id no.5(clt抗原5的多肽序列)
[0479][0480]
seq id no.6(clt抗原6的多肽序列)
[0481]
[0482]
seq id no.7(clt抗原7的多肽序列)
[0483][0484]
seq id no.8(clt抗原8的多肽序列)
[0485][0486]
seq id no.9(衍生自clt抗原1的肽序列)
[0487][0488]
seq id no.10(衍生自clt抗原1的肽序列)
[0489][0490]
seq id no.11(衍生自clt抗原2的肽序列)
[0491][0492]
seq id no.12(衍生自clt抗原2的肽序列)
[0493][0494]
seq id no.13(衍生自clt抗原2的肽序列)
[0495][0496]
seq id no.14(衍生自clt抗原2的肽序列)
[0497][0498]
seq id no.15(衍生自clt抗原3的肽序列)
[0499][0500]
seq id no.16(衍生自clt抗原4的肽序列)
[0501][0502]
seq id no.17(衍生自clt抗原4的肽序列)
[0503][0504]
seq id no.18(衍生自clt抗原5的肽序列)
[0505][0506]
seq id no.19(衍生自clt抗原6的肽序列)
[0507][0508]
seq id no.20(衍生自clt抗原6的肽序列)
[0509][0510]
seq id no.21(衍生自clt抗原7的肽序列)
[0511][0512]
seq id no.22(衍生自clt抗原8的肽序列)
[0513][0514]
seq id no.23(编码clt抗原1的clt的cdna序列)
[0515]
[0516][0517]
seq id no.24(编码clt抗原2的clt的cdna序列)
[0518]
[0519]
[0520][0521]
seq id no.25(编码clt抗原3的clt的cdna序列)
[0522]
[0523][0524]
seq id no 26(编码clt抗原4的clt的cdna序列)
[0525][0526]
seq id no 27(编码clt抗原5的clt的cdna序列)
[0527][0528]
seq id no 28(编码clt抗原6的clt的cdna序列)
[0529]
[0530]
[0531][0532]
seq id no 29(编码clt抗原7的clt的cdna序列)
[0533]
[0534][0535]
seq id no 30(编码clt抗原8的clt的cdna序列)
[0536][0537][0538]
seq id no.31(编码clt抗原1的cdna序列)
[0539][0540]
seq id no.32(编码clt抗原2的cdna序列)
[0541][0542]
seq id no.33(编码clt抗原3的cdna序列)
[0543][0544]
seq id no.34(编码clt抗原4的cdna序列)
[0545][0546]
seq id no 35(编码clt抗原5的cdna序列)
[0547][0548]
seq id no 36(编码clt抗原6的cdna序列)
[0549][0550]
seq id no 37(编码clt抗原7的cdna序列)
[0551][0552]
seq id no 38(编码clt抗原8的cdna序列)
[0553][0554]
seq id no 39(衍生自clt抗原6的肽序列)
[0555]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。