1.本发明涉及一种分析区分方法,具体地说是建立“hcho
‑ꢀ
nahso3ꢀ‑ꢀ
na2so
3”为底物的ph时钟体系,根据该体系对于不同卤酸盐的响应不同即诱导时间的不同实现对于氯酸钾(kcio3)及溴酸钾(kbro3)的定性分析方法,属于分析化学领域。
背景技术:
2.由卤素酸根离子和碱金属构成的盐广泛存在于水溶液中,对人类的生产生活产生不同的影响:氯酸钾,分子式:kcio3,氯酸钾溶液稳定性较低且具有强氧化性,属于易制爆的管制品,要避免接触有机材料及还原性物质;溴酸钾,分子式:kbro3,溴酸钾是水中受管制的污染物,被国际癌症研究机构定为2b级的潜在致癌物。另外,在水溶液进行化学消毒的过程中,氯酸盐和溴酸盐易被电化学还原成相应的还原形式,由于其慢性毒性,已受到相当多的关注。因此卤酸盐的鉴别对于科学研究的发展、人类生命的健康和地球环境的改善有重大意义。
3.由于氯酸钾和溴酸钾溶液均为无色、无味澄清透明液体,因此使它们难以直观区分,给定性分析带来了困难。目前已经报道的区分氯酸钾及溴酸钾的方法主要采用仪器分析方法,如离子色谱(ic)法、质谱法和离子色谱-质谱(ic
‑ꢀ
ms)联用技术,也有采用化学发光、分光光度和流动注射在线萃取荧光法等光学法测定的报道。离子色谱法和离子色谱-质谱联用均具有灵敏度高、准确性好的优点,但对基体复杂的样品,前者的分析灵敏度降低,后者具有更高的灵敏度和准确度,不过所需仪器尚难普及。因此寻找一种检测效果好且操作简便快速的检测分析方法就显得十分必要。
技术实现要素:
4.本发明旨在为氯酸钾和溴酸钾提供一种新颖且方便快捷的区分方法,即以“hcho
‑ꢀ
nahso3ꢀ‑ꢀ
na2so3”ꢀ
ph时钟反应体系为区分溶液对kcio3和kbro3进行定性区分的方法,本方法是基于该ph时钟体系对kcio3和kbro3的敏感响应而开发的一种时钟体系法。具体地说,应用“hcho
‑ꢀ
nahso3ꢀ‑ꢀ
na2so
3”ph时钟反应体系作为区分溶液,记录ph随时间变化的图谱,当ph时钟反应开始时,分别将相同浓度待区分样品(氯酸钾和溴酸钾)等体积加入到ph时钟体系中,根据待区分样品对体系所产生的诱导时间的不同,实现对于待区分样品的区分:若加入待区分溶液后,ph时钟的诱导时间有较小程度的延长,则所加入的待区分样品为氯酸钾;若加入待区分溶液后,ph时钟的诱导时间有较大程度的延长,则所加入的待区分样品为溴酸钾。且本发明处理样品时间短,测定条件简单易控制便于推广和应用。
5.本定性区分方法与现有技术的区别在于,本发明应用“hcho
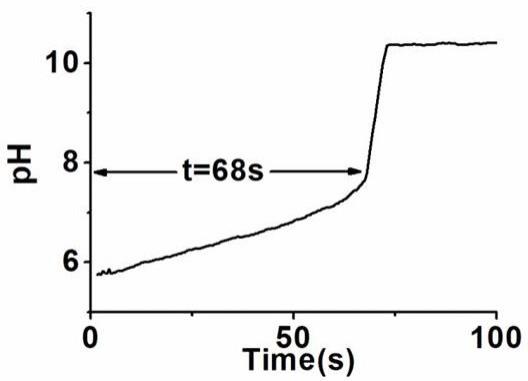
‑ꢀ
nahso
3 ‑ꢀ
na2so
3”ph时钟体系作为区分溶液,以及该体系对于氯酸钾和溴酸钾的响应不同即诱导时间的不同,实现对于氯酸钾和溴酸钾的定性分析。
6.氯酸钾和溴酸钾在区分溶液(ph时钟体系)中的可区分的浓度范围为5.0
×
10-4
mol/l-2.5
×
10-3
mol/l。
7.区分待测溶液时ph时钟体系的温度被控制在20-25℃范围内任意一个特定的温度。
8.上述待区分溶液可区分的浓度范围是经实验确定的最优浓度范围。在该浓度范围内,氯酸钾和溴酸钾对该区分溶液产生的影响差异十分明显,易于观察分析,容易实现区分。另外,区分溶液(ph时钟体系)中各组分的浓度范围如表1所示,经过多次实验得到的区分溶液(ph时钟体系)的最佳溶液如表2所示:表1:ph时钟体系中各组分的浓度hcho(mol/l)nahso3(mol/l)na2so3(mol/l)0.045-0.06250.045-0.06250.0045-0.00625表2:ph时钟体系中各组分的最佳浓度hcho(mol/l)nahso3(mol/l)na2so3(mol/l)0.0510.04950.00495具体实验步骤如下:1、按表1规定的浓度范围配制待区分溶液(ph时钟体系),其温度被控制在20-25℃之间的某一特定的温度值保持不变;将准备好的工作电极(ph复合电极,雷磁,e-331)插入溶液中,工作电极的另一端通过电位/温度/ph综合测试仪(嘉兴迪生电子科技有限公司,zhfx-595)连接至电脑,打开电脑中化学信号采集分析程序对采集时间和取样速度进行设置后,迅速点击开始键对溶液进行ph监测。计算机记录所采集的ph随时间变化的曲线,即ph时钟图谱(此时尚未加入待测试样),以作空白对照。向两组各组分浓度相同的区分溶液中,在ph时钟体系反应开始的同时迅速加入待区分溶液,按相同的方式记录ph随时间变化的ph时钟图谱,根据待区分样品对ph时钟体系的响应不同即诱导时间不同,实现对待区分样品的定性分析。具体如下:若加入待区分溶液后,ph时钟的诱导时间有较小程度的延长,则所加入的待区分样品为氯酸钾;若加入待区分溶液后,ph时钟的诱导时间有较大程度的延长,则所加入的待区分样品为溴酸钾;ph时钟图谱的基本参数包括:诱导时间:从ph时钟体系反应开始到ph突跃所需的时间。
9.ph突跃范围:ph突跃开始对应的ph到ph突跃结束对应的ph。
附图说明
10.图1是实施例1中,未加入待区分样品时,区分溶液(ph时钟体系)ph值随时间变化的图谱。
11.图2是实施例1中,加入5
×
10-4
mol/l kcio3后,区分溶液(ph时钟体系)ph值随时间变化的图谱。
12.图3是实施例1中,加入5
×
10-4
mol/l kbro3后,区分溶液(ph时钟体系)ph值随时间变化的图谱。
13.图4是实施例2中,未加入待区分样品时,区分溶液(ph时钟体系)ph值随时间变化的图谱。
14.图5是实施例2中,加入1
×
10-3
mol/l kcio3后,区分溶液(ph时钟体系)ph值随时间变化的图谱。
15.图6是实施例2中,加入1
×
10-3
mol/l kbro3后,区分溶液(ph时钟体系)ph值随时间变化的图谱。
16.图7是实施例3中,未加入待区分样品时,区分溶液(ph时钟体系)ph值随时间变化的图谱。
17.图8是实施例3中,加入2
×
10-3
mol/l kcio3后,区分溶液(ph时钟体系)ph值随时间变化的图谱。
18.图9是实施例3中,加入2
×
10-3
mol/l kbro3后,区分溶液(ph时钟体系)ph值随时间变化的图谱。
具体实施方式
19.实施例1:本实施例按如下步骤验证本发明氯酸钾和溴酸钾的区分方法的可行性:(1) 配制溶液首先用蒸馏水配制分别配制0.2mol/l的hcho溶液、0.1mol/l的nahso3和0.01mol/l 的na2so3的混合溶液。向50ml小烧杯中依次加入10.0ml 蒸馏水溶液、19.8ml nahso
3 ‑ꢀ
na2so3混合溶液、10.2ml 0.2mol/l hcho溶液,以保证“hcho
‑ꢀ
nahso
3 ‑ꢀ
na2so
3”ph时钟体系中各组分的浓度为hcho 0.051mol/l、nahso
3 0.0495mol/l、na2so
3 0.00495mol/l,总体积为40ml,温度被控制在25℃。
20.同时以蒸馏水为溶剂,配制系0.1mol/l的氯酸钾溶液和溴酸钾溶液。
21.(2) 获得ph时钟图谱配制好的区分溶液的ph值随时间变化的图谱由装有化学信号采集分析程序的计算机记录(未加入区分样品)。如图1所示。ph诱导时间为68s以作空白对照。另配置两组各组分浓度与上述区分溶液相同的区分溶液。对于其中一组,在反应开始的同时,向40 ml的ph时钟体系中加入200μl0.1mol/l的氯酸钾样品溶液,使得氯酸钾在区分液中的浓度为5
×
10-4
mol/l,加入的氯酸钾使得诱导时间延长为77s如图2所示;对于另一组,在反应开始的同时,向40 ml的ph时钟体系中加入200μl 0.1mol/l的溴酸钾样品溶液,使得溴酸钾在区分溶液中的浓度为5
×
10-4
mol/l,加入的溴酸钾使得诱导时间变为85s如图3所示。
22.(3) 区分作为氯酸钾和溴酸钾因为化学式不同,其对ph时钟体系的诱导时间影响也不相同。比较图2 图3可知,氯酸钾的加入,使得ph时钟的诱导时间有较小程度的延长;溴酸钾的加入,使得ph时钟的诱导时间有较大程度的延长。由上述实验可知,通过比较ph时钟体系诱导时间的变化,可以实现对氯酸钾和溴酸钾的区分。
23.取事先配制的两个0.1mol/l的待区分样品的溶液(其中一个为氯酸钾溶液,另一个为溴酸钾溶液,但两者尚未区分),将其中一个标记为样品1,另一个标记为样品2;配制两组各组分浓度与上述浓度相同的ph时钟体系溶液,分别采集相应的扰动图谱,在ph时钟开始时分别加入200μl 0.1mol/l的样品1和样品2,使得它们在区分溶液中的浓度为5
×
10-4
mol/l。
24.分析比较可知:样品1的加入,使得ph时钟的诱导时间有较小程度的延长(振荡图谱与图2相对应、与图3不对应),而样品2的加入,使得ph时钟的诱导时间有较大程度的延长
(振荡图谱与图3相对应、与图2不对应)。因此,样品1是氯酸钾溶液、样品2是溴酸钾溶液,从而实现了对氯酸钾及溴酸钾溶液的区分。
25.实施例2:本实施例按如下步骤验证本发明氯酸钾和溴酸钾的区分方法的可行性:(1) 配制溶液首先用蒸馏水配制分别配制0.2mol/l的hcho溶液、0.1mol/l的nahso3和0.01mol/l 的na2so3的混合溶液。向50ml小烧杯中依次加入9.5ml 蒸馏水溶液、20.0ml nahso
3 ‑ꢀ
na2so3混合溶液、10.5ml 0.2mol/l hcho溶液,以保证“hcho
‑ꢀ
nahso
3 ‑ꢀ
na2so
3”ph时钟体系中各组分的浓度为hcho 0.0525mol/l、nahso
3 0.05mol/l、na2so
3 0.005mol/l,总体积为40ml,温度被控制在25℃。
26.同时以蒸馏水为溶剂,配制系0.1mol/l的氯酸钾溶液和溴酸钾溶液。
27.(2) 获得ph时钟图谱配制好的区分溶液的ph值随时间变化的图谱由装有化学信号采集分析程序的计算机记录(未加入区分样品)。如图4所示。ph诱导时间为67s以作空白对照。另配置两组各组分浓度与上述区分溶液相同的区分溶液。对于其中一组,在反应开始的同时,向40 ml的ph时钟体系中加入400μl0.1mol/l的氯酸钾样品溶液,使得氯酸钾在区分液中的浓度为1.0
×
10-3
mol/l,加入的氯酸钾使得诱导时间延长为81s如图5所示;对于另一组,在反应开始的同时,向40 ml的ph时钟体系中加入400μl 0.1mol/l的溴酸钾样品溶液,使得溴酸钾在区分溶液中的浓度为1.0
×
10-3
mol/l,加入的溴酸钾使得诱导时间变为88s如图6所示。
28.(3) 区分作为氯酸钾和溴酸钾因为化学式不同,其对ph时钟体系的诱导时间影响也不相同。比较图5 图6可知,氯酸钾的加入,使得ph时钟的诱导时间有较小程度的延长;溴酸钾的加入,使得ph时钟的诱导时间有较大程度的延长。由上述实验可知,通过比较ph时钟体系诱导时间的变化,可以实现对氯酸钾和溴酸钾的区分。
29.取事先配制的两个0.1mol/l的待区分样品的溶液(其中一个为氯酸钾溶液,另一个为溴酸钾溶液,但两者尚未区分),将其中一个标记为样品1,另一个标记为样品2;配制两组各组分浓度与上述浓度相同的ph时钟体系溶液,分别采集相应的扰动图谱,在ph时钟开始时分别加入400μl 0.1mol/l的样品1和样品2,使得它们在区分溶液中的浓度为1
×
10-3
mol/l。
30.分析比较可知:样品1的加入,使得ph时钟的诱导时间有较小程度的延长(振荡图谱与图5相对应、与图6不对应),而样品2的加入,使得ph时钟的诱导时间有较大程度的延长(振荡图谱与图6相对应、与图5不对应)。因此,样品1是氯酸钾溶液、样品2是溴酸钾溶液,从而实现了对氯酸钾及溴酸钾溶液的区分。
31.实施例3:本实施例按如下步骤验证本发明氯酸钾和溴酸钾的区分方法的可行性:(1) 配制溶液首先用蒸馏水配制分别配制0.2mol/l的hcho溶液、0.1mol/l的nahso3和0.01mol/l 的na2so3的混合溶液。向50ml小烧杯中依次加入10.2ml 蒸馏水溶液、20ml nahso
3 ‑ꢀ
na2so3混合溶液、9.8ml 0.2mol/l hcho溶液,以保证“hcho
‑ꢀ
nahso
3 ‑ꢀ
na2so
3”ph时钟体系
中各组分的浓度为hcho 0.049mol/l、nahso
3 0.05mol/l、na2so
3 0.005mol/l,总体积为40ml,温度被控制在25℃℃。
32.同时以蒸馏水为溶剂,配制系0.1mol/l的氯酸钾溶液和溴酸钾溶液。
33.(2) 获得ph时钟图谱配制好的区分溶液的ph值随时间变化的图谱由装有化学信号采集分析程序的计算机记录(未加入区分样品)。如图7所示。ph诱导时间为68s以作空白对照。另配置两组各组分浓度与上述区分溶液相同的区分溶液。对于其中一组,在反应开始的同时,向40 ml的ph时钟体系中加入800μl 0.1mol/l的氯酸钾样品溶液,使得氯酸钾在区分液中的浓度为2.0
×
10-3
mol/l,加入的氯酸钾使得诱导时间延长为102s如图8所示;对于另一组,在反应开始的同时,向40 ml的ph时钟体系中加入800μl 0.1mol/l的溴酸钾样品溶液,使得溴酸钾在区分溶液中的浓度为2.0
×
10-3
mol/l,加入的溴酸钾使得诱导时间变为123s如图9所示。
34.(3) 区分作为氯酸钾和溴酸钾因为化学式不同,其对ph时钟体系的诱导时间影响也不相同。比较图8 图9可知,氯酸钾的加入,使得ph时钟的诱导时间有较小程度的延长;溴酸钾的加入,使得ph时钟的诱导时间有较大程度的延长。由上述实验可知,通过比较ph时钟体系诱导时间的变化,可以实现对氯酸钾和溴酸钾的区分。
35.取事先配制的两个0.1mol/l的待区分样品的溶液(其中一个为氯酸钾溶液,另一个为溴酸钾溶液,但两者尚未区分),将其中一个标记为样品1,另一个标记为样品2;配制两组各组分浓度与上述浓度相同的ph时钟体系溶液,分别采集相应的扰动图谱,在ph时钟开始时分别加入800μl 0.1mol/l的样品1和样品2,使得它们在区分溶液中的浓度为2
×
10-3
mol/l。
36.分析比较可知:样品1的加入,使得ph时钟的诱导时间有较小程度的延长(振荡图谱与图8相对应、与图9不对应),而样品2的加入,使得ph时钟的诱导时间有较大程度的延长(振荡图谱与图9相对应、与图8不对应)。因此,样品1是氯酸钾溶液、样品2是溴酸钾溶液,从而实现了对氯酸钾及溴酸钾溶液的区分。
37.通过以上各实施例可以看出,更小或更大浓度的氯酸钾及溴酸钾溶液也可以通过本发明方法进行区分。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。