1.本发明涉及一种将外来物质从真核细胞的外部向该细胞的内部导入(移送)的方法和用于该方法的载体肽片段。
背景技术:
2.目前,向人或人以外的哺乳动物等的细胞(真核细胞)内导入多肽等外来物质,尤其是生理活性物质,改变该细胞(进而由该细胞构成的组织或器官)的性状,或者改善、提高该细胞的功能。
3.例如,在专利文献1中公开了一种用于将多肽、dna等外来物质导入细胞内的细胞透过性载体肽。在该专利文献中记载了通过使用将细胞透过性载体肽和异源多肽、dna等连结而成的载体肽缀合物(carrier peptide conjugate),能够将多肽、dna等生理活性物质高效地导入细胞内。
4.另外,寻求一种方法,其能够不使用特别的装置而将分子量较大的多肽整体作为想要导入的外来物质(生理活性物质)容易地导入目标细胞内,改变该细胞的性状、或者改善(或提高)功能。
5.再或者,寻求一种方法,其能够代替导入多肽或蛋白质整体,而着眼于该多肽具有的某特定的功能,将作为可表达该功能的最小单位的氨基酸序列部分、即构成肽基序(肽片段)的氨基酸序列(外来物质)高效地导入细胞内。
6.现有技术文献
7.专利文献
8.专利文献1:日本专利第3854995号公报
9.专利文献2:国际公开第2011/013700号
10.非专利文献
11.非专利文献1:生物化学期刊(jounal of biological chemistry),281卷35号,2006年,pp.25223-25230
技术实现要素:
12.发明所要解决的课题
13.在专利文献2中公开了一种外来物质导入用构建体,其包含非专利文献1所记载的作为核仁定位信号(nucleolar localization signal:以下称为“nols”。)已知的序列号2记载的氨基酸序列(载体肽片段)和目标外来物质。该构建体由于能够高效地通过真核细胞的细胞膜,从而能够高效地将上述目标外来物质从真核细胞的外部向该细胞的细胞质内导入。
14.近年来,从医疗等观点考虑,对上述的以nols为首的细胞膜透过性肽的关注提高,期望更高效地将外来物质导入目标细胞的技术的开发。
15.因此,本发明是为了应对该期望而作出的,其目的在于提供一种能够高效地将目
标外来物质从真核细胞的外部至少向该细胞的细胞质内导入的方法。另外,本发明的目的在于提供一种构建体,其能够高效地将目标外来物质从真核细胞的外部导入该细胞的细胞质内,该构建体具有载体肽片段和该外来物质。
16.用于解决课题的方法
17.本发明的发明人为了更高效地将上述的专利文献2所公开的外来物质导入用构建体从真核细胞的外部向该细胞的细胞质导入,对序列号2所示的氨基酸序列进行了各种各样的氨基酸残基的取代,尝试了细胞膜透过性更高的构建体的制作。其结果发现,在将从序列号2所示的氨基酸序列的n末端侧开始数第8个天冬酰胺用丝氨酸取代且将第9个天冬酰胺酸取代为天冬酰胺而得到的突变体中,细胞膜透过性提高。出人意料的是,上述第9个氨基酸残基的取代并不是氨基酸残基的保守取代的所谓保守性取代(例如将碱性氨基酸残基用另外的碱性氨基酸残基取代得到的序列)。即,这里所公开的序列号1记载的氨基酸序列是本发明的发明人通过大量的试错而得到的。
18.这里所公开的方法是将目标外来物质从真核细胞(特别是以不具有细胞壁的人或其以外的哺乳动物为代表的各种动物细胞)的外部(即细胞膜的外侧)至少向该细胞的细胞质内(优选进一步向核内)导入(移送)的方法。即,这里所公开的外来物质导入方法包括:
19.(1)准备外来物质导入用构建体的工序,上述外来物质导入用构建体具有:
20.由以下的氨基酸序列构成的载体肽片段,
21.kkrtlrksnrkkr(序列号1);和
22.与上述载体肽片段的n末端侧和/或c末端侧结合的上述目标外来物质;
23.(2)将上述外来物质导入用构建体提供给包含目标真核细胞的样品中的工序;
24.(3)对供给了上述外来物质导入用构建体的所述样品进行孵育,向该样品中的真核细胞内导入上述外来物质导入用构建体的工序。
25.这里,“外来物质”是指能够与上述载体肽片段的n末端侧或c末端侧直接结合或经由适当的接头间接结合的无机化合物和有机化合物,且具有能够导入真核细胞内的分子尺寸和化学性质。
26.根据上述结构的外来物质导入方法,通过将使目标外来物质(典型地为多肽、核酸、色素、药剂等有机化合物)与上述载体肽片段的n末端侧和/或c末端侧直接结合或经由适当的接头间接结合而构建的外来物质导入用构建体提供到包含目标真核细胞的样品(例如,包含该细胞的培养物)中(即在生存的真核细胞中添加),能够使该目标外来物质从真核细胞的外部(细胞膜的外侧)通过细胞膜,高效地导入细胞质内(优选进一步通过核膜而导入核内)。
27.这里所公开的外来物质导入方法的优选的一个方式中,特征在于,上述外来物质是选自多肽、核酸、色素和药剂中的任一种有机化合物。以包含这样的有机化合物方式制得的构建体能够更高效地向目标细胞内导入。
28.这里,“多肽”是指具有多个氨基酸通过肽键键合而成的结构的聚合物。多肽的肽键的数量(即,氨基酸残基数)不受限定。即,多肽包括氨基酸残基数为10以上且低于300的程度的一般被称为肽的物质和一般被称为蛋白质(典型地为由300以上的氨基酸残基构成的高分子化合物)的物质。在该领域中,多肽和蛋白质未被严格区分。在本说明书中,将由多个氨基酸残基构成的聚合物(包括寡聚物。)总称为多肽。
29.另外,“核酸”是指核苷酸的聚合物,包含dna和rna。“核酸”的碱基数不受限定。
30.另外,这里所公开的外来物质导入方法的优选的另一个方式中,上述外来物质是源自任意生物种的成熟多肽或其前体多肽,上述外来物质导入用构建体是具有与作为该外来物质的成熟多肽或其前体多肽对应的氨基酸序列和上述载体肽片段的氨基酸序列的合成多肽。
31.根据该结构,能够将具有上述成熟多肽或其前体多肽的氨基酸序列和载体肽片段的氨基酸序列的合成肽高效地向目标真核细胞内导入。
32.另外,这里所公开的外来物质导入方法的优选的另一个方式中,与作为上述外来物质的成熟多肽或其前体多肽对应的氨基酸序列配置于上述载体肽片段的n末端侧。
33.根据该结构,能够更高效地将上述成熟多肽或其前体多肽的氨基酸序列向目标真核细胞内导入。
34.另外,这里所公开的外来物质导入方法的优选的另一个方式中,导入上述外来物质导入用构建体的对象的真核细胞是人或人以外的哺乳动物的细胞。
35.根据这里所公开的方法,能够高效地将外来物质向人或人以外的哺乳动物的细胞的细胞质内导入。
36.另外,本发明中,为了实现上述目的,提供用于将目标外来物质从真核细胞(特别是以没有细胞壁的人或其以外的哺乳动物为代表的各种动物细胞)的外部(即细胞膜的外侧)至少向该细胞的细胞质内(优选进一步向核内)导入(移送)而人工制作的外来物质导入用构建体。
37.即,这里所公开的外来物质导入用构建体具有由kkrtlrksnrkkr(序列号1)构成的载体肽片段和与该载体肽片段的n末端侧和/或c末端侧结合的上述目标外来物质。
38.通过利用这样的构建体实施上述的这里所公开的外来物质导入方法,能够高效地向目标真核细胞导入目标外来物质。
39.这里所公开的外来物质导入用构建体的优选的一个方式中,如上所述,上述外来物质是选自多肽、核酸、色素和药剂中的任一种有机化合物。
40.另外,优选上述外来物质是源自任意生物种的成熟多肽或其前体多肽,上述外来物质导入用构建体是具有与作为该外来物质的成熟多肽或其前体多肽对应的氨基酸序列和上述载体肽片段的氨基酸序列的合成多肽。
41.另外,进一步优选与作为上述外来物质的成熟多肽或其前体多肽对应的氨基酸序列配置于上述载体肽片段的n末端侧。
附图说明
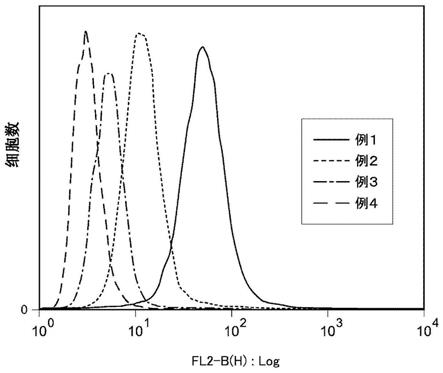
42.图1是表示在对hela细胞的培养液添加具有序列号1所示的氨基酸序列和fam的样品1的试验(例1)、添加具有序列号2所示的氨基酸序列和fam的样品2的试验(例2)、添加fam的试验(例3)和仅添加dmso的试验(例4)中,通过利用流式细胞仪对培养后的细胞进行分析而获得的荧光强度与细胞数的关系的直方图。x轴表示荧光强度,y轴表示细胞数。
具体实施方式
43.以下,对本发明的优选的实施方式进行说明。在本说明书中特别提及的事项以外
的实施所需的情况(例如与肽的化学合成法、细胞培养技术、包含肽或核酸作为成分的组合物的制备相关的一般事项)能够作为基于细胞工程、生理学、医学、药学、有机化学、生物化学、基因工程、蛋白质工程、分子生物学、遗传学等领域中的现有技术作为本领域技术人员的设计事项来把握。
44.另外,本发明能够基于本说明书所公开的内容和该领域中的技术常识来实施。此外,在以下的说明中,根据情况,依据由iupac-iub指南所示的与氨基酸有关的命名法的以1文字符号(其中,在序列表中为3文字符号)表示氨基酸。此外,在本说明书中,除了特别提及的情况以外,“氨基酸残基”是包含肽链的n末端氨基酸和c末端氨基酸的术语。
45.另外,在本说明书中,“合成肽”不是其肽链仅其独立稳定地存在于自然界的物质,而是指通过人工化学合成或者生物合成(即基于基因工程的生产)制造且能够在规定的组合物中稳定地存在的肽片段。这里,“肽”是指具有多个肽键的氨基酸聚合物的术语,不受氨基酸残基数限定。
46.此外,本说明书中所记载的氨基酸序列中,通常左侧表示n末端侧,右侧表示c末端侧。
47.这里所公开的外来物质导入用构建体具有由kkrtlrksnrkkr(序列号1)构成的载体肽片段和与该载体肽片段的n末端侧和/或c末端侧结合而成的上述目标外来物质。
48.这里所公开的“载体肽片段”是由序列号1所示的氨基酸序列规定(把握)的序列,且是发挥真核细胞的细胞膜透过性(进一步优选发挥核移行性(核膜透过性))的氨基酸序列。
49.如上所述,序列号1所示的氨基酸序列是制作对序列号2所示的氨基酸序列进行各种各样的氨基酸取代得到的突变体并对这些突变体的细胞膜透过性进行评价而发现的氨基酸序列。具体而言,序列号1所示的氨基酸序列是将从序列号2所示的氨基酸序列的n末端侧开始数第8个天冬酰胺取代为丝氨酸且将第9个天冬酰胺酸取代为天冬酰胺而得到的序列。
50.序列号2所示的氨基酸序列是相当于由作为与细胞内信息传递相关的蛋白激酶中的一种的存在于人内皮细胞的lim激酶2(lim kinase2:参照非专利文献1)的从第491个氨基酸残基至第503个氨基酸残基的合计13个氨基酸残基构成的序列部分(基序)的nols,如专利文献2所述,是显示优异的细胞膜透过性的序列部分。
51.序列号1所示的氨基酸序列是具有优于序列号2所示的氨基酸序列的细胞膜透过性的载体肽片段,因此,具有该载体肽片段和与该载体肽片段的n末端侧和/或c末端侧结合的目标外来物质的外来物质导入用构建体能够更高效地从真核细胞的外部至少向该细胞的细胞质内导入。
52.这里所公开的“载体肽片段”典型地为与序列号1所示的氨基酸序列相同的氨基酸序列,只要不损害细胞膜透过性,也包含该氨基酸序列的改变序列(modified sequence)。这里,“改变序列”是取代、缺失和/或添加(插入)1个或数个(典型地为2个或3个)氨基酸残基而形成的氨基酸序列(改变氨基酸序列)。对本领域技术人员而言,这样的轻微的改变序列能够基于这里所公开的信息而容易地利用,因此包含于作为这里所公开的技术思想的“载体肽片段”中。
53.作为本说明书中的改变序列的典型例,例如可以列举通过保守取代了1个、2个或3
个氨基酸残基的所谓保守性取代(conservative amino acid replacement)产生的序列、或对规定的氨基酸序列添加(插入)或者缺失1个、2个或3个氨基酸残基得到的序列等。作为保守性取代的典型例,例如可以列举将碱性氨基酸残基用另外的碱性氨基酸残基取代得到的序列(例如赖氨酸残基和精氨酸残基的相互取代)、或将疏水性氨基酸残基用另外的疏水性氨基酸残基取代得到的序列(例如亮氨酸残基、异亮氨酸残基和缬氨酸残基的相互取代)等。
54.外来物质导入用构建体能够通过将所希望的外来物质与上述载体片段的n末端侧和/或c末端侧直接结合或经由适当的接头间接结合(连结)来设计、构建。
55.接头没有特别限制,可以是肽性接头,也可以是非肽性接头。没有特别限制,构成肽性接头的氨基酸序列优选为不产生位阻且柔性的氨基酸序列。肽性接头例如可以是由包含1种或2种选自甘氨酸、丙氨酸和丝氨酸等的氨基酸残基的、10个以下(更优选为1个以上5个以下,例如1个、2个、3个、4个或5个氨基酸残基)的氨基酸残基构成的接头。另外,作为这样的接头也可以使用β丙氨酸。作为非肽性接头,没有特别限制,例如也可以使用烷基接头、peg(聚乙二醇)接头、氨基己酰基间隔基等。
56.外来物质典型地为多肽、核酸、色素、药剂等有机化合物。
57.外来物质例如可以是多肽。在外来物质是多肽的情况下,以包含构成该多肽的氨基酸序列和构成载体肽片段的氨基酸序列的方式设计肽链,并对该肽链进行生物合成或者化学合成,由此,能够制作目标外来物质导入用构建体。另外,能够通过现有公知的各种科学方法使各种dna或rna这样的核酸、色素(例如fam或fitc等各种荧光色素化合物)、或者作为药剂(例如包含5-氟尿嘧啶(5fu)等的核酸系抗肿瘤剂的抗肿瘤剂或齐多夫定(azt)等抗病毒剂等)发挥作用的有机化合物与上述的载体肽片段的n末端侧和/或c末端侧直接或者间接结合,构建外来物质导入用构建体。
58.没有特别限制,外来物质所具有的功能可以是例如干细胞的分化诱导的促进(干细胞分化诱导活性)、肿瘤细胞的增殖抑制(抗肿瘤活性)、病毒感染细胞的增殖抑制(抗病毒活性)等。
59.在外来物质导入用构建体中,与载体肽片段结合的外来物质的数量没有特别限制。即,可以使1种或1种以上的外来物质与1个载体肽片段结合。没有特别限制,例如,可以在1个载体肽片段的n末端侧结合多肽、核酸、药剂等,在c末端侧结合色素。通过使色素与载体肽片段结合,容易评价外来物质导入用构建体向真核细胞的导入效率及细胞内的定位,故而优选。
60.此外,在外来物质是多肽的情况下,所采用的多肽(氨基酸序列)没有特别限制。例如可以采用氨基酸残基数为100~1000左右的多肽或者蛋白质这样的、氨基酸残基数较多的物质作为外来物质。
61.典型地,构成外来物质导入用构建体制作的合成肽的总氨基酸残基数为数个~数十个(例如10个)以上、且1000以下为适当的,优选为600以下,进一步优选为500以下,特别优选300以下(例如10~300)。这样的长度的多肽容易合成(生物合成、化学合成),易于使用。
62.作为外来物质,优选涉及到各种细胞或组织(器官)的产生、分化、增殖、癌化、体内平衡(内稳态)、代谢的调节等功能的多肽的成熟型或者前体(包含前体型(pro-form)、原前
体型(prepro-form)。)。另外,也能够为了将功能未知的多肽导入细胞内并阐明该多肽在细胞内(生物组织内)的功能而实施这里所公开的外来物质导入方法。
63.例如,在导入外来物质的目标真核细胞是人以外的哺乳动物的干细胞的情况下,优选利用具有与该干细胞的分化诱导相关的各种生理活性的多肽的成熟型或其前体。此外,“干细胞”包含体干细胞、胚胎干细胞、人工多能干细胞(induced pluripotent stem cells:以下称为ips细胞。)。另外,在导入外来物质的目标真核细胞是癌细胞(肿瘤细胞)的情况下,优选利用与该癌细胞(肿瘤细胞)的细胞凋亡诱导相关的各种多肽。或者,在该情况下,优选利用能够阻碍癌细胞(肿瘤细胞)抑制免疫监测机构的功能的多肽。另外,在导入的目标真核细胞是细菌感染细胞或病毒感染细胞的情况下,优选利用与该感染细胞的细胞凋亡诱导相关的各种多肽、或能够在该感染细胞中抑制细菌或者病毒增殖的多肽、或能够抑制细菌或者病毒的感染从该感染细胞扩散的多肽。
64.此外,与载体肽片段同样,作为外来物质的多肽只要保持其功能即可,也可以包含取代、缺失和/或添加(插入)1个或数个氨基酸残基而形成的改变氨基酸序列。
65.外来物质导入用构建体优选至少1个氨基酸残基被酰胺化的物质。如果将氨基酸残基(典型为肽链的c末端氨基酸残基)的羧基酰胺化,则可以提高外来物质导入用构建体的细胞质内和核内的结构稳定性(例如蛋白酶抗性)。
66.例如,在外来物质与载体肽片段的n末端侧结合的情况下,优选将载体肽片段的c末端氨基酸残基酰胺化。另外,例如在外来物质是多肽且该多肽与载体肽片段的c末端侧结合的情况下,优选将该多肽的c末端氨基酸残基酰胺化。
67.外来物质导入用构建体中肽链(包含作为外来物质构成的多肽、载体肽片段和肽性接头)较短的物质能够按照一般的化学合成法容易地制造。例如,可以采用现有公知的固相合成法或液相合成法中的任一种。优选应用boc(叔丁氧羰基,t-butyloxycarbonyl)或者fmoc(9-芴甲氧羰基,9-fluorenylmethoxycarbonyl)作为氨基的保护基的固相合成法。即,能够通过使用市售的肽合成机的固相合成法来合成具有所希望的氨基酸序列、修饰(c末端酰胺化等)部分的上述肽链。此外,可以通过上述方法仅合成肽链的一部分,例如,可以合成仅包含载体肽片段的肽链,或也可以合成包含载体肽片段和肽接头部分的肽链。
68.或者,可以基于基因工程的方法通过生物合成制作肽部分。即,合成编码所希望的氨基酸序列的核苷酸序列(包含atg起始密码子。)的多核苷酸(典型为dna)。而且,根据宿主细胞构建具有包含所合成的多核苷酸(dna)和用于在宿主细胞内表达该氨基酸序列的各种调控元件(包含启动子、核糖体结合位点、终止子、增强子、控制表达水平的各种顺式元件。)的表达用基因构建体的重组载体。
69.通过通常的技术将该重组载体导入规定的宿主细胞(例如酵母、昆虫细胞、植物细胞),在规定的条件下培养该宿主细胞或包含该细胞的组织或个体。由此,能够在细胞内生产目标肽。而且,通过从宿主细胞(在分泌的情况下,在培养基中)分离肽部分并根据需要进行重折叠、提纯等,能够获得目标肽部分。
70.此外,重组载体的构建方法和构建得到的重组载体向宿主细胞的导入方法等直接采用一直以来在该领域中进行的方法即可,该方法本身并不特别表征本发明,因此省略详细的说明。
71.例如,为了在宿主细胞内高效且大量地生产,能够使用融合蛋白质表达系统。即,
化学合成编码目标多肽的氨基酸序列的基因(dna),将该合成基因导入适当的融合蛋白质表达用载体(如例如由novagen公司提供的pet系列和由amersham生物科学公司提供的pgex系列这样的gst(谷胱甘肽s-转移酶,glutathione s-transferase)融合蛋白质表达用载体)的合适的位点。而且,利用该载体对宿主细胞(典型为大肠杆菌)进行转化。对所获得的转化体进行培养,制备目标融合蛋白质。接下来,对该蛋白质进行提取和提纯。接下来,用规定的酶(蛋白酶)切断所获得的提纯融合蛋白质,通过亲和层析等方法回收游离的目标肽片段(即所设计的人工多肽)。通过使用这样现有公知的融合蛋白质表达系统(例如可以使用由amersham生物科学公司提供的gst/his系统。),能够制造目标外来物质导入用构建体(人工多肽)。
72.或者,能够构建无细胞蛋白质合成系统用的模板dna(即,包含编码外来物质导入用构建体的肽部分的氨基酸序列的核苷酸序列的合成基因片段),使用肽部分的合成所需的各种化合物(atp、rna聚合酶、氨基酸类等),采用所谓无细胞蛋白质合成系统在体外合成目标多肽。无细胞蛋白质合成系统例如参考shimizu等的论文(shimizu et al.,nature biotechnology,19,751-755(2001))、madin等的论文(madin et al.,proc.natl.acad.sci.usa,97(2),559-564(2000))。基于这些论文所记载的技术,在提交本技术时,已经有许多企业进行多肽的受托生产,并且,无细胞蛋白质合成用试剂盒(例如,可以从日本(株)cellfree science获得)也有市售。
73.包含编码外来物质导入用构建体的肽部分的核苷酸序列和/或与该序列互补的核苷酸序列的单链或双链的多核苷酸能够通过现有公知的方法容易地制造(合成)。即,通过选择与构成所设计的氨基酸序列的各氨基酸残基对应的密码子,容易确定并提供与该氨基酸序列对应的核苷酸序列。而且,一旦确定核苷酸序列,则能够使用dna合成机等容易地获得与所希望的核苷酸序列对应的多核苷酸(单链)。进而,能够将所获得的单链dna用作模板,采用各种酶合成手段(典型为pcr)获得目标双链dna。另外,多核苷酸可以是dna的形态,也可以是rna(mrna等)的形态。dna可以以双链或单链提供。在以单链提供的情况下,可以是编码链(有义链),也可以是与其互补的序列的非编码链(反义链)。
74.如上所述,这样获得的多核苷酸能够用作构建用于在各种宿主细胞中或利用无细胞蛋白质合成系统生产肽的重组基因(表达盒)的材料。
75.外来物质导入用构建体能够合适地用作基于外来物质的功能的用途的组合物的有效成分。此外,只要不丧失外来物质的功能,外来物质导入用构建体也可以是盐的形态。例如,能够使用可通过根据常规方法使通常使用的无机酸或有机酸进行加成反应而获得的酸加成盐。因此,本说明书和权利要求书所记载的“外来物质导入用构建体”包含该盐形态的物质。
76.外来物质导入用构建体能够作为除了作为有效成分的外来物质导入用构建体之外还包含根据使用方式而在医药(药学)上可接受的各种载体的组合物而提供。
77.作为上述载体,例如,优选作为稀释剂、赋型剂一般在肽类药物中使用的载体等。作为该载体,可以根据外来物质导入用构建体的用途或方式而适当地不同,典型地,可以列举水、生理缓冲液、各种有机溶剂。另外,该载体可以是适当浓度的酒精(乙醇等)水溶液、丙三醇、橄榄油这样的不干性油,或者也可以是脂质体。另外,作为可包含在医药用组合物中的次要成分,可以列举各种填充剂、增量剂、结合剂、保湿剂、表面活性剂、色素、香料等。
78.组合物的形态没有特别限制。例如,作为典型的形态,可以列举液剂、悬浮剂、乳剂、气溶胶、泡沫剂、颗粒剂、粉末剂、片剂、胶囊、软膏。另外,为了用于注射等,也能够制成用于在要使用之前溶解于生理盐水或适当的缓冲液(例如pbs)等而制备药液的冻干物、造粒物。
79.将外来物质导入用构建体(主成分)和各种载体(副成分)作为材料制备各种方式的药剂(组合物)的工艺本身依据现有公知的方法即可,该制剂方法本身并不表征本发明,因此省略详细的说明。作为与处方有关的详细的信息源,例如,可以列举comprehensive medicinal chemistry,corwin hansch主编、pergamon press刊(1990)。
80.提供使用这里所公开的外来物质导入用构建体(组合物)在生物内(体内)或生物外(体外)导入外来物质导入用构建体的方法。在该方法中,大致包含以下的(1)~(3)的工序:
81.(1)准备外来物质导入用构建体的工序,该外来物质导入用构建体具有由序列号1所示的氨基酸序列构成的载体肽片段和与该载体肽片段的n末端侧和/或c末端侧结合的所述目标外来物质;
82.(2)将外来物质导入用构建体提供到包含目标真核细胞的样品中的工序;和
83.(3)对供给了外来物质导入用构建体的样品进行孵育,向该样品中的真核细胞内导入该构建体的工序。
84.上述“真核细胞”在体内例如包含各种组织、内脏、器官、血液和淋巴液等。上述“真核细胞”在体外例如包含从生物摘除的各种细胞团、组织、内脏、器官、血液和淋巴液、以及细胞株等。
85.上述的包含这里所公开的构建体的组合物在体内能够以与其形态和目的相应的方法和用量来使用。例如,作为液剂,能够通过向静脉内、肌肉内、皮下、皮内或者腹腔内注射向患者(即生物)的患部(例如恶性肿瘤组织、病毒感染组织、炎症组织等)以所希望的量给药。或者能够将片剂等固体形态的药剂或软膏等凝胶状或者水性胶状的药剂直接向规定的组织(即例如包含肿瘤细胞、病毒感染细胞、炎症细胞等的组织或器官等患部)给药。或者,片剂等固体形态的药剂能够口服给药。在口服给药的情况下,为了抑制消化道内的消化酶分解,优选胶囊化或应用保护(包衣)材料。
86.或者,对于在生物外(体外)培养的真核细胞,可以向目标真核细胞的培养液至少供给一次这里所公开的组合物的适当量(即,外来物质导入用构建体的适当量)。每次的供给量和供给次数可以根据培养的真核细胞的种类、细胞密度(培养开始时的细胞密度)、传代数、培养条件、培养基的种类等条件而不同,故而没有特别限制。例如,优选添加1次、2次或其以上的多次添加,使得培养液中的载体肽片段浓度大致在0.05μm以上100μm以下的范围内,例如在0.5μm以上50μm以下的范围内,另外例如在1μm以上20μm以下的范围内。
87.此外,对体外的导入方法在下述实施例中示出一例。
88.评价外来物质导入用构建体的导入效率的方法没有特别限制。例如,在该构建体结合有色素(典型为荧光色素化合物)的情况下,能够使用显微镜观察(例如荧光显微镜观察)或流式细胞术等评价向真核细胞的导入效率。另外,也能够通过使用特异识别上述构建体的肽部分的抗体的免疫化学的方法(例如蛋白质印迹法或免疫细胞染色等)来评价上述构建体的导入效率。
89.以下,对与本发明有关的几个实施例进行说明,但不旨在将本发明限定于该实施例所示的内容。
90.<外来物质导入用构建体的制作>
91.准备表1所示的两种合成肽(肽1~2)。肽1是由序列号1所示的氨基酸序列构成的载体肽片段。肽2是由序列号2所示的氨基酸序列构成的肽,该氨基酸序列作为lim激酶2的nols而为人所知。
92.肽1和肽2均合成为c末端氨基酸残基的羧基(-cooh)被酰胺化(-conh2)。肽1和肽2均通过使用市售的肽合成机并按照手册实施固相合成法(fmoc法)来合成。
93.此外,肽合成机的使用方式本身并不表征本发明,因此省略详细的说明。
94.[表1]
[0095]
肽no.序列序列号1kkrtlrksnrkkr12kkrtlrkndrkkr2
[0096]
接着,基于常规方法,使作为外来物质的荧光色素的fam(c
21h12
o7:5(6)-羰基荧光素,5(6)-carboxyfluorescein,分子量376.3,激发波长495nm,荧光波长520nm)与肽1和肽2的n末端侧的氨基酸残基直接结合,制作具有肽1的外来物质导入用构建体(也称为“样品1”)和具有肽2的外来物质导入用构建体(也称为“样品2”)。用dmso分别稀释样品1和样品2,制备样品1的浓度为2mm的样品溶液1和样品2的浓度为2mm的样品溶液2。
[0097]
<样品1和样品2的细胞膜透过性评价>
[0098]
作为真核细胞使用hela细胞(源自人类宫颈癌细胞的建立细胞株),评价样品1和样品2的细胞膜透过性。如表2所示,将对hela细胞的培养液添加样品1的试验设为例1,将添加样品2的试验设为例2,将添加用dmso稀释的fam的试验设为例3,将仅添加dmso的试验设为例4。
[0099]
[表2]
[0100] 添加物例1fam-kkrtlrksnrkkr-conh2例2fam-kkrtlrkndrkkr-conh2例3fam例4无(仅dmso)
[0101]
(例1)
[0102]
在一般的培养基即含有10%fbs(fetal bovine serum)的dmem(dulbecco
′
s modified eagle
′
s medium(富士胶片和光纯药株式会社制,cat no.043-30085))中培养hela细胞。
[0103]
用pbs对附着在培养板的hela细胞进行清洗后,添加0.25%胰蛋白酶/edta溶液,在37℃中进行3分钟孵育。在该孵育后,加入上述含有10%fbs的dmem,使胰蛋白酶失活后,以150
×
g进行5分钟的离心分离,使细胞沉淀。去除由离心分离产生的上清后,在沉淀(细胞团)中加入上述含有10%fbs的dmem,制备大约1
×
105个细胞/ml的细胞悬浮液。将该细胞悬浮液在市售的6孔板(iwaki公司制)的孔加入2ml,接种细胞(大约2
×
105个细胞/孔)。接着,通过在5%co2条件下以37℃培养3小时,使细胞附着到孔的底面。此外,连续进行3次细胞膜
透过性评价,因此,在3个孔中接种细胞,用于例1的试验,对各孔实施以下的操作。
[0104]
接着,用上述含有10%fbs的dmem稀释上述2mm样品溶液1,准备样品1的浓度为20μm的样品溶液1。从上述培养3小时培养后的孔去除1ml培养上清后,向该孔添加1ml上述20μm样品溶液1(即,使得孔中的培养液的样品1的浓度为10μm,dmso浓度为0.5%)。接着,将细胞在5%co2条件下以37℃孵育20小时。在该20小时孵育后,从孔去除培养上清,用1ml的pbs对孔中的细胞清洗2次。接着,向孔添加200μl的0.25%胰蛋白酶/edta溶液,在37℃中进行3分钟孵育。在该孵育后,通过向孔添加400μl的上述含有10%fbs的dmem而使胰蛋白酶失活后,将孔中的细胞悬浮液移到管中,回收细胞。之后,再向孔添加600μl的pbs,对孔进行清洗。接着,通过将孔中的pbs移到上述管中,将残留在孔中的细胞回收到上述管中。在4℃、210
×
g的条件下对该管进行5分钟离心分离。在离心分离后,去除上清,用过1ml的pbs将沉淀(细胞团)悬浮(清洗),在与上述相同的条件下进行离心分离。重复2次该操作后,去除上清,获得以含有样品1的培养基培养的细胞(细胞团)。
[0105]
对上述获得的细胞(细胞团)使用流式细胞仪进行样品1的细胞膜透过性的分析。作为流式细胞仪,使用on-chip flow cytometer(on-chip biotechnologies co.,ltd.制)。
[0106]
为了进行该分析,将上述获得的细胞团悬浮于50μl的pbs中。在该悬浮液中再加入50μl的上述流式细胞仪用的2
×
样品缓冲液(sample buffer),准备分析用的细胞悬浮液。
[0107]
使用上述流式细胞仪进行基于前向散射(forward scatter:fsc)和侧向散射(side scatter:ssc)的门控(gating),对设为分析对象的细胞团设定门,对该门内的细胞团测定荧光强度。此外,以该细胞团至少为5000个以上的方式进行分析。在荧光强度的测定中使用能够检测fam的荧光波长的上述流式细胞仪的荧光检测器fl2。对该测定结果使用市售的分析软件“flowjo(注册商标)”(treestar公司制)进行分析,获得测定对象细胞团的平均荧光强度(mean fluorescent intensity:mfi)。
[0108]
(例2)
[0109]
除了将上述样品溶液1设为上述样品溶液2以外,与例1同样地实施。
[0110]
(例3)
[0111]
除了将上述样品溶液1设为用dmso稀释的fam溶液以外,与例1同样地实施。此外,以该fam溶液的浓度与样品1溶液的浓度相同的方式使用(即,以孔中的培养液的fam浓度为10μm、dmso浓度为0.5%的方式使用)。
[0112]
(例4)
[0113]
除了将上述样品溶液1设为dmso以外,与例1同样地实施。
[0114]
在表3和图1中表示例1~4所获得的结果。在表3中表示各例中的连续3次的mfi的平均值。在图1中表示在各例中连续3次中最接近mfi的平均值的试验例的流式细胞术的直方图。
[0115]
[表3]
[0116] 例1例2例3例4mfi6215.563.4
[0117]
如图1所示,添加具有肽1和荧光色素(fam)的外来物质导入用构建体1的例1、添加具有肽2和荧光色素(fam)的外来物质导入用构建体2的例2与仅添加fam的例3相比,直方图
向x轴的右方向移动,因此确认了与肽1和肽2相比,作为外来物质的荧光色素(fam)更高效地导入hela细胞的细胞质。另外,对例1和例2进行比较,与例2相比,例1的直方图向x轴的右方向移动,因此确认了与具有肽2的外来物质导入用构建体相比,具有肽1的外来物质导入用构建体的细胞膜透过性更高,能够以更高的效率将外来物质从细胞外部导入细胞内部。就其效率(细胞膜透过性)而言,利用表3所示的mfi进行比较,确认了例1比例2高4倍。
[0118]
另外,虽未示出详细的数据,通过本发明的发明人的研究确认,外来物质不仅是荧光色素,即使是多肽、核酸和药剂中的任一种,该外来物质也高效地从细胞的外部通过细胞膜导入细胞质内。
[0119]
由以上可知,根据这里所公开的技术,作为外来物质导入方法的特别优选的一个方式,提供了将目标外来物质从真核细胞的外部至少向该细胞的细胞质内导入的方法,其特征在于,使用由序列号1构成的载体肽片段。该载体肽片段适于向细胞质内导入目标外来物质的目的。
[0120]
以上,对这里所公开的技术的具体例详细地进行了说明,但这些只是示例,不限定权利要求书。权利要求书所记载的技术包括对以上例示的具体例进行各种变形、变更的内容。
[0121]
工业上的可利用性
[0122]
根据这里所公开的技术,提供用于将目标外来物质从真核细胞(特别是以没有细胞壁的人或其以外的哺乳动物为代表的各种动物细胞)的外部导入细胞质内而人工制作的构建体。通过使用该构建体,能够将目标外来物质高效地导入目标细胞,获得包含导入了该外来物质的细胞以及包含该外来物质的细胞的器官等生物组织。另外,通过使用该构建体,能够提供针对疾患的治疗用药。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。