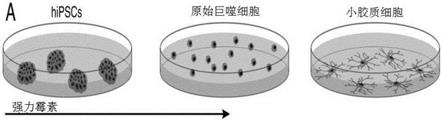
1.本发明涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括以下步骤:将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和将转录因子pu.1的编码序列靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1;以及通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子重现(recapitulate)了在小胶质细胞的胚胎发育或成体小胶质细胞增殖、分化或极化的至少一个阶段期间的信号传导。此外,本发明涉及通过本发明的方法获得的小胶质细胞及其各种用途。
背景技术:
2.小胶质细胞是中枢神经系统(cns)中的常驻免疫细胞[schafer等,2015]。它们来源于在早期胚胎发育中的原始造血的第一波过程中出现的早期卵黄囊巨噬细胞。一旦建立了循环系统,原始卵黄囊巨噬细胞就通过血流扩散从而填充(populate)发育中的cns。相比于其它器官中的组织驻留巨噬细胞,在胚胎发育的后期阶段,小胶质细胞不被胎儿单核细胞替代[mcgrath等,303;ginhoux等,2010;gomez perdiguero等,2015]。在早期胚胎发育期间建立小胶质细胞群后,小胶质细胞在一生中通过局部增殖来自我维持,而不是由骨髓来源的细胞替代[r
é
u等,2017]。小胶质细胞均匀地分布在整个脑和脊髓中,并在cns的发育、维持、可塑性和防御中起关键作用[schafer等,2015]。在健康的cns中,“静息”内环境稳态小胶质细胞是具有小细胞体和精细细胞突起的高度分枝的细胞。这些小胶质细胞突起(process)是能动的,并且连续地对其环境取样以扫描内部或外部危险的信号(比如侵入的病原体或由受损或死亡的细胞局部产生的信号)。这些信号的检测导致小胶质细胞活化,该种活化包括在小胶质细胞形态、基因表达和功能上的深刻变化。在活化后,小胶质细胞收回它们的突起并回复到变形虫样的外观。它们在趋化梯度后主动迁移至cns病灶并分泌炎性细胞因子。
[0003]
通过大量细胞表面受体,包括神经递质和细胞因子受体,它们与神经元、其它神经胶质细胞和外周免疫系统细胞通信[kettenmann等,2011]。鉴于它们的多功能和它们在健康cns中作为免疫系统代表的独特位置,小胶质细胞参与许多神经疾病的发作和进展并不令人惊讶[ranshoff等,2016]。
[0004]
最近,在阿尔茨海默症(ad)和其它神经退行性疾病(包括衰老、肌萎缩性脊髓侧索硬化症或tau病变相关的额颞叶变性(ftld-tau))的小鼠模型中,小胶质细胞的单细胞转录组学分析已经揭示了在小胶质细胞的小亚组中的促炎转录组学特征(signature),其被称为小胶质细胞神经变性表型(mgnd)[krasemann等,2017]或疾病相关的小胶质细胞(dam)[keren-saul等,2017]。小胶质细胞从内环境稳态向疾病相关表型的转换被认为是神经退行性病变中大脑稳态改变的反应,并且依赖于独特的时间和空间控制的转录程序[krasemann等,2017;keren-shaul等,2017;butovsky等,1998]。在大多数情况下,仍不清楚
这些细胞是否具有保护性或疾病诱导/增殖功能。对体外和体内、健康和疾病中人小胶质细胞的研究将促进与其有益和有害功能相关的因素的识别,以及恢复内环境稳态小胶质细胞特征或诱导dam小胶质细胞特征的策略的开发。这可以允许我们靶向小胶质细胞以治疗神经退行性疾病。
[0005]
许多人类细胞类型的分离或体外衍生仍然具有挑战性且是低效的。尤其是包括小胶质细胞的人cns的细胞是特别难以获得的。过去,从神经外科样本或死后脑组织中的低效分离代表了唯一的获得途径。人多能干细胞(hpsc)代表了无限的和可再生的来源,理论上,可以从其产生人类有机体的所有细胞类型[thomson等,1998]。人皮肤成纤维细胞可容易地转化为与胚胎干细胞显示相同的性质的人诱导的多能干细胞(hipsc)这一突破性发现允许产生自体和定制的细胞类型以用于再生医学中的应用。对于包括疾病建模、药物发现和细胞移植的若干关键应用,需要从hpsc大规模制造成熟的人细胞类型。最近,公布了用于产生小胶质细胞的第一个hpsc分化方案。该方案是以在相同的“神经胶质分化培养基,其成分浓度被调整到与人脑脊液的成分浓度相匹配”中培养数月的最初形成的胚状体(eb)为基础的,所述培养基补充有白介素(il)-34和集落刺激因子1(csf-1)[muffat等,2016]。该开创性文献为人小胶质细胞的最终成熟和维持提供了详尽的培养基组合物。然而,该方案长的持续时间、不确定的初始分化步骤(即基于eb的、几乎不遵循胚胎原理的中间步骤)和需要若干用于细胞纯化的机械操作步骤可能阻碍该方案的广泛应用。随后,几个其它组验证了通过相似但不同的经典分化方法从hpsc产生小胶质细胞样细胞[abud等,2017;takata等,2017;haenseler等,2017;pandya等,2017;douvaras等,2017]。然而,以在下游应用中所需的量和纯度体外衍生特定人类细胞类型(包括小胶质细胞)仍然具有挑战性,并且目前正在寻找替代方法[cohen等,2011]。与传统分化相比,最近的生产策略是直接细胞重编程[ladewig等,2013]。这种策略是指将任何细胞类型(通常是皮肤成纤维细胞)直接转化成另一种细胞类型而无需经由多能中间体进行。尽管提供了自容易获得的细胞类型生产细胞的快速途径,但是所需细胞群体的收率和纯度仍然低且不足[zhang等,2013]。最近,提出了称为“正向编程”的第三种途径,其用于以前所未有的速度和效率来制造成熟的人类细胞类型[zhang等,2013]。
[0006]
作为一种直接将多能干细胞(包括hpsc)转化为成熟细胞类型的方法,正向编程已经被认为是一种用于衍生人类细胞的有力策略。它涉及关键谱系转录因子(或非编码rna,包括lncrna和microrna)的强制表达,以便将干细胞转化为特定的成熟细胞类型。目前可用的正向编程方案主要基于细胞的慢病毒转导,其导致随机插入的诱导盒的多样化表达或完全沉默。这导致需要另外的纯化步骤来分离表达所需转录因子的亚群。因此,显然需要对这些方法进行进一步的改进。
[0007]
对所述方法的任何改进必须确保包含在诱导盒内的诸如转基因的遗传物质的稳定转录对沉默和其它阴性的整合位点相关的影响具有抗性。沉默可能是由包括dna甲基化或组蛋白修饰的多种表观遗传机制引起的。使用基于慢病毒转导的现有技术方法,获得的细胞是其中转基因完全、部分或沉默表达的异质群体。显然,这对于许多应用来说是不可取的。病毒载体表现出将其遗传物质整合到基因组的转录活性区域中的趋势,由此增加了由于插入诱变而导致的致癌事件的可能性。对于许多应用而言,需要控制细胞中插入的遗传物质的转录,以便诱导盒可以根据需要开启并以特定水平(包括高水平)转录。如果诱导盒
在基因组中的插入是随机的,则这是不能实现的。
[0008]
在一些出版物中已经解决了这一问题,即小胶质细胞既参与一些严重疾病又与脑组织纠缠在一起以至于它们自活组织中的分离仍然难以捉摸。为了克服这个问题,使用人干细胞,通过例如限定的培养条件[muffat等,2016]或与干细胞衍生的神经元共培养[haenseler等,2017;takata等,2017]来产生小胶质细胞或小胶质细胞样细胞。这些方法仅依赖于暴露于生长因子和细胞因子以将干细胞分化成小胶质细胞。
[0009]
此外,对这种特殊细胞类型的需求是巨大的,因为它们在包括神经退行性疾病、神经炎症或自身免疫疾病、自身抗体介导的脑炎或感染性疾病、神经血管疾病、中风、外伤性脑损伤和癌症的几乎所有中枢神经系统疾病中均起重要作用,然而它们在不同疾病中的作用的确切机制仍不清楚。与现有技术一致,干细胞来源的小胶质细胞确实重现了最初的患者疾病表型[muffat等,2016;abud等,2017;takata等,2017]。基于此,小胶质细胞参与某些疾病的巨大科学缺口可以通过从干细胞产生小胶质细胞来克服。然而,使干细胞分化的传统方案非常耗时,并且结果不令人信服。
[0010]
因此,本发明的发明人已经开发了一种通过使用将诱导盒稳定引入干细胞基因组中,同时能够控制该诱导盒的转录并由此控制插入的转录因子,从干细胞产生小胶质细胞的快速方法。这些转录因子作为重编程因子用于小胶质细胞产生的潜力是先前未知的,并代表了本发明人的独特知识。这使得它们能够产生表达在天然小胶质细胞群体中观察到的所有表面标志物和rna的纯小胶质细胞群。此外,该方法可用于自神经退行性疾病患者的人ips细胞分化小胶质细胞,从而能够分析否则会对医学检查保持完全惰性的细胞群。因此,强烈需要从容易获得的来源制造成熟的人小胶质细胞。因此,本技术所面临的技术问题是满足这些需要。通过提供在权利要求中反映的、说明书中描述的以及下面给出的实施例和附图中示出的实施方案,解决了上述技术问题。
技术实现要素:
[0011]
本发明的发明人已经开发了一种用于从干细胞产生小胶质细胞的方法。
[0012]
本发明涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括以下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子重现了在小胶质细胞的胚胎发育或成体小胶质细胞增殖、分化或极化的至少一个阶段期间的信号传导。
[0013]
在本发明方法的一个实施方案中,所述至少一种生长因子或小分子选自活化素a(seq id no:7)、bmp4(seq id no:8)、fgf(seq id no:9)、vegf-a(seq id no:10)、ly294002、chir99021、scf(seq id no:11)、il-3(seq id no:12)、il-6(seq id no:13)、csf1(seq id no:14)、il-34(seq id no:15)、csf2(seq id no:16)、cd200(seq id no:17)、cx3cl1(seq id no:18)、tgfβ1(seq id no:19)和ide1。
[0014]
在本发明方法的另一实施方案中,所述至少一种生长因子是csf1(seq id no:14)或il-34(seq id no:15)。
[0015]
在本发明方法的再一实施方案中,所述至少一种小分子是chir99021、ly294002或ide1。
[0016]
在本发明方法的又一实施方案中,所述第一和第二基因组安全港位点是不同的。
[0017]
在本发明方法的另又一实施方案中,所述方法进一步包括转录因子cebpb的基因的编码序列(seq id no:3)的插入及其表达。
[0018]
在本发明方法的再又一实施方案中,所述方法进一步包括转录因子runx1的基因的编码序列(seq id no:4)的插入及其表达。
[0019]
在本发明方法的另一实施方案中,所述方法进一步包括转录因子irf8的基因的编码序列(seq id no:5)的插入及其表达。
[0020]
在本发明方法的又一实施方案中,所述方法进一步包括转录因子sall1的基因的编码序列(seq id no:6)的插入及其表达。
[0021]
在本发明方法的再一实施方案中,所述转录调节蛋白是反向四环素反式激活蛋白(rtta)(seq id no:20),并且其活性受强力霉素或四环素控制。
[0022]
在本发明方法的另又一实施方案中,所述诱导型启动子包括tet应答元件(tre)(seq id no:21)。
[0023]
在本发明方法的再又一实施方案中,所述第一和所述第二基因组安全港位点选自hrosa26基因座(seq id no:22)、aavs1基因座(seq id no:23)、clybl基因(seq id no:24)、ccr5基因(seq id no:25)、hprt基因(seq id no:26)或具有染色体8上的位点id 325(seq id no:27)、染色体1上的位点id 227(seq id no:28)、染色体2上的位点id 229(seq id no:29)、染色体5上的位点id 255(seq id no:30)、染色体14上的位点id 259(seq id no:31)、染色体x上的位点id 263(seq id no:32)、染色体2上的位点id 303(seq id no:33)、染色体4上的位点id 231(seq id no:34)、染色体5上的位点id 315(seq id no:35)、染色体16上的位点id 307(seq id no:36)、染色体6上的位点id 285(seq id no:37)、染色体6上的位点id 233(seq id no:38)、染色体134上的位点id 311(seq id no:39)、染色体7上的位点id 301(seq id no:40)、染色体8上的位点id 293(seq id no:41)、染色体11上的位点id 319(seq id no:42)、染色体12上的位点id 329(seq id no:43)、染色体x上的位点id 313(seq id no:44)的基因。
[0024]
在本发明方法的另一实施方案中,所述干细胞是多能干细胞、诱导的多能干细胞(ipsc)、神经祖细胞、造血干细胞或胚胎干细胞(esc)。
[0025]
在本发明方法的又一实施方案中,所述干细胞是人类或小鼠干细胞。
[0026]
本发明还涉及通过任意根据本发明所述的方法获得的小胶质细胞,优选地,其中所述小胶质细胞表达选自itgam(cd11b)(seq id no:45)、itgax(cd11c)(seq id no:46)、cd14(seq id no:47)、cd16(seq id no:48)、entpd1(cd39)(seq id no:49)、ptprc(cd45)(seq id no:50)、cd68(seq id no:51)、csf1r(cd115)(seq id no:52)、cd163(seq id no:53)、cx3cr1(seq id no:54)、trem2(seq id no:55)、p2ry12(seq id no:56)、tm119(seq id no:57)和hla-dr(seq id no:58)中的至少一种小胶质细胞表面蛋白。
[0027]
在本发明的进一步实施方案中,所述小胶质细胞用于治疗。
[0028]
此外,本发明涉及根据本发明所述的此类小胶质细胞用于疾病的体外诊断的用途。优选地,所述疾病选自中枢神经系统疾病,优选地为神经退行性疾病;更优选地为阿尔
茨海默症、帕金森病、额颞叶性痴呆或肌萎缩性脊髓侧索硬化症;神经炎症或自身免疫疾病,优选地为多发性硬化症、自身抗体介导的脑炎或感染性疾病、神经血管疾病;优选地为中风、血管炎;外伤性脑损伤和癌症。
[0029]
此外,本发明涉及根据本发明所述的此类小胶质细胞用于与脑类器官体外培养的用途。
附图说明
[0030]
图1示出了用于细胞制造的主要途径的示意图,所述主要途径为:使用四种确定的转录因子klf4、oct4、c-myc和sox2将体细胞(成纤维细胞)重编程为诱导的多能干细胞(ipsc),使用确定的转录因子将体细胞直接转化为期望的靶细胞类型的直接重编程,代表从多能干细胞逐步转化为期望的靶细胞的传统分化方法,以及将hpsc直接转化为靶细胞类型的正向编程。(缩写:tf=转录因子,esc=胚胎干细胞,ipsc=诱导的多能干细胞(esc和ipsc统称为多能干细胞(psc))。
[0031]
图2示出了本发明中使用的靶向策略。将dox诱导型tet-on系统靶向人rosa26基因座(cag-rtta)和hpsc的aavs1位点(tre-egfp)。(缩写:har=同源臂,neo=新霉素抗性基因,cag=组成型cag启动子,rtta=反向四环素控制的反式激活蛋白,puro=嘌呤霉素抗性基因,tre=诱导型tet-应答元件,egfp=增强的绿色荧光蛋白,sa=剪接受体,t2a=t2a切割位点,pa=聚腺苷酸化位点)。
[0032]
图3示出了被选作候选重编程因子的小胶质细胞谱系的关键转录因子、其编码序列的长度及其来源的表。
[0033]
图4示出了供体质粒,其通过分子克隆产生并用于rosa26 gsh或aavs1 gsh的遗传修饰。(缩写:har=同源臂,neo=新霉素抗性基因,cag=组成型cag启动子,rtta=反向四环素控制的反式激活蛋白,puro=嘌呤霉素抗性基因,tre=诱导型tet-应答元件,egfp=增强的绿色荧光蛋白,sa=剪接受体,t2a=t2a切割位点,pa=聚腺苷酸化位点)。
[0034]
图5示出了小胶质细胞正向编程方案的示意图(参见图5a)。通过流式细胞术评估的在原始巨噬细胞和小胶质细胞上表达的细胞表面标志物的时间过程(n=2个生物学重复)(参见图5b和图5c)。第20天小胶质细胞单一培养:小胶质细胞样细胞的相衬实况图像和小胶质特征跨膜蛋白tmem119的icc,因为专用的标记的流式抗体是不可获得的(参见图5d)。第20天小胶质细胞/神经元共培养:细胞内钙结合蛋白iba1(也称为aif1)和神经元标志物βiii-微管蛋白(tubb3)的icc(参见图5e)。在单一培养中hipsc和小胶质细胞的qpcr(sybr green)(第20天)。所有数值都是相对于管家基因gapdh的,并标准化为hipsc。对于spi1和cebpb的转录物,使用两种不同的引物对(参见seq id nos:80-87;seq id no:80:spi1总正向引物;seq id no:81:spi1总反向引物;seq id no:82:spi1内正向引物;seq id no:83:spi1内反向引物;seq id no:84:cebpb总正向引物;seq id no:85:cebpb总反向引物;seq id no:86:cebpb内正向引物;seq id no:87:cebpb内反向引物),检测所有转录物(总),或仅检测来自各自内源基因座的转录物,但不检测aavs1靶向转基因(内)。如所预期的,当转基因表达被关闭时(通过在方案的第10天撤去dox),在相对表达水平上没有检测到差异,因此证实了细胞表型的转基因非依赖性(f)。
[0035]
图6示出了用强力霉素诱导24小时的双重靶向ips细胞系的免疫细胞化学。该细胞
为pu.1和cebpb阳性,但oct4阴性。
[0036]
图7示出了供体质粒puc_aavs1_p-resp-(pu.1-cebpb)(seq id no:61)的图谱,该供体质粒用于aavs1基因座的遗传修饰,并包含转录因子pu.1和cebpb的编码序列。
[0037]
图8示出了供体质粒puc_aavs1_p-resp-(pu.1-irf8)(seq id no:62)的图谱,该供体质粒用于aavs1基因座的遗传修饰,并包含编码转录因子pu.1和irf8的编码序列。
[0038]
图9示出了供体质粒puc_aavs1_p-resp-(pu.1-runx1)(seq id no:63)的图谱,该供体质粒用于aavs1基因座的遗传修饰,并包含转录因子pu.1和runx1的编码序列。
[0039]
图10示出了供体质粒puc_aavs1_p-resp-(pu.1)(seq id no:64)的图谱,该供体质粒用于aavs1基因座的遗传修饰,并包含转录因子pu.1的编码序列。
[0040]
图11示出了供体质粒puc_aavs1_p-resp-(pu.1-sall1)(seq id no:65)的图谱,该供体质粒用于aavs1基因座的遗传修饰,并包含转录因子pu.1和sall1的编码序列。
[0041]
图12示出了包含cas酶和向导rna a的编码序列的质粒rosa-向导a_cas9n(seq id no:66)的图谱。
[0042]
图13示出了包含cas酶和向导rna b的编码序列的质粒rosa-向导b_cas9n(seq id no:67)的图谱。
[0043]
图14示出了包含组成型cag启动子和rtta的供体质粒puc_rosa_n_cag-rtta(seq id no:72)的图谱。
[0044]
图15示出了质粒pzfn-aavs1-l_eld(seq id no:68)的图谱。
[0045]
图16示出了质粒pzfn-aavs1-r_kkr(seq id no:69)的图谱。
[0046]
使用了以下缩写:t2a:t2a肽(核糖体跳跃信号),puror:嘌呤霉素抗性基因,pa:聚腺苷酸化信号,cag:组成型cag启动子,tre3gv:tet-应答元件,ha-r,ha-l:同源臂(右、左),ampr:氨苄青霉素抗性基因,ori:复制起点,neor:新霉素抗性基因,kanr:卡那霉素抗性基因。
具体实施方式
[0047]
本发明涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括以下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子重现了在小胶质细胞的胚胎发育或成体小胶质细胞增殖、分化或极化的至少一个阶段期间的信号传导。
[0048]
在一个实施方案中,本发明涉及一种从干细胞产生小胶质细胞的方法,所述方法包括如下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子重现了在小胶质细胞的胚胎发育或成体小胶质细胞增殖、分化或极化的至少一个阶段期间的信号传导。
[0049]
在一个实施方案中,本发明涉及一种从干细胞产生小胶质细胞的方法,所述方法包括如下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子重现了在小胶质细胞的胚胎发育的至少一个阶段期间的信号传导。
[0050]
在一个实施方案中,本发明涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括以下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子重现了在小胶质细胞胚胎发育的至少一个阶段期间的信号传导。
[0051]
在一个实施方案中,本发明还涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括如下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子重现了在成体小胶质细胞分化的至少一个阶段期间的信号传导。
[0052]
在一个进一步的实施方案中,本发明涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括如下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述生长因子或小分子重现了在成体小胶质细胞极化的至少一个阶段期间的信号传导。
[0053]
在另一个实施方案中,本发明涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括如下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子重现了小胶质细胞的胚胎发育。
[0054]
在一个进一步的实施方案中,本发明涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括如下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和
b)收获的干细胞,所述至少一种生长因子或小分子模拟在小胶质细胞的胚胎发育或成体小胶质细胞增殖、分化或极化的至少一个阶段期间的信号传导。
[0055]
在一个进一步的实施方案中,本发明涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括如下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子模拟在小胶质细胞的胚胎发育的至少一个阶段期间的信号传导。
[0056]
在一个实施方案中,本发明还涉及一种用于从干细胞产生小胶质细胞的方法,所述方法包括如下步骤:a)将编码转录调节蛋白的核苷酸序列靶向插入第一基因组安全港位点;和b)将转录因子pu.1的编码序列(seq id no:1)靶向插入第二基因组安全港位点,其中所述基因与诱导型启动子可操作地连接,所述诱导型启动子由转录调节蛋白调节;表达pu.1(seq id no:2);和c)通过暴露于至少一种生长因子或小分子来培养从步骤a)和b)收获的干细胞,所述至少一种生长因子或小分子重现体外小胶质细胞的胚胎发育。
[0057]
如在本发明中所用的,术语“小胶质细胞”是指成熟细胞类型,其为中枢神经系统的独特细胞群。如在比较解剖学和组织学中所定义的,“小胶质细胞是固有的组织细胞型细胞和cns的关键先天免疫效应物。通常将它们描述为静息的(即,分枝的)或活化的,但是这些术语不能表达它们的精细突起和固有免疫监视活性的动态重塑。(
…
)证据表明早期小胶质细胞源自卵黄囊祖细胞”(hagan等,2012)。这意味着小胶质细胞在胚胎早期产生,并在整个成年期都驻留于脑中。
[0058]
如在本发明中所用的,术语“小胶质细胞的产生”意指从干细胞产生成熟细胞(小胶质细胞),其通过任何本文所述的本发明的方法获得。
[0059]
如在本发明中所用的,术语“干细胞”意指能够分裂以产生更多细胞或能够发育成具有特定目的的细胞的细胞类型。在本发明中,所用的干细胞可以是多能干细胞。多能干细胞具有分化成体内几乎任何细胞的潜能。多能干细胞有几种来源。胚胎干细胞(es细胞)是衍生自胚泡(一种早期植入前胚胎)内细胞团的多能干细胞。诱导的多能干细胞(ipsc)是成体细胞,其通过被强制表达对于维持胚胎干细胞的限定特性重要的基因和因子而被遗传重编程为胚胎干细胞样状态。在2006年证明了引入编码转录因子的四种特定基因可以将成体细胞转化为多能干细胞(takahashi等,2006),但是随后的工作已经减少/改变了所需基因的数目。oct-3/4和sox基因家族的某些成员已经被识别为参与诱导过程的潜在关键转录调节因子。包括klf家族、myc家族、nanog和lin28的某些成员的其它基因可增加诱导效率。可被包含在重编程因子中的基因的实例包括oct3/4、sox2、soxl、sox3、soxl5、soxl7、klf4、klf2、c-myc、n-myc、l-myc、nanog、lin28、fbxl5、eras、ecat15-2、tell、β-连环蛋白、lin28b、sall1、sall4、esrrb、nr5a2、tbx3和glisl,并且这些重编程因子可单独使用,或以其两种或更多种的组合使用。
[0060]
如果通过插入诱导盒而被修饰的细胞是用于人类患者的,则优选该细胞是来自该个体的ipsc。这种自体细胞的使用将消除细胞与受体匹配的需要。或者,可以使用本领域技术人员已知的市售ipsc。或者,该细胞可以是组织特异性干细胞,其也可以是自体的或捐献
的。合适的细胞包括外胚层干细胞、诱导的神经干细胞和其它组织特异性干细胞。
[0061]
在本发明方法的一些实施方案中,优选所用的干细胞是胚胎干细胞或干细胞系。现在已有许多胚胎干细胞系上市,例如wa01(hi)、wa09(h9)、khes-1、khes-2和khes-3。不破坏胚胎的衍生的干细胞系是可获得的。本发明不延伸至任何涉及破坏人胚胎的方法。
[0062]
如在本发明中所用,术语“靶向插入”意指向基因组安全港(gsh)位点的插入,如在其它地方所述的,插入优选特异性地在gsh序列内。可以使用任何合适的将多核苷酸插入特定序列的技术,并且在本领域中描述一些这样的技术。合适的技术包括本领域技术人员已知的任何方法,该种方法能在期望的位置引入断裂并允许将载体重组到间隙中。因此,靶向位点特异性基因组修饰的关键第一步是在待修饰的基因组基因座上产生双链dna断裂(dsb)。可利用不同的细胞修复机制来修复该dsb并引入所需序列,这些不同的细胞修复机制是更易于出错的非同源末端连接修复(nhej);以及由供体dna模板介导的同源重组修复(hr),它们可用于插入诱导盒。
[0063]
存在几种技术以允许在基因组中定制的位点特异性产生dsb。这些技术中的许多都涉及使用定制的内切核酸酶,例如锌指核酸酶(zfn)、转录激活因子样效应因子核酸酶(talen)或成簇的规律间隔的短回文重复序列/crispr相关蛋白(crispr/cas9)系统(gaj等,2013)。锌指核酸酶是人工酶,其通过将锌指dna结合结构域融合到限制性酶fokl的核酸酶结构域而产生。后者具有非特异性的切割结构域,该结构域必须二聚化才能切割dna。这意味着需要两个zfn单体来允许fokl结构域的二聚化和切割dna。可以将dna结合结构域设计为靶向任何感兴趣的基因组序列,可以是cys2his2锌指的串联阵列,其每一个识别靶序列中的三个连续核苷酸。两个结合位点被5-7bp隔开以允许fokl结构域的最佳二聚化。因此,该酶能够在特定位点切割dna,并且通过确保必须发生两个邻近的dna结合事件以实现双链断裂来增加靶标特异性。转录激活因子样效应因子核酸酶或talen是二聚体转录因子/核酸酶。它们是通过将tal效应子dna结合结构域融合到dna切割结构域(核酸酶)而制备的。转录激活因子样效应因子(talen)可以被工程化以实际上结合任何期望的dna序列,因此当与核酸酶组合时,dna可以在特定位置被切割。tal效应因子是由黄单胞菌分泌的蛋白质,其dna结合结构域含有一个重复的高度保守的33-34个氨基酸序列,该序列具有不同的第12和第13位氨基酸。这两个位置是高度可变的,并且显示出与特异性核苷酸识别的强相关性。氨基酸序列和dna识别之间的这种直接关系使得能够通过选择在两个可变位置含有合适残基的重复区段的组合来工程化特异性dna结合结构域。由此,由33至35个氨基酸模块的阵列构建了talen,每个模块靶向单个核苷酸。通过选择模块阵列,几乎任何序列都可以作为靶标。所用的核酸酶可以是fokl或其衍生物。
[0064]
已经识别了三种crispr机制,其中对ii型的研究最为深入。crispr/cas9系统(ii型系统)利用cas9核酸酶在dna中在由短向导rna确定的位点处产生双链断裂。crispr/cas系统是原核免疫系统,其赋予对外源遗传元件的抗性。crispr是含有碱基序列的短重复的原核dna的区段。每个重复后是来自先前暴露于外源遗传元件的“原间隔子dna”的短区段。crispr间隔使用rna干扰识别并切割外源遗传元件。crispr免疫应答通过两个步骤发生:crispr-rna(crrna)生物合成和crrna-导向的干扰。crrna分子由转录自原间隔子dna的可变序列和crisp重复组成。然后,每个crrna分子与称为反式激活crispr rna(tracrrna)的第二rna杂交,并且这两者一起最终与核酸酶cas9形成复合物。crrna的原间隔子dna编码的
部分指导cas9切割互补靶dna序列,如果它们与被称为原始间隔子相邻基序(pam)的短序列相邻的话。在许多其它应用中,已将这种天然系统工程化并用于在基因组dna的特定位点引入dsb断裂。特别地,可以使用来自酿脓链球菌的crisp ii型系统。最简单地,crispr/cas9系统包含被递送至细胞以提供基因组编辑的两种组分:cas9核酸酶本身和小的向导rna(grna)。grna是一种定制的位点特异性crrna(针对靶序列)和标准化的tracrrna的融合体。
[0065]
一旦制备了dsb,就提供与靶基因座具有同源性的供体模板。dsb可通过允许进行精确插入的同源定向修复(hdr)途径修复。该系统的衍生物也是可能的。可利用cas9的突变形式,例如cas9d10a,其仅具有切口酶活性。这意味着,它只切割一条dna链,并且不激活nhej。相对地,当提供同源修复模板时,dna修复仅通过高保真hdr途径进行。cas9d10a可用在配对的cas9复合物中,该复合物被设计成与两个sgrna一起产生与靶位点的相反链上的邻近区域互补的邻近dna切口,这可能是特别有利的。可以将用于使双链dna断裂的元件引入一个或多个诸如质粒的载体中以在细胞中表达。因此,在本发明的方法中可以使用任何在基因组中产生特异性的、靶向的双链断裂以允许插入核苷酸序列/基因/诱导盒的方法。优选本发明的方法用于将基因/可诱导的盒插入zfn、talen和/或crispr/cas9系统或其任何衍生物中的任何一种或多种。
[0066]
一旦通过任何合适的方法制备了dsb,则可以以如下所述的任何合适的方式提供用于插入的基因/诱导盒。基因/诱导盒和相关的遗传物质形成用于修复dsb处的dna的供体dna,并使用标准细胞修复机制/途径将其插入。如上所述,如何引发断裂将改变使用哪种途径来修复损伤。然而,这也在本领域技术人员的知识范围内。
[0067]
如在本发明中所用,术语“基因”意指基本的物理单位遗传,即沿着dna区段的核苷酸的线性序列,其为rna的合成提供编码指令,当rna被翻译成蛋白质时,导致遗传特性的表达。
[0068]
如在本发明中所用,术语“核苷酸序列”是指形成如上定义的基因的dna区段中的一系列碱基。
[0069]
如在本发明中所用,术语“转录调节蛋白”意指与dna结合的蛋白,优选地为与位于启动子中或附近的dna位点特异性结合的序列,其促进转录机制与启动子结合,从而促进dna序列的转录(转录激活因子)或阻断该过程(转录抑制子)。这样的实体也称为转录因子。将转录调节蛋白结合的dna序列称为转录因子结合位点或应答元件,其存在于受调节的dna序列的启动子中或存在于受调节的dna序列的启动子附近。应答元件是本发明的一部分。转录激活因子蛋白结合应答元件并促进基因表达。在本发明的方法中,优选这些蛋白用于控制诱导盒表达。转录抑制子蛋白结合到应答元件上并阻止基因表达。转录调节蛋白可以通过许多机制激活或失活,这些机制包括物质的结合、与其它转录因子(例如同源或异源二聚化)或共调节蛋白的相互作用、磷酸化和/或甲基化。可以通过激活或失活来控制转录调节因子。如果转录调节蛋白是转录激活蛋白,那么优选的是转录激活蛋白需要激活。这种激活可以通过任何合适的方式进行,但是优选的是,通过向干细胞添加外源物质来激活转录调节蛋白。可以控制向干细胞中供应外源物质,从而可以控制转录调节蛋白的激活。此类转录调节蛋白也称为诱导型转录调节蛋白。
[0070]
如在本发明中所用,术语“转录因子”意指与dna结合的蛋白质,优选地为与位于启动子中或附近的dna位点特异性结合的序列,其促进转录机制与启动子结合,从而促进dna
序列的转录(转录激活因子)或阻断该过程(转录抑制子)。在本发明的上下文中,转录因子是所需的遗传序列,优选是与诱导盒一起转移到细胞中的dna序列。将诱导盒向基因组中的引入具有通过加入允许基因表达的遗传序列来改变该细胞表型的潜力。本发明的方法提供了在细胞中的诱导盒内转录因子组的遗传序列的可控转录。
[0071]
主调节因子可以是以下中的一个或多个:转录因子、转录调节因子、细胞因子受体或信号传导分子等。主调节因子是一种表达的基因,其影响表达它的细胞的谱系。可能需要主调节因子网络来确定细胞谱系。如本文所用,在发育谱系或细胞类型开始时表达的主调节基因通过直接或通过基因表达变化的级联调节多个下游基因来参与该谱系的特化。如果主调节因子被表达,则它具有重新确定注定形成其它谱系的细胞的命运的能力。可用于本发明方法的转录因子包括pu.1(seq id no:2)(基因spi1,seq id no:1)、cebpb(seq id no:3)、runx1(seq id no:4)、irf8(seq id no:5)和sall1(seq id no:6)。
[0072]
如在本发明中所用,术语“pu.1”(seq id no:2)意指转录因子,也称为造血转录因子pu.1、spi-1原癌基因、31kda转化蛋白、转录因子pu.1、脾病灶形成病毒(sffv)前病毒整合癌基因spi1、脾病灶形成病毒(sffv)前病毒整合癌基因或31kda转化蛋白、sfpi1、spi-1、spi-a、pu.1或of,其中“spi1”是指基因(seq id no:1)(spi-1原癌基因),其编码在骨髓和b淋巴细胞发育期间激活基因表达的ets-结构域转录因子。
[0073]
如在本发明中所用,术语“基因组安全港位点”意指一种遗传位点,该遗传位点允许遗传物质的插入而对细胞没有有害作用并允许插入的遗传物质的转录。本领域技术人员可使用这些简化的标准来识别合适的gsh和/或使用更正式的标准。相比于随机基因组整合,在基因组安全的港位点(gsh)内的特定插入是优选的,因为预期这是基因组的更安全的修饰,并且其不太可能导致不希望的副作用,所述不希望的副作用比如沉默天然基因表达或引起导致癌细胞类型的突变。因此,基因组安全港位点是基因组内的基因座,其中可以插入基因或其他遗传物质而对细胞或对插入的遗传物质没有任何有害作用。最有益的是其中表达插入基因序列的gsh位点不会被来自邻近基因的任何连读表达和诱导盒的表达扰动,从而使对内源性转录程序的干扰最小化。已经提出了更正式的标准,其有助于确定特定基因座是否是gsh位点(pellenz等,2019)。这些标准包括如下位点:(i)距离所有癌基因列表上的任何癌症相关基因>300kb的位点,(ii)距离任何mirna/其它功能性小rna>300kb的位点,(iii)距离任何5'基因末端>50kb的位点,(iv)距离任何复制起点>50kb的位点,(v)距离任何超保守元件>50kb的位点,(vi)低转录活性(无mrna
±
25kb)的位点,(vii)不在拷贝数可变区中的位点,(viii)在开放染色质中的位点(dhs信号
±
1kb)和(ix)独特的位点(在人基因组中1个拷贝)。可能不必满足所有这些提出的标准,因为已经识别的gsh不满足所有这些标准。优选地,合适的gsh可以满足这些标准中的至少3、4、5、6、7或8个,最优选地满足所有9个标准。
[0074]
在本发明的方法中,插入发生在不同的gsh上。需要至少两个gsh。通过插入转录调节蛋白来修饰第一gsh。通过插入诱导盒来修饰第二gsh,该诱导盒包含与诱导型启动子可操作地连接的编码序列。也可将其它遗传物质与这些元件中的一个或两个一起插入。优选地,与诱导盒内的诱导型启动子可操作地连接的遗传序列是dna序列。优选地,诱导盒的遗传序列编码rna分子,并因此能够被转录。使用诱导型启动子控制转录。rna分子可以是任意序列,但优选地为编码蛋白质的mrna、shrna或grna。
[0075]
第一gsh可以是任何合适的gsh位点。任选地,第一gsh是具有组成型表达的内源启动子的gsh,这将导致插入的转录调节蛋白组成型地表达。合适的gsh是人细胞的hrosa26位点。在本发明的另一实施方案中,与启动子可操作地连接的插入的转录调节蛋白是组成型启动子。组成型启动子可以例如与hrosa26位点的插入联合使用。
[0076]
如在本发明中所用,术语“诱导型启动子”意指一种启动和调节多核苷酸转录的核苷酸序列。“诱导型启动子”是一种核苷酸序列,其中与该启动子可操作连接的遗传序列的表达受分析物、辅助因子、调节蛋白等的控制。在本发明方法的一个实施方案中,所述控制受转录调节蛋白的影响。术语“启动子”或“控制元件”包括全长启动子区和这些区的功能(例如,控制转录或翻译的)区段。优选地,编码转录调节蛋白的基因与组成型启动子可操作地连接。或者,可选择第一gsh,使其已经具有可驱动转录调节蛋白基因和任何相关遗传物质的表达的组成型启动子。组成型启动子确保持续的和高水平的基因表达。常用的组成型启动子包括人β-肌动蛋白启动子(actb)、巨细胞病毒(cmv)、延伸因子-la(efla)、磷酸甘油酸激酶(pgk)和泛素c(ubc)。cag启动子是一种经常用于驱动高水平的基因表达的强合成启动子。
[0077]
如在本发明中所用,术语“培养”意指诸如细菌和酵母的微生物,或人、植物或动物细胞在确保生长的合适条件下的生长,所述合适的条件是本领域技术人员具备的知识。
[0078]
如在本发明中所用,术语“生长因子”意指以自分泌、旁分泌或内分泌方式控制细胞活性的信号分子。如本文所用,在本发明的上下文中,术语“生长因子”可以与“细胞因子”互换使用。生长因子或细胞因子由生物体的不同细胞类型产生,并通过结合特定受体和激活相关的下游信号传导通路发挥其生物学功能,所述下游信号传导通路进而调节细胞核中的基因转录并最终刺激生物学应答,所述生物学应答包括调节性细胞过程,如细胞分裂、细胞存活、细胞分化、粘附和迁移。
[0079]
如在本发明中所用,术语“小分子”意指天然或人工产生的生物活性分子,其能够扩散通过细胞膜并能够调节信号传导通路。在本发明中优选使用的小分子可以抑制磷脂酰肌醇3-激酶(pi3k)和糖原合成酶激酶3,分别如ly294002和chir99021。
[0080]
如在本发明中所用,术语“重现(recapitulate)信号传导”意指模拟、模仿或效仿分泌的分子(比如生长因子和/或趋化因子)的功能,所述分子影响天然环境中的细胞,从而能够通过这些作用产生小胶质细胞。
[0081]
如在本发明中所用,术语“模拟信号传导”意指模拟、模仿、效仿或重现分泌的分子(比如生长因子和/或趋化因子)的功能,所述分子影响自然环境中的细胞并由此能够通过这些作用产生小胶质细胞。
[0082]
如在本发明中所用,术语“小胶质细胞的胚胎发育”意指根据人胚胎、胎儿和出生后发育期间的发育的小胶质细胞分化的结果,多能干细胞向成熟小胶质细胞的逐步转变,从植入前胚泡期胚胎开始,直到完全建立的和自我维持的小胶质细胞群体。
[0083]
如在本发明中所用,术语“成体小胶质细胞增殖”意指导致成熟小胶质细胞的任何细胞分裂过程。
[0084]
如在本发明中所用,术语“成体小胶质细胞分化”意指处于小胶质祖细胞状态的细胞向成体小胶质细胞类型的分化,所述成体小胶质细胞引入了处于稳态/静息状态的小胶质细胞的典型特征。
[0085]
如在本发明中所用,术语“成体小胶质细胞极化”意指成熟小胶质细胞对细胞外环境提供的细胞外刺激的反应,这些细胞外环境提供的细胞外刺激分别是由于血脑屏障功能障碍导致的来自损伤的神经元、神经胶质细胞的信号或暴露于血浆蛋白的信号。这种小胶质细胞反应包括小胶质细胞向损伤部位的移动,并且可以具有神经保护或毒性作用。
[0086]
此外,在本发明方法的一个实施方案中,所述至少一种生长因子或小分子选自活化素a(seq id no:7)、bmp4(seq id no:8)、fgf(seq id no:9)、vegf-a(seq id no:10)、ly294002、chir99021、scf(seq id no:11)、il-3(seq id no:12)、il-6(seq id no:13)、csf1(seq id no:14)、il-34(seq id no:15)、csf2(seq id no:16)、cd200(seq id no:17)、cx3cl1(seq id no:18)、tgfβ1(seq id no:19)和ide1。
[0087]
如在本发明中所用的,活化素a(seq id no:7)意指活化素β-a链、edf、红细胞分化蛋白、frp、fsh释放蛋白、inhba、抑制素β-a链、抑制素β-1。由该基因编码的蛋白质是由多能干细胞、内胚层和中胚层产生的转化生长因子β(tgf-β)蛋白家族的成员。
[0088]
如在本发明中所用的,bmp4(seq id no:8)意指骨形态发生蛋白4,也称为zyme、bmp2b或bmp2b1。由该基因编码的蛋白质是骨形态发生蛋白家族的成员,其是转化生长因子-β超家族的一部分。
[0089]
如在本发明中所用的,fgf(seq id no:9)意指成纤维细胞生长因子。由该基因编码的蛋白质是如在如hui等,2018中所述的细胞信号蛋白家族的成员。
[0090]
如在本发明中所用的,vegf-a(seq id no:10)意指血管内皮生长因子a,也称为vpf、vegf或mvcd1。由该基因编码的蛋白质是pdgf/vegf生长因子家族的成员并是一种肝素结合蛋白。该生长因子诱导血管内皮细胞的增殖和迁移,并且对于生理性和病理性血管生成都是必需的。
[0091]
如在本发明中所用的,ly294002意指磷脂酰肌醇3-激酶(pi3k)的有效的细胞渗透性抑制剂,其作用于酶的atp结合位点(vlahos等,1994)。其化学结构如下:
[0092][0093]
如在本发明中所用的,chir99021意指氨基嘧啶衍生物,其是糖原合成酶激酶3的极有效的抑制剂,其抑制gsk3β(ic
50
=6.7nm)和gsk3α(ic
50
=10nm)并作为wnt激活剂。其化学结构如下:
[0094][0095]
如在本发明中所用的,scf(seq id no:11)意指干细胞因子,也称为kit配体、肥大细胞生长因子或steel因子。由该基因编码的蛋白质是一种早期作用的细胞因子,其在胚胎和成体造血的调节中起关键作用。
[0096]
如在本发明中所用的,il-3(seq id no:12)意指白细胞介素-3、mcgf(肥大细胞生长因子)、多-csf、hcgf、p-细胞刺激因子、mgc79398或mgc79399。由该基因编码的蛋白质是生长促进细胞因子。
[0097]
如在本发明中所用的,il-6(seq id no:13)意指白细胞介素6,也称为b-细胞刺激因子2、ctl分化因子、杂交瘤生长因子、干扰素β-2、白细胞介素-6、ifn-β-2、ifnb2、bsf-2、cdf、干扰素、β2、b细胞分化因子、干扰素、β2、白细胞介素bsf-2、bsf2、hgf或hsf。该基因编码的蛋白质是在炎症和b细胞成熟中起作用的细胞因子。
[0098]
如在本发明中所用的,csf1(seq id no:14)意指集落刺激因子1,也称为集落刺激因子1(巨噬细胞)、巨噬细胞集落刺激因子1、巨噬细胞集落刺激因子1、lanimostim、csf-1、mcsf、m-csf,并且由该基因编码的蛋白质是控制巨噬细胞的产生、分化和功能的细胞因子。
[0099]
如在本发明中所用的,il-34(seq id no:15)意指白细胞介素34,也称为c16或f77。由该基因编码的蛋白质是通过集落刺激因子-1受体促进单核细胞和巨噬细胞的分化和生存力的细胞因子。
[0100]
如在本发明中所用的,csf2(seq id no:16)意指集落刺激因子2,也称为sarcramostim、集落刺激因子2(粒细胞-巨噬细胞)、粒细胞-巨噬细胞集落刺激因子、molgramostin、莫拉司亭、gmcsf、csf、粒细胞巨噬细胞-集落刺激因子、粒细胞-巨噬细胞集落刺激因子、集落刺激因子、gm-csf。由该基因编码的蛋白质是控制粒细胞和巨噬细胞的产生、分化和功能的细胞因子。
[0101]
如在本发明中使用的,cd200(seq id no:17)意指cd200基因,也称为cd200分子、cd200抗原、单克隆抗体mrc ox-2所识别的抗原、ox-2膜糖蛋白、mox1、mox2、ox-2或mrc。由该基因编码的蛋白质是含有两个胞外免疫球蛋白结构域,一个跨膜结构域和一个胞质结构域的i型膜糖蛋白。
[0102]
如在本发明中所用的,cx3cl1(seq id no:18)意指cx3cl1基因,也称为c-x3-c基序趋化因子配体1、小诱导细胞因子亚家族d(cys-x3-cys)、成员1(趋化因子分形素(fractalkine),神经肌动蛋白(neurotactin))、趋化因子(c-x3-c基序)配体1、cx3c膜锚定趋化因子、小诱导细胞因子d1、c-x3-c基序趋化因子1,神经肌动蛋白、趋化因子分形素,或scyd1、ntt、小诱导细胞因子亚家族d(cys-x3-cys)、成员-1、c3xkine、abcd-3、cxc3c、cxc3、ntn或fkn。由该基因编码的蛋白质属于趋化因子的cx3c亚组,其特征在于位于保守半胱氨
酸残基之间的氨基酸数目。
[0103]
如在本发明中所用的,tgfβ1(seq id no:19)意指转化生长因子β1,也称为转化生长因子β-1蛋白原、前体转化生长因子β-1、tgfb、转化生长因子β1、转化生长因子β-1、潜伏相关肽、camauri-engelmann氏病、tgf-β-1、ibdimde、tgfβ、dpd1、ced或lap。由该基因编码的蛋白质是tgf-β(转化生长因子-β)蛋白质超家族的分泌配体。
[0104]
在本发明方法的另一实施方案中,所述至少一种生长因子是csf1(seq id no:14)或il-34(seq id no:15)。在本发明方法的又一实施方案中,所述至少一种生长因子是csf1(seq id no:14)。在本发明方法的再一实施方案中,所述至少一种生长因子是il-34(seq id no:15)。
[0105]
在本发明方法的另一个实施方案中,所述至少一种小分子是chir99021、ly294002或ide1。
[0106]
如在本发明中所用的,ly294002意指磷脂酰肌醇3-激酶(pi3k)的有效的细胞渗透性抑制剂,其作用于酶的atp结合位点(vlahos等,1994)。其化学结构如下:
[0107][0108]
如在本发明中所用的,chir99021意指氨基嘧啶衍生物,其是糖原合成酶激酶3的有效抑制剂,其抑制gsk3β(ic
50
=6.7nm)和gsk3α(ic
50
=10nm)并作为wnt激活剂。其化学结构如下:
[0109][0110]
如在本发明中所用的,ide1意指定形内胚层的诱导物;激活tgf-β通路并可用作生长因子tgf-β的替代物的小分子。其化学结构如下:
[0111][0112]
在本发明方法的另一实施方案中,所述第一和第二基因组安全港位点是不同的。
[0113]
在本发明方法的又一实施方案中,所述方法进一步包括转录因子cebpb的基因的编码序列(seq id no:3)的插入及其表达。
[0114]
如在本发明中所用的,cebpb(seq id no:3)意指ccaat增强子结合蛋白β,也称为ccaat增强子结合蛋白β、ccaat/增强子结合蛋白(c/ebp)、β、白介素6依赖性dna结合蛋白、ccaat/增强子结合蛋白β、白介素6的核因子、转录因子5、核因子nf-il6、tcf5、肝富集转录激活蛋白、ccaat/增强子结合蛋白β、肝富集抑制蛋白、转录因子c/ebpβ、肝激活蛋白、c/ebp-β、c/ebpβ、il6dbp、nf-il6、tcf-5、lap或lip。该种无内含子基因编码含有碱性亮氨酸拉链(bzip)结构域的转录因子。
[0115]
在本发明方法的另一个实施方案中,所述方法进一步包括转录因子runx1的基因的编码序列(seq id no:4)的插入及其表达。
[0116]
如在本发明中所用的,runx1(seq id no:4)意指runt相关转录因子1、runt相关的转录因子1、多瘤病毒增强子结合蛋白2αb亚基、sl3/akv核心结合因子αb亚基、sl3-3增强子因子1αb亚基、急性髓性白血病1蛋白、癌基因aml-1、pebp2-αb、pea2-αb、cbfa2、aml1、核心结合因子runt结构域α亚基2核心结合因子亚基α-2、aml1-evi-1融合蛋白、急性髓性白血病、aml1癌基因、cbf-α-2、aml1-evi-1、pebp2α、cbf2α、pebp2ab、amlcr1或evi-1。由该基因编码的蛋白质代表cbf的α亚基,并被认为参与正常血细胞生成的发育。
[0117]
在本发明方法的另一实施方案中,所述方法还包括转录因子irf8的基因的编码序列(seq id no:5)的插入及其表达。
[0118]
如在本发明中所用的,irf8(seq id no:5)意是指干扰素调节因子8,也称为干扰素共有序列结合蛋白1、h-icsbp、icsbp1、icsbp、irf-8、干扰素共有序列结合蛋白、imd32a、imd32b或干扰素共有序列结合蛋白(icsbp)。它是干扰素(ifn)调节因子(irf)家族的转录因子。
[0119]
在本发明方法的另一个实施方案中,所述方法还包括转录因子sall1的基因的编码序列(seq id no:6)的插入及其表达。
[0120]
如在本发明中所用的,sall1(seq id no:6)意指spalt样转录因子1,也称为锌指蛋白spalt-1、锌指蛋白sall1、锌指蛋白794、sal-样蛋白1、znf794、sal-1、附睾分泌蛋白li 89、spalt-样转录因子1、sal(果蝇)样1、sal-样1(果蝇)、hel-s-89、hsal1、hsal1、sal1或tbs。由该基因编码的蛋白质是锌指转录抑制子,并且可以是nurd组蛋白脱乙酰酶复合物(hdac)的一部分。
[0121]
在本发明方法的另一实施方案中,所述转录调节蛋白是反向四环素反式激活蛋白(rtta)(seq id no:20),其活性受强力霉素或四环素控制。
[0122]
如在本发明中所用的,术语“反向四环素反式激活蛋白(rtta)”意指由四环素或其衍生物诱导的转录激活蛋白。四环素控制的转录激活是一种诱导型基因表达的方法,其中在抗生素四环素或其衍生物之一(如更稳定的强力霉素)存在的情况下,转录可逆地开启或关闭。在该系统中,转录激活蛋白可以是四环素应答性转录激活蛋白(rtta)或其衍生物。本发明的转录调节蛋白可以是rtta。rtta蛋白能够在特定teto操纵子序列处结合dna。将这种teto序列的若干重复置于最小启动子(比如cmv启动子)的上游,它们一起形成四环素应答元件(tre)(seq id no:21)。根据添加四环素或衍生物是激活(tet-on)还是失活(tet-off)rtta蛋白,该系统分为两种形式。在本发明方法的一个实施方案中,也可以使用其中强力霉
素激活rtta蛋白的tet-on系统。
[0123]
tet-on系统由两个组件组成;(1)组成型地表达的四环素应答转录激活蛋白(rtta)和rtta敏感性诱导型启动子(tet应答元件,tre)。该系统可以被四环素或四环素更稳定的衍生物(包括强力霉素(dox))结合,导致rtta的激活,使其与tre序列结合,并诱导tre控制的基因的表达。在本发明的方法中使用这种系统可能是优选的。因此,本发明方法的转录调节蛋白可以是四环素应答转录激活蛋白(rtta),其可以被外源提供的抗生素四环素或其衍生物之一激活或失活。如果转录调节蛋白是rtta,那么插入第二gsh位点的诱导型启动子包括四环素应答元件(tre)。外源提供的物质可以是抗生素四环素或其衍生物之一,如强力霉素,优选四环素或强力霉素。
[0124]
可以将变体和修饰的rtta蛋白用于本发明的方法中。它们可以包括tet-on高级反式激活蛋白(也称为rtta2s-m2)和tet-on 3g(也称为rtta-v16,衍生自rtta2s-s2)。
[0125]
在本发明方法的另一个实施方案中,诱导型启动子包括tet应答元件(tre)(seq id no:21)。
[0126]
如在本发明中所用,术语“tet应答元件(tre)”意指由间隔序列隔开的19bp的7个重复的细菌teto序列,并具有最小启动子。因为最小启动子可以是任何合适的启动子,因此tre序列的变体和修饰是可能的。优选地,在不存在rtta结合的情况下,最小启动子显示无表达水平或显示最小表达水平。因此,插入第二gsh的诱导型启动子可包含tre。本发明的基本遗传原理也在图2中进行了描述,该图示出了不同的gsh位点(hrosa26和aavs1)和整合的rtta(seq id no:20)和tre(seq id no:21)。
[0127]
在本发明方法的另一个实施方案中,所述第一和所述第二基因组安全港位点选自hrosa26基因座(seq id no:22)、aavs1基因座(seq id no:23)、clybl基因(seq id no:24)、ccr5基因(seq id no:25)、hprt基因(seq id no:26)或具有染色体8上的位点id 325(seq id no:27)、染色体1上的位点id 227(seq id no:28)、染色体2上的位点id 229(seq id no:29)、染色体5上的位点id 255(seq id no:30)、染色体14上的位点id 259(seq id no:31)、染色体x上的位点id 263(id no:32)、染色体2上的位点id 303(seq id no:33)、染色体4上的位点id 231(seq id no:34)、染色体5上的位点id 315(seq id no:35)、染色体16上的位点id 307(seq id no:36)、染色体6上的位点id 285(seq id no:37)、染色体6上的位点id233(seq id no:38)、染色体134上的位点id 311(seq id no:39)、染色体7上的位点id 301(seq id no:40)、染色体8上的位点id 293(seq id no:41)、染色体11上的位点id 319(seq id no:42)、染色体12上的位点id 329(seq id no:43)、染色体x上的位点id 313(seq id no:44)的基因。优选地,在本发明方法的另一个实施方案中,所述第一和所述第二基因组安全港位点选自hrosa26基因座(seq id no:22)、aavs1基因座(seq id no:23)、clybl基因(seq id no:24)、ccr5基因(seq id no:25)、hprt基因(seq id no:26)。更优选地,所述第一和所述第二基因组安全港位点选自hrosa26基因座(seq id no:22)和aavs1基因座(seq id no:23)。
[0128]
可以通过寻找病毒天然整合而不破坏天然基因表达的位点来识别其它位点。对于本发明的方法,可使用几个gsh位点,这将在下面更详细地描述。
[0129]
腺相关病毒整合位点1基因座(aavs1)(seq id no:23)位于人19号染色体上的蛋白磷酸酶1,调节亚基12c(ppp1r12c)基因内,其在人组织中均匀且普遍地表达。该位点作为
285:89,574,320-89,574,339(seq id no:37);染色体6上的位点id 233:114,713,905-114,713,924(seq id no:38);染色体6上的位点id 311:134,385,946-134,385,965(seq id no:39);染色体7上的位点id 301:113,327,685-113,327,704(seq id no:40);染色体8上的位点id 293:40,727,927-40,727,946(seq id no:41);染色体11上的位点id 319:32,680,546-32,680,565(seq id no:42);染色体12上的位点id 329:126,152,581-126,152,600(seq id no:43);和染色体x上的位点id 313:16,059,732-16,059,751(seq id no:44)。
[0135]
在本发明方法的另一个实施方案中,所述干细胞是多能干细胞、诱导的多能干细胞(ipsc)、神经祖细胞、造血干细胞或胚胎干细胞(esc)。
[0136]
在本发明中,术语“多能干细胞”如上文所定义使用。
[0137]
如在本发明中所用,术语“神经祖细胞”意指多能干细胞和成熟体细胞之间的多能细胞状态。这种细胞状态通常被确定为变成特化的细胞类型,如神经元、少突胶质细胞和星形胶质细胞。
[0138]
在本发明中,术语“诱导的多能干细胞(ipsc)”如上文所定义使用。
[0139]
如在本发明中所用,术语“造血干细胞”意指造血的干细胞。这种特殊类型的多能干细胞能够形成任何类型的血细胞,但丧失了形成其它细胞类型的能力。
[0140]
在本发明中,术语“胚胎干细胞(esc)”如上文所定义使用。
[0141]
在本发明方法的另一个实施方案中,所述干细胞是人或小鼠干细胞。
[0142]
如在本发明中所用,术语“人或小鼠干细胞”意指来自人或小鼠的细胞。然而,本发明方法中使用的干细胞可以是任何人或动物细胞。优选哺乳动物细胞,比如来自诸如小鼠和大鼠的啮齿动物的细胞;有袋动物,例如袋鼠和可袋熊;非人灵长类动物,比如矮黑猩猩、黑猩猩、狐猴、长臂猿和猿;骆驼科动物,比如骆驼和美洲驼;牲畜,比如马、猪、牛、水牛、野牛、山羊、绵羊、鹿、驯鹿、驴、白臀野牛、牦牛、鸡、鸭和火鸡;家畜,比如猫、狗、兔和豚鼠。优选地,细胞是人细胞。在一些方面,细胞优选来自牲畜。一旦遗传物质向gsh位点的插入完成,本发明方法中所用细胞的类型将取决于细胞的应用。
[0143]
本发明还涉及通过根据本发明的任何方法获得的小胶质细胞,优选地其中所述小胶质细胞表达至少一种选自itgam(cd11b)(seq id no:45)、itgax(cd11c)(seq id no:46)、cd14(seq id no:47)、cd16(seq id no:48)、entpd1(cd39)(seq id no:49)、ptprc(cd45)(seq id no:50)、cd68(seq id no:51)、csf1r(cd115)(seq id no:52)、cd163(seq id no:53)、cx3cr1(seq id no:54)、trem2(seq id no:55)、p2ry12(seq id no:56)、tmem119(seq id no:57)和hla-dr(seq id no:58)的小胶质细胞表面蛋白。
[0144]
因此,通过表达以下表面蛋白中的至少一种进一步定义了小胶质细胞:itgam(cd11b)(seq id no:45)、itgax(cd11c)(seq id no:46)、cd14(seq id no:47)、cd16(seq id no:48)、entpd1(cd39)(seq id no:49)、ptprc(cd45)(seq id no:50)、cd68(seq id no:51)、csf1r(cd115)(seq id no:52)、cd163(seq id no:53)、cx3cr1(seq id no:54)、trem2(seq id no:55)、p2ry12(seq id no:56)、tmem119(seq id no:57)和hla-dr(seq id no:58)。这些蛋白质定义如下。
[0145]
如在本发明中所用的,itgam(cd11b)意指整联蛋白亚基αm,一种编码整联蛋白αm链的基因。整联蛋白是由α链和β链组成的异二聚体整合膜蛋白。itgam(cd11b)的蛋白质序
列在seq id no:45中给出。
[0146]
如在本发明中所用的,itgax(cd11c)意指整联蛋白亚基αx,且该基因编码整联蛋白αx链蛋白。itgax(cd11c)的蛋白质序列在seq id no:46中给出。
[0147]
如在本发明中所用的,cd14意指单核细胞分化抗原cd14,由该基因编码的蛋白质是优选在单核细胞/巨噬细胞上表达的表面抗原。cd14的蛋白质序列在seq id no:47中给出。
[0148]
如在本发明中所用的,cd16意指igg受体iiia的fcgr3a fc片段,该基因编码免疫球蛋白g的fc部分的受体,它参与从循环中移除抗原-抗体复合物,以及其它抗体依赖性应答。cd16的蛋白质序列在seq id no:48中给出。
[0149]
如在本发明中所用的,entpd1(cd39)意指外核苷三磷酸二磷酸水解酶1,并且由该基因编码的蛋白质是将细胞外atp和adp水解成amp的质膜蛋白质。entpd1(cd39)的蛋白质序列在seq id no:49中给出。
[0150]
如在本发明中所用的,ptprc(cd45)意指蛋白酪氨酸磷酸酶受体c型,由该基因编码的蛋白是蛋白酪氨酸磷酸酶(ptp)家族的成员。ptprc(cd45)的蛋白质序列在seq id no:50中给出。
[0151]
如在本发明中所用的,cd68意指cd68抗原,该基因编码由人单核细胞和组织巨噬细胞高度表达的110-kd跨膜糖蛋白。cd68的蛋白质序列在seq id no:51中给出。
[0152]
如在本发明中所用的,csf1r(cd115)意指集落刺激因子1受体,由该基因编码的蛋白是集落刺激因子1的受体,集落刺激因子是控制巨噬细胞产生、分化和功能的细胞因子。csf1r(cd115)的蛋白质序列在seq id no:52中给出。
[0153]
如在本发明中所用的,cd163意指cd163抗原,由该基因编码的蛋白质是富含半胱氨酸的清道夫受体(srcr)超家族的成员,并只在单核细胞和巨噬细胞中表达。cd163的蛋白质序列在seq id no:53中给出。
[0154]
如在本发明中所用的,cx3cr1意指c-x3-c基序趋化因子受体1,由该基因编码的蛋白是趋化因子分形素的受体。cx3cr1的蛋白质序列在seq id no:54中给出。趋化因子分形素是一种参与白细胞的粘附和迁移的跨膜蛋白和趋化因子。
[0155]
如在本发明中所用的,trem2意指在髓系细胞上表达的触发受体2,该基因编码与tyro蛋白酪氨酸激酶结合蛋白形成受体信号复合物的膜蛋白。trem2的蛋白质序列在seq id no:55中给出。
[0156]
如在本发明中所用的,p2ry12意指嘌呤能受体p2y12,该基因的产物属于g-蛋白偶联受体家族。p2ry12的蛋白质序列在seq id no:56中给出。
[0157]
如在本发明中使用的,tmem119意指跨膜蛋白119,它是一种编码蛋白的基因。其相关途径有神经炎症期间的小胶质细胞激活。tmem119的蛋白质序列在seq id no:57中给出。
[0158]
如在本发明中所用的,hla-dr意指主要组织相容性复合物,ii类、drα和β,hla-dra和hla-drb1都是hla ii类α链旁系同源物。hla-dr的蛋白质序列在seq id no:58中给出。
[0159]
在进一步的实施方案中,本发明还包括用于治疗的根据本发明所述的小胶质细胞。
[0160]
如本发明所用,术语“治疗”是指生物体、动物或人类的疾病或不希望的健康状态的任何形式的治疗。它还可以包括基因疗法。可以将基因疗法定义为以治疗为目的将外源
dna人为地插入细胞核。这种定义包括向细胞提供一个或多个基因以便提供野生型形式的错误基因、添加干扰靶基因表达的rna分子的基因(其可能是缺陷的),提供自杀基因(比如将无害前药更昔洛韦(gcv)转化为细胞毒性药物酶-单纯疱疹病毒胸苷激酶(hsv-tk)和胞嘧啶脱氨酶(cd)酶)、提供用于免疫疗法或癌症疗法(包括细胞过继免疫疗法)的dna疫苗,以及向细胞提供任何其它基因以用于治疗目。此外,可直接将成熟小胶质细胞用于移植到人或动物体内。可选地,小胶质细胞可形成用于研究的测试材料,所述研究包括药物对基因表达的影响和药物与特定基因的相互作用。用于研究的小胶质细胞可涉及使用具有未知功能的基因序列的诱导盒,以研究该基因序列的可控表达。此外,可以将小胶质细胞用于生产大量所需的材料,比如生长因子或细胞因子。
[0161]
此外,在一个实施方案中,本发明还涉及根据本发明所述的此类小胶质细胞用于疾病的体外诊断的用途。优选地,所述疾病选自中枢神经系统疾病,优选神经退行性疾病;更优选地为阿尔茨海默症、帕金森病、额颞叶性痴呆或肌萎缩性脊髓侧索硬化;神经炎症或自身免疫疾病,优选地为多发性硬化、自身抗体介导的脑炎或感染性疾病、神经血管疾病;优选地为中风、血管炎;外伤性脑损伤和癌症。
[0162]
此外,本发明涉及根据本发明所述的此类小胶质细胞用于与脑类器官体外培养的用途。
[0163]
如在本发明中所用,术语“类器官”意指(主要是干)细胞衍生的体外3d-器官模型,并与根据本发明产生的小胶质细胞组合代表了用于医学诊断的有力工具,所述医学诊断用以研究小胶质细胞与脑的其他细胞的参与和相互作用。
[0164]
***
[0165]
注意,除非上下文另有明确指示,否则如本文所用的单数形式“一个”、“一种”和“该/所述”包括复数指代,。因此,例如,对“一种试剂”的指代包括此类试剂中的一种或多种,并且对“所述方法”的指代包括对本领域普通技术人员已知的等效步骤和方法的指代,所述等效步骤和方法可修改或取代本文中所描述的方法。
[0166]
除非另有说明,在一系列元素前的术语“至少”应理解为指代该系列中的每个元素。如果没有特别不同地限定,术语“至少一种”指代一种或多种,比如两种、三种、四种、五种、六种、七种、八种、九种、十种或更多种。本领域技术人员将认识到或能够使用不超过常规实验确定本文所述的本发明的具体实施方案的许多等效物。这些等效物也包括在本发明中。
[0167]
本文中使用的术语“和/或”均包括“和”、“或”和“由所述术语连接的元素的全部或任何其它组合”的含义。
[0168]
术语“小于”或“大于”不包括具体的数字。
[0169]
例如,小于20意指小于所指示的数字。类似地,“多于”或“大于”意指多于或大于所指示的数字,例如,大于80%意指大于或多于所指定的数字80%。
[0170]
贯穿本说明书和随后的权利要求书,除非上下文另有要求,词语“包括/包含(comprise)”以及变形词语比如“包括/包含(comprises)”和“包括/包含(comprising)”将被理解为意指包括陈述的整数或步骤、或整数或步骤的集合,但并不排除任何其它的整数或步骤、或整数或步骤的集合。当本文使用时,术语“包括/包含(comprising)”能够被术语“含有(containing)”或“包括(including)”替代,或有时本文使用时会以术语“具有”替代。
本文使用的“由
……
组成”排除任何未规定的元素、步骤或成分。
[0171]
术语“包括”意指“包括但不限于”。“包括”和“包括但不限于”可互换使用。
[0172]
术语“约”意是指正或负10%,优选地正或负5%,更优选地正或负2%,最优选地正或负1%。
[0173]
在本说明书的说明和权利要求中,除非上下文另有要求,否则单数涵盖复数。特别地,在使用不定冠词的情况下,除非上下文另有要求,否则说明书应被理解为既考虑复数又考虑单数。
[0174]
应该理解的是,本发明并不限于本文所述的具体的方法学、方案、材料、试剂和物质等,因为这些能够改变。本文所使用的术语只用于描述特定实施方案的目的而并不意在限制本发明的范围,本发明的范围仅由权利要求限定。
[0175]
本说明书全文所引用的所有出版物(包括所有的专利、专利申请、科学出版物、说明书等),无论在前还是在后,其以全文并入本文。本文的任何内容均不能被解释为承认本发明由于在先发明而不早于这样的公开物。在通过引入方式并入的材料与本说明书矛盾或不一致时,本说明书将取代任何这样的材料。
[0176]
本文引用的所有文献和专利文献的内容均通过引入以其整体并入本文。
[0177]
通过以下仅出于说明性目的提供的实施例可以更好的理解本发明及其优势。这些实施例并非意在以任何方式限制本发明的范围。
[0178]
本发明的实施例
[0179]
以下实施例阐释了本发明,但不应解释为限制本发明的范围。
[0180]
实施例1
[0181]
材料和方法
[0182]
对于最步筛选实验,首先产生hrosa-cag-rtta hipsc-系(如图2a和图4a所示表达cas9-切口酶、两个hrosa26特异性向导rna(seq id no:66和seq id no:67)的三个质粒和具有cag-rtta表达盒的供体质粒的核转染;抗生素选择、克隆扩增和单个克隆hipsc集落的表征),随后进行四个aavs1靶向载体(seq id no:61至seq id no:64)(也参见图4b-e)的瞬时转染,以允许pu.1(seq id no:2)单独或与三个其它转录因子runx1(seq id no:4)、cebpb(seq id no:3)或irf8(seq id no:5)中的任一种组合以双顺反子表达盒(图4b-e)(seq id no:61至seq id no:64)的形式快速过表达。出于筛选目的,靶细胞不克隆扩增,从而仅在细胞亚群中过表达。
[0183]
令人惊讶地,初步筛选实验证明在表达pu.1(seq id no:2)和任何其它三种候选重编程因子的所有三种细胞系中快速诱导髓系和小胶质细胞系标志物,但在野生型对照hipsc中或在单独表达pu.1(seq id no:2)的细胞中不快速诱导髓系和小胶质细胞系标志物。
[0184]
描述
[0185]
为了开发原型方案和建立合适的读出参数,本发明人决定聚焦于pu.1(seq id no:2)和cebpb(seq id no:3)的组合过表达。因此,产生并克隆扩增了完全证实的靶向双重gsh的诱导型pu.1 cebpb hipsc。
[0186]
观察
[0187]
强力霉素的添加导致多能性标志物oct4(seq id no:78)和nanog(seq id no:79)
的表达的快速丧失以及在所有细胞中两种转基因的诱导(参见图6)。
[0188]
实施例2
[0189]
材料和方法
[0190]
简言之,将hipsc作为单细胞铺板到多能性维持培养基中的基质胶上。两天后,将培养基更换为补充有用于转基因诱导的dox以及模拟上述胚胎事件序列的小分子和生长因子的dulbecco改良eagle培养基(dmem)/f12。诱导三天后,粘附细胞开始从组织培养板分层,并在上清液中作为漂浮的单个细胞而被发现。
[0191]
描述
[0192]
随后,本发明人进行了更长时间的筛选实验,在实验中将细胞诱导长达20天以优化培养基组成。多色流式细胞术证明了对髓样细胞表面标志物的显著稳健和快速的诱导,所述髓样细胞表面标志物被选择作为用于诱导原始巨噬细胞和/或小胶质细胞的筛选组(cd11b(seq id no:45)、cd14(seq id no:47)、cd45(seq id no:50)、cd163(seq id no:53)、cx3cr1(seq id no:54))。发明人还注意到重要的培养条件-依赖性差异:当转录因子过表达与定时暴露于模拟胚胎发育的序列的细胞外信号(cue)(小分子、生长因子)联合进行时,诱导发生得最为快速和有效:(1)朝向(后原条)胚外中胚层和血管原细胞的多能外胚层(hipsc)的模式化,(2)原始造血和早期巨噬细胞前体的诱导,(3)向原始卵黄囊巨噬细胞的分化,(4)向小胶质细胞的分化(参见图5)。
[0193]
观察
[0194]
如流式细胞术所证明的,细胞迅速开始表达包括cd45(seq id no:50)(也称为ptprc)、cd11b(seq id no:45)(也称为itgam)、cd14(seq id no:47)和cx3cr1(seq id no:54)在内的典型的髓样表面蛋白(参见图5b-c)。到第10天,根据muffat等,2016,所有细胞已转变至上清液中,并将其铺板到于最终的化学限定的小胶质细胞分化和维持培养基中的聚-l-赖氨酸(pll)涂覆的组织培养皿上。有趣地,当在诱导方案的第十天后撤除强力霉素时,向小胶质细胞的分化甚至更有效地发生,因此明确地证明了细胞表型与持续的转基因表达的独立性。
[0195]
如通过流式细胞术定量的(参见图5c)或通过免疫细胞化学证实的(参见图5d),在粘附培养中进行6-10天的无转基因分化和成熟后,几乎所有细胞均表达了广泛的常见髓样和更多小胶质细胞特异性蛋白质,包括cd39(seq id no:49)、p2ry12(seq id no:56)、trem2(seq id no:55)和tmem119(seq id no:57)。接下来,进行共培养实验,其中发明人将小胶质细胞前体铺板到根据先前公开的、根据zhang等,2013和pawlowski等,2017的方案产生的源自同基因hipsc的皮层神经元的纯群体上。与单一培养的细胞相比,小胶质细胞具有更多的分枝(即更少活化)形态(参见图5e)。在单一培养中的hipsc和小胶质细胞的实时qpcr分析证实了多能性因子的下调、myb-独立性(与原始卵黄囊巨噬细胞来源的小胶质细胞一致)、和核心小胶质细胞转录因子、典型表面标志物、以及最近提出的独特小胶质细胞特征基因的高表达(参见图5f)。
[0196]
参考文献:
[0197]
abud em,ramirez rn,martinez es,healy lm,nguyen chh,newman sa,yeromin a v,scarfone vm,marsh se,fimbres c,等:ipsc-derived human microglia-like cells to study neurological diseases.neuron,2017,94:278-293.e9.
[0198]
butovsky o,weiner hl:microglial signatures and their role in health and disease.nat rev neurosci.,2018,19.
[0199]
cantos c,francisco p,trijatmiko kr,slamet-loedin i and chadha-mohanty pk:identification of“safe harbor”loci in indica rice genome by harnessing the property of zinc-finger nucleases to induce dna damage and repair.frontier in plant science,2014,5:302,pp.1-8.
[0200]
cerbini t,funahashi r,luo y,liu c,park k,rao m,malik n,zou j:transcription activator-like effector nuclease(talen)-mediated clybl targeting enables enhanced transgene expression and one-step generation of dual reporter human induced pluripotent stem cell(ipsc)and neural stem cell(nsc)lines.plos one,2015.
[0201]
chung y,klimanskaya i,becker s,li t,maserati m,lu s,zdravkovic t,ilic d,genbacev o,fisher s,krtolica a,and lanza r:human embryonic stem cell lines generated without embryo destruction.2008,cell stem cell,2(2)pp.113-117.
[0202]
cohen de,melton da:turning straw into gold:directing cell fate for regenerative medicine.nat rev genet 2011,12:243-52.
[0203]
douvaras p,sun b,wang m,kruglikov l,lallos g,zimmer m,terrenoire c,zhang b,gandy s,schadt e,等:directed differentiation of human pluripotent stem cells to microglia.stem cell reports,2017,8:1516-1524.
[0204]
gaj,t,gersbach,ca,barbas,cf:zfn,talen,and crispr/cas-based methods for genome engineering,trends biotechnol.,2013,31(7):397-405.
[0205]
ginhoux f,greter m,leboeuf m,nandi s,see p,gokhan s,mehler mf,conway sj,ng lg,stanley er等:fate mapping analysis reveals that adult microglia derive from primitive macrophages.science,(80)2010,330:841-5.
[0206]
gomez perdiguero e,klapproth k,schulz c,busch k,azzoni e,crozet l,garner h,trouillet c,de bruijn mf,geissmann f等:tissueresident macrophages originate from yolk-sac-derived erythro-myeloid progenitors.nature 2015,518:547-51.
[0207]
haenseler w,sansom sn,buchrieser j,newey se,moore cs,nicholls fj,chintawar s,schnell c,antel jp,allen nd等:a highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response.stem cell reports 2017,8:1727-1742.
[0208]
hagan ce,bolon b and keene cd,comparative anatomy and histology,2012,pages 339-394.
[0209]
keren-shaul h,spinrad a,weiner a,matcovitch-natan o,dvir-szternfeld r,ulland tk,david e,baruch k,lara-astaiso d,toth b等:a unique microglia type associated with restricting development of alzheimer's disease.cell,2017,169:1276-1290.e17.
differentiation and function.immunity,2017,47:1 83-1 98.e6.
[0223]
thomson ja,ltskovitz-eldor j,shapiro ss,waknitz ma,swiergiel jj,marshall vs,jones jm:embryonic stem cell lines derived from human blastocysts.science,(80-)1998,282:1145-7.
[0224]
vlahos cj,matter wf,hui ky,and brown rf:a specific inhibitor of phosphatidylinositol 3-kinase,2-(4-morpholinyl)-8-phenyl-4h-l-benzopyran-4-one(ly294002).the journal of biological chemistry,1994,269(7),pp.5241-5248.
[0225]
zhangy,pak c,han y,ahlenius h,zhangz,chanda s,marro s,patzke c,acuna c,covy j等:rapid single-step induction of functional neurons from human pluripotent stem cells.neuron,2013,78:785-98.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。