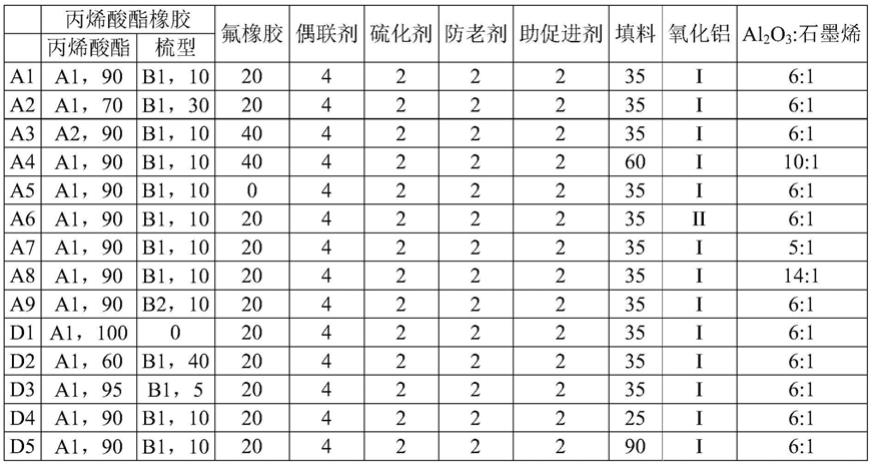
1.本发明涉及生物技术领域,具体地,涉及一种封闭式的菌体裂解工艺。
背景技术:
2.基因治疗(gene therapy)是指将外源治疗性基因导入靶细胞,以纠正或补偿因基因缺陷和异常引起的疾病,或通过外源基因表达的产物作用于疾病靶点,以达到治疗目的。
3.质粒载体是基因治疗的基础,可以直接用于体内治疗,也可以被包装成病毒载体,或者在体外修饰靶细胞(如t细胞或者干细胞)后用于患者的治疗。
4.质粒载体的纯度(包括超螺旋比例和内毒含量等)会影响到下游病毒的包装和基因治疗的疗效。质粒可以分为开环、超螺旋、复制中间体等。开环会导致功能基因的失活,让病毒包装效能或者体内疗效下降,因此超螺旋比例是质粒的关键质量属性,也是质粒纯化过程中的关键控制点。虽然说纯化工艺可以去除一部分开环,但是如何控制开环的形成才是质粒生产的关键要素。
5.工程化质粒使用大肠杆菌发酵生产,碱裂解法是从大肠杆菌中提取质粒的常用方法,开环大多是在菌体裂解过程中产生的。传统工艺采用手工裂解或者搅拌裂解的方法,前一种方法的产能因操作者而异;不容易控制,而且通量较小;后一种方法剪切力太大,对质粒的损伤较大,特别是大质粒,很容易导致开环的形成。
6.因此,本领域需要开发一种简单、方便且高质量提取质粒的方法。
技术实现要素:
7.本发明的目的在于提供一种菌体裂解方法,所述的菌体裂解方法能够显著提高菌体与裂解液充分混合,从而使质粒从菌体中释放出来,提高质粒的产量和重量。
8.本发明第一方面,提供一种菌体裂解方法,所述的方法包括步骤:
9.(1)将菌体液置于第一摇床中进行摇动后,将裂解液加入到摇动的菌体液中,经摇动混匀后,静置,得到初菌体裂解液,其中,所述的第一摇床的转速为10-30rpm,所述的混匀时间为1-10min;
10.(2)将初菌体裂解液置于第二摇床中进行摇动后,将缓冲液加入到摇动的初菌体裂解液中,经摇动混匀后,静置,得到菌体裂解液;其中,所述的第二摇床的转速为10-70rpm,所述的混匀时间为1-10min。
11.在另一优选例中,所述的步骤(1)中,所述的菌体为经质粒改造的工程菌菌体。
12.在另一优选例中,所述的质粒包括p1质粒。
13.在另一优选例中,所述的步骤(1)中,所述的菌体包括top10大肠杆菌工程菌。
14.在另一优选例中,所述的步骤(1)中,所述的第一摇床的转速为10-20rpm。
15.在另一优选例中,所述的步骤(1)中,所述的静置时间为1-60min,较佳地 1-8min,更佳地1-5min。
16.在另一优选例中,所述的步骤(1)中,所述的混匀时间为1-8min,较佳地 3-8min。
17.在另一优选例中,所述的步骤(1)中,所述的菌体液包括菌体缓冲液。
18.在另一优选例中,所述的步骤(1)中,所述的菌体液通过以下方法制备:
19.(1-1)将菌体与缓冲液混合后,在第三摇床上进行摇动混匀后,得到菌体液。
20.在另一优选例中,所述的步骤(1-1)中,所述的缓冲液包括tris缓冲液。
21.在另一优选例中,所述的步骤(1-1)中,所述第三摇床的转速为10-70rpm,较佳地10-20rpm。
22.在另一优选例中,所述的步骤(1-1)中,所述混匀的时间为1-5min。
23.在另一优选例中,所述的步骤(1)中,将所述的裂解液以50ml-400ml/min,较佳地50-300ml/min,更佳地50-200ml/min,更佳地150-200ml/min的流速加入到摇动的菌体液中。
24.在另一优选例中,所述的第一摇床、第二摇床和第二摇床为同一摇床或不同摇床。
25.在另一优选例中,所述的第一摇床为3d或者2d摇床;和/或所述的第二摇床为3d或者2d摇床。
26.在另一优选例中,所述的第三摇床为3d或者2d摇床。
27.在另一优选例中,所述的第一摇床为前后摇摆、左右摇摆和/或波浪式摇床。
28.在另一优选例中,所述的第二摇床为前后摇摆、左右摇摆和/或波浪式摇床。
29.在另一优选例中,所述的第三摇床为前后摇摆、左右摇摆和/或波浪式摇床。
30.在另一优选例中,所述的步骤(1)中,所述的裂解液包括naoh/sds裂解液。
31.在另一优选例中,所述的步骤(1)中,所述的裂解液包括naoh/sds组分。
32.在另一优选例中,所述的第一摇床包括第一托盘。
33.在另一优选例中,所述的第二摇床包括第二托盘。
34.在另一优选例中,所述的第三摇床包括第三托盘。
35.在另一优选例中,所述的步骤(1)中,所述的菌体液置于所述的第一托盘上进行摇动,所述的第一托盘与与水平面的角度为10-20。
36.在另一优选例中,所述的菌体液置于配液袋中。
37.在另一优选例中,所述的步骤(2)中,所述的初菌体裂解液置于所述的第二托盘上进行摇动,所述的第二托盘与与水平面的角度为10-20
°
。
38.在另一优选例中,所述的初菌体裂解液置于配液袋中。
39.在另一优选例中,所述的步骤(2)中,所述的静置时间为1-60min。
40.在另一优选例中,所述的步骤(2)中,所述的缓冲液包括醋酸盐(如醋酸钾)缓冲液。
41.在另一优选例中,所述的步骤(2)中,将缓冲液以50ml-400ml/min,较佳地50ml-300ml/min,较佳地50-200ml/min,更佳地150-200ml/min的流速加入到摇动的初菌体裂解液中。
42.在另一优选例中,所述的步骤(2)中,所述的第二摇床的转速为30-55rpm,较佳地40-50rpm。
43.在另一优选例中,所述的步骤(2)中,所述的混匀时间为3-8min
44.在另一优选例中,所述的步骤(2)中,所述的静置时间为1-60min,较佳地 3-8min。
45.本发明第二方面,提供一种制备质粒的方法,所述的方法包括步骤:
46.(a)用如本发明第一方面所述的菌体裂解方法对经质粒改造的工程菌菌体进行裂解,得到菌体裂解液;
47.(b)从所述菌体裂解液中分离得到质粒。
48.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例) 中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0049][0050]
图1为裂解产物dna凝胶电泳结果图。
[0051]
图2为dna凝胶电泳图中的泳道和条带2中的方框中裂解产物的泳道和条带。
[0052]
图3为dna凝胶电泳图中的泳道和条带3中的方框中裂解产物的泳道和条带。
具体实施方式
[0053]
本发明人经过广泛而又深入的研究,开发了一种菌体裂解方法,本发明所述的菌体裂解方法相对于传统的人力裂解方式或搅拌式裂解方式,能够显著提高菌体与裂解液充分混合,从而使质粒从菌体中释放出来,提高质粒的产量,且提高质粒浓度和超螺旋比例。在此基础上,发明人完成了本发明。
[0054]
术语
[0055]
除非另有定义,否则本文中所用的所有技术和科学术语的含义与本发明所属领域普通技术人员普遍理解的含义相同。
[0056]
如本文所用,术语“包括”、“包含”与“含有”可互换使用,不仅包括开放式定义,还包括半封闭式、和封闭式定义。换言之,所述术语包括了“由
……
构成”、“基本上由
……
构成”。
[0057]
菌体裂解方法
[0058]
本发明提供一种菌体裂解方法,所述的方法包括步骤:
[0059]
(1)将菌体液置于第一摇床中进行摇动后,将裂解液加入到摇动的菌体液中,经摇动混匀后,静置,得到初菌体裂解液,其中,所述的第一摇床的转速为10-30rpm,所述的混匀时间为1-10min;
[0060]
(2)将初菌体裂解液置于第二摇床中进行摇动后,将缓冲液加入到摇动的初菌体裂解液中,经摇动混匀后,静置,得到菌体裂解液;其中,所述的第二摇床的转速为10-70rpm,所述的混匀时间为1-10min。
[0061]
在本发明的一个优选例中,所述的菌体和质粒并没有特别的限制。
[0062]
代表性地,所述的菌体为经质粒改造的工程菌菌体。
[0063]
代表性地,所述的质粒包括p1质粒。
[0064]
典型地,所述的菌体包括top10大肠杆菌工程菌。
[0065]
在本发明的一个优选例中,所述的步骤(1)中,所述的第一摇床的转速为 10-20rpm。
[0066]
在本发明的一个优选例中,所述的步骤(1)中,所述的静置时间为1-60min,较佳地
1-8min,更佳地1-5min。
[0067]
在本发明的一个优选例中,所述的步骤(1)中,所述的混匀时间为1-8min,较佳地3-8min。
[0068]
在本发明的一个优选例中,所述的步骤(1)中,所述的菌体液包括菌体缓冲液。
[0069]
代表性地,所述的步骤(1)中,所述的菌体液通过以下方法制备:
[0070]
(1-1)将菌体与缓冲液混合后,在第三摇床上进行摇动混匀后,得到菌体液。
[0071]
在另一优选例中,所述的步骤(1-1)中,所述的缓冲液包括tris缓冲液。
[0072]
在另一优选例中,所述的步骤(1-1)中,所述第三摇床的转速为10-70rpm,较佳地10-20rpm。
[0073]
在另一优选例中,所述的步骤(1-1)中,所述混匀的时间为1-5min。
[0074]
在本发明的一个优选例中,所述的步骤(1)中,将所述的裂解液以 50ml-400ml/min,较佳地50-300ml/min,更佳地50-200ml/min,更佳地150-200 ml/min的流速加入到摇动的菌体液中。
[0075]
在本发明所述的方法中,所述的第一摇床、第二摇床和第二摇床为同一摇床或不同摇床。
[0076]
代表性地,所述的第一摇床为3d或者2d摇床。
[0077]
代表性地,所述的第二摇床为3d或者2d摇床。
[0078]
代表性地,所述的第三摇床为3d或者2d摇床。
[0079]
典型地,所述的第一摇床为前后摇摆、左右摇摆和/或波浪式摇床。
[0080]
典型地,所述的第二摇床为前后摇摆、左右摇摆和/或波浪式摇床。
[0081]
典型地,所述的第三摇床为前后摇摆、左右摇摆和/或波浪式摇床。
[0082]
在本发明的一个优选例中,,所述的步骤(1)中,所述的裂解液包括naoh/sds 裂解液。
[0083]
在另一优选例中,所述的步骤(1)中,所述的裂解液包括naoh/sds组分。
[0084]
在本发明的一个优选例中,所述的第一摇床包括第一托盘。
[0085]
在本发明的一个优选例中,所述的第二摇床包括第二托盘。
[0086]
在本发明的一个优选例中,所述的第三摇床包括第三托盘。
[0087]
在另一优选例中,所述的步骤(1)中,所述的菌体液置于所述的第一托盘上进行摇动。
[0088]
在另一优选例中,所述的第一托盘与与水平面的角度为10-20
°
。
[0089]
在另一优选例中,所述的菌体液置于配液袋中。
[0090]
在另一优选例中,所述的步骤(2)中,所述的初菌体裂解液置于所述的第二托盘上进行摇动。
[0091]
在另一优选例中,所述的第二托盘与与水平面的角度为10-20
°
。
[0092]
在另一优选例中,所述的初菌体裂解液置于配液袋中。
[0093]
在另一优选例中,所述的步骤(2)中,所述的静置时间为1-60min。
[0094]
在另一优选例中,所述的步骤(2)中,所述的缓冲液包括醋酸盐(如醋酸钾)缓冲液。
[0095]
将缓冲液以50ml-400ml/min的流速加入到摇动的初菌体裂解液中
[0096]
在本发明的一个优选例中,,所述的步骤(2)中,将缓冲液以50ml-400ml/min,较佳地50ml-300ml/min,较佳地50-200ml/min,更佳地150-200ml/min的流速加入到摇动的初菌体裂解液中
[0097]
在本发明的一个优选例中,,所述的步骤(2)中,所述的第二摇床的转速为 30-55rpm,较佳地40-50rpm。
[0098]
在本发明的一个优选例中,,所述的步骤(2)中,所述的混匀时间为3-8min
[0099]
在本发明的一个优选例中,,所述的步骤(2)中,所述的静置时间为1-60min,较佳地3-8min。
[0100]
质粒的制备方法
[0101]
本发明还提供一种制备质粒的方法,所述的方法包括步骤:
[0102]
(a)用本发明所述的菌体裂解方法对经质粒改造的工程菌菌体进行裂解,得到菌体裂解液;
[0103]
(b)从所述菌体裂解液中分离得到质粒。
[0104]
本发明的主要优点主要包括:
[0105]
1.本发明所述的菌体裂解方法具有操作简单、节省时间与人力,方便和适合工业化生产。
[0106]
2.本发明所述的菌体裂解方法相对于传统的人力裂解方式或搅拌式裂解方式,能够显著提高菌体与裂解液充分混合,从而使质粒从菌体中释放出来,提高质粒的产量,且提高质粒浓度和超螺旋比例。
[0107]
3.本发明所述的菌体裂解方法克服人为因素影响,可稳定放大。
[0108]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0109]
实施例1
[0110]
1.质粒菌种的培养与扩增
[0111]
试剂及材料:lb培养基;top10大肠杆菌工程菌;2l三角烧瓶卡那霉素或氨苄青霉素浓缩液;移液管;500ml离心瓶。
[0112]
仪器:恒温摇床;高速离心机;akta flux 6;蠕动泵。
[0113]
1.1菌体培养和收集:
[0114]
接种培养:将top10大肠杆菌工程菌(含有p1质粒,分子量约为2000bp) 按照1:1000的比例加入lb培养基中,按照1:500的比例加入卡那霉素或氨苄青霉素浓缩液。将三角烧瓶放入摇床,37℃,260rpm培养10-30h,培养结束后使用离心机或者超滤系统收获菌体。
[0115]
2菌体裂解
[0116]
试剂及材料:tris缓冲液;naoh/sds裂解液;醋酸钾缓冲液;波浪式配液袋;移液管;离心管。
[0117]
仪器:3d摇床(scilogex),3d摇床摇动的方式为波浪式;蠕动泵。
[0118]
2.1加入tris缓冲液:将75ml的tris缓冲液分别加至含菌体的离心瓶中。充分重悬混匀后。随机选取其中一瓶,使用传统人力操作进行裂解。用蠕动泵将剩余菌液泵入5l配液袋中,将配液袋放在3d摇床的托盘上。开启摇床,设置转速为15rpm,混匀3min。
[0119]
2.2加入naoh/sds裂解液:
[0120]
人力操作:将75ml的naoh/sds裂解液加入选取进行人力操作的离心瓶中,轻柔翻转混匀3次,静置1min。
[0121]
摇床操作:将3d摇床设置转速为15rpm(3d摇床的托盘与水平面的角度为15
°
),开始转动后,将825ml的naoh/sds裂解液通过蠕动泵200ml/min 泵入5l配液袋中,混匀5min后暂停摇床,静置2min。
[0122]
2.3加入醋酸钾缓冲液:
[0123]
人力操作:将75ml的醋酸钾缓冲液加入选取进行人力操作的离心瓶中,轻柔翻转混匀6次。将裂解产物取样1ml于1.5ml离心管中用于后续试验检测。
[0124]
摇床操作:将3d摇床设置转速为45rpm,开始转动后,将825ml的醋酸钾缓冲液通过蠕动泵以200ml/min的速率泵入配液袋中,混匀5min后暂停摇床,静置5min。完成后将裂解产物取样1ml于1.5ml离心管。
[0125]
3实验结果
[0126]
1.质粒浓度测定
[0127]
仪器:超微量紫外分光光度计
[0128]
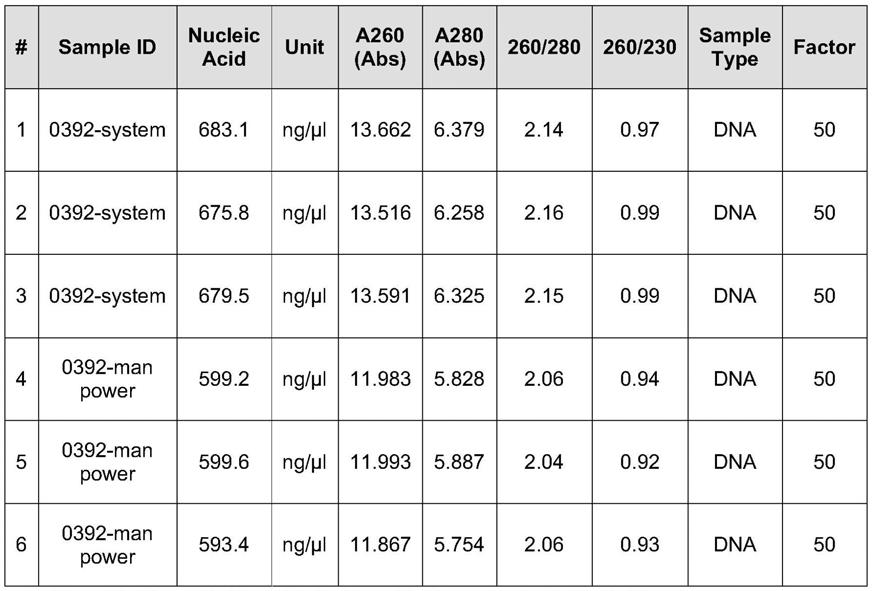
将取样后的两组裂解产物分别用超微量紫外分光光度计进行质粒浓度检测。每次取2μl进行检测,每组检测重复3次,质粒浓度结果见下表1:
[0129]
表1裂解产物质粒浓度检测结果
[0130][0131]
备注:编号1-3为摇床操作组,编号4-6为人力操作组。
[0132]
从表1可以看出,摇床操作组(system)所得的裂解产物其质粒浓度平均值为:679.5ng/μl;人力操作组(man power)所得的裂解产物其质粒浓度平均值为:597.4ng/μl。由以上结果可知,通过摇床操作进行裂解,相对于人力操作裂解的方式更能让菌体与裂解液充分混合,从而使质粒从菌体中释放出来,得到更高产量的质粒。
[0133]
2.dna凝胶电泳检测与质粒超螺旋比例分析
[0134]
仪器:数显式稳压稳流电泳仪、凝胶成像仪
[0135]
根据得到的质粒浓度结果,对两组裂解产物分别取1000ng-1100ng进行 dna凝胶电泳检测(120v 30min)。电泳结束后通过凝胶成像仪进行分析,dna 凝胶电泳结果如下图1所示:
[0136]
从图1的dna凝胶电泳检测的结果来看,摇床操作组(系统裂解)和人力操作组所得到的裂解产物其所含的质粒电泳条带位置一致。证明菌体中所含的质粒并不会因为机械的裂解操作而导致改变,能得到和人力操作相一致的、正确的裂解产物。
[0137]
图1中的dna凝胶电泳图中的泳道和条带2、3中蓝色方框中的裂解产物泳道和条带分析图分别如图2和图3所示:
[0138]
根据裂解产物的超螺旋比例分析结果我们可以发现,摇床操作组(泳道2) 的质粒超螺旋比例为78%,人力操作组(泳道3)的超螺旋比例为76.5%。由以上结果可知通过摇床操作进行裂解,相对于人力操作裂解的方式更能让菌体与裂解液充分混合,所得到的质粒,超螺旋比例更高
[0139]
总结
[0140]
在本实施例中可以看出,在相同的裂解体系下,波浪式配液袋和配液摇床相的裂解方式相对于传统的人力操作裂解方式,裂解操作既可控可定量化,节省时间与人力,且得到的质粒裂解产物,质粒浓度和超螺旋比例更高。
[0141]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。