1.本发明属于医药生物化工技术领域,具体地说,是关于一种用于制备光学纯的6-氟-色满-2-羧酸的连续双相分批拆分工艺。
背景技术:
2.6-氟-色满-2-羧酸是重要医药中间体。化学名称是6-氟-3,4-二氢-2h-1-苯并吡喃-2-甲酸,化学分子式是c
10
h9o3f分子量是196.18,结构式为:
[0003][0004]
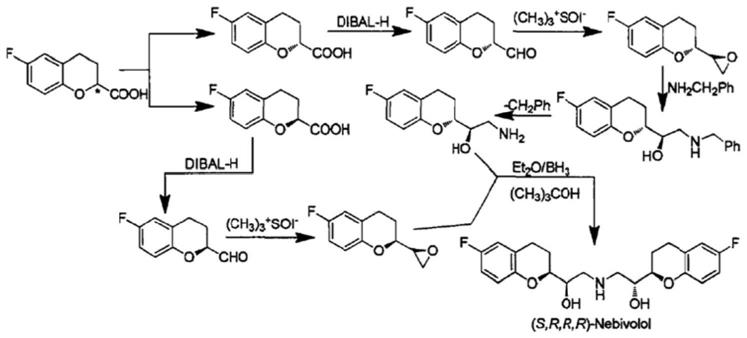
在许多具有生物活性的分子结构中,都能发现6-氟-色满的色满结构单元的存在。譬如,该结构广泛包含在维生素e及许多拮抗β受体的抗高血压药中。光学纯的6-氟-色满-2-羧酸用于新型降血压药物(s,r,r,r)-奈必洛尔的合成。(s,r,r,r)-奈必洛尔是第三代兼有血管扩张作用的心脏高度选择性β1受体阻滞剂,主要用于治疗原发性高血压,能有效地控制高血压和保持左心室功能,并且具有剂量低、副作用少,耐受性好等优点。
[0005]
杨森制药有限公司提供了一种以6-氟-色满-2-羧酸为起始原料来制备(s,r,r,r)-奈必洛尔的合成路线,合成路线如图1所示。
[0006]
从奈必洛尔的合成路线图中可知,6-氟-色满-2-羧酸的拆分是第一步也是关键的一步。6-氟-色满-2-羧酸的拆分效率是影响合成奈必洛尔的关键环节。因此提高其拆分效率也是值得研究的问题。
[0007]
6-氟-色满-2-羧酸是制备奈必洛尔的关键中间体,其拆分效率决定制备奈必洛尔合成方法的最终结果。但是关于6-氟-色满-2-羧酸(r)-,(s)-光学异构体拆分方法文献报道较少。迄今为止,化学方法、生物拆分法等是几种拆分有机酸常用的办法。化学拆分方法均以外消旋的6-氟色满-2-羧酸化合物为原料,通过与不同手性有机胺反应,形成非对映异构体的酰胺或铵盐,利用非对映异构体酰胺或铵盐在溶剂中的溶解度差异,经重结晶分离出r或s构型的6-氟色满-2-羧酸。但是此方法存在生产成本高,过程较冗长,拆分效率较低,环境污染严重等问题。
[0008]
为此,市面上有部分利用脂肪酶或酯酶选择性水解6-氟色满-2-羧酸甲酯或乙酯,得到光学纯的(r)-6-氟-色满-2-羧酸。此类方法具有操作简便,条件温和,立体选择性高等优点。ep2646426报道过利用来源于真菌ophiostoma novo-ulmi的酯酶拆分外消旋的6-氟-色满-2-羧酸乙酯,分离纯化得到(r)-6-氟-色满-2-羧酸,ee值是90.72%,转化率是50.28%,其中立体选择性不高。但是目前没有文献关于利用脂肪酶或酯酶拆分制备(s)-6-氟-色满-2-羧酸的报道;因此急需找到其他的高活性和高立体选择性的脂肪酶/酯酶。
技术实现要素:
[0009]
本发明以外消旋6-氟-色满-2-羧酸甲酯为底物,在两相反应中,利用高效表达酯酶ests的重组大肠杆菌的冻干菌体(lycests)作为催化剂,选择性催化(s)-6-氟-色满-2-羧酸甲酯的水解反应,反应结束后,将未反应完底物的有机相投入下一批次反应,投入高效表达酯酶estr的重组大肠杆菌的冻干菌体(lycestr),选择性催化(r)-6-氟-色满-2-羧酸甲酯的水解。由此制备获得(s)-6-氟-色满-2-羧酸,其转化率》46%,ee值99%;(r)-6-氟-色满-2-羧酸,其转化率》47%,ee值99%。并依此,本发明继续研究,通过分批投入底物以及交替投入固定化表达酯酶ests的重组大肠杆菌细胞(imcests)和固定化表达酯酶estr的重组大肠杆菌细胞(imcestr),实现底物最大的拆分效率,以及循环使用甲苯相。因此,本发明的目的是提供一种用于制备光学纯的6-氟-色满-2-羧酸的连续双相分批拆分工艺。
[0010]
为实现上述目的,本发明采用如下技术方案:
[0011]
一种用于制备光学纯的6-氟-色满-2-羧酸的连续双相分批拆分工艺,以外消旋6-氟-色满-2-羧酸甲酯为底物,进行两批次或多批次反应,相邻批次反应交替使用表达ests的重组大肠杆菌或表达estr的重组大肠杆菌作为催化剂,在有机相和水相的双相体系中反应;
[0012]
每批次反应完成后,分离有机相和水相,回收未反应完全底物的有机相用于下一批反应;纯化水相,去除溶剂,获得(s)-6-氟-色满-2-羧酸或(r)-6-氟-色满-2-羧酸;
[0013]
在每个批次后补充水相,用于下一批次反应;在每两个批次后补充底物6-氟-色满-2-羧酸甲酯,用于下一批次反应;如此循环,实现6-氟色满-2-羧酸甲酯的连续分批拆分。
[0014]
根据本发明,双水相体系的反应温度为30℃,反应时间为2~40小时。
[0015]
根据本发明,每批次反应完成后,采用过滤方法去除菌体或回收固定化细胞后,其中imcests或imcestr用生理盐水洗涤3遍作为下一批次的催化剂。
[0016]
根据本发明,每批次反应完成后,反应液中加入氢氧化钠溶液调节ph至11-12后,分离有机相和水相,然后在水相中加入盐酸溶液调节ph至1-2,用乙酸乙酯萃取3遍,旋蒸蒸发除去溶剂,得到(s)-6-氟-色满-2-羧酸白色固体或(r)-6-氟-色满-2-羧酸白色固体,未反应完全底物的有机相用于下一批次反应。
[0017]
根据本发明,所述的双相体系,有机相与水相的体积比为1:3,其中,有机相为甲苯,水相为磷酸缓冲液。
[0018]
根据本发明,表达estr的重组大肠杆菌的催化剂为表达estr的重组大肠杆菌的冻干菌体或固定化表达estr的重组大肠杆菌细胞;表达ests的重组大肠杆菌的催化剂为表达ests的重组大肠杆菌的冻干菌体或固定化表达ests的重组大肠杆菌细胞。
[0019]
根据本发明,当使用表达ests的重组大肠杆菌进行拆分时,反应体系的ph控制在7.0-7.1;当使用表达estr的重组大肠杆菌进行拆分时,反应体系的ph控制在7.4-7.5。
[0020]
优选的,当使用表达ests的重组大肠杆菌进行拆分时,双水相体系中流加0.5-1m的naoh,控制ph恒定为7.1;当使用表达estr的重组大肠杆菌进行拆分时,双水相体系中流加0.5-1m的naoh,控制ph恒定为7.4。
[0021]
根据本发明,所述有机相的含量的体积百分比为20%-30%。
[0022]
进一步的,所述有机相为甲苯。
[0023]
根据本发明,所述表达ests的重组大肠杆菌或表达estr的重组大肠杆菌的浓度为10g/l。
[0024]
优选的,外消旋6-氟-色满-2-羧酸甲酯的浓度是100-200mm。
[0025]
根据本发明,分批反应时,先投入表达ests的重组大肠杆菌进行拆分反应;下一批次反应,再投入表达estr的重组大肠杆菌进行拆分反应。
[0026]
根据本发明,表达ests的重组大肠杆菌是将具有序列如seq id no.3所示的ests基因序列的目的片段克隆到表达载体中,获得重组质粒,然后将重组质粒转化到大肠杆菌bl21(de3)感受态细胞中制备获得。
[0027]
进一步的,所述表达载体为pet-28a( )表达载体。
[0028]
根据本发明,表达estr的重组大肠杆菌将具有序列如seq id no.7所示的ests基因序列的目的片段克隆到表达载体中,获得重组质粒,然后将重组质粒转化到大肠杆菌bl21(de3)感受态细胞中制备获得。
[0029]
进一步的,所述表达载体为pet-28a( )表达载体。
[0030]
本发明的连续双相分批拆分工艺,其有益效果是:具有总拆分效率高、立体选择性强、工艺相对简单等特点,具体如下:
[0031]
1、通过交替投入表达酯酶ests的重组大肠杆菌和表达酯酶estr的重组大肠杆菌,实现底物最大的拆分效率。
[0032]
2、有机相可以循环使用,同时可以回收各批次的表达酯酶ests的重组大肠杆菌和表达酯酶estr的重组大肠杆菌,催化剂利用率高。
[0033]
3、底物转化率高,当交替投入催化剂(即交替投入表达酯酶ests的重组大肠杆菌和表达酯酶estr的重组大肠杆菌)的次数为6次时,底物转化率高达99.1%。
附图说明
[0034]
图1为奈必洛尔的合成路线图。
[0035]
图2为实施例3的有机溶剂比例对反应的影响。
[0036]
图3为实施例3的温度对反应的影响。
[0037]
图4为实施例3的ph对反应的影响。
[0038]
图5为实施例4的(s)-6-氟-色满-2-羧酸的液相图。
[0039]
图6为实施例7的有机溶剂比例对反应的影响。
[0040]
图7为实施例7的温度对反应的影响。
[0041]
图8为实施例7的ph对反应的影响。
[0042]
图9为实施例8的(s)-6-氟-色满-2-羧酸的液相图。
[0043]
图10为实施例9的6-氟色满-2-羧酸甲酯的两步拆分结果图。
[0044]
图11为实施例10的6-氟色满-2-羧酸甲酯的连续分批拆分结果图。
具体实施方式
[0045]
以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或厂商提供的条件进行。
[0046]
实施例1表达酯酶ests的大肠杆菌基因工程菌的构建及酯酶ests的高效表达
[0047]
1.将热链状地芽孢杆菌geobacillus thermocatenulatus strain bgsc 93a1使用培养基(peptone 5g,meat extract 3g,蒸馏水1l)复苏,在60℃恒温摇床中需氧培养12小时,使用紫外分光光度计测量细菌浓度。
[0048]
2.细菌dna提取,使用细菌基因组dna快速提取试剂盒(generay biotech,shanghai,china)进行提取,获得geobacillus thermocatenulatus基因组dna。
[0049]
3.根据geobacillus thermocatenulatus菌株的酯酶ests基因序列设计引物,所设计上游引物和下游引物如下:
[0050]
上游引物:5’cgcggatccatggtcattgttgaaacaga 3’,seq id no.1,其中,下划线部分为bamh i识别位点;
[0051]
下游引物:5’cgcaagcttttacacatgctcgcgaaacc 3’,seq id no.2,其中,下划线部分为hind iii识别位点;
[0052]
4.然后以热链状地芽孢杆菌geobacillus thermocatenulatus的基因组dna为模板,利用聚合酶链式反应(pcr)进行基因扩增,获得包含酯酶ests全长基因的pcr产物,核苷酸序列如seq id no.3所示,氨基酸序列如seq id no.4所示。其中,pcr扩增体系为primer star max 25μl;正向引物和反向引物各1.5μl;水22μl;模板0.5μl。
[0053]
核苷酸序列:
[0054]
atggtcattgttgaaacagaacggctggctgatgtgccggtgcttcatgttgtcaagccggaaaagcgggacgcacggctgccgctcattttctttattcacggctttacaagcgcgaaagagcataatttgcatttcggctacttgcttgccgaggcaggctatcgcgttgtgcttcccgacgcgctgtttcacggcgagcgggacgaaggtttgagcgagcggaaattgcagctgtcgttttgggacattgtcgtgcgcacgatcaccgaaatcgaggagatgaaaaacgaccttgtcagccgcgggctggctgaccaagaacggattgggctcgctgggacatcgatgggcggcatcgtcacattcggcgcgctcgccgtctatccgtgggtgaaggcggcggtggcgcttatgggctgcccgaactacagcgccttttttgacgcgatgatggaagaagcgaagcggcgtcagatcgacatcccgatgccgccgacgctgttggcgcttgaaagagaaaagctcgctcgctacgatttatccaagcagccggaaacactcgccgggcggccgttgttcatctggcacgggaaagccgaccaagtcgtcccgtatagttatacatatgaattttaccagcaaattaagccgctttatgaaggaaacgaagaccggctgcaattcatcgccgacccgcacgccggccataaagtgacgcgcgaggcgtttttggaaacggtgcgctggtttcgcgagcatgtgtaa,seq id no.3。
[0055]
氨基酸序列:
[0056]
mviveterladvpvlhvvkpekrdarlpliffihgftsakehnlhfgyllaeagyrvvlpdalfhgerdeglserklqlsfwdivvrtiteieemkndlvsrgladqeriglagtsmggivtfgalavypwvkaavalmgcpnysaffdammeeakrrqidipmpptllalereklarydlskqpetlagrplfiwhgkadqvvpysytyefyqqikplyegnedrlqfiadphaghkvtreafletvrwfrehv,seq id no.4。
[0057]
5.将pet-28a( )空载质粒,以及步骤4得到的带有bamh i和hind iii酶切位点的基因(序列如seq id no.3所示),分别用bamh i和hind iii进行双酶切。回收大片段,用t4dna连接酶连接,热激法转化大肠杆菌bl21,用含50μg/ml卡那霉素的lb固体培养基进行筛选,pcr法挑取阳性克隆,试剂盒提取阳性克隆质粒,经基因测序鉴定,获得正确的克隆质粒,从而构建得到酯酶ests基因工程菌株lycests。
[0058]
6.将阳性重组菌株(步骤5的酯酶ests基因工程菌株lycests)接种于含有50μg/ml
卡那霉素的5ml lb培养基中37℃过夜培养,随后以1%转接量接入50ml含有50μg/ml卡那霉素的新鲜lb培养基中继续繁殖,当od600达到0.6~0.8时,加入iptg至终浓度0.1mm。在20℃下诱导16~18小时后,离心收集菌体,然后放在冷冻干燥机冷冻12小时,制备冻干菌粉储存冰箱,备用。
[0059]
实施例2(s)-6-氟-色满-2-羧酸的分离纯化以及液相检测方法
[0060]
在0.1m磷酸盐缓冲液中,用实施例1制备的冻干菌粉(lycests)进行(
±
)-6-氟-色满-2-羧酸甲酯的水解动力学拆分,但是没有观察到良好的活性和选择性。因此,反应在包含不同有机溶剂的双相体系(有机溶剂与磷酸盐缓冲液)中进行。
[0061]
反应完成后,采用过滤方法去除菌体后,加入5m氢氧化钠溶液调节ph至11-12后,分离有机相和水相,然后在水相中加入盐酸溶液调节ph至1-2,用乙酸乙酯萃取3遍,旋蒸蒸发除去溶剂即可得到(s)-6-氟-色满-2-羧酸白色固体。高效液相色谱(手性柱chirasil-ad-h)分析,测定底物转化率和产物的ee值。具体分析条件为:柱温度25℃,流动相为正己烷:异丙醇(90:10),流速1.0ml/ml,检测波长254nm。
[0062]
实施例3以冻干大肠杆菌菌体(lycests)为催化剂,考察(s)-6-氟-色满-2-羧酸制备的条件
[0063]
反应体系包括:菌体,(
±
)-6-氟-色满-2-羧酸甲酯,有机溶剂,反应温度,反应时间,反应ph,底物浓度,buffer,(
±
)-6-氟-色满-2-羧酸甲酯即底物。
[0064]
以上述实例1中的重组大肠杆菌菌体(步骤5的酯酶ests基因工程菌株)为酶源,考察有机溶剂的选择、有机溶剂添加的比例、反应温度、反应ph、底物浓度等因素,以提高目标产物(s)-6-氟-色满-2-羧酸的时空产率。
[0065]
1、考察所选有机溶剂对反应的影响
[0066]
在10ml的反应体系中,菌体浓度10g/l;(
±
)-6-氟-色满-2-羧酸甲酯用量为100mm;有机溶剂与pb buffer(ph7.4)的比例是1:4;反应温度为30℃;反应时间为6h。所选的有机溶剂包括异丙醇、丁醇、甲苯、正己烷、正庚烷、异辛烷。结果见表1。
[0067]
表1有机溶剂对反应的影响
[0068]
有机溶剂log p转化率(%)ee(%)异丙醇0.3865.321.3丁醇0.8810.22.7甲苯2.546.699.0正己烷3.538.481.4正庚烷4.071.727.5异辛烷4.587.824.6
[0069]
结果显示:所选的有机溶剂中,甲苯的转化率和ee值均良好。
[0070]
2、考察甲苯与pb buffer(ph7.4)对反应的影响。
[0071]
在10ml的反应体系中,菌体浓度10g/l;(
±
)-6-氟-色满-2-羧酸甲酯用量为100mm;反应温度为30℃;反应ph是7.4;反应时间为6h。所选甲苯占总体积的比例是10%、20%、30%、40%,50%(v/v)。结果如图2所示。
[0072]
图2结果显示,甲苯占总体积的比例为20%和30%时的ee值良好。
[0073]
3、考察温度对反应的影响。
[0074]
在10ml的反应体系中,菌体浓度10g/l;(
±
)-6-氟-色满-2-羧酸甲酯用量为100mm;甲苯与pb buffer(ph7.4)的比例是1:3;反应时间为6h。所选反应温度是20~60℃。结果如图3所示。
[0075]
图3结果显示,当反应温度为30℃和40℃时,ee值和转化率均良好。
[0076]
4、考察ph对反应的影响。
[0077]
在10ml的反应体系中,菌体浓度10g/l;(
±
)-6-氟-色满-2-羧酸甲酯用量为100mm;甲苯与buffer的比例是1:3;反应时间为6h。所选反应ph是6、6.5、7、7.5、8、8.5。结果如图4所示。
[0078]
图4结果显示,当反应ph是7.0时,ee值和转化率均良好。
[0079]
5、考察底物浓度对反应的影响。在10ml的反应体系中,甲苯与buffer的比例是1:3;反应温度为30℃;反应ph是7.0。所选底物浓度是100、200、300、400mm。结果见表2。
[0080]
表2底物浓度对反应的影响
[0081]
底物浓度反应时间转化率(%)ee(%)100mm1.5h48.999.2200mm4h49.199.1300mm6h45.798.8400mm8h38.098.5
[0082]
表2结果显示,当底物浓度为100mm、200mm和300mm时,转化率和ee值均良好。
[0083]
实施例4
[0084]
以大肠杆菌菌体(步骤5的酯酶ests基因工程菌株)为酶源,酶法拆分(
±
)-6-氟-色满-2-羧酸甲酯生产(s)-6-氟-色满-2-羧酸
[0085]
根据实施例3确定的最佳拆分条件,以上述实例1中冻干大肠杆菌菌体为催化剂,在0.2升反应液中加入菌体2g,(
±
)-6-氟-色满-2-羧酸甲酯200mm,甲苯与pb buffer(ph7.0)的比例是1:3;反应温度30℃,转化时间6h,进行(
±
)-6-氟-色满-2-羧酸甲酯的水解拆分。采用实施例2的(s)-6-氟-色满-2-羧酸的分离纯化以及液相检测方法,(s)-6-氟-色满-2-羧酸的液相图如图5所示。
[0086]
结果,测定(s)-6-氟-色满-2-羧酸含量为89.3mm;转化率为46.9%;ee值是99.07%。
[0087]
实施例5表达酯酶estr的大肠杆菌基因工程菌的构建及酯酶estr的高效表达
[0088]
1.将热链状地芽孢杆菌geobacillus thermocatenulatus strain bgsc 93a1使用培养基(peptone 5g,meat extract 3g,蒸馏水1l)复苏,在60℃恒温摇床中需氧培养12小时,使用紫外分光光度计测量细菌浓度。
[0089]
2.细菌dna提取,使用细菌基因组dna快速提取试剂盒(generay biotech,shanghai,china)进行提取,获得geobacillus thermocatenulatus基因组dna。
[0090]
3.根据geobacillus thermocatenulatus菌株的酯酶estr基因序列设计引物,所设计上游引物和下游引物如下:
[0091]
上游引物:5’cgcggatccgtgcaagaccagtttttttc 3’,seq id no.5,其中,下划线部分为bamh i识别位点;
[0092]
下游引物:5’cgcaagctttcattgttcaccctcctccg 3’,seq id no.6,其中,下划线部
分为hind iii识别位点;
[0093]
4.然后以热链状地芽孢杆菌geobacillus thermocatenulatus的基因组dna为模板,利用聚合酶链式反应(pcr)进行基因扩增,获得包含酯酶estr全长基因的pcr产物,核苷酸序列如seq id no.3所示,氨基酸序列如seq id no.4所示。其中,其中,pcr扩增体系为primer star max 25μl;正向引物和反向引物各1.5μl;水22μl;模板0.5μl。
[0094]
核苷酸序列:
[0095]
gtgcaagaccagtttttttcggtcgccaagccgccgacaaaagaacaacggccgccgacggctgaaacaaggcaacatgacgagaaaatggatattgttgctcttggcgattcgttgacgagaggaacgggcgatgaaagcggcaaagggtatgttggctatatggtcgatgcgcttcgccggcaaacggatcggccgatccgtgtgacgaatttggccatccgcggccttcgctccgacgggctgcttcgccagcttggccagcctgagattcaacggcaagtcgccatggcggatttgatcgtgatgacgatcggcggcaacgacttgtttcaagggggggaagcgcttcggttgaacgccaagcagctggatgaagcgaagcgccggtatgcagccaacctagaccacattttcgccgcgctgcgccgcttcaacagcgaagcggtcatttttgcaatcggtttgtacaacccgtttggcgatttaaacgatgccaaacggacgtcggccgttgtgcgcgattggaattttgcatcagcggaagtggcggcccgctatccgaacatcgtcgcggtgccgacgtttgatttgtttgccctccatgtcaatgactatttgtacagcgaccattttcatccaaacgcggcaggctacaagcggattggagagcgcgtcgcctcgctcatcacgttgacggaggagggtgaacaatga,seq id no.7。
[0096]
氨基酸序列:
[0097]
vqdqffsvakpptkeqrpptaetrqhdekmdivalgdsltrgtgdesgkgyvgymvdalrrqtdrpirvtnlairglrsdgllrqlgqpeiqrqvamadlivmtiggndlfqggealrlnakqldeakrryaanldhifaalrrfnseavifaiglynpfgdlndakrtsavvrdwnfasaevaarypnivavptfdlfalhvndylysdhfhpnaagykrigervaslitlteegeq,seq id no.8。
[0098]
5.将pet-28a( )空载质粒,以及步骤4得到的带有bamh i和hind iii酶切位点的基因(序列如seq id no.3所示),分别用bamh i和hind iii进行双酶切。回收大片段,用t4dna连接酶连接,热激法转化大肠杆菌bl21,用含50μg/ml卡那霉素的lb固体培养基进行筛选,pcr法挑取阳性克隆,试剂盒提取阳性克隆质粒,经基因测序鉴定,获得正确的克隆质粒,从而构建得到酯酶estr基因工程菌株lycestr。
[0099]
6.将阳性重组菌株(步骤5的酯酶estr基因工程菌株lycestr)接种于含有50μg/ml卡那霉素的5ml lb培养基中37℃过夜培养,随后以1%转接量接入50ml含有50μg/ml卡那霉素的新鲜lb培养基中继续繁殖,当od600达到0.6~0.8时,加入iptg至终浓度0.1mm。在20℃下诱导16~18小时后,离心收集菌体,然后放在冷冻干燥机冷冻12小时,制备冻干菌粉储存冰箱,备用。
[0100]
实施例6(r)-6-氟-色满-2-羧酸的分离纯化以及液相检测方法
[0101]
在0.1m磷酸盐缓冲液中,用实施例1制备的冻干菌粉(lycestr)进行(
±
)-6-氟-色满-2-羧酸甲酯的水解动力学拆分,但是没有观察到良好的活性和选择性。因此,反应在包含不同有机溶剂的双相体系(有机溶剂与磷酸盐缓冲液)中进行。
[0102]
反应完成后,采用过滤方法去除菌体后,加入5m氢氧化钠溶液调节ph11-12后,分离有机相和水相,然后在水相中加入盐酸溶液调节ph1-2,用乙酸乙酯萃取3遍,旋蒸蒸发除去溶剂即可得到(r)-6-氟-色满-2-羧酸白色固体。高效液相色谱(手性柱chirasil-ad-h)分析,测定底物转化率和产物的ee值。具体分析条件为:柱温度25℃,流动相为正己烷:异丙
醇(90:10),流速1.0ml/ml,检测波长254nm。
[0103]
实施例7以冻干大肠杆菌菌体(lycestr)为催化剂,考察(r)-6-氟-色满-2-羧酸制备的条件
[0104]
反应体系包括:菌体,(
±
)-6-氟-色满-2-羧酸甲酯,有机溶剂,反应温度,反应时间,反应ph,底物浓度,buffer,(
±
)-6-氟-色满-2-羧酸甲酯即底物。
[0105]
以上述实施例5中的重组大肠杆菌菌体(步骤5的酯酶estr基因工程菌株)为酶源,考察有机溶剂的选择、有机溶剂添加的比例、反应温度、反应ph、底物浓度等因素,以提高目标产物(r)-6-氟-色满-2-羧酸的时空产率。
[0106]
1、考察所选有机溶剂对反应的影响
[0107]
在10ml的反应体系中,菌体浓度10g/l;(
±
)-6-氟-色满-2-羧酸甲酯用量为100mm;有机溶剂与pb buffer(ph7.4)的比例是1:4;反应温度为30℃;反应时间为12h。所选的有机溶剂包括异丙醇、丁醇、甲苯、正己烷、正庚烷、异辛烷。结果见表3。
[0108]
表3有机溶剂对反应的影响
[0109]
有机溶剂log p转化率(%)ee(%)异丙醇0.3852.345.3丁醇0.887.81.6甲苯2.548.695.6正己烷3.542.589.7正庚烷4.026.611.6异辛烷4.55.42.1
[0110]
结果显示:所选的有机溶剂中,甲苯的转化率和ee值均良好。
[0111]
2、考察甲苯与pb buffer(ph7.4)对反应的影响。
[0112]
在10ml的反应体系中,菌体浓度10g/l;(
±
)-6-氟-色满-2-羧酸甲酯用量为100mm;反应温度为30℃;反应ph是7.4;反应时间为12h。所选甲苯占总体积的比例是10%、20%、30%、40%,50%(v/v)。结果如图6所示。
[0113]
图6结果显示,甲苯占总体积为20-30%时,转化率和ee值均良好。
[0114]
3、考察温度对反应的影响。
[0115]
在10ml的反应体系中,菌体浓度10g/l;(
±
)-6-氟-色满-2-羧酸甲酯用量为100mm;甲苯与pb buffer(ph7.4)的比例是1:3;反应时间为6h。所选反应温度是10~50℃。结果如图7所示。
[0116]
图7结果显示,反应温度为30℃时,转化率和ee值均良好。
[0117]
4、考察ph对反应的影响。
[0118]
在10ml的反应体系中,菌体浓度10g/l;(
±
)-6-氟-色满-2-羧酸甲酯用量为100mm;甲苯与buffer的比例是1:3;反应时间为6h。结果如图8所示。
[0119]
图8结果显示,所选反应ph是6、6.5、7、7.5、8、8.5,优选为7.5。
[0120]
5、考察底物浓度对反应的影响。在10ml的反应体系中,甲苯与buffer的比例是1:3;反应温度为30℃;反应ph是7.5。所选底物浓度是100、200、300、400mm,结果见表4。
[0121]
表4底物浓度对反应的影响
[0122]
底物浓度反应时间转化率(%)ee(%)
100mm2.5h50.295.6200mm4h50.995.4300mm7h49.294.7400mm12h36.693.5
[0123]
表4结果显示,所选底物浓度为100mm、200mm和300mm时,转化率和ee值均良好。
[0124]
实施例8
[0125]
以大肠杆菌菌体(步骤5的酯酶estr基因工程菌株)为酶源,酶法拆分(
±
)-6-氟-色满-2-羧酸甲酯生产(r)-6-氟-色满-2-羧酸
[0126]
根据实施例6确定的最佳拆分条件,以上述实施例5中冻干大肠杆菌菌体为催化剂,在0.2升反应液中加入菌体2g,(
±
)-6-氟-色满-2-羧酸甲酯300mm,甲苯与pb buffer(ph7.5)的比例是1:3;反应温度30℃,转化时间12h,进行(
±
)-6-氟-色满-2-羧酸甲酯的水解拆分。采用与实施例2的(r)-6-氟-色满-2-羧酸的分离纯化以及液相检测方法,(r)-6-氟-色满-2-羧酸的液相图如图9所示。
[0127]
结果,测定(r)-6-氟-色满-2-羧酸含量为138.8mm;转化率为48.7%;ee值是95.47%。
[0128]
实施例9 6-氟色满-2-羧酸甲酯的两步拆分
[0129]
在200ml的反应体系中,称取实施例1制备的冻干菌粉lycests 2g,投入底物6-氟色满-2-羧酸甲酯0.04mol(相当于200mm),甲苯与pb buffer(磷酸盐缓冲液,0.2m,ph7.1)的比例是1:3,反应温度30℃,并且控制ph7.1恒定,磁力搅拌反应3h,进行(
±
)-6-氟-色满-2-羧酸甲酯的选择性水解拆分。反应完成后,采用过滤方法去除菌体后,加入5m氢氧化钠溶液调节ph至11-12后,分离有机相和水相,然后在水相中加入盐酸溶液调节ph至1-2,用乙酸乙酯萃取3遍,旋蒸蒸发除去溶剂即可得到(s)-6-氟-色满-2-羧酸白色固体。高效液相色谱(手性柱chirasil-ad-h)分析,测定底物转化率和产物的ee值。具体分析条件为:柱温度25℃,流动相为正己烷:异丙醇(90:10),流速1.0ml/ml,检测波长254nm。测定(s)-6-氟-色满-2-羧酸含量为0.01786mol;转化率为46.9%;ee值是97.47%(见图10)。
[0130]
2.将未反应完全底物的甲苯相转移到下一次反应体系,投入实施例5制备的冻干菌粉lycestr 2g,加入pb buffer(0.2m ph7.5)150ml,反应温度30℃,并且控制ph7.5恒定,磁力搅拌反应5h。反应完成后,采用上述的分离纯化以及液相检测方法,测定(r)-6-氟-色满-2-羧酸含量为0.01872mol;转化率为49.3%;ee值是99.07%(见图10)。
[0131]
实施例10 6-氟色满-2-羧酸甲酯的连续分批拆分
[0132]
本实施例采用固定化细胞进行试验。固定化细胞流程如下:
[0133]
在实施例1的步骤6获得表达酯酶ests的基因工程菌和实施例5的步骤6获得表达酯酶ests的基因工程菌后,即分别离心收菌,将4g聚乙烯醇和1g海藻酸钠添加到50ml盐溶液中,在80℃恒温水浴中搅拌溶解。待溶液完全溶解并冷却至20℃后,将溶液与质量浓度为20%的相同体积的细菌液体均匀混合,获得混合物。然后通过注射器将混合物滴入含质量浓度为2%氯化钙的饱和硼酸溶液中,并储存4h以形成凝胶微球。形成的凝胶微球用生理盐水冲洗三次,分别获得表达酯酶ests的基因工程菌细胞imcests和表达酯酶estr的基因工程菌细胞imcestr,然后在4℃的磷酸盐缓冲液中储存,备用。
[0134]
第一批次反应:在100ml的反应体系中,包含75ml磷酸盐缓冲液(0.2m,ph7.0),
25ml甲苯,100mm底物6-氟色满-2-羧酸甲酯,表达酯酶ests的基因工程菌细胞imcests 10g,反应温度30℃,并且控制ph7.1恒定,磁力搅拌反应3h,在反应结束后,imcests通过过滤收集并用生理盐水洗涤3遍作为第三批次的催化剂。反应液是加氢氧化钠溶液调节ph至10-11,分离水相和有机相,水相是通过加盐酸调节ph至1-2,用乙酸乙酯萃取3遍获得(s)-6-氟-色满-2-羧酸,未反应完全底物的甲苯相用于下一批次反应。
[0135]
第二批次反应:包含上批次未反应完全底物的甲苯相,75ml磷酸盐缓冲液(0.2mph7.4),表达酯酶estr的基因工程菌细胞imcestr 10g,反应温度30℃,并且控制ph7.5恒定,磁力搅拌反应5h。反应完成后,imcestr通过过滤收集并用生理盐水洗涤3遍作为第四批次的催化剂。采用实施例9中的分离纯化方法从水相中得到(r)-6-氟-色满-2-羧酸。包含少量底物的有机相重新加入100mm底物(6-氟色满-2-羧酸甲酯)用于下批次反应,第三和第四批次反应分别是通过imcests(第一批次回收)和imcestr(第二批次回收)催化的。反应过程和产物分离过程与前面反应一致。如此循环,实现6-氟色满-2-羧酸甲酯的连续分批拆分。
[0136]
如图11所示,重复利用5批次后,imcests剩余最初活力的65%,imcestr由于在双相反应中细胞裂解而显著失去活性。在经过总的10批次反应,获得了229.3mm(s)-6-氟-色满-2-羧酸(96.9%ee)和224.1mm(r)-6-氟-色满-2-羧酸(99.1%ee),总的转化率达到93.5%。其中,在前6批次反应,转化率高达99.1%。
[0137]
综上所述,本发明提供了一种用于制备光学纯的6-氟-色满-2-羧酸的连续双相分批拆分工艺,其通过交替投入表达酯酶ests的重组大肠杆菌和表达酯酶estr的重组大肠杆菌,实现了底物最大的拆分效率。且其有机相可以循环使用,同时可以回收各批次的表达酯酶ests的重组大肠杆菌和表达酯酶estr的重组大肠杆菌,催化剂利用率高。
[0138]
以上所述仅是本发明的实施方式的举例,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。