1.本发明涉及一种司美格鲁肽制剂的制备方法,属于药物制剂技术领域。
背景技术:
2.司美格鲁肽是一种glp-1类似物,与人类glp-1序列同源性为94%。司美格鲁肽作为一种glp-1受体激动剂,能够选择性地结合并激活glp-1的靶点受体,通过特异性介导胰腺和大脑中的glp-1受体,影响人体的血糖和食欲。当血糖升高时,司美格鲁肽通过刺激胰岛素分泌和降低胰高血糖素的分泌,以葡萄糖依赖的方式降低血糖。低血糖时,司美格鲁肽只减少胰岛素分泌,却不影响胰高血糖素的分泌。司美格鲁肽能使人的食欲下降,减少了机体对高脂肪食物的偏好,通过降低能量摄入来降低体重和体脂量。
3.glp-1受体也存在于心脏、血管系统、免疫系统和肾脏中,故而,在临床研究中发现,司美格鲁肽还具有降血脂、降低收缩压和减少炎症的作用。在动物实验中,司美格鲁肽通过阻止主动脉斑块化的进程和减轻斑块中的炎症来减缓动脉粥样硬化的发展。
4.现有的合成纯化方法已经能够得到较高纯度的司美格鲁肽,但是在制备司美格鲁肽制剂,以及后期的存储和运输过程中,由于司美格鲁肽原料药在水溶液条件下对光照以及热敏感,现有工业化技术中的司美格鲁肽制剂虽然改善了其对光照以及热的敏感程度,但光照和热对制剂的影响仍然较大,杂质含量仍然较多。
技术实现要素:
5.为解决上述技术问题,本发明提供一种司美格鲁肽制剂的制备方法。制备的司美格鲁肽制剂即使是经过光照和高温等不利影响条件,杂质含量依然较少,提升了制剂在运输、储存和使用过程中的稳定性,极大提高了制剂临床给药时的安全性。
6.本发明的第一个目的是提供一种司美格鲁肽制剂的制备方法,包括如下步骤:将司美格鲁肽活性物质溶解在含有辅料的溶液中,并调节ph、过滤除菌,得到所述的司美格鲁肽制剂;其中,在司美格鲁肽制剂制备过程中,控制配液温度以及通入保护气体。
7.进一步地,所述的配液温度控制在20~30℃。
8.进一步地,所述的保护气体为氮气和/或二氧化碳。
9.进一步地,所述的通入保护气体以控制药液溶氧水平在0.1-2.0mg/l。
10.进一步地,所述的保护气体通入总时长为30-360min。
11.进一步地,所述的司美格鲁肽制剂中,司美格鲁肽的浓度为1.0-10.0mg/ml。
12.进一步地,所述的辅料包括抑菌剂、等渗剂、缓冲剂中的一种或多种。
13.进一步地,所述的抑菌剂为苯酚、邻苯基苯酚、苯甲酸中的一种或多种。
14.进一步地,所述的苯酚的浓度为2-12mg/ml。
15.进一步地,所述的邻苯基苯酚的浓度为0.1-4.8mg/ml。
16.进一步地,所述的苯甲酸的浓度为1-6mg/ml。
17.进一步地,所述的等渗剂为丙二醇、甘露醇、乳糖中的一种或多种。
18.进一步地,所述的丙二醇的浓度为5-25mg/ml。
19.进一步地,所述的甘露醇的浓度为15-55mg/ml。
20.进一步地,所述的乳糖的浓度为30-100mg/ml。
21.进一步地,所述的缓冲剂为磷酸氢二钠或碳酸氢钠。
22.进一步地,所述的磷酸氢二钠浓度为0.5-2.5mg/ml。
23.进一步地,所述的碳酸氢钠浓度为0.1-1.5mg/ml。
24.本发明的有益效果是:
25.本发明通过控制配液温度在20-30℃,以及通入保护气体控制药液中的溶氧水平在0.1-2.0mg/l范围,能够显著提高司美格鲁肽制剂的质量,其杂质含量较少,且能够改善高温和光照对制剂的不良影响,极大提高了制剂在运输、储存和使用过程中的稳定性,提升司美格鲁肽制剂的安全性,具有明显的临床优势。
附图说明:
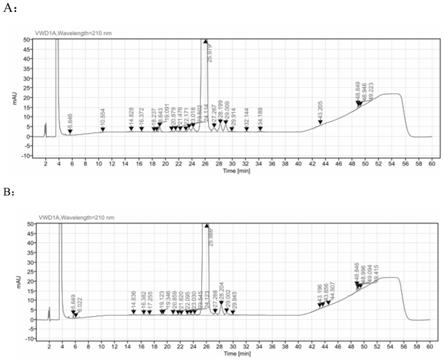
26.图1为实施例1影响因素条件hplc图谱;其中,a为实施例1样品经40℃10天处理后的hplc图谱,b为实施例1样品经光照10天处理后的hplc图谱;
27.图2为对比例1影响因素条件hplc图谱;其中,a为对比例1样品经40℃10天处理后的hplc图谱,b为对比例1样品经光照10天处理后的hplc图谱;
28.图3为对比例2影响因素条件hplc图谱;其中,a为对比例2样品经40℃10天处理后的hplc图谱,b为对比例2样品经光照10天处理后的hplc图谱。
具体实施方式
29.下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
30.本发明一方面提供了一种司美格鲁肽制剂的制备方法,包括以下步骤:
31.(1)将司美格鲁肽溶解在包含所有辅料的溶液中,通过添加稀氢氧化钠或稀盐酸来调节ph,并用注射用水稀释以获得所需的重量,配制过程中需控制配料温度在25℃
±
5℃,并且通入保护气体控制溶氧为0.1-2.0mg/l;
32.(2)将最终溶液除菌过滤;
33.(3)将除菌后溶液灌装到经过灭菌和去热原的笔式注射器用硼硅玻璃套筒中;
34.(4)将检查过的已灌装药液的笔式注射器用硼硅玻璃套组装在特定的笔式注射器中,即得到司美格鲁肽制剂。
35.在一些实施方式中,所述在配制过程中通入保护气体的工艺为在配制药液过程中选择通入保护氮气和/或二氧化碳。所述通入保护气体工艺如以下4种:
36.1)往所需注射用水中通入保护气体10-120min后开始配液。
37.2)投入辅料前,先行往注射用水中通入保护气体10-120min;再于投入司美格鲁肽前,往辅料的溶液中通入保护气体10-120min;投入api后,通入保护气体10-120min;调节ph并定容,持续往药液液中通入保护气体,定容后,继续通入保护气体10-120min。
38.3)往所需注射用水中通入保护气体10-120min后配液,待定容后,往药液中通入保护气体10-120min。
39.4)配液完成,定容后,往药液中通入保护气体10-120min。
40.在一些实施方式中,所述除菌方式为采用滤膜孔径为0.22μm的过滤器过滤,所用过滤器的滤膜材质可选择聚丙烯腈、聚苯乙烯塑料、聚偏氟乙烯、聚氯乙烯或聚丙烯中的至少一种。
41.在一种优选的实施方式中,所述司美格鲁肽制剂的制备方法,具体包括以下步骤:
42.(1)配液:
43.1)配制稀盐酸溶液和稀氢氧化钠溶液;
44.2)量取注射用水(需控制温度在25℃
±
5℃)于配液罐中,通入保护气体10-120min;称取苯酚、磷酸氢二钠和丙二醇加入注射用水中,搅拌使其完全溶解,并通入保护气体10-120min;称取司美格鲁肽原料药加至辅料溶液中,搅拌使其溶解,并通入保护气体10-120min;
45.3)若需要,以稀盐酸溶液和稀氢氧化钠溶液调节ph;并用注射用水稀释以获得所需的重量,过程中通入保护气体。
46.(2)中间体检测:取适量中间体药液,测定中间体含量等指标;
47.(3)过滤:使用滤膜孔径为0.22μm的过滤器进行过滤除菌;
48.(4)灌装、轧盖:先将笔式注射器用溴化丁基橡胶活塞加塞至笔式注射器用硼硅玻璃套筒中,再将药液灌装,然后以笔式注射器用复合铝盖进行轧盖,所述司美格鲁肽的浓度为1.21-1.34mg/ml;
49.(5)目检:剔除无盖或轧盖不良、装量不符合要求、瓶内有玻璃屑、纤维、色点等异物、瓶身有划痕、污瓶破瓶等不合格品;
50.(6)组装入注射笔内,贴标签,装盒,装箱,成品检验。
51.本发明另一个方面还涉及一种如上所述的司美格鲁肽制剂的制备方法制备得到的司美格鲁肽制剂。
52.本发明的司美格鲁肽制剂中,司美格鲁肽的浓度可以在1.0-10.0mg/ml;此外,选用苯酚、邻苯基苯酚、苯甲酸中的一种或多种作为抑菌剂,苯酚浓度可以在2-12mg/ml,邻苯基苯酚的浓度为0.1-4.8mg/ml,苯甲酸的浓度为1-6mg/ml;选用丙二醇、甘露醇、乳糖中的一种或多种作为等渗剂,丙二醇浓度可以在5-25mg/ml,甘露醇的浓度为15-55mg/ml,乳糖的浓度为30-100mg/ml;选用磷酸氢二钠或碳酸氢钠作为缓冲剂,磷酸氢二钠浓度可以在0.5-2.5mg/ml,碳酸氢钠浓度为0.1-1.5mg/ml。如果需要,还可采用稀盐酸和稀氢氧化钠作为ph调节剂,稀盐酸浓度可以在0.1-1mol/l,稀氢氧化钠浓度可以在0.1-1mol/l。通过不同辅料的作用以及控制药物溶液的ph为6.0-8.0,可更好的提高制剂的稳定性以及安全性。
53.在一些实施方式中,所述司美格鲁肽的浓度可以在1.0-10.0mg/ml,如1.23-1.41mg/ml。
54.在一些实施方式中,所述苯酚的浓度可以在2-12mg/ml范围,如2.0-3.0mg/ml、5.0-6.0mg/ml、8.0-8.5mg/ml和10.0-11.5mg/ml等。
55.在一些实施方式中,所述丙二醇的浓度可以在5-25mg/ml范围,如6-8mg/ml或13-15mg/ml。
56.在一些实施方式中,所述磷酸氢二钠的浓度可以在0.5-2.5mg/ml范围,如0.55-1.70mg/ml。
57.在一些实施方式中,所述ph调节剂可以选自稀盐酸,其浓度可以在0.1-1mol/ml范围,如0.1mg/ml、0.2mol/ml、0.5mol/ml和1mol/ml等。
58.在一些实施方式中,所述ph调节剂可以选自稀氢氧化钠,其浓度可以在0.1-1mol/ml范围,如0.1mg/ml、0.2mol/ml、0.5mol/ml和1mol/ml等。
59.在一些实施方式中,所述ph调节剂可以选自稀盐酸和稀氢氧化钠,两者浓度可以在0.1-1mol/ml范围,如0.1mg/ml、0.2mol/ml、0.5mol/ml和1mol/ml等。
60.在一些实施方式中,所述药液最终ph可以在6.0-8.0范围,如6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9等。
61.本发明中的司美格鲁肽制剂即使是经过光照和高温等不利影响条件,杂质含量依然较少,提升了制剂在运输、储存和使用过程中的稳定性,极大提高了制剂临床给药时的安全性。下面将以具体的实施例和对比例对本发明作进一步的解释说明。
62.实施例1:
63.一种司美格鲁肽制剂的制备方法,包括以下步骤:
64.(1)配液:
65.1)配制稀盐酸溶液和稀氢氧化钠溶液:
66.盐酸溶液配制:取5ml盐酸,加注射用水至120ml,混匀,即得0.5mol/l hcl;
67.氢氧化钠溶液配制:称取1g氢氧化钠,加注射用水稀释至125ml,混匀,即得0.2mol/l naoh;
68.2)量取12l注射用水(温度在25℃
±
5℃)于配液罐中,通入氮气10min;分别称取82.5g苯酚、17g磷酸氢二钠和210g丙二醇加入注射用水中,搅拌使其完全溶解,并通入氮气10min;称取纯度约为99.55%的司美格鲁肽原料药20g加入至辅料溶液中,搅拌使其溶解,并通入氮气10min;
69.3)以0.5mol/l hcl溶液调节ph值7.30;并用注射用水定容至15l,过程中通入氮气,并于定容后继续通入氮气20min。
70.(2)中间体检测:取适量中间体药液,测定中间体含量等指标;
71.(3)过滤:使用0.22μm聚偏氟乙烯过滤器进行过滤除菌;
72.(4)灌装、轧盖:先将笔式注射器用溴化丁基橡胶活塞加塞至3ml笔式注射器用硼硅玻璃套筒中,再将药液灌装,然后以笔式注射器用复合铝盖进行轧盖;
73.(5)目检:剔除无盖或轧盖不良、装量不符合要求、瓶内有玻璃屑、纤维、色点等异物、瓶身有划痕、污瓶破瓶等不合格品;半成品检验。
74.实施例2:
75.一种司美格鲁肽制剂的制备方法,包括以下步骤:
76.(1)配液:
77.1)配制稀盐酸溶液和稀氢氧化钠溶液:
78.盐酸溶液配制:取10ml盐酸,加注射用水至240ml,混匀,即得0.5mol/l hcl;
79.氢氧化钠溶液配制:称取1g氢氧化钠,加注射用水稀释至125ml,混匀,即得0.2mol/l naoh;
80.2)量取24l注射用水(温度在25℃
±
5℃)于配液罐中,通入氮气20min;分别称取165g苯酚、34g磷酸氢二钠和420g丙二醇加入注射用水中,搅拌使其完全溶解,并通入氮气
20min;称取纯度约为99.55%的司美格鲁肽原料药40g加入至辅料溶液中,搅拌使其溶解,并通入氮气60min;
81.3)以0.5mol/l hcl溶液调节ph值7.28;并用注射用水定容至30l,过程中通入氮气,并于定容后继续通入氮气20min。
82.(2)中间体检测:取适量中间体药液,测定中间体含量等指标;
83.(3)过滤:使用0.22μm聚偏氟乙烯过滤器进行过滤除菌;
84.(4)灌装、轧盖:先将笔式注射器用溴化丁基橡胶活塞加塞至3ml笔式注射器用硼硅玻璃套筒中,再将药液灌装,然后以笔式注射器用复合铝盖进行轧盖;
85.(5)目检:剔除无盖或轧盖不良、装量不符合要求、瓶内有玻璃屑、纤维、色点等异物、瓶身有划痕、污瓶破瓶等不合格品;
86.(6)组装入注射笔内,贴标签,装盒,装箱,成品检验。
87.实施例3:
88.一种司美格鲁肽制剂的制备方法,包括以下步骤:
89.(1)配液:
90.1)配制稀盐酸溶液和稀氢氧化钠溶液:
91.盐酸溶液配制:取10ml盐酸,加注射用水至240ml,混匀,即得0.5mol/l hcl;
92.氢氧化钠溶液配制:称取1g氢氧化钠,加注射用水稀释至125ml,混匀,即得0.2mol/l naoh;
93.2)量取24l注射用水(温度在25℃
±
5℃)于配液罐中,通入氮气20min;分别称取165g苯酚、34g磷酸氢二钠和420g丙二醇加入注射用水中,搅拌使其完全溶解,并通入氮气20min;称取纯度约为99.55%的司美格鲁肽原料药40g加入至辅料溶液中,搅拌使其溶解,并通入氮气30min;
94.3)以0.5mol/l hcl溶液调节ph值7.25;并用注射用水定容至30l,过程中通入氮气,并于定容后继续通入氮气20min。
95.(2)中间体检测:取适量中间体药液,测定中间体含量等指标;
96.(3)过滤:使用0.22μm聚偏氟乙烯过滤器进行过滤除菌;
97.(4)灌装、轧盖:先将笔式注射器用溴化丁基橡胶活塞加塞至3ml笔式注射器用硼硅玻璃套筒中,再将药液灌装,然后以笔式注射器用复合铝盖进行轧盖;
98.(5)目检:剔除无盖或轧盖不良、装量不符合要求、瓶内有玻璃屑、纤维、色点等异物、瓶身有划痕、污瓶破瓶等不合格品;
99.(6)组装入注射笔内,贴标签,装盒,装箱,成品检验。
100.对比例1:
101.一种司美格鲁肽制剂的制备方法,包括以下步骤:
102.(1)配液:
103.1)配制稀盐酸溶液和稀氢氧化钠溶液:
104.盐酸溶液配制:取5ml盐酸,加注射用水至120ml,混匀,即得0.5mol/l hcl;
105.氢氧化钠溶液配制:称取1g氢氧化钠,加注射用水稀释至125ml,混匀,即得0.2mol/l naoh;
106.2)量取12l注射用水(温度约45℃)于配液罐中,通入氮气10min;分别称取82.5g苯
酚、17g磷酸氢二钠和210g丙二醇加入注射用水中,搅拌使其完全溶解,并通入氮气10min;称取纯度约为99.55%的司美格鲁肽原料药20g加入至辅料溶液中,搅拌使其溶解,并通入氮气10min;
107.3)以0.5mol/l hcl溶液调节ph值7.30;并用注射用水定容至15l,过程中通入氮气,并于定容后继续通入氮气20min。
108.(2)中间体检测:取适量中间体药液,测定中间体含量等指标;
109.(3)过滤:使用0.22μm聚偏氟乙烯过滤器进行过滤除菌;
110.(4)灌装、轧盖:先将笔式注射器用溴化丁基橡胶活塞加塞至3ml笔式注射器用硼硅玻璃套筒中,再将药液灌装,然后以笔式注射器用复合铝盖进行轧盖;
111.(5)目检:剔除无盖或轧盖不良、装量不符合要求、瓶内有玻璃屑、纤维、色点等异物、瓶身有划痕、污瓶破瓶等不合格品;半成品检验。
112.对比例2:
113.一种司美格鲁肽制剂的制备方法,包括以下步骤:
114.(1)配液:
115.1)配制稀盐酸溶液和稀氢氧化钠溶液:
116.盐酸溶液配制:取5ml盐酸,加注射用水至120ml,混匀,即得0.5mol/l hcl;
117.氢氧化钠溶液配制:称取1g氢氧化钠,加注射用水稀释至125ml,混匀,即得0.2mol/l naoh;
118.2)量取12l注射用水(温度在25℃
±
5℃)于配液罐中;分别称取82.5g苯酚、17g磷酸氢二钠和210g丙二醇加入注射用水中,搅拌使其完全溶解;称取纯度约为99.55%的司美格鲁肽原料药20g加入至辅料溶液中,搅拌使其溶解;
119.3)以0.5mol/l hcl溶液调节ph值7.30;并用注射用水定容至15l。
120.(2)中间体检测:取适量中间体药液,测定中间体含量等指标;
121.(3)过滤:使用0.22μm聚偏氟乙烯过滤器进行过滤除菌;
122.(4)灌装、轧盖:先将笔式注射器用溴化丁基橡胶活塞加塞至3ml笔式注射器用硼硅玻璃套筒中,再将药液灌装,然后以笔式注射器用复合铝盖进行轧盖;
123.(5)目检:剔除无盖或轧盖不良、装量不符合要求、瓶内有玻璃屑、纤维、色点等异物、瓶身有划痕、污瓶破瓶等不合格品;半成品检验。
124.测试例:
125.将本发明实施例1制得的司美格鲁肽制剂和对比例1、对比例2的制剂分别进行影响因素试验,试验条件为光照(5000
±
500lx,紫外强度90μw/cm 2
)、40℃和60℃放置10天,于第10天取样检测有关物质,结果如表1所示:
126.表1司美格鲁肽制剂稳定性试验的各项检测指标结果
[0127][0128]
由表1可知,在影响因素高温和光照条件下,对比例1和对比例2的制剂杂质明显增加且杂质总量较多,而本技术制得的司美格鲁肽制剂杂质量增加幅度较小,总杂较少;尤其是在光照条件下,本技术的司美格鲁肽制剂的杂质水平远远低于对比例1和对比例2,各项测试指标均优于对比例1和对比例2,提高了制剂在运输和贮存过程中的稳定性。
[0129]
本发明实施例2-3制备得到的司美格鲁肽制剂经过上述影响因素稳定性试验,制得的司美格鲁肽制剂杂质量增加幅度较小,总杂较少,通过本发明的制备方法可有效提高司美格鲁肽制剂的稳定性,提高制剂临床给药时的安全性。
[0130]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
