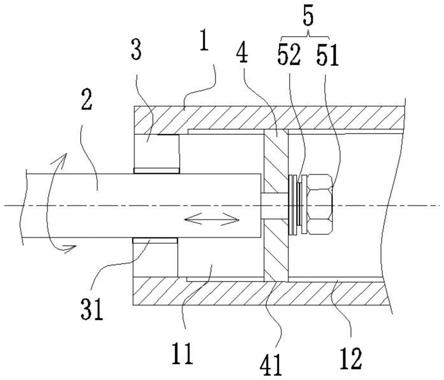
1.本发明属于抗菌水凝胶领域,具体涉及一种含抗菌肽的水凝胶及其制备方法和应用。
背景技术:
2.自20世纪发现抗生素以来,因抗生素具有抗菌、抗病毒、抗肿瘤和促进生长的作用,被广泛应用于人类医学和畜牧业中(abushaheen ma,muzaheed,fatani aj,et al.antimicrobial resistance,mechanisms and its clinical significance[j].dis mon,2020,66(6):100971.)。随着抗生素的滥用,细菌耐药性、抗生素污染和药物残留已成为全球公共卫生问题,严重威胁着畜牧业发展和人类健康(aslam b,wang w,arshad mi,et al.antibiotic resistance:a rundown of a global crisis[j].infect drug resist,2018,11:1645-1658.)。如果不解决抗生素耐药性的问题,一些常见的细菌传染病可能会再次威胁到人们的生命,所以,亟需研发一种新型抗菌药物来替代抗生素。
[0003]
抗菌肽是一类多肽类小分子,具有广谱抗菌活性,能够选择性地抑制、杀灭细菌、真菌等微生物,在固有免疫防御系统中发挥着重要作用。与抗生素针对细菌的特定分子受体的抗菌机制不同,抗菌肽可以改变细菌膜的通透性,并与细胞内一系列靶分子相互作用从而杀灭细菌(abdi m,mirkalantari s,amirmozafari n.bacterial resistance to antimicrobial peptides[j].jpept sci,2019,25(11):e3210.)。抗菌肽在与细菌作用过程中基本不会产生耐药性,作为抗菌剂具有很大的开发潜力,可以作为抗生素替代药物广泛应用于食品、医药和动物中(mahlapuu m,j,ringstad l,et al.antimicrobial peptides:an emerging category of therapeutic agents[j].front cell infect microbiol,2016,6:194.)。
[0004]
慢性伤口感染和治疗时所产生的抗生素耐药性是一个严重的世界性公共卫生问题。由于大多数抗菌肽对环境(如氧化、光解)和创伤中复杂的微生物环境等具有一定的敏感性,在局部应用后容易降解,降低了其抗菌和伤口愈合的效果(thapa rk,diep db,hh.topical antimicrobial peptide formulations for wound healing:current developments and future prospects[j].acta biomater,2020,103:52-67.)。因此,有必要开发一种可以提高抗菌肽稳定性和持续递送抗菌肽的外用配方,以最大限度地延长给药时间,发挥抗菌和伤口愈合作用。
技术实现要素:
[0005]
本发明的目的是提供一种含抗菌肽的水凝胶,抗菌并能够缩短伤口愈合时间。
[0006]
本发明的第二个目的是提供上述含抗菌肽的水凝胶的制备方法。
[0007]
本发明的第三个目的是提供上述含抗菌肽的水凝胶的应用。
[0008]
为了实现以上目的,本发明的含抗菌肽的水凝胶所采用的技术方案是:
[0009]
一种含抗菌肽的水凝胶,由海藻酸钙水凝胶和分散在海藻酸钙水凝胶中的抗菌肽
组成;所述海藻酸钙水凝胶由海藻酸钠、碳酸钙、葡萄糖酸内酯和水制成;所述抗菌肽选自chol-37(f34-r)、myr-36pw、pmap-23ri-dec中的一种或两种以上组合。
[0010]
本发明的含抗菌肽的水凝胶,为特定抗菌肽搭建水凝胶载体,抗菌肽均匀分散并吸附在水凝胶微孔内部,实现抗菌肽的缓慢释放,缓解抗菌肽对环境和创伤中复杂的微生物环境的敏感性,提高抗菌肽稳定性和持续递送能力,以最大限度地延长给药时间,发挥抗菌和伤口愈合作用。
[0011]
为更好地调节水凝胶中抗菌肽的缓释效果,优选地,所述海藻酸钙水凝胶中,钙离子与海藻酸钠中羧基的摩尔比a为0.3~0.4,葡萄糖酸内酯与钙离子的摩尔比b为0.4~0.8。海藻酸钠中的羧基均是以羧酸根的形式存在。海藻酸钠的cas登录号为9005-38-3。钙离子与海藻酸钠中羧基的摩尔比a,按质量比换算后,碳酸钙与海藻酸钠的质量比为(0.0076~0.0101):0.05。
[0012]
为进一步实现缓释效率和抗菌肽释放率的兼顾,优选地,钙离子与羧基的摩尔比a为0.4,葡萄糖酸内酯与钙离子的摩尔比b为0.4。
[0013]
上述三种抗菌肽的结构上的共性在于:chol-37(f34-r)、myr-36pw、pmap-23ri-dec均来源于cathelicidins家族,分别根据猪髓源抗菌肽pmap-37、pmap-36、pmap-23原肽的正电荷和疏水性特点进行改造修饰而来。三种抗菌肽均具有两亲性(n端亲水、c端疏水)的特征,能够很好的溶解于水中。同时,三种抗菌肽具有α-螺旋结构,既表现出极好的水脂两亲结构,也展现出很高的抗菌活性。以上特性使得三种抗菌肽能够很好的分散并吸附在水凝胶网络中,使水凝胶、抗菌肽的特性相互契合,从而在长效抗菌、促进伤口愈合、提高抗菌肽的利用率方面取得良好效果。
[0014]
为进一步优化含有上述抗菌肽的水凝胶的形态以及应用效果,优选地,所述海藻酸钙水凝胶中,以海藻酸钠计的原料终浓度为0.6~1.0wt%。为更进一步缩短凝胶成形时间,优选地,以海藻酸钠计的原料终浓度为1.0wt%。
[0015]
从成本以及应用效果方面综合考虑,优选地,所述抗菌肽在所述海藻酸钙水凝胶中的分散终浓度为100~200μg/ml。
[0016]
本发明的含抗菌肽的水凝胶的制备方法的技术方案是:
[0017]
一种上述含抗菌肽的水凝胶的制备方法,包括以下步骤:将抗菌肽、海藻酸钠、碳酸钙、葡萄糖酸内酯在水中混合均匀,静置形成水凝胶。
[0018]
本发明的含抗菌肽的水凝胶的制备方法,水凝胶载药基质制备简单、绿色安全、生产成本低,具有高含水量、良好的生物相容性和稳定性。
[0019]
为进一步提高原料的混合均匀程度和混合效率,优选地,所述混合均匀包括首先配制由抗菌肽、海藻酸钠和水组成的1号溶液,由碳酸钙和水组成的2号悬浊液,由葡萄糖酸内酯和水组成的3号溶液,然后将所述1号溶液、2号悬浊液、3号溶液混合。
[0020]
进一步优选地,1号溶液、2号悬浊液、3号溶液的体积比为3:1:1。采用该方式更利于原料的快速混匀。
[0021]
上述含抗菌肽的水凝胶在用于细菌感染的创伤敷料中的应用。
[0022]
上述抗菌肽水凝胶具有较好的抑菌、杀菌作用,能有效缩短细菌感染伤口的愈合时间,在药物输送、创伤敷料等领域具有广泛的应用前景。
附图说明
[0023]
图1为不同原料配比制成的空白水凝胶的形成外观图;
[0024]
图2为不同原料配比制成的空白水凝胶的扫描电子显微镜观察图;
[0025]
图3为不同原料配比对空白水凝胶溶胀率的影响;
[0026]
图4为不同原料配比对空白水凝胶含水率的影响;
[0027]
图5为不同原料配比对空白水凝胶保水率的影响;
[0028]
图6为不同原料配比对抗菌肽水凝胶缓释抗菌肽的影响,其中a:chol-37(f34-r),b:myr-36pw,c:pmap-23ri-dec;
[0029]
图7为含chol-37(f34-r)的抗菌肽水凝胶的外观形态图;
[0030]
图8为空白水凝胶(a)与含chol-37(f34-r)的抗菌肽水凝胶(b)的扫描电子显微镜观察图;
[0031]
图9为实施例1的含chol-37(f34-r)的抗菌肽水凝胶的缓释抗菌效果图;
[0032]
图10为含chol-37(f34-r)的抗菌肽水凝胶治疗小鼠创伤感染后第0、6、10天的创口愈合情况图;
[0033]
图11为含chol-37(f34-r)的抗菌肽水凝胶治疗小鼠创伤感染后第10天的皮肤组织病理切片图;
[0034]
图12为实施例4制备的含myr-36pw的抗菌肽水凝胶的外观形态图;
[0035]
图13为空白水凝胶(a)与含myr-36pw的抗菌肽水凝胶(b)的扫描电子显微镜观察图;
[0036]
图14为含myr-36pw的抗菌肽水凝胶的缓释抗菌效果图;
[0037]
图15为含myr-36pw的抗菌肽水凝胶治疗小鼠创伤感染后第0、6、10天的创口愈合情况图;
[0038]
图16为含myr-36pw的抗菌肽水凝胶治疗小鼠创伤感染后第10天的皮肤组织病理切片图,其中a是视野放大100倍,b是视野放大200倍;
[0039]
图17为实施例5制备的含pmap-23ri-dec的抗菌肽水凝胶的外观形态图;
[0040]
图18为为空白水凝胶(a)与含pmap-23ri-dec的抗菌肽水凝胶(b)的扫描电子显微镜观察图;
[0041]
图19为含pmap-23ri-dec的抗菌肽水凝胶的缓释抗菌效果图;
[0042]
图20为含pmap-23ri-dec的抗菌肽水凝胶治疗小鼠创伤感染后第0、6和10天的创口愈合情况图;
[0043]
图21为含pmap-23ri-dec的抗菌肽水凝胶治疗小鼠创伤感染后第10天皮肤组织病理切片图,其中a是视野放大100倍,b是视野放大200倍。
具体实施方式
[0044]
下面结合具体实施例对本发明的实施过程进行详细说明。
[0045]
一、含chol-37(f34-r)的抗菌肽水凝胶及其制备方法的具体实施例
[0046]
猪髓源性抗菌肽(porcine myeloid antimicrobial peptide,pmaps)来源于猪的骨髓细胞,属于抗菌肽cathelicidin家族,具有稳定的α-螺旋结构和高效广谱的抗菌活性,对细菌、真菌、肿瘤、寄生虫都具有较强的活性。pmaps富含大量正电荷,易与带负电荷的细
菌膜表面结合,但与真核细胞膜的结合力较弱或不存在,溶血效果相对较低(shi s,shen t,liu y,et al.porcine myeloid antimicrobial peptides:a review of the activity and latest advances[j].front vet sci,2021,8:664139.)。
[0047]
pmap-37是一种两亲性α螺旋阳离子pmaps,含有37个氨基酸残基,氨基酸序列为gllsrlrdflsdrgrrlgekierigqkikdlseffqs,具有高效广谱的抗菌活性(zhou j,liu y,shen t,et al.enhancing the antibacterial activity of pmap-37 by increasing its hydrophobicity[j].chem biol drug des,2019,94(5):1986-1999.)。以pmap-37为模板,经过一系列结构改造而合成的新型抗菌肽chol-37(f34-r)具有更高的抗菌活性,chol-37(f34-r)对金黄色葡萄球菌atcc 25923、鼠伤寒沙门菌sl1344、铜绿假单胞菌gim1.551和单增李斯特菌cicc 21634的mic值都比较低,且chol-37(f34-r)具有有效的抗生物被膜活性,毒性低,无溶血活性。此外,在动物创伤和脓肿模型中,chol-37(f34-r)可以更好的促进伤口愈合和脓肿减少;在金黄色葡萄球菌atcc 25923感染的腹膜炎模型中,chol-37(f34-r)的体内治疗和病理损伤的恢复效果与抗生素青霉素钾相当(chen l,shen t,liu y,et al.enhancing the antibacterial activity of antimicrobial peptide pmap-37(f34-r)by cholesterol modification[j].bmc vet res,2020,16(1):419.)。
[0048]
实施例1
[0049]
本实施例的含抗菌肽的水凝胶,由海藻酸钙水凝胶和分散在海藻酸钙水凝胶中的抗菌肽chol-37(f34-r)组成。
[0050]
海藻酸钙水凝胶由海藻酸钠、碳酸钙、葡萄糖酸内酯和水制成;海藻酸钙水凝胶中,钙离子与羧基的摩尔比a为0.4,葡萄糖酸内酯与钙离子的摩尔比b为0.4。以海藻酸钠计的原料终浓度为1.0wt%。
[0051]
抗菌肽chol-37(f34-r)在海藻酸钙水凝胶中的分散终浓度为200μg/ml。
[0052]
本实施例的含抗菌肽的水凝胶的制备方法,包括以下步骤:
[0053]
(1)将1mg的抗菌肽chol-37(f34-r)溶于3ml去离子水中,再将0.05g海藻酸钠充分溶解于抗菌肽chol-37(f34-r)溶液中,混合均匀,得到1号溶液;
[0054]
(2)将0.0101g碳酸钙加入1ml去离子水中,充分混合,得到碳酸钙悬浊液(2号液);
[0055]
(3)将葡萄糖酸内酯溶于1ml去离子水中,充分混合,得到0.0071g葡萄糖酸内酯溶液(3号溶液);
[0056]
(4)将1号溶液、2号液和3号溶液加在一起使用涡旋振荡器充分持续混合30s,静置1min即可得到含chol-37(f34-r)的抗菌肽水凝胶。在其他实施情形下,步骤(1)~步骤(3)的顺序可调换,步骤(4)中3种液体的混合顺序没有限制。
[0057]
实施例2
[0058]
本实施例的含抗菌肽的水凝胶,与实施例1的区别仅在于:海藻酸钙水凝胶中,钙离子与羧基的摩尔比a为0.4,葡萄糖酸内酯与钙离子的摩尔比b为0.8。海藻酸钠、碳酸钙、葡萄糖酸内酯的用量分别为0.05g、0.0101g、0.0143g。
[0059]
本实施例的含抗菌肽的水凝胶的制备方法,参考实施例1的方法进行制备。
[0060]
实施例3
[0061]
本实施例的含抗菌肽的水凝胶,与实施例1的区别仅在于:海藻酸钙水凝胶中,钙离子与羧基的摩尔比a为0.3,葡萄糖酸内酯与钙离子的摩尔比b为0.8。海藻酸钠、碳酸钙、
葡萄糖酸内酯的用量分别为0.05g、0.0076g、0.0107g。
[0062]
本实施例的含抗菌肽的水凝胶的制备方法,参考实施例1的方法进行制备。
[0063]
二、含myr-36pw的抗菌肽水凝胶及其制备方法的具体实施例
[0064]
pmap-36是从猪骨髓细胞中分离出来的一种典型的两亲性α-螺旋抗菌肽,含有较高的正电荷,阳离子氨基酸比例达36%(lv y,wang j,gao h,et al.antimicrobial properties and membrane-active mechanism of a potentialα-helical antimicrobial derived from cathelicidin pmap-36[j].plos one,2014,9:e86364.)。以色氨酸(w)替代pmap-36的25和26位脯氨酸(p)设计合成了pmap-36pw,增强了pmap-36的疏水性,提高了它的抗菌活性,pmap-36pw显示出良好的稳定性,有效减少了感染小鼠的细菌负荷和组织损伤(zhou j,liu y,shen t,et al.antimicrobial activity of the antibacterial peptide pmap-36and its analogues[j].microb pathog,2019,136:103712.)。在此基础上,进一步以脂肪酸修饰的方式对pmap-36pw进行改造。将肉豆蔻酸偶联到pmap-36pw的n端,设计合成了一种n端肉豆蔻酰化抗菌肽myr-36pw(liu y,li s,shen t,et al.n-terminal myristoylation enhanced the antimicrobial activity of antimicrobial peptide pmap-36pw[j].front cell infect microbiol,2020,10:450.)。
[0065]
实施例4
[0066]
本实施例的含抗菌肽的水凝胶,由海藻酸钙水凝胶和分散在海藻酸钙水凝胶中的抗菌肽myr-36pw组成。抗菌肽myr-36pw为猪cathelicidins家族抗菌肽pmap-36的脂肪酸修饰肽myr-36pw,氨基酸序列为myr-g-grfrrlrkktrkrlkkigkvlkwiwwivgsiplgcg。
[0067]
海藻酸钙水凝胶由海藻酸钠、碳酸钙、葡萄糖酸内酯和水制成;海藻酸钙水凝胶中,钙离子与羧基的摩尔比a为0.4,葡萄糖酸内酯与钙离子的摩尔比b为0.4。以海藻酸钠计的原料终浓度为1.0wt%。
[0068]
抗菌肽myr-36pw在海藻酸钙水凝胶中的分散终浓度为200μg/ml。
[0069]
本实施例的含抗菌肽的水凝胶的制备方法,包括以下步骤:
[0070]
(1)将1mg的抗菌肽myr-36pw粉末溶于3ml去离子水中,再将海藻酸钠充分溶解于抗菌肽myr-36pw溶液中,混合均匀,得到1号溶液;
[0071]
(2)将碳酸钙加入1ml去离子水中,充分混合,得到碳酸钙悬浊液(2号液);
[0072]
(3)将葡萄糖酸内酯溶于1ml去离子水中,充分混合,得到葡萄糖酸内酯溶液(3号溶液);
[0073]
(4)将1号溶液、2号液和3号溶液加在一起使用涡旋振荡器充分持续混合30s,静置1min即可得到含myr-36pw的抗菌肽水凝胶。在其他实施情形下,步骤(1)~步骤(3)的顺序可调换,步骤(4)中3种液体的混合顺序没有限制。
[0074]
三、含pmap-23ri-dec的抗菌肽水凝胶及其制备方法的具体实施例
[0075]
猪髓源性抗菌肽pmap-23具有广谱抗菌活性,但稳定性较差。以pmap-23为模板,结合其抗菌机制进行结构优化。首先用精氨酸替换抗菌肽pmap-23第5位上的亮氨酸和用异亮氨酸替换第19位上的苏氨酸设计得到抗菌肽pmap-23ri;此后通过使用癸酸修饰抗菌肽pmap-23ri得到抗菌肽pmap-23ri-dec(shen t,chen l,liu y,et al.decanoic acid modification enhances the antibacterial activity of pmap-23ri-dec[j].eur j pharm sci,2021,157,105609.)。
[0076]
实施例5
[0077]
本实施例的含抗菌肽的水凝胶,由海藻酸钙水凝胶和分散在海藻酸钙水凝胶中的抗菌肽pmap-23ri-dec组成。
[0078]
海藻酸钙水凝胶由海藻酸钠、碳酸钙、葡萄糖酸内酯和水制成;海藻酸钙水凝胶中,钙离子与羧基的摩尔比a为0.4,葡萄糖酸内酯与钙离子的摩尔比b为0.4。以海藻酸钠计的原料终浓度为1.0wt%。
[0079]
抗菌肽pmap-23ri-dec在海藻酸钙水凝胶中的分散终浓度为200μg/ml。
[0080]
本实施例的含抗菌肽的水凝胶的制备方法,包括以下步骤:
[0081]
(1)将1mg的抗菌肽pmap-23ri-dec粉末溶于3ml去离子水中,再将海藻酸钠充分溶解于抗菌肽pmap-23ri-dec溶液中,混合均匀,得到1号溶液;
[0082]
(2)将碳酸钙加入1ml去离子水中,充分混合,得到碳酸钙悬浊液(2号液);
[0083]
(3)将葡萄糖酸内酯溶于1ml去离子水中,充分混合,得到葡萄糖酸内酯溶液(3号溶液);
[0084]
(4)将1号溶液、2号液和3号溶液加在一起使用涡旋振荡器充分持续混合30s,静置1min即可得到含pmap-23ri-dec的抗菌肽水凝胶。在其他实施情形下,步骤(1)~步骤(3)的顺序可调换,步骤(4)中3种液体的混合顺序没有限制。
[0085]
四、含抗菌肽的水凝胶在用于细菌感染的创伤敷料中的应用的具体实施例,参见以下实验例部分。
[0086]
五、实验例
[0087]
实验例1原料配比对水凝胶的性能影响实验
[0088]
海藻酸钠的浓度是影响水凝胶成型主要关键因素之一。根据海藻酸钠的溶解度确定其使用浓度,设置0.5wt%、1.0wt%、1.5wt%和2.0wt%四个梯度,观察其溶解状态,结果发现1.5wt%和2.0wt%的海藻酸钠溶液非常粘稠,浓度过高会导致溶解不完全,只发生溶胀而无法形成均一的溶液,制备水凝胶的没有弹性,易脆。以0.5wt%和1.0wt%的终浓度制备水凝胶时发现,0.5wt%的海藻酸钠溶液制备的水凝胶过软,不成型。因而确定海藻酸钠的终浓度为0.6wt%~1.0wt%,以上实施例均以1.0wt%的浓度进行说明。
[0089]
图1为不同配比制成的空白水凝胶的形成外观图,其中编号
①
为1.0wt%海藻酸钠水溶液,编号
②
为实施例2的方法所得水凝胶,编号
③
为实施例3的方法所得水凝胶;编号
④
为实施例1的方法所得水凝胶。
[0090]
摩尔比a、摩尔比b搭配不当会导致水凝胶不成型、反应速度过慢或过快。编号
②
中,葡萄糖内酯较多,形成的水凝胶中有大量水分析出;钙离子含量过低,形成速度变慢,且形成的水凝胶也过软,甚至不能形成水凝胶,进而无法搭载抗菌肽,同时,反应速度过慢则会在创伤辅料应用过程中等待较长时间。编号
②
、编号
③
中,单位体积内与海藻酸钠可结合的ca
2
多,形成水凝胶的速度过快,肉眼可见的有絮状物产生。反应速度过快导致水凝胶的网络结构中凝胶粒子交联密度不均匀,不利于抗菌肽的搭载和释放。编号
④
中,能形成表观均匀的水凝胶,无水分析出和絮状物产生。
[0091]
图2为不同实施例的空白水凝胶的扫描电子显微镜观察图,左、中、右分别为实施例2、实施例3、实施例1的方法所得水凝胶,可以看出实施例1的水凝胶呈现出最均匀的三维孔状结构(优于实施例2、实施例3),各孔洞结构之间相互连通,且孔径大小最为均匀,这有
利于抗菌肽最大限度吸附至水凝胶微孔内部。
[0092]
为研究各配比对水凝胶溶胀率的影响。根据特定时间间隔的水凝胶质量变化来计算其溶胀率。在室温下,先称量制备好的水凝胶样品质量w0,然后将其放置于去离子水中,每隔2h取出,测量水凝胶的质量w
t
,直至水凝胶的质量不再变化,即表示达到溶胀平衡。每次从去离子水中取出的水凝胶样品的重量w
t
是用吸水纸去除表面水分后测量的。水凝胶样品的溶胀率根据以下公式计算:溶胀率=(w
t-w0)/w0×
100%。
[0093]
同上述水凝胶样品的溶胀率一起测定含水率,以研究各配比对水凝胶含水率的影响。含水率计算公式:含水率=(w
t-w0)/w
t
×
100%。
[0094]
进一步研究各配比对水凝胶保水率的影响。将制备好的水凝胶样品放置于去离子水中,使其达到溶胀平衡后取出,测量水凝胶的质量w0,再将达到溶胀平衡后的水凝胶样品放置于室温,35%湿度的条件下,每隔2h测定其质量w
t
。水凝胶样品的保水率根据以下公式计算:保水率=w
t
/w0×
100%。
[0095]
各配比对水凝胶溶胀率、含水率和保水率的影响实验结果分别如图3、图4和图5所示。实施例1、实施例2、实施例3的方法所得水凝胶(空白)的溶胀率均在刚开始的2h内吸水速率最快,实施例1优于实施例2和实施例3,能达到约105%,10h时已经基本达到溶胀平衡,实施例1的方法所得水凝胶最终溶胀率最高,约为151.53%(图3)。水凝胶在水环境中具有较高的溶胀能力,水凝胶的溶胀率与聚合物的材料结构和孔径大小有关,而药物释放量与水凝胶的溶胀率有着重要关联,一般来说,水凝胶溶胀率越大,药物释放量就会越高。随着水凝胶的溶胀,其含水量也在逐渐增加,实施例1的方法所得水凝胶24h时的含水量能够维持在60%左右,实施例2的方法所得水凝胶含水量较低(图4)。与传统纱布敷料相比,水凝胶的高含水率和三维网络多孔结构可以保持伤口处的湿润环境,以防止留下疤痕。保水性能也是衡量敷料能否提供一个有助于伤口湿性愈合环境的有效指标。普通用纱布包扎伤口时不能很好的留住水分,所以治愈慢性创面的效果不好。高含水性的水凝胶敷料可为干燥创口提供一定水分,保证创口处于湿润环境,促进创口的愈合。由图5可知,海藻酸钠水凝胶的保水性能较好,随着时间的推移,水分逐渐蒸发,24h后的保水率还可以维持在60%左右(图5)。除此之外,在治疗慢性创伤时,如果有大量的伤口分泌液,水凝胶还可以不断吸收伤口分泌液而不妨碍小分子的物质传递,避免伤口分泌物的二次伤害,作为创伤敷料具有巨大的潜力。
[0096]
结合图3可以看出,实施例1的配方的溶胀率最大,实施例2的配方的溶胀率最小。
[0097]
不同原料配比对抗菌肽水凝胶缓释抗菌肽的影响如图6所示。随着时间的推移,水凝胶中抗菌肽开始缓慢释放。抗菌肽释放量与水凝胶的溶胀率有着重要关联,水凝胶溶胀率越大,相同时间内抗菌肽释放量就会越高。按实施例1原料配比制得的含抗菌肽水凝胶,8h后释放速率开始减慢,24h后水凝胶中的抗菌肽释放率约为70%~90%(图6)。按实施例2原料配比制得的含抗菌肽水凝胶,虽然释放缓慢,但是最终释放率比较低,抗菌肽释放量较少。按实施例3原料配比制得的含抗菌肽水凝胶释放抗菌肽速率过快,缓释效果较差。
[0098]
实验例2实施例1的含chol-37(f34-r)的抗菌肽水凝胶的综合评价
[0099]
2.1形貌表征
[0100]
实施例1制成的抗菌肽chol-37(f34-r)的抗菌肽水凝胶的外观形态如图7所示,其形成均匀凝胶状,形态稳定,表面光滑,富有弹性。
r)的抗菌肽水凝胶经过6个月以上仍保持同样的抗菌活性,并且具有较好的稳定性。这说明本发明提供的含chol-37(f34-r)的抗菌肽水凝胶具有较强的抗菌活性。
[0116]
2.5含chol-37(f34-r)的抗菌肽水凝胶的缓释抗菌效果
[0117]
以金黄色葡萄球菌为测试菌,将其均匀涂抹在营养琼脂培养基上,并将含chol-37(f34-r)的抗菌肽水凝胶放置在涂抹菌液的培养基上,每隔12h将水凝胶放入新的营养琼脂培养基上,在37℃恒温箱中孵育12h后测量其抑菌圈直径,以特定时间内抑菌圈直径大小来评价抗菌肽水凝胶的药物缓释情况。
[0118]
如图9所示,随着时间的推移,抑菌圈直径越来越小,表明水凝胶中的抗菌肽含量越来越少,直至48h时无抑菌圈出现,表明水凝胶中的抗菌肽chol-37(f34-r)已释放完全(图9)。此实验说明本发明制备的抗菌肽水凝胶具有一定的药物缓释作用,能够持续输送药物,可以在实际应用中减少给药次数,使局部药物的浓度维持在较高水平,具有广泛的应用潜力。
[0119]
2.6含chol-37(f34-r)的抗菌肽水凝胶对创伤感染小鼠的治疗实验
[0120]
使用铜绿假单胞菌gim1.551构建小鼠的创伤模型。将小鼠随机分为6组,分组情况见表2。剔除小鼠背部的毛皮,并在小鼠背部制作一个直径约1.5cm的圆形创口,将6.5
×
10
10
cfu/ml的铜绿假单胞菌悬浮液接种于创口上。感染后2h进行一次治疗,此后每天进行一次治疗,持续10天,每天观察伤口愈合情况,直至伤口愈合。治疗结束后,采集小鼠伤口愈合处的皮肤组织固定染色,进行组织病理学观察。
[0121]
表2实验分组
[0122][0123][0124]
伤口愈合情况如图10所示,随着治疗次数的增多,各组小鼠的创口范围逐渐缩小。在第10天,含chol-37(f34-r)的抗菌肽水凝胶组的创口已基本愈合(图10),且与其他组相比,其愈合情况最好。小鼠伤口愈合处的皮肤组织病理学结果如图11所示,空白组毛囊较少,且分化程度低,治疗组处理的皮肤组织出现不同程度的炎性损伤,真皮中可见炎性细胞浸润(图11)。与空白组相比,10天后,经过药物和水凝胶处理过的各治疗组的毛囊呈现不同程度的增加,分化程度也随之增强,其中含chol-37(f34-r)的抗菌肽水凝胶组的毛囊最多,大部分已成梭型,即将突破表皮层,皮下组织和脂肪组织都明显增厚,愈合程度最好。并且体外细胞实验也证实了含chol-37(f34-r)的抗菌肽水凝胶具有良好的生物相容性。这说明本发明提供的含chol-37(f34-r)的抗菌肽水凝胶可以减少创口处的细菌感染,加快伤口愈合,在创伤敷料领域中具有巨大的应用潜力。
[0125]
实验例3实施例4的含myr-36pw的抗菌肽水凝胶的综合评价
36pw的抗菌肽水凝胶经过6个月以上仍保持同样的抗菌活性,并且具有较好的稳定性。
[0142]
3.5含myr-36pw的抗菌肽水凝胶的缓释抗菌效果
[0143]
实验方法如下:以金黄色葡萄球菌atcc 25923为测试细菌,取200μl的过夜培养的细菌悬浮液均匀涂布在琼脂板上,将含myr-36pw的抗菌肽水凝胶放置在涂有细菌的琼脂板上,每隔12h测量抑菌圈的直径,并将含myr-36pw的抗菌肽水凝胶转移至新的琼脂平板上。通过抑菌圈的大小评价抗菌肽的缓释效果。
[0144]
由图14可知,随着时间的延长,抗菌肽myr-36pw缓慢释放出来,myr-36pw水凝胶中的抗菌肽myr-36pw逐渐减少,表现为抑菌圈直径逐渐减小,抗菌性能逐渐减弱。48h时,无抑菌圈,表明myr-36pw已完全释放。这说明本发明提供的含myr-36pw的抗菌肽水凝具有一定的抗菌缓释作用,为抗菌药物的缓慢释放和持久抗菌提供了可能。
[0145]
3.6含myr-36pw的抗菌肽水凝胶的应用
[0146]
建立小鼠皮肤创伤模型。实验分组为:健康组(不作任何处理)、空白组(感染、不治疗)、空白水凝胶组(感染、空白水凝胶治疗)、myr-36pw组(感染、myr-36pw治疗)、含myr-36pw的抗菌肽水凝胶组(感染、含myr-36pw的抗菌肽水凝胶治疗)和抗生素组(感染、复方多粘菌素b软膏治疗)。在小鼠背部剪开一个直径1.5cm左右的圆形创口,创口处接种6.5
×
10
10
cfu/ml的铜绿假单胞菌gim1.551(100μl)。感染后2h开始治疗,治疗时将水凝胶材料敷于创口处,每天治疗1次,治疗持续10天。每天观察小鼠的创口变化。10天后,取小鼠创口组织固定染色,进行组织病理观察。
[0147]
由图15可知,随着治疗天数的增多,每组小鼠的创口范围逐渐缩小(图15)。其中,水凝胶组和抗生素组的小鼠创口范围较大。在第10天,含myr-36pw的抗菌肽水凝胶组小鼠的创口基本愈合,myr-36pw组小鼠创口愈合为小孔。水凝胶组和抗生素组的小鼠创口范围缩小,但仍未完全愈合。由图16可知,空白创伤组有少量毛囊分布,且成纤维细胞和炎性细胞分布密集。水凝胶组有少量毛囊且分化程度低,成纤维细胞分布较密集,有大量炎性细胞浸润;myr-36pw组的毛囊较多但分化程度低,成纤维细胞分布稀疏,炎性细胞数量减少;含myr-36pw的抗菌肽水凝胶组的毛囊密集且分化程度较高,炎性细胞大量减少。抗生素组也有较多毛囊分布但分化程度不高,有少量炎性细胞浸润(图16)。并且体外细胞实验也证实了含myr-36pw的抗菌肽水凝胶具有良好的生物相容性。这说明本发明提供的含myr-36pw的抗菌肽水凝胶可以减轻创伤部位细菌感染,有作为创伤敷料的潜能。
[0148]
实验例4实施例5的含pmap-23ri-dec的抗菌肽水凝胶的综合性能评价
[0149]
4.1形貌表征
[0150]
由实施例5制备的抗菌肽水凝胶为图17所示的乳白色均匀立体结构,表面光滑且富有弹性。其扫描电子显微镜观察图如图18所示。
[0151]
由图18可知,抗菌肽pmap-23ri-dec水凝胶(b)呈现出较多孔隙结构(与空白水凝胶a的孔隙结构差异不大),且各孔洞之间相互连通。
[0152]
4.2实施例5制备的抗菌肽水凝胶的溶胀率、含水率和保水率的测定
[0153]
含pmap-23ri-dec的抗菌肽水凝胶溶胀率、含水率和保水率的实验方法及评价参考实验例1,结果发现含pmap-23ri-dec的抗菌肽水凝胶溶胀率、含水率和保水率与空白水凝胶无明显区别。
[0154]
4.3实施例5制备的抗菌肽水凝胶的释放率
[0155]
实验方法参考实验例3,结果如图6所示。
[0156]
图6中,含pmap-23ri-dec的抗菌肽水凝胶在水溶液中在0~10h之内释放较快,在10h之后释放速度减缓,在14h释放量趋于平衡,最大释放量约80%(图6c)。本发明制备海藻酸盐水凝胶装载抗菌肽pmap-23ri-dec,具有持续、缓慢释放抗菌肽作用,为伤口提供一个持续的抗菌药库。
[0157]
4.4含pmap-23ri-dec的抗菌肽水凝胶的体外抗菌性能
[0158]
采用琼脂扩散实验测定含pmap-23ri-dec的抗菌肽水凝胶对金黄色葡萄球菌atcc25923、猪链球菌ha 9801、铜绿假单胞菌gim 1.511和猪巴氏杆菌pm-29的抗菌作用。将细菌在液体培养基中培养至对数生长期,取200μl细菌悬浮液至琼脂培养基,用涂布棒使菌液均匀分散开。将直径6mm的水凝胶材料(含pmap-23ri-dec的抗菌肽水凝胶10μg抗菌肽pmap-23ri-dec)贴在培养基上。将培养皿置于37℃恒温恒湿培养箱过夜培养,观察细菌生长情况并测量抑菌圈直径,每组重复三次。
[0159]
实验分组如下:a为抗菌肽pmap-23ri-dec;b为含pmap-23ri-dec的抗菌肽水凝胶;c为头孢噻呋钠;d为空白水凝胶。
[0160]
表4抑菌圈直径(mm)
[0161][0162]
如表4所示,含pmap-23ri-dec的抗菌肽水凝胶的抑菌圈直径与头孢噻呋钠相当,保持较高的抗菌活性(表4)。在进一步的保质期研究中发现,含pmap-23ri-dec的抗菌肽水凝胶经过6个月以上仍保持同样的抗菌活性,并且具有较好的稳定性。这说明本发明提供的含pmap-23ri-dec的抗菌肽水凝胶具有较强的抗菌活性。
[0163]
4.5含pmap-23ri-dec的抗菌肽水凝胶的缓释抗菌效果
[0164]
将金黄色葡萄球菌atcc 25923在液体培养基中培养至对数生长期,取200μl细菌悬浮液至琼脂培养基,用涂布棒使菌液均匀分散开。将直径6mm的含pmap-23ri-dec的抗菌肽水凝胶贴在琼脂培养基上。37℃孵育12h后观察细菌生长情况并测量抑菌圈直径。取200μl对数生长期的细菌悬浮液于一新琼脂培养基上,用涂布棒使菌液均匀分散开。将含pmap-23ri-dec的抗菌肽水凝胶转移至这一新的琼脂培养基上。37℃孵育,每隔12h更新一次琼脂培养基,直至不再出现抑菌圈。
[0165]
如图19所示,含pmap-23ri-dec的抗菌肽水凝胶在24h仍有显著的抑菌效果(图19),36h时未出现抑菌效果。说明含pmap-23ri-dec的抗菌肽水凝胶有缓释抗菌肽pmap-23ri-dec的作用。
[0166]
4.6含pmap-23ri-dec的抗菌肽水凝胶治疗小鼠皮肤创伤
[0167]
将30只雌性小鼠随机分为6组,每组5只,实验分组为:健康组(不作任何处理)、空白组(感染、不治疗)、空白水凝胶组(感染、空白水凝胶治疗)、myr-36pw组(感染、myr-36pw治疗)、含myr-36pw的抗菌肽水凝胶组(感染、含myr-36pw的抗菌肽水凝胶治疗)和抗生素组
(感染、复方多粘菌素b软膏治疗)。将小鼠背部右后侧毛发剔除,并制作一个直径约为1.5cm的全皮层创伤,接种100μl铜绿假单胞杆菌gim 1.511(6.5
×
10
10
cfu/ml)。感染后2h进行治疗,每天治疗一次,连续治疗10天,每天观察伤口愈合情况,第10天收集小鼠创伤部位皮肤组织,制作切片,观察病理变化。
[0168]
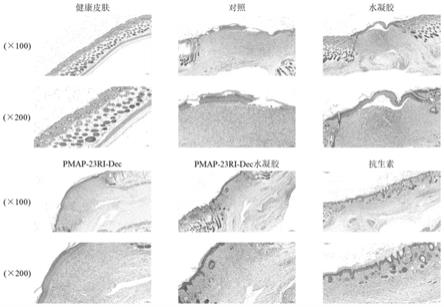
如图20所示,在第6天时,阴性对照组、水凝胶组和复方多粘菌素软膏组伤口愈合较慢。在第10天时,pmap-23ri-dec组、含pmap-23ri-dec的抗菌肽水凝胶组和复方多粘菌素软膏组已愈合,阴性对照组仍有明显结痂(图20)。
[0169]
如图21所示,正常皮肤组织结构完整,细胞分层清晰,真皮层可见波浪状纤维组织,排列有序,分布均匀,毛囊大小均匀,形态规则。阴性对照组创伤区被覆表皮再生,但表皮层不完整,附着不紧密,表皮细胞层厚薄不一,上皮细胞大小形态及排列不规则,真皮层肉芽组织及纤维组织增生。水凝胶治疗组比对照组表皮层略完整。pmap-23ri-dec治疗组表皮层完整、连续、细胞排列紧密,有丰富的毛细血管。含pmap-23ri-dec的抗菌肽水凝胶治疗组开始分化出毛囊,复方多粘菌素软膏治疗组毛囊恢复更多(图21)。并且体外细胞实验也证实了含pmap-23ri-dec的抗菌肽水凝胶具有良好的生物相容性。这说明本发明提供的含pmap-23ri-dec的抗菌肽水凝胶可以减少创口处的细菌感染,加快伤口愈合,在创伤敷料领域中具有巨大的应用潜力。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。